2020非金属及其化合物的常用化学方程式与对应离子方程式(硅氯硫氮)
非金属及其化合物反应方程式

硅及其化合物的化学方程式和离子方程式一、硅1、硅和氟气反应:Si+2F2错误!未找到引用源。
SiF42、硅和氯气加热:Si+2Cl2错误!未找到引用源。
SiCl43、硅与氧气加热:Si+O2错误!未找到引用源。
SiO24、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O错误!未找到引用源。
Na2SiO3+2H2↑Si+2OH-+H2O错误!未找到引用源。
SiO32-+2H2↑5、硅和氢氟酸反应:Si+4HF错误!未找到引用源。
SiF4+2H2↑二、二氧化硅1、工业上用二氧化硅制备粗硅:SiO2+2C错误!未找到引用源。
Si+2CO↑2、工业上二氧化硅制备金刚砂:SiO2+3C错误!未找到引用源。
SiC+2CO↑3、碳酸钙高温条件下与二氧化硅反应:CaCO3+SiO2错误!未找到引用源。
CaSiO3+CO2↑4、碳酸钠高温条件下与二氧化硅反应:Na2CO3+SiO2错误!未找到引用源。
Na2SiO3+CO2↑5、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2错误!未找到引用源。
Na2SiO3+H2O2OH-+SiO2错误!未找到引用源。
SiO32-+H2O6、将二氧化硅溶于氢氟酸:SiO2+4HF错误!未找到引用源。
SiF4+2H2O7、二氧化硅高温与生石灰反应:CaO+SiO2错误!未找到引用源。
CaSiO3三、硅酸1、硅酸溶于氢氧化钠溶液:H2SiO3+2NaOH错误!未找到引用源。
Na2SiO3+2H2OH2SiO3+2OH-错误!未找到引用源。
SiO32-+2H2O2、加热硅酸:H2SiO3错误!未找到引用源。
SiO2+H2O四、硅酸钠1、硅酸钠溶液加入氯化钙溶液:Na2SiO3+CaCl2错误!未找到引用源。
CaSiO3↓+2NaClSiO32-+Ca2+错误!未找到引用源。
CaSiO3↓2、硅酸钠溶液呈碱性:Na2SiO3+H2O错误!未找到引用源。
NaHSiO3+NaOHSiO32-+H2O错误!未找到引用源。
非金属元素及其化合物重要化学方程式小结

高一上学期非金属元素及其化合物重要化学方程式小结1.F2 + H2=2HF (冷暗处爆炸) Cl2 +H2点燃2HCl (光照或点燃)注意:氢气在氯气中燃烧时呈苍白色火焰.硫单质与氢气的化合反应:2.Cl2 +2Na点燃2NaCl(火焰呈黄色,白烟) Cl2+Cu点燃CuCl2(棕色的烟)3Cl2 +2Fe点燃2FeCl3(棕色的烟)3.Cl2+2NaBr=2NaCl+Br2 Cl2 +2KI =2KCl+I2(此反应可用于氯气的检验)4.2O2 +3Fe 点燃Fe3O4 2Fe+3Br2=2FeBr3 Fe+I2△FeI2Fe+S △2Cu+ S△Cu2S 2Na+S=Na2S(研磨或加热)5.S+O2点燃SO2 N2+O2=2NO(放电)6.2C+O2(少量)点燃2CO C+O2(足量)点燃CO2 C+CO2高温2CO7.Cl2+H2O=HCl+HClO 2F2 +2H2O=4HF+O28.Cl2+2NaOH=NaCl+NaClO+H2O9.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(漂粉精的主要成分与有效成分)10.4HCl(浓)+MnO2△MnCl2+Cl2↑+2H2O(实验室制取氯气的反应原理)11.注意工业上氨的催化氧化制硝酸的反应原理4NH3+5O2催化剂△4NO+6H2O2NO+O2=2NO2(NO是无色气体而NO2是红棕色气体)3NO2+H2O=2HNO3+NO12.NH3+HCl=NH4Cl(白烟) NH3+HNO3=NH4NO3(白烟) 2NH3+H2SO4=(NH4)2SO413.工业合成SO3:2SO2+O2催化剂加热2SO3。
14.工业上合成硫酸的原理:⑴工业上制取SO2有两种方法:一是用FeS2;另一种用硫磺。
⑵SO2催化氧制取SO3:2SO2+O2催化剂加热2SO3⑶溶于水制得硫酸SO3+H2O=H2SO415.2SO2+O2+2H2O=2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)16.SO2使氯水褪色:SO2+Cl2+2H2O=H2SO4+2HCl注:SO2能使氯水、溴水、碘水褪色,显示的是SO2的还原性,而不是漂白性17.2CO+O2点燃2CO2 CO+CuO △Cu+CO218.工业上炼铁的反应原理3CO+Fe2O3△219.SO2+H2O H2SO3 CO2+H2O H2CO320.SO3+H2O=H2SO4 SO3+CaO=CaSO4 SO3 +Na2O=Na2SO4 CO2 +Na2O=Na2CO321.SO3+Ca(OH)2=CaSO4+H2O SO2+Ca(OH)2=CaSO3↓+H2O注:不能用澄清石灰水鉴别SO2和CO2,可用品红、溴水、酸性高锰酸钾溶液鉴别。
高一化学非金属及其化合物的化学方程式总结

非金属及其化合物化学方程式汇总1.硅的化学性质:Si + O2 SiO2Si + 2NaOH + H2O === Na2SiO3 + 2 H2↑Si + 4HF === SiF4↑+ 2 H2↑2.二氧化硅的化学性质:①酸性氧化物的通性:SiO2+ 2NaOH == Na2SiO3+ H2OSiO2+ CaO △CaSiO3②弱氧化性:SiO2+2C 高温2CO+Si③与酸(只与氢氟酸)反应——腐蚀玻璃4HF+SiO2==SiF4↑+2H2O3.氯气的化学性质:2Fe+3Cl2点燃2FeCl3Cu+Cl2点燃CuCl2注意:Cl2的氧化性强,和可变价金属反应生成高价的金属氯化物!2Na+ Cl2点燃2NaClH2+ Cl2点燃2HClCl2+ H2O ==== HCl + HClO2HClO ==== 2HCl + O2 ↑Cl2 + 2NaOH ===== NaCl + NaClO + H2OCl2 + 2Ca(OH)2 ===== CaCl2 + Ca(ClO)2 + H2O Ca(ClO)2+2HCl==CaCl2+2HClO注意:①Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO②2HClO==2HCl +O2↑③Ca(ClO)2+2HCl==CaCl2+2HClO①漂白原理;①②在空气中变质;③工业上应用4.卤素的性质:①与氢气反应:H2+F2==2HFH2+ Cl2点燃2HClH2+ Br2加热2H BrH2+ I2加热2HI②与水反应:2H2O+2F2==4HF+O2Cl2+ H2O HCl + HClOBr2+ H2O HBr+ HBrO③与碱反应:Cl2 + 2NaOH ===== NaCl + NaClO + H2O Br2+ 2NaOH ===== NaBr + NaBrO + H2O ④置换反应:Cl2 + 2NaBr===== 2NaCl + Br2Cl2 + 2NaI===== 2NaCl + I2Br2 + 2NaI===== 2NaBr + I25.硫的化学性质:①还原性:S+O2点燃SO2②氧化性:S+H2△H2S2Cu+S △Cu2SFe+S △FeS注意:S的氧化性较弱,和可变价金属反应生成低价的金属硫化物!2Na+ S == 2Na2S③3S+6NaOH △2Na2S+Na2SO3+3H2O④硫的特性:S+2Hg==HgS(用硫粉除去洒落的Hg珠)2Ag+S==Ag2S6.二氧化硫的化学性质:①酸性氧化物的通性:SO2+H2O H2SO3SO2+ 2NaOH == Na2SO3+ H2OSO2+ NaOH == NaHSO3SO2+ CaO == CaSO3②还原性:SO2+2H2O+Cl2== H2SO4+2HClSO2+2H2O+Br2== H2SO4+2HBrSO2+2H2O+X2== H2SO4+2HX (X= Cl、Br、I)③氧化性:SO2+2H2S== 3S↓+2H2O7.硫酸的化学性质:①酸的通性:H2SO4+Zn== ZnSO4+ H2↑CuO +H2SO4== CuSO4 + H2O2NaOH +H2SO4==Na2SO4 +H2ONa2CO3 +H2SO4==Na2SO4 +H2O +CO2↑②浓硫酸具有强氧化性:S+2H2SO4(浓)△↑+2H2OC+2H2SO4(浓)△CO2↑+2SO2↑+2H2O(浓H2SO4与非金属反应时只作氧化剂)Cu+2H2SO4(浓)△CuSO4+SO2↑+2H2O(浓H2SO4与金属反应既表现出氧化剂有表现出酸性)③吸水性:④脱水性:8. 硝酸的化学性质:①酸的通性:CuO +2HNO3== Cu(NO3)2 + H2ONaOH +HNO3==NaNO3 +H2ONa2CO3 + 2HNO3==2NaNO3 +H2O +CO2↑②浓硝酸具有强氧化性:S+6HNO3(浓)△H2SO4+6NO2↑+2H2OC+4HNO3(浓)△CO2↑+4NO2↑+2H2O(浓H2SO4与非金属反应时只作氧化剂)Cu+2H2SO4(浓)△CuSO4+SO2↑+2H2OCu+4HNO3(浓)△Cu(NO3)2+2NO2↑+2H2O(浓HNO3与金属反应既作氧化剂又作酸)9. H2S、HI通入浓硫酸中H2S+H2SO4(浓)==SO2↑+S↓+2H2O2H2S+H2SO4(浓)==3S↓+4H2O2HI+H2SO4(浓)==SO2↑+I2+H2O 10.工业上用接触法制硫酸:4FeS2+11O2催化剂△2Fe2O3+8SO22SO2+O2催化剂高温高压2SO3SO3+H2O==H2SO4 11.工业上生产HNO3:4NH3+5O2催化剂△4NO+6H2O2NO+O2==2NO23NO2+H2O==2HNO3+NO12.工业上生产晶体硅/玻璃:①晶体硅:SiO2+2C==2CO+Si(粗硅,后两步用于提纯)Si+2Cl2==SiCl4(g)SiCl4+2H2==Si+4HCl②玻璃:Na2CO3+SiO2高温Na2SiO3+CO2↑CaCO3+SiO2高温CaSiO3+CO2↑(CaSiO3的热稳定性比CaCO3强)13.实验室制NH3、Cl2:①制取NH3:2NH4Cl(固)+Ca(OH)2(固)△CaCl2+2NH3↑+2H2O(此方程式不能写离子反应方程式。
高中化学方程式大全非金属单质

高中化学方程式大全非金属单质(F2 ,Cl2 , O2 , S, N2 , P ,C ,Si)1,氧化性:F2 + H2 === 2HFF2 +Xe(过量)===XeF22F2(过量)+Xe===XeF4nF2 +2M===2MFn (表示大部分金属)2F2 +2H2O===4HF+O22F2 +2NaOH===2NaF+OF2 +H2OF2 +2NaCl===2NaF+Cl2F2 +2NaBr===2NaF+Br2F2+2NaI ===2NaF+I2F2 +Cl2 (等体积)===2ClF3F2 (过量)+Cl2===2ClF37F2(过量)+I2 ===2IF7Cl2 +H2 ===2HCl3Cl2 +2P===2PCl3Cl2 +PCl3 ===PCl5Cl2 +2Na===2NaCl3Cl2 +2Fe===2FeCl3Cl2 +2FeCl2 ===2FeCl3Cl2+Cu===CuCl22Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I25Cl2+I2+6H2O===2HIO3+10HClCl2 +Na2S===2NaCl+SCl2 +H2S===2HCl+SCl2+SO2 +2H2O===H2SO4 +2HClCl2 +H2O2 ===2HCl+O22O2 +3Fe===Fe3O4O2+K===KO2S+H2===H2S2S+C===CS2S+Fe===FeSS+2Cu===Cu2S3S+2Al===Al2S3S+Zn===ZnSN2+3H2===2NH3N2+3Mg===Mg3N2N2+3Ca===Ca3N2N2+3Ba===Ba3N2N2+6Na===2Na3NN2+6K===2K3NN2+6Rb===2Rb3NP2+6H2===4PH3P+3Na===Na3P2P+3Zn===Zn3P22.还原性S+O2===SO2S+O2===SO2S+6HNO3(浓)===H2SO4+6NO2+2H2O3S+4 HNO3(稀)===3SO2+4NO+2H2ON2+O2===2NO4P+5O2===P4O10(常写成P2O5)2P+3X2===2PX3 (X表示F2,Cl2,Br2)PX3+X2===PX5P4+20HNO3(浓)===4H3PO4+20NO2+4H2OC+2F2===CF4C+2Cl2===CCl42C+O2(少量)===2COC+O2(足量)===CO2C+CO2===2COC+H2O===CO+H2(生成水煤气)2C+SiO2===Si+2CO(制得粗硅)Si(粗)+2Cl===SiCl4(SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2===SiO2Si+C===SiC(金刚砂)Si+2NaOH+H2O===Na2SiO3+2H23,(碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O3S+6NaOH===2Na2S+Na2SO3+3H2O4P+3KOH(浓)+3H2O===PH3+3KH2PO211P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4 3C+CaO===CaC2+CO3C+SiO2===SiC+2CO二,金属单质(Na,Mg,Al,Fe)的还原性2Na+H2===2NaH4Na+O2===2Na2O2Na2O+O2===2Na2O22Na+O2===Na2O22Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H22Na+2NH3===2NaNH2+H24Na+TiCl4(熔融)===4NaCl+TiMg+Cl2===MgCl2Mg+Br2===MgBr22Mg+O2===2MgOMg+S===MgSMg+2H2O===Mg(OH)2+H22Mg+TiCl4(熔融)===Ti+2MgCl2Mg+2RbCl===MgCl2+2Rb2Mg+CO2===2MgO+C2Mg+SiO2===2MgO+SiMg+H2S===MgS+H2Mg+H2SO4===MgSO4+H22Al+3Cl2===2AlCl34Al+3O2===2Al2O3(钝化)4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg 4Al+3MnO2===2Al2O3+3Mn2Al+Cr2O3===Al2O3+2Cr2Al+Fe2O3===Al2O3+2Fe2Al+3FeO===Al2O3+3Fe2Al+6HCl===2AlCl3+3H22Al+3H2SO4===Al2(SO4)3+3H22Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO(稀)===Al(NO3)3+NO+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H22Fe+3Br2===2FeBr3Fe+I2===FeI2Fe+S===FeS3Fe+4H2O(g)===Fe3O4+4H2Fe+2HCl===FeCl2+H2Fe+CuCl2===FeCl2+CuFe+SnCl4===FeCl2+SnCl2(铁在酸性环境下,不能把四氯化锡完全还原为单质锡Fe+SnCl2==FeCl2+Sn)三,非金属氢化物(HF,HCl,H2O,H2S,NH3)1,还原性:4HCl(浓)+MnO2===MnCl2+Cl2+2H2O4HCl(g)+O2===2Cl2+2H2O16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O 14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O 2H2O+2F2===4HF+O22H2S+3O2(足量)===2SO2+2H2O2H2S+O2(少量)===2S+2H2O2H2S+SO2===3S+2H2OH2S+H2SO4(浓)===S+SO2+2H2O3H2S+2HNO(稀)===3S+2NO+4H2O5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O H2S+4Na2O2+2H2O===Na2SO4+6NaOH2NH3+3CuO===3Cu+N2+3H2O2NH3+3Cl2===N2+6HCl8NH3+3Cl2===N2+6NH4Cl4NH3+3O2(纯氧)===2N2+6H2O4NH3+5O2===4NO+6H2O4NH3+6NO===5N2+6HO(用氨清除NO)NaH+H2O===NaOH+H24NaH+TiCl4===Ti+4NaCl+2H2CaH2+2H2O===Ca(OH)2+2H22,酸性:4HF+SiO2===SiF4+2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量)2HF+CaCl2===CaF2+2HClH2S+Fe===FeS+H2H2S+CuCl2===CuS+2HClH2S+2AgNO3===Ag2S+2HNO3H2S+HgCl2===HgS+2HClH2S+Pb(NO3)2===PbS+2HNO3H2S+FeCl2===2NH3+2Na==2NaNH2+H2(NaNH2+H2O===NaOH+NH3)3,碱性:NH3+HCl===NH4ClNH3+HNO3===NH4NO32NH3+H2SO4===(NH4)2SO4NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl(此反应用于工业制备小苏打,苏打)4,不稳定性:2HF===H2+F22HCl===H2+Cl22H2O===2H2+O22H2O2===2H2O+O2H2S===H2+S2NH3===N2+3H2四,非金属氧化物低价态的还原性:2SO2+O2===2SO32SO2+O2+2H2O===2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O===H2SO4+2HClSO2+Br2+2H2O===H2SO4+2HBrSO2+I2+2H2O===H2SO4+2HISO2+NO2===SO3+NO2NO+O2===2NO2NO+NO2+2NaOH===2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)2CO+O2===2CO2CO+CuO===Cu+CO23CO+Fe2O3===2Fe+3CO2CO+H2O===CO2+H2氧化性:SO2+2H2S===3S+2H2OSO3+2KI===K2SO3+I2NO2+2KI+H2O===NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S===4NO+SO3+H2O2NO2+Cu===4CuO+N2CO2+2Mg===2MgO+C(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)SiO2+2H2===Si+2H2OSiO2+2Mg===2MgO+Si3,与水的作用:SO2+H2O===H2SO3SO3+H2O===H2SO43NO2+H2O===2HNO3+NON2O5+H2O===2HNO3P2O5+H2O===2HPO3P2O5+3H2O===2H3PO4(P2O5极易吸水,可作气体干燥剂P2O5+3H2SO4(浓)===2H3PO4+3SO3)CO2+H2O===H2CO34,与碱性物质的作用:SO2+2NH3+H2O===(NH4)2SO3SO2+(NH4)2SO3+H2O===2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,再用H2SO4处理:2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2 生成的硫酸铵作化肥,SO2循环作原料气)SO2+Ca(OH)2===CaSO3+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+MgO===MgSO4SO3+Ca(OH)2===CaSO4+H2OCO2+2NaOH(过量)===Na2CO3+H2OCO2(过量)+NaOH===NaHCO3CO2+Ca(OH)2(过量)===CaCO3+H2O2CO2(过量)+Ca(OH)2===Ca(HCO3)2CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3CO2+C6H5ONa+H2O===C6H5OH+NaHCO3SiO2+CaO===CaSiO3SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3===Na2SiO3+CO2SiO2+CaCO3===CaSiO3+CO2五,金属氧化物1,低价态的还原性:6FeO+O2===2Fe3O4FeO+4HNO3===Fe(NO3)3+NO2+2H2O2,氧化性:Na2O2+2Na===2Na2O(此反应用于制备Na2O)MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al。
硅、硫、氮及其化合物化学方程式

1.硅与氧气加热:2.二氧化硅与氢氟酸反应:_______________________________________3.二氧化硅与氧化钙高温反应:__________________________________4.二氧化硅与氢氧化钠溶液反应:_____________________________________________5.二氧化硅与碳反应:____________________________________6硅酸钠与盐酸反应:______________________________离子方程式:_________________________7.往硅酸钠溶液中通入二氧化碳:________________ _______8.二氧化硅与纯碱反应:_______________________ ___ _______9.二氧化硅与石灰石反应:______________________ ___二、硫及其化合物1.硫在空气中燃烧:___________________________________2.二氧化硫与水:______________________________________二氧化硫与氧化钙:__________________________________少量SO2与氢氧化钠:______________________________离子方程式:_______________________过量SO2与氢氧化钠:______________________________离子方程式:_______________________3.SO2通入过量的澄清石灰水:过量的SO2通入澄清石灰水:4.二氧化硫与硫化氢: _____5.SO2的催化氧化:____________________________________6.亚硫酸钠和硫酸反应: _________________________________________7.Na2SO3与氧气反应:__________________________________8.三氧化硫和水反应:____________________________________9.三氧化硫与氧化钙:___________________________10.三氧化硫与氢氧化钙:___________________________11.铜与浓硫酸反应: ________________________________________12.碳与浓硫酸反应: _______________________________________1.氮气和氧气反应:____________________________2.工业合成氨:____________________________________3.一氧化氮与氧气反应: ____________________4.NO2溶于水:____________________________________5.氨气溶于水:___________________________氨水显弱碱性(电离方程式):____________________6.浓氨水受热分解___________________________7.氨气和氯化氢:____________________________________8.氨的催化氧化_________________________________________9.氯化铵受热分解: ____________________________________10.碳酸氢铵受热分解:___________________________________11.硝酸铵和NaOH:__________________________________离子方程式:_________________________12.实验室制氨气:_______________________________________13.浓硝酸与铜反应:_________________________________离子方程式:_________________________14.稀硝酸与铜反应:________________________________离子方程式:________________________15.硝酸见光分解:_____________________________________________16.NH4+的检验离子方程式:___________________________17.NO2、O2混合气通入水中无剩余气体:18.NO、O2混合通入水中无剩余气体:。
非金属及其化合物重要化学方程式总结(答案)

非金属及其化合物重要化学方程式总结一.碳、硅及其化合物Si 和NaOH 溶液的反应Si +2OH -+H 2O===SiO 2-3+2H 2↑;SiO 2和NaOH 溶液的反应SiO 2+2OH -===SiO 2-3+H 2O ;SiO 2和C 的反应SiO 2+2C=====高温Si +2CO ↑;SiO 2和氢氟酸的反应SiO 2+4HF===SiF 4↑+2H 2O ;向Na 2SiO 3溶液中通入过量CO 2气体SiO 2-3+2CO 2+2H 2O===H 2SiO 3↓+2HCO -3;Mg 在CO 2中燃烧2Mg +CO 2=====点燃2MgO +C ;向澄清石灰水中通入少量CO 2气体Ca 2++2OH -+CO 2===CaCO 3↓+H 2O ;向澄清石灰水中通入过量CO 2气体OH -+CO 2===HCO -3;⑨除去CO 2中的COCO +CuO=====△CO 2+Cu ;生产普通玻璃的原理Na 2CO 3+SiO 2=====高温Na 2SiO 3+CO 2↑、CaCO 3+SiO 2=====高温CaSiO 3+CO 2↑。
二.氯气及其化合物Cl 2和H 2O 的反应Cl 2+H 2O H ++Cl -+HClO ;Cl 2和NaOH 溶液的反应Cl 2+2OH -===Cl -+ClO -+H 2O ;Cl 2和石灰乳的反应Cl 2+Ca(OH)2===Ca 2++Cl -+ClO -+H 2O ;把Cl 2通入到Na 2SO 3溶液中Cl 2+SO 2-3+H 2O===SO 2-4+2H ++2Cl -; 将Cl 2和SO 2混合通入H 2O 中SO 2+Cl 2+2H 2O===4H ++2Cl -+SO 2-4;将Cl 2通入到氢硫酸溶液中Cl 2+H 2S===S ↓+2H ++2Cl -;将浓盐酸和MnO 2混合加热MnO 2+4H ++2Cl -=====△Mn 2++Cl 2↑+2H 2O ;电解饱和食盐水2Cl -+2H 2O=====电解Cl 2↑+H 2↑+2OH -;将浓盐酸与漂白液混合Cl -+ClO -+2H +===Cl 2↑+H 2O ;将浓盐酸与KClO 3溶液混合6H ++5Cl -+ClO -3===3Cl 2↑+3H 2O ;向KMnO 4固体滴加浓盐酸2MnO -4+16H ++10Cl -===2Mn 2++5Cl 2↑+8H 2O ;向漂白粉溶液中通入少量CO 2气体Ca 2++2ClO -+CO 2+H 2O===CaCO 3↓+2HClO 。
非金属及其化合物部分方程式汇总

非金属及其化合物部分方程式汇总1.硅硅单质与氧气反应:Si + O2SiO2二氧化硅与氢氟酸反应:SiO2 + 4HF = Si F4 ↑+ 2H2O二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2OSiO2 + 2OH -= SiO32-+ H2O二氧化硅与氧化钙高温反应:SiO2 + CaO CaSiO3硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3(胶体)(硅酸的制备)往硅酸钠溶液中通二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3(胶体)粗硅的制取:SiO2 + 2C 高温Si + 2CO↑玻璃的生产原理:CaCO3+SiO2CaSiO3+CO2↑Na2CO3+SiO2Na2SiO3+CO2↑2.硫硫在氧气中:S + O2点燃SO2硫与金属反应:Fe + S△FeS 2Cu + S△Cu2S (都生成低价化合物)二氧化硫与氧气在催化剂的作用下反应:2SO2 + O22SO3二氧化硫与水反应:SO 2 + H2O H2SO3三氧化硫与水反应:SO3 + H2O = H2SO4二氧化硫与氢氧化钠反应:SO2 + 2NaOH = Na2SO3 + H2OSO2 + 2OH -= SO32-+ H2O三氧化硫与氢氧化钠反应:SO3 + 2NaOH = Na2SO4+ H2OSO3 + 2OH -= SO42-+ H2O少量二氧化硫与石灰水反应:SO2 + Ca(OH)2 = CaSO3↓ + H2O(CaSO3白色沉淀)SO2 + Ca2++2OH-= CaSO3↓ + H2O足量二氧化硫与石灰水反应:SO2 + Ca(OH)2 = Ca(HSO3)2SO2 + OH-= HSO3-二氧化硫与氧化钙反应:SO2 + CaO高温CaSO3二氧化硫与氯水反应:SO2 + Cl2 + 2H2O = 2HCl + H2SO4SO2 + Cl2 + 2H2O = 4H++ SO42-+2Cl-二氧化硫与溴水反应:SO2 + Br2 + 2H2O = 2HBr + H2SO4SO2 + Br2+ 2H2O = 4H++ SO42-+2Br-(氯水或溴水褪色体现SO2的还原性,不是漂白性)浓硫酸与木炭反应:C + 2H2SO4(浓) CO2↑+ 2SO2↑ + 2H2O浓硫酸与铜反应:Cu + 2H2SO4(浓) CuSO4 + SO2↑ + 2H2O3.氯氯气与金属钠反应:2Na + Cl2 2NaCl氯气与金属铁反应:2Fe + 3Cl22FeCl3氯气与金属铜反应:Cu + Cl2CuCl2氯气与氢气反应:Cl2 + H22HCl (苍白色火焰)氯气与水反应:Cl2 + H2O = HCl + HClOCl2 + H2O = H+ + Cl-+ HClO (HClO是弱酸,不能改写)Cl2从溴化物(或碘化物)中置换出Br2(或I2):Cl2+2NaBr=Br2+2NaCl Cl2+2KI=I2+2KClCl2+2Br -=Br2+2Cl -Cl2+2I -= I2+2Cl -次氯酸光照分解:2HClO 2HCl + O2↑氯气与氢氧化钠溶液反应(工业制漂白液):Cl2 + 2NaOH = NaCl + NaClO + H2OCl2 + 2OH-= Cl -+ ClO-+ H2O氯气与石灰乳反应(工业制漂白粉):2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O(漂白粉的主要成分是 CaCl2和 Ca(ClO)2,有效成分是 Ca(ClO)2)漂白粉长期露置在空气中:Ca(ClO)2 + H2O + CO2 = CaCO3↓ + 2HClO实验室制氯气:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2OMnO2+4H++2Cl-Mn2++Cl2↑+2H2O4.氮放电或高温氮气与氧气反应:N2 + O2 ===== 2NO (无色气体)一氧化氮与氧气反应:2NO + O2 = 2NO2(红棕色气体)二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NO3NO2 + H2O = 2H+ + 2NO3-+ NO氨水受热分解:NH3·H2O NH3↑ + H2O氨气与氯化氢反应:NH3 + HCl = NH4Cl (产生大量白烟)氯化铵受热分解:NH4Cl NH3↑ + HCl↑碳酸氢铵受热分解:NH4HCO3NH3↑ + H2O+ CO2↑硝酸铵溶液与氢氧化钠溶液反应:NH4NO3 + NaOH NH3↑ + NaNO3 + H2ONH4++OH-NH3↑+ H2O硫酸铵溶液与氢氧化钠溶液反应:(NH4)2SO4+ 2NaOH2NH3↑+Na2SO4+2H2ONH4++OH-NH3↑+ H2O氨气的实验室制法:2NH4Cl + Ca(OH)2CaCl2 + 2H2O + 2NH3↑氨气的催化氧化:4 NH3 +5O2 4NO+6H2O工业合成氨:N2 + 3H22NH3 (请记住反应条件)浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑Cu + 4H+ + 2NO3-= Cu2+ + 2H2O+ 2NO2↑稀硝酸与铜反应:3Cu + 8HNO3(稀) =3Cu(NO3)2 + 4H2O + 2NO↑3Cu + 8H+ + 2NO3- = 3Cu2+ + 4H2O + 2NO↑浓硝酸与木炭反应:C + 4HNO3(浓) CO2↑+ 4NO2↑+ 2H2O稀硝酸与足量的铁反应:3 Fe + 8HNO3(稀) =3Fe (NO3)2+ 2NO↑+4H2O3 Fe + 8H+ + 2NO3- =3 Fe 2+ + 4H2O + 2NO↑稀硝酸与少量的铁反应:Fe + 4HNO3(稀) =Fe (NO3)3 + NO↑+2H2OFe + 4H+ + NO3- = Fe 3+ + NO↑+ 2H2O工业制硝酸的流程:NH3NO NO2HNO3O2H2OO2①②③4 NH3 +5O2 4NO+6H2O 2NO + O2 = 2NO23NO2 + H2O = 2HNO3 + NO。
高中化学方程式——非金属及其化合物

50、Fe + H2SO4(浓) =
51、H2S + H2SO4(浓) =
三、氮族元素
52、N2+ H2—
53、N2+ Mg =
54、氨的催化氧化:NH3+ O2 =
55、N2+ O2 =
56、NO+ O2═
57、NO2+ H2O═
58、NO+ O2+ H2O═
59、NO2+ O2+ H2O═
39、H2S + O2(足) ═
40、H2S (少)+ NaOH ═
41、H2S (足) + NaOH═
42、H2S+ Br2 ═
43、H2S+ CuSO4 ═
44、H2S+ FeCl3 ═
45、C + H2SO4(浓) =
46、S + H2SO4(浓) =
47、S + HNO3(浓) =
48、S+ HNO3(稀) =
18、Cl2+ H2S =
19、Cl2+ SO2+ H2O =
20、HF + SiO2 =
21、HF + Si =
二、氧族元素
22、O2+ Fe =
23、S+ Fe =
24、S+ Cu =
25、S+ O2 =
26、SO2+ H2O—
27、H2SO3+ O2 =
28、SO2+ O2 —
29、SO3+ H2O ═
四、碳族元素
70、Si + NaOH =
非金属及其化合物方程式汇总

非金属及其化合物重要方程式汇总(一)硅及其化合物1. 硅与氧气的反应:化学方程式:2.Si与氟气的反应:化学方程式:3.硅与NaOH溶液反应:化学方程式:离子方程式:4.Si与HF作用:化学方程式:5.C在高温下与SiO2的反应:化学方程式:6.SiO2与氢氟酸的反应:化学方程式:7.SiO2与碱性氧化物(CaO)的反应:化学方程式:8.SiO2与强碱NaOH溶液的反应:化学方程式:离子方程式:9.Na2CO3固体与SiO2的反应:化学方程式:10.H2SiO3与强碱NaOH溶液的反应:化学方程式:离子方程式:11.硅酸的热稳定性很弱,受热分解:化学方程式:12.向硅酸钠溶液中通入足量的CO2的反应:化学方程式:离子方程式:13.向硅酸钠溶液中通入适量的CO2的反应:化学方程式:离子方程式:14. 向硅酸钠溶液中滴加稀盐酸的反应:化学方程式:离子方程式:15.硅酸盐产品:玻璃、、。
它们都是以硅酸盐为主要原料经过高温烧制而成。
(1)生产普通玻璃的主要原料:、和。
普通玻璃的成份:、。
(2)生产水泥的主要原料:和。
水泥的成份:、、。
(3)生产陶瓷的主要原料:。
(二)氯及其化合物1.铁丝在氯气中点燃:化学方程式:2.氢气在氯气中点燃:化学方程式:3.氯气通入到FeCl2溶液中:化学方程式:离子方程式:4.常用NaOH溶液吸收多余的Cl2,以消除污染:化学方程式:离子方程式:________________________________________ 5.氯气与NaOH加热条件下的反应:化学方程式:离子方程式:6.氯气与水反应:化学方程式:离子方程式:________________________________________ 7.氯水滴加到碘化钾溶液中:化学方程式:1离子方程式:8.二氧化硫气体通入到氯水中:化学方程式:离子方程式:9.制取漂白粉:化学方程式:离子方程式:10.漂白粉漂白原理:化学方程式:离子方程式:11.漂白粉放置在空气中容易失效的原因:化学方程式:①②离子方程式:①②12.使用漂白粉时,将其溶于水后加入少量稀盐酸或通入过量CO2的原因:化学方程式:①②离子方程式:①②13.氯气的实验室制法:化学方程式:离子方程式:14.碘单质与氢气化合:化学方程式:15.氟单质与水的反应:化学方程式:离子方程式:16.溴单质与铁化合:化学方程式:17.碘单质与铁丝加热条件下反应:化学方程式:18.①足量的氯气通入到FeBr2溶液:化学方程式:离子方程式:②少量的氯气通入到FeBr2溶液:化学方程式:离子方程式:19.少量的氯气通入到FeI2溶液:化学方程式:离子方程式:20.KBr溶液与硝酸银溶液混合:化学方程式:离子方程式:21. KI溶液与硝酸银溶液混合:化学方程式:离子方程式:22.氢氟酸腐蚀玻璃的反应:化学方程式:23. AgBr作为变色眼镜添加材料原因:化学方程式:(三)氮及其化合物1.工业制取氨气:化学方程式:2.N2与O2反应:化学方程式:3.N2与Mg反应:化学方程式:4.氨气与浓HCl反应化学方程式:5.氨气与浓HNO3反应:化学方程式:6.工业制硝酸:化学方程式:2①第一步:氨气与O2反应(氨的催化氧化):②第二步:③第三步:7.NO与O2被水完全吸收的总反应:化学方程式:8.NO2与O2被水完全吸收的总反应:化学方程式:9.实验室制取氨气的反应原理:化学方程式:10.①氯化铵受热分解:化学方程式:②碳酸铵受热分解:化学方程式:③配平硝酸铵分解的化学方程式:____NH4NO3 =____N2↑+___HNO3+____H2ONH4NO3 = N2O↑+H2ONH4NO3 = N2↑+O2↑+H2ONH4NO3 = N2↑+NO2↑+H2O 11.浓氨水受热分解,化学方程式:12.氨气溶于水的化学方程式:13. 一水合氨的电离方程式:14.铜和浓硝酸反应:化学方程式:离子方程式:15.铜和稀硝酸反应:化学方程式:离子方程式:16.铁和浓硝酸加热反应:化学方程式:17.①铁粉和过量稀硝酸的反应:化学方程式:②过量铁粉和稀硝酸的反应:化学方程式:18.木炭和浓硝酸的反应:化学方程式:19.硫磺和浓硝酸的反应:化学方程式:20.FeO和稀硝酸的反应:化学方程式:离子方程式:21.Fe(NO3)2和稀硝酸的反应:化学方程式:离子方程式:22.KI和稀硝酸的反应:化学方程式:离子方程式:23.Na2S和稀硝酸的反应:化学方程式:离子方程式:24.Na2SO3和稀硝酸反应:化学方程式:离子方程式:(四)氧、硫及其化合物1.铝和硫共热:2.铜和硫共热:3.铁和硫共热:4.氢气和硫共热:5.硫在氧气中燃烧:36.硫与NaOH反应:7.硫与浓硫酸共热:8.硫与浓硝酸共热:9.Mg在SO2中燃烧:10. SO2和H2S混合:11. SO2通入氯水:12. SO2催化氧化:13.SO2通入KMnO4溶液:14.SO2与水反应:15.SO2与CaO反应:16.少量SO2通入NaOH溶液:17.过量SO2通入NaOH溶液:18、SO3化学性质:具有酸性氧化物的通性:(1)SO3与水反应:(2)SO3与NaOH溶液反应:19、SO2的制备方法:Na2SO3和浓硫酸反应20、硫化氢的物理性质:H2S是色,有气味的体。
非金属相关方程式总结 高中高考化学方程总结

非金属相关方程式总结一、硅及其化合物1、硅与氧气、氟、氯气、碳反应:Si+O2SiO2 ;Si+2F2==SiF4Si+2Cl2温高SiCl4 Si+C温高SiC2、硅与氢氟酸、氢氧化钠反应:Si+4HF=SiF4↑+2H2↑Si+2NaOH+H2O=Na2SiO3+2H2↑3、二氧化硅与氢氟酸反应:SiO2+4HF=SiF4↑+2H2O4、二氧化硅与碱性氧化物反应:SiO2+CaO温高CaSiO35、二氧化硅与碱反应:SiO2+2NaOH =Na2SiO3+H2O6、二氧化硅与碳反应:SiO2+2C温高Si+2CO↑7、二氧化硅与碳酸钠、碳酸钙反应:SiO2+Na2CO3温高Na2SiO3+CO2↑SiO2+CaCO3温高CaSiO3+CO2↑8、硅酸和氢氧化钠反应:H2SiO3+2NaOH=Na2SiO3+2H2O9、硅酸受热分解:H2SiO3SiO2+H2O10、硅酸钠与酸反应:Na2SiO3+2HCl=2NaCl+H2SiO3(胶体)Na2SiO3+H2O+CO2(少量)=H2SiO3(胶体)+Na2CO3Na2SiO3+2H2O+2CO2(过量)=H2SiO3(胶体)+2NaHCO3二、氯及其化合物1、氯气与金属反应:Cl2+2Na燃点2NaCl;Cl2+Cu燃点CuCl2;3Cl2+2Fe燃点2FeCl32、氯气与非金属反应:Cl2+H2燃点2HCl3、实验室制氯气:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O4、氯气、氟与水的反应:Cl2+H2O=HCl+HClO ;Cl2+H2O=H++Cl-+HClO2HClO照光2HCl+O2↑;2F2+2H2O=4HF+O2高中化学必备5、氯气与碱反应:Cl2+2NaOH=NaCl+NaClO+H2O;Cl2+2OH- = Cl-+ClO-+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;Cl2+2OH- = Cl-+ClO-+H2O 6、漂白液、漂白粉、漂白精长期露置空气中会发生反应:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO;2NaClO+H2O+CO2=Na2CO3+2HClO2HClO照光2HCl+O2↑7、氯离子检验:先在被检验液中加稀硝酸酸化,再加硝酸银溶液,如产生白色沉淀,可判断原溶液中含氯离子:Ag++Cl-=AgCl↓8、卤素单质间置换:Cl2+2Br-=2Cl-+Br2 ;Cl2+2I-=2Cl-+I2 ;Br2+2I-=2Br-+I2三、硫和氮及其化合物1、二氧化硫和水反应:SO2+H2O=H2SO32、二氧化硫和氧化钙反应:SO2+CaO=CaSO33、二氧化硫和氢氧化钠反应:SO2(少)+2NaOH=Na2SO3+H2O;SO2(过)+NaOH=NaHSO34、二氧化硫和盐反应SO2(少)+2NaHCO3=Na2SO3+H2O+2CO2SO2(过)+NaHCO3=NaHSO3+CO25、二氧化硫和硫化氢反应:SO2+2H2S=3S↓+2H2O6、二氧化硫和卤素单质水溶液反应:SO2+X2+2H2O=H2SO4+2HX(X=Cl、Br、I;F除外)7、二氧化硫能被氧气氧化:2SO2+O22SO38、三氧化硫与水、碱、碱性氧化物反应:SO3+H2O=H2SO4 ;SO3+CaO=CaSO4;SO3+2NaOH=Na2SO4+H2O9 、氮气和氧气反应:N2+O2压高或电放2NO10、一氧化氮与氧气反应:2NO+O2=2NO211、二氧化氮与水反应:3NO2+H2O=2HNO3+NOP2O512、氮的氧化物溶于水的有关计算:3NO 2+H 2O=2HNO 3+NO ; 2NO+O 2=2NO 24NO 2+O 2+2H 2O=4HNO 3; 4NO+3O 2+2H 2O=4HNO 313、氮的氧化物和氢氧化钠反应:NO 2+NO+2NaOH=2NaNO 2+H 2O2NO 2+2NaOH=NaNO 3+ NaNO 2+H 2O四、氨、硝酸、硫酸1、氨:3H N 22H 3+2N2、氨与水的反应:NH 3+H 2O NH 3•H 2O (可逆)3、氨水不稳定:NH 3•H 2ONH 3↑+H 2O 4、氨与HCl 等酸的反应:NH 3+HCl=NH 4Cl ; 2NH 3+H 2SO 4=(NH 4)2SO 4NH 3+HNO 3==NH 4NO 3; NH 3+H 2O+CO 2=NH 4HCO 36、铵盐受热分解: NH 4Cl NH 3↑+HCl↑; NH 4HCO 3NH 3↑+H 2O↑+CO 2↑7、氨的催化氧化:4NH 3+5O 2剂化催4NO+6H 2O 8、氨的制法:2NH 4Cl+Ca(OH)2 CaCl 2+2NH 3↑+2H 2O9、浓硫酸和铜反应:2H 2SO 4(浓)+CuCuSO 4+2H 2O+SO 2↑ 10、浓硫酸和碳反应:2H 2SO 4(浓)+C CO 2↑+2H 2O+2SO 2↑11、浓硫酸和铁加热条件下反应:6H 2SO 4(浓)+2Fe Fe 2(SO 4)3+6H 2O+3SO 2↑12、浓硝酸和铜反应: Cu+4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O13、稀硝酸和铜反应:3Cu+8HNO 3(稀) = 3Cu(NO 3)2+2N O↑+4H 2O。
非金属金属及化合物转换关系图和化学方程式与离子方程式的归纳与整理
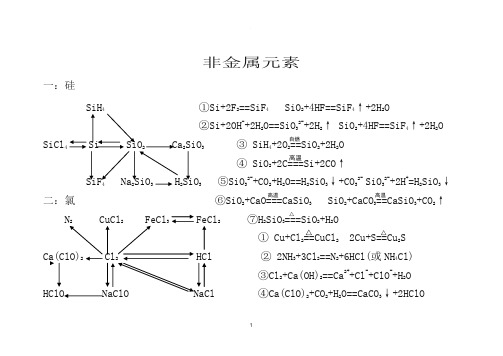
非金属元素一:硅SiH 4 ①Si+2F 2==SiF 4 SiO 2+4HF==SiF 4↑+2H 2O②Si+2OH -+2H 2O==SiO 32-+2H 2↑ SiO 2+4HF==SiF 4↑+2H 2OSiCl 4 Si SiO 2 Ca 2SiO 3 ③ SiH 4+2O 2==SiO 2+2H 2O ④ SiO 2+2C===Si+2CO ↑SiF 4 Na 2SiO 3 H 2SiO 3 ⑤SiO 32-+CO 2+H 2O==H 2SiO 3↓+CO 32- SiO 32-+2H +=H 2SiO 3↓ 二:氯 ⑥SiO 2+CaO===CaSiO 3 SiO 2+CaCO 3==CaSiO 3+CO 2↑N 2 CuCl 2 FeCl 3 FeCl 2 ⑦H 2SiO 3===SiO 2+H 2O① Cu+Cl 2==CuCl 2 2Cu+S==Cu 2S Ca(ClO)2 Cl 2 HCl ② 2NH 3+3Cl 2==N 2+6HCl(或NH 4Cl) ③Cl 2+Ca(OH)2==Ca 2++Cl -+ClO -+H 2O HClO NaClO NaCl ④Ca(ClO)2+CO 2+H 2O==CaCO 3↓+2HClO高温高温高温 △△ △自燃Ca(ClO)2+2HCl==CaCl 2+2HClO ICl+ H 2O==HIO+HCl ⑤2NaOH+Cl 2==NaCl+NaClO+H 2OFe 2O 3+ 6HI==2FeI 2+I 2+3H 2O ⑥Cl -+ ClO -+2H +==Cl 2↑+H 2O2NaCl+MnO 2+2H 2SO 4(浓)== ⑦ClO -+CO 2+H 2O==HClO+HCO 3- ClO -+SO 2+H 2O==Cl -+SO 42-+2H +Na 2SO 4+MnSO 4+Cl 2↑+2H 2O ⑧ MnO 2+4HCl(浓)— 2MnO 4-+10Cl -+16H +==2Mn 2++5Cl 2↑+4H 2O⑨2NaCl+2H 2O===2NaOH+Cl 2↑+H 2↑ ⑩NaCl+H 2SO 4(浓)==NaHSO 4+ HCl ↑ 三:硫 ⑴ 2Al+3S==Al 2S 3 Al 2S 3+6H 2O==2Al(OH)3↓+3H 2S ↑ CuS Cu ⑵Fe+S==FeS FeS+2H +==Fe 2++H 2S ↑ ⑶ Cu 2++ H 2S==CuS ↓+2H +H 2S S SO 2 SO 3 ⑷2H 2S+O 2==3S+2H 2O 2H 2S+3O 2==2SO 2+2H 2O ⑸ 2H 2S+SO 2==3S+2H 2O H 2S+2Fe 3+==2Fe 2++S ↓+2H +FeS Al 2S 3 H 2SO 4 ⑹ 2SO 2+ O 2 2SO 3 Na 2SO 3 Na 2SO 4 ⑺2H 2SO 4(浓)+Cu===CuSO 4+SO 2↑+2H 2O△△电解 点燃 点燃△V 2O 5450℃ △△△四:氮⑴ N 2+3H 2 2NH 3 NH 4Cl NH 3 N 2 NO NO 2 HNO 3 ⑵ 8NH 3+3Cl 2==N 2+6NH 4Cl ⑶ N 2+O 2==2NONH 3·H 2O Mg 3N 2 NaNO 2 NaNO 3 ⑷4NH 3+6NO==5N 2+6H 2O ⑸2NH 4Cl+Ca(OH)2==CaCl 2+2NH 3↑+2H 2O ⑹NH 4++OH -==NH 3·H 2O NH 4++OH -==NH 3↑+H 2O⑺NH 3·H 2O(浓)===NH 3↑+H 2O ⑻ 3NO 2+H 2O==2HNO 3+NO ⑼NO+ NO 2+2OH -==2NO 2-+H 2O 2NO 2+2OH -==NO 2-+NO 3-+H 2O⑽4NH 3+5O 2===4NO+6H 2O ⑾Cu+4HNO 3(浓)==Cu(NO 3)2+2NO 2↑+2H 2O 3Cu+8HNO 3(稀)==3Cu(NO 3)2+2NO ↑+4H 2O△⑾CaO或碱石灰△高温、高压催化剂 催化剂△催化剂△ 放电欢迎您的下载,资料仅供参考!致力为企业和个人提供合同协议,策划案计划书,学习资料等等打造全网一站式需求。
高中金属和非金属化学方程式总结

金属及其化合物一、钠和钠的化合物1、钠与水反应: 2Na+2H 2O =2NaOH+H 2↑2Na+2H 2O = 2Na ++2OH -+H 2↑ 2、钠与氧气反应:①常温反应 4Na+O 2 =2Na 2O ②点燃或加热2Na+O 2 = Na 2O 23、钠与盐酸等酸反应: 2Na+2HCl = 2NaCl +H 2↑2Na+2H + = 2Na ++H 2↑ 4 、钠与氯气的反应:2Na+Cl 2 =2NaCl5、钠与硫的反应: 2Na+S = Na 2S6、钠与碱溶液的反应实际上是与钠跟水的反应7、钠与盐溶液的反应 ①NaCl 溶液:实际上与水反应,反应的化学方程式:2Na+2H 2O = 2NaOH+H 2↑②CuSO4溶液:2Na+CuSO 4 +2H 2O = Cu(OH)2↓+H 2↑ + Na 2SO 4③NaHSO 4溶液:2Na + 2NaHSO 4 = 2Na 2SO 4 + H 2↑④通常钠不能从盐溶液中置换出金属:若盐为熔融状态,钠可以置换出较不活泼的金属,如:4Na点燃点燃Δ+ TiCl4 = 4 NaCl + Ti 8、金属钠露置在空气中的变化过程4Na+O 2 =2Na 2ONa 2O+H 2O = 2NaOH2NaOH+CO 2=Na 2CO 3+H 2O9、氧化钠和水的反应:Na 2O+H 2O =2NaOH10、氧化钠和盐酸的反应:Na 2O+2HCl =2NaCl+H 2O11、氧化钠和二氧化碳的反应:Na 2O+CO 2 =Na 2CO 312、过氧化钠和水的反应:2Na 2O 2+2H 2O =4NaOH+O 2↑13、过氧化钠和二氧化碳的反应:2Na 2O 2+2CO 2=2Na 2CO 3+O 214、过氧化钠和盐酸的反应:2Na 2O 2+4HCl =4NaCl+2H 2O+O 2↑15、氧化钠和过氧化钠转化:2Na 2O+O 2=2Na 2O 216、碳酸钠和盐酸反应:①Na 2CO 3+HCl =NaHCO 3+NaCl ②Na 2CO 3+2HCl =2NaCl+H 2O+CO 2↑17、碳酸钠和氢氧化钙反应:Na 2CO 3+Ca (OH )2=CaCO 3↓+2NaOH18、碳酸钠和可溶性盐反应:Na 2CO 3+CaCl 2=CaCO 3↓+2NaCl熔融ΔNa 2CO 3+BaCl 2=BaCO 3↓+2NaCl19、碳酸氢钠和盐酸反应:NaHCO 3+HCl =NaCl+H 2O+CO 2↑ 20、碳酸氢钠和氢氧化钠、氢氧化钙反应:NaOH =Na 2CO 3+H 2O2NaHCO 3+Ca (OH )2=CaCO 3↓+Na 2CO 3+2H 2O21、碳酸氢钠和盐反应:NaHCO 3+NaHSO 4=Na 2SO 4+H 2O+CO 2↑22、碳酸氢钠受热分解:2NaHCO 3=Na 2CO 3+H 2O+CO 2↑ 23、碳酸氢钠和碳酸钠转化:Na 2CO 3+H 2O+CO 2=2NaHCO 3 2NaHCO 3=Na 2CO 3+H 2O+CO 2↑ NaHCO 3+NaOH =Na 2CO 3+H 2O24、碳酸氢钠制法:NH3+NaCl+H 2O+CO 2=NaHCO 3↓+NH4Cl二、铝和铝的化合物1、铝与氧气反应:4Al+3O 2=2Al 2O 32、铝与盐酸等酸的反应:2Al+6HCl =2AlCl 3+3H 23、铝与氢氧化钠溶液的反应:2Al+2NaOH+2H 2O =2NaAlO 2+3H 2↑4、氧化铝和盐酸反应:Al 2O 3+6HCl =2AlCl 3+3H 2OΔΔ Δ5、氧化铝和氢氧化钠反应:Al2O3+2NaOH=2NaAlO2+H2O6、氢氧化铝制备:Al3++3NH3•H2O=Al(OH)3↓+3NH4+7、氢氧化铝和酸的反应:Al(OH)3+3HCl=AlCl3+3H2O8、氢氧化铝和氢氧化钠的反应:Al(OH)3+NaOH=NaAlO2+2H2O氢氧化铝不稳定性:2Al(OH )3=Al2O3+3H2O三、铁和铁的化合物1、铁与氧气反应:3Fe+2O2=Fe3O42、铁与水蒸气反应:3Fe+4H2O(g)=Fe3O4+4H2↑3、铁与盐酸等酸反应:Fe+2HCl=FeCl2+H2↑4、铁的氧化物分别与酸反应:FeO+2H+=Fe2++H2OFe2O3+6H+=2Fe3++3H2OFe3O4+8H+=Fe2++2Fe3++4H2O5、铁的氧化物与还原剂反应:Fe x O y+yCO=x Fe+yCO26、铁的氢氧化物与盐酸等酸反应:Fe(OH)2+2HCl=FeCl2+2H2OFe(OH)3+3HCl=FeCl3+3H2O7、铁的氢氧化物制备:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4Δ点燃高温高温FeCl 3+3NaOH=Fe (OH )3↓+3NaCl 8、转化:4Fe (OH )2+O 2+2H 2O =4Fe (OH )3 9、受热分解:2Fe (OH )3=Fe 2O 3+3H 2O 10、Fe 3+的检验:Fe 3++3SCN -=Fe(SCN)3(血红色)11、氧化性:2Fe 3++Fe =3Fe 2+ 2Fe 3++Cu =2Fe 2++Cu 2+12、还原性:2Fe 2++Cl2=2Fe 3++2Cl -四、硅及其化合物1、硅与氧气、氟、氯气、碳反应:Si+O 2=SiO 2 Si+2F 2=SiF 4 Si+2Cl 2=SiCl 4 Si+C =SiC2、硅与氢氟酸、氢氧化钠反应: Si+4HF =SiF 4↑+2H 2↑Si+2NaOH+H 2O =Na 2SiO 3+2H 2↑3、二氧化硅与氢氟酸反应:SiO 2+4HF=SiF 4↑+2H 2O 4、二氧化硅与碱性氧化物反应:SiO 2+CaO =CaSiO 35、二氧化硅与碱反应:SiO 2+2=Na 2SiO 3+H 2O 6、二氧化硅与碳反应:SiO 2+2C =Si+2CO ↑ΔΔ高温高温高温 高温7、二氧化硅与碳酸钠、碳酸钙反应: SiO 2+Na 2CO 3=Na 2SiO 3+CO 2↑SiO 2+CaCO 3=CaSiO 3+CO 2↑8、硅酸和氢氧化钠反应:H 2SiO 3+2NaOH=Na 2SiO 3+2H 2O9、硅酸受热分解:H 2SiO 3=SiO 2+H 2O10、硅酸钠与酸反应:Na 2SiO 3+2HCl =2NaCl+H 2SiO 3(胶体) Na 2SiO 3+H 2O+CO 2=H 2SiO 3(胶体)+Na 2CO 3 Na 2SiO 3+2H 2O+2CO 2=H 2SiO 3(胶体)+2NaHCO 3 五、氯1、氯气与金属反应:Cl 2+2Na=2NaCl Cl 2+Cu =CuCl 23Cl 2+2Fe =2FeCl 32、氯气与非金属反应:Cl 2+H 2=2HCl3、氯气、氟与水的反应:Cl 2+H 2O =HCl+HClO2HClO =2HCl+O 2↑2F 2+2H 2O =4H F +O 2高温Δ 高温点燃点燃 点燃 点燃 光照4、氯气与碱反应:Cl2+2NaOH=NaCl+NaClO+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 5、漂白液、漂白粉、漂白精长期露置空气中会发生反应:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO2NaClO+H2O+CO2=Na2CO3+2HClO光照2HClO=2HCl+O2↑6、氯离子检验:先在被检验液中加稀硝酸酸化,再加硝酸银溶液,如产生白色沉淀可判断原溶液中含氯离子Ag++Cl-=AgCl↓7、卤素单质间置换:Cl2+2Br-=2Cl-+Br2Cl2+2I-=2Cl-+I2Br2+2I-=2Br-+I2六、硫和氮二氧化硫和水反应:SO2+H2O=H2SO31、二氧化硫和氧化钙反应:SO2+CaO=CaSO32、二氧化硫和氢氧化钠反应:SO2(少)+2NaOH=Na2SO3+H2O 3、SO2(过)+NaOH=NaHSO34、二氧化硫和盐反应SO2(少)+2NaHCO3=Na2SO3+H2O+2CO2SO2(过)+NaHCO3=NaHSO3+CO25、二氧化硫和硫化氢反应:SO2+2H2S=3S↓+2H2O6、二氧化硫和卤素单质水溶液反应:SO 2+X 2+2H 2O=H 2SO 4+2HX(X=Cl 、Br 、I,F 除外)7、二氧化硫能被氧气氧化:2SO 2+O 2=2SO 38、三氧化硫与水、碱、碱性氧化物反应:SO 3+H 2O=H 2SO 4 SO 3+CaO=CaSO 4 SO 3+NaOH=Na 2SO 4 9 、氮气和氧气反应:N 2+O 2=2NO10、一氧化氮与氧气反应:2NO+O 2=2NO 211、二氧化氮与水反应:3NO 2+H 2O=3HNO 3+NO12、氮的氧化物溶于水的有关计算:3NO 2+H 2O=3HNO 3+NO2NO+O 2=2NO 24NO 2+O 2+2H 2O=4HNO 34NO+3O 2+2H 2O=4HNO 3七、氨硝酸硫酸1、氨:N2+3H2=2NH3(反应条件是高温高压和催化剂)2、氨与水的反应 NH3+H 2O =NH3•H 2O (可逆)3、氨水不稳定:NH3•H 2O =NH3↑+H 2O4、氨与HCl 等酸的反应NH 3+HCl =NH 4Cl2NH 3+H 2SO 4=(NH 4)2SO 4 P 2O 5Δ 放电或高压ΔNH3+HNO3=NH4NO3NH3+H2O+CO2=NH4HCO35铵盐受热分解:ΔΔNH4Cl=NH 3↑+HCl↑NH4HCO3=NH3↑+H2O↑+CO2↑6氨的催化氧化:4NH3+5O24NO+6H2O(条件是催化剂和加热)Δ7氨的制法:2NH4Cl+Ca(OH)2=CaC l2+2NH3↑+2H2O。
非金属元素及其化合物方程式

非金属及其化合物方程式归纳(接上次金属及其化合物)V、碳族元素(IVA)(碳硅及其化合物)(一)碳及其化合物1、C与O2:完全燃烧:C+O2CO2 不完全燃烧:C+O2CO2、3C+Fe2O32Fe+3CO↑、2C+SiO2Si+2CO↑、C+H2OCO+H2(制水煤气)3、C+2H2SO4(浓)CO2↑+2SO2↑+2H2O 、C+4HNO3(浓)CO2↑+4NO2↑+2H2O4、2CO+O2 2CO2 、CO+CuOCu+CO2 、3CO+Fe2O32Fe+3CO25、CO的实验室制备:HCOOHCO↑+H2O6、CO2+H2OH2CO3 、 CO2+CaO=CaCO3 、CO2+Ca(OH)2=CaCO3↓+H2O7、CO2+C2CO 、2Mg+CO22MgO+C8、Na2CO3+CO2+H2O=2NaHCO3、CaCO3+CO2+H2O=Ca(HCO3)2、Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO9、CO2的工业和实验室制备:CaCO3CaO+CO2↑CaCO3+2HCl=CaCl2+CO2↑+H2O 离子方程式:CaCO3+2H+=Ca2++CO2↑+H2O(二)硅的化学性质:1、硅与非金属:Si+O2SiO2 、Si+2F2=SiF4 、 Si+2Cl2SiCl42、硅单质与氢氟酸:Si+4HF=SiF4↑+2H2 ↑3、Si与强碱溶液:Si+2NaOH+H2O=Na2SiO3+2H2↑离子方程式:Si+2OH —+HO=SiO32-+2H2↑24. Si的制备:SiO2+2CSi+2CO↑(二)二氧化硅的化学性质:1. SiO2(酸性氧化物):a.与碱性氧化物:SiO2+CaOCaSiO3b.SiO2与碱溶液:SiO2+2NaOH=Na2SiO3+H2O离子方程式:SiO2+2OH-=SiO32-+H2O2. SiO2与氢氟酸:SiO2+4HF=SiF4↑+2H2O3. SiO2与碳反应:SiO2 + 2CSi + 2CO↑4.工业生产玻璃:SiO2+Na2CO3Na2SiO3+CO2↑、SiO2+CaCO3CaSiO3+CO2↑(三)硅酸、硅酸盐:1. H2SiO3+2NaOH=Na2SiO3+ H2O2.硅酸分解:H2SiO3SiO2+H2O3.硅酸盐制硅酸:Na2SiO3+2HCl=H2SiO3↓+2NaCl 离子方程式:SiO32-+2H+=HSiO3↓2往硅酸钠溶液中通入二氧化碳:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3 4.由SiO2制备硅酸:SiO2+2NaOH=Na2SiO3 +H2O 、 Na2SiO3+CO2 +H2O=Na2CO3+H2SiO3↓VI、氮族元素(VA)(氮及其化合物)(一)氮及氮的氧化物1.氮气和非金属:N2+O2 2NO(无色) 、N2 + 3H22NH3 (无色)放电2.氮气与金属:N2+3Mg Mg3N23.一氧化氮与氧气反应:2NO+O2=2NO2 (红综色)4.NO2溶于水: 3NO2 + H2O = 2HNO3 + NO5. 氮的氧化物和氧气溶于水:4NO+2H2O+3O2=4HNO3、4NO2+2H2O+O2=4HNO36. 相互转化:2NO2N2O47.氮的氧化物的尾气吸收:2NO2+2NaOH=NaNO3+NaNO2+H2O、NO2+NO+2NaOH=2NaNO2+H2O(二)氨气1.氨气溶于水:NH3 + H2ONH3·H2O氨水显弱碱性(电离方程式):NH3·H2ONH4++OH-2.浓氨水受热分解NH3·H2ONH3↑+H2O3.氨气和酸:HCl + NH3= NH4Cl(白烟)、NH3+ HNO3=NH4NO3、2NH3+H2SO4=(NH4)2SO44.氨的催化氧化 4NH3+5O24NO+6H2O5.氨水与弱碱阳离子(Mg2+、Al3+、Fe3+、Fe2+、Cu2+、Ag+等)生成沉淀: Fe3++3NH3·H2O=Fe(OH)3+3NH4+6.氨气的检验方法:a.将湿润的红色石蕊试纸伸入容器内,若试纸变蓝则证明该气体为氨气。
非金属部分化学方程式总结

非金属部分化学方程式一、氯气制备氯气:4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O4H++2Cl–+MnO2Mn2++Cl2↑+2H2O(16HCl+2KMnO4===2KCl+2MnCl2+5Cl2↑+8H2O16 H++10Cl-+2MnO4–=2Mn2++5Cl2↑+8H2O6HCl+KClO3==KCl+3Cl2↑+3H2O6H++5Cl–+ClO3–=3Cl2↑+3H2O)Cl2+2Na2NaCl 3Cl2+2Fe2FeCl3Cl2+Cu CuCl2Cl2+H22HCl (将H2在Cl2点燃;混合点燃、加热、光照发生爆炸)3Cl2+2P2PCl3Cl2+PCl3PCl5Cl2+2FeCl2===2FeCl3(在水溶液中:Cl2+2Fe2+===2Fe3++3Cl-)Cl2+2NaBr===2NaCl+Br2Cl2+2Br-=2Cl-+Br2Cl2+2KI===2KCl+I2Cl2+2I-=2Cl-+I2Cl2+H2O==HCl+HClO(加碱或光照促进歧化:(Cl2+H2O H++Cl–+HClO)2HClO2HCl+O2↑(保存在棕色瓶中)Cl2+2NaOH==NaCl+NaClO+H2O (Cl2+2OH–=Cl–+ClO–+H2O)Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O (Cl2+2OH–=Cl–+ClO–+H2O)二、硫及其化合物S+Fe FeS (既能由单质制取,又能由离子制取)S+2Cu Cu2S (只能由单质制取,不能由离子制取)3S+2Al Al2S3 (只能由单质制取,不能由离子制取)S+H2H2S S+O2SO2SO2+H2O H2SO3SO2+Ca(OH)2===CaSO3↓+H2O (不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别) Na2CO3+SO2==Na2SO3+CO2(1:1)CO32-+SO2=SO32-+CO2NaHCO3+SO2===NaHSO3+CO2(CO2中的SO2可用NaHCO3洗气)2HCO3-+SO2=2HSO3-+CO22NaHCO3+SO2==Na2SO3+2CO2+H2O2HCO3-+SO2=SO32-+2CO2+H2O2SO2+O2催化剂加热2SO3SO2+Cl2+2H2O===H2SO4+2HCl Cl2+SO2+2H2O=4H++SO42–+2Cl–SO2+Br2+2H2O===H2SO4+2HBr Br2+SO2+2H2O=4H++SO42–+2Br–SO2+2H2S===3S↓+2H2OSO3+H2O===H2SO4Cu +2H2SO4(浓)CuSO4+SO2↑+2H2O2H2SO4(浓)+C CO2↑+2SO2↑+2H2O2H2SO4(浓)+S3SO2↑+2H2O浓H2SO4+Fe(Al)室温下钝化6H2SO4(浓)+2Fe Fe2(SO4)3+3SO2↑+6H2OH2SO4(稀)+Fe===FeSO4+H2↑2H++Fe=Fe2++H2↑Ba(OH)2+H2SO4==BaSO4↓+2H2O2H++2OH–+Ba2++SO42–=BaSO4↓2H2O三、氮及其化合物NH3+H2O NH3·H2ON2+3H2催化剂高温高压2NH34NH3+5O2催化剂△4NO+6H2O4NH3+6NO===5N2+6H2O (用氨清除NO)NH3+HNO3===NH4NO3NH3+H+=NH4+2NH3+H2SO4===(NH4)2SO4NH3+H+=NH4+Ca(OH)2+2NH4Cl2CaCl2+2NH3↑+2H2O (实验室制NH3)NaOH+NH4Cl NaCl+NH3↑+H2ONH4Cl NH3↑+HCl↑NH4HCO3NH3↑+H2O+CO2↑N2+O2 2NO2NO+O2====2NO23NO2+H2O===2HNO3+NO (NO2不是硝酸的酸酐)Cu +4HNO3(浓) ==Cu(NO3)2↑+2NO2↑+2H2O3Cu +8HNO3(浓) ==3Cu(NO3)2↑+2NO↑+4H2O4HNO3(浓)+C CO2↑+4NO2↑+2H2O4HNO34NO2↑+O2↑+2H2O (保存在棕色瓶中)四、碳和硅2C+SiO2Si+2CO(制得粗硅)3C+SiO2SiC+2CO↑Si(粗)+2Cl2SiCl4(SiCl4+2H2===Si(纯)+4HCl)Si+O2SiO2Si+2NaOH+H2O==Na2SiO3+2H2↑(Si+2OH-+H2O=-23SiO+2H2↑) 4HF+SiO2===SiF4+2H2O(可测定矿样或钢样中SiO2的含量,玻璃雕刻)4HF+Si===SiF4+2H2↑SiO2+CaO CaSiO3 (炼钢造渣)SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3Na2SiO3+CO2 (制取玻璃)SiO2+CaCO3CaSiO3+CO2(制取玻璃)Na2SiO3+2HCl===H2SiO3↓+NaCl 或Na2SiO3+2HCl+H2O===H4SiO4↓+2NaCl SiO32-+2H+=H2SiO3↓或SiO32-+2H++H2O=H4SiO4↓Na2SiO3+CO2+2H2O===H2SiO3↓+Na2CO3SiO32-+CO2+2H2O=H4SiO4↓+CO32-C+O2(足量)CO2 2C+O2(少量)2COC+CO22COCO2+2NaOH(过量)==Na2CO3+H2O 2OH-+CO2=CO32–+H2OCO2(过量)+NaOH==NaHCO3OH-+CO2=HCO3–CO2+Ca(OH)2(过量)==CaCO3↓+H2O Ca2++2OH+CO2=CaCO3↓+H2O 2CO2(过量)+Ca(OH)2==Ca(HCO3)2OH―+CO2=HCO3–CO2+CaCO3+H2O==Ca(HCO3)2CO2+CaCO3+H2O=Ca2++2HCO3–CO2(不足)+2NaAlO2+3H2O===2Al(OH)3↓+Na2CO3CO2+3H2O+AlO2–=Al(OH)3↓+CO32–CO2(足)+NaAlO2+2H2O===Al(OH)3↓+NaHCO3CO2+2H2O+AlO2–=Al(OH)3↓+HCO3–。
高中化学必修一非金属方程式

高中化学必修一非金属方程式TYYGROUP system office room 【TYYUA16H-TYY-TYYYUA8Q8-一、硅及其化合物(写出化学方程式,是离子反应的写离子方程式)1.硅与氢氟酸的反应 4HF+Si=SiF4↑+2H2↑2.硅与氢氧化钠溶液反应 Si+2NaOH+H2O =Na2SiO3+2H2↑(2OH-+ Si+H2O =SiO32–+2H2↑)3.硅与氟气反应 2F2+Si=SiF44.硅与氧气在加热条件下反应 O2+Si SiO25.二氧化硅与氢氟酸反应 4HF+SiO2=SiF4↑+2H2O6.二氧化硅与氢氧化钠溶液反应 SiO2+2NaOH=Na2SiO3+H2O (2OH-+SiO2=SiO32–+H2O)7.二氧化硅与氧化钙反应 SiO2+CaO=====高温CaSiO38.工业制备纯硅的过程2C+SiO2=====高温Si(粗)+2CO Si(粗)+2Cl2=====高温SiCl4SiCl4+2H2=====高温Si(纯)+4HCl9.碳酸钙与二氧化硅在高温下反应 CaCO3+SiO2=====高温CaSiO3+CO2↑10.碳酸钠与二氧化硅在高温下反应 Na2CO3+SiO2=====高温Na2SiO3+CO2↑11.硅酸钠溶液中通入少量的二氧化碳气体 Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3(SiO32-+CO2+H2O=H2SiO3↓+CO32-)12.硅酸钠溶液中通入过量的二氧化碳气体 Na2SiO3+2CO2+2H2O=H2SiO3↓+2NaHCO3(SiO32-+2CO2+2H2O= H2SiO3↓+HCO3-)13.硅酸受热分解 H2SiO3SiO2+H2O二、卤素及其化合物(写出化学方程式,是离子反应的写离子方程式)1.碘单质与铁粉反应 I2+Fe FeI22.氯气与铜反应 Cl2+Cu CuCl23.氯气与钠反应 Cl2+Na NaCl4. 将Cl2通入NaBr溶液中方程式Cl2+2NaBr=2NaCl+Br2(Cl2+2Br-=2Cl-+Br2),再加入苯,其现象为溶液分层有机层变为橙红色5.将Cl2通入淀粉-KI溶液中方程式 Cl2+2KI=2KCl+I2(Cl2+2I-=2Cl-+I2),现象为淀粉溶液变蓝6.氯气与水反应 Cl2+H2O HCl+HClO (Cl2+H2O H++Cl–+HClO)7.氯气与氢氧化钠溶液反应 Cl2+2NaOH=NaCl+NaClO+H2O ( Cl2+2OH–=Cl–+ClO–+H2O)8.次氯酸见光分解 2HClO2HCl+O2↑ (2HClO2H++2Cl-+O2↑)9.向漂白粉溶液中通入少量CO2气体: Ca(ClO)2+CO2+H2O= 2HClO +CaCO3↓ (Ca2++2ClO-+CO2+H2O=2 HClO + CaCO3↓ )10.将氯水与硝酸银溶液混合的离子方程式 Cl-+Ag+=AgCl↓二、卤素及其化合物(写出化学方程式,是离子反应的写离子方程式)1. 红磷在氯气中燃烧 3Cl2+2P2PCl3Cl2+PCl3PCl52.氢气在氯气中燃烧 Cl2+H22HCl3.氯气与铁粉反应 3Cl2+2Fe2FeCl34.向碘化钾溶液中加入溴水 Br2+2KI =2KBr+I2(Br2+2I- =2Br-+I2)5.氟气通入水中2F2+2H2O =4HF+O26. 将氯气通入石灰乳(工业制漂白粉) 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(2Cl2+2 Ca(OH)2=2 Ca2++2Cl–+2ClO–+2H2O)7.漂白粉露置空气中失效 Ca(ClO)2+CO2+H2O= 2HClO +CaCO3↓ 2HClO2HCl+O2↑8.向漂白粉溶液中通入过量CO2气体: Ca(ClO)2+2CO2+2H2O= 2HClO +Ca(HCO3)2(ClO-+CO2+H2O= HClO + HCO3- )9.将氯水与氯化亚铁溶液混合的离子方程式 Cl2+2Fe2+=2Fe3+2Cl-10. 实验室制备Cl2 4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O(4H++2Cl–+MnO2Mn2++Cl2↑+2H2O)三、硫及其化合物(写出化学方程式,是离子反应的写离子方程式)1.硫单质与氢气加热 S+H2H2S2.硫粉与铁粉混合加热 S+Fe FeS3.硫粉与铜粉混合加热 S+2Cu Cu2S4.硫单质在纯氧中点燃 S+O2SO25. S与热NaOH溶液的反应 3S+6NaOH2Na2S+Na2SO3+3H2O(3S+6OH-2S2-+SO32-+3H2O)6.二氧化硫气体通入水中 SO2+H2O H2SO37.三氧化硫溶于水 SO3+H2O=H2SO4(SO3+H2O=2H++SO42–)8.亚硫酸受热分解 H2SO3H2O+SO2↑9.碳酸钠溶液中通入过量的二氧化硫气体 Na2CO3+H2O+2SO2(足)=2NaHSO3+CO2(CO32-+H2O+2SO2=2HSO3-+CO2)10.碳酸钠溶液中通入少量的二氧化硫气体 2Na2CO3(足)+H2O+SO2=Na2SO3+2NaHCO3(2CO32-+H2O+SO2=SO32-+2HCO3-)11.二氧化硫与饱和碳酸氢钠溶液 2NaHCO3+SO2(少) = Na2SO3+ CO2+ H2O 2 HCO3-+SO2(少) = SO32-+ CO2+ H2O NaHCO3+SO2(过)= NaHSO3+CO2HCO3-+SO2(少) = HSO3-+CO212.少量二氧化硫通入氢氧化钠溶液 SO2 + 2NaOH= Na2SO3+ H2O SO2+ 2OH-= SO32- + H2O13.过量二氧化硫通入氢氧化钠溶液 SO 2 + NaOH= NaHSO 3 CO 2 + OH -= HSO 3- 三、硫及其化合物(写出化学方程式,是离子反应的写离子方程式) 1.二氧化硫催化氧化 2SO 2+O 2催化剂 加热2SO 32.二氧化硫与硫化氢混合 SO 2+2H 2S=3S↓+2H 2O3.二氧化硫与氧化钙在高温下反应 SO 2+ CaO CaSO 34.三氧化硫与氧化钙在高温下反应 SO 3+ CaOCaSO 45.二氧化硫气体通入澄清石灰水先变浑浊后变澄清 SO 2+Ca(OH)2=CaSO 3↓+H 2O CaSO 3+ SO 2 +H 2O=Ca(HSO 3)2 (SO 2+Ca 2++2OH -=CaSO 3↓+H 2O CaSO 3+ SO 2 +H 2O=Ca 2++2HSO 3-通入Br 2水中: Br 2+SO 2+2H 2O =2HBr+H 2SO 4 (Br 2+SO 2+2H 2O =4H ++2Br -+SO 42- ) 通入KMnO 4溶液中: 5SO 2+2KMnO 4+2H 2O=K 2SO 4+2MnSO 4+2H 2SO 4 (5SO 2+2MnO 4-+2H 2O=5SO 42-+2Mn 2++4H +)通入FeCl 3溶液中: SO 2+2FeCl 3+2H 2O=FeCl 2+FeSO 4+4HCl(SO 2+2Fe 3++2H 2O=2Fe 2++SO 42-+4H +)9.将H 2S 气体通入亚硫酸中: 2H 2S+H 2SO 3=3S↓+3H 2O 10. 将H 2SO 4、Na 2SO 3、Na 2S 三种溶液混合: 3H 2SO 4 +Na 2SO 3+2Na 2S=3Na 2SO 4+3S↓+3H 2O(6H + +SO 32-+2S 2-=3S↓+3H 2O ) 11.将少量NaHSO 4滴到Ba(OH)2溶液中: NaHSO 4+Ba(OH)2= BaSO 4↓+NaOH+ H 2O(H ++SO 42-+Ba 2++OH -= BaSO 4↓+ H 2O ) 12.将Ba(OH)2滴加到NaHSO 4溶液中至中性: 2NaHSO 4+Ba(OH)2= BaSO 4↓+2H 2O (2H ++SO 42-+Ba 2++2OH -= BaSO 4↓+2H 2O ) 四、氮及其化合物(写出化学方程式,是离子反应的写离子方程式) 1.工业合成氨反应 N 2+3H 2催化剂 高温高压2NH 32.氮气与氧气反应生成一氧化氮 N2+O22NO与O2的反应 2NO+O2=2NO2与H2O的反应 3NO2+H2O=2HNO3+NO5.二氧化氮与氧气混合气体通入水中生成硝酸 4NO2+O2+2H2O=4HNO36.一氧化氮与氧气混合气体通入水中生成硝酸 4NO+3O2+2H2O=4HNO37.二氧化氮与氢氧化钠溶液反应生亚硝酸盐和硝酸盐2NO2+2NaOH=NaNO2+NaNO3+H2O(2NO2+2OH-=NO2-+NO3-+H2O )8.氨气溶于水 NH3+H2O NH3·H2O9.氨的催化氧化 4NH3+5O2催化剂△4NO+6H2O10.氨气与氯化氢气体反应 NH3+HCl =NH4Cl11.实验室制氨气 Ca(OH)2+2NH4Cl2CaCl2+2NH3↑+2H2O12.浓氢氧化钠溶液与氯化铵溶液不加热反应 NaOH+NH4Cl=NaCl+NH3H2O(+4NH+OH-= NH3H2O)13.氨气与稀硝酸反应 NH3+HNO3=NH4NO3(NH3+H+=NH4+)14.氯化铵受热分解 NH4Cl NH3↑+HCl↑15.氢氧化钠溶液与硝酸铵溶液加热反应 NaOH+NH4NO3NaNO3+NH3↑+H2O(+4NH+OH- NH3↑+H2O)五、硝酸硫酸(写出化学方程式,是离子反应的写离子方程式)和浓H2SO4加热条件下的反应 2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O2.碳和浓H2SO4加热条件下反应 2H2SO4(浓)+C CO2↑+2SO2↑+2H2O3.铁和浓H2SO4加热条件下反应 6H2SO4(浓)+2Fe Fe2(SO4)3+3SO2↑+6H2O4.足量的浓硝酸与铁加热条件下反应 6HNO3(浓)+Fe Fe(NO3)3+3NO2↑+3H2O(6H++3NO3-+Fe Fe3++3NO2↑+3H2O)5.足量的稀硝酸与铁反应4HNO3(稀)+ Fe=Fe(NO3)3+NO↑+ 2H2O (4H++NO3-+Fe=Fe3++NO↑+2H2O)6.足量的铁与浓硝酸加热条件下反应 4HNO3(浓)+Fe=Fe(NO3)2+2NO2↑+2H2O(4H++2NO3-+Fe=Fe2++2NO2+2H2O)7.足量的铁与稀硝酸反应 8HNO3(稀)+3Fe=3Fe(NO3)2+2NO↑+4H2O(8H++2NO3-+3Fe=3Fe2++2NO↑+4H2O)8.实验室用铜和稀硝酸制取一氧化氮 8HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O(8H++2NO3-+3Cu=3Cu2++2NO↑+4H2O)9.实验室用铜和浓硝酸制取二氧化氮 4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H2O(4H++2NO3-+Cu=Cu2++2NO2↑+2H2O)10.铁红与稀硝酸反应 Fe2O3+6 HNO3=2Fe(NO3)3+3H2O (Fe2O3+6 H+=2Fe3++3H2O)11.氧化亚铁与稀硝酸反应 3FeO+10 HNO3=3Fe(NO3)3+NO↑+5H2O(3FeO+10H++ NO3-=3Fe3++NO↑+5H2O)12.磁性氧化铁与稀硝酸反应 3Fe3O4+28 HNO3=9Fe(NO3)3+NO↑+14H2O(3Fe3O4+28H++ NO3-=9Fe3++NO↑+14H2O)13.碳与浓硝酸反应 4HNO3(浓)+C CO2↑+4NO2↑+2H2O14.硝酸见光分解 4HNO34NO2↑+O2↑+2H2O。
非金属及其化合物的化学方程式总结

非金属及其化合物化学方程式汇总1.硅的化学性质:Si + O2 SiO2Si + 2NaOH + H2O === Na2SiO3 + 2 H2↑Si + 4HF === SiF4↑+ 2 H2↑2.二氧化硅的化学性质:①酸性氧化物的通性:SiO2+ 2NaOH == Na2SiO3+ H2O离子方程式SiO2+ CaO △CaSiO3②弱氧化性:SiO2+2C高温2CO+Si③与酸(只与氢氟酸)反应——腐蚀玻璃4HF+SiO2==SiF4↑+2H2O3.氯气的化学性质:2Fe+3Cl2点燃2FeCl3Cu+Cl2点燃CuCl2注意:Cl2的氧化性强,和可变价金属反应生成高价的金属氯化物!2Na+ Cl2点燃2NaClH2+ Cl2点燃2HClCl2+ H2O ==== HCl + HClO2HClO ==== 2HCl + O2↑离子方程式Cl2 + 2NaOH ===== NaCl + NaClO + H2O离子方程式Cl2 + 2Ca(OH)2 ===== CaCl2 + Ca(ClO)2 + H2O离子方程式Ca(ClO)2+2HCl==CaCl2+2HClO离子方程式注意:①Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO②2HClO==2HCl +O2↑③Ca(ClO)2+2HCl==CaCl2+2HClO①漂白原理;①②在空气中变质;③工业上应用4.卤素的性质:①与氢气反应:H2+F2==2HFH2+ Cl2点燃2HClH2+ Br2加热2H BrH2+ I2加热2HI②与水反应:2H2O+2F2==4HF+O2Cl2+ H2OHCl + HClO离子方程式Br2+ H2OHBr+ HBrO离子方程式I2+ H2OHI + HIO离子方程式③与碱反应:Cl2 + 2NaOH ===== NaCl + NaClO + H2O离子方程式Br2+ 2NaOH ===== NaBr + NaBrO + H2O离子方程式I2 + 2NaOH ===== NaI+ NaIO + H2O离子方程式④置换反应:Cl2 + 2NaBr===== 2NaCl + Br2离子方程式Cl2 + 2NaI===== 2NaCl + I2离子方程式Br2 + 2NaI===== 2NaBr + I2离子方程式5.硫的化学性质:①还原性:S+O2点燃SO2②氧化性:S+H2△H2S2Cu+S △Cu2SFe+S △FeS注意:S 的氧化性较弱,和可变价金属反应生成低价的金属硫化物! 2Na+ S == 2Na 2S ③3S+6NaOH△2Na 2S+Na 2SO 3+3H 2O离子方程式 ④硫的特性:S+2Hg==HgS (用硫粉除去洒落的Hg 珠) 2Ag+S 错误!未找到引用源。
超详细的人教版必修一化学第四章非金属及其化合物化学方程式总结

第四章非金属及其化合物方程式总结---------- 加粗的是对应的离子方程式一、硅及其化合物1、硅单质物理性质:有金属光泽的灰黑色固体,熔点高,硬度大,质地脆,导电性介于导体和绝缘体之间。
化学性质:常温下化学性质稳定硅的复原性:Si(粉)+O 2 SiO2粗硅的制取:2C+SiO 2 Si+2CO( 制得粗硅)粗硅的提纯:Si( 粗)+2Cl 2 SiCl 4 SiCl 4+2H2=Si(纯)+4HCl硅与强碱的反响:Si+2NaOH+H 2O =Na 2SiO3+2H 2↑2OH -+ Si+H 2O =SiO 32–+H2↑硅与氢氟酸反响:4HF+Si=SiF 4↑+2H2↑硅的用途:硅可制造集成路、电子芯片、太阳能电池板等。
2、二氧化硅及硅酸存在:结晶形和无定形。
通称硅石。
性质:化学性质稳定,除氢氟酸外,一般不与其他酸反响,可以与强碱、碱性氧化物发生反响,属酸性氧化物。
用途:SiO2 是光导纤维的主要原料,以SiO2 为主要原料的物质大多都有石英某某、水晶某某;玛瑙某某。
①Si(粉)+O 2 SiO2②与碱性氧化物反响:SiO2+CaO CaSiO 3③与碱的反响:SiO2+2NaOH=Na 2SiO3+H 2O OH④硅酸盐与酸生成硅酸的反响:- 2–+SiO2=SiO3 +H 2ONa2SiO3+2HCl=H 2SiO3(胶体)+2NaCl SiO32-+2H +=H 2SiO3(胶体)2- 2-Na2SiO3+CO 2+H 2O=H 2SiO3↓+Na2CO 3 SiO3 +CO 2+H 2O=H 2SiO3↓+CO3⑤与氢氟酸反响:SiO2+4HF =SiF 4↑+2H2O硅酸易受热分解:H2SiO3 SiO2↓+H2O3、硅酸盐:硅酸盐是由硅、氧和金属组成的化合物的总称,在自然界分布极广,种类极多,是一类构造复杂的固体物质,大多不溶于水,化学性质很稳定。
硅酸钠:〔最简单的硅酸盐〕可溶于水,其水溶液俗称水玻璃,可做粘合剂和防火剂,是制备硅胶和木材防火剂等的原料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
SiSi+O 2高温SiO 2Si+2Cl 2高温SiCl 42C+SiO 2高温Si+2COSiCl 4+2H 2高温Si+4HCl SiHCl 3+H 2高温Si+3HClSi+4HF== SiF 4↑+2H 2↑Si+2F 2 == SiF 4SiO 2+CaO高温CaSiO 3SiO 2+CaCO 3高温CaSiO 3+CO 2↑SiO 2+4HF===SiF 4↑+2H 2O SiO 2+Na 2CO 3高温Na 2SiO 3+CO 2↑化学方程式离子方程式Si+2NaOH+H 2O═══Na 2SiO 3+2H 2↑ Si+2OH -+H 2O══SiO 32-+2H 2↑ Na 2SiO 3+CO 2+H 2O ══H 2SiO 3↓+Na 2CO 3 SiO 32-+CO 2+H 2O══H 2SiO 3↓+CO 32- Na 2SiO 3+2CO 2+2H 2O ══H 2SiO 3↓+2NaHCO 3SiO 32-+2CO 2+2H 2O══H 2SiO 3↓+2HCO 3-Na 2SiO 3+2HCl ═══H 2SiO 3↓+2NaCl SiO 32-+2H +══H 2SiO 3↓SiO 2+2NaOH == Na 2SiO 3+H 2OSiO 2+2OH -=-SiO 32-+H 2OCl (包含少量Br 、I )Cu+Cl 2点燃CuCl 2 2Fe+3Cl 2点燃2FeCl 32Na+Cl 2点燃2NaClH 2+Cl 2点燃2HCl2HClO2HCl+O 2Br 2+H 2S ═══2HBr +S↓2Fe+3Br 2 == 2FeBr 3Fe+I 2△FeI 2离子还原性:Cl -<Br -<Fe 2+<I -<SO 2(SO 32-)<S 2- H 2SO 4(浓)+2HBr===2H 2O+SO 2+Br 2NaCl +H 2SO 4(浓)△NaHSO 4+HCl ↑化学方程式离子方程式Cl 2+H 2O == HCl+HClOCl 2+H 2O == H ++Cl -+HClO Cl 2+2NaOH == NaCl+NaClO+H 2O Cl 2+2OH - == Cl -+ClO -+H 2O 3Cl 2+6NaOH(浓)△5NaCl+NaClO 3+3H 2O3Cl 2+6OH -△5Cl -+ClO 3-+3H 2OCa(ClO)2+CO 2+H 2O == CaCO 3↓+2HClOCa 2++2ClO -+CO 2+H 2O == CaCO 3↓+2HClOCl 2+SO 2+2H 2O == H 2SO 4+2HCl Cl 2+SO 2+2H 2O == 4H ++SO 42-+2Cl -Cl 2+2NaBr == Br 2+2NaCl Cl 2+2Br - == Br 2+2Cl - Cl 2+2KI == 2KCl+I 2Cl 2+2I - == 2Cl -+I 2 2KI+2FeCl 3 == 2FeCl 2+2KCl+I 22I -+2Fe 3+ == 2Fe 2++I 2 Cl 2+2FeCl 2 == 2FeCl 3 Cl 2+2Fe 2+== 2Fe 3++2Cl - MnO 2+4HCl(浓)△MnCl 2+Cl 2↑+2H 2OMnO 2+4H ++2Cl -△Mn 2++Cl 2↑+2H 2OKClO 3+6HCl(浓) == KCl+3Cl 2↑+3H 2O ClO 3-+5Cl -+6H +== 3Cl 2↑+3H 2O NaClO+2HCl(浓) == NaCl+Cl 2↑+H 2OClO -+2H ++Cl -== Cl 2↑+H 2O2KMnO 4+16HCl(浓) == 2MnCl 2+2KCl+5Cl 2↑+8H 2O MnO 4—+10Cl —+16H +== 5Cl 2↑+8H 2O+2Mn 2+SS+Fe △FeS S+2Cu△Cu 2SS+O 2点燃SO 2S+6HNO 3(浓)△H 2SO 4+6NO 2↑+2H 2OS + 2H 2SO 4(浓)△3SO 2↑+2H 2OSO 2 + 2H 2S =3S ↓+2H 2O2SO2+O22SO32SO2+O2+2H2O=2H2SO4 SO3+H2O=H2SO4SO2+Na2O2==Na2SO42Al+6H2SO4(浓)△Al2(SO4)3+3SO2↑+6H2O 2H2SO4(浓)+C△CO2↑+2SO2↑+2H2O2H2SO4(浓)+Cu △CuSO4+SO2↑+2H2O H2SO4(浓)+2HBr == SO2+Br2+2H2OH2SO4(浓)+NaCl △NaHSO4+HCl↑3H2SO4(浓)+Ca3(PO4)2=3CaSO4+2H3PO4化学方程式离子方程式3S+6NaOH(浓)△2Na2S+Na2SO3+3H2O 3S + 6OH-△2S2- + SO32- + 3H2OSO2+Cl2+2H2O=H2SO4+2HCl SO2 + Cl2 + 2H2O == 2Cl- + 4H+ + SO42-少量Na2S:Na2S + 2FeCl3 == 2FeCl2 +2NaCl +S↓S2- + 2Fe3+ == 2Fe2++ S↓过量Na2S:3Na2S + 2FeCl3 == 2FeS↓+S↓+6NaCl 3S2- + 2Fe3+ == 2FeS↓+ S↓少量SO2:SO2+2NH3•H2O == (NH4)2SO3+H2O SO2+2NH3•H2O == 2NH4++SO32-+H2O 过量SO2:SO2+NH3•H2O == NH4HSO3SO2+NH3•H2O == NH4++HSO3-SO2 + 2FeCl3 + 2H2O == 2FeCl2 + H2SO4 +2HCl SO2 + 2Fe3+ + 2H2O == 2Fe2+ + SO42- + 4H+ SO2 + H2O2== H2SO4SO2 + H2O2== 2H+ + SO42-3SO2 + 3Ba(NO3)2 + 2H2O == 3BaSO4↓+ 2NO↑ + 4H NO33SO2 + 2NO3- + 2H2O == 3BaSO4↓+ 2NO↑ + 4H+少量:KH SO4+ Ba(OH)2== BaSO4↓+ KOH+ H2O SO42- + H+ + Ba2+ + OH-== BaSO4↓+ H2O过量:2KH SO4+ Ba(OH)2== BaSO4↓+ K2SO4+ 2H2O SO42- + 2H+ + Ba2+ + 2OH- == BaSO4↓+ 2H2O 5SO2 + 2KMnO4 + 2H2O == 2MnSO4 + K2SO4+2H2SO45SO2 + 2MnO4- + 2H2O == 2Mn2+ + 5SO42- + 4H+ NN2+3H2催化剂高温高压2NH3N2+O22NON2+3Mg点燃Mg3N26NO + 4NH3催化剂△5N2 + 6H2O 2NO+O2 == 2NO23NO2+H2O == 2HNO3+NONO+NO2+2NaOH == 2NaNO2+H2O2NO2+2NaOH == NaNO3+NaNO2+H2O2NH3+3CuO △3Cu+N2+3H2O4NH3+6NO催化剂△5N2+6H2ONH3+HCl == NH4Cl 2NH3+H2SO4 == (NH4)2SO48NH3+3Cl2=N2+6NH4Cl NH3 + H2O NH3·H2O NH4+ + OH-NH3·H2O △NH3↑+H2O 4NH3+3O2点燃2N2+6H2O (在纯氧中燃烧)NH4HCO3△NH3↑+H2O+CO2↑2NH4Cl + Ca(OH)2△CaCl2 + 2NH3↑+ 2H2ONH4Cl + NaOH △NaCl + NH3↑+ H2O 2NH4NO3△2N2↑+ O2↑+ 4H2O4HNO3(浓)+C △CO2↑+4NO2↑+2H2O 2HNO3+CaCO3 == Ca(NO3)2+H2O+CO2↑NH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl(侯氏制碱法的基本原理,利用NaHCO3溶解度小,析出晶体)化学方程式离子方程式NH4 NO3 + NaOH == Na NO3 + NH3·H2O NH4+ + OH- ==NH3·H2ONH4 NO3 + NaOH △Na NO3 + NH3↑+ H2O NH4+ + OH-△NH3↑+H2OAl+4HNO3(稀) == Al(NO3)3+NO↑+2H2O Al+4H++NO3- == Al3++NO↑+2H2O Fe+4HNO3(稀) == Fe(NO3)3+NO↑+2H2O Fe+4H++NO3- == Fe3++NO↑+2H2O6HNO3(浓)+Fe △Fe(NO3)3+3NO2↑+3H2O Fe+3NO3-+6H+△Fe3++3NO2↑+3H2O3H2S+2HNO3(稀) == 3S↓+2NO+4H2O 3H2S+2H++NO3- ==3S↓+2NO+4H2O3FeO+10HNO3(稀) == 3Fe(NO3)3+NO↑+5H2O NO3- + 3FeO + 10H+ == 3Fe3++ NO↑ + 5H2O FeO+4HNO3(浓) == Fe(NO3)3+NO2↑+2H2O NO3- + FeO + 4H+ == Fe3+ + NO2↑ + 2H2O。
