举例说明保护基团的作用
第五章保护基团

锂化合物的全部反应。反应完毕,l,3-二噻环己烷化合物可在
高汞离子存在下用酸水解,变为羰基化合物。
43
例3 合成
44
例4 合成
45
例5 合成
46
5.5 羧基常用的保护
形成羧酸酯的形式被保护,
常用甲酯、乙酯、叔丁酯或苄酯。
叔丁酯用酸除去,苄酯用氢解法除去。 还可用酰胺和酰肼来保护羧基 。
甲酯和乙酯可以用羧酸直接与甲醇或乙醇发生酯化反应制得,又 可以被碱水解。 叔丁酯可由羧酸先变为酰氯,再与叔丁醇作用,或者通过羧酸与 异丁烯直接作用而得。它不能氢解,在通常条件下也不被氨解及 碱催化水解 。 苯甲酯可由羧酸与苯甲基卤在碱性条件下反应而得。它除了可在 强酸性或碱性条件下水解,还可以被氢解 。
2-叔丁氧羰基氧亚胺基苯乙腈
N O O N
23
O
NH2 COOH
Boc 2O NaOH, t -BuOH, H 2 O 78%
NH2.HCl HO COOMe
Boc2 O Et3 N 95% HO
NHB
C
H N Boc 2O HN O DMAP, Et N
24
B
N Boc
N
常用脱保护剂:三氟乙酸/CH2Cl2、HF/H2O
25
2、苄氧羰基(Cbz或Z) • 常用保护试剂:苄氧甲酰氯(CbzCl) • 常用脱保护剂:催化氢解、锂氨还原
26
27
3、 9-芴甲氧基羰基(Fmoc):常用于多肽合成 常用保护试剂:Fmoc-Cl(9-fluorenylmethoxycarbonyl-Cl) 常用脱保护剂:NH3, Et2NH(DEA), 哌啶(六氢吡啶) ,吗啡啉
11
5.1.3 生成烷基醚保护基
有机合成课件保护基团

要点二
详细描述
在有机合成中,酮是一种常见的反应物和产物,但它的羰 基容易受到氧化和还原等反应的影响。为了保护酮的羰基 ,可以使用各种保护基团,如甲氧羰基、乙氧羰基、丙氧 羰基等。这些保护基团可以与酮形成稳定的化学键,从而 避免酮参与不必要的反应。
THANKS
谢谢
详细描述
在有机合成中,羧酸是一种常见的反应物和产物,但它的羧基容易受到脱羧和氧化等反应的影响。为了保护羧酸 ,可以使用各种保护基团,如甲酯、乙酯、丙酯等。这些保护基团可以与羧酸形成稳定的化学键,从而避免羧酸 参与不必要的反应。
醛基保护基团的应用实例
总结词
醛基保护基团能够保护醛免受氧化和还原等反应的影响。
保护。
硅氧基
如三甲基硅氧基,常用 于醇的保护,易于脱去
。
磷酸酯基
如磷酸三乙酯、磷酸三 丁酯等,适用于醇的保
护,并可耐强酸。
氨基保护基团
乙酰基
常用于伯胺的保护。
苯磺酰基
适用于仲胺和叔胺的保护,可 在酸性条件下脱去。
甲磺酰基
适用于仲胺的保护,可在酸性 条件下脱去。
丙酮肟基
适用于伯胺的保护,可在酸性 条件下脱去。
羧基保护基团
甲酯基
常用于羧酸的保护,可在碱性条件下脱去。
苯甲酯基
适用于不活泼羧酸的保护,可在碱性条件下 脱去。
乙酯基
适用于羧酸的保护,可在碱性条件下脱去。
氨基甲酸酯基
适用于羧酸的保护,可在酸性或碱性条件下 脱去。
醛基保护基团
烯丙基
常用于醛的保护。
苯甲酰基
适用于醛的保护,可在酸性条件下脱 去。
乙酰基
亲核加成反应
在形成氮-保护基团时,通常发 生亲核加成反应,即试剂进攻有 机物中的硝基、磺酸酯等基团,
有机合成中的保护反应与去保护反应

有机合成中的保护反应与去保护反应有机合成是化学领域中的一个重要分支,广泛应用于药物合成、材料科学等领域。
在有机合成中,保护反应和去保护反应被广泛应用于有机化合物的构建与转化。
保护反应用于保护或掩蔽某些化学官能团,以防止其在反应过程中发生不期望的副反应,而去保护反应则是将保护基去除,还原其原有的化学性质。
本文将介绍有机合成中的保护反应与去保护反应的基本原理、常用的保护基和去保护方法,并阐述其应用的重要性。
一、保护反应的原理与常用保护基保护反应是在有机分子中引入保护基,以保护特定的化学官能团不被反应损伤或发生不期望的副反应。
保护基的引入可通过化学修饰或反应进行,常用的保护基有酯、醚、酮、酮醇、醚醚等。
这些保护基能够形成稳定的结构,避免官能团发生意外的反应。
下面将介绍几种常用的保护基及其原理。
1. 酯保护基:酯是较为常见的保护基之一,它可通过酸催化下的酯化反应引入。
酯保护基通常通过酸催化下的脱保护反应去除,恢复原有的官能团。
2. 醚保护基:醚保护基通常是通过醚化反应引入。
醚保护基可以通过酸或碱的催化下的脱保护反应去除。
3. 酮保护基:酮保护基通过酮化反应引入。
酮保护基的脱保护反应多数需要强酸或强碱的催化。
二、去保护反应的原理与常用方法去保护反应是将有机化合物中的保护基去除,还原其原有的化学性质。
常用的去保护反应方法有酸催化、酸加热、碱催化、金属还原等。
1. 酸催化:酸催化下的脱保护反应常用于酯、醚等保护基的去除。
酸催化下保护基的脱除可以通过加热或追加其他试剂实现。
2. 酸加热:有些保护基在酸性条件下通过加热即可脱除。
这种方法常用于有机分子中的酮保护基的去除。
3. 碱催化:碱催化下的去保护反应常用于醚、酮醇等保护基的脱除。
碱的选择要根据官能团的稳定性和反应条件来确定。
4. 金属还原:金属还原法是通过金属还原剂将有机分子中的保护基还原为相应的官能团。
这种方法可应用于一些特殊的保护基脱除,例如醛酮的去保护反应。
举例说明保护基团的作用
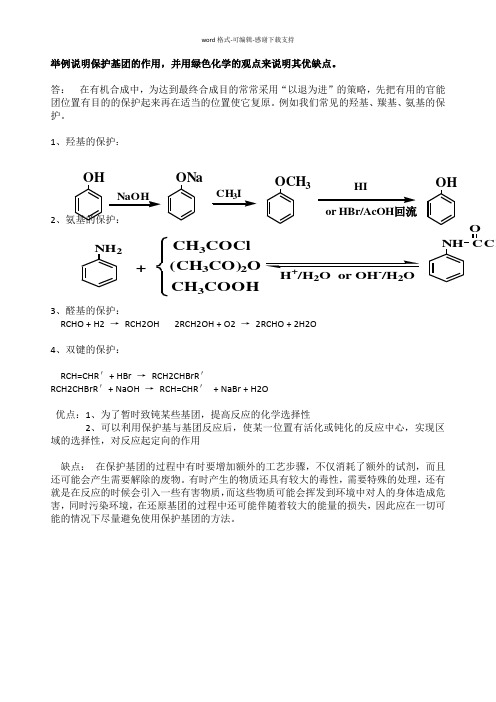
word 格式-可编辑-感谢下载支持
举例说明保护基团的作用,并用绿色化学的观点来说明其优缺点。
答: 在有机合成中,为达到最终合成目的常常采用“以退为进”的策略,先把有用的官能团位置有目的的保护起来再在适当的位置使它复原。
例如我们常见的羟基、羰基、氨基的保护。
1、羟基的保护:
2
、氨基的保护:
3、醛基的保护:
RCHO + H2 →
RCH2OH 2RCH2OH + O2 → 2RCHO + 2H2O
4、双键的保护:
RCH=CHR '+ HBr → RCH2CHBrR ' RCH2CHBrR '+ NaOH → RCH=CHR ' + NaBr + H2O
优点:1、为了暂时致钝某些基团,提高反应的化学选择性
2、可以利用保护基与基团反应后,使某一位置有活化或钝化的反应中心,实现区域的选择性,对反应起定向的作用
缺点: 在保护基团的过程中有时要增加额外的工艺步骤,不仅消耗了额外的试剂,而且还可能会产生需要解除的废物。
有时产生的物质还具有较大的毒性,需要特殊的处理,还有就是在反应的时候会引入一些有害物质,而这些物质可能会挥发到环境中对人的身体造成危害,同时污染环境,在还原基团的过程中还可能伴随着较大的能量的损失,因此应在一切可能的情况下尽量避免使用保护基团的方法。
NH 2+CH 3COCl (CH 3CO)2O CH 3COOH NH CCH
O H /H 2O or OH /H 2O OH ONa OCH 3HI or HBr/AcOH 回流OH。
有机合成基团保护

有机合成中基团保护的综述提要:有机基团的保护是有机合成中很重要的反应方法之一。
本文综述了基团保护的基本原理,从基团的结构和反应活性的角度, 对羟基、羰基和氨基的保护进行了分析并介绍了常用的保护方法, 阐明了基团保护在有机合成中的重要作用。
关键词:有机合成基团保护在有机合成中,对于含有多个官能团的化合物, 除特定部位或基团发生预期反应外, 还常常导致其他部位或基团发生变化, 结果不仅使得反应产物变得复杂, 而且有时还会导致所需反应的失败。
最理想的合成路线是希望只在所需要的部位上发生反应,而其它部位不受任何干扰,为了解决这一问题,常常采取保护基团的策略,将作用物分子中不希望反应的敏感部位如羟基、羰基、氨基等用合适的保护基团掩蔽起来,待反应完成后再恢复原来的基团,这种方法就是有机合成中的基团保护。
1 、基团保护与保护基所谓基团保护,就是在合成时先将要保护的基团反应掉,待条件适宜时,再将其复原。
基团保护一般采用基团保护基的方法, 即用保护试剂与被保护的基团发生反应, 使其在某一条件下失去反应活性, 从而使不希望发生的副反应不能进行或活性降低。
一般来说, 基团保护的目的是为了拉大主副反应的活性差距, 使希望发生的反应活性更高, 而使不希望发生的反应活性降低。
根据被保护基团的性质不同,需要采取不同的方法加以保护。
由于亲核试剂的活性取决于其富电子程度, 一些亲核试剂如氨基、羟基等的保护, 是围绕着降低其中心元素的电子云密度进行的。
对于典型的亲电试剂如羰基, 为了使其免受亲核试剂的进攻, 采取的措施是使羰基碳的电子云密度增加, 亲电活性降低。
有机合成若需要基团保护,须给两类信息:基团保护的反应;被保护基团的“还原”反应。
去保护基是在反应后, 选择合适的反应条件将保护基去除。
例如, 为了防止酚羟基被氧化, 常常是使它生成酚醚, 完成反应之后再与氢碘酸反应生产原来的酚。
基团保护需要选择使用合适的保护基。
从基团保护的角度考虑,理想的保护基标准为:(1) 在温和的条件下, 保护基容易有选择性地与被保护基团反应;(2) 保护基引入到被保护的基团上后, 其性质在保护阶段的各种反应条件下应该是稳定的, 能够防御其他试剂的“侵袭”, 在反应过程中不发生变化;(3) 保护基在完成保护任务之后, 在不破坏分子其他部位的条件下,保护基易于在温和条件下除去;(4) 保护基的引入和去除应操作简单, 收率要高;(5) 若需要对两个或两个以上的基团进行保护时, 在选择保护基时必须注意保护基团的引入和去除互不干扰。
第7章基团的保护

CH2Cl O OH 砒 啶 或 Ph 3CCl 苄醚 O CPh3 CH2
H2
/ Pd-C 催化氢 解
或 Na / C2H5OH
OH H2O, HOAc r. t. 易水解
三 苯甲醚
(5)叔丁基醚 叔 丁 基 醚 对 强 碱 性 条 件 稳 定, 但 可 以 为 烷 基 锂 和
Grignard 试 剂 在 较 高 温 度 下 进 攻 破 坏。 它 的 制 备 一 般 用
2、缩醛和缩酮衍生物
(1)四氢吡喃醚
O OH , TsO H O O 混合型缩醛结构 H2O , H+ OH
Et 2O
H+ O O
RO H RO H O
-H
+
RO
O
一元醇在TsOH存在下与二氢吡喃作用生成四氢吡喃醚。 对碱、格氏试剂、烷基锂、氢化铝锂、烃化剂和酰化剂均稳定。
缺点是:不能用于在酸性介质中进行反应。此外,若用于旋光性醇, 由于引入了一个新的手性中心,将导致生成非对映异构体的混合物, 分离困难,造成产率降低。然而它在室温条件下,即能进行催化水解。
O R R'
(MeO)3CH, MeOH InCl3(5mol%) Cyclohexane reflux HO(CH2)nOH InCl3(5mol%)
第二节 羟基的保护
①
RR'C-CH2CH2OH OH R'H + RCOCH2CH2OMgX
H2O
+
RCOCH2CH2OH + R'MgX
③ Na R''X ②
RCOCH2CH2OR''
④ R'MgX H3O
有机物官能团保护

保护基与被保护的官能团反应,起到“钝化”保护作用,反应后,保护基在温和条件下与外加修饰试剂反
和Ars—作磷酸的—oH保护基,可分别用py、I z和cucl
z
在温和条件下活化,形成活性反应中心。在毗啶作用下,氯甲基变成吡啶翁甲基吸电子基团,使苯氧基易离去,在特定位置上 形成反应活性中心这种方法已成功地用于舍成,并且使合成过程大大简化。例如利用此法可晟简便地合成胆碱—∞P。
RNHa・pheoeH2S02Cl
——*RNHs02cHtcoph塑竺望竖型兰:Q}
昶一二=NH
》勘eH。e。pn跫等哥虽NH
州/Ns。2eH2e。ph—I西南
4、c=c的保护
c=c双键易发生加成,氧化反应,在合成中有时需要保护。常用的保护方法有二卤代反应,一般是加溴, 还可以使c=c形成环氧化合物,脱保护基时可在乙酸中使用锌处理,使双键再生。
CH2~o卜{
eH20Cph
o
己H:-。H
咛!i璺曼!,6H:旬i
亡H2。cp秘
e15H3{8一cI
CH2一oCp魏3 CH—oCoCl 5H3{ eH2一oCpn3
6H2一。H戮7
墼器:慧c洲。,
eH,一oH
以上例子中两个羟基能够被选择性地保护反应和脱除,同样利用不同保护基可实现同时用于六羟基化合
加以掩蔽,待反应完成后,再恢复原来的基团,这就是官能团的保护。 官能团保护一般采用官能团保护基的策略,引入保护基后,当经过必须反应后,不得损坏其它官能团,反应选择性高,收 率要尽可能好,同时易被除去。随着有机合成的技术不断发展,保护基在合成中的作用除所谓只是暂时使之“钝化”外,还有 高选择性区域反应的保护基等。下面将这两类主要的保护基分别介绍:
有机化学试题库及答案

有机化学试题库及答案一、选择题1. 下列化合物中,哪一个是醇?A. 甲烷B. 乙醇C. 乙酸D. 甲酸答案:B2. 哪个反应是酯化反应?A. 醇与酸反应生成酯和水B. 醇与碱反应生成盐和水C. 醇与卤素反应生成卤代烃D. 醇与醇反应生成醚答案:A3. 以下哪个是芳香族化合物?A. 甲烷B. 乙炔C. 苯D. 丙烯答案:C4. 哪个是碳正离子的稳定化效应?A. 诱导效应B. 共轭效应C. 场效应D. 氢键效应答案:A5. 以下哪个是亲核取代反应?A. 卤代烃的水解B. 醇的脱水C. 醛的氧化D. 酯的水解答案:A二、填空题6. 芳香族化合物的特点是含有______个π电子的环状共轭系统。
答案:4n+27. 碳正离子的稳定性与其电荷分布有关,其中______位碳正离子最为稳定。
答案:叔8. 有机反应中,亲核试剂通常攻击底物的______原子。
答案:碳9. 碳链异构体是指具有相同分子式但______不同的化合物。
答案:碳链结构10. 有机化合物的命名通常遵循IUPAC规则,其中“醇”的后缀是______。
答案:-ol三、简答题11. 简述什么是SN1和SN2反应机制,并说明它们的主要区别。
答案:SN1反应是单分子亲核取代反应,反应过程中底物首先发生碳正离子的形成,然后亲核试剂攻击碳正离子形成产物。
SN2反应是双分子亲核取代反应,亲核试剂同时攻击底物的碳原子,导致底物的离去基团被取代。
主要区别在于SN1反应有碳正离子中间体,反应速率只与底物浓度有关;而SN2反应没有中间体,反应速率与底物和亲核试剂的浓度都有关。
12. 描述什么是共轭效应,并举例说明其在有机化学中的重要性。
答案:共轭效应是指在含有交替单双键的分子中,π电子可以在整个共轭系统中分布,从而降低分子的能量,增加稳定性。
例如,在丁二烯中,由于共轭效应,分子的能量比两个分开的乙烯分子的总和要低,这使得丁二烯比预期的更稳定。
四、计算题13. 某醇与足量的羧酸反应生成酯和水,已知醇的摩尔质量为46g/mol,羧酸的摩尔质量为60 g/mol,反应生成的酯的摩尔质量为106 g/mol。
举例说明蛋白质结构和功能的关系

举例说明蛋白质结构和功能的关系示例文章篇一:嘿,同学们!今天咱们来聊聊蛋白质这个超级神奇的东西,特别是它的结构和功能的关系。
你们想想看,蛋白质就像是一个个超级小战士,它们有着不同的样子和本领。
先来说说蛋白质的结构吧!就像我们盖房子,房子的结构决定了它能住多少人,能有多牢固。
蛋白质也有自己的“房子结构”。
有的蛋白质结构简单,就像一个小木屋,虽然简单但也能发挥作用。
比如一些小的激素蛋白质,它们结构不那么复杂,但是在我们身体里传递消息可厉害啦!这难道不神奇吗?还有的蛋白质结构复杂得像一座大城堡!它们由好多好多的部分组成,每一部分都有自己的任务。
就比如说血红蛋白,它就像一个运输大队,专门负责把氧气运送到身体的各个角落。
它的结构那么精妙,才能完成这么重要的任务呀!那蛋白质的结构怎么就决定了它的功能呢?这就好比不同的工具,锤子是用来敲钉子的,因为它的形状和材质适合敲;而剪刀是用来剪纸的,因为它的构造就是为了剪开东西。
蛋白质也是这样啊!如果蛋白质的结构不合适,就没法完成特定的功能。
比如说,酶这种蛋白质,它们的结构就像一把专门的钥匙,能打开特定的“锁”,也就是参与特定的化学反应。
如果这把“钥匙”变形了,还能打开那把“锁”吗?当然不能啦!再想想看,抗体蛋白就像是我们身体里的小卫士,它们的结构让它们能够准确地识别和抓住入侵的病菌。
要是结构变了,还能这么厉害地保护我们吗?所以说,蛋白质的结构和功能的关系,那可真是紧密得不得了!结构就像是蛋白质的“身份证”,决定了它们能做什么,能做得有多好。
总之,蛋白质的结构和功能相互依存,缺一不可。
只有合适的结构,才能让蛋白质在我们身体里发挥出神奇又重要的作用!同学们,现在你们是不是对蛋白质的结构和功能的关系更清楚啦?示例文章篇二:哎呀呀,蛋白质这个东西可神奇啦!你知道吗?蛋白质的结构就像是一座精心搭建的城堡,而它的功能就像是城堡里的各种设施和活动。
先来说说蛋白质的结构吧。
蛋白质就像一个复杂的拼图,由一个个小小的“拼图块”组成,这些“拼图块”就是氨基酸。
绿色化学答案

绿色化学答案【篇一:绿色化学习题与答案】lass=txt>1、绿色化学产生的时代背景是什么?答:长期以来,人们对传统化学不能有效的利用资源,无节制的消耗以及造成严重的环境污染进行了深入思考,制定了一系列的防治和预防污染的措施,但都不能从源头解决污染。
绿色化学正是在这大背景下应运而生。
2、简要概括绿色化学的基本内容?答:绿色化学的研究主要是围绕化学反应、原料、催化剂、溶剂和产品的绿色化来进行的。
它主要包括:化学反应的绿色化、原料的绿色化、溶剂的绿色化、催化剂的绿色化、产品的绿色化以及化工生产的绿色化。
3、叙述绿色化学与环境化学的异同点?答:不同点:环境化学是一门研究有害化学物质在环境介质中的存在、化学特性、行为和效应及其控制的化学原理和方法的科学;绿色化学是防止污染、产生较少的危险废物以及减少环境和人类健康的风险的环境友好化学品和过程的设计、制造和使用,目的是从源头减少污染,是一种理念、一种愿望。
相同点:两者都是减少有害化学物质对环境的污染,保护环境。
第二次作业冉力 201204430011、举例说明保护基团的作用,并用绿色化学的观点来说明其优缺点?答:例子保护基团是为了在实验中不使其它的基团发生改变,而只使特定基团或部位发生预期反应,这样就避免了实验的失败及反应产物的结构复杂化,防止危害其它物质的功效。
优点:保护基团能使反应朝着人们预想的方向前行,能有效的利用反应物原料,防止基团影响其他反应物和产物的功效。
缺点:在保护基团解除的过程中,保护物质就变成了废物,不仅消耗了额外的试剂,还产生了需要处理的废物,造成污染,这不符合绿色化学的要求。
第三次作业冉力 201204430011、举例说明分子筛催化剂的性能和催化特性?答:分子筛具有选择性吸附、高效吸附性能、离子交换性能和催化性能。
如沸石分子筛只允许直径比较小的分子通过,而且对水、氨气、二氧化碳等极性分子有很高的亲和力,是良好的催化剂和催化载体。
《保护基团》课件

本课件将为您介绍保护基团的概念及其在化学和生物领域中的重要性和应用。 让我们一起探索这个令人着迷的主题。
保护基团
在本节中,我们将介绍保护基团的定义和其在化学和生物领域中的应用。保 护基团是实现有机合成和生物学研究中成功的关键因素。
保护基团的方法
有机合成中的保护基团
了解有机合成中保护基团的定义和常见的保护基团,以及它们引入和去除的方法。
- Chen, T.; Wu, S.; Li, H. Applications of protecting groups in organic synthesis. Journal of Organic Chemistry, 2018.
- Zhang, L.; Wang, J.; Zhao, S. The role of protective groups in biomedical research. Nature Reviews Drug Discovery, 2019.
结论
通过本课件,我们了解了保护基团在化学和生物领域中的重要性和应用前景。 同时,我们还探讨了今后的研究方向以推动该领域的发展。Fra bibliotek参考文献
- Adams, J.; Dolfi, A.; Hartman, C.; McCoy, M. D.; Smaltz, J. Design and implementation of protected areas. Journal of Environmental Conservation, 2020.
生物学中的保护基团
探索生物大分子中的保护基团的功能和去除方法,以及它们在生物学研究中的重要性。
保护基团在化学及生物领域中的应用
化学合成中的应用
现代有机合成中的保护基

第 三 章
有 机 合 成 中 的 保 护 基
21
特 殊 的, 它 的 除 去 是 用 肼 在 甲 醇 或 乙 醇 中 进 行, 不 是 一 个 严 格 的 水 解 反 应。 它 的 机 理 大 致 是 肼 对 酰 胺 的 加 成 - 消 除, 最 后 的 净 结 果 是 置 换 出 游 离 的 氨 基。
第 三 章
有 机 合 成 中 的 保 护 基
20
围 绕 这 些 要 求 人 们 在 经 过 了 几 十 年 的 努 力 之 后, 今 天 仍 不 时 有 对 新 的 保 护 基 团 的 研 究 工 作 报 道, 为 有 机 合 成 提 供 更 加 巧 妙 的 手 段1, 2。 相 信 今 后 对 这 一 领 域 的 研 究 还 会 有 更 大 的 发 展。
3.2
保护基团的互不相干性原则
对 于 一 个 结 构 复 杂 的 分 子 的 合 成, 合 成 设 计 者 必 须 考 虑 许 多 问 题, 如 片 断 的 合 成、 片 断 的 连 接、 立 体 化 学、 官 能 团 的 相 互 转 换, 还 有 就 是 保 护 基 问 题。 合 成 中, 上 保 护 基 的 问 题 往 往 是 容 易 解 决 的, 而 去 保 护 基 步 骤 常 是 整 个 合 成 的 压 轴 戏, 许 多 的 合 成 工 作 因 此 而 失 败。 当 合 成 过 程 中 存 在 多 种 保 护 基 的 选 择 性 脱 除 时, 预 先 作 一 周 密 的 考 虑 是 必 需 的, 最 理 想 的 情 形 就 是 我 们 认 为 的 保 护 基 团 能 符 合 互 不 相 干 性 原 则, 即 其 中 一 个 保 护 基 的 脱 除 不 影 响 另 外 的 保 护 基。 虽 然 实 际 的 情 况 很 少 百 分 之 百 符 合, 但 这 种 观 念 在 考 虑 问 题 时 是 十 分 重 要 的。 下 面, 我 们 分 十 二 种 情 况 加 以 讨 论。
第7章基团的保护

精品资料
2、缩醛和缩酮衍生物
(1)四氢吡喃醚
O , TsOH
H2O ,H+
OH Et2O
第七章 官能团保护 (bǎohù)
精品资料
第一节 概 述
有 机 合 成 中, 如 果 分 子 中 有 几 个 部 位 或 官 能 团 可 能 发 生 反 应, 而 我 们 又 只 希 望 在 某 一 部 位 或 官 能 团 上 发 生 反 应, 比 较 直 接 的 办 法 是 采 用 选 择 性 的 反 应 条 件 和 试 剂。 但 是 在 复 杂 分 子 的 合 成 中, 许 多 情 况 下 会 找 不 到 这 样 的 直 接 条 件, 或 选 择 性 不 好, 于 是 必 须 采 用 另 外 的 办 法, 将 不 希 望 发 生 反 应 的 部 位 保 护 起 来 成 为 衍 生 物 形 式, 待 达 到 目 的 之 后 再 恢 复 原 来 的 官 能 团, 这 样 的 办 法 称 为 “保 护 基 团” (Protecting Groups) 法。
OO 混合型缩醛结构
OH
H+
ROH
-H+
O
O
RO O
H
一元醇在TsOH存在下与二氢吡喃作用生成四氢吡喃醚。
RO O
对碱、格氏试剂、烷基锂、氢化铝锂、烃化剂和酰化剂均稳定。
缺点是:不能用于在酸性介质中进行(jìnxíng)反应。此外,若用于旋光性醇,由 于引入了一个新的手性中心,将导致生成非对映异构体的混合物,分离困难,造 成产率降低。然而它在室温条件下,即能进行(jìnxíng)催化水解。
保护基团在有机合成中的应用课件

。
保护酚羟基不被硝酸氧化
保护基团在有机合成中的应用
10
练3:工业上用甲苯生产对—羟基苯甲酸乙酯
一种常用的化妆品防霉剂),其生产过程如下(反应条件及某些反应 物、产物未全部注明):
按上图填写下列空白:
(1)在合成路线中,设计反应③和反应⑥的目保的是护_酚__羟___基__不__被__。氧化
(2)写出反应⑤的化学方程式(有机物写结构简式,注明反应条件)。 ______________________保_护_基_团_在_有__机_合_成_中_的_应__用__________________1_1___
将其中不需要反应的基团先保护起来,待
合成任务完成后,再脱去保护基。但是,
从减少反应成本的角度考虑,最好的策略
是尽量避免使用保护基,也能达到有机合
成之目的。
保护基团在有机合成中的应用
17
保护基团在有机合成中的应用
18
答案1
保护基团在有机合成中的应用
19
保护基团在有机合成中的应用
20
答案2
保护基团在有机合成中的应用
• 从题给信息中筛选出以上两条,然后根据 基团保护的有机合成过程:基团保护有机 合成被保基团还原(前后可能还有其他有机 反应),不难得出答案。
保护基团在有机合成中的应用
5
常见的基团保护法
基团保护一般包括引入保护基和去保 护基的两个过程。包括:对碳碳双键 的保护;对酚羟基的保护;对羰基的 保护;对氨基的保护;对碳氢键的保 护;对醇羟基的保护;对羧基的保护 等。
取代基则取代在间位上:
写出试剂X、Y、Z的化学式(或名称)。X__________,
Y_(_3_)浓_H_N_O_3_/_浓_H_2,SOZ4 ____保K_护M_基n_O团_在4_/有H。+机合成中的应Fe用/HCl
官能团的保护

§官能团的保护1.易于被保护基团反应,且除被保护基团外不影响其他基团.2.保护基团必须经受得起在保护阶段的各种反应条件.3.保护基团易于除去.化学合成中常用的保护基碳氢键的保护羟基的保护氨基的保护羰基的保护羧基的保护1. 碳氢键的保护乙炔及末端炔烃中的炔氢较活泼,它可以与活泼金属`强碱`强氧化剂及有机金属化合物反应.常用的炔氢保护基为三甲硅基.将炔烃转变为格氏试剂后同三甲基氯硅烷作用.即可引入三甲硅基.该保护基对于金属有机试剂`氧化剂很稳定.可在使用这类试剂的场合保护炔基.2.羟基的保护醚类缩醛和缩酮类酯类羟基是一个活性基团,它能够分解格氏试剂和其他有机金属化合物,本身易被氧化,叔醇还容易脱水,并可以发生烃基化和酰基化反应.所以在进行某些反应时,若要保留烃基,就必须将它保护起来.醇羟基常用的保护方法有3类:2.1 转变成醚甲醚用生成甲醚的方法保护羟基是一个经典方法.通常使用硫酸二甲酯,在氢氧化钠或氢氧化钡存在下,在DMF或DMSO溶剂中反应得到.优点:该保护基很容易引入,且对酸,碱,氧化剂和还原剂都很稳定.缺点:难于脱保护,用氢卤酸回流脱保护基条件比较剧烈,常使分子遭到破坏,只有当分子中其他部位没有敏感基团时才适用.2.1 转变成醚叔丁醚将醇的二氯甲烷溶液或悬浮液在硫酸复合物存在下,在室温与过量的异丁烯作用,可得到叔丁醚.优点:对碱及催化氢化是稳定的.缺点:对酸敏感,其稳定性低于甲醚.由于脱保护基所用的酸性条件剧烈,当分子中存在对酸敏感的基团时不适用2.1 转变成醚三甲硅醚三甲硅醚广泛用于保护糖类,甾类及其他醇羟基.通常引入三甲基硅基保护基所用的试剂有三甲基氯化硅和碱;六甲基二硅氨烷.在含水醇溶液中加热回流即可除去保护基.优点:醇的三甲硅醚对催化氢化,氧化还原反应是稳定的,该保护基可在非常温和的条件下引入和去除.缺点:对酸和碱敏感,只能在中性条件下使用.2.2 转变成缩醛或缩酮2,3-二氢-4H-吡喃在酸的催化作用下,与醇类起加成反应,生成四氢吡喃醚衍生物.这是最常用的醇羟基的保护方法之一.此保护基广泛用于炔醇,甾类及核苷酸的合成中.2.3 转变成酯醇与酰卤,酸酐作用生成羧酸酯;与氯甲酸作用生成碳酸酯.所生成的酯在中性和酸性条件下比较稳定,因此可在硝化`氧化和形成酰氯时用成酯的方法保护羟基.保护基团可通过碱性水解除去,或在锌-铜的乙酸溶液中除去.3.氨基的保护伯胺和仲胺很容易被氧化,且易发生烃基化,酰基化以及与醛酮羰基的亲核加成反应.在合成中常采用:(1)氨基质子化(2)变为酰基衍生物(3)变为烃基衍生物等方法将氨基保护起来3.1 质子化此方法仅用于防止氨基的氧化,因为理论上说采用氨基质子化,即占据氮尚未共用电子对,以阻止取代反应的放生.这是对氨基保护最简单的法.3.2 转变为酰基衍生物将氨基酰化转变成酰胺是保护氨常用的方法.通常伯胺酰基化已足以保护基,防止其被氧化和烃化反应的发生.常用的酰基化试剂为酰卤和酸酐.保护基可在酸性和碱性条件下水解出去.3.2 转变为酰基衍生物邻苯二甲酸酐与伯胺所生成的邻苯二甲酰亚胺非常稳定,不受催化氢化碱性还原,醇解以及氯化氢,溴化氢,乙酸溶液的影响,也适用于保护伯胺.在酸性或碱性条件下水解或用肼解法脱去保护.3.3 转变为烃基衍生物用烃基保护氨基主要用三苯甲基或苯甲基.三苯甲基衍生物可用胺与溴或氯代三苯甲烷在碱存在下制备.三苯甲基由于空间位阻效应对氨基起到很好的保护作用,它对碱是稳定的.苯甲基衍生物用胺和氯化苯甲基在碱存下制得.4.羰基的保护羰基具有许多反应性能,是有机化学中最易发生反应的活性官能团之一.保护羰基常用的方法:生成缩醛和缩酮来降低羰基活性而保护羰基.4.羰基的保护保护醛酮羰基最常用的方法是通过乙二醇和2-疏基乙醇的反应,生成相应的叫做环缩醛或缩酮的产物.5.羧基的保护羰基通常用形成酯的方法保护.常见的有转变为甲酯,乙酯,叔丁酯,苯甲酯.甲酯和乙酯可以用羧酸直接与甲醇或乙醇发生酯化反应制得,又可以被碱水解.5.羧基的保护叔丁酯可由羧酸先变为酰氯,再与叔丁醇作用,或者通过羧酸与异丁烯直接作用而得.它不能氢解,在通常条件下也不被氨解及碱催化水解.5.羧基的保护苯甲酯可由羧酸与苯甲基卤在碱性条件下反应而得.它除了可在强酸性或碱性条件下水解,还可以被氢解.。
绿色化学答案

绿色化学答案【篇一:绿色化学习题与答案】lass=txt>1、绿色化学产生的时代背景是什么?答:长期以来,人们对传统化学不能有效的利用资源,无节制的消耗以及造成严重的环境污染进行了深入思考,制定了一系列的防治和预防污染的措施,但都不能从源头解决污染。
绿色化学正是在这大背景下应运而生。
2、简要概括绿色化学的基本内容?答:绿色化学的研究主要是围绕化学反应、原料、催化剂、溶剂和产品的绿色化来进行的。
它主要包括:化学反应的绿色化、原料的绿色化、溶剂的绿色化、催化剂的绿色化、产品的绿色化以及化工生产的绿色化。
3、叙述绿色化学与环境化学的异同点?答:不同点:环境化学是一门研究有害化学物质在环境介质中的存在、化学特性、行为和效应及其控制的化学原理和方法的科学;绿色化学是防止污染、产生较少的危险废物以及减少环境和人类健康的风险的环境友好化学品和过程的设计、制造和使用,目的是从源头减少污染,是一种理念、一种愿望。
相同点:两者都是减少有害化学物质对环境的污染,保护环境。
第二次作业冉力 201204430011、举例说明保护基团的作用,并用绿色化学的观点来说明其优缺点?答:例子保护基团是为了在实验中不使其它的基团发生改变,而只使特定基团或部位发生预期反应,这样就避免了实验的失败及反应产物的结构复杂化,防止危害其它物质的功效。
优点:保护基团能使反应朝着人们预想的方向前行,能有效的利用反应物原料,防止基团影响其他反应物和产物的功效。
缺点:在保护基团解除的过程中,保护物质就变成了废物,不仅消耗了额外的试剂,还产生了需要处理的废物,造成污染,这不符合绿色化学的要求。
第三次作业冉力 201204430011、举例说明分子筛催化剂的性能和催化特性?答:分子筛具有选择性吸附、高效吸附性能、离子交换性能和催化性能。
如沸石分子筛只允许直径比较小的分子通过,而且对水、氨气、二氧化碳等极性分子有很高的亲和力,是良好的催化剂和催化载体。
邻近基团效应的举例

邻近基团效应的举例邻近基团效应是有机化学中一个重要的概念,指的是在一个有机分子中,它的邻近基团对该分子的化学性质和反应起到影响。
下面我将列举十个具体的例子,来说明邻近基团效应的作用。
1. 取代基对芳香环的影响:在芳香族化合物中,邻位或间位取代基的引入可以改变分子的电子密度分布,从而影响其反应性。
例如,邻位或间位带有电子给体基团(如-OCH3)的芳香化合物,会增加反应活性,容易发生亲电取代反应。
2. 取代基对酚的酸碱性影响:在苯酚分子中,邻位或间位取代基的引入会影响其酸碱性。
例如,苯酚的邻位或间位带有电子给体基团(如-OCH3)时,会增强其酸性,使其更容易失去质子。
3. 取代基对醇的酸碱性影响:在醇分子中,邻位或间位取代基的引入会影响其酸碱性。
例如,苯甲醇的邻位或间位带有电子给体基团(如-OCH3)时,会增强其酸性,使其更容易失去质子。
4. 取代基对羧酸的酸性影响:在羧酸分子中,邻位或间位取代基的引入会影响其酸性。
例如,苯甲酸的邻位或间位带有电子给体基团(如-OCH3)时,会增强其酸性,使其更容易失去质子。
5. 取代基对酰胺的稳定性影响:在酰胺分子中,邻位或间位取代基的引入会影响其稳定性。
例如,苯甲酰胺的邻位或间位带有电子给体基团(如-OCH3)时,会增强其稳定性,使其更不容易水解。
6. 取代基对酮的稳定性影响:在酮分子中,邻位或间位取代基的引入会影响其稳定性。
例如,邻位或间位带有电子给体基团(如-OCH3)的酮,由于电子效应的作用,会增加其稳定性。
7. 取代基对醛的稳定性影响:在醛分子中,邻位或间位取代基的引入会影响其稳定性。
例如,邻位或间位带有电子给体基团(如-OCH3)的醛,由于电子效应的作用,会增加其稳定性。
8. 取代基对酮和醛的亲核加成反应影响:在酮和醛分子中,邻位或间位取代基的引入会影响其亲核加成反应。
例如,邻位或间位带有电子吸引基团(如-NO2)的酮和醛,由于电子效应的作用,会降低其亲核加成反应的速率。
有关官能团的保护

有机合成中的基团保护、导向基(高考必备)(一)基团保护在有机合成中,些不希望起反应的官能团,在反应试剂或反应条件的影响下而产生副反应,这样就不能达到预计的合成目标,因此,必须采取对这些基团进行保护,完成合成后再除去保护基,使其复原。
对保护措施一定要符合下列要求:①只对要保护的基团发生反应,而对其他基团不反应;②反应较容易进行,精制容易;③保护基易脱除,在除去保护基时,不影响其他基团。
下面只简略介绍要保护的基团的方法。
1、羟基的保护在进行氧化反应或某些在碱性条件进行的反应,往往要对羟基进行保护。
如防止羟基受碱的影响,可用成醚反应。
防止羟基氧化可用酯化反应。
2、对氨基的保护氨基是个很活泼的基团,在进行氧化、烷基化、磺化、硝化、卤化等反应时往往要对氨基进行保护。
(1)乙酰化(2)对NR 2可以加H + 质子化形成季铵盐,– NH 2也可加H + 成 – NH3而保护。
3、对羰基的保护羰基,特别是醛基,在进行氧化反应或遇碱时,往往要进行保护。
对羰基的保护一般采用缩醛或缩酮反应。
4、对羧基的保护羧基在高温或遇碱性试剂时,有时也需要保护,对羧基的保护最常用的是酯化反应。
– OH –OR– NH 2 CH 3COCl或酸酐–NH 2-C -CH 3O–COOH + R –OH – COORH +–CHO + 2ROH – CH(OR)2H +-O -C -RO– OH5、对不饱和碳碳键的保护碳碳重键易被氧化,对它们的保护主要要加成使之达到饱和。
(二)导向基在有机合成中,往往要“借”某个基团的作用使其达到预定的目的,预定目的达到后,再把借来的基团去掉,恢复本来面貌,这个“借”用基团 我们叫“导向基”。
当然这样的基团,要符合易“借”和易去掉的原则,如由苯合成1,3,5 – 三溴苯,在苯的亲电取代反应中,溴是邻、对位取代基,而1,3,5 – 三溴苯互居间位,显然不是由溴的定位效应能引起的。
但如苯上有一个强的邻、对位定位基存在,它的定位效应比溴的定位效应强,使溴进入它的邻、对位,这样溴就会呈间位,而苯环上原来并无此类基团,显然要在合成时首先引入,完成任务后,再把它去掉,恰好氨基能完成这样的任务,因为它是一个强的邻、对位定位基,它可如下引入:– H → – NO 2 → – NH 2 ,同时氨基也容易去掉:– NH 2 → – N 2 → – H 因此,它的合成路线是:根据导向基团的目的不同,可分为下列几种情况: 1、致活导向假如要合成 可以用 但这种方法产率低,因为丙酮两个甲基活性一样,会有副反应发生:但在丙酮的一个甲基上导入一个致活基团,使两个甲基上的氢的活性有显著差别,这可用一个乙酯基(–COOC 2H 5)导入丙酮的一个甲基上,则这个甲基的氢OC 6H 5O+ C 6H 5BrOC 6H 5OC 6H 5C 6H 5Br碱C 6H 5Br碱O C 6H 5C 6H 5O有较大的活性,使这个碳成为苄基溴进攻的部位,因此,利用乙酰乙酸乙酯而不用丙酮,完成任务后,把乙酯基水解成羧基,利用β– 酮酸易于脱羧的特性将导向基去掉,于是得出合成路线为:2、致钝导向活化可以导向,有时致钝也能导向,如合成氨基是很强的邻、对位定位基,进行取代反应时容易生成多元取代物:如只在苯胺环上的氨基的对位引入一个溴,必须将氨基的活性降低,这可通过乙酰化反应来达到,同时乙酰氨基是一个邻、对位定位基,而此情况下对位产物是主要产物:3、利用封闭特定位置来导向例如合成 ,用苯胺为起始原料,用混酸硝化,一方面苯胺易被硝酸氧化,另一方面,苯胺与硫酸还会生成硫酸盐,而 是一个间位定位基,硝化时得到,所以苯胺硝化时,要把苯胺乙酰化后,再硝化。
有机化学-保护基团

LiAlH4
O
O CO2Et
selectivity 是手段不是目的
一、概述:理想保护基团的标准
1.保护基的来源,经济性 2.容易引入,保护效率高 3.保护基的引入对化合物的结构不应增加过量的复 杂性,如新手性中心等。 4.保护后的化合物在后面的反应中要求稳定 5.保护后的化合物对分离、纯化和层析要稳定 6.能在高度专一的条件下选择性、高效脱除、不影 响分子其余部分。 7.去保护后的主产物要易于分离。 8.有时还可以将保护基转换为其他官能团。
O O
O O OTBDTS O SH SH TsOH S O OTBDTS S
MeSH H+ O
O
SMe SMe
Raney Ni 可将羰基还原成亚甲基。 应注意去保护,同时可以完整地还原成CH2 很好的保护基,但不如乙二醇
乙二醇,毒性小 二硫醇,毒性,气味
五、羧酸的保护 (一),形成酯 1. 羧酸酯化,一般酯化 苄酯 叔丁酯
MOM MEM THP
1.甲氧基甲醚MOM醚
甲氧基甲醚是用氯甲基甲醚或甲醛缩二甲醇将醇羟基甲 氧甲基化生成。在强碱(如氢化钠、氢化钾)存在下,氯 甲基甲醚烃化被保护的醇得到甲氧基甲醚。在五氧化二 磷催化下,甲醛缩二甲醇烃化醇羟基同样可生成甲氧基 甲醚。甲氧基甲醚的裂解去保护可用盐酸甲醇溶液、盐 酸THF水溶液、硫酸/乙酸水溶液等。
二、羟基的保护
(一)形成醚
1.甲基醚
ROH NaH, (CH3)2SO4 (CH3)3SiI, CHCl3 ROCH3
I. 保护
(1 ) Me2SO4 MeOH Bu4N+I- 有机溶剂, 产率 60—90%
(2)MeI, Me2SO4 NaH, KI,THF,引入甲醚 无很大位阻影响 (3)CH2N2 (重氮甲烷) 硅胶 /HBF4
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
举例说明保护基团的作用,并用绿色化学的观点来说明其优缺点。
答: 在有机合成中,为达到最终合成目的常常采用“以退为进”的策略,先把有用的官能团位置有目的的保护起来再在适当的位置使它复原。
例如我们常见的羟基、羰基、氨基的保护。
1、羟基的保护:
2、氨基的保护:
3、醛基的保护: RCHO + H2 → RCH2OH 2RCH2OH + O2 → 2RCHO + 2H2O
4、双键的保护:
RCH=CHR '+ HBr → RCH2CHBrR '
RCH2CHBrR '+ NaOH → RCH=CHR ' + NaBr + H2O
优点:1、为了暂时致钝某些基团,提高反应的化学选择性
2、可以利用保护基与基团反应后,使某一位置有活化或钝化的反应中心,实现区域的选择性,对反应起定向的作用
缺点: 在保护基团的过程中有时要增加额外的工艺步骤,不仅消耗了额外的试剂,而且还可能会产生需要解除的废物。
有时产生的物质还具有较大的毒性,需要特殊的处理,还有就是在反应的时候会引入一些有害物质,而这些物质可能会挥发到环境中对人的身体造成危害,同时污染环境,在还原基团的过程中还可能伴随着较大的能量的损失,因此应在一切可能的情况下尽量避免使用保护基团的方法。
NH 2
+
C H 3C O C l (C H 3C O )2O C H 3C O O H NH CCH O H +/H 2O or OH -/H 2O O H O Na NaOH CH 3I O CH 3HI or HBr/AcOH 回流O H。
