第十章 分子结构习题
高中生化学分子结构练习题库

高中生化学分子结构练习题库1. 水分子的化学式是什么?水分子的化学式是H2O。
2. 请写出甲烷(CH4)的分子式结构。
3. 已知乙醇(C2H5OH)分子式,画出其分子结构。
4. 碳酸氢根(HCO3-)是一个离子,它的分子结构如何?5. 正己烷(C6H14)是烷烃的一种,画出其分子结构。
6. 氨(NH3)是一种常见的化合物,画出其分子结构。
7. 三氟化硼(BF3)是无机化合物,其分子结构是什么样子的?8. 苯(C6H6)是一种芳香烃,请画出其分子结构。
9. 硝酸根(NO3-)是一种离子,请写出其分子结构。
10. 二氧化氮(NO2)是一种与空气污染有关的气体,画出其分子结构。
11. 乙酸(CH3COOH)是一种有机酸,请写出其分子结构。
12. 醚是一类含氧化合物,请写出乙醚(C2H5OC2H5)的分子结构。
13. 纳米管是碳纳米材料的一种形式,请写出碳纳米管(C60)的分子结构。
14. 戊二酸(C5H8O4)是一种二羧酸,请画出其分子结构。
15. 溴酸根(BrO3-)是一种离子,请写出其分子结构。
16. 磷酸(H3PO4)是一种无机酸,请画出其分子结构。
17. 氟化锂(LiF)是一种无机化合物,请写出其分子结构。
18. 稀硫酸(H2SO4)是一种强酸,请画出其分子结构。
19. 乳酸分子(C3H6O3)是一种有机酸,请写出其分子结构。
20. 硝酸(HNO3)是一种强酸,请画出其分子结构。
以上是高中生化学分子结构练习题库的部分题目,通过解答这些题目,可以加深对分子结构的理解和记忆。
希望这份题库对你的学习有所帮助!。
基础化学第二版李保山10 化学键与分子结构习题解答-学生
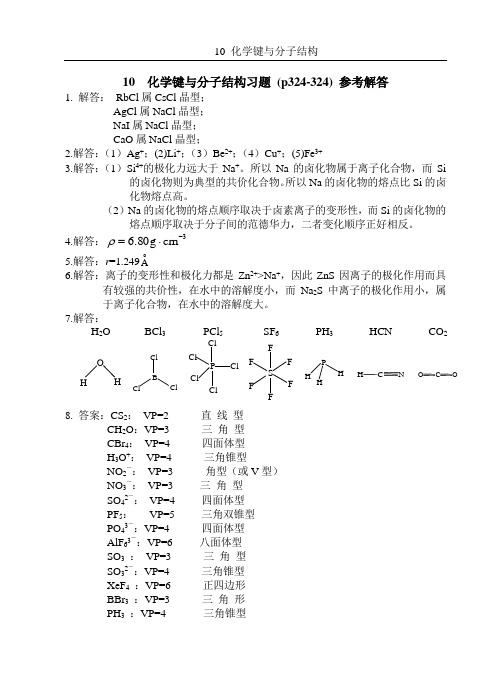
10 化学键与分子结构习题 (p324-324) 参考解答1. 解答: RbCl 属CsCl 晶型;AgCl 属NaCl 晶型;NaI 属NaCl 晶型;CaO 属NaCl 晶型;2.解答:(1)Ag +;(2)Li +;(3)Be 2+;(4)Cu +;(5)Fe 3+3.解答:(1)Si 4+的极化力远大于Na +。
所以Na 的卤化物属于离子化合物,而Si的卤化物则为典型的共价化合物。
所以Na 的卤化物的熔点比Si 的卤化物熔点高。
(2)Na 的卤化物的熔点顺序取决于卤素离子的变形性,而Si 的卤化物的熔点顺序取决于分子间的范德华力,二者变化顺序正好相反。
4.解答:3cm g 80.6-⋅=ρ5.解答:r =1.249o A6.解答:离子的变形性和极化力都是Zn 2+>Na +,因此ZnS 因离子的极化作用而具有较强的共价性,在水中的溶解度小,而Na 2S 中离子的极化作用小,属于离子化合物,在水中的溶解度大。
7.解答:H 2O BCl 3 PCl 5 SF 6 PH 3 HCN CO 2 OH B Cl Cl Cl PCl Cl Cl Cl ClS F F F F F F P H H C N H O C O8. 答案:CS 2: VP=2 直 线 型CH 2O :VP=3 三 角 型CBr 4: VP=4 四面体型H 3O +: VP=4 三角锥型NO 2-: VP=3 角型(或V 型)NO 3-: VP=3 三 角 型SO 42-: VP=4 四面体型PF 5: VP=5 三角双锥型PO 43-:VP=4 四面体型AlF 63-:VP=6 八面体型SO 3 : VP=3 三 角 型SO 32-:VP=4 三角锥型XeF 4 :VP=6 正四边形BBr 3 :VP=3 三 角 形PH 3 :VP=4 三角锥型H2S :VP=4 角型(或V型)CCl4:VP=4 四面体型NH4+:VP=4 四面体型9.答案:本题不适于8隅体规则。
遗传学第十章 遗传物质的分子基础10.6 习题

第十章遗传物质的分子基础一、填空题1、在互补测验中,两个突变型若表现出互补效应,则证明____;若不能出现互补,则证明____。
2、顺反子既有功能上的____,又有结构上的____。
3、用S(35)标记的噬菌体感染细菌,放在液体培养基培养,而后分离菌体和培养液,绝大部分的放射性将在( )测得。
4、用放射性胸腺嘧啶标记某一染色体,而后移入一般培养基中让其复制两次,则在四条染色体中有( )条有放射性。
5、DNA是脱氧核苷酸的多聚体,其核苷酸是由()、()和()连接起来构成的。
6、在三联体密码中,编写密码的字母已知为A、U、G、C四个。
在由这些字母编成的64个三联体密码中,不包含尿嘧啶(U)的密码在理论上有()个,至少包括一个尿嘧啶的密码有()个。
7、某一区段DNA单链的核苷酸顺序如下:A链 TACGATTG,其B链的核苷酸顺序为( ),若mRNA转录是以A链为模版的,那么,mRNA的碱基顺序为( )。
8、T4噬菌体溶菌酶由164个氨基酸组成,由此可知决定T4噬菌体溶菌酶的基因由()对碱基组成。
酵母丙氨酸tRNA由77个核苷酸组成,因此可知决定酵母丙氨酸tRNA的基因由()对碱基组成。
9、在DNA复制过程中,连续合成的子链称为( ),另一条非连续合成的子链称为( )。
10、DNA后随链合成的起始要一段短的()。
11、tRNA的分子结构是( )的,外形象( ),它的顶端有三个碱基,可以和mRNA上相应的碱基配合,这三个碱基称为( )。
12、生物体内有两类核酸,一类叫( ),主要存在于( )。
它具有遗传信息;另一类是( ),它主要存在于( ),它对于遗传信息的传递和蛋白质的合成具有重要作用。
13、中心法则是指在蛋白质合成中,从( )到( )再到( )的遗传信息转录和转译过程,以及遗传信息从( ) 到( )的复制过程。
14、一个具n个碱基对的DNA片段,碱基的不同排列顺序有( )种。
15、在某一DNA分子中,A的含量占20%,则T、C、G的含量分别为( )、( )和( )。
有机化学第十章习题醛酮课后习题答案
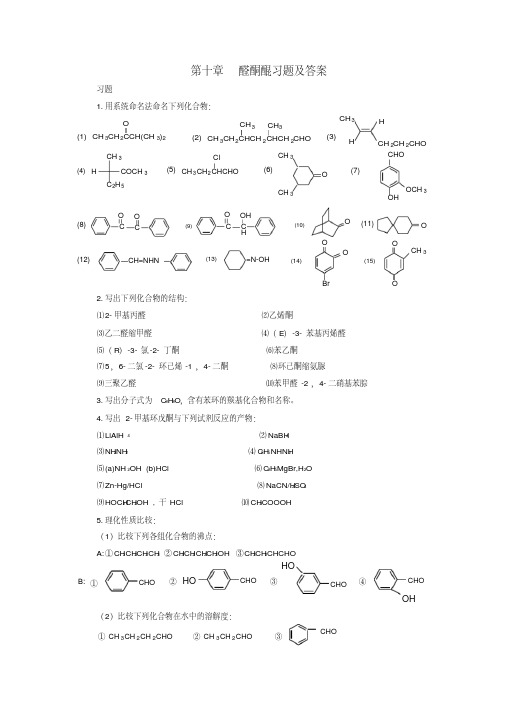
第十章醛酮醌习题及答案习题1.用系统命名法命名下列化合物:CH 3CH 2CCH(CH 3)2O(1)(2)(3)CH 3CH 2CHCH 2CHCH 2CHOCH 3CH 3CH 3HHCH 2CH 2CHO(4)(5)CH 3C 2H 5COCH 3HCH 3CH 2CHCHOCl(6)OCH 3CH 3(7)CHOOHOCH 3(11)(8)(9)(10)CO CO COC HOH OO (12)(13)(14)(15)CH=NHN=N-OHOOBr OOCH 32.写出下列化合物的结构:⑴2-甲基丙醛⑵乙烯酮⑶乙二醛缩甲醛⑷(E )-3-苯基丙烯醛⑸(R )-3-氯-2-丁酮⑹苯乙酮⑺5,6-二氯-2-环己烯-1,4-二酮⑻环己酮缩氨脲⑼三聚乙醛⑽苯甲醛-2,4-二硝基苯腙3.写出分子式为C 8H 8O ,含有苯环的羰基化合物和名称。
4.写出2-甲基环戊酮与下列试剂反应的产物:⑴LiAlH4⑵NaBH 4⑶NH2NH 2⑷C6H 5NHNH 2⑸(a)NH 2OH (b)HCl ⑹C 2H 5MgBr,H 2O ⑺Zn-Hg/HCl ⑻NaCN/H 2SO 4⑼HOCH 2CH 2OH ,干HCl ⑽CH 3COOOH5.理化性质比较:(1)比较下列各组化合物的沸点:A:①CH 3CH 2CH 2CH 3 ②CH 3CH 2CH 2CH 2OH ③CH 3CH 2CHCHOOH③①CHO②CHOHOCHOHOCHO④B:(2)比较下列化合物在水中的溶解度:① CH 3CH 2CH 2CHO ② CH 3CH 2CHOCHO③(3)比较下列化合物与HCN 加成反应的活性:③①②④CH 3CHOC 6H 5COCH3CH 3COCH3C 6H 5CC 6H 5O(4)比较下列化合物与NaHSO 3加成反应的活性:HOOO③①②(5)比较下列化合物的稳定性:③①②④OHOOO(6)比较下列负离子的稳定性:③①②OOOOOCH 3(7)比较下列化合物pka 的大小:③①②④CH 3CHO C 6H 5COCH3CH 3COCH3C 6H 5CC 6H 5O6.完成下列反应:⑴HCN OH -CH 3CH 2COCH 3?稀H 2SO 4?⑵OH -NaHSO 3CH 3COCH 3H 2O⑶CH 3-C-CH 2CH 3OCH 3MgBr H 2O,⑷CH 3CHO Br 2 / FeH 2O / H+Mg 无水乙醚?⑸O+CHCNaH 3O +⑹NH 2OHHCl?C 6H 5CCH 3OOCH 3(C 6H 5)3P=CHCH3⑺+⑻H 2O,HAcO(1mol) Br 2C CH 3CH 3C-CH 3I 2NaOH⑼CH 3OH 3O +CH 3O⑽NaBH 4COONaOH,H 2OCH 3-C-CH 3⑾?+CH 3OCOHO ⑿(CH 3)2NHHCl?O+HCHO +⒀NaCN / EtOH / H2OOCHO ClCH 2COOC 2H 5NaOC(CH 3)3⒁+OMe 2CuLi?+O⒂⒃AlCl 3-CuC 2l 2CH 3++COHCl浓NaOH+?⒄CH 3ICH 3COOOHH 3O +?N⒅CH 3-C-CH 2CH 2BrOOHOH干 HClH 2O / H +Mg 干醚O?⒆+(CH 3CH 2-C)2OOOCHOCH 3CH 2-C-OKO⒇COCH 3AlCl3+O-C-CH 3O OH7.下列化合物:(1)CH 3CHO (2)CH 3CH 2COCH 2CH 3(3)(CH 3)2CHOH (4)O(5) (CH 3)2CHCHO (6) C 6H 5CHO (7) C 6H 5COCH 3(8)CHO能够发生碘仿反应的有?能与亚硫酸氢钠反应的有?能与甲醛发生交叉Cannizzaro 反应的有?能够与Tollens 试剂反应的有?能够与Fehling 试剂反应的有?8.鉴别下列各组化合物:(1)CH 3COCH 2CH 3A.CH 3CH 2CH 2CHOB. C.CH 3CHCH 2CH 3OHD.CH 3CH 2CH 2CH 2OH(2)A.CHOCOCH 3B.C.CH=CH 2 D.C CH(3)A.正戊醛 B.苯甲醛戊酮戊酮戊醇戊醇(4) A.B.OHOHC.CHOD.O9.解释下列反应的机理:(1):H-C-CH 2CH 2CH 2-CH-C-HOOCH 3稀 OH -CH 3CHO(2):OHORRH 3O +RR(3):二苯基乙二酮在NaOH 的作用下发生重排,生成二苯基羟乙酸钠,酸化后得到二苯基羟乙酸,如果用CH 3ONa代替NaOH ,则可以得到二苯基羟乙酸甲酯。
基础化学李保山第二版10-分子结构习题答案

10 分子结构习题解答(p322-325)思考题1. Na和Cl、F之间,K和Cl、F之间能形成离子化合物。
2. 答案:Be2+ 2电子构型;Ca2+8电子构型;Fe3+9~17电子构型;Cu+ 18电子构型;Sn2+18+2电子构型;Pb4+18电子构型;O2-8电子构型。
3.答案:S2->K+>Na+>Mg2+4. Sn4+ >Fe2+ >Sn2+ >Sr2+>Ba2+5. S2->O2->F->Cu+ >Na+6. (1)半径比规则可以用来判断离子晶体的晶格类型。
晶格能可以用来衡量离子键的强弱。
(2)离子极化的结果使原来的离子键向共价键方向过渡。
(3)18电子构型的正离子极化率较强;18电子构型的负离子变形性较强。
7. 答案:原子轨道的角度分布方向是一定的,共价键的形成遵循最大重叠原则,所以只能在建轴方向上才能形成稳定的共价键,因而共价键具有方向性;每个原子的未成对电子数时一定的,有几个未成对电子就可以形成几个共用电子对,所以共价键具有饱和性。
8. (1)由两个相同或不相同的原子轨道沿轨道对称轴方向相互重叠而形成的共价键(头碰头),叫做σ键。
当两个原子的轨道从垂直于成键原子的核间连线的方向接近,发生电子云重叠而成键(肩并肩),这样形成的共价键称为π键。
(2)单键:在价键理论中,两个原子之间如只有一对共用电子,形成的化学键称为单键。
单电子键:在分子轨道理论中,只有一个电子填入分子轨道形成的化学键称为单电子共价键。
(3)同类型的杂化轨道可分为等性杂化和不等性杂化两种。
如果原子轨道杂化后形成的杂化轨道是等同的,这种杂化叫做等性杂化。
如果原子轨道杂化后形成的杂化轨道中有一条或几条被孤对电子所占据,使得杂化轨道之间的夹角改变,这种由于孤对电子的存在而造成杂化轨道不完全等同的杂化,叫做不等性杂化。
9. (1)BF3键角大,因为BF3中B的价电子结构为2s22p1,形成分子时,进行sp2杂化,三个sp2杂化轨道分别与三个F原子的p轨道成键,故BF3分子为平面三角形,键角为120度。
最新精选粤沪版初中物理八年级下第十章 从粒子到宇宙1 认识分子练习题第十八篇

最新精选粤沪版初中物理八年级下第十章从粒子到宇宙1 认识分子练习题第十八篇第1题【单选题】下列说法正确是( )A、电子的发现使人们确信,原子是可分的B、分子是由原子和电子组成C、原子是不可再分的最小微粒D、通常情况下,原子内部原子核所带的正电荷数与核外所有电子的负电荷数是不相等【答案】:【解析】:第2题【单选题】下列粒子不带电的是( )A、质子B、中子C、电子D、原子核【答案】:【解析】:第3题【单选题】关于粒子和宇宙,下列说法中正确的是( )A、摩擦起电是通过摩擦的方法创造了电荷B、水和酒精混合后总体积变小说明分子间有空隙C、原子是由原子核和中子组成的D、地球等行星围绕太阳转动,太阳是宇宙的中心【答案】:【解析】:第4题【单选题】下列说法中错误的是( )A、物质是由大量分子组成的B、分子是很小的C、一滴水就是一个分子D、分子间同时存在引力和斥力【答案】:【解析】:第5题【单选题】关于粒子与宇宙,下列说法中正确的是( )A、一小勺盐放入盛满水的杯中,水未溢出,说明分子间有引力B、毛皮摩擦过的橡胶棒能吸引碎纸屑,橡胶棒带正电C、汤姆生发现电子,说明原子可分D、谱线“红移”现象,说明星系在逐渐靠近我们【答案】:【解析】:第6题【单选题】关于粒子和宇宙,下列说法正确的是( )A、雾霾是由于固体分子不停运动形成的B、依据汤姆生的原子核式模型理论,在原子中绕核高速旋转的是电子C、炭笔画出的连续的线放大后不连续,说明分子间有空隙D、在质子、电子和原子中,尺度最小的是电子【答案】:【解析】:第7题【填空题】常见的物质由分子组成,分子由______组成;夏日荷花盛开飘来阵阵花香,这是______现象;清晨荷叶上的两颗露珠接触后成为了更大的一颗水珠,表明分子之间存在______力.【答案】:【解析】:第8题【填空题】原子是由带______电的电子和带______电的原子核构成,而原子核又是______电的中子和带______电的质子组成.原子不带电是因为组成原子的______数等于______.【答案】:【解析】:第9题【填空题】任何物质都是由极其微小的粒子组成,这些粒子保持了物质原有的性质,我们把它们叫做______.一个瓶子能盛1kg水,用这个瓶子能盛______?kg水银.(水银密度13.6×10^3kg/m^3)A、分子B、13.6【答案】:【解析】:第10题【填空题】请你在图中所空横线上完成物质结构图。
化学分子的构型和极性练习题

化学分子的构型和极性练习题化学分子的构型和极性是化学领域中的重要概念。
通过理解分子的构型和极性,我们可以更好地理解分子之间的相互作用、化学反应的进行以及物质的性质。
下面是一些关于化学分子构型和极性的练习题,帮助读者深入理解这些概念。
练习题一:1. H2O的分子构型是什么?它的极性如何?2. CH4的分子构型是什么?它的极性如何?3. NH3的分子构型是什么?它的极性如何?4. CO2的分子构型是什么?它的极性如何?5. SO2的分子构型是什么?它的极性如何?解答:1. H2O的分子构型是倒V形,两个氢原子和一个氧原子位于同一平面上。
H2O是极性分子,由于氧原子比氢原子更电负,电子云在氧原子周围更为密集,使得氧原子带有局部负电荷,氢原子带有局部正电荷。
2. CH4的分子构型是正四面体形状,四个氢原子均位于中心的碳原子的四个顶点上。
CH4是非极性分子,由于碳-氢键的电负性相近,电子云分布均匀,没有局部正负电荷产生。
3. NH3的分子构型是三角锥形,一个氮原子位于底部,三个氢原子位于底部的三个顶点上。
NH3是极性分子,氮原子带有局部负电荷,氢原子带有局部正电荷。
这是由于氮原子比氢原子更电负,电子云在氮原子周围更为密集。
4. CO2的分子构型是线性形状,一个碳原子位于中心,两个氧原子位于碳原子的两侧。
CO2是非极性分子,碳-氧键的电负性相等,电子云分布均匀,没有局部正负电荷产生。
5. SO2的分子构型是V形,一个硫原子位于底部,两个氧原子位于底部的两个顶点上。
SO2是极性分子,硫原子带有局部正电荷,氧原子带有局部负电荷。
这是因为硫原子比氧原子更电负,电子云在硫原子周围更为密集。
练习题二:1. HF的分子构型是什么?它的极性如何?2. CO的分子构型是什么?它的极性如何?3. H2的分子构型是什么?它的极性如何?4. HCl的分子构型是什么?它的极性如何?5. O3的分子构型是什么?它的极性如何?解答:1. HF的分子构型是线性形状,一个氟原子位于中心,一个氢原子位于氟原子的一侧。
分子结构习题

第十章分子结构习题一.选择题1.最早指出共价键理论的是( )2. A. 美国的路易斯; B. 英国的海特勒;3. C. 德国的伦敦; D. 法国的洪特.4.NH4+形成后,关于四个N-H键,下列说法正确的是( )A. 键长相等;B. 键长不相等;C. 键角相等;D. 配位键的键长大于其他三键;E. 配位键的键长小于其他三键.5.下列说法中不正确的是( )A. 键的一对成键电子的电子密度分布对键轴方向呈园柱型对称;B. 键电子云分布是对通过键轴的平面呈镜面对称;C. 键比键活泼性高,易参与化学反应;D. 配位键只能在分子内原子之间形成,不可以在分子间形成;E. 成键电子的原子轨道重叠程度越大,所形成的共价键越牢固.6.CO和N2的键级都是3,两者相比CO的( )A. 键能较小,较易氧化;B. 键能较小,较难氧化;C. 键能较大,较难氧化;D. 键能较大,较易氧化.7.下列分子或离子中,键角最小的是( )A. HgCl2B. H2OC. NH3D. PH38.下列说法正确的是( )A. 原子形成的共价键数等于游离气态原子中不成对电子数;B. 同种原子双键的键能为单键键能的两倍;C. 键长是指成键原子的核间距离;D. 线性分子如A-B-C是非极性的;E. 共价键的极性是由成键元素的电负性差造成的.9.关于原子轨道的说法正确的是( )A.凡中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体.B. CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的;C. sp3杂化轨道是由同一原子中能量相近的s轨道和p轨道混合起来形成的一组能量相等的新轨道;D. 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键.10.下列化合物中氢键最强的是( )A. CH3OHB. HFC. H2OD. NH311.对羟基苯甲醛比邻羟基苯甲醛的熔沸点高的原因是( )A. 前者不能形成氢键,后者能形成氢键;B. 前者能形成氢键,后者不能形成氢键;C. 前者形成分子间氢键,后者形成分子内氢键;D. 前者形成分子内氢键,后者形成分子间氢键.12.下列各组物质沸点高低顺序中正确的是( )A. HI>HBr>HCl>HFB. H2Te>H2Se>H2S>H2OC. NH3>AsH3>PH3D. CH4>GeH4>SiH413.I2的CCl4溶液中分子间主要存在的作用力是( )A. 色散力B. 取向力C. 取向力.诱导力.色散力D. 氢键.诱导力.色散力14.下列分子中有最大偶极矩的是( )A. HIB. HClC. HBrD. HF15.下列分子中偶极矩为零的是( )A. NF3B. NO2C. PCl3D. BCl316.下列分子是极性分子的是( )A. BCl3B. SiCl4C. CHCl3D. PCl3E. BeCl217.下列离子或分子有顺磁性的是( )A. O2B. O22-C. N2D. NOE. NO+18.加热熔化时需要打开共价键的物质是( )A. MgCl2B. CO2(s)C. SiO2D. H2O19.某元素E具有(Ar)3d24s2电子排布,它和溴生成符合族数的溴化物分子式是( )A. EBr3B. EBr2C. EBr4D. EBr20.关于共价键的说法,下述说法正确的是( )A. 一般来说键键能小于键键能;B. 原子形成共价键的数目等于基态原子的未成对电子数;C. 相同原子间的双键键能是单键键能的两倍;D. 所有不同原子间的键至少具有弱极性.21.CO和N2相比,CO的( )A. 键能较小,较易氧化;B. 键能较小,较难氧化;C. 键能较大,较难氧化;D. 键能较大,较易氧化.22.下列分子中心原子是sp2杂化的是( )A. PBr3B. CH4C. BF3D. H2O23.SO42-离子的空间构型是( )A. 平面正方形B. 三角锥形C. 四面体D.八面体24.下列各物质分子其中心原子以sp2杂化的是( )A. H2OB. NO2C. SCl2D. CS225.用价键法和分子轨道法处理O2分子结构,其结果是( )A. 键能不同B. 磁性不同C. 极性不同D. 结果不同26.下列关于O22-和O2-的性质的说法,哪组不正确( )A. 两种离子都比O2分子稳定性小;B. O2-的键长比O22-的键长长;C. 键级次序是O2>O2->O22-;D. O2-是反磁性的,但O22-是顺磁性的.27.下列关于化学键正确的说法是( )A. 原子与原子之间的作用;B. 分子之间的一种相互作用;C. 相邻原子之间的强烈相互作用;D. 非直接相邻的原子之间的相互作用.28.下列各题说法不正确的是( ) A. 两个原子的P电子只能沿P 轨道对称轴平行方式重叠形成键;B. 极性键只能形成极性分子;C. 非极性键形成非极性分子;D. 形成配位键的条件是一方有空轨道,另一方有孤对电子;E. 共价键形成的条件是欲成键原子必须有未成对电子.29.下列说法正确的是( )A. 极性分子间仅存在取向力;B. 取向力只存在于极性分子之间;C. 熔沸点依次升高;D. 氨易溶于水,是因为氨与水分子间可形成氢键;E. 色散力仅存在于非极性分子间.30.下列关于分子间力的说法正确的是( )A. 分子型物质的沸点总是随分子量的增大而增加的;B. 大多数含氢化合物中都存在氢键;C. 极性分子间仅存在取向力;D. 色散力存在于所有相邻分子间.31.原子间成键时,同一原子中能量相近的某些原子轨道要先杂化,其原因是( )A. 保持共价键的方向性;B. 进行电子重排;C. 增加成键能力;D. 使不能成键的原子轨道能够成键.32.在酒精的水溶液中,分子间主要存在的作用力为( )A. 取向力B. 诱导力C. 色散力和诱导力.取向力D. 取向力.诱导力.色散力.氢键33.下列物质中键级最小的是( )A. O2B. N2C. F2D. O2+二.填空题1.<1>. 离子键是指_____________________________所成的化学键.<2>. 离子键主要存在于______________________中.2.<1>. 三十年代以来共价键的两大主要理论为__________________.<2>. 共价键的特征是________________________________ 3.下列物质的变化各主要需打破或克服什么结合力? <1>. 冰熔化_____ <2>. 单质硅熔化_____4. 同周期元素离子电子层构型相同时,随离子电荷数增加,阳离子半径____, 阴离子半径________.5. 下列热化学方程式的能量变化各表示什么含义? △H ø(KJ/mol)例 Na(s)+½Cl 2(g)=NaCl(s) (生成焓) <1>. HCl(g)=H(g)+Cl(g) 428 ( ) <2>. Na +(g)+Cl -(g)=NaCl(s) ( ) 6.<1>. 对于双原子分子,键能与键的离解能的关系是______________.<2>. 对于多原子分子,键能与键的离解能的关系是_______________ 7.一般来说,键能越大,键越________,由该键构成的分子越_______. 8.MO 法中成键电子数与反键电子数之差的一半就是分子的键级.键级的大小表示两个相邻原子之间成键的_________,键级越大,键越___________. 9.等性sp 2、sp 3杂化轨道的夹角分别为.10. 分子间力按产生的原因和特性一般分为取向力、诱导力、色散力. <1>. 取向力存在于__________________________________之间;<2>. 诱导力存在于___________________________________之间。
分子结构练习题

分子结构练习题一、填空题1.O2+的分子轨道电子排布式为,N2+的分子轨道电子排布式为,它们的键级为:O2+,N2+,它们在磁场中均呈现。
2. CO32—、NF3、POCl3、PCl5、BF3中,中心原子的杂化方式依次为,其中杂化轨道中有孤对电子的物种有,有d轨道参与杂化的物种有.3.根据价层电子对互斥理论可推知ICl4-共有对价层电子对,离子的空间构型为,中心原子采用的杂化方式为。
4.SiF4中硅原子的杂化方式为,分子间键角为,SiF62-中硅原子的杂化方式为,离子中键角为。
5.由原子轨道线性组合成分子轨道必须遵守的三个原则是①;②;③。
6.COCl2(∠ClCCl =120º,∠OCCl =120º)中心原子的杂化轨道的类型是;PCl3(∠ClPCl =101º)中心原子的杂化轨道类型是。
7.B2分子的分子轨道排布式为,分子的键级是。
8.一般来说,键能越大,键越________,由该键构成的分子越_______。
9.MO法中成键电子数与反键电子数之差的一半就是分子的键级。
键级的大小表示两个相邻原子之间成键的_________,键级越大,键越___________。
10.等性sp2、sp3杂化轨道的夹角分别为_______. 。
11.分子的磁性主要是由______________________________所引起的.13. 共价键形成的主要条件是:<1〉。
____________________________〈2〉.____________________________________________________.14。
共价键按两原子间共用电子对数可分为__________和_________.15。
共价键的强度一般用___________和__________表示.16。
在核间距相等时,σ键稳定性比π键稳定性___,故π电子比σ电子17. 共价键按共用电子对来源不同分为_____________和___________;共价键按轨道重叠方式不同分为_______________和_____________.18。
分子结构 习题答案

2、 结合Cl 2的形成,说明共价键形成的条件。
共价键为什么有饱和性共价键形成的条件:原子中必须有单电子,而且成单电子的自旋方向必须相反。
共价键有饱和性是因为:一个原子的一个成单电子只能与另一个成单电子配对,形成一个共价单键。
一个原子有几个成单电子便与几个自旋相反的成单电子配对成键。
电子配对后,便不再具有成单电子了,若再有单电子与之靠近,也不能成键了。
例如:每一个Cl 原子有一个带有单电子的p 轨道,相互以头碰头的形式重叠可以形成共价单键,且只能形成一个单键。
3、 画出下列化合物分子的结构式并指出何者是键,何者是键,何者是配位键。
H HHΖ?δδσσσPN I I IΖ?δδσσσN N N H H H H σσσσσ 膦PH 3, 三碘化氮NI 3 肼N 2H 4(N —H 单键)c C c H H HH σσσσσπ N NN O O o O H σσσσσππππ,乙烯, 四氧化二氮(有双键)。
4.PCl 3的空间构型是三角锥形,键角略小于10928,SiCl 4是四面体形,键角为10928,试用杂化轨道理论加以说明。
杂化轨道理论认为,在形成PCl 3分子时,磷原子的一个3s 轨道和三个 3p 轨道采取sp 3杂化。
在四个sp 3杂化轨道中,有一个杂化轨道被一对孤电子对所占据,剩下的三个杂化轨道为三个成单电子占据,占据一个sp 3杂化轨道的一对孤电子对,由于它不参加成键作用,电子云较密集于磷原子的周围,因此孤电子对对成键电子所占据的杂化轨道有排斥作用,为不等性杂化,所以键角略小于109°28′。
而在SiCl 4分子中,为等性杂化,没有不参加成键的孤电子对,四个杂化轨道都为四个成单电子占据,不存在孤电子对对成键电子对所占据杂化轨道的排斥作用,所以键角为109°28′。
5. 判断下列物种的几何构型,并指出中心原子采取何种杂化方式。
(1) AsF 4 (2) XeOF 3 (3) SF 5 (4) Cl 2CO(5) HO 2 (6) HNO 3 (7) I 3 (8) I 3分子式 杂化方式 电子对构型 分子构型AsF 4sp 3d三角双锥四角锥XeOF 3 sp 3d 三角双锥四角锥SF 5sp 3d三角双锥三角双锥Cl 2COsp 2平面正三角形C OClCl平面三角形HO 2 sp 3 角形O OHHNO 3 sp 2 平面正三角形N OOOH平面三角形I 3 sp 3 四面体 角形I 3- sp 3d三角双锥 直线形6、 试用价层电子对互斥理论写出下列各分子的分子构型,并用杂化轨道理论加以说明。
原子结构-化学键-分子结构

原子结构-化学键-分子结构work Information Technology Company.2020YEAR原子结构、化学键、分子结构习题1.判断下列叙述是否正确(1)电子具有波粒二象性,故每个电子都既是粒子又是波。
(2)电子的波动性是大量电子运动表现出的统计性规律的结果。
(3)波函数,即电子波的振幅。
(4)波函数Ψ,即原子轨道,是描述电子空间运动状态的数学函数式。
(1)(2)(3)(4)2. 用原子轨道光谱学符号表示下列各套量子数:(1) n =2, l = 1, m = –1 (2) n =4, l = 0, m =0 (3) n =5, l = 2, m =02 (1)2p (2) 4s (3) 5d3. 假定有下列电子的各套量子数,指出哪几套不可能存在,并说明原因。
(1) 3,2,2,1/2 (2) 3,0,–1,1/2 (3) 2, 2, 2, 2(4) 1, 0, 0, 0, (5) 2,–1,0, –2/1 (6) 2,0,–2,1/23. (1)存在,为3d 的一条轨道;(2) 当l=0时,m只能为0,或当m=±1时,l可以为2或1。
(3) 当l=2时,n应为≥3正整数,m s=+1/2或-1/2;或n=2时l=0 m=0 m s=+1/2或-1/2;l=1 m=0或±1,m s=+1/2或-1/2;(4)m s=1/2或–1/2 ;(5)l不可能有负值;(6)当l=0时,m只能为04.指出下列各电子结构中,哪一种表示基态原子,哪一种表示激发态原子,哪一种表示是错误的?(1)1s22s2 (2) 1s22s12d1 (3) 1s22s12p2(4) 1s22s22p13s1 (5) 1s22s42p2 (6) 1s22s22p63s23p63d15.符合下列每一种情况的各是哪一族哪一元素?(1)最外层有6个p电子。
(2)3d轨道无电子,n =4,l = 0的轨道只有1个电子。
DNA分子结构练习题

一、选择题1.下列关于DNA结构的叙述中,错误的是( )A.大多数DNA分子由两条核糖核苷酸长链盘旋而成为螺旋结构B.外侧是由磷酸和脱氧核糖交替连接构成的基本骨架,内侧是碱基C.DNA两条链上的碱基间以氢键相连,且A与T配对,C与G是配对D.DNA的两条链反向平行解析:绝大多数DNA分子由两条脱氧核苷酸长链盘旋而成为双螺旋结构,而不是由核糖核苷酸长链盘旋而成,核糖核苷酸是RNA的基本组成单位。
答案:A2.如图为核苷酸的模式图,下列相关说法正确的是( )A.DNA与RNA在核苷酸上的不同点只在②方面B.如果要构成ATP,只要在①位置上加上两个磷酸基团C.③在超级细菌遗传物质中只有4种D.DNA分子中每个②均与一个①相连解析:图中①为磷酸,②为五碳糖,③为含氮碱基。
DNA与RNA在核苷酸上除在②方面不同外(DNA含有脱氧核糖,RNA含有核糖),还表现在③上(DNA含碱基T,RNA含碱基U),A错误;如果要构成ATP,应在①位置上加上2个磷酸基团,且③应为腺嘌呤,B错误;超级细菌的遗传物质是DNA,③在超级细菌遗传物质中只有A、T、C、G 4种,C正确;DNA分子中每个②均与两个①相连,D错误。
答案: C3.某DNA分子中A+T占整个DNA分子碱基总数的44%,其中一条链(a)上的G占该链碱基总数的21%,那么,对应的另一条互补链(b)上的G占该链碱基总数的比例是( )A.35% B.29% C.28% D.21%解析:整个DNA中的(A+T)占整个DNA碱基总数的44%,则(G+C)占整个DNA碱基总数的56%,又因整个DNA分子中(G+C)所占比例与每一条链上(G+C)所占该链碱基总数的比例相等,可知b链上(G+C)=56%,其中G(a链)=21%,C(b 链)=21%,推出G(b链)=35%。
答案: A4.下面关于DNA分子结构的叙述中,不正确的是( )A.每个DNA分子中含有四种脱氧核苷酸B.DNA分子的两条链反向平行C.DNA两条链上的碱基以氢键相连,且A与T配对,G与C配对D.每个脱氧核糖上均连接一个磷酸和一个含氮碱基答案: D5.如图是一个DNA分子的片段,从图中不能得到的信息是( )A.DNA是双螺旋结构B.碱基严格互补配对C.嘌呤数等于嘧啶数D.两条脱氧核苷酸链反向平行解析:由图示可以看出,DNA是双螺旋结构,且两条链之间碱基严格互补配对,即嘌呤数等于嘧啶数;从图中不能看出两条链的方向。
DNA分子结构练习题

DNA分子结构练习题一、单选题1、下列哪一项不是DNA的基本组成单位?A.核糖核酸B.脱氧核糖核酸C.磷酸和脱氧核糖交替连接的化合物D.碱基、脱氧核糖和磷酸组成的化合物正确答案:A.核糖核酸。
2、下列哪一项不是DNA分子结构的特点?A.由两条反向平行的多核苷酸链组成B.脱氧核糖和磷酸交替连接形成的基本骨架位于双链的外侧C.碱基之间以氢键连接,形成了碱基对D.两股链之间的横桥连接形成了双螺旋结构正确答案:D.两股链之间的横桥连接形成了双螺旋结构。
1、DNA分子结构中,哪些部分组成了双链?A.两条反向平行的多核苷酸链B.脱氧核糖和磷酸交替连接形成的基本骨架C.碱基之间以氢键连接,形成了碱基对D.两股链之间的横桥连接形成了双螺旋结构正确答案:A.两条反向平行的多核苷酸链和C.碱基之间以氢键连接,形成了碱基对。
2、DNA分子结构中,哪些部分构成了基本骨架?A.脱氧核糖和磷酸交替连接形成的基本骨架位于双链的内侧B.脱氧核糖和磷酸交替连接形成的基本骨架位于双链的外侧C.碱基、脱氧核糖和磷酸组成的化合物构成了基本骨架正确答案:B.脱氧核糖和磷酸交替连接形成的基本骨架位于双链的外侧和C.碱基、脱氧核糖和磷酸组成的化合物构成了基本骨架。
1、DNA分子结构中,两股链之间的横桥连接形成了双螺旋结构。
()错误。
DNA分子结构中,两股链之间通过互补配对原则形成碱基对,且双螺旋结构是由脱氧核糖和磷酸交替连接形成的基本骨架在外侧构成的。
2、DNA分子结构中,碱基排列顺序的千变万化构成了DNA分子的多样性。
()正确。
碱基排列顺序的千变万化是DNA分子多样性的原因之一。
DNA分子复制练习题一、选择题1、在DNA复制过程中,下列哪一项不是必须的?A.解旋酶B. DNA聚合酶C.引物D.螺旋酶正确答案是:D.螺旋酶。
在DNA复制过程中,螺旋酶不是必须的,因为DNA双螺旋结构在高温下会自动打开,不需要螺旋酶来破坏双螺旋结构。
2、下列哪一种酶不是参与DNA复制的?A. DNA聚合酶B.解旋酶C.引物酶D.连接酶正确答案是:D.连接酶。
化学高二分子的空间结构练习题

化学高二分子的空间结构练习题一、选择题1. 分子的空间结构是指分子中原子的_________。
a) 排列顺序b) 互相间的连通性c) 体积分布d) 堆积方式2. 分子的线性结构通常包含___________。
a) 单键b) 双键c) 三键d) 非键电子对3. 以下哪个是单键的空间结构?a) 氯气b) 氨气c) 氧气d) 硫气4. 分子的平面结构通常包含___________。
a) 单键b) 双键c) 三键d) 非键电子对5. 分子的立体结构通常涉及到___________。
a) 双键b) 三键c) 键角d) 非键电子对二、填空题1. 由于氯原子的电负性较大,氯原子所在的分子通常会呈现___________的空间结构。
2. 卤素分子中,键角最大的是___________。
3. 饱和烃类分子中,碳原子通常采取___________的空间结构。
4. 碳原子形成___________的空间结构,使得有机化合物具有丰富多样的结构。
5. 氨分子的空间结构是___________。
三、简答题1. 请解释键角对于分子空间结构的影响。
2. 请说明分子间的氢键如何影响分子的空间结构。
3. 请解释立体异构体的概念,并给出一个例子说明。
四、综合题1. 请给出一种具有线性结构的有机物,并描述其空间结构特点。
2. 请给出一种具有平面结构的无机分子,并描述其空间结构特点。
3. 请给出一种具有立体结构的有机物,并描述其空间结构特点。
(文章正文结束)。
2023-2024学年九年级物理上册《第十章 内能》同步练习题含答案(北师大版)

2023-2024学年九年级物理上册《第十章内能》同步练习题含答案(北师大版)学校:___________班级:___________姓名:___________考号:___________一、选择题1. 关于物质的构成,下列说法正确的是( )A. 分子的直径很小,一般为10-10cmB. 可以借助光学显微镜观察到分子C. 常见物质是由分子、原子构成的D. 大雾天,我们看到的小水珠就是分子2. 下列现象中属于扩散现象的是()A. 扫地时灰尘飞舞B. 下雪时雪花飘飘C. 暴雨后河水浑浊D. 八月桂花飘香3. 下列现象中,能说明分子在做无规则运动的是()A.春天柳枝摇曳B.夏天荷花飘香C.秋天落叶飞舞D.冬天瑞雪飘飘4.无锡中考如图所示,“天宫课堂”上王亚平老师将两块透明板上的水球接触后粘在一起,慢慢拉开板后形成一个长长的“液桥”,该现象主要说明了()A.水分子间有空隙B. 水分子间存在吸引力C. 水分子间存在排斥力D. 水分子处在永不停息的无规则运动中5. 用分子的知识解释生活中的现象,其中合理的是()A. 酒精挥发说明酒精分子的体积增大B. 用高强度的钛材料做成的钛管很难被拽长,说明钛分子间存在斥力C. 流感病毒之所以传播的快,是因为分子运动得快造成的D. 香水香说明分子在不断地做无规则运动6. 把干净的玻璃板吊在弹簧测力计的下面,记下测力计的示数,如图所示让玻璃板的下表面接触水面,然后稍稍用力向上拉,发现弹簧测力计示数变大,其原因是玻璃板与水的接触面之间存在( )A. 摩擦力B. 分子引力C. 分子斥力D. 大气压力7. 将复写纸夹在两张白纸之间后放在水平桌面上,再分别取两个盛有等量冷水和热水的相同铝质易拉罐压在纸上。
一段时间后,发现纸上留下痕迹的颜色深浅不同。
该现象说明()A. 分子热运动与温度有关B. 分子间存在引力C. 分子间存在斥力D. 分子间有空隙8. 老师在引导学生理解固体、液体和气体的微观结构时,带领学生做游戏,用人群的状态类比物质的状态。
10 分子结构习题解答0

10 分子结构4510 分子结构习题解答(p309-311)1. 答案:DB BABBDDC2. 在下列各题的横线处填上正确的文字,符号或数值(1) 极性分子间的取向力由__偶极作用_产生,诱导力由__诱导偶极作用__产生。
色散力由瞬时偶极作用产生。
一般分子间力多以色散力为主。
(2)分子中的电子在分子轨道中的排布应遵循_能量最低原理_、Pauli不相容原理、Hund规则三规则。
对 2p轨道来说是__2___重简并的。
(3) HI分子间的作用力有_色散力、取向力和诱导力_,其中主要的作用力是色散力。
(4) 在HF分子中,分子轨道的类型有__3σ__、____1π____和____4σ____轨道。
通常_____1π___轨道与相应的原子轨道能量相等或相近。
(5) SO2的极化率比O3的____大____,C3H8比C2H6的极化率_____大___。
(6) A、B两元素同属第三周期,A单质在常温下为气体,B元素的原子序数比A 少3,A、B两元素形成的常见化合物分子式为__SiCl4___,其中心原子采用的杂化轨道是__sp3__,分子的空间构型为__正四面体_A、B原子间成键所用的轨道是_sp3-p__。
(7) 根据价层电子对互斥理论,确定下列分子或离子的几何形状:SO42-为__正四面体形__,PO43-为_正四面体形_,XeO4为_正四面体形_,XeO3为___三角锥形___。
(8) 按照杂化轨道理论,原子轨道发生等性杂化时,原子轨道的形状、_大小、伸展方向等_都发生改变。
形成的杂化轨道能量(或成键能力)相等。
(9) SCl2的空间构型为_角形_,中心原子采用__不等性sp3__杂化方式,有__2___对孤对电子,分子偶极矩__不等于_零。
(10) 对于下列分子的有关性质:A. NH3分子的空间构型;B. CH4分子中H-C-H的键角;C. O2分子的磁性;D. H2O分子的极性;可以用杂化轨道理论予以说明的有__A B D_,不能用杂化轨道理论说明的有_C_。
大学化学分子结构习题带答案

1.离子晶体中的化学键都是离子键。
()1.错2.CO 分子含有配位键。
()2.对3.所有分子的共价键都具有饱和性与方向性,而离子键没有饱和性与方向性。
()3.错4. 中心原子所形成的杂化轨道数等于参加杂化的原子轨道数。
()4.对5. 原子轨道发生杂化后可以增强成键能力。
()5.对6. 杂化轨道具有能量相等、空间伸展方向一定的特征。
()6.对7. 凡是中心原子采取sp3杂化轨道成键的分子,其空间构型都是正四面体。
()7.错8. 在任何情况下,每一个sp2杂化轨道所含的s、p成分均相同。
()8.错9. 由分子轨道理论可推知 O2-、O22-都比 O2稳定。
()9.错10. 按照分子轨道理论,N2+和 N2-的键级相等。
()10.对11. 色散力存在于一切分子之间。
()11.对12. 弱极性分子之间的分子间力均以色散力为主。
()12.对13. 氢键只存在于 NH3、H2O、HF 的分子之间,其它分子间不存在氢键。
()13.错14. 根据价层电子对互斥理论,分子或离子的空间构型取决于中心原子的价层电子对数。
()14.对15. 对 AB m型分子 ( 或离子 ) 来说,当中心原子 A 的价电子对数为 m 时,分子的空间构型与电子对在空间的构型一致。
()15.对16. AsF5是三角双锥形分子。
()16.错17. SO42-、ClO4-、PO43-的空间构型相同。
()17.对18. 下列化合物中既有离子键又有共价键和配位键的是()。
18.D(A) KF; (B) H2SO4; (C) CuCl2; (D) NH4NO3。
19. 关于离子键的本性,下列叙述中正确的是()。
19.D(A) 主要是由于原子轨道的重叠; (B) 由一个原子提供成对共用电子;(C) 两个离子之间瞬时偶极的相互作用; (D) 正、负离子之间的静电吸引为主的作用力。
20. 下列各组卤化物中,离子键成分大小顺序正确的是()。
20.A(A) CsF > RbCl > KBr > NaI;(B) CsF > RbBr > KCl > NaF;(C) RbBr > CsI > NaF > KCl;(D) KCl > NaF > CsI > RbBr。
高二化学分子结构练习题及答案

高二化学分子结构练习题及答案一、选择题1. 以下物质中具有离子键的是:A. 水B. 乙烷C. 氯化铜D. 甲烷答案:C2. 分子中存在单独的分子之间以氢键连接的是:A. 液氨B. 哌嗪C. 碳酸氢铵D. 乙烯答案:B3. 以下物质中属于共价键的是:A. 氮化锂B. 磷酸氢二铵C. 氧化钠D. 氢氧化钠答案:B4. 下列化学式中,哪一种有极性键?A. HClB. O₂C. COD. N₂答案:A5. 以下物质中,氧、氮、碳原子的电子结构分别是:A. 2,5,6B. 2,8,6C. 2,7,5D. 2,5,4答案:B二、填空题1. 具有分子式 C₃H₈O 的化合物有 ______ 种同分异构体。
答案:32. 分子式为 H₂O₂的化合物是 ______。
答案:过氧化氢3. 以下化学键属于离子键的是 ______。
答案:NaCl4. 以下物质中,属于分子式的是 ______。
答案:CO₂5. 共价键中,电子的共用是指 ______。
答案:原子间电子云的重叠三、解答题1. 说明离子键的形成原理及特点,并给出一个具体例子。
答案:离子键是由于两种或多种不同电负性原子之间电子的转移而形成的。
在化学键中,较强的电负性原子会从较弱的电负性原子那里接受一个或多个电子,形成带正电荷的离子和带负电荷的离子,互相吸引而形成化学键。
离子键通常在金属与非金属元素之间形成。
例如,氯化钠(NaCl)中钠原子会失去一个电子,形成正离子Na⁺,而氯原子会获得一个电子,形成负离子Cl⁻,它们通过电子的吸引力相互结合,形成离子键。
离子键的特点包括:离子键通常是由金属离子和非金属离子之间形成的,它们具有强的电荷吸引力;离子键的键能通常较高,所以离子化合物具有较高的熔点和沸点;离子键在溶液中能够导电,因为带电的离子能够自由移动。
2. 说明共价键的形成原理及特点,并给出一个具体例子。
答案:共价键是由于两个或多个非金属原子之间的原子间电子云的重叠而形成的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十章分子结构习题一.选择题1.最早指出共价键理论的是( )2. A. 美国的路易斯; B. 英国的海特勒;3. C. 德国的伦敦; D. 法国的洪特.4.NH4+形成后,关于四个N-H键,下列说法正确的是( )A. 键长相等;B. 键长不相等;C. 键角相等;D. 配位键的键长大于其他三键;E. 配位键的键长小于其他三键.5.下列说法中不正确的是( )A. σ键的一对成键电子的电子密度分布对键轴方向呈园柱型对称;B. π键电子云分布是对通过键轴的平面呈镜面对称;C. σ键比π键活泼性高,易参与化学反应;D. 配位键只能在分子内原子之间形成,不可以在分子间形成;E. 成键电子的原子轨道重叠程度越大,所形成的共价键越牢固.6.CO和N2的键级都是3,两者相比CO的( )A. 键能较小,较易氧化;B. 键能较小,较难氧化;C. 键能较大,较难氧化;D. 键能较大,较易氧化.7.下列分子或离子中,键角最小的是( )A. HgCl2B. H2OC. NH3D. PH38.下列说法正确的是( )A. 原子形成的共价键数等于游离气态原子中不成对电子数;B. 同种原子双键的键能为单键键能的两倍;C. 键长是指成键原子的核间距离;D. 线性分子如A-B-C是非极性的;E. 共价键的极性是由成键元素的电负性差造成的.9.关于原子轨道的说法正确的是( )A.凡中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体.B. CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的;C. sp3杂化轨道是由同一原子中能量相近的s轨道和p轨道混合起来形成的一组能量相等的新轨道;D. 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键.10.下列化合物中氢键最强的是( )A. CH3OHB. HFC. H2OD. NH311.对羟基苯甲醛比邻羟基苯甲醛的熔沸点高的原因是( )A. 前者不能形成氢键,后者能形成氢键;B. 前者能形成氢键,后者不能形成氢键;C. 前者形成分子间氢键,后者形成分子内氢键;D. 前者形成分子内氢键,后者形成分子间氢键.12.下列各组物质沸点高低顺序中正确的是( )A. HI>HBr>HCl>HFB. H2Te>H2Se>H2S>H2OC. NH3>AsH3>PH3D. CH4>GeH4>SiH413.I2的CCl4溶液中分子间主要存在的作用力是( )A. 色散力B. 取向力C. 取向力.诱导力.色散力D. 氢键.诱导力.色散力14.下列分子中有最大偶极矩的是( )A. HIB. HClC. HBrD. HF15.下列分子中偶极矩为零的是( )A. NF3B. NO2C. PCl3D. BCl316.下列分子是极性分子的是( )A. BCl3B. SiCl4C. CHCl3D. PCl3E. BeCl217.下列离子或分子有顺磁性的是( )A. O2B. O22-C. N2D. NOE. NO+18.加热熔化时需要打开共价键的物质是( )A. MgCl2B. CO2(s)C. SiO2D. H2O19.某元素E具有(Ar)3d24s2电子排布,它和溴生成符合族数的溴化物分子式是( )A. EBr3B. EBr2C. EBr4D. EBr20.关于共价键的说法,下述说法正确的是( )A. 一般来说σ键键能小于π键键能;B. 原子形成共价键的数目等于基态原子的未成对电子数;C. 相同原子间的双键键能是单键键能的两倍;D. 所有不同原子间的键至少具有弱极性.21.CO和N2相比,CO的( )A. 键能较小,较易氧化;B. 键能较小,较难氧化;C. 键能较大,较难氧化;D. 键能较大,较易氧化.22.下列分子中心原子是sp2杂化的是( )A. PBr3B. CH4C. BF3D. H2O23.SO42-离子的空间构型是( )A. 平面正方形B. 三角锥形C. 四面体D. 八面体24.下列各物质分子其中心原子以sp2杂化的是( )A. H2OB. NO2C. SCl2D. CS225.用价键法和分子轨道法处理O2分子结构,其结果是( )A. 键能不同B. 磁性不同C. 极性不同D. 结果不同26.下列关于O22-和O2-的性质的说法,哪组不正确( )A. 两种离子都比O2分子稳定性小;B. O2-的键长比O22-的键长长;C. 键级次序是O2>O2->O22-;D. O2-是反磁性的,但O22-是顺磁性的.27.下列关于化学键正确的说法是( )A. 原子与原子之间的作用;B. 分子之间的一种相互作用;C. 相邻原子之间的强烈相互作用;D. 非直接相邻的原子之间的相互作用.28.下列各题说法不正确的是( )A. 两个原子的P电子只能沿P轨道对称轴平行方式重叠形成 键;B. 极性键只能形成极性分子;C. 非极性键形成非极性分子;D. 形成配位键的条件是一方有空轨道,另一方有孤对电子;E. 共价键形成的条件是欲成键原子必须有未成对电子.29.下列说法正确的是( )A. 极性分子间仅存在取向力;B. 取向力只存在于极性分子之间;C. HF.HCl.HBr.HI熔沸点依次升高;D. 氨易溶于水,是因为氨与水分子间可形成氢键;E. 色散力仅存在于非极性分子间.30.下列关于分子间力的说法正确的是( )A. 分子型物质的沸点总是随分子量的增大而增加的;B. 大多数含氢化合物中都存在氢键;C. 极性分子间仅存在取向力;D. 色散力存在于所有相邻分子间.31.原子间成键时,同一原子中能量相近的某些原子轨道要先杂化,其原因是( )A. 保持共价键的方向性;B. 进行电子重排;C. 增加成键能力;D. 使不能成键的原子轨道能够成键.32.在酒精的水溶液中,分子间主要存在的作用力为( )A. 取向力B. 诱导力C. 色散力和诱导力.取向力D. 取向力.诱导力.色散力.氢键33.下列物质中键级最小的是( )A. O2B. N2C. F2D. O2+二.填空题1.<1>. 离子键是指_____________________________所成的化学键.<2>. 离子键主要存在于______________________中.2.<1>. 三十年代以来共价键的两大主要理论为__________________.<2>. 共价键的特征是________________________________3.下列物质的变化各主要需打破或克服什么结合力?<1>. 冰熔化_____ <2>. 单质硅熔化_____4.同周期元素离子电子层构型相同时,随离子电荷数增加,阳离子半径____,阴离子半径________.5.下列热化学方程式的能量变化各表示什么含义?△Hø(KJ/mol)例Na(s)+½Cl2(g)=NaCl(s) -410.9 (生成焓)<1>. HCl(g)=H(g)+Cl(g) 428 ( )<2>. Na+(g)+Cl-(g)=NaCl(s) -770.8 ( )6.<1>. 对于双原子分子,键能与键的离解能的关系是______________.<2>. 对于多原子分子,键能与键的离解能的关系是_______________7.一般来说,键能越大,键越________,由该键构成的分子越_______.8.MO法中成键电子数与反键电子数之差的一半就是分子的键级.键级的大小表示两个相邻原子之间成键的_________,键级越大,键越___________.9.等性sp2、sp3杂化轨道的夹角分别为_______._____.10.分子间力按产生的原因和特性一般分为取向力、诱导力、色散力.<1>. 取向力存在于__________________________________之间;<2>. 诱导力存在于___________________________________之间。
11.分子的磁性主要是由______________________________所引起的.由极性键组成的多原子分子的极性是由__________________决定的.12.共价键按成键电子对来源不同分为________________和________.13.共价键形成的主要条件是:<1>.____________________________<2>.____________________________________________________.14.共价键按两原子间共用电子对数可分为__________和_________.15.共价键的强度一般用___________和__________表示.16.在核间距相等时,σ键稳定性比π键稳定性___,故π电子比σ电子___.17.共价键按共用电子对来源不同分为_____________和___________;共价键按轨道重叠方式不同分为_______________和_____________.18.SO32-和SO42-的空间构型分别为___________和____________,19.碳原子在下列各式中,杂化形式分别是:(1)CH3Cl _____________ ,(2)CO32- _________20.氢键键能和分子间力的数量级相近,它与一般分子间力的不同点是具有_____________ 和___________.21.顺磁性物质的磁矩大小除可由实验间接测定外还可依公式_______计算,该磁矩的单位是___________________.22.偶极矩是衡量_________________的物理量,偶极矩(u)的数学表达式为___________23.VB法成键三原理是:<1>.电子配对原理;<2>.__________;<3>.__________ .24.共价键具有饱和性的原因是______________________________.共价键具有方向性的原因是__________________________________.25.F原子中2s和2p原子轨道能差较大,故F2分子的分子轨道能级E(σ2p)______E(π2p);B原子中2s和2p原子轨道能差较小,故B2分子的分子轨道能级E(σ2p)______E(π2p).26.2s与2s原子轨道可组成两个分子轨道,用符号______________表示,分别称__________________轨道.27.原子轨道用_____________等符号表示轨道名称,而分子轨道用________等符号表示轨道名称.28.原子轨道组成分子轨道的原则是<1>.对称性原则,<2>._____________,<3>________________.三.问答题1.sp型杂化可分为哪几种? 各种的杂化轨道数及所含s成分p成分各多少?2.试述共价键的形成条件.本质和特点.3.什么叫σ键,什么叫π键,二者有何区别?4.什么是杂化和杂化轨道?杂化轨道的数目与什么有关?5.以NH3分子为例,说明不等性杂化的特点.6.BF3分子构型是平面三角形,而NF3分子构型是三角锥形,试用杂化轨道理论解释.7.用杂化理论描述CCl4的生成和分子构型.8.为什么H2O分子的键角既不是90°也不是109°28′而是104.5°?9.CH4、H2O、NH3中心原子杂化态皆是sp3,其键角大小是否相同?为什么?其空间构型各为何?10.N2的键能比N2+键能大,而O2的键能比O2+键能小,试用分子轨道法解释.11.用VB法和MO法说明H2稳定存在,He2不能稳定存在的原因.12.用VB法和MO法说明O2的分子结构.13.用分子轨道法讨论N2、N2+的稳定性和磁性.14.写出N2、O2分子轨道表示式.并比较二者稳定性大小.15.CH4和NH3分子中心原子都采取sp3杂化,但二者的分子构型不同,为什么?四.计算题1.已知锂的升华热(S)为159kJ·mol-1,锂的第一电离势(I)为520.2kJ·mol-1,F2的离解势(D)为155.5kJ·mol-1,F的电子亲合势(E)为-349.3kJ·mol-1,氟化锂的生成热(△Hø)为-612kJ·mol-1,.求LiF(s)的晶格能(U)是多少?2.已知: Na(s)+½F2(g)=NaF(s) △Hø=-576kJ·mol-1Na+(g)+F-(g)=NaF(s) △Hø=-920kJ·mol-1Na(s)=Na(g) △Hø=102kJ·mol-1F2(g)=2F(g) △Hø=159kJ·mol-1F(g)+e=F-(g) △Hø=-340kJ·mol-1求Na的电离能.3.已知甲烷的生成热为-74.9kJ·mol-1,原子氢的生成热为218kJ·mol-1,碳的升华热为718kJ·mol-1,试求C-H的键能(提示:CH4分子中C-H的键能为CH4分子离解能的).4.已知: H2的键能D(H-H)=436kJ·mol-1Cl2的键能D(Cl-Cl)=247kJ·mol-1HCl的生成热△H0f(H-Cl)=-92.5kJ·mol-1求HCl的键能.第七章分子结构习题答案一、选择题二.填空题1.<1>. 阴.阳离子间通过静电作用<2>. 离子晶体(或离子化合物)2.<1>. 现代价键理论(VB法)和分子轨道理论(MO法)<2>. 既有饱和性又有方向性。
