分子结构-答案
分子结构练习及参考答案

专题9 分子结构一、选择题:1.以下物质种,含有非极性共价键的离子化合物是〔〕A、Na2O2B、NaOHC、H2O2D、MgCl22.以下物质中,含有极性共价键的是〔〕〔1〕N2(2)H2O (3)CCl4(4)Na2O2(5)NaOH (6)Na2OA、〔1〕〔2〕〔3〕 B.〔4〕〔5〕〔6〕C、〔2〕〔3〕〔5〕D(2)(4)(6)3.A原子的L电子层比B原子的L电子层少3个电子,B原子核外的电子总数比A原子电子总数多5个,那么A、B可能形成( )A、离子化合物B2A3B、离子化合物B3A2 C.共价化合物B3A2D、共价化合物BA24、根据“相似相溶〞的规律,以下溶剂可以用来从溴水中萃取溴的是〔〕(1)酒精〔2〕CCl4〔3〕液氨〔4〕苯〔5〕直馏汽油A、〔1〕〔2〕〔4〕〔5〕B、〔2〕〔4〕〔5〕C、〔1〕〔3〕〔5〕D、〔1〕〔3〕〔4〕5.以下各组物质中,化学键类型相同,分子的极性也相同的是〔〕A SO2和CH4B、CO2和CCl4C、SO2和CO2D、NH3和CCl46.含有极性键的非极性分子是〔〕(1)SO2(键角119ο)〔2〕CS2(直线型)〔3〕CCl4(4)NH3(5)CH2Cl2(6)BF3(平面正三角形)A、〔2〕〔3〕〔4〕B、〔1〕〔4〕〔6〕C、〔2〕〔3〕〔6〕D、〔2〕〔3〕〔5〕7.关于化学键的表达,正确的选项是〔〕A.离子化合物可能含共价键B.共价化合物可能含离子键C.离子化合物中只含离子键D.共价化合物中不含离子键8.以下分子中所含原子都满足最外层8电子结构的是〔〕A、光气〔COCl2〕 B.六氟化硫C、二氟化氙D、三氟化硼9.以下分子的结构中,原子的最外层电子不能满足8电子稳定结构的是〔〕A、CO2B、PCl3C、CCl4D、NO210.以下各分子中所有原子都满足最外层8电子结构的是〔〕A、BeCl2B、PCl3 C、PCl5 D、N211.以下性质中,可以证实某化合物内一定存在离子键的是〔〕A、可溶于水B、具有较高的熔点C、水溶液可以导电D、熔融状态能导电12、最近科学家研制的一种新分子,它具有空心的类似于足球的结构,分子式为C60,以下说法正确的选项是〔〕A、C60是一种新型的化合物B、C60和石墨都是碳的同素异形体C、C60中含有离子键D、C60的相对分子质量是720二、填空题:13、写出以下物质的电子式:〔1〕Cl2____________(2)N2_____________(3)HCl_______________(4)NH3_______________ 〔5〕H2O___________(6)H2O2___________(7)CO2____________(8)CH4________________ (9)PCl3____________(10)NaCl____________(11)MgCl2__________〔12〕Na2S____________ (13)NaOH___________(14)Na2O2__________(15)NH4Cl__________(16)甲基_____________ 17〕羟基__________〔18〕醛基___________〔19〕乙烯_________〔20〕乙炔______________ 〔21〕甲酸_______________14、用电子式表示以下物质的形成过程:(1)H2_____________________________________(2)HCl_______________________________ (3)H2S____________________________________(4)NH3______________________________ (5)KCl____________________________________(6)CaCl2_____________________________ (7)K2S___________________________________(8)BaCl2_____________________________________________ 15、化合物A是一种不稳定的物质,它的分子组成可用O x F y表示,10Ml氧气和10Ml氟气〔同温同压〕下,试答复:(1)A的化学式______________,理由______________________________(2)A分子中,x个氧原子呈-O-O-键状排列,每一根短线代表_________,A的电子式为____________,A分子的结构式为______________________.答案:1、A2、C3、B4、B5、B6、C7、AD8、A 9、D 10、BD 11、D 12、BD15、O3F2;1mol A分解产生了3mol O 原子,2mol F原子;在同温同压,体积比等于物质的量的比. F-O-O-O-F .。
分子结构练习20题

分子结构练习20题1、下列分子中,两个相邻共价键的夹角最小的是:A、BF3B、HS2C、NH3OD、H2正确答案:B2、下列分子和离子中,中心原子成键轨道不是sp2杂化的是:-A、NO3B、HCHOC、BF3D、NH3正确答案:D3、下列化合物中,极性最大的是:A、CS2B、HS2C、SO3D、SnCl4正确答案:B4、下列分子中,偶极矩不等于零的是:A、BeCl2B、BF3C、NF3D、CO2正确答案:C5、下列液态物质中只需克服色散力就能使之沸腾的是:A、HO2B、COC、HFD、Xe正确答案:D6、下列各组离子中,离子的极化力最强的是:A、K+、Li+B、Ca2+、Mg2+C、Fe3+、Ti4+D、Sc3+、Y3+正确答案:C7、下列物质熔点变化顺序中,不正确的是:A、NaF>NaCl>NaBr>NaIB、NaCl<MgCl 2<AlCl 3<SiCl 4C、LiF>NaCl>KBr>CsID、Al 2O 3>MgO>CaO>BaO正确答案:B8、下列原子轨道的n 相同,且各有一个自旋方式相反的不成对电子,则沿X 轴方向可形成π键的是:A、P X -P XB、P X -PyC、Py-P ZD、Pz-Pz正确答案:D9、下列分子或离子中,具有反磁性的是:A、O 2B、O 2-C、O 2+D、O 22-正确答案:D10、按分子轨道理论,下列稳定性排列正确的是:A、O 2>O 2+>O 22-B、O 2+>O 2>O 22-C、O 22->O 2>O 2+D、O 2+>O 22->O 2正确答案:B11、下列分子或离子中,中心原子的价层电子对几何构型为四面体,而分子(离子)的空间构型为V 字形的是:A、NH 4+B、SO 2C、ICl 2-D、OF 2正确答案:D12、几何形状是平面三角形的分子或离子是:A、SO 3B、SO 32-C、CH 3-D、PH 3正确答案:A13、下列分子中偶极矩大于零的是:A、BF 3B、PF 3C、SiF 4D、PF 5正确答案:B14、根据VSEPR 理论,BrF 3分子的几何构型为:A、平面三角形B、三角锥形C、三角双锥形D、T 字形正确答案:D15、下列分子中,离域π键类型为П33的是:A、O 3B、SO 3C、NO 2D、HNO 3正确答案:C16、下列晶格能大小顺序中正确的是:A、CaO>KCl>MgO>NaClB、NaCl>KCl>RbCl>SrOC、MgO>RbCl>SrO>BaOD、MgO>NaCl>KCl>RbCl正确答案:D17、在下列各种含氢化合物中,有氢键的是:A、CHF 3B、C 2H 6C、C 6H 6D、HCOOHE、CH 4正确答案:D18、在石墨晶体中,层与层之间的结合力是:A、金属键B、共价键C、范德华力D、大π键正确答案:C19、下列关于O 22-和O 2-的性质的说法中,不正确的是:A、两种离子都比O 2分子稳定性小B、O 22-的键长比O 2-键长短C、O 22-是反磁性的,而O 2-是顺磁性的D、O 22-的键能比O 2-的键能小正确答案:B20、若中心原子采用sp 3d 杂化轨道成键的分子,其空间构型可能是:A、三角双锥形B、变形四面体C、直线形D、以上三种均有可能正确答案:D。
基础化学第二版习题答案chap11

第十一章分子结构习题答案1. 解释下列概念:(1) σ键和π键(2) 极性共价键和非极性共价键、极性分子和非极性分子(3) 氢键和范德华力(4) 等性杂化和不等性杂化(5) 成键轨道和反键轨道解: (1) σ键是s—s,s—p x,p x—p x原子轨道以头碰头方式重叠形成的共价键,成键电子云分布在两核之间,稳定性比较大。
π键是由p y—p y,p z—p z以肩并肩方式重叠形成的,成键电子云分布在x轴所在平面的上下两侧,π键不能单独存在,只能存在于共价双键或共价叁键中,比σ键的稳定性小,容易发生反应。
(2) 同种元素原子间形成的共价键,正、负电荷重心重合,这样的共价键为非极性共价键;电负性不同的两元素原子间形成的共价键,正、负电荷重心不能完全重合,一端带部分正电荷,另一端带部分负电荷,这样的共价键为极性键。
以共价键形成的分子,如果分子的正、负电荷重心重合,则为非极性分子;如果分子的正、负电荷重心不能重合,这样的分子就是极性分子,分子的偶极矩大于零。
分子的极性和键的极性以及分子的空间构型有关。
(3) 氢原子与电负性很大(如N、O、F)半径很小的原子结合以后,几乎成为裸露的质子,正电荷密度很大,可以与另一个电负性很大半径很小的原子产生强烈的相互吸引作用,这种作用力就叫做氢键。
氢键有方向性和饱和性。
分子间存在一种只有化学键键能的1/10—1/100的弱的作用力,最早由荷兰物理学家van der Waals提出,故称作范德华力。
包括取向力、诱导力、色散力三种。
(4) 原子轨道杂化后所形成的杂化轨道的成分和能量完全等同,这样的杂化就叫做等性杂化。
如果原子轨道杂化以后所形成的杂化轨道的能量和成分不完全相同,这样的杂化叫做不等性杂化。
如水分子、氨分子在形成时中心原子采用的就是不等性sp3杂化。
(5) 原子轨道线性组合形成分子轨道时,在形成的分子轨道中一半的分子轨道能量降低,叫做成键轨道。
另一半的分子轨道能量升高叫做反键轨道。
普通化学习题答案-第八章 化学键和分子结构

5
General Chemistry
Chapter 3 Homework
2. 将下列化合物按熔点从高到低的顺序排列:
NaF SiF4 NaBr SiBr4 NaCl SiCl4 NaI SiI4 NaF >NaCl> NaBr> NaI> SiI4> SiBr4> SiCl4 >
◆同主族元素,自上而下,具有相同电荷的离子半径依次增大
如:r (Li+)<r (Na+)<r(K+)<r (Rb+)<r (Cs+);
r(F-)<r(Cl-)<r(Br-)<r(I-)
◆同一周期中,电子构型相同时,随着离子电荷数增加,正离
子半径减小,负离子半径增大
如:r (Na+) >r(Mg2+) >r (Al3+); r(F-)<r(O2-)<r(N3-)
SiF4 3. 指出下列各对分子之间存在的分子间作用力的类型(取向 力、诱导力、色散力、氢键):
(1) 苯和CCl4
(2) 甲醇和H2O
(3) CO2和H2O
(4) HBr和HI
(1) 色散力(非极性分子间) (2) 色散力、取向力、诱导力、氢键(极性分子间) (3) 色散力、诱导力、(极性和非极性分子间) (4) 色散力、取向力、诱导力、(极性分子间)
3.C2H4分子中包含有 5 个σ键, 1 个π键,两个C原子采用
了 sp杂2 化形式,π键在
C原子与
C原子间形成。
4.AgCl、AgBr、AgI在水中的溶解度依次 减小 ,颜色依
分子结构答案

分子结构——答案1.下列分子中只含键的为()。
A、HCN;B、H2O;C、CO;D、N2;E、C2H4解答或答案:B。
2.下列化合物中分子极性最大的是()A、CCl4;B、C2H5OH;C、I2;D、H2O;E、H2S解答或答案:D3.下列化合物=0的是()A、H2O;B、NH3;C、BF3;D、CH3Cl;E、HCl解答或答案:C4.在下列分子或离子中,没有孤对电子的是()。
A、H2O;B、NH3;C、H2S;D、NH4+;E、OH-5.乙醇和水之间的作用力为()。
A、色散力;B、取向力和诱导力;C、色散力和诱导力;D、取向力、诱导力和色散力;E、除D所述之外还有氢键解答或答案:E6.惰性气体在低温下能够被液化的原因在于()。
A、单原子分子有一定的体积;B、单原子分子有一定的质量;C、单原子分子间有相互作用;D、单原子分子在低温下形成氢键;E、原子是由带正电荷的核和带负电荷的电子组成的解答或答案:C7.下列说法中正确的是()。
A、p轨道之间以“肩并肩”重叠可形成键;B、p轨道之间以“头碰头”重叠可形成键;C、s轨道和p轨道“头碰头”重叠可形成键;D、s轨道和p轨道“头碰头”重叠可形成键;E、共价键是两个原子轨道“头碰头”重叠形成解答或答案:C8.甲烷(CH4)分子中,碳原子所采用的杂化方式为()。
A、sp;B、sp2;C、sp3;D、dsp2;E、spd2解答或答案:C9.下列各分子之间仅存在着色散力的是()。
A、甲醇和水;B、溴化氢和氯化氢;C、氮气和水;D、乙醇和水;E、苯和四氯化碳解答或答案:B10.下列分子中极性最小的是()。
A、NaF;B、HF;C、HCl;D、HBr;E、HI解答或答案:E11.下列分子中存在氢键的是()。
A、HF;B、CH4;C、HI;D、CCl4;E、CO2解答或答案:A12.下列化合物中,能形成分子内氢键的是()。
A、C O O HO H;B、CH3F;C、COOHHO;D、H2O;E、PH3解答或答案:A13.NH3分子中N原子采取不等性sp3杂化,分子在空间的构型为()。
基础化学李保山第二版10-分子结构习题答案

10 分子结构习题解答(p322-325)思考题1. Na和Cl、F之间,K和Cl、F之间能形成离子化合物。
2. 答案:Be2+ 2电子构型;Ca2+8电子构型;Fe3+9~17电子构型;Cu+ 18电子构型;Sn2+18+2电子构型;Pb4+18电子构型;O2-8电子构型。
3.答案:S2->K+>Na+>Mg2+4. Sn4+ >Fe2+ >Sn2+ >Sr2+>Ba2+5. S2->O2->F->Cu+ >Na+6. (1)半径比规则可以用来判断离子晶体的晶格类型。
晶格能可以用来衡量离子键的强弱。
(2)离子极化的结果使原来的离子键向共价键方向过渡。
(3)18电子构型的正离子极化率较强;18电子构型的负离子变形性较强。
7. 答案:原子轨道的角度分布方向是一定的,共价键的形成遵循最大重叠原则,所以只能在建轴方向上才能形成稳定的共价键,因而共价键具有方向性;每个原子的未成对电子数时一定的,有几个未成对电子就可以形成几个共用电子对,所以共价键具有饱和性。
8. (1)由两个相同或不相同的原子轨道沿轨道对称轴方向相互重叠而形成的共价键(头碰头),叫做σ键。
当两个原子的轨道从垂直于成键原子的核间连线的方向接近,发生电子云重叠而成键(肩并肩),这样形成的共价键称为π键。
(2)单键:在价键理论中,两个原子之间如只有一对共用电子,形成的化学键称为单键。
单电子键:在分子轨道理论中,只有一个电子填入分子轨道形成的化学键称为单电子共价键。
(3)同类型的杂化轨道可分为等性杂化和不等性杂化两种。
如果原子轨道杂化后形成的杂化轨道是等同的,这种杂化叫做等性杂化。
如果原子轨道杂化后形成的杂化轨道中有一条或几条被孤对电子所占据,使得杂化轨道之间的夹角改变,这种由于孤对电子的存在而造成杂化轨道不完全等同的杂化,叫做不等性杂化。
9. (1)BF3键角大,因为BF3中B的价电子结构为2s22p1,形成分子时,进行sp2杂化,三个sp2杂化轨道分别与三个F原子的p轨道成键,故BF3分子为平面三角形,键角为120度。
第二章分子结构之练习参考答案
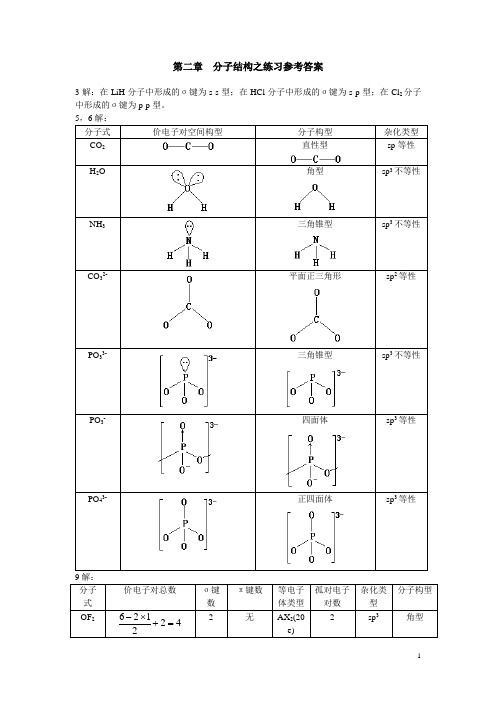
第二章 分子结构之练习参考答案3解:在LiH 分子中形成的σ键为s-s 型;在HCl 分子中形成的σ键为s-p 型;在Cl 2分子中形成的σ键为p-p 型。
5,6解: 分子式 价电子对空间构型分子构型 杂化类型 CO 2直性型sp 等性H 2O角型sp 3不等性 NH 3三角锥型sp 3不等性CO 32-平面正三角形sp 2等性PO 33-三角锥型sp 3不等性PO 3-四面体sp 3等性PO 43-正四面体sp 3等性分子式 价电子对总数σ键数 π键数 等电子体类型 孤对电子对数 杂化类型 分子构型 OF 2422126=+⨯- 2无AX 2(20e)2sp 3角型ClF 3532137=+⨯- 3 无AX 3(28e)2 sp 3d 变形T 型 SOCl 2 4322126=+-⨯-3 2个d-p π反馈π键 AX 3(26e)1 sp 3 三角锥型 XeF2 522128=+⨯- 2 无 AX 2(22e) 3 sp 3d 直性型 SF 6 662166=+⨯- 6 无 AX 6(48e) 0 sp 3d 2 正八面体 PCl 5552155=+⨯- 5无AX 5(40e)sp 3d三角双锥10解:丁三烯的路易斯结构式为:价电子总数:20;C1和C4为sp 2杂化,C2和C3为sp 杂化,C-C-C 键角为1800。
有一个由四个碳原子参与形成的π44大π键和由C2和C3原子参与形成的p-p π键。
这两个π键相互垂直。
11解:O 3-离子的价电子对总数=(6-2×2+1)÷2+2=3.5≈4,且其键角为1000,可推算其应采取sp 3不等性杂化(因更接近109.50而非1200)。
由于孤对电子的排斥作用,使其键角小于109.50,离子空间构型为三角锥型。
12解:第二周期同核双原子分子中的Be 2因键级等于零而不能稳定存在。
有顺磁性的分子是:B 2,O 2。
13解:它们的分子轨道排布式为:O 2+:(σ1s )2(σ*1s )2(σ2s )2(σ*2s )2(σ2p )2 (π2p )4(π*2p )1 键级=(6-1)÷2=2.5 O 2:(σ1s )2(σ*1s )2(σ2s )2(σ*2s )2(σ2p )2 (π2p )4(π*2p )2 键级=(6-2)÷2=2.0O 2-:(σ1s )2(σ*1s )2(σ2s )2(σ*2s )2(σ2p )2 (π2p )4(π*2p )3 键级=(6-3)÷2=1.5 O 22-:(σ1s )2(σ*1s )2(σ2s )2(σ*2s )2(σ2p )2 (π2p )4(π*2p )4 键级=(6-4)÷2=1.0 因键级越大,键越强,则键长越短,所以:键长顺序: O 2+< O 2< O 2-< O 22-. 其中,具有顺磁性的有: O 2+, O 2和O 2-. 15解:CO 和NO 的分子轨道排布式为:CO :(σ1s )2(σ*1s )2(σ2s )2(σ*2s )2(π2p )4 (σ2p )2 键级=(6-0)÷2=3.0NO :(σ1s )2(σ*1s )2(σ2s )2(σ*2s )2 (σ2p )2 (π2p )4 (π*2p )1 键级=(6-1)÷2=2.5 键长: CO<NO NO 具有顺磁性.注:教材题目有错,对于NO 分子,其σ2p 的能量应低于π2p ,即应先填充σ2p 。
高中化学竞赛专题考试—分子结构(含答案)

高中化学竞赛专题考试——分子结构1(路易斯结构式、共振式、VSPER 理论)1.008Zr Nb Mo T cRu Rh Pd Ag Cd In S n S b T e I Hf T a W Re OsIr Pt Au Hg T l Pb Bi Po At Ac-Lr HLi BeB C N O F Na MgAl S i P Cl S K Ca S c T i V Cr Mn Fe Co Ni Cu Zn G a G e As S e BrRb Cs Fr S r Ba RaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn 相对原子质量Rf Db Sg Bh Hs Mt一. 选择题(每题只有一个正确选项,每题2分,共50分)1. 根据鲍林近似能级图,在多电子原子中,基态时,下列电子均处于一定的能级,其中占据能级最高轨道的电子是: ( )A 2,1,1,+1/2B 3,1,1,+1/2C 3,2,1,+1/2D 4,0,0,1/2 2. 下列离子的电子构型可以用[Ar]3d 6表示的是( )A Mn 2+B Fe 3+C Co 3+D Ni 2+3.下列离子半径变小的顺序正确的是( )A F ->Na +>Mg 2+Al 3+B Na +>Mg 2+>Al 3+>F -C Al 3+>Mg 2+>Na +>F -D F ->Al 3+>Mg 2+>Na +4. 下列元素的原子中,第一电离能最大的是 ( )A BeB BC CD N5. 下列物质中,含极性键的非极性分子是()A H2OB HClC SO3D NO26. 下列分子中,没有配位键的是()A COB (BeCl2)2C CH3OBF3D N2H47. NO3—合理的共振式总数为()A 1B 2C 3D 48.下列分子中,键级等于零的是()A.O2 B. F2 C. N2 D. Ne29.原子轨道沿两核连线以“肩并肩”方式进行重叠的是()A. б键B. 氢键C. π键D. 离子键10. 下列物种中,键长最短的是( )A O2B O2+C O2—D O22—11. 下列化合物中,极性最大的是()A CS2B H2OC SO3D SnCl412. 下列物种中,既是路易斯酸,也是路易斯碱的是()ACCl4 B SOCl2 C NH2— D Hg2+13. 估计下列分子中,键角最小的是()()A NH3B PH3C AsH3D SbH314.估计下列分子或离子中,键角最小的是()A NH3B NO3—C NF3D NCl315. 几何形状是平面三角形的离子是()A SO-23 B SnCl-3C CH-3D NO-316. 下列分子或离子为平面四方构型的是()A ICl4—B ClO4—C BrF4+D SF417. 下列分子或离子中,属于三角锥构型的是()A BCl3B H3O+C BrF3D CH+318. 下列化合物中,可能含有卤桥键的是()A SnCl4B BeCl2C CCl4D NCl319. IF5是共价化合物,但液态IF5是电的良导体,原因是IF5二聚后电离,得到各带一个单位正负电荷的阴阳离子,则在该液体中存在的阳离子的几何构型是()A 三角双锥B 四方锥C 平面四方D 变形四面体20 下列哪一个分子的空间构型为折线型()A N3—B I3—C SO32—D CO32—21.下列分子中,偶极矩不为零的是()A BeCl2B BF3C NF3D CH422. 下列分子或离子中,键角最大的是()A XeF2B NCl3C CO-23 D PCl+423 通过测定AB2型分子的偶极距,能够判断:()A分子的空间构型 B 两元素的电负性之差C A—B键的极性D A—B键的键长24. 下列分子中含有两个不同键长的是()A CO2B SO3C SF4D XeF425. 下列分子中,最不容易聚合的是()A N2O5B BeCl2C AlCl3D NO2二、填空题(共50分)26.(10分)指出下列分子中有几个σ键和π键数目。
无机化学答案 第2章分子对称性与分子结构-习题答案

aA2 =1/24 [1×1×4+8×1×1+3×1×0+6×(-1)×0+ 6×(-1)×2]=0
aE =1/24 [1×2×4+8×(-1)×1+3×2×0+6×0×0+6×0×2]=0
aT1 =1/24 [1×3×4+8×0×1+3×(-1)×0+6×1×0+6×(-1)×2]=0
4
aT2 =1/4 [1×3×4+8×0×1+3×(-1)×0+6×(-1)×0+6×1×2]=1 得Γ=A1 ⊕ T2
T2
3
0
-1 -1
1
(x , y , z)
(xy , xz , yz)
以CH4的 4 条杂化轨道为基(分别记为r1、r2、r 3、r 4),依据Td点群的对称元素对其进行
操作,得可约表示Γ:
Td
E
8C3
3C2
6S4
6σd
Γ
4
1
0
0
2
r 1、r2、r 3、r 4
用群分解公式将Γ约化:
aA1 =1/24(1×1×4+8×1×1+3×1×0+6×1×0+6×1×2)=1
2.5 [MA2B2]2-呈平面四边形构型时属D2h点群,含有对称元素:C2、2C2'、σh、i、2σv。[MA2B2]2 -呈四面体构型时属C2v点群,含有对称元素:C2、2σv。
2.6 C4h点群比D4h点群缺少 4 条垂直于主轴的C2'旋转轴。D4h点群的例子有配离子PtCl42-,C4h 点群例子有:
B
C
A
C
A
B
C2v
C
B
A
B
A
C
C2v
C
B
A
A
B
C
D2h
02 分子结构(练习题)

4、只有第一、第二周期的非金属元素之间才可形成π 键。
5、键的极性越大,键就越强。
6、NH3 的离解能总和大于 N2 的键离解能,但 NH3 容易氧化,N2 则很困难。这是因为衡量一个分 子的反应性,主要是看打破第一个键所需的能量,而不是打破所有键的总能量。
7、非金属元素之间的化合物也可存在着离子键。
5、什么叫杂化?原子轨道为什么要杂化?
6、说明下列分子或离子的几何构型,并指出中心原子杂化类型,画出成键示意图(用短线表示
成键):H2S、BeH2、OF2、BF3、CCl4、NF3、CHCl3 7、现有几种双原子分子 Li2、Be2、B2 和 O2-离子.
(1) 写出它们的分子轨道表示式
(2) 计算它们的键级,指出哪个最稳定,哪个最不稳定
A.P2 B.As2 C.S8 D.C2
17、下列那种分子不可能以固体存在?
A.OCl2 B.NO2 C.OF2 D.都不可能
18、下列那种化合物中实际上没有氢键? A.H3BO3 B.C2H6 C.N2H4 D.都没有氢键
19、下列那种关于物质内部范德华力的说法是错的
A.非极性分子的物质没有取向力
B. NaF > F2 > HCl > HF > HI
C.NaF > HF > HI > HCl > F2
D.NaF > HF > HCl > HI > F2
26、下列物质中,分子间作用力从大到小的顺序是
A. Cl2 Br2 ICl He B. ICl Cl2 Br2 He
C. Br2 ICl Cl2 He
);色散力最大的为(
),最小的为
(
)。
第二章分子结构之练习参考答案
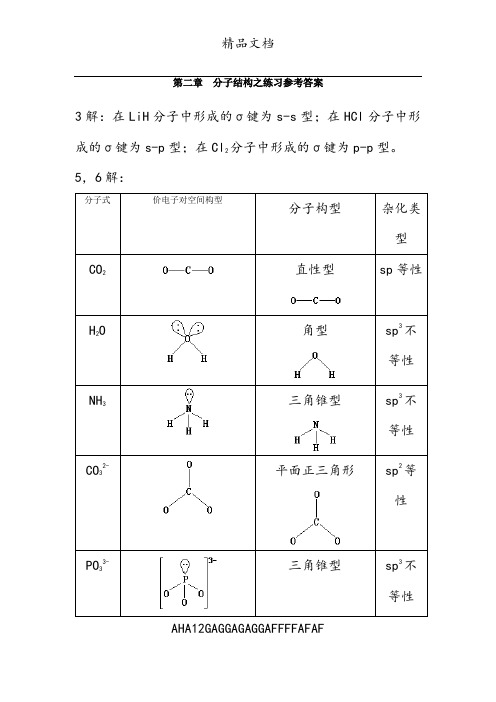
第二章分子结构之练习参考答案3解:在LiH分子中形成的σ键为s-s型;在HCl分子中形成的σ键为s-p型;在Cl2分子中形成的σ键为p-p型。
5,6解:分子式价电子对空间构型分子构型杂化类型CO2直性型sp等性H2O角型sp3不等性NH3三角锥型sp3不等性CO32-平面正三角形sp2等性PO33-三角锥型sp3不等性AHA12GAGGAGAGGAFFFFAFAFAHA12GAGGAGAGGAFFFFAFAFPO 3-四面体sp 3等性PO 43-正四面体sp 3等性9解: 分子式 价电子对总数 σ键数 π键数等电子体类型 孤对电子对数杂化类型 分子构型OF 2422126=+⨯- 2无AX 2(20e)2sp 3角型AHA12GAGGAGAGGAFFFFAFAFClF 3 532137=+⨯- 3 无 AX 3(28e)2 sp 3d 变形T型SOC l 24322126=+-⨯-3 2个d-p π反馈π键AX 3(26e) 1 sp 3三角锥型XeF 2522128=+⨯- 2 无 AX 2(22e)3 sp 3d直性型SF 6662166=+⨯- 6 无 AX 6(48e)sp 3d 2正八面体PCl 5552155=+⨯- 5 无 AX 5(40e)0 sp 3d三角双锥10解:丁三烯的路易斯结构式为:价电子总数:20;C1和C4为sp 2杂化,C2和C3为sp 杂化,C-C-C 键角为1800。
有一个由四个碳原子参与形成的π44大π键和由C2和C3原子参与形成的p-p π键。
这两个π键相互垂直。
11解:O 3-离子的价电子对总数=(6-2×2+1)÷2+2=3.5≈4,且其键角为1000,可推算其应采取sp3不等性杂化(因更接近109.50而非1200)。
由于孤对电子的排斥作用,使其键角小于109.50,离子空间构型为三角锥型。
12解:第二周期同核双原子分子中的Be2因键级等于零而不能稳定存在。
分子的对称性及分子结构习题及答案

第二章分子的对称性与分子结构【补充习题及答案】1.HCN和CS2都是直线形分子,请写出它们具有的对称元素的种类。
答案:HCN:C∞、σv。
CS2:C∞、C2'、σh、σv、i、S∞。
2.指出下列分子存在的对称元素:(1)AsCl3;(2)BHFBr;(3)SiH4答案:(1)AsCl3分子为三角锥形,存在对称元素C3和3σv。
(2)BHFBr分子为三角形,存在对称元素1个σ。
(3)SiH4分子为四面体形,存在对称元素4C3、3C2、3S4、6σd。
3.SF5Cl分子的形状和SF6相似,试指出它的点群。
答案:SF5Cl分子仍为八面体,但1条键与其他键不同,分子点群为C4v。
4.正八面体6个顶点上的原子有3个被另一种原子取代,有几种可能的方式?取代产物各属于什么点群?取代产物是否具有旋光性和偶极矩?答案:只有经式(mer-)和面式(fac-)两种取代方式。
经式产物属于C2v点群,面式产物属于C3v点群。
均有偶极矩,均无旋光性。
5.指出下列各对分子的点群。
(1)CO2和 SO2 (2)二茂铁(交错式)和二茂钌(重叠式)(3)[IF6]+八面体)和[IF6]-(五角锥)(4) SnClF(角形)和XeClF(线形)(5)mer-WCl3F3和fac-WCl3F3(6)顺式和反式Mo(CO)4Cl2答案:(1)CO2:D∞h点群;SO2:C2v点群。
(2)二茂铁(交错式):D5h点群;二茂钌(重叠式):D5d点群。
(3) [IF6]+(八面体):O h点群;[IF6]-(五角锥):C5v点群。
(4)SnClF(角形):C s点群;XeClF(线形):C∞v点群。
(5)mer-WCl3F3:C2v点群;fac-WCl3F3:C3v点群。
(6)顺式Mo(CO)4Cl2:C2v;反式Mo(CO)4Cl2 :D4h点群6.如何判断一个分子有无永久偶极矩和有无旋光性?答案:对称元素不是交于一点的分子具有永久偶极矩。
(完整版)第四章分子结构习题及答案

第四章分子结构习题1。
是非判断题1-1化学键是相邻原子与原子(或离子与离子)之间的强烈相互作用。
1—2 50Sn2+是18+2电子构型,50Sn4+是18电子构型。
1-3 Al3+,Ba2+,Si(IV)的电子构型都属于8电子构型.1-4具有未成对电子的两个原子相互接近时可以形成稳定的共价键.1—5原子形成共价键的数目等于基态原子的未成对电子数。
1-6σ键的特点是原子轨道沿键轴方向重叠,重叠部分沿键轴呈圆柱形对称。
1-7一般来说,σ键的键能比π键键能小。
1—8 s电子与s电子配对形成的键一定是σ键,p电子与p电子配对形成的键一定为π键.1—9两个σ键组成一个双键.1-10键的强度与键长无关。
1-11所有非金属元素之间形成的化合物都不是离子化合物。
1—12μ=0的分子,其化学键一定是非极性键.1—13共价键具有饱和性的原因在于每个原子提供一定数目的自旋方向相反的未成对电子。
1—14原子核外有几个未成对电子,就能形成几个共价键。
1-15共价键类型可以分为σ键和π键,π键的键能小于σ键的键能,因此π键的稳定性弱于σ键. 1—16烷烃分子中C-H键的键能为413 KJ·mol -1,因此提供413KJ·mol -1的能量能使甲烷和乙烷分子中C-H键断裂。
1-17沿键轴方向的s轨道和p轨道进行重叠可形成π键。
1-18原子轨道相互重叠应满足最大重叠原理,所以沿键轴以“头碰头”方式才能成键。
1—19原子轨道之所以要发生杂化是因为能增大成键能力。
1—20 sp3杂化是,s轨道的主量子数和p轨道的主量子数可以是不同的,也可以是相同的。
1-21 1个s轨道和3个p轨道,形成1个sp3杂化轨道.1-22在sp,sp2,sp3杂化中,杂化轨道的成键能力随s轨道成分增多而增强。
1-23发生轨道杂化的原子轨道可以具有成对电子。
1-24原子轨道发生杂化,若轨道上有孤对电子存在,这类杂化是不等性的。
1-25 NH3和H2O分子中的中心原子都是发生sp3杂化,但氧原子的2对孤对电子占据2 个杂化轨道而产生更大的斥力,使O—H键键角大于氨分之中N—H键键角。
分子结构 习题答案

第二章分子结构习题答案(总9页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--2、结合Cl 2的形成,说明共价键形成的条件。
共价键为什么有饱和性共价键形成的条件:原子中必须有单电子,而且成单电子的自旋方向必须相反。
共价键有饱和性是因为:一个原子的一个成单电子只能与另一个成单电子配对,形成一个共价单键。
一个原子有几个成单电子便与几个自旋相反的成单电子配对成键。
电子配对后,便不再具有成单电子了,若再有单电子与之靠近,也不能成键了。
例如:每一个Cl 原子有一个带有单电子的p 轨道,相互以头碰头的形式重叠可以形成共价单键,且只能形成一个单键。
3、画出下列化合物分子的结构式并指出何者是键,何者是键,何者是配位键。
H H H Ζ?δδσσσP N I I I Ζ?δδσσσN N N H H H H σσσσσ 膦PH 3, 三碘化氮NI 3 肼N 2H 4(N —H 单键)c C c H H H H σσσσσπ N N N O O o O H σσσσσππππ ,乙烯, 四氧化二氮(有双键)。
4.PCl 3的空间构型是三角锥形,键角略小于10928,SiCl 4是四面体形,键角为10928,试用杂化轨道理论加以说明。
杂化轨道理论认为,在形成PCl 3分子时,磷原子的一个3s 轨道和三个 3p 轨道采取sp 3杂化。
在四个sp 3杂化轨道中,有一个杂化轨道被一对孤电子对所占据,剩下的三个杂化轨道为三个成单电子占据,占据一个sp 3杂化轨道的一对孤电子对,由于它不参加成键作用,电子云较密集于磷原子的周围,因此孤电子对对成键电子所占据的杂化轨道有排斥作用,为不等性杂化,所以键角略小于109°28′。
而在SiCl 4分子中,为等性杂化,没有不参加成键的孤电子对,四个杂化轨道都为四个成单电子占据,不存在孤电子对对成键电子对所占据杂化轨道的排斥作用,所以键角为109°28′。
第二章 分子结构 习题答案

2、 结合Cl 2的形成,说明共价键形成的条件。
共价键为什么有饱和性?共价键形成的条件:原子中必须有单电子,而且成单电子的自旋方向必须相反。
共价键有饱和性是因为:一个原子的一个成单电子只能与另一个成单电子配对,形成一个共价单键。
一个原子有几个成单电子便与几个自旋相反的成单电子配对成键。
电子配对后,便不再具有成单电子了,若再有单电子与之靠近,也不能成键了。
例如:每一个Cl 原子有一个带有单电子的p 轨道,相互以头碰头的形式重叠可以形成共价单键,且只能形成一个单键。
3、 画出下列化合物分子的结构式并指出何者是σ键,何者是π键,何者是配位键。
H HHΖ?δδσσσPN I I IΖ?δδσσσN N N H H H H σσσσσ膦PH 3, 三碘化氮NI 3 肼N 2H 4(N —H 单键)c C c H H HH σσσσσπ N NN O O o O H σσσσσππππ,乙烯, 四氧化二氮(有双键)。
4.PCl 3的空间构型是三角锥形,键角略小于109︒28',SiCl 4是四面体形,键角为109︒28',试用杂化轨道理论加以说明。
杂化轨道理论认为,在形成PCl 3分子时,磷原子的一个3s 轨道和三个 3p 轨道采取sp 3杂化。
在四个sp 3杂化轨道中,有一个杂化轨道被一对孤电子对所占据,剩下的三个杂化轨道为三个成单电子占据,占据一个sp 3杂化轨道的一对孤电子对,由于它不参加成键作用,电子云较密集于磷原子的周围,因此孤电子对对成键电子所占据的杂化轨道有排斥作用,为不等性杂化,所以键角略小于109°28′。
而在SiCl 4分子中,为等性杂化,没有不参加成键的孤电子对,四个杂化轨道都为四个成单电子占据,不存在孤电子对对成键电子对所占据杂化轨道的排斥作用,所以键角为109°28′。
5. 判断下列物种的几何构型,并指出中心原子采取何种杂化方式。
(1) AsF 4- (2) XeOF 3+ (3) SF 5+ (4) Cl 2CO(5) HO 2- (6) HNO 3 (7) I 3+ (8) I 3-分子式 杂化方式 电子对构型 分子构型AsF 4-sp 3d三角双锥四角锥XeOF 3+ sp 3d 三角双锥四角锥SF 5+sp 3d三角双锥三角双锥Cl 2COsp 2平面正三角形C OClCl平面三角形HO 2- sp 3 角形O OHHNO 3 sp 2 平面正三角形N OOOH平面三角形I 3+ sp 3 四面体 角形I 3- sp 3d三角双锥 直线形6、 试用价层电子对互斥理论写出下列各分子的分子构型,并用杂化轨道理论加以说明。
10 分子结构习题解答0

10 分子结构4510 分子结构习题解答(p309-311)1. 答案:DB BABBDDC2. 在下列各题的横线处填上正确的文字,符号或数值(1) 极性分子间的取向力由__偶极作用_产生,诱导力由__诱导偶极作用__产生。
色散力由瞬时偶极作用产生。
一般分子间力多以色散力为主。
(2)分子中的电子在分子轨道中的排布应遵循_能量最低原理_、Pauli不相容原理、Hund规则三规则。
对 2p轨道来说是__2___重简并的。
(3) HI分子间的作用力有_色散力、取向力和诱导力_,其中主要的作用力是色散力。
(4) 在HF分子中,分子轨道的类型有__3σ__、____1π____和____4σ____轨道。
通常_____1π___轨道与相应的原子轨道能量相等或相近。
(5) SO2的极化率比O3的____大____,C3H8比C2H6的极化率_____大___。
(6) A、B两元素同属第三周期,A单质在常温下为气体,B元素的原子序数比A 少3,A、B两元素形成的常见化合物分子式为__SiCl4___,其中心原子采用的杂化轨道是__sp3__,分子的空间构型为__正四面体_A、B原子间成键所用的轨道是_sp3-p__。
(7) 根据价层电子对互斥理论,确定下列分子或离子的几何形状:SO42-为__正四面体形__,PO43-为_正四面体形_,XeO4为_正四面体形_,XeO3为___三角锥形___。
(8) 按照杂化轨道理论,原子轨道发生等性杂化时,原子轨道的形状、_大小、伸展方向等_都发生改变。
形成的杂化轨道能量(或成键能力)相等。
(9) SCl2的空间构型为_角形_,中心原子采用__不等性sp3__杂化方式,有__2___对孤对电子,分子偶极矩__不等于_零。
(10) 对于下列分子的有关性质:A. NH3分子的空间构型;B. CH4分子中H-C-H的键角;C. O2分子的磁性;D. H2O分子的极性;可以用杂化轨道理论予以说明的有__A B D_,不能用杂化轨道理论说明的有_C_。
大学化学分子结构习题带答案

1.离子晶体中的化学键都是离子键。
()1.错2.CO 分子含有配位键。
()2.对3.所有分子的共价键都具有饱和性与方向性,而离子键没有饱和性与方向性。
()3.错4. 中心原子所形成的杂化轨道数等于参加杂化的原子轨道数。
()4.对5. 原子轨道发生杂化后可以增强成键能力。
()5.对6. 杂化轨道具有能量相等、空间伸展方向一定的特征。
()6.对7. 凡是中心原子采取sp3杂化轨道成键的分子,其空间构型都是正四面体。
()7.错8. 在任何情况下,每一个sp2杂化轨道所含的s、p成分均相同。
()8.错9. 由分子轨道理论可推知 O2-、O22-都比 O2稳定。
()9.错10. 按照分子轨道理论,N2+和 N2-的键级相等。
()10.对11. 色散力存在于一切分子之间。
()11.对12. 弱极性分子之间的分子间力均以色散力为主。
()12.对13. 氢键只存在于 NH3、H2O、HF 的分子之间,其它分子间不存在氢键。
()13.错14. 根据价层电子对互斥理论,分子或离子的空间构型取决于中心原子的价层电子对数。
()14.对15. 对 AB m型分子 ( 或离子 ) 来说,当中心原子 A 的价电子对数为 m 时,分子的空间构型与电子对在空间的构型一致。
()15.对16. AsF5是三角双锥形分子。
()16.错17. SO42-、ClO4-、PO43-的空间构型相同。
()17.对18. 下列化合物中既有离子键又有共价键和配位键的是()。
18.D(A) KF; (B) H2SO4; (C) CuCl2; (D) NH4NO3。
19. 关于离子键的本性,下列叙述中正确的是()。
19.D(A) 主要是由于原子轨道的重叠; (B) 由一个原子提供成对共用电子;(C) 两个离子之间瞬时偶极的相互作用; (D) 正、负离子之间的静电吸引为主的作用力。
20. 下列各组卤化物中,离子键成分大小顺序正确的是()。
20.A(A) CsF > RbCl > KBr > NaI;(B) CsF > RbBr > KCl > NaF;(C) RbBr > CsI > NaF > KCl;(D) KCl > NaF > CsI > RbBr。
大学化学分子结构、配合物习题及答案

一.分子结构6.(本题 2分) 4039下列各组离子中,离子的极化力最强的是 ( )(A) K+,Li+ (B) Ca2 +,Mg2 + (C) Fe3+,Ti4+ (D) Sc3+,Y3+6.(4039) (C)8.(本题 2分) 1075比较下列各组物质的熔点,正确的是- ( )(A) NaCl > NaF (B) CCl4> CBr4 (C) H2S > H2Te (D) FeCl3< FeCl28.(1075) (D)8.(本题 2分) 1075比较下列各组物质的熔点,正确的是- ( )(A) NaCl > NaF (B) CCl4> CBr4 (C) H2S > H2Te (D) FeCl3< FeCl28.(1075) (D)9.(本题 2分) 4018下列有关离子变形性的说法中,不正确的是 ( )(A) 外层 8 电子构型的离子的变形性小于其他电子构型的离子(B) 同一元素不同价态的负离子中,所带电荷越多变形性越小(C) 同种原子形成的阴离子比阳离子变形性大(D) 离子半径大,则变形性大(其他条件相同)9.(4018) (B)10.(本题 2分) 4019下列物质中,既有离子键又有共价键的是 ( )(A) KCl (B) CO (C) Na2SO4 (D) NH10.(4019) (C)11.(本题 2分) 4027试判断下列说法,正确的是 ( )(A) 离子键和共价键相比,作用范围更大(B) 所有高熔点物质都是离子型的(C) 离子型固体的饱和水溶液都是导电性极其良好的(D) 阴离子总是比阳离子大11.(4027) (A)12.(本题 1分) 4028下列物质中,既有离子键,又有共价键的是 ( )(A) AlCl3 (B) SiC (C) CaC2 (D) BN12.(4028) (C)15.(本题 2分) 4038试判断下列说法,正确的是 ( )(A) ⅠA,ⅡA,ⅢA族金属的 M3+阳离子的价电子都是 8 电子构型(B) ds区元素形成 M+和 M2 +阳离子的价电子是 18+2 电子构型(C) ⅣA族元素形成的 M2 +阳离子是 18 电子构型(D) d区过渡金属低价阳离子(+1,+2,+3)是 9~17 电子构型15.(4038) (D)填空:3.(本题 2分) 4020按从大到小的顺序排列以下各组物质 :(A) 按离子极化大小排列MnCl2,ZnCl2,NaCl,CaCl2 _____________________________________________________________________________________________;(B)按键的极性大小排列NaCl,HCl,Cl2,HI____________________________________________________________________________________________________。
北师大无机化学四版习题答案10分子结构

第10章 分子结构10.1 画出O 2、H 2O 2、CO 、CO 2、NCl 3、SF 4的路易斯结构式。
不要忘记标出孤对电子和分子的总电子数!解:O=OHO O HCOCOO12e 14e 10e 16eClN ClClFFF26e 34e评注:各种教科书对路易斯结构式的定义不尽相同。
涉及:( l )路易斯结构式是否一定要给出分子的立体结构?可以不涉及。
能表达更好。
(2 ) 路易斯结构式是否给出分子的全部电子?在有机化学中常不给出,但对初学者以给出为好。
(3) 路易斯结构式表达O2的结构时要不要给出三电子键?不必。
氧分子的三电子键属于分子轨道的理论表达,路易斯结构式一般不涉及分子轨道理论。
(4 ) 一氧化碳的路易斯结构式要不要给出配价键?最好给。
因此上面的CO 结构式最好写成:10.2 画出硫酸根各共振体的结构式。
SO OO OSOOOOSOOO OSOOO OSOOOOS OO O SOO OOSOO OOSOOO评注:SO 42-离子有32 个价电子,即16 对电子,因此,只要给出16 对电子,而且氧原子周围的电子数不超过8 的路易斯结构式都可以认为是硫酸根的共振结构式。
上列任一共振结构式并不能正确给出硫酸根的真实结构。
在有的教科书中用如下之一表达硫酸根的结构式:S O O OO2-2-也有的教科书将所有硫和氧原子之间的被都画成S 指向氧原子的箭头。
应当注意到的事实是,硫酸根中硫原子和氧原子之间的化学键明显具有双键的性质,用单键表达,是明显偏离事实的。
从形式电荷的角度,上面的两根双键的路易斯结构式的硫原子和两个氧原子都是零,另外两个氧原子因获得外加的电子而呈-1,是最合理的,而四根单键的结构式,形式电荷为S +2 ,O -1 ,也是可以成立的。
这是路易斯结构式不能克服的内在矛盾。
10.3 σ键可由s -s 、s -p 和p -p 原子轨道“头碰头”重叠构建而成,试讨论LiH (气态分子)、HCl 、Cl 2分子里的σ键分别属于哪一种?答:LiH 是s -s σ键:HCl 是s -p σ键;Cl 2是p -p σ键。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章 化学键和分子结构一.选择题1. 下列分子或离子中,键角最小的是( ) A. HgCl 2 B. H 2O C. NH 3 D. PH 32. 关于原子轨道的说法正确的是( ) A.凡中心原子采取sp 3杂化轨道成键的分子其几何构型都是正四面体; B. CH 4分子中的sp 3杂化轨道是由4个H 原子的1s 轨道和C 原子的2p 轨道混合起来而形成的 ; C. sp 3杂化轨道是由同一原子中能量相近的s 轨道和p 轨道混合起来形成的一组能量相等的新轨道;D. 凡AB 3型的共价化合物,其中心原子A 均采用sp 3杂化轨道成键。
3. 下列化合物中氢键最强的是( ) A. CH 3OH B. HF C. H 2O D. NH 34. 对羟基苯甲醛比邻羟基苯甲醛的熔沸点高的原因是( ) A. 前者不能形成氢键,后者可以; B. 前者能形成氢键,后者不能; C. 前者形成分子间氢键,后者形成分子内氢键; D. 前者形成分子内氢键,后者形成分子间氢键。
5. 下列各组物质沸点高低顺序中正确的是( ) A. HI>HBr>HCl>HF B. H 2Te>H 2Se>H 2S>H 2O C. NH 3>AsH 3>PH 3 D. CH 4>GeH 4>SiH 46. I 2的CCl 4溶液中分子间主要存在的作用力是( ) A. 色散力 B. 取向力 C. 取向力、诱导力、色散力 D. 氢键、诱导力、色散力7. 下列分子中偶极矩为零的是( ) A. NF 3 B. NO 2 C. PCl 3 D. BCl 38. 下列分子是极性分子的是( ) A. BCl 3 B. SiCl 4 C. CHCl 3 D.. BeCl 2 9. 下列离子或分子有顺磁性的是( ) A. O 2 B. O 22- C. N 2 D. CO10. 下列分子中心原子是sp 2杂化的是( ) A. PBr 3 B. CH 4 C. BF 3 D. H 2O11. SO 42-离子的空间构型是( ) A. 平面正方形 B. 三角锥形 C. 四面体 D. 八面体 12. 下列各物质分子其中心原子以sp 2杂化的是( )A. H 2OB. NO 2C. SCl 2D. CS 213. 下列关于O 22-和O 2-的性质的说法,哪组不正确( )A. 两种离子都比O 2分子稳定性小;B. O 2-的键长比O 22-的键长长;C. 键级次序是O 2>O 2->O 22-;D. O 2-是反磁性的,但O 22-是顺磁性的。
14. 下列各题说法不正确的是( ) A. 共价键形成的条件是欲成键原子必须有未成对电子;B. 极性键只能形成极性分子;C. 非极性键形成非极性分子;D. 形成配位键的条件是一方有空轨道,另一方有孤对电子;15. 原子间成键时,同一原子中能量相近的某些原子轨道要先杂化,其原因是( )A. 保持共价键的方向性;B. 进行电子重排;C. 增加成键能力;D. 使不能成键的原子轨道能够成键。
16. 在酒精的水溶液中,分子间主要存在的作用力为( ) A. 取向力 B. 诱导力 C. 色散力、诱导力和取向力 D. 取向力、诱导力、色散力和氢键 17. 下列物质中键级最小的是( )A. O 2B. N 2C. F 2D. O 2+18. NH 4+形成后,关于四个N-H 键,下列说法正确的是( )A. 键长相等;B. 键角不相等;C. 配位键的键长小于其他三键D. 配位键的键长大于其他三键; 19. 下列说法中不正确的是( ) A. ?键的一对成键电子的电子密度分布对键轴方向呈园柱型对称; B. ?键电子云分布是对通过键轴的平面呈镜面对称; C. ?键比?键活泼性高,易参与化学反应; D. ?键比?键活泼性高,易参与化学反应。
20. 下列说法正确的是( ) A. 原子形成的共价键数等于游离气态原子中不成对电子数; B. 同种原子双键的键能为单键键能的两倍; C.共价键的极性是由成键元素的电负性差造成的; D. 线性分子如A-B-C 是非极性的; 21. 下列分子中有最大偶极矩的是( ) A. HI B. HCl C. HBr D. HF 22. 关于共价键的说法,下述说法正确的是( ) A. 一般来说?键键能小于?键键能; B. 原子形成共价键的数目等于基态原子的未成对电子数; C. 相同原子间的双键键能是单键键能的两倍;D. 所有不同原子间的键至少具有弱极性。
23.用价键法和分子轨道法处理O2分子结构,其结果是( )A. 键能不同B. 磁性不同C. 极性不同D. 结果不同24.下列关于化学键正确的说法是( )A. 原子与原子之间的作用;B. 分子之间的一种相互作用;C. 相邻原子之间的强烈相互作用;D. 非直接相邻的原子之间的相互作用。
25.下列各题说法不正确的是( )A. 共价键形成的条件是欲成键原子必须有未成对电子;B. 极性键只能形成极性分子;C. 非极性键形成非极性分子;D. 形成配位键的条件是一方有空轨道,另一方有孤对电子。
26.下列说法正确的是( )A. 极性分子间仅存在取向力;B. 取向力只存在于极性与非极性分子之间;C. HF、HCl、HBr、HI熔沸点依次升高;D. 氨易溶于水,是因为氨与水分子间可形成氢键;E. 色散力仅存在于非极性分子间。
27.下列关于分子间力的说法正确的是( )A. 分子型物质的沸点总是随分子量的增大而增加的;B. 大多数含氢化合物中都存在氢键;C. 极性分子间仅存在取向力;D. 色散力存在于所有相邻分子间。
28.原子间成键时,同一原子中能量相近的某些原子轨道要先杂化,其原因是( )A. 保持共价键的方向性;B. 进行电子重排;C. 增加成键能力;D. 使不能成键的原子轨道能够成键。
29 下列分子中心原子的杂化轨道类型为sp3不等性杂化的是:A CH4B NH3C NH4+ D CO2二.填空题1.离子键是指_____阴.阳离子间通过静电作用___所成的化学键。
离子键主要存在于___离子晶体(或离子化合物)___中。
2.下列物质的变化各主要需打破或克服什么结合力冰熔化_氢键,单质硅熔化___共价键。
3.一般来说键能越大,键越__牢固__,由该键构成的分子越___稳定____。
4.MO法中成键电子数与反键电子数之差的一半就是分子的键级。
键级的大小表示两个相邻原子之间成键的__强度__,键级越大,键越__稳定__。
5.等性sp2、sp3杂化轨道的夹角分别为__120°;109°28′_。
6.分子间力按产生的原因和特性一般分为取向力、诱导力、色散力。
取向力存在于极性分子与非极性分子____之间;诱导力存在于____极性分子与非极性分子, 极性与极性分子_____之间。
7.分子的磁性主要是由_____分子中未成对电子产生的磁场__所引起的。
由极性键组成的多原子分子的极性是由___分子的空间构型___决定的。
8.在核间距相等时,?键稳定性比?键稳定性_大_,故?电子比?电子_活泼。
9.共价键按共用电子对来源不同分为__正常共价键和配位键__;共价键按轨道重叠方式不同分为____?键__和__?键____。
10.SO32-和SO42-的空间构型分别为____三角锥___和_正四面体__。
11.碳原子在下列各式中,杂化形式分别是:(1)CH3Cl ___sp3____ ,(2)CO32-____sp2___ 。
12.顺磁性物质的磁矩大小除可由实验间接测定外还可依公式__μ=n(n+2) BM计算,该磁矩的单位是___玻尔磁子_______。
13.偶极矩是衡量___分子极性大小的____的物理量,偶极矩(μ)的数学表达式为__μ=q·d __。
14.共价键具有饱和性的原因是___一个原子有几个未成对电子只可和几个自旋相反的电子配对成键___。
共价键具有方向性的原因是__为满足最大重叠,,成键电子的轨道只有沿着轨道伸展的方向进行重叠才能成键(除s轨道),所以共价键具有方向性_。
15.2s与2s原子轨道可组成两个分子轨道,用符号__?2s 和?2s*__表示,分别称___成键和反键___轨道。
16.原子轨道组成分子轨道的原则是:对称性原则;最大重叠原则;能量近似原则。
三.问答题1.sp型杂化可分为哪几种各种的杂化轨道数及所含s成分p成分各多少答:sp杂化可分为三种:sp、sp2、sp3。
各种杂化的成分如下:sp: 1/2s + 1/2p; sp2: 1/3s + 2/3p; sp3: 1/4s + 3/4p 2.什么叫?键,什么叫?键,二者有何区别答:原子轨道沿键轴方向按头碰头方式重叠,形成?键;原子轨道沿键轴方向按肩并肩方式重叠,形成?键;?键沿键轴呈圆柱形对称,重叠程度大,键能大,不易参加反应;?键沿键轴的节面呈平面对称,重叠程度小,键能小,易参加反应。
3.以NH3分子为例,说明不等性杂化的特点。
答:NH3分子中中心原子N与H成键时采取sp3不等性杂化,即由于一条杂化轨道被孤电子对占据,因而所形成的杂化轨道中含的s成分就不完全一样、被孤电子对占据的那条sp3杂化轨道s成分就大,这种不完全等同的杂化轨道的形成过程即不等性杂化。
4.BF3分子构型是平面三角形,而NF3分子构型是三角锥形,试用杂化轨道理论解释。
答:BF3中B原子成键时呈等性sp2杂化,得到三条能量相等的sp2杂化轨道对称分布在B原子周围互成120°角。
它们与三个F原子的2p轨道形成三条sp2-p?键,所以BF3为平面三角形。
NF3中N原子成键时呈不等性的sp3杂化,生成的四条杂化轨道中一条被成对电子占有,其它三条与三个F原子的2p轨道形成sp3-p?键,孤电子对对成键电子对有排斥作用.所以空间构型是三角锥形。
5.为什么H2O分子的键角既不是90°也不是109°28′而是°答:因中心原子“O”不是用单纯的2py 、2pz轨道与H原子轨道成键,所以键角不是90°。
中心原子“O”在成键的同时进行了sp3不等性杂化。
用其中含未成对电子的杂化轨道与H原子的1s轨道成键,两个含孤电子对的杂化轨道对成键电子对排斥的结果使键角也不是109°28′,而是°。
6.CH4、H2O、NH3中心原子杂化态皆是sp3,其键角大小是否相同为什么其空间构型各为何答: CH4中C采取sp3等性杂化,∴是正面体构型。
NH3中N采取sp3不等性杂化.因有一孤对电子,三个?键. ∴为三角锥形。
7.N2的键能比N2+键能大,而O2的键能比O2+键能小,试用分子轨道法解释。
