无机化学第四版第十四章习题答案
大学无机化学第十四章试题及答案修订稿

大学无机化学第十四章试题及答案集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-第十五章 氮族元素总体目标:1.掌握氮和磷单质、氢化物、卤化物、氧化物、含氧酸及其盐的结构、性质、制备和用途2.了解砷、锑、铋单质及其化合物的性质递变规律 各节目标: 第一节 氮的单质掌握N 2的结构;氮与非金属、金属的反应;氮气的实验室制法和工业制法 第二节 氮的成键特征通过氮的价层电子结构,了解它的成键特征 第三节 氮的氢氧化物1.掌握NH 3的工业制法和实验室制法以及它的结构2.了解NH 3的物理性质;掌握它的配位反应、取代反应、氨解反应和氧化反应以及用途;铵盐的水解性和热稳定性。
3.了解联氨、羟胺、叠氨酸的结构和性质 第四节 氮的氧化物1.掌握氮元素的自由能—氧化图2.掌握氮的氧化物(N 2O 、NO 、N 2O 3、NO 2、N 2O 4、N 2O 5)的结构和重要性质3.了解HNO 2及其盐的制备、结构、性质4.掌握HNO 3及其盐的结构和性质;硝酸盐热分解的一般规律;王水的成分和性质5.掌握硝酸盐和亚硝酸盐的鉴别方法 第五节 磷单质1.掌握磷原子的价电子层结构;磷的成键特征2.掌握磷的工业制法、同素异形体、化学性质及用途 第六节 磷的化合物1.掌握磷化氢的制备方法和性质2.掌握P 4O 6、P 4O 10和H 3PO 4的结构、制备、性质和用途;磷酸盐的溶解性3.了解次磷酸、亚磷酸、焦磷酸、偏磷酸化学式的书写、命名和主要性质;卤化磷、硫化磷的重要性质 第七节 砷、锑、铋了解砷、锑、铋单质及其化合物的性质递变规律 习题 一 选择题1. 氮气制备的方法是( )A. 将硝酸氨NH 4NO 3加热B. 将亚硝酸氨NH 4NO 2加热C. 将氯气与氨气混合D. B 和C 2. 下列化合物中与水反应放出HCl 的是( )A. CCl 4B. NCl 3C. POCl 3D. Cl 2O 7 3. NO 2溶解在NaOH 溶液中可得到( )A. NaNO 2和H 2OB. NaNO 2、O 2和H 2OC. NaNO 3、N 2O 5和H 2OD. NaNO 3、NaNO 2和H 2O 4. 硝酸盐加热分解可以得到单质的是( )A. AgNO 3B. Pb (NO 3)2C. Zn (NO 3)2D. NaNO 3 5. 下列分子中具有顺磁性的是( )A. N 2OB. NOC. NO 2D. N 2O 3 6. 下列分子中,不存在43π离域键的是( ) (吉林大学《无机化学例题与习题》)A. HNO 3B. HNO 2C. N 2OD. -3N7. 分子中含d —p 反馈 键的是( ) (吉林大学《无机化学例题与习题》)A. HNO 3B. HNO 2C. H 3PO 2D. NH 3 8. 下列物质中酸性最强的是( )A. N 2H 4B. NH 2OHC. NH 3D. HN 39. 下列酸中为一元酸的是( ) (吉林大学《无机化学例题与习题》)A. H 4P 2O 7B. H 3PO 2C. H 3PO 3D. H 3PO 4 10. 下列各物质按酸性排列顺序正确的是( ) (吉林大学《无机化学例题与习题》)A. HNO 2>H 3PO 4>H 4P 2O 7B. H 4P 2O 7>H 3PO 4>HNO 2C. H 4P 2O 7>HNO 2>H 3PO 4D. H 3PO 4>H 4P 2O 7>HNO 211. 下列物质中,不溶于氢氧化钠溶液的是( ) (吉林大学《无机化学例题与习题》)A. Sb(OH)3B. Sb(OH)5C. H 3AsO 4D. Bi(OH)3 12. 加热分解可以得到金属单质的是( ) (吉林大学《无机化学例题与习题》)A. Hg(NO 3)2B. Cu(NO 3)2C. KNO 3D. Mg(NO 3)2 13. NH 4NO 3受热分解产物为( )A. NH 3+HNO 2B. N 2+H 2OC. NO+H 2OD. N 2O+H 2O 14. 下列物质中受热可得到NO 2的是( )A. NaNO 3B. LiNO 3C. KNO 3D. NH 4NO 315. 下列氢化物中,热稳定性最差的是( )A. NH 3B. PH 3C. AsH 3D. SbH 3 16. 遇水后能放出气体并有沉淀生成的是( ) (吉林大学《无机化学例题与习题》)A. Bi(NO 3)2B. Mg 3N 2C. (NH 4)2SO 4D. NCl 3 17. 下列物质均有较强的氧化性,其中强氧化性与惰性电子对有关的是( )A. K 2Cr 2O 7B. NaBiO 3C. (NH 4)2S 2O 8D. H 5IO 6 18. 下列化合物中,最易发生爆炸反应的是( )A. Pb(NO 3)2B. Pb(N 3)2C. PbCO 3D. K 2CrO 4 19. 欲制备NO 气体,最好的实验方法是( ) A. 向酸化的NaNO 2溶液中滴加KI 溶液 B. 向酸化的KI 溶液中滴加NaNO 2溶液 C. Zn 粒与2moldm -3HNO 3反应 D. 向双氧水中滴加NaNO 2溶液20. N 2和C 2H 2分子中都含有 键,但的化学性质不活泼。
无机与分析化学答案(第四版)_南京大学编_课后习题详细

无机及分析化学(第四版)南京大学3-45^R = pl ; JOCMPa = L 处屮丄 1 x273K P ; _ p ;Ts 拓XKPo _ 化X29MK“ mRT 0J64«xS /?ISXPa7 ' K 1 x 298A^“ rM = --------- -- ---------------------------------------------- : ----------------- mPV101.3kPa x 250x MJ"化学犬H CH= (0.<«6 +0.957)x10 '/nn/x8 3l5kPtr^m0/ lK 0273K -50-0xl0^L= 4735kPa* P (V|=r*V- 0<» ^-5 63)xO5=(> 25xP *1913451 iP fn ()MmkRi)6 (1) HI 为空肌・0■不录* P?以对空T 有P.VHSVi1013x4-(101 3^l9 6)Xi X-7.8L(Q*屮注怖AS.U1为可以他 A 了间妙|的临抒基*甲詩価眦分了内氯H.tfiAMp 、= L53g-L 'PV ~lOJJtFtfXSOOxlO *L=30je4, HHRn = —MRTx £00 耳 KJ83l5JtPd £z»w/ ^JC 1X273K =0086mnxil 53X)4Fax5O.OxlO V &订禅m 山•-AT 'x333K=0.957niirial札 15七 HtHjQ 的>100-1.71*98.29^Z 川仆丿―呱2<"丫1警RT 8JI5JtP^7 K 'x288A r=0 04%讪< H ,土臥i?l PV-nRT7用 x 4竟3x11*5 S.3I5X513⑶ShHpPHiffiT書色Ifi力k(3) iCUHr;繭音*农定向力如诱导力⑷ MjO>NdiO Mg:<电荀稔.H: > M fi0 M rt k⑸SiO^^SO;'fi 3期瓯f晶悻/ i吿为仔『晶障i6>SrK'f:>SnCL Sn^ttft*丸于Sn;r. £nCL.问人忖逆过常比创直1训*~上也』人、”1十2“""册和一卜MI即-46.02/f? mol1• -X945JW 1+丄X43WC/册厂-3A.%_屮*- 亠行侏比..川=391K丿加"■狞2比n NH -NH、~ 九Hg科+ 2A卜H凋■} — 4A4H^ I—九町.、一对即^.26KJ mnl 1= 1+2K4J6^J WM?/ '-4x的iJC/ imJ '-亠"卜“褂%% M=I57KJW0.2«Ox»W>02920x180 H-101n=(ftr=O. 2920 x8314x310 = 753Jt?^13 n-b*RT>(0 5C6H)4#640055H).0^0011 ^OJI *0.002) X8 314x298 ■ 2TWW 14. r r = —= ——— = L53**X1O *^-L*fir 8315x291*册二0.51芍< V - 0.1539x50.0x10⑶byAZ = A ;7> = 0,5I2X L54X I0 1 =7.88X 10 * ATLX6xL54xlO * - 2.86x10 *K⑷ 卜給tA|^AT t ^IAT r A*b7-无法测笊・15 f(As 3S^m nS' 广 2nH*16A :K J K-i('hJu |>fckS< L>A 1( \iB:ACl^MESCu^KJlxlCNkln. 4电赫:当囲菠两扣坝牛扣对运动时.滞动的帝电体与博酒寧体之何的电够5f )0/22.4xl7 560/22.4x17-IKK> xKKr ; = 29.K f rO^OxlO 1!- L 1 X29.H■ LS»7&M W L 1CH.NinMK 比为恥尚.心CHN0.7W 00«7l> 0.1727 .._ , 12 I HL21X I03/M 243x10 1A/ =1・86卿&?员|)<匚2欢 CL5&KKX24.5 関=0 162烁册川 1 - 162 :/ nw>J甘汕的ttl^ VTffi* M=92E rnul *100x10 £2 (WK 7心皿討 xIOOxlO.86 K 蘇诉沏*(\H,<)..X HX <X>H>NX N.>( X :h呵 O.543K -- —■ -------K f 1,853 -4V9 誓皈!7 }聲;xh - A\ x抵民一聊特殊的“艄棒眾小中较体额諒威奇聚躺甘了耳和逢捲朋压闵优第勵蛤构空算充#i 了浪f*我社像《attt:皎体因折入隴第順血析出的过科\H»ik液剂彷了在压力ft用卜曲怖搐藏向編渚帧楼时过稈称为屁洽走. ia (1)II水的澳逢圧高十演水.鱼适应了海廉的潘逢医创不健适应播永的褂進医.(2)雄里落液的液度裔Jilt圧大于植債体的濤逢压・菌物孔盐就M L里会凶失倉血枯娄.0)出涪解到雷中使水的融周点ffffi.44)江河中的畋悽在入海赴週列电解质艾牛最锻*5 光加M]船时*朋舷时金旃龌育保护朮用.再1 如见加扛他讷.总化箱对带陀肴媲沉ft用*洛独i口聚贰啟不会址厭・二會5C SO S ; M u &>;t>z pl s urun心T —o 丄-*5芋 丄-飞養n $艮丄+{二倉 nNEAE —)*(二学n s H a亠・v <£13^s 3i M 0—^二當 n二公;)x P丄-12X -呂 —x :( -1 n g X 7站<-1 2® Z T I O I ~- 1-33T T -- 1-3^-^r -—-i =三肾丄二零工6窘*£m 6f >"a=d 0 —「工F:-l 3x rl X T R k **nu垄3H <r u r J:-H pk weI fs pa —*=■■. HC9-6ni £ + B X ^^-«x 7N 空“ 7 I-5^3>・*- ;5 i -A二二X里 F n三X N寧z x -N*- E u ** 兰亠左*r-i 样 J --f i c 3AC -S =i 6 r二X ^--I R s i e x *©- X S T ^-s -X Z A f x dL ^s 咧&o-h1HL-L A X x %A X \h二 「〔二菽町丁-壬 M三工交二=x £j二K x二!!.>;-X .K二二右£y JI _X T o M= ・l s l =才・£亠法*51 I s l #5=l莘毕JA"::+必诃 1)- 2 X (SOtiM rwl ')' I 1*-'} 岷般= 1253.7Mfl!fl/_,% 比收存打"['"“xl 节工了k/別凶1 =195KM.75M工 U) <1) Wi 2V ; + 2fl ; = 4Wj(3)A r ; = {-116&.8M /w>/■')-(-15304W^Hjr')=361 Wk/ mflj'1- 1 A H F ,= ' X36Ih=M0 4M OWJ J 'r ■* 斗 『* 目s均砒■£反应IM*能・£生-_rtl + A t w k A1+A*W|fl _wt + A*H (W J-[2A t nj -AA 丿怙 fyi + At^)/ »i r J=I.U.IkJ M * + %际/ 用川"+ 祗Xk 丿曲# ')-(2x-165kJ mr>/ * * 276U mji/ 1)= -3<)k/ BW / ' a u> ><2) >⑶>4 <⑸>⑹< 10 ⑴M⑵盾人 ⑶mk<5/ 悄 k…940.6x10* JJFW /'1rf =373A :U> AS ・込宀"曲_5IO77K275 A r也际KISMta273K = 22AJKIM A rAft if,弁r 旳況乱g 慟如补比曙化时期加怕队 鮎阳燈间KIJ. W=PAV == 8314J<-1'x373r = 3Jfc/[J W 「"k. J八\= 40.7k/Af/=^-W = 4O.7U-3Jk/ = 3T6My Q 4070UJ do =—=T 373ATM .利用左卫:|血竹養系・灿新反I 柱汁:刨,人f (M 僦既生*小于0可(U 发生(U“:=卜口站MJ 血广)* {jrrmij 册腐)][Cs9b.8KJ 时,「)]+(-39丄42佃川')=2SJkJ rnpZ 1 小于G 阿览引 ⑵注心:=卜 132192 w f J")+2x(- 237 2k/flw/■')!-(-1797V wL )=07JJ 加" 天于0不可投牛') [( 18SU W ')+(-l37/2L/ ntflJ )|= 69.2U mn/ 1小于0可发生15 (I )苫12)否(訂 fi(4)遺;刃昔A r G ; = (-S%W nW)— [(—5515kJww 厂)+2x(-157.317 ^-1 )|= -2U 7W W"1 小于0-此反应可以发牛17.巾址“讥-珞斗AfG.Cb 181—25TAH 打门尸&门十166亦Ar6…(J>= 20—43TAG = 0= 1(WJ A -AG = AW-7M 此憶極人于彼故此J 诅不可发生⑴亠屮:二id 成物的b 射卜no 討砌的t 成対=* 393 5U flin/ 'J+nx(- 283-83M^/11| 匸 2222U 预胡■卜・564£25k/w 」初 牡山 ffX 9 jy m * JTf 'x300ftffi = 19llU19llU, = 135>nol =46?g5644 25}J fnoi 12n, G J CO, =「“O + CO*)* (-3^3.5k/mn/ ' )|-{-12O6.9U>M ?/ 1 )= 178.3k> mr>/ 1A r S ; =(3M 77 AT ' 1+(213,6JJC ' )-92,97JC ' = 160 4MT ' fejSHIftfStl 时 = 0即= Ql7E3xlt>Jmpf 1I604J A r 1 ~ 21 UHQH Y 、2H 、0A r G* - |&K2k71+(-22S.6k/?W ')]-(-1e8.6U ftirt/ '卜8.2打*»「$//: _ 卜24MRJ 加",)+523kJ w*rj/ ')-(- 2353k/') - 45.HM mr?/ "A,S* =(2IWJT Jl8S/U K ')-2827-K 1 =126 l/ Af 1 2>VB1 AG)0 '■卷不握4 36(吃时 AC ;-45,SkJ/W 1 -(3W +273)x126.1x10 \J - -34.Q2U rtrfl/小于"JiJfi 可皈览宅21虚川:・(-235如如「)-(-277血』誠")・42”37财/ **iMU :.r =I26JJ X 1SV ■HV-紀r m o &T -X『60-7-呂「9V Z1+・ ¥『伫$卩-f kPOMT l n m弗T m r m亠—【T H披-}*I m z n -j w v < 9 u p er F c-¥f n w -d -f oo £v ;f ,£-^*X A ><M H ^<-飞E r芒o tl丄二層s *m "丄丄二富7W«W丄菽丄二¥s *二A 丄 H v <Nxwy■£■?」l<一二z y —-u 巷、-hs H a —一电£/■工-hot"「工<A G?n"匸工\久*1生更物}工心心「1反庙拗-*197.15 + (-228.59)・(39436)-2x(-1 氐 4B) = L6KJ1UU =,KM3K fl xKPl N T O.* ^ij|.yi < i dPN)IO(Hi+2x=ll6 k=l6KPjjr* ■色心戶厶.血-■。
大学《无机化学》第四版_习题答案

无机化学(第四版)答案第一章物质的结构1-1 在自然界中氢有三种同位素,氧也有三种同位素,问:总共有种含不同核素的水分子?由于3H太少,可以忽略不计,问:不计3H时天然水中共有多少种同位素异构水分子?1-2 天然氟是单核素(19F)元素,而天然碳有两种稳定同位素(12C和13C),在质谱仪中,每一质量数的微粒出现一个峰,氢预言在质谱仪中能出现几个相应于CF4+的峰?1-3 用质谱仪测得溴得两种天然同位素的相对原子质量和同位素丰度分别为79Br 789183占50。
54%,81Br 80。
9163占49。
46%,求溴的相对原子质量(原子量)。
1-4 铊的天然同位素203Tl和205Tl的核素质量分别为202。
97u和204。
97u,已知铊的相对原子质量(原子量)为204。
39,求铊的同位素丰度。
1-5 等质量的银制成氯化银和碘化银,测得质量比m(AgCl):m(AgBr)=1。
63810:1,又测得银和氯得相对原子质量(原子量)分别为107。
868和35。
453,求碘得相对原子质量(原子量)。
1-6 表1-1中贝采里乌斯1826年测得的铂原子量与现代测定的铂的相对原子质量(原子量)相比,有多大差别?1-7 设全球有50亿人,设每人每秒数2个金原子,需要多少年全球的人才能数完1mol金原子(1年按365天计)?1-8 试讨论,为什么有的元素的相对质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-9 太阳系,例如地球,存在周期表所有稳定元素,而太阳却只开始发生氢燃烧,该核反应的产物只有氢,应怎样理解这个事实?1-10 中国古代哲学家认为,宇宙万物起源于一种叫“元气”的物质,“元气生阴阳,阴阳生万物”,请对比元素诞生说与这种古代哲学。
1-11 “金木水火土”是中国古代的元素论,至今仍有许多人对它们的“相生相克”深信不疑。
与化学元素论相比,它出发点最致命的错误是什么?1-12 请用计算机编一个小程序,按1.3式计算氢光谱各谱系的谱线的波长(本练习为开放式习题,并不需要所有学生都会做)。
张祖德《无机化学习题》及答案第十四章

第十四章 答案1. 金刚石中碳原子采取sp 3杂化,C 原子与C 原子之间以共价键结合形成原子晶体,∴金刚石的主要特征为高硬度,高熔点,高沸点,不导电。
石墨中碳原子采取sp 2杂化,一个C 原子与三个C 原子以共价键连接形成层状结构,每个C 原子上还有一个垂直于层状平面的p 轨道,这些p 轨道重叠形成离域π键,其p 电子离域在每一层上,另外层与层之间是分子间作用力,∴石墨是混合型晶体,它的主要特征为具有润滑性,导电性和导热性。
2. CO 与N 2物理性质相似之处:具有较低的熔点和沸点,具有相近的临界温度和临界压力:m.p. (℃) b.p. (℃) 临界压力(atm) 临界温度(℃)C O-200 -190 36-140 N 2 -210 -196 33-146 化学性质相似之处:CO 与N 2都不助燃;化学性质不同之处:CO 作还原剂,N 2的还原性很差;CO 可以作为配体,而N 2配位能力弱。
CO 与N 2分子性质之所以不同是因为,在CO 分子中O 原子上的一对电子占有C 原子的2p 轨道,增强了C 的电子密度,∴C 原子的配位能力强于N 2( )分子中的N 原子。
CO 2与N 2O 相似性很小,而差异性很大,显然它们并不是等电子体之故。
3. SiCl 4↑(1)Na 2SiO 3(2)←−−Si (3)−−→SiHCl 3 ↑(4)(5)4(6)←−−SiO 2(7)−−→Na 2SiO 3(8)−−→H 2SiO 3(1) Si + 2Cl (2) Si + 2NaOH + H 2O 2SiO 3 + 2H 2↑3 + H 2 (4) SiO 2 + 2Mg(5) 3SiF 4+ 4H 2O 4SiO 4 + 2H 2SiF 6 (6) SiO 2 + 4HF4 + 2H 2O(7) SiO 2 + Na 2CO 32SiO 3+ CO 2↑ (8) SiO 32- + 2H +2SiO 3↓4. SiO 2晶体属于原子晶体,基本单元为SiO 4,Si 原子为四面体中心,四个O 原子位于正四面体的顶点,原子之间以—O —Si —O —共价键相连,∴以固体状态存在;而CO 2是直线型分子,低温下固体CO 2属于分子晶体,每个CO 2分子通过分子间作用力连接,作用力很弱,温度略微上升,分子间作用力就被破坏而形成单个CO 2分子,∴常温时为气态。
无机化学(第四版)课后答案

无机化学课后答案 第13章氢和稀有气体13-1 氢作为能源,其优点是什么?目前开发中的困难是什么? 1、解:氢作为能源,具有以下特点:(1)原料来源于地球上储量丰富的水,因而资源不受限制; (2)氢气燃烧时放出的热量很大;(3)作为燃料的最大优点是燃烧后的产物为水,不会污染环境; (4)有可能实现能量的储存,也有可能实现经济高效的输送。
发展氢能源需要解决三个方面的问题:氢气的发生,氢气的储备和氢气的利用13-2按室温和常压下的状态(气态 液态 固态)将下列化合物分类,哪一种固体可能是电的良导体?BaH 2;SiH 4;NH 3;AsH 3;PdH 0.9;HI13-3试述从空气中分离稀有气体和从混合气体中分离各组分的根据和方法。
3、解:从空气中分离稀有气体和从混合稀有气体中分离各组分,主要是利用它们不同的物理性质如:原子间不同的作用力、熔点沸点的高低以及被吸附的难易等差异达到分离的目的。
13-4试说明稀有气体的熔点 、沸点、密度等性质的变化趋势和原因?4、解:氦、氖、氩、氪、氙,这几种稀有气体熔点、沸点、密度逐渐增大。
这主要是由于惰性气体都是单原子分子,分子间相互作用力主要决定于分子量。
分子量越大,分子间相互作用力越大,熔点沸点越来越高。
密度逐渐增大是由于其原子量逐渐增大,而单位体积中原子个数相同。
13-5你会选择哪种稀有气体作为:(a )温度最低的液体冷冻剂;(b )电离能最低 安全的放电光源;(c )最廉价的惰性气氛。
13-6用价键理论和分子轨道理论解释HeH 、HeH +、He 2+粒子存在的可能性。
为什么氦没有双原子分子存在?13-7 给出与下列物种具有相同结构的稀有气体化合物的化学式并指出其空间构型:(a) ICl 4- (b)IBr 2- (c)BrO 3- (d)ClF7、 解: 4XeF 平面四边形 2XeF 直线形3XeO 三角锥 XeO 直线形13-8用 VSEPR 理论判断XeF 2 、XeF 4、XeF 6、XeOF 4及ClF 3的空间构型。
无机化学第四版第十四章习题答案

无机化学第四版第十四章习题答案(Inorganic chemistry, Fourth Edition, fourteenth chapter, exercises, answers)Fourteenth chapter halogen14-1 why do not use KF water solution when making fluorine by electrolysis? Why liquid hydrogen fluoride does not conduct electricity while potassium fluoride anhydrous hydrogen fluoride solution can conduct electricity?1 solution: because F2 reacts with water, there is no free ion in the liquid HF molecule, so it can not conduct electricity. In the anhydrous HF solution of KF, K+ and HF2- exist;14-2 what are the special characteristics of fluorine in this element? What are the characteristics of hydrogen fluoride and hydrofluoric acid?2, solution: (1) as the radius of the F is very small, so F2 can dissociation is very small, the F- hydration heat of other halogen ions.(2) hydrogen bonds exist between HF molecules, so the boiling point and heat of vaporization of HF molecules are especially high.(3) AgF is a compound easily soluble in water.(4) the product of F2 reaction with water is complex.(5) HF is a weak acid with increasing acidity and increasingconcentration.(6) HF can react with SiO2 or silicate to form gaseous SiF4;14-3 (1) the reaction tendency of Cl2 was generated by comparing KMnO4, K2Cr2O7 and MnO2 with hydrochloric acid (1mol.L-1) according to the electrode potential.(2) what is the minimum concentration of hydrochloric acid if MnO2 is reacted with hydrochloric acid to cause Cl2 to occur successfully?3, Xie: (1) according to the relationship between electrode potential, we can see the reaction trend:KMnO4>K2Cr2O7>MnO2;14-4 according to the potential map, the reaction equilibrium constant of Br2 in alkaline aqueous solution is reduced to Br- and BrO3- at 298K.4. Solution: by formula: -ZFE=-RTlnKGet: K=exp (ZFE/RT)=2.92 * 103814-5, three, fluorinated nitrogen NF3 (boiling point -129 degrees Celsius) does not show Lewis alkaline, and relatively low molecular mass compounds NH3 (boiling point -33 degrees Celsius) is a well known Lewis base. (a) to explain the reasonwhy their volatility is so great; (b) explain why they differ in alkalinity.5. Xie: (1) NH3 has a higher boiling point because of the hydrogen bond between the molecules.(2) the NF3 atom has a large radius of F atoms, which makes it difficult to match Lewis acid because of steric hindrance.In addition, the electronegativity of the F atom is larger, which weakens the electronegativity of the central atom N.14-6 from bittern making Br2 available chlorine oxidation method. But from a thermodynamic point of view, Br- can be oxidized to Br2 by O2. Why not use O2 to make Br2?14-7 pass Cl2 can be used in slaked lime to obtain bleaching powder, and hydrochloric acid can be added to Cl2 in the solution of bleaching powder. The two phenomena are explained by using electrode potential.7, Xie: because Cl2 pass into the hydrated lime is in alkaline medium, and because of, so Cl2 in alkaline conditions prone to disproportionation reaction.When the hydrochloric acid is added to the bleach solution, the following reaction can be carried to the right:HClO + Cl- + H+ = Cl2 + H2O14-8 which of the following oxides are anhydrides: OF2, Cl2O7,ClO2, Cl2O, Br2O and I2O5? If the anhydride is prepared, the reaction is obtained by the corresponding acid or other method of getting the anhydride.8 solution: Cl2O7 is the anhydride of HClO4. Cl2O, Br2O are HClO, HBrO anhydrides, respectively14-9 how do you identify the three salts of KClO, KClO3, and KClO4?9 、 solution: add a small amount of solid into the dried test tube, and then do the following experimentAdd dilute hydrochloric acid, that is, Cl2 gas release is KClO;KClO+2HCl=KCl+Cl2+H2OAdding concentrated hydrochloric acid has Cl2 and emits, and the solution turns yellow is KClO3;8KC1O3+24HCl (strong) =9Cl2 = +8KCl+60ClO2 (yellow) +12H2OThe other is KClO414-10 the reaction equation for preparing HIO4, KIO3, I2O5 and KIO4 was prepared with I2 as raw material.The solubility of 14-11 (1) I2 in water is very small. The concentration of I2 saturated solution is calculated from the following 2.5 reactions at 298K.I2 (s) + 2e- = 2I-; 0.535V = Phi thetaI2 (AQ) + 2e- = 2I-; 0.621V = Phi theta(2) 0.100mol I2 was dissolved in 1.00L 0.100mol.L-1 KI solution and I3- solution was obtained. The Kc value of the I3- generation reaction is 0.752, and the concentration of I2 in the I3- solution is calculated.14-11, (1) I2 (AQ) =I2 (s)K=exp (ZFE/RT)=812K=1/[I2 (AQ)]I2 (AQ) =1/812=0.00123mol/L(2) I2+I-=I3-;KC=; so [I2]=?The solution is x=0.0934mol/L.Explain the following phenomena: 14-12 by adding a small amount of NaClO in the electrode potential of starch potassium iodide solution, blue A solution, adding excessive NaClO, B get a colorless solution, then acidified and add a small amount of solid Na2SO3 in B solution, A blue reproduction, when the excessive amount of Na2SO3 blue and then faded become colorlesssolution C, A the solution then add NaIO3 solution and blue. Point out A, B, C why each kind of substance, and write out the reaction equation of each step.12, Xie: A:I2;B:NaIO3;C:NaI14-13 write out the equation for the reaction of iodate and excess H2O2, such as adding starch to the system. What do you see?13 solution: HIO3+3H2O2=3O2+HI+3H2O; if the starch is added to the system, the solution turns blue slowly and then fades.14-14 write out the molecular formula of three metal halides with covalent bonds, and explain the common properties of this type of halides.14 and Xie: (AlCl3) 2; (AlBr3) 2; (AlI3) 2; all molecules contain coordinate bonds14-15 what is a multi halide? What is the trend of the formation of Br3- and Cl3- ions in comparison with I3- ions?14-16 what are halogen compounds?(a) write ClF3, BrF3 and IF3 halogen halide complexes, central atom hybridization orbitals, molecular electronicconfigurations and molecular configurations.(b) is there any risk of explosion when the following compounds are exposed to BrF3? Explain why.SbF5; CH3OH; F2; S2Cl2(c) why are halogenated compounds often diamagnetic, covalent, and chemically active than halogen?14-17 laboratory has a calcium halide, soluble in water, try to use concentrated H2SO4 to determine the nature and name of this salt.17. Solution: different phenomena can be identified by the reaction of halide with concentrated sulfuric acid.14-18 please click the following example,The bromine, iodine, and halogen ions containing various conversion and transformation conditions as oxygen acid interaction diagram.。
无机化学第四版课后习题答案

= = 0.070
则 = 0.26100 kPa = 26 kPa
平衡时该气体混合物的总压为52 kPa
(2)T不变, 不变。
NH4HS(s)NH3(g)+ H2S(g)
平衡分压/kPa 25.3+
= = 0.070
= 17 kPa
13.解:(1)PCl5(g)PCl3(g)+ Cl2(g)
酸碱中和后:H++ OH-→H2O
c(OH-)=0.045mol·L-1
pH=12.65
3.解:正常状态时
pH=7.35c(H+)=4.5×10-8mol·L-1
pH=7.45c(H+)=3.5×10-8mol·L-1
患病时
pH=5.90c(H+)=1.2×10-6mol·L-1
患此种疾病的人血液中c(H+)为正常状态的27~34倍。
HOAc H++ OAc-
c平/(mol·L-1) 0.078-x x 0.74+x
,x=1.9×10-6,pH=-lgc(H+)=5.72
向此溶液通入0.10molHCl气体,则发生如下反应:
NaOAc + HCl→NaCl + HOAc
反应后:c(HOAc)=0.18mol·L-1,c(OAc-)=0.64mol·L-1
p(Ar) =1103Pa
6.解:(1) 0.114mol;
(2)
(3)
7.解:(1)p(H2) =95.43 kPa
(2)m(H2) = =0.194 g
8.解:(1)=5.0 mol
(2)=2.5 mol
结论:反应进度()的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
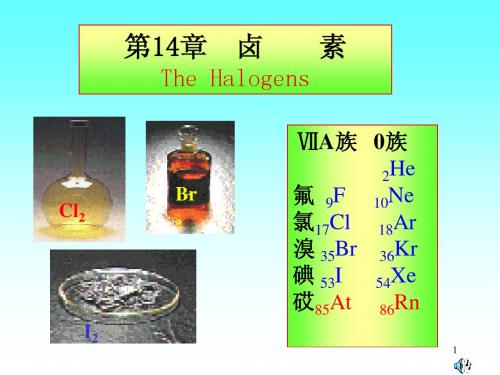
大学无机化学第14章 卤素
4
ø2
(0.4556 1 1.0774 1)V 0.7665 V 2
ø3
(0.6126 6 - 1.0774 1)V 0.5196 V 5
12
(2)
0.7665
BrO
3
0.5357
BrO
-
0.4556
Br2
1.0774
Br
-
0.5196
Br2、BrO 可以歧化。
13
电解液中,常加入少量的氟化物如LiF、 AlF3等,以降低电解质的熔点,减少HF的挥 发。阳极和阴极用隔板隔开,气体氟经过 净化后,以17.7~17.8 MPa的压力压入特 22 制钢瓶中。
2-3
2、合成法 1986年Karl Chrite 首次 用化学方法合成了F2: (1)4KMnO4+4KF+20HF==4K2MnF6+10H2O+3O2 ↑ (2)SbCl5+5HF====SbF5+5HCl 423K (3)2K2MnF6+4SbF5 ==== 4KSbF6+2MnF3+F2 ↑
注意: 氟与稀碱反应是 2F2+2OH-=2F-+OF2+H2O 氟与浓碱反应是 2F2+4OH-=4F-+O2+2H2O 卤素与碱反应是制备次卤酸盐和卤酸盐的 常用方法,在酸性条件下均可发生反岐化反 应
3Br2+2OH-=5Br-+BrO3-+3H2O
5Br-+BrO3-+6H+= 3Br2+3H2O
-
(3) 因为 BrO 能歧化 ,不稳定。 所以 Br 2 (l) 与 NaOH 混合最稳定的产物
无机化学_第四版_北师大版_课后答案(补充:1-11章)_khdaw

无机化学_第四版_北师大版_课后答案(补充:1-11章)_khdaw第一章原子结构与元素周期系1-14Br2分子分解为Br原子需要的最低解离能为190kJ/mol,求引起溴分子解离需要吸收的最低能量子的波长与频率。
答:∵E=190kJ/mol∴每个分子解离所需要的能量为190×10-3/6.02×1023=3.156×10-19(J)所需吸收光子能量为E=hν=3.156×10-19J∴λ=c/ν=c·h/E=3×108×6.63×10-34/3.156×10-19=6.3×10-7(m)=630(nm)ν=4.76×10141-19氢原子核外电子光谱中的莱曼光谱中有一条谱线的波长为103nm,问:它相应于氢原子核外电子的哪一个跃迁?答:氢原子莱曼系的跃迁吸收光子的波数公式为ǔ=1/λ=R H·(1/12-1/n2)已知波长λ=103nm=1.03×10-7m∴1/1.03×10-7=R H·(1/12-1/n2),R H=1.09677×10-7∴n=2.95≈3∴相应于氢原子电子从n=1的轨道向n=3的轨道跃迁的过程,即从K 层→M层轨道的跃迁1-21当电子的速度达到光速的20.0%时,该电子的德布罗意波长多大?当锂原子(质量7.02amu)以相同速度飞行时,其德布罗意波长多大?答:对电子,λ=h/mv=6.63×10-34×(9.11×10-31×3×108×20%)-1=1.21×10-11m=12.1(pm)对锂原子,其m=7.02×1.660×10-24×10-3=1.165×10-26(kg)∴λ=h/mv=6.63×10-34×(1.165×10-26×3×108×20%)-1 =9.48×10-16m=9.48×10-4(pm)1-23处于K、L、M层的电子最大可能数目各为多少?答:处于K层,即n=1,而每个能层能容纳的最大电子数目为2n2∴第K层:2×12=2(个)第L层:2×22=8(个)第M层:2×32=18(个)1-24以下哪些符号是错误的?(a)6s(b)1p(c)4d(d)2d(e)3p(f)3f答:(a)6s对;(b)1p错(因为n=1,则l只能是0,即s);(c)4d对;(d)2d错(因为n=2,则l可能是0,1,即s,p轨道);(e)3p对;(f)3f错(因为n=3,则l可能是0,1,3即s,p,d轨道)。
无机化学课后习题参考答案完全版(汪小兰第四版)

目录第一章绪论 (1)第二章饱和烃 (2)第三章不饱和烃 (6)第四章环烃 (14)第五章旋光异构 (23)第六章卤代烃 (28)第七章波谱法在有机化学中的应用 (33)第八章醇酚醚 (43)第九章醛、酮、醌 (52)第十章羧酸及其衍生物 (64)第十一章取代酸 (72)第十二章含氮化合物 (79)第十三章含硫和含磷有机化合物 (87)第十四章碳水化合物 (90)第十五章氨基酸、多肽与蛋白质 (101)第十六章类脂化合物 (106)第十七章杂环化合物 (115)Fulin 湛师第一章 绪论1.1扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2 NaCl 与KBr 各1mol 溶于水中所得的溶液与NaBr 及KCl 各1mol 溶于水中所得溶液是否相同?如将CH 4及CCl 4各1mol 混在一起,与CHCl 3及CH 3Cl 各1mol 的混合物是否相同?为什么? 答案:NaCl 与KBr 各1mol 与NaBr 及KCl 各1mol 溶于水中所得溶液相同。
因为两者溶液中均为Na +,K +,Br -, Cl -离子各1mol 。
由于CH 4与CCl 4及CHCl 3与CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合物。
1.3碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH 4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624H CCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2p y2p z2p x2sH1.4写出下列化合物的Lewis 电子式。
a.C 2H 4b.CH 3Clc.NH 3d.H 2Se.HNO 3f.HCHOg.H 3PO 4h.C 2H 6i.C 2H 2j.H 2SO 4 答案:a.C C H HCC HH HH或 b.H C H c.H N Hd.H S H e.H O NOf.O C H Hg.O P O O H H Hh.H C C HHH H HO P O O H HH或i.H C C Hj.O S O HH OS H H或1.5下列各化合物哪个有偶极矩?画出其方向。
第四版无机化学习题及答案

第一章原子结构和原子周期系1-1根据原子序数给出下列元素的基态原子的核外电子组态:(a)K (b)Al (c)Cl (d)Ti(Z=22)(e)Zn(Z=30)(f)As(Z=33)答:(a)[Ar]4s1(b)[Ne]3s23p1(c)[Ne]3s23p5(d)[Ar]3d54s2(e)[Ar] 3d104s1(f)[Ar]4s24p31-2给出下列原子或离子的价电子层电子组态,并用方框图表示轨道,填入轨道的电子用箭头表示。
(a)Be (b)N (c)F (d)Cl-(e)Ne+(f)Fe3+(g)As3+1-3 Li+、Na+、K+、Rb+、Cs+的基态的最外层电子组态与次外层电子组态分别如何?1-4以下+3价离子那些具有8电子外壳?Al3+、Ga3+、Bi3+、Mn3+、Sc3+答:Al3+和Sc3+具有8电子外壳。
1-5已知电中性的基态原子的价电子层电子组态分别为:(a)3s23p5(b)3d64s2(c)5s2(d)4f96s2(e)5d106s1试根据这个信息确定它们在周期表中属于那个区、哪个族、哪个周期。
答:(a)p区,ⅦA族,第三周期(b)d区,Ⅷ族,第四周期(c)s区,ⅡA族,第五周期(d)f区,ⅢB族,第六周期(e)ds区,ⅠB族,第六周期1-6根据Ti、Ge、Ag、Rb、Ne在周期表中的位置,推出它们的基态原子的电子组态。
答:Ti位于第四周期ⅣB族,它的基态原子的电子组态为[Ar]3d24s2;Ge位于第四周期ⅣA族,它的基态原子的电子组态为[Ar]3d104s24p2;Ag位于第五周期ⅠB族,它的基态原子的电子组态为[Kr] 4d105s1;Rb位于第五周期ⅠA族,它的基态原子的电子组态为[Kr] 5s1;Ne位于第二周期0族,它的基态原子的电子组态为[He] 2s22p6。
1-7某元素的基态价层电子构型为5d36s2,给出比该元素的原子序数小4的元素的基态原子电子组态。
北师大无机化学四版习题答案14章碳硅硼

第14章 碳、硅、硼14.1. 对比等电子体CO 与N 2的分子结构及主要物理、化学性质。
解:CO 和N 2是等电子体(14e ),分子轨道能级图相似,分子中都有三重键:∶N ≡N ∶、C O δ+δ-∶∶,键能相近。
一般条件下,两种物质都是气体,很少溶于水;熔、沸点,临界压力,临界温度等一些物理性质也相似。
但CO 和N 2分子中三重键特点并不完全相同,N 2分子中负电荷分布是对称的,而CO 却是不对称的。
C 原子略带负电荷,再加上C 的电负性比N 小,因此CO 比N 2较易给出电子对向过渡金属原子(离子)配位,除形成σ―配键外,还有π―反馈键形成,故生成的配合物较稳定。
而N 2的配位能力远不如CO ,分子氮配合物远不如羰基化合物稳定。
所以CO 的键能虽比N 2略大,但化学性质却比N 2要活泼,不象N 2那样“惰性”。
14.2 概述CO 的实验室制法及收集方法,写出CO 与下列物质起反应的方程式并注明反应的条件:(1)Ni ;(2)CuCl ;(3)NaOH ;(4)H 2 ;(5)PdCl 2 解:CO 的实验室制法:HCOOH浓H 2SO 42O用排水集气法收集。
(1)Ni + 4CO100 -250atm 423 -493KNi(CO)4(2)(3)CO + NaOH HCOONa1.01×103kPa473K(4)CO + 3H 2CH 4 + H 2O Fe 、Co 、Ni523K,101kPa(5) CO + PdCl 2 + H 2O === Pd ↓ + CO 2 + 2HCl14.3. 某实验室备有CCl 4、干冰和泡沫灭火器(内为Al 2(SO 4)3和NaHCO 3),还有水源和砂。
若有下列失火情况,各宜用哪种方法灭火并说明理由: (1)金属镁着火; (2)金属钠着火;(3)黄磷着火; (4)油着火; (5)木器着火。
解:14.4. 标准状况时,CO 2的溶解度为170 mL / 100g 水:(1)计算在此条件下,溶液中H 2CO 3的实际浓度。
无机化学_第四版_北师大版_课后答案(补充:1-11章)_khdaw

第一章原子结构与元素周期系1-14Br2分子分解为Br原子需要的最低解离能为190kJ/mol,求引起溴分子解离需要吸收的最低能量子的波长与频率。
答:∵E=190kJ/mol∴每个分子解离所需要的能量为190×10-3/6.02×1023=3.156×10-19(J)所需吸收光子能量为E=hν=3.156×10-19J∴λ=c/ν=c·h/E=3×108×6.63×10-34/3.156×10-19=6.3×10-7(m)=630(nm)ν=4.76×10141-19氢原子核外电子光谱中的莱曼光谱中有一条谱线的波长为103nm,问:它相应于氢原子核外电子的哪一个跃迁?答:氢原子莱曼系的跃迁吸收光子的波数公式为ǔ=1/λ=R H·(1/12-1/n2)已知波长λ=103nm=1.03×10-7m∴1/1.03×10-7=R H·(1/12-1/n2),R H=1.09677×10-7∴n=2.95≈3∴相应于氢原子电子从n=1的轨道向n=3的轨道跃迁的过程,即从K 层→M层轨道的跃迁1-21当电子的速度达到光速的20.0%时,该电子的德布罗意波长多大?当锂原子(质量7.02amu)以相同速度飞行时,其德布罗意波长多大?答:对电子,λ=h/mv=6.63×10-34×(9.11×10-31×3×108×20%)-1=1.21×10-11m=12.1(pm)对锂原子,其m=7.02×1.660×10-24×10-3=1.165×10-26(kg)∴λ=h/mv=6.63×10-34×(1.165×10-26×3×108×20%)-1=9.48×10-16m=9.48×10-4(pm)1-23处于K、L、M层的电子最大可能数目各为多少?答:处于K层,即n=1,而每个能层能容纳的最大电子数目为2n2∴第K层:2×12=2(个)第L层:2×22=8(个)第M层:2×32=18(个)1-24以下哪些符号是错误的?(a)6s(b)1p(c)4d(d)2d(e)3p(f)3f答:(a)6s对;(b)1p错(因为n=1,则l只能是0,即s);(c)4d对;(d)2d错(因为n=2,则l可能是0,1,即s,p轨道);(e)3p对;(f)3f错(因为n=3,则l可能是0,1,3即s,p,d轨道)。
湖南理工学院无机化学习题库第14章P区元素(二)

湖南理工学院无机化学习题库第14章P区元素(二)第14章P区元素(二)一是非题1. 物种O2+, O2 , O2 -, O2 2-,的键长按序从右向左增大()2 ()3. 常温下最稳定的晶体硫为S2。
()4. 物种SO3, O3, ICl3 和H3O+都是平面三角形。
()5. SF4, N2O, XeF2, IF3 价层均有 5 对价电子对,但这些分子的空间构性却不同。
这些分子的空间构型分别为变形四面体,直线型,直线型,T 型。
()二选择题1. 下列物质在常温下呈液态的是()1 HF2 Br23 I24 MgCl22. 下列微粒中不具氧化性的是()1 F2 2 Cl-3 BrO-(4) I23. 根据标准电极电位,判断卤素离子X-能被O2 氧化发生4X-+O2+2H2O=2X2+4OH-反应的是()1 F-2 Cl-(3)Br-(4)都不能4. 在任何温度下,X2 与碱性溶液作用能得到XO3-和X-的卤素是()1 F2 2 Cl23 Br2 (4) I25. 由于HF 分子间形成氢键而产生的现象是()1 HF 的熔点高于HCl2 HF 是弱酸3 除F-化物外还有HF2 等化合物4 三种现象都是6. HX 及卤化物中的X- 具有最大还原性的是()1 F-2 I-3 Cl-4 Br-7. 盐酸是重要的工业酸,它的产量标志国家的化学工业水平,其主要性质是()1 浓HCl 有络合性 2 具有还原性3 具有强酸性4 三者都是8. 下列各组溶液按pH 值增大顺序排列的是()1 HI<HBr<HCl<HF2 HClO4<HClO3<HClO3 HClO<HBrO<HIO4 三者都是9. 下列各组物质,按热稳定性顺序增加排列的是()1 HI<HBr<HCl<HF (2) HClO<NaClO3 HClO<HClO3<HClO4(4) 三者都是10. 下列各组物质其水解程度按顺序增加排列的是()1 KClO3, KClO2, KClO (2) KClO, KbrO, KIO3 KCl, KClO, NH4ClO (4)三者都是11. 氯元素会全部被氧化的反应是()1 Cl2+H2O=HCl+HClO (2) 2NaCl+F2=2NaF+Cl23 4HCl+MnO2=MnCl2+Cl2+2H2O4 2NaCl+3H2SO4+MnO2=MnSO4+2NaHSO4+2H2O+Cl212. 制备F2 实际所采用的方法是()1 电解HF2 电解CaF23 电解KHF24 电解NH4F13. 实验室制备Cl2 气体的最常用的方法是()1 KMnO4 与浓盐酸共热2 MnO2 与稀盐酸反应3 MnO2 与浓盐酸共热4 KMnO4 与稀盐酸反应14. 实验室制得的氯气含有HCl 和水蒸气欲通过二个洗气瓶净化下列洗气瓶中试剂选择及顺序正确的是()1 NaOH 浓H2SO42 CaCl2 浓H2SO43 H2O 浓H2SO4 4 浓H2SO4 H2O15. 下列各试剂混合后能产生氯气的是()1 NaCl 与浓H2SO42 NaCl 和MnO23 NaCl 与浓HNO34 KMnO4 与浓HCl16. 实验室中制取少量HBr 所采用的方法是()1 红磷与Br2 混合后滴加H2O; 2 KBr 固体与浓H2SO4 作用3 红磷与H2O 混合后滴加Br2;4 Br2 在水中歧化反应17. 欲由KBr 固体制备HBr 气体应选择的酸是()1 H2SO42 HAc3 HNO34 H3PO418. 氢氟酸最好储存在()1 塑料瓶中2 无色玻璃瓶中3 金属容器中4 棕色玻璃瓶中19. 卤素单质中与水不发生水解反应的是1 F2 2 Cl23 Br24 I220. 下列含氧酸中酸性最弱的是()1 HClO2 HIO3 HIO34 HBrO21. 下列含氧酸中酸性最强的是()1 HClO32 HClO3 HIO34 HIO22. 下列有关卤素的论述不正确的是()1 溴可由氯作氧化剂制得2 卤素单质都可由电解熔融卤化物得到3 I2 是最强的还原剂4 F2 是最强的氧化剂23. 下列含氧酸的氧化性递变不正确的是()1 HClO4>H2SO4>H3PO42 HBrO4>HClO4>H5IO63 HClO>HClO3>HClO4 4 HBrO3>HClO3>HIO324. 下列物质中关于热稳定性判断正确的是()1 HF<HCl<HBr<HI2 HF>HCl>HBr>HI3 HClO>HClO2>HClO3>HClO4 4 HCl>HClO4>HBrO4>HIO4三填空题1. 硫的两种主要同素异形体是和其中稳定态的单质是它受热到95℃时转变为两者的分子都是具有状结构,其中硫原子的杂化方式是2. S8 环与硫链二者中能溶于CS2的是3. 单斜硫与弹性硫于室温下放置,均能转变为4. 在SO3中S 采取杂化方式为而在(SO3)3中S 采取的杂化方式为5. H2O2分子中O-O 键级为 O2 分子中O-O 键级为 O3分子中O-O 键级为6. 高空大气层中臭氧对生物界的保护作用是因为7. 硫酸表现出沸点高和不易挥发性是因为8. 向各离子浓度均为0.1mol/dm-3的Mn2+, Zn2+, Cu2+ Ag+Hg2+, Pb2+混合溶液中通入H2S 可被沉淀的离子有9. 若除去氢气中少量的SO2H2S 和水蒸气,应将氢气先通过溶液再过10. 硫化物ZnS, CuS, MnS, SnS, HgS 中易溶于稀盐酸的是不溶于稀盐酸但溶于浓盐酸的是不溶于浓盐酸但可溶于硝酸的是只溶于王水的是11. AgNO3 溶液与过量的Na2S2O3 溶液反庆生成色的过量的AgNO3溶液与Na2S2O3 溶液反应生成色的后变为色的12. NaHSO3受热分解产物为Na2S2O8 受热分解产物为Na2SO3受热分解产物为13. H2S 水溶液长期放置后变混浊原因是14. 非曲直酸化某溶液得S 和H2SO3则原溶液中的含硫化合物可能为或15. 写出下列物质的化学式胆矾石膏绿矾芒硝皓矾泻盐摩尔盐明矾16. 染料工业上大量使用的保险粉的分子式是它具有强性四完成并配平下列反应方程式1. 向Na2S2溶液中滴加盐酸2. 将Cr2S3投入水中3. 过氧化钠分别与冷水热水作用4. PbS 中加入过量H2O25. Ag(S2O3)23-的弱酸性溶液中通入H2S五简答题1. 为什么O2 为非极性分子而O3 却为极性分子2. 从分子结构角度解释为什么O3 比O2 的氧化能力强3. 将臭氧通入酸化的淀粉碘化钾溶液给出实验现象及相关的反应方程式4. 给出SO2 SO3 O3 分子中离域大键类型并指出形成离域大键的条件5. 已知O2F2 结构与H2O2 相似但O2F2 中O-O 键长121pm H2O2 中O-O 键长148pm请给出O2F2 的结构并解释二个化合物中O-O 键长不同的原因6. 将还原剂H2SO3 和氧化剂浓H2SO4 混合后能否发生氧化还原反应为什么7. 现有五瓶无色溶液分别是Na2S, Na2SO3, Na2S2O3, Na2SO4, Na2S2O8 试加以确认并写出有关的反应方程式8. 将无色钠盐溶于水得无色溶液A 用pH 试纸检验知A 显碱性向A 中滴加KMnO4 溶液则紫红色褪去,说明 A 被氧化为B,向 B 中加入BaCl2 溶液得不溶于强酸的白色沉淀C,向 A 中加入稀盐酸有无色气体 D 放出。
江苏师范大学《无机化学》习题库及答案第十四章 P区元素(二)

第十四章P区元素(二)一、选择题(每题2分,共20分)1、在下列结构中,属于sp3d杂化的是()A、PCl3B、[PCl4]+C、XeF2D、[PCl6]-2、下列产物中哪个是H2O2同HNO2水溶液反应的主要产物()A、O2和HNO3B、O2和NOC、H2O和HNO3D、H2O和NO3、王水溶解贵金属时,HCl的主要作用是什么()A、增加氢离子浓度B、提供比HNO3更强的氧化性C、将金属转化为易溶于HNO3的状态D、提供Cl-作络合剂4、下列双原子分子或离子中,和CO互为等电子体的是()A、N2+B、CN-C、O2+D、O22-5、硝酸盐受热分解可得到单质的是()A、AgNO3B、Pb(NO3)2C、Zn(NO3)2D、NaNO36、下列物质的水解产物中既有酸又有碱的是()A、Mg3N2B、SbCl3C、POCl3D、NCl37、加热下列铵盐,不产生氨气的是()A、(NH4)2SO4B、(NH4)2Cr2O7C、NH4HCO3D、(NH4)2HPO48、下列硫化物既不溶于Na2S, 又不溶于Na2S x的是()A、Bi2S3B、Sb2S3C、As2S3D、SnS29、下列盐加热分解时,分子中各元素都参与氧化还原反应的是()A、NH4NO2B、Pb(NO3)2C、AgNO3D、NH4NO310、下列有关过氧化氢(H2O2)性质的表达最全面的是()A、是一种酸B、具有氧化性C、具有还原性D、既是酸,又是氧化剂和还原剂二、填空题(每空1分,共32分)1、硫的两种主要同素异形体是和,其中稳定态的单质是。
2、在SO3中S 采取杂化方式为。
3、硫化物ZnS, CuS, MnS, SnS, HgS 中,易溶于稀盐酸的是不溶于稀盐酸但溶于浓盐酸的是不溶于浓盐酸但可溶于硝酸的是只溶于王水的是。
4、H2S 水溶液长期放置后变混浊,原因是。
5、AgNO3 溶液与过量的Na2S2O3 溶液反应生成色的,过量的AgNO3溶液与Na2S2O3 溶液反应生成色的,后变为色的。
大学无机化学第十四章试题及答案培训讲学

大学无机化学第十四章试题及答案第十五章氮族元素总体目标:1.掌握氮和磷单质、氢化物、卤化物、氧化物、含氧酸及其盐的结构、性质、制备和用途2.了解砷、锑、铋单质及其化合物的性质递变规律各节目标:第一节氮的单质掌握N2的结构;氮与非金属、金属的反应;氮气的实验室制法和工业制法第二节氮的成键特征通过氮的价层电子结构,了解它的成键特征第三节氮的氢氧化物1.掌握NH3的工业制法和实验室制法以及它的结构2.了解NH3的物理性质;掌握它的配位反应、取代反应、氨解反应和氧化反应以及用途;铵盐的水解性和热稳定性。
3.了解联氨、羟胺、叠氨酸的结构和性质第四节氮的氧化物1.掌握氮元素的自由能—氧化图2.掌握氮的氧化物(N2O、NO、N2O3、NO2、N2O4、N2O5)的结构和重要性质3.了解HNO2及其盐的制备、结构、性质4.掌握HNO3及其盐的结构和性质;硝酸盐热分解的一般规律;王水的成分和性质5.掌握硝酸盐和亚硝酸盐的鉴别方法第五节磷单质1.掌握磷原子的价电子层结构;磷的成键特征2.掌握磷的工业制法、同素异形体、化学性质及用途第六节磷的化合物1.掌握磷化氢的制备方法和性质2.掌握P4O6、P4O10和H3PO4的结构、制备、性质和用途;磷酸盐的溶解性3.了解次磷酸、亚磷酸、焦磷酸、偏磷酸化学式的书写、命名和主要性质;卤化磷、硫化磷的重要性质第七节砷、锑、铋了解砷、锑、铋单质及其化合物的性质递变规律习题一选择题1. 氮气制备的方法是()A. 将硝酸氨NH4NO3加热B. 将亚硝酸氨NH4NO2加热C. 将氯气与氨气混合D. B和C2. 下列化合物中与水反应放出HCl的是()A. CCl4B. NCl3C. POCl3D. Cl2O73. NO2溶解在NaOH溶液中可得到()A. NaNO2和H2OB. NaNO2、O2和H2OC. NaNO3、N2O5和H2OD. NaNO3、NaNO2和H2O4. 硝酸盐加热分解可以得到单质的是()A. AgNO3B. Pb(NO3)2C. Zn(NO3)2D. NaNO35. 下列分子中具有顺磁性的是()A. N2OB. NOC. NO2D. N2O3π离域键的是() (吉林大学《无机化学例题与习题》) 6. 下列分子中,不存在43NA. HNO3B. HNO2C. N2OD. -37. 分子中含d—p反馈π键的是() (吉林大学《无机化学例题与习题》)A. HNO3B. HNO2C. H3PO2D. NH38. 下列物质中酸性最强的是()A. N2H4B. NH2OHC. NH3D. HN39. 下列酸中为一元酸的是() (吉林大学《无机化学例题与习题》)A. H4P2O7B. H3PO2C. H3PO3D. H3PO410. 下列各物质按酸性排列顺序正确的是() (吉林大学《无机化学例题与习题》)A. HNO2>H3PO4>H4P2O7B. H4P2O7>H3PO4>HNO2C. H4P2O7>HNO2>H3PO4D. H3PO4>H4P2O7>HNO211. 下列物质中,不溶于氢氧化钠溶液的是() (吉林大学《无机化学例题与习题》)A. Sb(OH)3B. Sb(OH)5C. H3AsO4D. Bi(OH)312. 加热分解可以得到金属单质的是() (吉林大学《无机化学例题与习题》)A. Hg(NO3)2B. Cu(NO3)2C. KNO3D. Mg(NO3)213. NH4NO3受热分解产物为()A. NH3+HNO2B. N2+H2OC. NO+H2OD. N2O+H2O14. 下列物质中受热可得到NO2的是()A. NaNO3B. LiNO3C. KNO3D. NH4NO315. 下列氢化物中,热稳定性最差的是()A. NH3B. PH3C. AsH3D. SbH316. 遇水后能放出气体并有沉淀生成的是() (吉林大学《无机化学例题与习题》)A. Bi(NO3)2B. Mg3N2C. (NH4)2SO4D. NCl317. 下列物质均有较强的氧化性,其中强氧化性与惰性电子对有关的是()A. K2Cr2O7B. NaBiO3C. (NH4)2S2O8D. H5IO618. 下列化合物中,最易发生爆炸反应的是()A. Pb(NO3)2B. Pb(N3)2C. PbCO3D. K2CrO419. 欲制备NO气体,最好的实验方法是()A. 向酸化的NaNO2溶液中滴加KI溶液B. 向酸化的KI溶液中滴加NaNO2溶液C. Zn粒与2mol·dm-3HNO3反应D. 向双氧水中滴加NaNO2溶液20. N2和C2H2分子中都含有 键,但的化学性质不活泼。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
B:NaIO3 ;
C:NaI
14-13写出碘酸和过量 H2O2 反应的方程式,如在该体系中加入淀粉,会看到什么现象?
13、解:HIO3+3H2O2=3O2+HI+3H2O;如果在该体系中加入淀粉,溶液慢慢变蓝,后又褪色。
14-14写出三个具有共价键的金属卤化物的分子式,并说明这种类型卤化物的共同特性。
14-18 请按下面的实例,将溴﹑碘单质﹑卤离子及各种含氧酸的相互转化和转化条件绘成相互关系图。
K=1/[I2(aq)]
I2(aq)=1/812=0.00123mol/L
(2) I2+I-=I3-;
KC=;所以[I2]=
解得x=0 .0934mol/L。
14-12利用电极电势解释下列现象:在淀粉碘化钾溶液中加入少量NaClO 时 ,得到蓝色溶液A,加入过量NaClO 时 ,得到无色溶液 B ,然后酸化之并加少量固体 Na2SO3 于B 溶液,则A的蓝色复现,当Na2SO3 过量时蓝色又褪去成为无色溶液C ,再加入NaIO3 溶液蓝色的A 溶液又出现。指出A﹑B﹑C各为何种物质,并写出各步的反应方程式。
(b)下列化合物与BrF3 接触时存在爆炸危险吗?说明原因。
SbF5 ; CH3OH ; F2 ; S2Cl2
(c)为什么卤素互化物常是反磁性共价型而且比卤素化学活性大?
14-17 实验室有一卤化钙,易溶于水,试利用浓H2SO4 确定此盐的性质和名称。
17、解:利用卤化物与浓硫酸反应的不同现象,可以鉴别。
14-4根据电势图计算在298K时,Br2 在碱性水溶液中歧化为Br- 和BrO3- 的反应平衡常数。
4、解:由公式:-ZFE=-RTlnK
得:K=exp(ZFE/RT)
=2.92×1038
14-5 三氟化氮NF3(沸点-129℃)不显Lewis 碱性,而相对分子质量较低的化合物NH3 (沸点-33℃)却是个人所共知的Lewis 碱。(a)说明它们挥发性差别如此之大的原因;(b)说明它们碱性不同的原因。
14、解:(AlCl3)2;(AlBr3)2;(AlI3)2;分子中均含有配位键
14-15什么是多卤化物?与I3- 离子比较,形成Br3-﹑Cl3- 离子的趋势怎样?
14-16什么是卤素互化物?
(a)写出ClF3﹑BrF3 和 IF3 等卤素互化物中心原子杂化轨道,分子电子构型和分子构型。
14-3(1)根据电极电势比较KMnO4 ﹑K2Cr2O7 和 MnO2 与盐酸(1mol.L-1)反应而生成Cl2 的反应趋势。
(2)若用MnO2与盐酸反应,使能顺利地发生Cl2 ,盐酸的最低浓度是多少?
3、解:(1)根据电极电势的关系,可知反应趋势:
KMnO4>K2Cr2O7>MnO2;
(2)将0.100mol I2 溶解在1.00L 0.100mol.L-1 KI 溶液中而得到I3- 溶液 。I3-生成反应的 Kc 值为0.752,求 I3- 溶液中I2 的浓度。
14-11、(1)I2(aq)=I2(s)
K=exp(ZFE/RT)
=812
另一种则为KClO4
14-10 以 I2 为原料写出制备HIO4﹑KIO3﹑I2O5 和KIO4 的反应方程式。
14-11(1)I2 在水中的溶解度很小,试从下列两个半反应计算在298K 时 ,I2饱和溶液的浓度。
I2(s) + 2e- ≒ 2I-; Φθ = 0.535V
I2(aq) + 2e- ≒ 2I-; Φθ = 0.621V
5、解:(1)NH3有较高的沸点,是因为它分子间存在氢键。
(2)NF3分子中,F原子半径较大,由于空间位阻作用,使它很难再配合Lewis酸。
另外,F原子的电负性较大,削弱了中心原子N的负电性。
14-6 从盐卤中制取Br2 可用氯气氧化法。不过从热力学观点看,Br- 可被O2 氧化为Br2 ,为什么不用O2 来制取Br2 ?
14-7通Cl2于消石灰中,可得漂白粉,而在漂白粉溶液中加入盐酸可产生Cl2 ,试用电极电势说明这两个现象。
7、解:因为Cl2通入消石灰是在碱性介质中作用的,又因为,所以Cl2在碱性条件下易发生歧化反应。
而在漂白粉溶液中加入盐酸后,酸性条件中, ,故而如下反应能够向右进行:
HClO + Cl- + H+ = Cl2 + H2O
2、解:(1)由于F的半径特别小,故F2的离解能特别小,F-的水合热比其他卤素离子多。
(2)HF分子间存在氢键,因而HF分子的熔沸点和汽化热特别高。
(3)AgF为易溶于水的化合物。
(4)F2与水反应产物复杂。
(5)HF是一弱酸,浓度增大,酸性增强。
(6)HF能与SiO2或硅酸盐反应,生成气态SiF4;
9、解:分别取少量固体加入干燥的试管中,再做以下实验
加入稀盐酸即有Cl2气放出的是KClO;
KClO+2HCl=KCl+Cl2+H2O
加入浓盐酸有Cl2与放出且溶液变黄的是KClO3;
8KC1O3+24HCl(浓)=9Cl2↑+8KCl+60ClO2酐:OF2 ﹑Cl2O7﹑ClO2﹑Cl2O﹑Br2O 和 I2O5 ?若是酸酐,写出由相应的酸或其它方法得到酸酐的反应。
8、解:Cl2O7是HClO4的酸酐。Cl2O,Br2O分别是HClO,HBrO 的酸酐
14-9 如何鉴别KClO﹑KClO3和 KClO4 这三种盐?
第14章卤素
14-1 电解制氟时,为何不用 KF 的水溶液?液态氟化氢为什么不导电,而氟化钾的无水氟化氢溶液却能导电?
1、解:因为F2与水能发生剧烈的化学反应;液态HF分子中,没有自由移动的离子,故而不能导电。而在KF的无水HF溶液中,存在K+,HF2-;
14-2氟在本族元素中有哪些特殊性?氟化氢和氢氟酸有哪些特性?
