简单蒸馏及分馏实验共23页
实验2蒸馏和分馏实验比较

实验 2 蒸馏和分馏实验比较(丙酮—水混合物分离)实验讲解前提问:1.分馏装置由几部分组成?与蒸馏比较有何不同2.分馏的主要目的一、实验目的:(1)理解蒸馏和分馏的基本原理,应用范围,什么情况下用蒸馏,什么情况下用分馏。
(2)熟练掌握蒸馏装置的安装和使用方法。
(3)掌握分馏柱的工作原理和常压下的简单分馏操作方法。
蒸馏和分馏的基本原理是一样的,都是利用有机物质的沸点不同,在蒸馏过程中低沸点的组分先蒸出,高沸点的组分后蒸出,从而达到分离提纯的目的。
不同的是,分馏是借助于分馏柱使一系列的蒸馏不需多次重复,一次得以完成的蒸馏(分馏就是多次蒸馏),应用范围也不同,蒸馏时混合液体中各组分的沸点要相差30℃以上,才可以进行分离,而要彻底分离沸点要相差110℃以上。
分馏可使沸点相近的互溶液体混合物(甚至沸点仅相差1-2℃)得到分离和纯化。
二、实验原理蒸馏——将液态物质加热到沸腾变为蒸气,又将蒸气冷凝为液体的联合操作过程。
用蒸馏方法分离混合组分时要求被分离组分的沸点差在30℃以上才能达到有效分离或提纯的目的。
蒸馏是分离和提线液态有机物常用方法之一;也可用来测量液态物质的沸点(常量法)。
分馏——装置上比蒸馏多一个分馏柱,在分馏柱内反复进行汽气冷凝回流过程,相当于是多次的简单蒸馏,最终在分馏柱顶部出来的蒸气为高纯度的低沸点组分,这样能把沸点相差较小的混合组分有效的分离或提纯出来。
用图1表示蒸馏和分馏的分离效率,能形成共沸混合物的混合物不能用蒸馏或分馏分离或提纯(见图2)。
影响分离效率的因素:①分馏柱效率——理论塔板数一块理论塔板相当于一次普通蒸馏的效果②回流比——回流比越大,分馏效率越好(即馏出液速度太快时分离效果差)③柱的保温三、简单的分馏装置和蒸馏装置(略)、冷凝管的选用原则(略)四、实验步骤1.按图安装好蒸馏或分馏装置,接受器改用量筒以便读取馏出液体积(两人配合)2.丙酮—水混合物分馏3.丙酮—水混合物蒸馏实验关键:①馏出速度1滴/1~2秒②注意平稳加热和分馏柱保温六、根据记录及结果馏出液体积ml 第一滴 2 4 6 8 10 11 12 13 14 16 18 ……分馏温度℃62℃62℃62℃馏出液体积……蒸馏温度℃依上表数据在同一坐标上图作分馏曲线和蒸馏曲线七、结果讨论操作要点和说明1、进行蒸馏操作时,有时发现馏出物的沸点往往低于(或高于)该化合物的沸点,有时馏出物的温度一直在上升,这可能是因为混合液体组成比较复杂,沸点又比较接近的缘故,简单蒸馏难以将它们分开,可考虑用分馏。
乙醇和正丁醇的蒸馏和分馏实验

乙醇和正丁醇的蒸馏和分馏实验一.实验目的1.了解分馏的原理和意义2.学习简单分馏的操作方法二.实验原理分馏原理简单蒸馏只能使液体混合物得到初步的分离。
为了获得高纯度的产品,理论上采用多次部分汽化和多次部分冷凝的方法,即将简单蒸馏得到的馏出液,再次部分汽化冷凝,以得到纯度更高的馏出液。
而将简单蒸馏剩余的混合液再次部分汽化,则得到易挥发组分更低、难挥发组分更高的混合液。
只要上面这一过程足够多,就可以将两种沸点相机溶液分离成纯度很高的易挥发组分和难挥发组分的两种产品。
简言之,分馏即为反复多次的简单蒸馏。
在实验室常采用分馏柱来实现,而工业上采用精馏塔。
分馏装置分馏装置与简单蒸馏装置类似,不同之处是在蒸馏瓶与蒸馏头之间加了一根分馏柱。
分馏柱的种类很多,实验室常用韦氏分馏柱。
三、实验仪器和药品请学生自己罗列四、实验装置图五、实验步骤1、在100ml圆底烧瓶中加入40ml乙醇和20ml水,混匀,加入几粒沸石,装配好实验仪器。
2、先通冷凝水,然后开始加热。
当出现第一滴馏出液时,调整加热的功率,控制馏出液馏出的速度,以1d/2~3s为宜。
3、分段收集馏分,记录各馏分的体积。
4、拆除蒸馏装置.测量各馏分的醇含量六、思考题1什么叫共沸物?为什么不能用分馏法分离共沸混合物?答:当某两种或三种液体以一定比例混合,可组成具有固定沸点的混合物,将这种混合物加热至沸腾时,在气液平衡体系中,气相组成和液相组成一样,故不能使用分馏法将其分离出来,只能得到按一定比例组成的混合物,这种混合物称为共沸混合物或恒沸混合物。
2.为什么控制馏出液速度是1滴/2~3s,而不是1~2d/s?答:因为加热太快,馏出速度太快,热量来不及交换(易挥发组分和难挥发组分),致使水银球周围液滴和蒸气未达平衡,一部分难挥发组分也被气化上升而冷凝,来不及分离就一道被蒸出,导致分离效果下降。
蒸馏和分馏实验比较

实验 2 蒸馏和分馏实验比较(丙酮—水混合物分离)实验讲解前提问:1.分馏装置由几部分组成?与蒸馏比较有何不同2.分馏的主要目的一、实验目的:(1)理解蒸馏和分馏的基本原理,应用范围,什么情况下用蒸馏,什么情况下用分馏。
(2)熟练掌握蒸馏装置的安装和使用方法。
(3)掌握分馏柱的工作原理和常压下的简单分馏操作方法。
蒸馏和分馏的基本原理是一样的,都是利用有机物质的沸点不同,在蒸馏过程中低沸点的组分先蒸出,高沸点的组分后蒸出,从而达到分离提纯的目的。
不同的是,分馏是借助于分馏柱使一系列的蒸馏不需多次重复,一次得以完成的蒸馏(分馏就是多次蒸馏),应用范围也不同,蒸馏时混合液体中各组分的沸点要相差30℃以上,才可以进行分离,而要彻底分离沸点要相差110℃以上。
分馏可使沸点相近的互溶液体混合物(甚至沸点仅相差1-2℃)得到分离和纯化。
二、实验原理蒸馏——将液态物质加热到沸腾变为蒸气,又将蒸气冷凝为液体的联合操作过程。
用蒸馏方法分离混合组分时要求被分离组分的沸点差在30℃以上才能达到有效分离或提纯的目的。
蒸馏是分离和提线液态有机物常用方法之一;也可用来测量液态物质的沸点(常量法)。
分馏——装置上比蒸馏多一个分馏柱,在分馏柱内反复进行汽气↔冷凝↔回流过程,相当于是多次的简单蒸馏,最终在分馏柱顶部出来的蒸气为高纯度的低沸点组分,这样能把沸点相差较小的混合组分有效的分离或提纯出来。
用图1表示蒸馏和分馏的分离效率,能形成共沸混合物的混合物不能用蒸馏或分馏分离或提纯(见图2)。
影响分离效率的因素:①分馏柱效率——理论塔板数一块理论塔板相当于一次普通蒸馏的效果②回流比——回流比越大,分馏效率越好(即馏出液速度太快时分离效果差)③柱的保温三、简单的分馏装置和蒸馏装置(略)、冷凝管的选用原则(略)四、实验步骤1.按图安装好蒸馏或分馏装置,接受器改用量筒以便读取馏出液体积(两人配合)2.丙酮—水混合物分馏3.丙酮—水混合物蒸馏实验关键:①馏出速度1滴/1~2秒②注意平稳加热和分馏柱保温六、根据记录及结果馏出液体积ml 第一滴 2 4 6 8 10 11 12 13 14 16 18 ……分馏温度℃62℃62℃62℃蒸馏馏出液体积……依上表数据在同一坐标上图作分馏曲线和蒸馏曲线七、结果讨论五、实验步骤1、蒸馏(1)组装仪器蒸馏装置由蒸馏烧瓶、冷凝管、接收器三部分组成。
实验一蒸馏与分馏

课时授课计划No 200 ~200 学年度、第学期化工系(部)化学制药专业班授课时间:第周第课时年月日章节及题目:实验课实验一:蒸馏与分馏教学目的:(1)使学生熟悉和掌握蒸馏和分馏的基本原理,应用范围。
(2)使学生熟练掌握蒸馏的操作要领和使用方法重点与难点:重点:熟悉和掌握蒸馏和分馏的基本原理难点:熟练掌握蒸馏的操作要领和使用方法参考书与教具(图表、模型、演术等)《有机化学实验》(第四版)高占先主编高教出版社教学过程(教学步骤、内容、时间分配等)组织教学:实验一: 简单蒸馏与分馏一、实验目的1、熟悉和掌握蒸馏和分馏的基本原理,应用范围,了解蒸馏和测定沸点的意义2、熟练掌握蒸馏的操作要领和使用方法;3、掌握分馏柱的工作原理和常压下的简单分馏操作方法。
二、实验原理实验证明,液体的蒸气压只与温度有关。
即液体在一定温度下具有一定的蒸气压。
当液态物质受热时蒸气压增大,待蒸气压大到与大气压或所给压力相等时液体沸腾,这时的温度称为液体的沸点。
将液体加热至沸腾,使液体变为蒸气,然后使蒸气冷却再凝结为液体,这两个过程的联合操作称为蒸馏。
蒸馏是提纯液体物质和分离混合物的一种常用方法。
纯粹的液体有机化合物在一定的压力下具有一定的沸点(沸程0.5-1.5 o C)。
利用这一点,我们可以测定纯液体有机物的沸点。
又称常量法。
对鉴定纯粹的液化有机物有一定的意义。
应用分馏柱将几种沸点相近的混合物进行分离的方法称为分馏。
将几种具有不同沸点而又可以完全互溶的液体混合物加热,当其总蒸气压等于外界压力时,就开始沸腾气化,蒸气中易挥发液体的成分较在原混合液中为多。
在分馏柱内,当上升的蒸气与下降的冷凝液互相接触时,上升的蒸气部分冷凝放出热量使下降的冷凝液部分气化,两者之间发生了热量交换,其结果,上升蒸气中易挥发组分增加,而下降的冷凝液中高沸点组分(难挥发组分)增加,如此继续多次,就等于进行了多次的气液平衡,即达到了多次蒸馏的效果。
这样靠近分馏柱顶部易挥发物质的组分比率高,而在烧瓶里高沸点组分(难挥发组分)的比率高。
蒸馏分馏实验报告

篇一:蒸馏与分馏实验预习报告蒸馏与分馏目的:1. 掌握普通蒸馏、分馏的原理和操作方法,了解其意义。
2. 学习安装仪器的基本方法。
3. 学会用常量法测定液态物质的沸点。
原理:蒸馏liquid分馏liquid1、蒸馏沸点: abgas gasliquid (纯) liquid (a)每种纯液态有机物在一定的压力下具有固定的沸点,当液态有机物受热时,蒸气压增大,待蒸气压达到大气压或所给定的压力时,即p 蒸=p 外,液体沸腾,这时的温度称为液体的沸点。
(饱和蒸汽压:当液体汽化的速率与其产生的气体液化的液体速率相同时的气压。
) (沸点与压强的关系:沸点和当水汽压力与环境压力相等时的温度有关,也就是说,沸点和气压是有关的。
通常情况下我们所说的沸点都是在标准大气压下测量得到的(即101325帕斯卡,或1atm)。
在海拔较高的地区,由于气压较低,沸点也相对低得多。
当气压上升,物体的沸点相应上升,达到临界点时,物体的液态和气态相一致。
物体的沸点不可能提高到临界点以上。
反之,当气压下降,物体的沸点相应下降,i直至三相点,类似地,物体的沸点不能降低到三相点以下。
) 【没有找到压强与非典的具体关系,只知道呈非线性关系,在1atm处大致为线性关系】临界点:在热力学中,临界点是可使一物质以液态存在的最高温度或以气态存在的最高压力,当物质的温度、压力超过此界线——即临界温度及临界压力——会相变成同时拥有液态及气态特征的流体:超临界流体。
临界温度下的p-v等温线上,在临界点处的一阶、二阶导数均为零,即:液—气—液的过程:蒸馏就是将液态物质加热到沸腾变为蒸气,又将蒸气冷凝为液体这两个过程的联合操作。
如果将某液体混合物(内含两种以上的物质,这几种物质沸点相差较大,一般大于30℃)进行蒸馏,那么沸点较低者先蒸出,沸点较高者后蒸出,不挥发的组分留在蒸馏瓶内,这样就可以达到分离和提纯的目的。
纯液态有机物在蒸馏过程中沸点变化范围很小(一般0.5-1.0℃)。
简单蒸馏及分馏实验

用于防止液体暴沸,保证实验安全。
仪器使用注意事项
在使用前需检查各仪器是 否完好无损,特别是玻璃 仪器有无裂纹或破损。
各仪器连接处需涂抹适量 凡士林,以确保气密性良 好,防止蒸汽泄漏。
加热时需使用合适的热源, 并控制加热速度,避免液 体暴沸或飞溅。
实验结束后需及时清理实验现 场,将废液倒入指定废液缸中 ,玻璃仪器需清洗干净并晾干 。
采用环保型溶剂和催化剂,减 少实验对环境的影响。
微型化
开发微型蒸馏和分馏装置,降 低实验成本,提高安全性。
拓展应用
探索蒸馏和分馏技术在其他领 域的应用,如废水处理、资源
回收等。
THANKS.
在实验过程中需佩戴防护 眼镜和实验服,确保实验 安全。
实验步骤与操作
03
前期准备工作
01
02
03
04
选择合适的蒸馏装置, 包括蒸馏烧瓶、冷凝管、 接收瓶等。
检查装置的气密性,确 保无漏气现象。
准备待蒸馏的液体样品, 记录其初始温度、体积 等信息。
根据实验需求,选择合 适的加热方式和热源。
蒸馏实验操作
04
分馏实验操作
01
02
03
04
在完成简单蒸馏后,进行分馏 操作以分离不同沸点的组分。
调整加热速度,使温度控制在 两个组分的沸点之间。
分别收集不同沸点的馏分,记 录每个馏分的体积和温度。
重复以上步骤,直至所有组分 分离完毕。
安全注意事项
实验过程中需佩戴防护眼镜和实验服,确保个人安全。 蒸馏过程中要保持通风良好,避免有毒气体积聚。
通过对分馏产物的观察和测试,我们可以了解其物理和化学性质,如颜色、气味、密度、 粘度、折射率、熔点、沸点等。与蒸馏产物相比,分馏产物的性质更加接近纯物质。
简单分馏的实验报告

简单分馏的实验报告简单分馏的实验报告引言:分馏是一种常见的物质分离方法,通过利用不同物质的沸点差异,将混合物中的组分分离出来。
本实验旨在通过简单分馏的方法,将乙醇和水的混合物分离,以验证该分离方法的有效性。
实验步骤:1. 准备工作:将实验室器材清洗干净,确保无杂质。
准备好乙醇和水的混合物,浓度为50%。
2. 将混合物倒入分馏烧瓶中,并加入适量的沸石(既有助于分离,又有助于提高分馏效果)。
3. 将分馏烧瓶连接到冷凝管和接收瓶,确保密封良好。
4. 将冷凝管的一端浸入水中,以便冷却分馏烧瓶中的蒸气。
5. 开始加热分馏烧瓶,控制加热速度,使其逐渐升温。
6. 观察分馏过程,当温度达到乙醇的沸点(78.5℃)时,开始收集乙醇蒸汽。
7. 当温度升高至水的沸点(100℃)时,停止收集。
实验结果与分析:通过实验,我们成功地将乙醇和水的混合物进行了分馏。
在加热过程中,乙醇首先沸腾,生成蒸汽,通过冷凝管冷却后转化为液体,最终被收集。
而水则留在分馏烧瓶中,没有蒸发出来。
分馏的原理是基于不同物质的沸点差异。
乙醇的沸点较低,所以在加热过程中首先蒸发出来。
而水的沸点较高,需要更高的温度才能蒸发。
通过控制加热温度和加热速度,可以实现对不同物质的有效分离。
分馏的应用非常广泛。
在工业上,分馏被广泛应用于石油、化工、制药等领域。
例如,通过分馏可以将原油分离成不同沸点范围内的馏分,从而得到汽油、柴油、润滑油等产品。
在实验室中,分馏也是一种常用的分离方法,可以用于提纯化合物、分离混合物等。
然而,分馏也存在一些限制。
首先,分馏只适用于沸点差异较大的物质。
如果两种物质的沸点相差不大,分馏效果会受到影响。
其次,分馏过程中需要控制温度和加热速度,过高或过低的温度都会影响分馏效果。
此外,分馏过程中还可能发生反应,导致物质的损失或不纯度的提高。
结论:本实验通过简单分馏的方法,成功地将乙醇和水的混合物进行了分离。
分馏是一种有效的物质分离方法,通过利用不同物质的沸点差异,可以实现对混合物的分离。
简单蒸馏及分馏
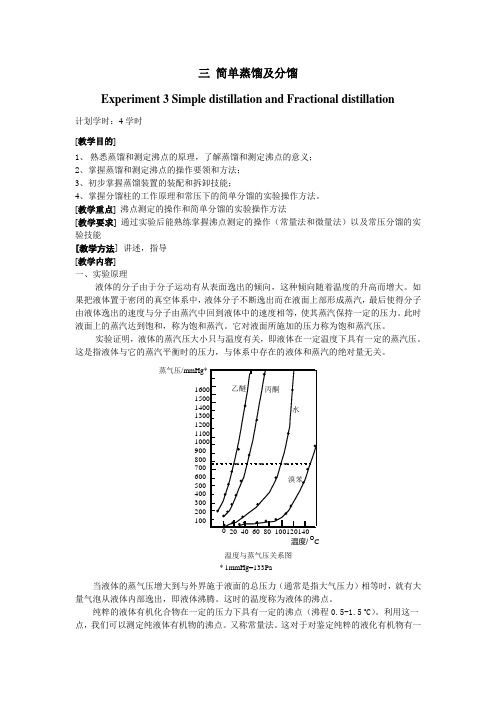
三 简单蒸馏及分馏Experiment 3 Simple distillation and Fractional distillation 计划学时:4学时[教学目的]1、 熟悉蒸馏和测定沸点的原理,了解蒸馏和测定沸点的意义;2、掌握蒸馏和测定沸点的操作要领和方法;3、初步掌握蒸馏装置的装配和拆卸技能;4、掌握分馏柱的工作原理和常压下的简单分馏的实验操作方法。
[教学重点] 沸点测定的操作和简单分馏的实验操作方法[教学要求] 通过实验后能熟练掌握沸点测定的操作(常量法和微量法)以及常压分馏的实验技能[教学方法] 讲述,指导[教学内容]一、实验原理液体的分子由于分子运动有从表面逸出的倾向,这种倾向随着温度的升高而增大。
如果把液体置于密闭的真空体系中,液体分子不断逸出而在液面上部形成蒸汽,最后使得分子由液体逸出的速度与分子由蒸汽中回到液体中的速度相等,使其蒸汽保持一定的压力。
此时液面上的蒸汽达到饱和,称为饱和蒸汽。
它对液面所施加的压力称为饱和蒸汽压。
实验证明,液体的蒸汽压大小只与温度有关,即液体在一定温度下具有一定的蒸汽压。
这是指液体与它的蒸汽平衡时的压力,与体系中存在的液体和蒸汽的绝对量无关。
当液体的蒸气压增大到与外界施于液面的总压力(通常是指大气压力)相等时,就有大量气泡从液体内部逸出,即液体沸腾。
这时的温度称为液体的沸点。
纯粹的液体有机化合物在一定的压力下具有一定的沸点(沸程0.5-1.5 o C )。
利用这一点,我们可以测定纯液体有机物的沸点。
又称常量法。
这对于对鉴定纯粹的液化有机物有一900800700600500400300200100温度/蒸气压/mmHg*O C 温度与蒸气压关系图* 1mmHg=133Pa定的意义。
但是具有固定沸点的液体不一定都是纯粹的化合物,因为某些有机化合物常和其它组分形成二元或三元共沸混合物,它们也有一定的沸点。
将液体加热至沸腾,使液体变为蒸汽,然后使蒸汽冷却凝结为液体,这两个过程的联合操作称为蒸馏。
简单蒸馏的实验报告

简单蒸馏的实验报告简单蒸馏的实验报告蒸馏是一种常见的分离技术,通过利用液体混合物中不同成分的沸点差异,将其分离出来。
本次实验旨在通过简单蒸馏的方法,分离出酒精和水的混合物。
实验设备和材料:1. 蒸馏瓶和冷凝管:用于进行蒸馏操作。
2. 温度计:用于测量蒸馏过程中的温度变化。
3. 酒精和水的混合物:用于进行实验。
实验步骤:1. 将酒精和水的混合物倒入蒸馏瓶中,确保液面高度不超过瓶口。
2. 将冷凝管连接到蒸馏瓶的出口,并将另一端浸入冷水中。
3. 开始加热蒸馏瓶,同时用温度计测量冷凝管出口处的温度。
4. 随着温度的升高,混合物开始蒸发,蒸汽通过冷凝管冷却后变为液体。
5. 收集冷凝管出口的液体,分别记录不同温度下收集到的液体。
实验结果:在实验过程中,我们观察到了以下现象:1. 初始阶段,温度升高较快,液体开始蒸发。
2. 随着温度的升高,蒸发速率逐渐减缓。
3. 当温度达到一定值时,我们观察到液体开始从冷凝管中滴下。
4. 随着温度的继续升高,滴下的液体逐渐增多。
5. 最终,我们分别收集到了酒精和水两种液体。
通过对实验结果的观察和记录,我们得出以下结论:1. 酒精和水的沸点差异导致了它们在蒸馏过程中的分离。
2. 酒精的沸点较低,因此在蒸馏过程中较早地蒸发出来并冷凝成液体。
3. 水的沸点较高,因此在温度升高到一定程度时才开始蒸发,并在冷凝管中滴下。
实验总结:通过本次实验,我们成功地利用简单蒸馏的方法将酒精和水的混合物分离出来。
蒸馏是一种常用的分离技术,广泛应用于实验室和工业生产中。
在实验过程中,我们需要注意控制加热的温度,以免发生意外。
同时,实验结果也验证了不同物质的沸点差异对于蒸馏分离的重要性。
蒸馏技术在化学、药学、食品科学等领域都有广泛应用,例如提取纯净的溶剂、分离混合物中的有机物等。
通过不断探索和实践,我们可以进一步了解蒸馏的原理和应用,为实验和生产提供更多的可能性。
总之,本次实验不仅让我们学习到了蒸馏的基本原理和操作技巧,还让我们认识到了科学实验的重要性和实验设计的细节。
蒸馏与分馏的实验报告

蒸馏与分馏的实验报告篇一:蒸馏与分馏实验预习报告蒸馏与分馏目的:1. 掌握普通蒸馏、分馏的原理和操作方法,了解其意义。
2. 学习安装仪器的基本方法。
3. 学会用常量法测定液态物质的沸点。
原理:蒸馏liquid分馏liquid1、蒸馏沸点:ABgas gasliquid (纯) liquid (A)每种纯液态有机物在一定的压力下具有固定的沸点,当液态有机物受热时,蒸气压增大,待蒸气压达到大气压或所给定的压力时,即P 蒸=P 外,液体沸腾,这时的温度称为液体的沸点。
(饱和蒸汽压:当液体汽化的速率与其产生的气体液化的液体速率相同时的气压。
)(沸点与压强的关系:沸点和当水汽压力与环境压力相等时的温度有关,也就是说,沸点和气压是有关的。
通常情况下我们所说的沸点都是在标准大气压下测量得到的(即101325帕斯卡,或1atm)。
在海拔较高的地区,由于气压较低,沸点也相对低得多。
当气压上升,物体的沸点相应上升,达到临界点时,物体的液态和气态相一致。
物体的沸点不可能提高到临界点以上。
反之,当气压下降,物体的沸点相应下降,i直至三相点,类似地,物体的沸点不能降低到三相点以下。
) 【没有找到压强与非典的具体关系,只知道呈非线性关系,在1atm处大致为线性关系】临界点:在热力学中,临界点是可使一物质以液态存在的最高温度或以气态存在的最高压力,当物质的温度、压力超过此界线——即临界温度及临界压力——会相变成同时拥有液态及气态特征的流体:超临界流体。
临界温度下的p-V等温线上,在临界点处的一阶、二阶导数均为零,即:液—气—液的过程:蒸馏就是将液态物质加热到沸腾变为蒸气,又将蒸气冷凝为液体这两个过程的联合操作。
如果将某液体混合物(内含两种以上的物质,这几种物质沸点相差较大,一般大于30℃)进行蒸馏,那么沸点较低者先蒸出,沸点较高者后蒸出,不挥发的组分留在蒸馏瓶内,这样就可以达到分离和提纯的目的。
纯液态有机物在蒸馏过程中沸点变化范围很小(一般0.5-1.0℃)。
蒸馏与分馏实验报告

实验一 蒸馏与分馏一、实验目的1. 掌握普通蒸馏、分馏的原理和操作方法,了解其意义。
2. 学习安装仪器的基本方法。
3. 学会用常量法测定液态物质的沸点。
二、基本原理liquid gas 冷凝liquid (纯)蒸馏liquid gas 冷凝liquid A B (A)分馏1、蒸馏(1)什么是沸点: 每种纯液态有机物在一定的压力下具有固定的沸点,当液态有机物受热时,蒸气压增大,待蒸气压达到大气压或所给定的压力时,即P 蒸=P 外,液体沸腾,这时的温度称为液体的沸点。
(2)液—气—液的过程蒸馏就是将液态物质加热到沸腾变为蒸气,又将蒸气冷凝为液体这两个过程的联合操作。
如果将某液体混合物(内含两种以上的物质,这几种物质沸点相差较大,一般大于30℃)进行蒸馏,那么沸点较低者先蒸出,沸点较高者后蒸出,不挥发的组分留在蒸馏瓶内,这样就可以达到分离和提纯的目的。
纯液态有机物在蒸馏过程中沸点变化范围很小(一般0.5-1.0℃)。
根据蒸馏所测定的沸程, 可以判断该液体物质的纯度。
归纳起来,蒸馏的意义有以下三个方面:① 分离和提纯液态有机物。
② 测出某纯液态物质的沸程,如果该物质为未知物,那么根据所测得的沸程数据,查物理常数手册,可以知道该未知物可能是什么物质。
③ 根据所测定的沸程可以判断该液态有机物的纯度。
2、分馏普通蒸馏只能分离和提纯沸点相差较大的物质,一般至少相差30℃以上才能得到较好的分离效果。
对沸点较接近的混合物用普通蒸馏法就难以分开。
虽经多次的蒸馏可达到较好的分离效果,但操作比较麻烦,损失量也很大。
在这种情况下,应采取分馏法来提纯该混合物。
分馏的基本原理与蒸馏相类似,所不同的是在装置上多一个分馏柱,使气化、冷凝的过程由一次变为多次。
简单地说,分馏就是多次蒸馏。
分馏就是利用分馏柱来实现这“多次重复”的蒸馏过程。
当混合物的蒸气进入分馏柱时,由于柱外空气的冷却,蒸气中高沸点的组分易被冷凝,所以冷凝液中就含有较多高沸点物质,而蒸气中低沸点的成分就相对地增多。
实验三蒸馏分馏和减压蒸馏

实验三蒸馏分馏和减压蒸馏实验三、蒸馏、分馏和减压蒸馏实验三:蒸馏、分馏和减压蒸馏(2022年10月22日)一、实验目的(1)了解蒸馏、分馏和减压蒸馏的基本原理和适用条件;(2)熟练掌握蒸馏、分馏装置的安装和使用方法;掌握减压蒸馏仪器的安装和操作方法。
二、基本原则(一)蒸馏和分馏蒸馏和分馏利用有机物的不同沸点。
蒸馏过程中,先蒸发低沸点组分,后蒸发高沸点组分,达到分离纯化的目的。
不同之处在于,分馏是一系列蒸馏,可以在分馏塔的帮助下一次完成,而无需重复蒸馏(分馏是多次蒸馏)。
应用范围也不同。
蒸馏过程中,混合液中各组分的沸点在分离前应大于30℃,完全分离的沸点应大于110℃。
分馏可以分离纯化沸点相近(即使沸点差只有1-2℃)的互溶液体混合物。
液体的分子由于分子运动有从表面逸出的倾向,这种倾向随着温度的升高而增大,进而在液面上部形成蒸气。
当分子由液体逸出的速度与分子由蒸气中回到液体中的速度相等,液面上的蒸气达到饱和,称为饱和蒸气。
它对液面所施加的压力称为饱和蒸气压。
实验证明,液体的蒸气压只与温度有关。
即液体在一定温度下具有一定的蒸气压。
当液态物质受热时蒸气压增大,到与外界施于液面的总压力(通常是大气压力)相等时,就有大量气泡从液体内部逸出,即液体沸腾。
这时的温度称为液体的沸点。
蒸馏:将液体物质加热至沸腾,将其转化为蒸汽,并将蒸汽冷却为液体的联合操作。
纯液体有机化合物在一定压力下具有一定的沸点(沸点范围0.5-1.5c)。
利用这个,我们可以确定纯液体有机物的沸点。
也称为常数法。
但是具有固定沸点的液体不一定都是纯粹的化合物,因为某些有机化合物常和其它组分形成二元或三元共沸混合物,它们也有一定的沸点。
非挥发性杂质可以通过蒸馏去除,沸点差大于30℃的液体混合物可以分离,纯液体有机物的沸点也可以测定,液体有机物的纯度可以定性测试。
分馏:如果将两种挥发性液体混合物进行蒸馏,在沸腾温度下,其气相与液相达成平衡,出来的蒸气中含有较多量易挥发物质的组分,将此蒸气冷凝成液体,其组成与气相组成等同(即含有较多的易挥发组分),而残留物中却含有较多量的高沸点组分(难挥发组分),这就是进行了一次简单的蒸馏。
试验四简单蒸馏与分馏

Farnesol (scent of lily of the valley)
CH3 CH3
CH3
H3C
C CH2 CH2 H3C
O C CH2 H3C CH CH3
b-Selinene(found in oil of celery)
22
圖四 簡單蒸餾裝置圖 蒸餾效果的判斷:蒸餾效果好壞可由溫度與收集之分餾液體積作圖得知, 如圖六。圖六-A 在溫度明顯的直線上升說明欲分餾的兩物在不同溫度下分別蒸 餾而出亦表示兩種組成之混合溶液完全分離,分離效果佳;而圖六-B 漸進平緩 的曲線說明在同一溫度下有多種液體同時蒸餾出來,表示兩種組成之混合溶液 只有部分被分離,分離效果不佳。
注意事項:
1. 加熱板勿開 Heat 鈕。 2. 加熱包的使用方法:電源—變壓器—加熱包,加熱包必須放在加熱攪拌器上, 否則會損毀實驗桌。 3. 加熱功率不可開至最大,以免發生危險。變壓器大約最大開到數字 5-6 之間 即可。 4. 蒸餾出的液體需要放置於老師指定的容器內,切記蒸餾完攪拌子要用取出棒 取出,不可倒入廢液桶內。 5. 架設蒸餾裝置須同組同學相互合作,並且注意玻璃器材的角度,不要顧此失 彼,而將玻璃弄斷,要小心架設。 6. 冷卻水不可開太大,否則接頭會脫落。 7. 注意不要燙傷及漏氣,需戴隔熱手套。磨砂玻璃接頭可塗一些凡士林。
2.如果有一溶液在一定的溫度下沸騰且完全蒸餾出來,你能判定此溶液為純物質嗎? 並提出至少兩個理由。
3.請解釋為何有加裝分餾管的分離效率比沒有分餾管的效率來的高。
26
實驗五 以蒸氣蒸餾法提煉果皮中的 d-Limonene
实验十一、简单蒸馏及分馏

实验十一、简单蒸馏及分馏一、实验目的1、熟悉和掌握蒸馏和分馏的基本原理,应用范围,了解蒸馏和测定沸点的意义2、熟练掌握蒸馏的操作要领和使用方法;3、掌握分馏柱的工作原理和常压下的简单分馏操作方法。
二、实验原理实验证明,液体的蒸气压只与温度有关。
即液体在一定温度下具有一定的蒸气压。
当液态物质受热时蒸气压增大,待蒸气压大到与大气压或所给压力相等时液体沸腾,这时的温度称为液体的沸点。
将液体加热至沸腾,使液体变为蒸气,然后使蒸气冷却再凝结为液体,这两个过程的联合操作称为蒸馏。
蒸馏是提纯液体物质和分离混合物的一种常用方法。
纯粹的液体有机化合物在一定的压力下具有一定的沸点(沸程0.5-1.5 o C)。
利用这一点,我们可以测定纯液体有机物的沸点。
又称常量法。
对鉴定纯粹的液化有机物有一定的意义。
应用分馏柱将几种沸点相近的混合物进行分离的方法称为分馏。
将几种具有不同沸点而又可以完全互溶的液体混合物加热,当其总蒸气压等于外界压力时,就开始沸腾气化,蒸气中易挥发液体的成分较在原混合液中为多。
在分馏柱内,当上升的蒸气与下降的冷凝液互相接触时,上升的蒸气部分冷凝放出热量使下降的冷凝液部分气化,两者之间发生了热量交换,其结果,上升蒸气中易挥发组分增加,而下降的冷凝液中高沸点组分(难挥发组分)增加,如此继续多次,就等于进行了多次的气液平衡,即达到了多次蒸馏的效果。
这样靠近分馏柱顶部易挥发物质的组分比率高,而在烧瓶里高沸点组分(难挥发组分)的比率高。
这样只要分馏柱足够高,就可将这种组分完全彻底分开。
蒸馏和分馏的基本原理是一样的,都是利用有机物质的沸点不同,在蒸馏过程中低沸点的组分先蒸出,高沸点的组分后蒸出,从而达到分离提纯的目的。
不同的是,分馏借助于分馏柱使一系列的蒸馏不需多次重复,一次得以完成(分馏即多次蒸馏),应用范围也不同,蒸馏时混合液体中各组分的沸点要相差30℃以上,才可以进行分离,而要彻底分离沸点要相差110℃以上。
蒸馏与分馏实验

有机化学实验预习报告乙酰苯胺的制备及重结晶姓名:凌佳龙指导教师:强根荣老师日期:2015年11月1日目录一.实验目的 (1)二.基本原理 (1)三.主要试剂与仪器 (3)四.实验装置 (3)五.实验步骤 (4)六.注意事项 (5)七.思考题 (7)八.参考文献 (10)实验乙酰苯胺的制备及重结晶一、实验目的1. 掌握普通蒸馏、分馏的原理,了解其意义。
2. 掌握普通蒸馏、分馏的操作方法。
3. 学会用常量法测定液态物质的沸点。
二、基本原理1、蒸馏(1)什么是沸点:每种纯液态有机物在一定的压力下具有固定的沸点,当液态有机物受热时,蒸气压增大,待蒸气压达到大气压或所给定的压力时,即P蒸=P 外,液体沸腾,这时的温度称为液体的沸点。
(2)液—气—液的过程蒸馏就是将液态物质加热到沸腾变为蒸气,又将蒸气冷凝为液体这两个过程的联合操作。
如果将某液体混合物(内含两种以上的物质,这几种物质沸点相差较大,一般大于30℃)进行蒸馏,那么沸点较低者先蒸出,沸点较高者后蒸出,不挥发的组分留在蒸馏瓶内,这样就可以达到分离和提纯的目的。
纯液态有机物在蒸馏过程中沸点变化范围很小(一般 0.5-1.0℃)。
根据蒸馏所测定的沸程, 可以判断该液体物质的纯度。
归纳起来,蒸馏的意义有以下三个方面:①分离和提纯液态有机物。
②测出某纯液态物质的沸程,如果该物质为未知物,那么根据所测得的沸程数据,查物理常数手册,可以知道该未知物可能是什么物质。
③根据所测定的沸程可以判断该液态有机物的纯度。
2、分馏普通蒸馏只能分离和提纯沸点相差较大的物质,一般至少相差30℃以上才能得到较好的分离效果。
对沸点较接近的混合物用普通蒸馏法就难以分开。
虽经多次的蒸馏可达到较好的分离效果,但操作比较麻烦,损失量也很大。
在这种情况下,应采取分馏法来提纯该混合物。
分馏的基本原理与蒸馏相类似,所不同的是在装置上多一个分馏柱,使气化、冷凝的过程由一次变为多次。
简单地说,分馏就是多次蒸馏。
蒸馏与分馏

蒸馏与分馏一、实验目的:(1)理解蒸馏和分馏的基本原理,应用范围,什么情况下用蒸馏,什么情况下用分馏。
(2)熟练掌握蒸馏装置的安装和使用方法。
(3)掌握分馏柱的工作原理和常压下的简单分馏操作方法。
蒸馏和分馏的基本原理是一样的,都是利用有机物质的沸点不同,在蒸馏过程中低沸点的组分先蒸出,高沸点的组分后蒸出,从而达到分离提纯的目的。
不同的是,分馏是借助于分馏柱使一系列的蒸馏不需多次重复,一次得以完成的蒸馏(分馏就是多次蒸馏),应用范围也不同,蒸馏时混合液体中各组分的沸点要相差30?以上,才可以进行分离,而要彻底分离沸点要相差110?以上。
分馏可使沸点相近的互溶液体混合物(甚至沸点仅相差1,2?)得到分离和纯化。
二、实验原理蒸馏——将液态物质加热到沸腾变为蒸气,又将蒸气冷凝为液体的联合操作过程。
用蒸馏方法分离混合组分时要求被分离组分的沸点差在30?以上才能达到有效分离或提纯的目的。
蒸馏是分离和提线液态有机物常用方法之一;也可用来测量液态物质的沸点(常量法)。
普通蒸馏的基本原理是,液体在一定的温度下具有一定的蒸汽压,在一定的压强下液体的蒸汽压只与温度有关,而与体系中存在液体的量无关。
将液体加热时,它的蒸汽压随温度升高而增大。
当液体表面蒸汽压增大到与其所受的外界压强相等时,液体呈沸腾状态,这时的温度称为该液体的沸点。
一个混合液体受热汽化时,蒸汽中低沸点组分的分压比高沸点组分的分压要大,即蒸汽中低沸点组分的相对含量比原混合液中的相对含量要高。
将此蒸气引出冷凝,就得到低沸点组分含量较高的溜出液。
这样就将两种沸点相差较大的液体分离。
〖注意〗普通蒸馏仅仅能分离沸点有显著不同(至少30?以上)的两种或两种以上的混合物。
分馏——装置上比蒸馏多一个分馏柱,在分馏柱内反复进行汽气冷凝回流过程,相当于是多次的简单蒸馏,最终在分馏柱顶部出来的蒸气为高纯度的低沸点组分,这样能把沸点相差较小的混合组分有效的分离或提纯出来。
分馏的原理:混合液沸腾后蒸气进入分馏柱中被部分冷凝,冷凝液在下降途中与继续上升的蒸气接触,二者进行热交换,蒸汽中高沸点组分被冷凝,低沸点组分仍呈蒸气上升,而冷凝液中低沸点组分受热气化,高沸点组分仍呈液态下降。
实验三、蒸馏、分馏和减压蒸馏

实验三、蒸馏、分馏和减压蒸馏(2006-10-22)一、实验目的(1)理解蒸馏、分馏和减压蒸馏的基本原理和适用条件;(2)熟练掌握蒸馏、分馏装置的安装和使用方法;掌握减压蒸馏仪器的安装和操作方法。
二、基本原理(一)蒸馏和分馏蒸馏和分馏都是利用有机物沸点不同,在蒸馏过程中将低沸点的组分先蒸出,高沸点的组分后蒸出,从而达到分离提纯的目的。
不同的是,分馏是借助于分馏柱使一系列的蒸馏不需多次重复,一次得以完成的蒸馏(分馏就是多次蒸馏),应用范围也不同,蒸馏时混合液体中各组分的沸点要相差30℃以上,才可以进行分离,而要彻底分离沸点要相差110℃以上。
分馏可使沸点相近的互溶液体混合物(甚至沸点仅相差1-2℃)得到分离和纯化。
液体的分子由于分子运动有从表面逸出的倾向,这种倾向随着温度的升高而增大,进而在液面上部形成蒸气。
当分子由液体逸出的速度与分子由蒸气中回到液体中的速度相等,液面上的蒸气达到饱和,称为饱和蒸气。
它对液面所施加的压力称为饱和蒸气压。
实验证明,液体的蒸气压只与温度有关。
即液体在一定温度下具有一定的蒸气压。
当液态物质受热时蒸气压增大,到与外界施于液面的总压力(通常是大气压力)相等时,就有大量气泡从液体内部逸出,即液体沸腾。
这时的温度称为液体的沸点。
蒸馏:是将液态物质加热到沸腾变为蒸气,又将蒸气冷却为液体这两个过程的联合操作。
纯粹的液体有机化合物在一定的压力下具有一定的沸点(沸程0.5-1.5 o C)。
利用这一点,我们可以测定纯液体有机物的沸点。
又称常量法。
但是具有固定沸点的液体不一定都是纯粹的化合物,因为某些有机化合物常和其它组分形成二元或三元共沸混合物,它们也有一定的沸点。
通过蒸馏可除去不挥发性杂质,可分离沸点差大于30 o C的液体混合物,还可以测定纯液体有机物的沸点及定性检验液体有机物的纯度。
分馏:如果将两种挥发性液体混合物进行蒸馏,在沸腾温度下,其气相与液相达成平衡,出来的蒸气中含有较多量易挥发物质的组分,将此蒸气冷凝成液体,其组成与气相组成等同(即含有较多的易挥发组分),而残留物中却含有较多量的高沸点组分(难挥发组分),这就是进行了一次简单的蒸馏。
