第四节几种新型极谱和伏安分析法 溶出伏安法
极谱分析法和伏安分析法

-1.26
-
-1.71
-1.66 -1.29 -1.10 -1.35
讨论
三、干扰及其消除方法
(1)残余电流
现象
原因
微量杂质等所产生的微弱电流 电容电流(充电电流):影响极谱分析灵 敏度的主要因素
减小措施
可通过试剂提纯、预电解、除氧等
采用新技术
(2)迁移电流
现象 原因
由于带电荷的被测离子(或带极性的分子)在静电 场力的作用下运动到电极表面所形成的电流
2. 单扫描极谱分析法
原理与装置
又称直流示波极谱法,以示波器为电信 号检测器
电压的扫描速度极快,0.25v/s 在汞滴生长后期,加线性增长的锯齿波 脉冲电压,产生的峰电流值与样品浓度成 正比
阴极射线示波器
X轴坐标:显示扫描电压; Y轴坐标:扩散电流
p= 1/2 - 0.028/n
特点
③ 电流急剧上升阶段 这在半波电位附近 ④ 极限扩散区 此时达到极限电流值, 称为极限电流。
C0 0
δ →常数, id= kC
,
i
C C0
id 称为极限扩散电流
(3)涉及概念
极化
浓差极化及形成条件
极化电极A小,反应离子数/单位面积 大,Cs→0
C低 静止
极化电极与去极化电极
减小措施
加入大量的支持电解质
(3)极谱极大
现象
产生的原因
溪流运动
消除方法
加入小量极大抑制剂 (表面活性剂)
(4) 氧波与氢波
(5) 其他概念: 可逆与不可逆波 氧化波与还原波
溶出伏安法

电位溶出分析法是在一定的电位下将被 测定的物质预先富集在工作电极上,例 如在汞电极上形成汞齐。然后断开电路, 同时利用溶液中特定的化学物质与工作 电极上已被富集的组分通过化学反应而 被溶出,记录溶出过程电位随时间变化 的曲线,从而获得被测定物质的浓度。 电位溶出伏安法也主要测定金属离子。 比阳极溶出伏安法有更高的灵敏度。
电极过程动力学研究n,D,C,E0,ks
研究吸附现象
复杂电极反应的过程
研究药物分析
化学生物学
阴极溶出伏安法可用于卤素、硫、 钨酸根等阴离子的测定。测定许多 能够与汞形成不溶性盐的有机和无 机化合物,能用该法测定的离子有 CN-,SCN-,C2O42-,S2-,VO3-, 卤素离子等,例如用Nafion/粘土 修饰电极在流动体系中测定S2- 。
极 谱 还 原 电 流 溶 出 氧 化 电 流
电 解 过 程
溶 出 过 程
阴极溶出分析法,有人将其 称之为阳极溶出伏安法的镜 像技术,其富集是氧化过程, 溶出是还原过程,它包括被 分析物的阳极沉积,伴随着 负向电位扫描溶出。Ag + 和 Hg 2+ 可以与很多阴离子生成 难溶盐,所以阴极溶出分析 法所用的电极常选用汞电极 和 银 电 极 。
利用被测定物质在一定电位下的 吸附性,经一定时间后被吸附物 质在电极表面被浓集,然后选择 合适的电化学分析方法测定吸附 物质的量,称为吸附溶出分析法。 包括吸附物的形成、吸附性积聚 浓缩和金属的表面活性络合物的 还原。
定量分析——广泛用于无机和有机化合物的测定, 可进行40多种元素的定量测定
阳极
阴极
溶出伏 安法
电位 吸附
溶出伏安法的操作主要分为两步:第一步是 预电解,第二步是溶出。预电解在恒电位 和搅拌溶液的条件下进行的,搅拌溶液是 为了保证去极剂不断地从溶液向电极输送。 预电解是为了富集,富集之后停止搅拌, 让溶液静止30-60秒,这段时间称为休止期, 休止期后再进行溶出
溶出伏安法

一、阳极溶出伏安法(用于金属离子的测量)
溶出伏法包含电解富集和电解溶出两个过程。
1、电解富集
在选定的恒定电位下,对待测溶液进行电解,将溶液中的痕
量待测物富集到电极表面的过程。
待测金属离子通过电解还原成金属,与汞电极形成
汞齐(或者直接将金属沉积在惰性电极表面)富集过程表示
富集
为
Mn+ + ne + Hg
溶出伏安法(stripping voltammetry)是先将待测物质 预电解富集在电极表面,然后施加反向电压使富集的物质
重新溶出,根据溶出过程的伏安曲线进行分析的方法。
分类: 1.一般溶出伏安法 阴极溶出伏安法:阳极富集,阴极溶出 阳极溶出伏安法:阴极富集,阳极溶出 2.吸附溶出伏安法:吸附作用富集
记录所得的电流-电位曲线,称为溶出曲线。
11:15:34
溶出伏安曲线呈峰状,如下图所示。曲线中峰尖对应的电流
称峰电流(ip—定量分析依据)、对应的电位称峰电位(φP— 定性分析依据)。
11:15:34
3、溶出峰电流公式
溶出峰电流与电极类型和被测物质
浓度的关系(对汞膜电极):
ip = K’n2AD2/3ω1/2 u-1/6 tvc
2. 阴极溶出伏安法(CSV): 工作电极上还原 反应
例:S2-+Hg-2e = HgS (-0.4V阳极富集)
阴极溶出(-0.4V→-1.0V,阴极线性扫描,HgS 还原)
应用:测阴离子S2-、Cl-、Br-、I-等
3. 吸附溶出法:吸附富集→溶出 溶出:正向或负向扫描→对称峰形波 ip=Kc
M(Hg)溶出11:5:34为了提高富集效果,可同时使电极旋转或搅拌溶液,以加快 被测物质输送到电极表面,富集物质的量则与电极电位、电 极面积、电解时间和搅拌速度等因素有关。
极谱与伏安分析法

(1)工作电极的表面积要足够小,这样电流密度才会 大,CS才易于趋于零;
(2)被测物质浓度要稀,才易于使CS →0;
(3)溶液要静止,才能在电极周围建立稳定的扩散层。
二、极谱定量分析
• 1.扩散电流方程式(尤考维奇公式):
• 在滴汞电极上,扩散电流随着时间 而增加,即随着汞 滴面积的增长而周期性变化---在任一瞬间:
极谱法与伏安法的主要区别在于: 极谱分析法中使用的为表面能够周期更新的滴汞电极, 而在伏安分析中使用的是表面不能更新的液体电极 (例如:悬汞电极、汞膜电极等)或者固体电极(例 如:铂电极、金电极、玻碳电极等)。
极谱法的发展概况及分类
• 1922年,捷克学者海洛夫斯基(Heyrovsky)首先提 出极谱分析法,开创了这一电分析化学的分支; 1925年,海洛夫斯基与日本学者志方益三研制出第 一台手工操作式的极谱仪,画出第一张极谱图;
• (1) 残余电流阶段 ir:外加电压在到达金属离子分解 电压之前,有微弱电流流过电解池,主要为由于杂质 被还原而引起的电解电流以及充电电流ic。
• (2) 电流上升部分:当到达析出电位后,金属离子 被还原,电解电流随着外加电压的增大而迅速上升。
• (3) 极限扩散电流部分:当外加电压增加到一定数 值时,电流不在随着外加外加电压的增大而增大,达 到一极限值-------称为极限电流il,极限电流与与残余 电流的差值称为极限扩散电流id。
i 708 nD1/ 2 m 2 / 3 1/ 6c
• 式中: n:电子转移数目 D:离子扩散系数(cm2/s)
• m:汞流速(mg/s) :汞滴生长时间(s) c:被测物质的 浓度(mmol/L)
• 在汞滴生长的周期内,由于电极(汞滴)面积不同,电流也是变
伏安法和电位溶出法

在某一时刻,滴汞电极表面的情况可用
波的形成过程可
分为三个部分。
1.残余电流部分
图中AB段。这时,阴极 电位尚未达到Cd2+的析出 电位,电解还没有发生, 溶液中只有微小的电流 流过电解池,此电流称 为残余电流。
图6-4 镉的极谱图
2.电流上升部分
BD段。当外加电压继续 增加,使阴极电位达到 Cd2+的析出电位时,Cd2+ 开始在滴汞电极上还原 析出金属镉,并与汞生 成汞齐。电极反应如下:
平衡时的电极电位,两者之间出现偏 差,产生极化。这种由浓度差别所引 起的极化,称为浓差极化。
例如,把两个铜电极插入浓度为c 的硫酸铜酸性溶液中进行电解。电解 开始后,阴极附近的Cu2+离子将被还 原析出到电极上,使阴极表面附近溶 液中的Cu2+离子浓度不断降低。结果 使本体溶液中和阴极表面附近溶液中 的Cu2+离子浓度有了浓差。
在阳极,Cu将被氧化而溶解到溶液中。 同样,如果溶解速度大于扩散速度, 将会使电极表面附近溶液中Cu2+离子浓 度大于本体溶液中的Cu2+离子浓度,结 果电极电位变得更正。
降低电流密度、增高溶液温度或进行 搅拌可减小浓差极化。
(二)电化学极化 电化学极化是由于电极反应迟缓引
起的。整个电极过程非常复杂,通常有 几个步骤组成,有气体产生的电极反应 尤其如此。整个电极过程的速度决定于 速度最慢的一步。许多情况下,电极反 应是最慢的一步,为限速步骤。当外加
(二)极谱分析过程和极谱波
现以测定溶液中的微量Cd2+为例,说明极谱 分析过程。在电解池中加入1×103 mol/L的 CdCl2溶液,加入比待测离子含量高50~ 100倍的另一电解质(如KCl),此电解质 称为支持电解质;再加入1%的动物胶(称 为极大抑制剂)几滴;插入两支电极,按 上图所示的装置连接。
溶出伏安法与循环伏安法讲解

扫描电压变化速率保持恒定。
底液
电解质溶液溶度不宜过大(盐浓度增加,峰电流降低);
预电解电位
比半波电位负0.2~0.5 伏;或实验确定;
预电解时间
预电解时间长可增加灵敏度, 但线性关系差;
除氧
通N2或加入Na2SO3 。
汞电极:挤压 式悬汞电极、 挂吊式悬汞电 极、汞膜电极 (以石墨电极 为基质,在其 表面上镀上一 层汞得到)。
溶出伏安法
电解富集过程 电解溶出过程
电解富集过程: 是被测物质,在适当的电压下进行恒电位 电解,通过搅拌溶液,使试样中的痕量物 质被还原之后沉积在阴极这样一个过程。
电解溶出过程: 经过一定时间的富集后,停止搅拌,然后将 溶液静置一分钟左右,然后再两级上施加反 向扫描电压,使得沉积在原来的阴极的金属, 氧化溶解,从而形成较大的峰电流,这个过 程称为溶出过程。
对-亚胺基苯醌及苯醌均在电极上还原 , 分别产生对-胺基苯酚和对苯二酚
(形成峰2)
(形成峰3)
④再次阳极扫描时,对苯二酚又被氧化为苯醌 ,形成峰4 ,而 对-胺基苯酚又被氧化为对-亚胺基苯醌,形成与峰1完全相同 的峰5。
极化曲线不同: 单扫描极谱法的极
谱图是单向的尖峰状; 循环伏安法由于双向扫 描,所以极谱图为双向 的循环伏安曲线,
1、上半部分 ——还原波,称为阴极支。
2、下半部分 ——氧化波,称为阳极支。
循环伏安法
循环伏安法除了作为定量分析方法外,更主要的是作为电 化学研究的方法,可用于研究电极反应的性质、机理及电极过 程动力学参数等。
i (-)
(+)
h
富集
E 溶出
例:测定盐酸溶液中痕量物质Cu2+、pb2+、cd2+
《伏安和极谱分析法》课件

伏安法的原理和应用
1
应用
2
伏安法可用于测定溶液中的金属离子浓
度、电极表面的质子反应以及电解过程
中的动力学信息。
3
原理
伏安法基于电流与电压之间的关系来分 析化学反应。
操作步骤
实验中包括电化学池的搭建、采集电流 和电压数据以及数据分析。
极谱分析法的原理和应用
1
原理
极谱分析法基于物质在特定波长光下的吸收或发射来分析其组成。
伏安法和极谱分析法的优缺点和比较
伏安法
• 优点:灵敏度高、实验步骤简单、结果准确。 • 缺点:对电极表面状态敏感、不适用于非电
化学反应。
极谱分பைடு நூலகம்法
• 优点:高精确度、广泛应用、适用于稀溶液。 • 缺点:需要仪器设备、样品处理步骤复杂。
2
应用
极谱分析法可用于定量和定性分析金属、离子、有机物和生物样品。
3
操作步骤
实验中包括样品预处理、光谱仪的设置和信号测量、数据分析和结果解释。
伏安法和极谱分析法适用的样品类型
1 伏安法
适用于液态和固态样品,尤其是含有氧化还原反应的溶液。
2 极谱分析法
适用于气体、液体和固体样品,特别是需要分析其元素或化合物组成的样品。
《伏安和极谱分析法》 PPT课件
欢迎来到本次课程,我们将一起探讨伏安法和极谱分析法。这两种分析方法 在化学领域中扮演着重要角色,让我们深入了解它们的原理和应用,以及实 验操作步骤。
什么是伏安法和极谱分析法
伏安法
伏安法是一种电化学实验方法,用于研究氧化还 原反应和电化学动力学。
极谱分析法
极谱分析法是一种测定物质吸收或发射光谱的方 法,用于分析元素和化合物。
极谱与伏安分析法

交流极谱分析过程与极谱图
(1) 在图中 A 点,直流电压叠加 交流电压仍达不到被测物质的析出 电位。无交流电解电流产生; (2)当直流电压达到被测物质的析 出电位后,叠加交流电压将产生交 流电解电流; (3)在曲线的 B 点(半波电位)交流 电流的振幅最大;
(4)在图中 C 点,叠加交流电压不 能使扩散电流产生变化. 交流极谱产生峰型信号
05:16:40
三、方波极谱分析
square-wave polarography
1. 原理
充电电流限制了交流极谱灵 敏度的提高。将叠加的交流正弦 波改为方波,使用特殊的时间开 关,利用充电电流随时间很快衰 减的特性,在方波出现的后期, 记录交流极化电流信号。峰电流:
i p Kn AD V0 c
05:16:40
2.交流极谱的峰电流方程式与特点
对可逆反应: Ox + ne Red
n2 F 2 ip AD1/ 2 1/ 2 V0 c 4 RT
交流电压的角频率;
V0 交流电压的振幅;
特点: (1) 灵敏度比直流极谱稍高; (2) 分辨率比直流极谱高,峰电 位差40 mV可分辨。 (3) 氧的干扰小。
05:16:40
dE /dt -E 曲线
交流示波极谱滴定法测定 Zn2+
开始时,溶液中Zn2+发生电解反应, dE /dt -E 曲线上对 称出现切口, 滴加EDTA标准溶液,生成Zn-EDYA配合物,浓 度减小,切口变小,切口消失时,到达滴定终点。 可进行多种金属离子的连续滴定。以Zn2+为指示离子采
(3) 电容电流的补偿
扫描电压 和电极面积变 化,导致产生 电容电流 ( 10-7 A,相 当于10-5mol的 物质产生的电 流)。
极谱分析法和溶出伏安分析法
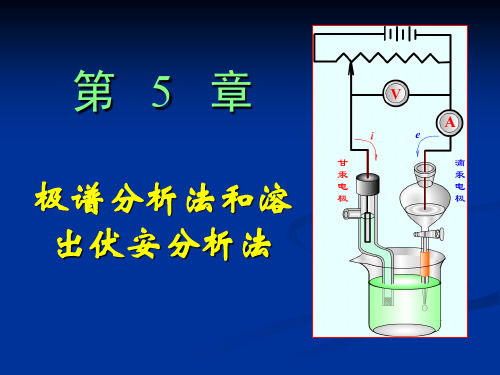
极化电极——由于滴汞电极面积很小,电解时电流密度很大,很容易发生
浓差极化,所以,在极谱分析中,滴汞电极为极化电极。
去极化电极——而甘汞电极其面积比滴汞电极大得多,电解时电流密度
很小,一般不会发生浓差极化,在一定条件下,其电极电位不变,所以,甘 汞电极为去极化电极。 下面以电解 CdCl2 溶液为 例说明极谱分析的一般过程。将1×10-3 mol/L CdCl2 溶液加入电解池中,同时加入 0.1 mol/L KCl 作支持电解质,加入几滴极大抑制剂,通 氮除氧,调节汞滴下落速度为3~5 s/滴,以滴 汞电极为阴极,甘汞电极为阳极,在静止溶液 中进行电解。通过移动滑线电阻触点 C 的位 置,使外加电压由0~-1V间逐渐增加。每改变 一次外加电压都记下相应的电流值。然后以电 流为纵坐标,外加电压为横坐标作图,即得到 电解镉离子的电流-电压曲线,即镉离子的极 化曲线,这就是所谓的极谱图。见图5.2。
第5章 极谱分析法和溶出伏安分析 7
2. 极谱分析的基本原理
极谱分析中,外加电压、电极电位和电流等之间的关系可用电解方程表示:
V = Ea − Ed.e + iR + η
外加电压 阳极电位 滴汞电极阴极电位 电压降 过电位
由于金属在滴汞电极上的过电位一般很小,可忽略;又由于极谱电流很小, 又有大量支持电解质,故电压降也可忽略,则
id = k c
第5章 极谱分析法和溶出伏安分析 11
id = k c
此时,若滴汞电极电位继续变负,扩散电流也不会再增大,所以在极谱图 上出现一个平台,这就是说,这时电极达到了完全浓差极化。在这种情况 下,极限扩散电流与被测离子的浓度成正比,如上式所示,这就是极谱定 量分析的依据。 由此可见,完全浓差极化是极谱分析的前提和基础。极谱波的产生就 是由于极化电极上出现的浓差极化现象引起的,所以,其电流-电压曲线也 称为极化曲线,“极谱”的名称也由此而来。 产生浓差极化的条件: 1) 作为极化电极的面积要小,这样电流密度就很大,单位面积上起电极 反应的离子数量就很多,电极表面被还原的离子浓度就易趋近于零; 2) 溶液中被测物质的浓度要低,一般不大于10-2 mol/L,使其在电极表面 易趋近于零; 3) 溶液不搅拌,有利于在电极表面附近建立起扩散层。
溶出伏安法

6
精选ppt
四、溶出伏安图
上图为电解富集时 的i-E曲线,C点为 产生极限电流的电 位。
下图为电解溶出时 的i- E曲线,呈峰状。
图9-1
7
精选ppt
五、溶出峰电流的性质
采用不同的工作电极时,溶出峰电流的表达 式各不相同。
1. 悬汞电极
ip K 1 z3 /2 D 0 2 /31 /2 1 /6 D R 1 /2 r1 /2 tc
3
精选ppt
三、工作原理
溶出伏安法的工作原理包含两个过程
1. 电解富集 2. 电解溶出
4
精选ppt
1. 电解富集
首先将被测物质在适当的电位
下(工作电极固定在产生极限电流电
位上)进恒电位电解,使被测物富集
在固定表面积的特殊电极上。
5
精选ppt
2.电解溶出
经过一定时间富集后,然后反 向改变工作电极电位,让富集在电 极上的被测物质重新溶出,同时记 录电流-电位曲线。
2. 汞膜电极
ip K 2z2D 0 2/3 1/2 1/6Atc
8
精选ppt
在一定实验条件下,iP与被测物的浓度成正比。
ip Kc
溶出伏安法定量分析的基础
9
精选ppt
六、特点
(一) 优点
突出优点是灵敏度很高。 原因:经过长时间的预先电解,将被测物质
富集的缘故。 一般达10-610-9mol.L-1,甚至可达10-11mol.L-1
1. 阳极溶出法
电解富集时,工作电极为阴极,电极上发生的是还原反应。 电解溶出时,工作电极为阳极,电极上发生的是氧化反应。 溶出时,工作电极上发生的是氧化反应就称为~ 。
2. 阴极溶出法
伏安与极谱分析法4
2. 示差脉冲极谱法 (DPP) ( Differential Pulse Polarography) 在一汞滴生长到一定时刻(一般为1~2s),在 线性变化的直流电压上叠加一个恒定振幅的脉 冲电压,在每滴汞生长期间记录两次电流,一 次在叠加脉冲前的20ms,另一次在脉冲结束 前20ms的瞬间。第一次记录的是直流电压的 背景电流,第二次记录的是叠加脉冲电压后的 电解电流。所得电流值扣除了由于直流电压所 引起的背景电流。
本章小结
1.极谱法是特殊条件下的电解方法:“一大一小”的 电极;在绝对静止条件下电解被测物质的稀溶液,由电 解所得电流-电压曲线来进行定性、定量分析。 2.尤考维奇方程是极谱定量分析的基础,必须牢记公 式的基本形式,明确各符号的物理意义及其单位,并能 熟练进行各种相关计算。
3.电容电流是提高经典极谱灵敏度的主要障碍。残余 电流、迁移电流、极大和氧波都是极谱分析的干扰电流。 分别用作图法、加入大量的支持电解质、加入极大抑制 剂和通N2除氧等办法加以消除。
溶出伏安法包含电解富集
和电解溶出两个过程。
溶出伏安法
阳极溶出伏安法:发生氧化反应 应用较多
阴极溶出伏安法:发生还原反应
阳极溶出伏安法 电解富集(阴极): 溶出(阳极):
M+ + ne- + Hg = M(Hg) M(Hg) = M+ + ne- + Hg
例:在盐酸介质中测定痕量铜、铅、镉 实验步骤: (1)电解:电位固定在 -0.8V,恒电位电解一 定的时间,同时通惰性 气体除氧,搅拌。 (2)静止:0.5-1min (3) 溶出:反向电位扫描 至0V, 同时记录溶出曲线。
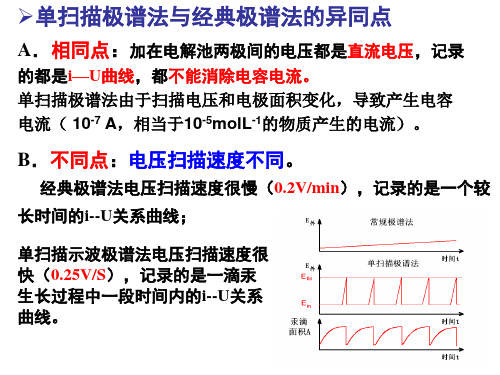
单扫描极谱法与经典极谱法的异同点
A.相同点:加在电解池两极间的电压都是直流电压,记录
溶出伏安法的原理和特点

溶出伏安法的原理和特点
溶出伏安法是一种电化学分析方法,它是通过测量在电极表面产生的
氧化还原电流来确定被测物质的含量。
该方法适用于溶液中含有可被
氧化还原的物质,如金属离子、有机物、无机物等。
该方法的原理基于法拉第定律和溶出动力学。
根据法拉第定律,当电
极表面与被测物质接触时,会发生氧化还原反应,并产生电流。
而溶
出动力学则描述了被测物质从固体样品中溶出到溶液中的过程。
因此,在进行溶出伏安法时,需要将固体样品置于电极上,并将其浸泡在含
有被测物质的溶液中。
然后施加一定的电势,在电极表面产生氧化还
原反应,并记录下产生的电流大小。
通过比较不同样品所产生的电流
大小,可以确定其含量差异。
与其他分析方法相比,溶出伏安法具有以下特点:
1. 灵敏度高:该方法可以检测微量物质,其灵敏度可达到ppb或更低水平。
2. 可选择性强:该方法可以针对不同的物质进行分析,并且可以通过
改变电极材料、电势大小等参数来提高选择性。
3. 操作简便:该方法操作简单,不需要复杂的仪器和设备,适用于实验室和现场分析。
4. 可重复性好:该方法测量结果稳定可靠,具有良好的重复性和准确性。
5. 适用范围广:该方法可用于分析各种溶解度较高的物质,如金属离子、有机物、无机物等。
总之,溶出伏安法是一种灵敏、可选择性强、操作简便、重复性好、适用范围广的电化学分析方法。
在实际应用中,可以根据需要进行改进和优化,以提高其分析效率和准确度。
伏安法和电位溶出法

由于理论分解电压等于电解池的反电动势,而电解池的反电动势E可由两个电极的平衡电位求得。如上例 中,铜电极为阴极,氧电极为阳极,其阴极平衡电位c和阳极平衡电位a分别
c
0 Cu
2
/Cu
0.059 2 lg a Cu 2
0.34 0.059 lg 0.1 2
0.31(V )
a
在阳极,Cu将被氧化而溶解到溶液中。同样,如果溶解速度大于扩散速度,将会使电极表面附近溶液中Cu2+离 子浓度大于本体溶液中的Cu2+离子浓度,结果电极电位变得更正。 降低电流密度、增高溶液温度或进行搅拌可减小浓差极化。
(二)电化学极化 电化学极化是由于电极反应迟缓引起的。整个电极过程非常复杂,通常有几个步骤组成,有气体产生的电极
负电荷进入溶液;
C2u 2e C u
(2)进入溶液的负电荷在电场的作用下从阴极移动到阳极;
(3)在阳极,电子又通过氧化反应
22 H O O 24 H 4e经导线回到电
源的正极。这三个步骤是同时进行的。
第二,电解是在不断克服反电解的过程中进行的。电解开始的瞬间,由于极少量的Cu和O2分别在阴极和阳极 上析出,使两支完全相同的铂电极分别变成了铜电极
滴汞电极的上部为贮汞瓶,下接一厚壁塑料管,塑料管的下端接一毛细管,其内径约为0.05 mm,汞自毛细 管中以3~6秒一滴的速度逐滴滴入电解液中。通常滴汞电极和外电源的负极相连,饱 和甘汞电极与外电源的正极 相连。
(二)极谱分析过程和极谱波
现以测定溶液中的微量Cd2+为例,说明极谱分析过程。在电解池中加入1×103 mol/L的CdCl2溶液,加入比待测 离子含量高50~100倍的另一电解质(如KCl),此电解质称为支持电解质;再加入1%的动物胶(称为极大抑制 剂)几滴;插入两支电极,按上图所示的装置连接。
溶出伏安法

溶出伏安法溶出伏安法是一种常用的电化学分析方法,用于研究物质在溶液中的电化学行为。
它通过测量溶液中的电流和电压来获得有关物质的信息,广泛应用于化学、材料科学、生物科学等领域。
溶出伏安法的原理是基于物质在溶液中的氧化还原反应。
在实验中,我们将待测物质溶解在电解质溶液中,通过施加外加电压或电流,使待测物质发生氧化或还原反应。
根据法拉第定律,物质的氧化还原反应与电流之间存在着一定的关系,通过测量电流和电压的变化,可以得到物质的氧化还原电位、电流-电势曲线等信息。
溶出伏安法的实验步骤通常包括:准备电化学池、制备溶液、选择电极、测量电流和电压等。
首先,我们需要准备一个电化学池,包括一个工作电极、一个参比电极和一个对电极。
工作电极是进行氧化还原反应的地方,参比电极用来提供一个稳定的参比电势,对电极则用来接通电路。
接下来,我们需要制备待测物质的溶液,将其注入电化学池中。
然后,选择合适的电极,将其插入电化学池中。
最后,通过测量电流和电压的变化,我们可以得到物质的氧化还原电位和电流-电势曲线。
溶出伏安法有很多应用。
在化学领域,它可以用来研究溶液中的氧化还原反应机理和反应动力学。
例如,我们可以利用溶出伏安法来研究金属腐蚀的机制,了解金属与溶液中的氧化还原反应过程。
在材料科学领域,溶出伏安法可以用来表征材料的电化学性能,评估材料的耐腐蚀性能。
在生物科学领域,溶出伏安法可以用来研究生物体内的氧化还原反应,了解生物体内的代谢过程。
溶出伏安法具有许多优点。
首先,它可以提供物质的氧化还原电位和电流-电势曲线等信息,有助于我们了解物质的电化学性质。
其次,溶出伏安法操作简单、灵活性高,适用于各种物质的研究。
此外,溶出伏安法还可以进行定量分析,可以用来测定物质的浓度和反应速率等。
溶出伏安法是一种重要的电化学分析方法,广泛应用于化学、材料科学、生物科学等领域。
通过测量电流和电压的变化,可以获得物质的氧化还原电位和电流-电势曲线等信息,有助于我们研究物质的电化学行为和性质。
2.4 伏安法

第二个波
H2O2 +2H++2e-= 2H2O, φ1/2=-0.8V 酸性
由于氧波的波形倾斜,延伸很长,影响许多物质的极 谱测定。必须除去溶解氧
17:55:45
(四) 氧波
除氧方法:
1.通气法
通入惰性气体除氧, 如高纯H2,N2 。
2.亚硫酸钠法
在中性或碱性溶液中, SO32-很容易被氧化为 SO42-,加入Na2SO3可 除去溶液中溶解的氧。
17:55:45
3. 操作条件的选择
(1)底液
一定浓度的电解质溶液(盐浓度增加,峰电流降低)。
(2)预电解电位
比半波电位负0.2~0.5 V;或实验确定。
(3) 预电解时间
预电解时间长可增加灵敏度, 但线性关系差。
(4) 除氧
通N2或加入Na2SO3 。
17:55:45
(5)电极
汞膜电极:银电极或玻碳电极上镀上一薄层汞,汞膜很 薄,沉积的金属浓度高,扩散出来的速率快,用汞膜电 极要比使用悬汞电极时的灵敏度高 1~2个数量级。
(4) 使用两支不同性能的电极。极化电极的电位随外加电 压变化而变,保证在电极表面形成浓差极化。
为什么使用两支性能不同的电极? 为什么要采用滴汞电极?
17:55:45
滴汞电极的特点
a. 电极毛细管口处的汞滴很小,易形成浓差
极化。
b. 汞滴不断滴落,电极表面不断更新,重 复性好。(但同时受汞滴周期性滴落的影响,汞 滴面积的变化使电流呈快速锯齿性变化)。
17:55:45
c. 氢在汞上的超电位较大。
d. 金属与汞生成汞齐,降低其析出电位,使碱金属 和碱土金属也可分析。 e. 汞容易提纯。 扩散电流产生过程中,电位变化很小,电解电流变化 较大,此时电极呈现去极化现象,这是由于被测物质的电 极反应所致。 被测物质具有去极化性质:去极剂。 Hg有毒。汞滴面积的变化导致不断产生充电电流(电
第4章 伏安法和极谱法

4-2-2 影响扩散电流的因素
(1)毛细管特性的影响
(id)平均 v2/3 t 1/6 (id)平均 h1/2
在实际操作中,应保持汞柱高度不变。
在分析标准溶液与未知试样时,要用同一支毛细管,并在同 样的汞柱高度下记录极谱图。
(id)平均=607nD1/2v2/3 t 1/6c
(2)温度影响
4-2-3 极谱分析中的干扰电流
1. 2. 3. 4. 残余电流 迁移电流 极谱极大 氧波
产生的原因:溶剂及试剂中的微量杂质及微量氧等。
消除方法:可通过试剂提纯、预电解、除氧等;
(b)充电电流(也称电容电流)
影响极谱分析灵敏度的主要因素。 产生的原因:分析过程中由于汞滴不停滴下,汞滴表面 积在不断变化,因此充电电流总是存在,较难消除。 充电电流约为10-7 A的数量级,相当于10-5~10-6mol/L的 被测物质产生的扩散电流,限制了极谱法的灵敏度。 消除方法:新极谱技术的发展,如方波极谱、脉冲极谱
(i
0
d
) t dt
( 8)
扩散电流方程:尤考维奇(Ilkovic)公式
(id)平均=607nD1/2v2/3 t 1/6c
(id)平均 每滴汞上的平均电流(A);n 电极反应中转移的电子 数;D 扩散系数; t 滴汞周期(s);c 待测物原始浓度(mmol/L); v 汞流速度(mg/s);
方 法 测量物理量 电极面积 待测物 极 化 电流 浓度 无浓差极化 趋于 0 -尽量减小极化 有电流 较高浓度 完全浓差极化 有电流 稀溶液 待测物 消耗量 极小 完全消耗 极小
电位分析 电位、电动势 -电解分析 电重量、电量 大面积 伏安法 电 流 小面积
目 录
4-1 普通极谱法的基本原理
伏安和电位溶出法

极谱分析法的基本原理 1.外加电压与电极电位的关系 V外 = φSCE –φde +iR V外--外加电压 φSCE--饱和甘汞电极电位 Φde--滴汞电极电位 R—电解池内电阻 (1)溶液中有大量支持电解质,R很小,所以 iR值可忽略不计 (2)饱和甘汞电极表面积的、电流密度小,不会有 浓差极化,电极电位保持恒定,不随外加电压改变 而改变,可作为电位参比标准(φSCE = 0) V外 = –φde
1922年,捷克学者海洛夫斯基 (Heyrovsky)首先提出极谱分析法,开 创了这一电分析化学的分支; 1925年,海洛夫斯基与日本学者志方 益三研制出第一台手工操作式的极谱仪, 画出第一张极谱图;
1959年,海洛夫斯基因发明和发展 了极谱分析法而获得诺贝尔化学奖; 20世纪,六、七十年代以来,理 论研究及应用得到迅速发展,各种新技 术、新方法不断出现。
其它干扰电流
氢波--H+在滴汞电极上还原而产生很大的还原电
流;
前波--溶液中存在着比被测物质 E
1/2更正的大
量前还原物质,它首先还原而干扰;
叠波--溶液中两种物质的半波电位相差<0.2V时, 两者的极谱原波发生重叠而互相干扰。
三、极谱分析方法
1、定性分析
半波电位φ1/2
2.定量分析
常用定量分析方法有标准曲线法、标准比较 法和标准加入法
室温下,O2在水中的溶解度约为8mg·L-1。电解
后,O2在电极上两步被还原,产生两个极谱波。
惰性气体驱O2--通常通入高纯N2气,有时也 可通H2气,也可在酸性溶液中通CO2、H2或 CO2 ; 还可以从酸性溶液中加入还原铁粉或加入 Na2CO3产生以驱O2; 化学除O2--通常在碱性或中性溶液中加入 Na2SO3,把O2还原除去,(在酸性介质中, SO32-不稳定且会在电极上还原,故O2还原。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. 基本原理
(1)预电解富集:在适当电压下使工作电极(如 预电解富集:在适当电压下使工作电极( 悬汞电极) :悬汞电极)电位处于能产生极限电流的电位进 行恒电位电解试液, 使被测物质富集在电极上; 行恒电位电解试液, 使被测物质富集在电极上; 电解富集时,搅拌溶液) (电解富集时,搅拌溶液) 溶出:施加反向电压, (2)溶出:施加反向电压, 使富集在工作电极上 的物质溶出,得到尖锋状的溶出伏安曲线. 的物质溶出,得到尖锋状的溶出伏安曲线. (溶出 时,保持溶液静止) 保持溶液静止)
二、循环伏安法(P179) 循环伏安法(P179)
(一)基本原理
扫描电压: 三角波电压,快速线性循环扫描于工作电极。 扫描电压: 三角波电压,快速线性循环扫描于工作电极。 工作电极:悬汞滴或铂电极等静止电极。 工作电极:悬汞滴或铂电极等静止电极。 一个三角波扫描完成一个还原—氧化循环, 一个三角波扫描完成一个还原—氧化循环,得到循环伏安曲 线。
23:05:22
P185第14题解答( P185第14题解答(注:不是标准加入法): 题解答 不是标准加入法): 设试样溶液中铅的物质的量浓度为C 解:设试样溶液中铅的物质的量浓度为CX ,则: 10.0 C x 法一: 法一: =k× = 58.9 − 12.4 = 46.5 (1) d (x) 50.0 10.0 C x + 5.0 × 1.7 × 10 −3 id ( x + s ) = k × = 81.5 − 12.4 = 69.1 50.00 10.0 C x 46.5 = = 0.673 (1) ÷ ( 2 ) : −3 10.0 C x + 5.0 × 1.7 × 10 69.1
C x = 1.75 × 10 −3 ( mol / L )
' C x = 1.75 × 10 −3 × 207.2 = 0.36 ( mg / ml )
(2)
法二: 法二:
1 0 .0 C x = 5 8 .9 − 1 2 .4 = 4 6 .5 (1 ) 5 0 .0 5 .0 × 1 .7 × 1 0 − 3 = 8 1 .5 − 5 8 .9 = 2 2 .6 id (s ) = k × 5 0 .0 由 ( 2 ) 得 : k = 1 .3 3 × 1 0 5 , 代 入 (1 ) , 得 : id ( x ) = k × C x = 1 .7 5 × 1 0 − 3 ( m o l / L ) C x' = 1 .7 5 × 1 0 − 3 × 2 0 7 .2 = 0 .3 6 ( m g / m l )
23:05:22
i
扫描方向: 扫描方向:
-0.4
-0.6 -0.8
-1.0
V
S2-的阴极溶出伏安曲线
2、主要测定条件的选择 主要测定条件的选择
(1) 富集过程 A.预电解电位:比半波电位负0.2~ 或实验确定; A.预电解电位:比半波电位负0.2~0.5 伏;或实验确定; 预电解电位 0.2 B. 预电解时间 预电解时间长可增加灵敏度, 但线性关系差; 预电解时间长可增加灵敏度, 但线性关系差; 化学计量: 被测物完全电积在阴极上。精确性好,时间长; 化学计量: 被测物完全电积在阴极上。精确性好,时间长; 非化学计量(常用方法): 2%~3%电积在阴极上 电积在阴极上; 非化学计量(常用方法): 约 2%~3%电积在阴极上; 在搅拌下,电解富集一定时间。 在搅拌下,电解富集一定时间。 (2)溶出过程 (2)溶出过程
待测物在滴汞电极上还原,产生的电流在测量电阻R上产生电压降, 待测物在滴汞电极上还原,产生的电流在测量电阻R上产生电压降,经垂 直偏向放大器放大后,加到示波器的垂直偏向板上( 轴坐标:电流); );电解 直偏向放大器放大后,加到示波器的垂直偏向板上(Y轴坐标:电流);电解 中的电位变化,经水平偏向放大器放大后,加到示波器的水平偏向板上( 中的电位变化,经水平偏向放大器放大后,加到示波器的水平偏向板上(X 轴坐标:扫描电压). 轴坐标:扫描电压).
23:05:22
2、单扫描极谱波的产生
经典极谱法: 获得一个极谱波需近百滴汞(滴汞周期 7s),电压扫描慢(0.2V/min 0.2V/min) 0.2V/min 单扫描极谱法: 在一滴汞(滴汞周期7s 滴落前2S 7s) 2S的 单扫描极谱法: 在一滴汞(滴汞周期7s)滴落前2S的 时间内进行电压快速线性扫描(0.5V/2S) 时间内进行电压快速线性扫描(0.5V/2S),就可获 得一个极谱波.. 得一个极谱波
23:05:22
4、工作电极
(1)悬汞电极 (2)汞膜电极:以玻碳或银作基质(载 体),其表面镀上一层很薄的一层汞。 (3)固体电极(如:铂电极、金电极) 优点:可在较正的电位范围作阳极溶出 电极(汞在较正电位时,可被氧化溶出)
23:05:22
作业: 作业:
P185 2、6、11、14、 补充: 极谱过程是一种特殊的电解过 程,主要表现在哪些方面?
第九章 极谱与伏安分析法 一、单扫描极谱 分析法 第四节 二、溶出伏安法 几种新型极谱和 三、循环伏安法 循环伏安法 伏安分析法
23:05:22
一.单扫描极谱法
(一)基本原理
单扫描极谱法(也称为直流示波极谱法): 单扫描极谱法(也称为直流示波极谱法): 用阴极射线示波器作为电信号测量工具的极谱法. 用阴极射线示波器作为电信号测量工具的极谱法.示波器显示 电压和电流信号大小。 电压和电流信号大小。 1、基本装置 扫描电压: 扫描电压:在直流可调 电压上叠加周期性的锯齿 型电压(极化电压) 型电压(极化电压)
除氧(消除氧波的干扰) 或加入Na A. 除氧(消除氧波的干扰):通N2或加入Na2SO3 。
B、保持溶液静止; 保持溶液静止; 扫描电压变化速率保持恒定。 C、扫描电压变化速率保持恒定。
23:05:22
3、定量方法
依据: 依据:条件一定时 测量峰高: 测量峰高:略 定量方法:与普通极谱法相同。 定量方法:与普通极谱法相同。 标准曲线法: 标准曲线法:略 标准加入法: 标准加入法:略 ip=kc 或 hp=kc
23:05:22
三、溶出伏安法(P182)
溶出伏安法: 溶出伏安法:以电解富集和溶出测定相结合的 一种电化学分析方法。 一种电化学分析方法。
溶出伏安法 阳极溶出伏安法 阴极溶出伏安法 富集 阴极 阳极 溶出 阳极 阴极
i + 0 ip =-KC φD φ
溶出时电位变化方向
测定对象 阳离子 阴离子
富集 溶出
氧化波(阳极支):R 氧化波(阳极支):R-ne→O ):
△φp
峰电流和峰电 位均与单扫描 极谱法相同。 极谱法相同。
(二)应用
该法常不用来作成分分析, 该法常不用来作成分分析,一般用于研究电极过程 和氧化还原反应机理.. 和氧化还原反应机理
1、判断电极过程的可逆性 判断电极过程的可逆性
可逆过程: 上、下两条曲线对称 可逆过 2e + Hg
M ( Hg )
在φD处电解富集
在一定条件下, 在一定条件下, 峰电流与被测物质浓度 成正比(定量依据): 成正比(定量依据): i = - KC
p
23:05:22
阳极溶出伏安曲线(红色所示) 阳极溶出伏安曲线(红色所示)
Cu , Pb
电流
,Cd
的阳极溶出伏安曲线
+ 0
波峰
波尾 基线
ip 峰电流; φp 峰电位。 峰电流; 峰电位。 ip ∝ c
定量依据
电位尚未达到被测离子的析出电位,电流很小,图中a 基线) (1)电位尚未达到被测离子的析出电位,电流很小,图中a~b段(基线); 被测离子的析出电位时 (2) 快速扫描达到被测离子的析出电位时,汞滴附近的被测离子瞬间被 ) 快速扫描达到被测离子的析出电位 还原, 急剧上升) 图中b~c段 还原,产生较大的电流(急剧上升),图中 段; (3)被测离子来不及扩散到电极表面,电流下降,图中 c ~d段; )被测离子来不及扩散到电极表面,电流下降, 段 此时受扩散控制, (4) 电极反应和扩散达到平衡 电流稳定 此时受扩散控制 图中 d ~e段 ) 电极反应和扩散达到平衡, 电流稳定,此时受扩散控制 段 波尾) (波尾).
i + 0
φ
① ipa= ipc ② ∆φp=φpa-φpc=2.22RT/nF 56.5/n(mv)(25℃ )(25 = 56.5/n(mv)(25℃) 通常∆φp=55/n mv~65/n mv,则可认为可逆过程. 通常∆ mv~ mv,则可认为可逆过程. 则可认为可逆过程 不可逆过程: 不可逆过程:上、下两条曲线极不对称, ∆φp不在 mv~ mv范围 甚至反扫描时不出现阳极峰。 范围, 55/n mv~65/n mv范围,甚至反扫描时不出现阳极峰。
-0.2 -0.4 -0.6 -0.8
电位( 电位(伏) 溶出时电位变化方向
-
Cu2+ Pb2+
Cd2+
如 M
23:05:22
2+
+ 2e + Hg
富集 溶出
M ( Hg )
S2-的阴极溶出伏安曲线: 的阴极溶出伏安曲线: 在-0.4伏处电解富集: 0.4伏处电解富集: 伏处电解富集 Hg+S2-→HgS+2e溶出(悬汞电极的电位由正向负方向扫描) 溶出(悬汞电极的电位由正向负方向扫描): HgS+2e- →Hg+S2阴极溶出伏安法可用来 测定Cl 测定Cl-、Br-、I-、S2-、 等阴离子. C2O42-等阴离子.
ip=K c (定量依据) 定量依据)
峰电位(对可逆波): 对可逆波)
ϕ1/ 2为普通极谱的半波电位
RT ϕ 与被测物浓度无关 定性依据) (定性依据) ϕP = ϕ1/ 2 ±1.1 p nF
还原波: 还原波: 氧化波: 氧化波: +
