药动学重要参数
药动学
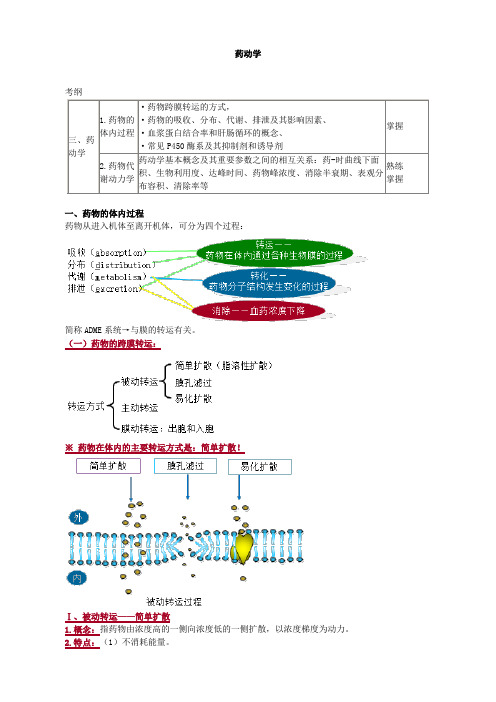
药动学考纲三、药动学1.药物的体内过程·药物跨膜转运的方式,·药物的吸收、分布、代谢、排泄及其影响因素、·血浆蛋白结合率和肝肠循环的概念、·常见P450酶系及其抑制剂和诱导剂掌握2.药物代谢动力学药动学基本概念及其重要参数之间的相互关系:药-时曲线下面积、生物利用度、达峰时间、药物峰浓度、消除半衰期、表观分布容积、清除率等熟练掌握一、药物的体内过程药物从进入机体至离开机体,可分为四个过程:简称ADME系统→与膜的转运有关。
(一)药物的跨膜转运:※药物在体内的主要转运方式是:简单扩散!Ⅰ、被动转运——简单扩散1.概念:指药物由浓度高的一侧向浓度低的一侧扩散,以浓度梯度为动力。
2.特点:(1)不消耗能量。
(2)不需要载体。
(3)转运时无饱和现象。
(4)不同药物同时转运时无竞争性抑制现象。
(5)当膜两侧浓度达到平衡时转运即停止。
3.影响简单扩散的药物理化性质(影响跨膜转运的因素)(1)分子量分子量小的药物易扩散。
(2)溶解性脂溶性大,极性小的物质易扩散。
(3)解离性非离子型药物可以自由穿透。
离子障是指离子型药物被限制在膜的一侧的现象。
※药物的解离程度受体液pH 值的影响离子型非离子型4.体液pH值对弱酸或弱碱药物的解离的影响:※pK a(解离常数)的含义:>>是指解离和不解离的药物相等时,即药物解离一半时,溶液的pH值。
>>每一种药物都有自己的pK a。
若为弱酸性药物,则:若为弱碱性药物,则:从公式可见,体液pH算数级的变化,会导致解离与不解离药物浓度差的指数级的变化,所以,pH值微小的变动将显著影响药物的解离和转运。
一个pK a=8.4的弱酸性药物在血浆中的解离度为A.10%B.40%C.50%D.60%E.90%『正确答案』A『正确解析』pH对弱酸性药物解离影响的公式为:即:解离度为107.4-8.4=10-1=0.1。
※四两拨千斤:体液pH值对药物解离度的影响规律:◇酸性药物——在酸性环境中解离少,容易跨膜转运。
药动学参数的概念及临床意义

药动学参数的概念及临床意义
首先,药动学参数可以用来确定药物的适应症和用药剂量。
了解药物的药动学特性可以帮助医生选择合适的药物,并确定合适的给药剂量。
对于吸收和分布速度较快的药物,可选择给予较大的剂量以快速达到治疗浓度;对于代谢和排泄速度较快的药物,可选择较低的剂量以避免药物积累而产生毒副作用。
因此,药动学参数对于合理用药至关重要。
其次,药动学参数还可以预测药物的药效和药物的作用时间。
药物通过与机体内的受体或酶结合产生药理效应,在药动学参数的帮助下可以预测药物达到治疗效果所需的时间和药物效应的持续时间。
这对于根据疾病的自然发展情况和病人的生理状态来调整给药计划具有重要意义。
此外,药动学参数还可以评估药物的安全性。
药物的代谢和排泄速度会直接影响药物在体内的浓度,从而影响药物的毒副作用发生的概率和程度。
了解药物的药动学参数可以帮助预测和评估药物的安全性,避免药物过量使用导致不良反应。
最后,药动学参数还可以指导药物的监护和调整。
对于需要长期使用的药物,了解药物的药动学特性可以帮助医生监测药物浓度的变化,并根据病人的具体情况调整给药剂量。
这对于提高疗效和减少不良反应尤为重要。
总之,药动学参数对于合理用药具有重要的临床意义。
它可以帮助医生确定合适的药物和用药剂量,预测药物的药效和作用时间,评估药物的安全性,以及指导药物的监护和调整。
因此,在临床工作中,合理应用药动学参数对于提高治疗效果,减少不良反应,保障患者安全至关重要。
药理学—— 药动学知识点归纳

药理学——药动学知识点归纳一、药物的体内过程药物从进入机体至离开机体,可分为四个过程:简称ADME系统→与膜的转运有关。
(一)药物的跨膜转运:※药物在体内的主要转运方式是:被动转运中的简单扩散!Ⅰ、被动转运——简单扩散1.概念:指药物由浓度高的一侧向浓度低的一侧扩散,以浓度梯度为动力。
2.特点:(1)不消耗能量。
(2)不需要载体。
(3)转运时无饱和现象。
(4)不同药物同时转运时无竞争性抑制现象。
(5)当膜两侧浓度达到平衡时转运即停止。
3.影响简单扩散的药物理化性质(影响跨膜转运的因素)(1)分子量分子量小的药物易扩散。
(2)溶解性脂溶性大,极性小的物质易扩散。
(3)解离性非离子型药物可以自由穿透。
离子障是指离子型药物被限制在膜的一侧的现象。
4.体液pH值对弱酸或弱碱药物的解离的影响:从公式可见,体液pH算数级的变化,会导致解离与不解离药物浓度差的指数级的变化,所以,pH值微小的变动将显著影响药物的解离和转运。
例题:一个pK a=8.4的弱酸性药物在血浆中的解离度为A.10%B.40%C.50%D.60%E.90%『正确答案』A『答案解析』pH对弱酸性药物解离影响的公式为:10 pH-pKa=[解离型]/[非解离型],即解离度为10 7.4-8.4=10-1=0.1。
※总结:体液pH值对药物解离度的影响规律:◇酸性药物在酸性环境中解离少,容易跨膜转运。
达到扩散平衡时,主要分布在碱侧。
◇碱性药物在碱性环境中解离少,容易跨膜转运。
达到扩散平衡时,主要分布在酸侧。
同性相斥、异性相吸或“酸酸碱碱促吸收;酸碱碱酸促排泄”例题:某弱酸性药物pK a=3.4,若已知胃液、血液和碱性尿液的pH 值分别是1.4、7.4和8.4。
问该药物在理论上达到平衡时,哪里的浓度高?A.碱性尿液>血液>胃液B.胃液>血液>碱性尿液C.血液>胃液>碱性尿液D.碱性尿液>胃液>血液E.血液>碱性尿液>胃液『正确答案』A『答案解析』同性相斥、异性相吸。
药动学参数(PK parameter) 的意义

药动学参数(PK parameter)是反映药物在体内动态变化规律性的一些常数,定量描述了药物在体内经时过程的动力学特点及作用变化规律。
药动学参数是临床制订合理给药方案的主要依据之一,同时也是评价药物制剂质量的重要指标。
一般情况下,药动学参数是指由非房室模型统计矩方法得到的参数,此外还包括房室模型药动学参数。
编辑本段非房室模型药动学参数1. 药峰浓度(Cmax)给药后出现的血药浓度最高值。
该参数是反映药物在体内吸收速率和吸收程度的重要指标。
2. 达峰时间(Tmax)给药后达到药峰浓度所需的时间。
该参数反映药物进入体内的速度,吸收速度快则达峰时间短。
3. 末端消除速率(Ke)末端相的血药浓度消除速率常数。
将血药浓度取对数,对时间作线性回归后所得斜率值的负数为末端消除速率。
4. 末端消除半衰期(T1/2)末端相血药浓度下降一半所需的时间。
该参数直观反映了药物从体内的消除速度。
末端消除半衰期在数值上与末端消除速率互为倒数,即: 末端消除半衰期=0.693/末端消除速率。
5. 药时曲线下面积(AUC)血药浓度曲线对时间轴所包围的面积。
该参数是评价药物吸收程度的重要指标,反映药物在体内的暴露特性。
由于药动学研究中血药浓度只能观察至某时间点t,因此AUC有两种表示方式: AUC(0-t)和AUC(0-∞),前者根据梯形面积法得到,后者计算式: AUC(0-∞) = AUC(0-t) + 末端点浓度/末端消除速率。
6. 清除率(CL)单位时间内从体内清除的药物表观分布容积数,单位一般为L/h。
该参数是反映机体对药物处置特性的重要参数,与生理因素有密切关系。
清除率根据剂量与AUC(0-∞)的比值得到。
7. 表观分布容积(Vd)药物在体内达到动态平衡时体内药量与血药浓度的比例常数,单位一般为L。
该参数反映了药物在体内分布广窄的程度,数值越高表示分布越广。
表观分布容积在数值上由清除率与末端消除速率的比值得到。
8. 平均驻留时间(MRT)药物分子在体内停留时间的平均值,表示从体内消除63.2%药物所需要的时间。
兽医药理学简答题

简答1.药动学的主要参数及其意义①消除半衰期:半衰期是指体内药物浓度或药量下降一半所需要的时间。
是反映药物从体内消除快慢的一种指标。
②药时曲线下面积(AUC):在药动学研究中,给药后在不同时间采集血样,测定其药物浓度,常以时间作为横坐标,以血药浓度作为纵坐标,绘出曲线,称为血药浓度-时间曲线,简称药时曲线,是反映吸收到体内的药物总量。
③表观分布容积(Vd):是指药物在体内的分布达到动态平衡时,药物总量按血浆药物浓度分布所需的总容积。
Vd值的意义是反映药物在体内的分布情况,一般Vd值越大,药物穿透入组织的越多,分布越广,血中药物浓度越低。
④体清除率(Clb):是指在单位时间内机体通过各种消除过程消除药物的血浆容积,是评价清除机制最重要的参数,反应肝肾功能。
⑤生物利用度:是指药物以某种剂型的制剂从给药部位吸收进入全身循环的速率和速度,是用于测定药物制剂生物等效性的主要参数。
2.吸入麻醉药和注射麻醉药的优缺点?注射麻醉:优点:不需要麻醉机、诱导期短或不明显。
对呼吸道不易产生刺激作用,无爆炸危险。
缺点;容易过量,麻醉深度不能迅速逆转、肌松作用差、消除依赖肝肾的功能。
吸入麻醉优点:麻醉剂量和浓度容易控制,麻醉作用迅速逆转、消除主要靠肺脏呼气迅速排出,不是肝肾的功能。
缺点:需要专门设备。
有的易燃易爆。
诱导期明显。
3.氨茶碱【药理作用】①支气管平滑肌松弛作用②兴奋呼吸中枢③强心作用、间接利尿作用【临床应用】主要用于支气管哮喘;治疗慢性阻塞性肺疾病;心源性哮喘4.肾上腺素【药理作用】(α、β₁和β₂受体激动剂,激动所有的肾上腺素受体)①心脏:dr激动心肌、窦房结和传导系统的β₁受体;心肌收缩力↑、输出量↑、心率↑、传导加速,起效迅速而剧烈。
②血管:激动血管平滑肌上的α₁、β₂受体;激动α₁-受体:强烈收缩皮肤粘膜血管;显著收缩肾和肠系膜血管;对脑和肺血管作用弱。
激动β₂-受体:舒张骨骼肌血管和冠状血管。
③平滑肌:取决于组织和器官上肾上腺素受体的类型。
药效动力学参数

药效动力学参数
摘要:
一、药效动力学参数的概念
二、药效动力学参数的重要性
三、药效动力学参数的分类
1.药代动力学参数
2.药效学参数
四、药效动力学参数的测定方法
五、药效动力学参数在临床应用中的作用
六、药效动力学参数的研究现状与发展趋势
正文:
药效动力学参数是指药物在生物体内发挥作用的过程中,反映药物浓度与生物效应之间关系的参数。
这些参数对于药物研发、临床用药以及个体化治疗等方面具有重要的意义。
药效动力学参数可以分为两大类:药代动力学参数和药效学参数。
药代动力学参数主要描述药物在体内的吸收、分布、代谢和排泄过程,包括药物的生物利用度、半衰期、清除率等。
药效学参数则主要描述药物对生物体的生物效应,如最大效应、效应强度、剂量- 效应关系等。
药效动力学参数的测定方法有多种,包括临床试验、动物实验以及计算机模拟等。
在药物研发过程中,研究人员会通过这些方法来评估药物的安全性、有效性和个体差异。
在临床应用中,医生会根据患者的药效动力学参数来调整
药物剂量,以达到最佳治疗效果。
随着药物研究的深入,药效动力学参数在药物研发和临床应用中的作用越来越受到重视。
研究人员不仅关注药物的化学结构和作用机制,还关注药物在体内的代谢和排泄过程,以及药物对生物体的生物效应。
此外,个体化治疗的理念也促使药效动力学参数的研究不断发展,以便为患者提供更个性化、更有效的治疗方案。
总之,药效动力学参数在药物研发、临床用药以及个体化治疗等方面具有重要意义。
第三章 第二节 药动学基本参数及概念
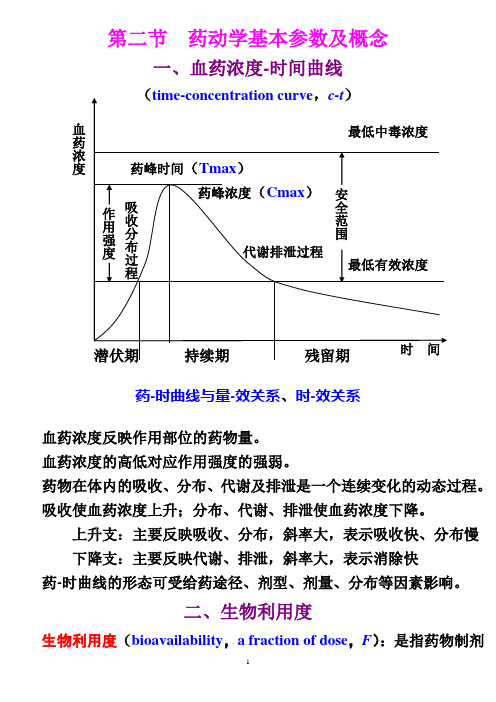
第二节 药动学基本参数及概念一、血药浓度-时间曲线药-时曲线与量-效关系、时-效关系血药浓度反映作用部位的药物量。
血药浓度的高低对应作用强度的强弱。
药物在体内的吸收、分布、代谢及排泄是一个连续变化的动态过程。
吸收使血药浓度上升;分布、代谢、排泄使血药浓度下降。
上升支:主要反映吸收、分布,斜率大,表示吸收快、分布慢 下降支:主要反映代谢、排泄,斜率大,表示消除快药-时曲线的形态可受给药途径、剂型、剂量、分布等因素影响。
二、生物利用度生物利用度(bioavailability ,a fraction of dose ,F ):是指药物制剂血药浓度被机体吸收的速率和吸收程度的一种量度。
即:实际被吸收利用的量(A)占服用总量(D)的百分比。
F=A/D×100%药物的吸收量可通过测定给药后的药-时曲线下面积(area under the time concentration curve,AUC)来估算。
绝对生物利用度F=AUC po×D iv/AUC iv×D po×100%相对生物利用度F=AUC t×D r/AUC r×D t×100%AUC:曲线下面积D:剂量po:口服iv:静注t:试验制剂r:参比制剂影响因素:可因制剂质量、剂型、给药途径、患者具体情况等不同,同一药物的生物利用度会有差异。
意义:评价各种药物制剂的生物等效性;评价药物的首过消除与作用强度;指导临床合理用药;查明药物无效或中毒的原因。
三、表观分布容积药物在体内的分布是不均的。
当药物在体内分布达到动态平衡时,体内药量与血药浓度的比值称表观分布容积(apparent volume of distribution,V d)。
V d=A/C。
V d:表观分布容积A:给药量(mg/kg)C:血药浓度(mg/L)意义:表示药物在组织中分布范围的广窄,结合程度的高低。
V d ≈0.045 L/kg,主要分布在血浆;V d = 0.14-0.29 L/kg,主要分布在细胞外液;V d = 0.3-0.4 L/kg,主要分布在细胞内液;V d ≈0.6L/kg,表示分布在细胞内外液;V d >>0.6L/kg,表示药物在某组织中集中分布。
药物动力学常见参数及计算方法PK

*
*
*
*
吸收 AUC 反映吸收程度、Ka反映吸收速度 分布 Vd 是表观分布容积. Vd接近0.1 L/kg说明药物主要在血中 Vd>>1 L/kg则说明该药有脏器浓集现象 消除 包括排泄及代谢, ke,β是消除速率常数 t1/2,t1/2β,CL反映药物的消除速度. 尿排率 过大者,肾功能不佳时应注意减量或延时 过小者,提示代谢为主,肝功不佳时慎用 该药易出现药物相互干扰,联用时应注意 个体差异 AUC,Vd及t1/2的变异系数大于50%者, 临床用药时应注意剂量调控.
药动学模型 为了定量研究药物体内过程的速度规律而建立的模拟数学模型。常用的有房室模型和消除动力学模型。
*
*
房室模型
房室(compartment)
房室的划分是相对的 房室模型的客观性 房室模型的时间性 房室模型的抽象性 开放式和封闭式模型
房室划分
单室模型 多室模型
中央室 周边室
*
*
一室模型 二室模型 ka---吸收速率常数 ke,k10--消除速率常数 k12--1室到2室的k k21-----2室到1室的k Vd---表观分布容积 V1----1室的分布容积
非线性消除动力学模型
*
*
ln C-T曲线
C-T曲线
线性 C-T图上恒为曲线
线性 lnC-T图上恒为直线
非线性 lnC-T图上 曲线为主,低段趋直线
非线性 C-T图上 直线为主,低段趋曲线
*
*
线性或非线性动力学的比较
线性 非线性 AUC 与剂量呈直线关系 与剂量呈曲线关系 与剂量呈正比 与剂量呈超比例增加 T1/2 基本不变 大剂量时,T1/2延长 Cmax 与剂量基本呈正比 与剂量呈超比例增加 模型 房室模型 米氏方程模型 动力学 一级动力学 非线性动力学 先零级,后一级 C-T图 曲线 先直线后曲线 lnC-T图 直线 先曲线后直线 药物 多数药物 少数药物
药动学参数的几何均值比

药动学参数的几何均值比一、药动学参数概述药动学(Pharmacokinetics,PK)是研究药物在生物体内吸收、分布、代谢和排泄等过程的科学。
在药物研发和临床应用中,药动学参数是评估药物疗效和安全性的重要依据。
常见的药动学参数包括生物利用度(F)、清除率(Cl)、半衰期(t1/2)和剂量比例(Cmax/Cmin)等。
本文将重点介绍药动学参数中的几何均值比。
二、几何均值比的概念与计算方法几何均值比(Geometric Mean Ratio,GMR)是一种用来描述两个药动学参数之间关系的统计量。
在临床试验中,研究者通常比较药物在患者体内的暴露量与剂量之间的关系,以评估药物的疗效和安全性。
几何均值比就是用来衡量这种关系的指标。
几何均值比的计算方法如下:GMR = (C1 / C2)^(1/n)其中,C1和C2分别为两个药动学参数的数值,n为样本数量。
当GMR 等于1时,表示两个药动学参数的值相等;当GMR大于1时,表示第一个药动学参数的值高于第二个药动学参数;当GMR小于1时,表示第一个药动学参数的值低于第二个药动学参数。
三、几何均值比的应用与意义1.药物剂量调整:通过比较不同剂量下药物的药动学参数,可以确定最佳剂量,以实现疗效最大化、副作用最小化。
2.药物相互作用研究:药物在体内的代谢和排泄过程可能受到其他药物的影响。
通过研究几何均值比,可以评估药物之间的相互作用,为临床用药提供依据。
3.个性化用药:根据患者的药动学参数,为其制定个体化的给药方案,提高药物疗效和安全性。
4.临床试验设计:几何均值比可用于评估临床试验中药物疗效的终点指标,为试验设计提供依据。
四、结论与展望药动学参数的几何均值比在药物研发和临床应用中具有重要意义。
随着生物统计学和计算机技术的发展,几何均值比在个性化用药和药物相互作用研究等领域将发挥越来越重要的作用。
药动学的名词解释药理学

药动学的名词解释药理学
药动学(Pharmacokinetics)是药理学的一个分支,研究药物在体内的吸收、分布、代谢和排泄过程,以及药物在体内的转化和消除速度等参数。
药动学的主要目标是了解药物在人体内的行为,以便更好地理解药物的药效、副作用和安全性。
药物在体内的吸收指的是药物从给药途径(如口服、注射等)进入到血液循环中的过程。
分布是指药物在体内的分布情况,包括药物在血浆和各组织器官中的浓度分布。
代谢是指药物在体内被代谢酶转化为代谢产物的过程,通常发生在肝脏中。
排泄是指药物及其代谢产物通过肾脏、胆道、肺和皮肤等途径离开体内的过程。
药动学研究的主要参数包括生物利用度(Bioavailability)、血浆药物浓度时间曲线、药物的体内分布和消除速率等。
生物利用度是指给定途径给药后进入循环系统的药物比例,反映了药物在体内吸收的有效程度。
血浆药物浓度时间曲线是药物在体内的吸收、分布、代谢和排泄过程的动态表现,通过绘制该曲线可以了解药物在体内的药代动力学过程。
药物的体内分布和消除速率反映了药物在体内的分布和清除速度,对药物的疗效和安全性具有重要影响。
药动学研究可以帮助药物研发人员更好地了解药物的药效和副作用,优化药物的给药途径和剂量,以及设计个体化的治疗方案。
此外,药
动学也对临床药学、药物治疗监测和药物相互作用等方面具有重要意义。
总之,药动学是一个重要的研究领域,通过研究药物在体内的吸收、分布、代谢和排泄过程,可以为药物研发和临床应用提供理论依据,以实现更有效、安全和个体化的药物治疗。
基于药物动力学的药物个体化剂量选择

基于药物动力学的药物个体化剂量选择药物个体化剂量选择是指根据患者的个体特征和药物作用动力学参数,个性化地调整药物剂量,以实现最佳的治疗效果和最小的药物不良反应。
药物动力学是研究药物在人体内吸收、分布、代谢和排泄的过程,而基于药物动力学的药物个体化剂量选择则是基于患者个体差异和药物的动力学特征,选择最佳的剂量方案。
本文将深入探讨基于药物动力学的药物个体化剂量选择的原则和方法。
一、药物动力学的参数药物动力学的参数主要包括最大浓度(Cmax)、最小浓度(Cmin)、药物半衰期(t1/2)、清除率(CL)、生物利用度(F)等。
这些参数可以通过药物代谢动力学的研究得到。
了解药物的动力学参数有助于个体化剂量的选择。
二、药物个体化剂量选择的原则1. 考虑患者的个体特征:药物的代谢和排泄过程与患者的个体特征密切相关。
例如,年龄、性别、体重和肝肾功能等因素会影响药物的代谢和排泄速度。
因此,在个体化剂量选择时,必须充分考虑患者的个体特征。
2. 达到治疗指标:个体化剂量的目标是使药物在患者体内维持在治疗指标范围内。
治疗指标可以是药物的最大疗效、最小毒性或最低有效浓度等。
通过调整剂量,可以让药物在患者体内始终维持在治疗指标范围内,提高治疗效果。
3. 避免药物不良反应:个体化剂量的选择还要考虑药物的不良反应。
有些患者对药物比较敏感,剂量过大可能引发严重的不良反应,而有些患者对药物的代谢能力较强,剂量过小又可能无法达到治疗效果。
因此,在选择个体化剂量时要权衡药物疗效和不良反应之间的平衡。
三、基于药物动力学的药物个体化剂量选择方法1. 药物浓度监测:药物浓度监测是个体化剂量选择的重要手段。
通过监测药物的浓度变化,可以了解药物在患者体内的代谢和排泄速度。
根据浓度监测结果,可以调整剂量,使药物在治疗指标范围内维持稳定。
2. 药物动力学模型:建立药物动力学模型是个体化剂量选择的一种常用方法。
通过测定患者的药物浓度,并结合药物动力学参数,建立个体化的药物动力学模型,可以预测患者在不同剂量下的药物浓度。
药代动力学参数汇编

药代动力学参数汇编药代动力学参数是研究药物在体内的吸收、分布、代谢和排泄等过程的关键指标。
本文档旨在汇编常见药代动力学参数的定义和计算方法,以便方便研究人员和临床医生的参考。
1. 药代动力学参数的定义1.1 最大浓度(Cmax)最大浓度是药物在体内达到的最高浓度,通常表示为Cmax。
它反映了药物的吸收速度和吸收程度。
1.2 时间最大浓度(Tmax)时间最大浓度是药物在体内达到最大浓度的时间点。
它反映了药物吸收的速度。
1.3 血药浓度-时间曲线(AUC)血药浓度-时间曲线是衡量药物在体内累积浓度随时间变化的曲线。
它通常用AUC来表示,包括AUC0-t和AUC0-inf。
1.4 生物利用度(F)生物利用度是指药物经口给药后进入循环系统并发生系统生物利用的程度。
常用的计算方法有相对生物利用度和绝对生物利用度。
2. 药代动力学参数的计算方法2.1 Cmax和Tmax的计算Cmax和Tmax可以通过药物在体内的测量数据进行计算,如血药浓度测定值。
Cmax是浓度的最高值,Tmax是对应的时间点。
2.2 AUC的计算AUC可以通过血药浓度-时间数据使用下列公式计算:AUC0-t = ∑(Ct * Dt), t=0 to t=tAUC0-inf = AUC0-t + (Ct * (t-inf)), t=t to inf其中Ct为任意时间点的血药浓度,Dt为采样间隔。
2.3 F的计算相对生物利用度可以通过口服给药和静脉给药后的AUC计算,公式如下:相对生物利用度(F)= (AUC口服 / AUC静脉) * 100%绝对生物利用度可以通过口服给药后的AUC计算,公式如下:绝对生物利用度(F)= (AUC口服 / AUC口服灌胃) * (灌胃给药量 / 给药量) * 100%结论本文档提供了药代动力学参数的定义和计算方法的汇编,希望对研究人员和临床医生在药物研究和临床实践中有所帮助。
请注意,在使用这些参数时,应考虑到特定的药物和个体差异。
药动学参数的几何均值比

药动学参数的几何均值比药物动力学参数(Pharmacokinetic Parameters)是评估药物在体内的吸收、分布、代谢和排泄过程的重要指标。
药物动力学参数中的几何均值比(geometric mean ratio)是用来评估两种不同治疗方案或不同人群之间药代动力学参数的差异性。
本文将介绍几何均值比的概念、计算方法以及临床意义。
一、几何均值比的概念几何均值比是用来比较两组数据的平均水平,通常用于药物动力学参数(如Cmax、AUC 等)的比较。
几何均值比表示两组数据的几何平均值之比,它比算术均值比更能反映两组数据的相对水平。
几何均值比的计算公式如下:几何均值比 = exp(平均对数差)exp代表自然对数的底,平均对数差是两组数据的对数平均值之差。
几何均值比通常用对数变换后进行比较,因为药代动力学参数往往呈现出正偏态分布,对数变换可以更好地满足正态性的假设。
二、几何均值比的计算方法1. 计算对数变换后的数据对两组数据进行对数变换,得到对数转换后的数据。
对数转换后的数据可以使用以下公式计算:log-transformed data = loge(原始数据) 2. 计算平均对数差使用对数转换后的数据计算两组数据的差值,并对差值取平均。
平均对数差= (Σlog-transformed data1 - Σlog-transformed data2) / n3. 计算几何均值比通过计算平均对数差的指数函数,得到几何均值比。
几何均值比 = exp(平均对数差)三、几何均值比的临床意义几何均值比通常用于比较不同药物制剂、不同剂量或不同人群之间的药代动力学参数。
当两组数据的几何均值比为1时,表示两组数据没有差异;当几何均值比大于1时,表示第一组数据比第二组数据更大;当几何均值比小于1时,表示第一组数据比第二组数据更小。
在临床研究中,几何均值比的值可以帮助医生和研究人员判断不同药物治疗方案或不同人群之间的药代动力学差异,从而指导合理用药和制定个性化治疗方案。
药动学参数的几何均值比

药动学参数的几何均值比一、药动学参数概述药动学(Pharmacokinetics,PK)是研究药物在生物体内吸收、分布、代谢和排泄等过程的科学。
在药物研发和临床应用中,药动学参数是评估药物疗效和安全性的重要依据。
常见的药动学参数包括生物利用度(F)、表观分布容积(Vd)、清除率(Cl)和半衰期(t1/2)等。
二、几何均值比的概念与计算方法几何均值比(Geometric Mean Ratio,GMR)是一种用来比较两个药物浓度或剂量之间关系的药动学参数。
它反映了药物在生物体内的浓度或剂量变化程度,可以用于评估药物的相对生物利用度、药物间相互作用以及药物制剂的稳定性等。
GMR的计算公式为:GMR = √(C1/C2) × (D1/D2)其中,C1和C2分别为药物在生物体内的浓度(或剂量)之比,D1和D2分别为药物的给药剂量之比。
三、几何均值比的应用与意义1.评估药物的相对生物利用度:通过比较受试药物与参比药物的几何均值比,可以评估药物在体内的浓度变化程度,从而判断药物的生物利用度。
2.药物相互作用研究:药物在体内代谢过程中,可能发生相互作用,影响药物浓度和疗效。
通过计算几何均值比,可以评估药物间的相互作用程度。
3.药物制剂稳定性评估:药物在储存、运输等过程中,可能发生降解、聚合等现象,影响药物的剂量和疗效。
几何均值比可用于评估药物制剂的稳定性。
四、实例分析以某两款抗高血压药物为例,分别计算它们的几何均值比。
假设药物A和药物B在体内的浓度变化曲线如下:药物A:C1 = 10μg/ml,C2 = 5μg/ml药物B:D1 = 50mg,D2 = 25mg则,几何均值比GMR = √(10/5) × (50/25) = 2.23根据计算结果,药物A的几何均值比大于1,说明其在体内的浓度变化程度较高,生物利用度较高;而药物B的几何均值比接近1,表明其生物利用度相对较低。
五、总结与展望几何均值比作为一种药动学参数,在药物研发、临床应用和药物相互作用研究中具有重要意义。
主管药师专业知识讲义-药理学——第三节 药动学
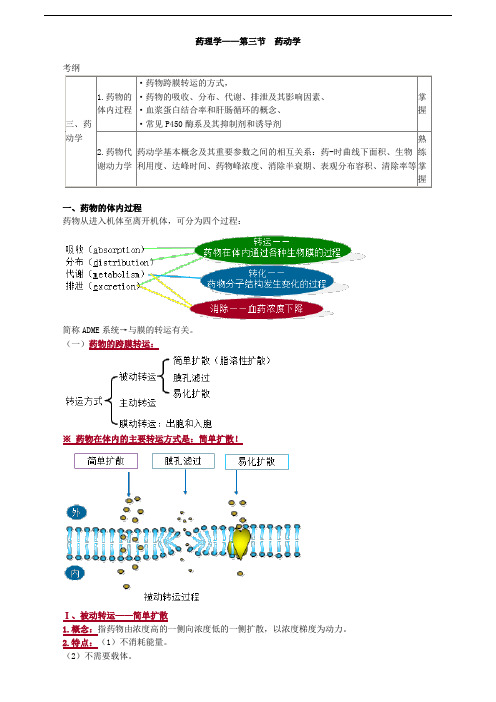
药理学——第三节药动学考纲一、药物的体内过程药物从进入机体至离开机体,可分为四个过程:简称ADME系统→与膜的转运有关。
(一)药物的跨膜转运:※药物在体内的主要转运方式是:简单扩散!Ⅰ、被动转运——简单扩散(3)转运时无饱和现象。
(4)不同药物同时转运时无竞争性抑制现象。
(5)当膜两侧浓度达到平衡时转运即停止。
3.影响简单扩散的药物理化性质(影响跨膜转运的因素)(1)分子量分子量小的药物易扩散。
(2)溶解性脂溶性大,极性小的物质易扩散。
(3)解离性非离子型药物可以自由穿透。
离子障是指离子型药物被限制在膜的一侧的现象。
※药物的解离程度受体液pH值的影响离子型非离子型4.体液pH值对弱酸或弱碱药物的解离的影响:※pK a(解离常数)的含义:>>是指解离和不解离的药物相等时,即药物解离一半时,溶液的pH值。
>>每一种药物都有自己的pK a。
若为弱酸性药物,则:若为弱碱性药物,则:从公式可见,体液pH算数级的变化,会导致解离与不解离药物浓度差的指数级的变化,所以,pH值微小的变动将显著影响药物的解离和转运。
一个pK a=8.4的弱酸性药物在血浆中的解离度为A.10%B.40%C.50%D.60%E.90%『正确答案』A『正确解析』pH对弱酸性药物解离影响的公式为:即:解离度为107.4-8.4=10-1=0.1。
※四两拨千斤:体液pH值对药物解离度的影响规律:◇酸性药物——在酸性环境中解离少,容易跨膜转运。
达到扩散平衡时,主要分布在碱侧。
◇碱性药物——在碱性环境中解离少,容易跨膜转运。
达到扩散平衡时,主要分布在酸侧。
同性相斥、异性相吸或“酸酸碱碱促吸收;酸碱碱酸促排泄”A.碱性尿液>血液>胃液B.胃液>血液>碱性尿液C.血液>胃液>碱性尿液D.碱性尿液>胃液>血液E.血液>碱性尿液>胃液『正确答案』A『正确解析』同性相斥、异性相吸。
在碱性尿液中弱碱性药物A.解离多,重吸收少,排泄快B.解离少,重吸收多,排泄快C.解离多,重吸收多,排泄快D.解离少,重吸收多,排泄慢E.解离多,重吸收少,排泄慢『正确答案』D『正确解析』酸酸碱碱促吸收;酸碱碱酸促排泄。
药物动力学重要参数

药物动力学重要参数
1.吸收速率常数(ka):药物从吸收部位进入人体循环的速度,即
吸收速度与体内药量之间的比例常数。
用来衡量药物吸收速度的快慢。
2.消除速率常数(K):药物在体内代谢、排泄的速度与体内药量
之间的比例常数。
K值的大小可用来衡量药物从体内消除速度的快慢。
3.吸收分数(F):药物进入体循环的量与所给剂量的比值。
血管
内给药F=1,表示药物全部进入体循环;其他给药途径F<1,用来衡量
血管外给药时进入体循环药物的相对数量,又称生物利用度:
4.表观分布容积):体内药量按血浆中同样浓度分布时所需体液
的总体积。
可用其来表示药物在体内分布的广泛性。
5.生物半衰期(t1/2):药物在体内消除一半所需要的时间。
与K
之间的关系为t1/2=0.693/K.用于衡量药物消除速度的快慢。
药物动力学常见参数及计算方法

中央室周边室
08:58:25×τ)
ss,av AUC (C ss,av 之下)
给药间隔时间(AUC ss
AUC (单剂量)AUC (1,t)
小时浓度Css,max Css,min
给药量与消除量相等时药时曲线在同一级水平上作周期性的重复变化,此时的平均药浓称为C
ss。
谷值(C
min )应高于有
才能产生安全可靠的持续药效。
设计多剂量给药方案中具有重要意义,因其决
定长期用药时药效的高低及毒副作用的大小。
29
坪浓度(Css)的高低与日用药总量成正比波动幅度与每日用药量成正比
用药量恒定时,坪浓度的高低限之间的波增加给药剂量不能缩短达到稳态时间,也不能按比例延长药物的消除时间
趋坪时间需要4-5个半衰期,达稳态后给
30
31202530
重复维持量Therapeutic
level
间隔给药,首剂加倍可使血药浓度立刻达到C ss T (h)
♦给药间隔♦
给药间隔Css,max
23.1
20.3
18.9
17.4
谢谢大家!
08:58:2547。
药物动力学参数

掌握药动学基本概念及其重要参数之间的相互关系:药-时曲线下面积、生物利用度、药峰时间、药峰浓度、消除半衰期、表观分布容积、清除率等。
一、一次性血管外给药三个时期1、潜伏期(短:吸收快)------有效期------残留期(长:蓄积中毒)2、时量关系:血药浓度随时间的变化过程。
3、房室概念与房室模型1)、一室模型:假定身体由一个房室组成,给药后药物立即均匀地分别于整个房室,并以一定的速率从该室消除。
单次静注给药时,时量(对数浓度)曲线呈单指数消除。
2)、二室模型:假定身体由两个房室组成,即中央室(血流丰富的器官如心、肝、肾)和周边室(血流量少的器官如骨、脂肪)。
给药后药物立即分布到中央室,然后缓慢分布到周边室。
单次静注给药时,时量(对数浓度)曲线呈双指数衰减即分为分布相和消除相。
二、药动学重要参数1、消除半衰期及意义:血药浓度下降一半所需的时间。
是决定给药间隔时间的重要参数之一。
2、生物利用度:药物吸收速度与程度的一种量度。
可药时曲线下面积AUC 计算,F=口服AUC/注射AUC 。
3、表观分布容积Vd :是指血药浓度与体内药物量间的一个比值,Vd=A/C=体内药量/血药浓度。
可反映药物分布的广泛程度或药物与组织结合的程度。
4、药-时曲线下面积AUC 代表一次用药后的吸收总量,反映药物的吸收程度。
三、药物消除动力学1.一级消除动力学(恒比消除):多数药消除半衰期恒定,与血药浓度无关。
血浆清除率(Cl):即单位时间内多少容积血浆中的药物被消除干净(单位用L&#8226;h-1 )。
消除速率:单位时间内被机体消除的药量。
常用表观分布容积(Vd)计算。
Vd及Cl的区别:①是两个独立的药动学指标,各有其固定的数值,互不影响,也不因剂量大小而改变其数值。
②Vd是表观数值,不是实际的体液间隔大小。
多数药的Vd值均大于血浆容积。
③Cl不是药物的实际排泄量。
Cl是肝肾等消除能力的总和。
④与组织亲和力大的脂溶xing药物其Vd可能比实际体重的容积还大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药-时曲线
吸收=消除
吸收<消除
吸收>消除潜伏期 持Fra bibliotek期残留期
半衰期(t1/2)
✓概念:C血浆→1/2 C血浆所需时间 ✓零级动力学消除(恒量消除)时, t1/2随给药剂量增大
而延长
✓ 一级动力学消除(恒量消除)时,t1/2不变 ✓ 一次给药:药物从体内基本消除约需4~6个t1/2
零级动力学消除的药物,消除率可变
小结
t1/2 F Vd CL
✓ 表示方法:Tmax和AUC
AUC Tmax
生物利用度(F)
✓ 分类
➢F绝对=
AUC血管外给药 AUC静脉给药
*100%
➢ F相对 =
AUC受试制剂 AUC标准制剂
*100%
评价生物等效性
表观分布容积(Vd)
清除率(CL)
✓ 概念:机体消除器官在单位时间内消除药物的血浆容积 。
✓ 体内所有消除器官消除药物的总和 ✓ 一级动力学消除的药物,消除率不变;
半衰期(t1/2)
✓ 多次给药 稳态血药浓度(Css/坪值) ➢ Css是一个范围,不是一个具体值 ➢ 约需4~6个t1/2达到 ➢ 不随给药时间间隔而改变
半衰期(t1/2)
✓ 多次给药 ➢ 首剂加倍(增加负荷量)可缩短达到Css的时间 ➢ 负荷量应视药物及患者具体情况而定
生物利用度(F)
✓ 概念:药物经血管外给药后,吸收进入血液循环的速度 和程度。
