百合组织培养实验报告
百合组培实验报告

竭诚为您提供优质文档/双击可除百合组培实验报告篇一:植物组织培养实验报告实验一植物组织培养实验报告一实验目的让植物组织经过脱分化作用,形成愈伤组织,经过再分化作用,愈伤组织又能重新分化为有结构的组织和器官,最终形成完整的植株。
二实验原理植物组织培养是把植物的器官,组织以至单个细胞,应用无菌操作使其在人工条件下,能够继续生长,甚至分化发育成一完整植株的过程。
植物的组织在培养条件下,原来已经分化停止生长的细胞,又能重新分裂,形成没有组织结构的细胞团,即愈伤组织。
这一过程称为“脱分化作用”,已经“脱分化”的愈伤组织,在一定条件下,又能重新分化形成输导系统以及根和芽等组织和器官,这一过程称“再分化作用”。
植物激素在此过程中起着重要的作用,吲哚乙酸(IAA)和6–苄基氨基腺嘌呤(6–bA)的比例,决定了根和芽的分化。
三实验器材(一)试剂乙醇、IAA或2,4–D、hgcl2(或次氯酸钠)、6-苄基氨基腺嘌呤(6-bA)ms培养基(二)仪器设备培养室,高压灭菌锅,水浴锅,解剖刀,三角烧瓶(100mL),烧杯,量筒,培养皿,超净工作台,分析天平,长镊子,剪刀,橡皮筋等三实验步骤1.配制培养基(1)愈伤组织诱导培养基:ms培养基(蔗糖含量为10g/L,2,4–D含量为2mg/L,琼脂10g/L)。
(2)试验培养基:在ms培养基中按表33–1加入IAA和6–bA。
吲哚乙酸先用少量0.1mol/Lnaoh溶解,6-苄基氨基腺嘌呤先用少量0.1mol/Lhcl溶解,然后用蒸馏水稀释,再加入培养基中。
2.培养基灭菌将配好的培养基加入琼脂加热溶解,调至ph5.8,趁热分装于100mL三角烧瓶中,每瓶约20mL。
待培养基冷却凝固后,用两层称量纸包扎瓶口,并用橡皮筋扎牢,然后在高压灭菌锅中121℃(1kg/cm2)下灭菌20min。
取出三角烧瓶放在台子上,冷却后备用。
接种操作所需的一切用具(如长镊子、解剖刀、剪刀等)及灭菌水,需同时灭菌。
百合的栽培技术实训报告

一、实训目的本次实训旨在通过实地操作和理论学习,掌握百合的栽培技术,了解百合的生长习性、繁殖方法、病虫害防治等知识,提高对百合种植的实践操作能力,为今后从事百合种植及相关工作打下坚实基础。
二、实训时间与地点实训时间:2023年10月15日至2023年11月15日实训地点:XX农业科技示范园百合种植基地三、实训内容1. 百合的生物学特性百合属百合科百合属植物,多年生草本球根植物,原产于亚洲东部温暖地带,我国是百合的原产地之一。
百合具有以下生物学特性:(1)生长习性:百合喜温暖、湿润、半阴环境,不耐寒、不耐旱,对土壤要求不严,以疏松、肥沃、排水良好的砂壤土为宜。
(2)繁殖方式:百合的繁殖方式主要有分球繁殖、鳞片扦插和播种繁殖。
2. 百合的繁殖方法(1)分球繁殖:在每年的秋季,将百合母株从土壤中挖出,把着生在母株上的小鳞茎掰下来,将鳞茎放在阴凉通风处。
等鳞茎上的伤口风干后重新种下,适当深栽15-20cm,等到第二年春天追施肥水,慢慢将小鳞茎养大养开花即可。
(2)鳞片扦插:在每年的秋季,将成熟的百合大鳞茎挖出,用手剥掉百合健壮的鳞片,将其放在阴凉通风处晾干,然后把鳞片扦插在潮湿的基质中。
保持温度在20左右,等鳞片生出小鳞片并且生根后,就可以将其移栽定植到土壤中了。
(3)播种繁殖:百合播种繁殖适用于容易着生珠芽的品种,如卷丹百合。
在植株的叶腋处着生珠芽,等这些珠芽长大后,我们可以摇晃植株茎秆,将叶腋处的珠芽摇下来。
或者用手把珠芽取下来,直接放在土壤表面,甚至都不用覆土。
3. 百合的栽培技术(1)选地整地:百合喜温暖、湿润的环境,种植地宜选择疏松、肥沃、湿润、日照不强的山间缓坡地域。
土地经多次翻耕打碎,深度为15cm—20cm左右,每亩施牛羊粪作基肥,牛羊粪必须至少发酵一个月,量根据土壤肥沃度定,起畦高20厘米、宽100~120厘米。
(2)种植时间:百合的种植时间一般在农历9月中旬至春节共计4个月左右。
(3)种植密度:百合的种植密度应根据品种和土壤肥力而定,一般行距为25cm左右,株距为15cm左右。
百合繁殖技术实训报告总结

一、实训背景百合作为一种世界著名的观赏花卉,其花朵色彩鲜艳,形态优美,深受人们的喜爱。
百合繁殖技术的研究对于提高百合的产量和品质具有重要意义。
本实训旨在通过实践操作,掌握百合繁殖技术,为我国百合产业发展提供技术支持。
二、实训目的1. 熟悉百合繁殖的基本原理和方法;2. 掌握百合组织培养、分株繁殖、扦插繁殖等繁殖技术;3. 提高百合繁殖的成活率和产量;4. 为百合产业发展提供技术支持。
三、实训内容1. 百合组织培养(1)材料准备:选取百合鳞茎、叶片、茎段等部位作为外植体,消毒处理后备用。
(2)培养基配制:采用MS培养基,添加不同激素比例进行实验。
(3)接种与培养:将外植体接种于培养基中,在适宜的条件下进行培养。
(4)结果观察:观察百合组织培养的成活率、生根情况、芽分化等指标。
2. 百合分株繁殖(1)材料准备:选取生长健壮的百合植株,消毒处理后备用。
(2)分株操作:将百合植株从土壤中挖出,按照一定的比例进行分株。
(3)栽植与管理:将分株后的百合栽植于花盆或大田中,进行浇水、施肥、病虫害防治等管理。
(4)结果观察:观察百合分株繁殖的成活率、生长状况等指标。
3. 百合扦插繁殖(1)材料准备:选取百合茎段、叶片等部位作为扦插材料,消毒处理后备用。
(2)扦插操作:将扦插材料插入沙床或珍珠岩中,保持适宜的温度、湿度。
(3)栽植与管理:将扦插生根后的百合栽植于花盆或大田中,进行浇水、施肥、病虫害防治等管理。
(4)结果观察:观察百合扦插繁殖的成活率、生长状况等指标。
四、实训结果与分析1. 百合组织培养通过实验,我们发现MS培养基添加0.5mg/L NAA和0.1mg/L 6-BA的激素组合,对百合组织培养效果较好。
在该条件下,百合外植体成活率达到90%,生根率达到70%,芽分化率达到60%。
2. 百合分株繁殖经过实践操作,百合分株繁殖的成活率达到了85%。
在适宜的管理条件下,分株后的百合生长状况良好,产量较高。
3. 百合扦插繁殖实验结果表明,百合扦插繁殖的成活率为80%,生根率达到60%。
兰州百合的组织培养

试验步骤
1.培养基的设计(初代培养15个,继代培养6 个,生根培养6个) 2.培养基的配制 3.材料的消毒 4.接种 5.生长及观察
材料的消毒
鳞茎由外向内剥取鳞片,用清水冲洗干净, 于无菌操作台上进行消毒。方法如下,将鳞 片放入无菌烧杯中,用75%的酒精消毒30s, 无菌水冲洗2次,再用2%次氯酸钠溶液消毒 10min,用无菌水冲洗4-5次,最后用无菌滤 纸吸干水分。
试验意义
一、兰州百合的研究离不开组织培养(包括 百合的脱毒,快速繁殖,育种等); 二、兰州百合营养丰富,兰州对百合的生长 比较适宜,因此具有广泛的市场潜力。
试验方法及步骤
通过单因素的设计分别筛选出在各个阶段的 最佳培养基配方; 取材——材料消毒—制备培养基—— 接种——初代培养——继代培养——增殖— —生根——炼苗——移栽
结论
1、百合的鳞茎内部比外部鳞片分化能力强 2、通过反复试验得出2%的次氯酸钠的消毒 时间为10min 3、褐变用VC 200mg/l+pvp100mg/l
试验结果
初代培养培养基:MS+6-BA+NAA 继NAA
植物组织培养综合实验报告

生物工程中游技术综合实验百合花的组织培养——探究并比较不同部位诱导愈伤组织的生长情况学院:生命科学学院班级:生物工程101班摘要:实验选取百合花的子房、花柱、花药、花丝和花茎为外植体, ;利用植物组织培养技术,探究百合花不同部位诱导愈伤组织的生长情况,并比较不同的植物生长素对百合花愈伤组织诱导分化影响的差异。
关键词:百合组织培养生长素愈伤组织1 前言百合(L ilium tenuim folium Fisch)为百合科百合属多年生球根花卉。
我国约有47 种,占世界种数的51% ,其中的36个种、15个变种是我国特有的珍稀种类。
由于其花形独特、芳香宜人而深受人们的喜爱,成为近年来国内外市场热销的花卉种类之一。
百合是通过杂交育种选育出来的,种子高度败育,传统的分球、扦插等繁育方式易使百合病毒积累、种性退化。
目前,国内为了降低生产成本,实现种球的自主繁育,进行组织培养与快速繁殖已十分必要。
最早关于百合组培的文章是Robb于1957年发表的,到现在关于百合组织培养的方法已有40多种 ,百合的许多组织和器官都可作为外植体,例如鳞片、根尖、叶片、子房、花柱、花托、花丝等。
本实验选取百合花的子房、花柱、花药、花丝和花茎为外植体, 利用植物组织培养技术,探究百合花不同部位诱导愈伤组织的生长情况,并比较不同的植物生长素对百合花愈伤组织诱导分化影响的差异。
2 材料和方法2.1 材料2.11 外植体百合花的子房、花柱、花药、花丝和花茎2.1.2 培养基配方一:MS+6-BA3+NAA0.05+3%蔗糖+8g琼脂(1L,pH=5.8)配方二:MS+6-BA1.5+NAA0.05+3%蔗糖+8g琼脂(1L,pH=5.8)2.1.3 试剂蔗糖、琼脂、培养基母液(大量元素、微量元素、铁盐、有机附加物)2.1.4 仪器设备高压灭菌锅、分析天平、果酱瓶、烧杯、量筒、培养皿、灭菌的滤纸、称量纸、玻璃棒、电炉、石棉网、移液瓶,剪刀,镊子,解剖刀、酒精灯、记号笔、标签纸、药匙等。
百合初代培养实训报告

一、实训目的本次实训旨在通过学习百合初代培养的方法和技巧,掌握百合组织培养的基本原理和操作流程,提高对植物组织培养技术的理解和应用能力。
同时,通过对百合初代培养过程中的各个环节进行实践操作,培养自己的动手能力和团队协作精神。
二、实训内容1. 百合组织培养概述百合(Lilium)是百合科百合属多年生草本植物,具有较高的观赏价值。
百合组织培养技术是一种无性繁殖方法,通过将百合的外植体接种到培养基上,使其在无菌条件下生长、分化,最终形成完整的植株。
2. 百合初代培养方法(1)外植体选取选取百合鳞茎或叶片作为外植体。
鳞茎选取饱满、无病虫害的健康鳞茎;叶片选取叶尖或叶缘部位。
(2)外植体消毒将外植体放入70%酒精中浸泡30秒,然后用无菌水冲洗3-5次。
将消毒后的外植体放入0.1%的氯化汞溶液中浸泡5-10分钟,再用无菌水冲洗3-5次。
(3)接种将消毒后的外植体接种到含有不同植物激素的培养基上。
培养基成分:MS培养基+6-BA 0.5mg/L+NAA 0.1mg/L。
(4)培养条件将接种后的培养基放入培养箱中,温度设置为25℃±2℃,光照强度为1000勒克斯,每天光照12-14小时,空气相对湿度保持在70%-80%。
3. 百合初代培养过程(1)愈伤组织诱导接种后3-5天内,外植体开始生长,形成愈伤组织。
愈伤组织呈白色、质地松软。
(2)芽分化愈伤组织培养7-10天后,开始分化出芽。
芽分化过程中,可适当调整培养基中植物激素的比例,以促进芽的分化。
(3)生根芽分化后,将芽转移到含有NAA 0.1mg/L的培养基上,促进生根。
生根过程中,芽可逐渐转移到生根培养基中。
(4)移栽当百合植株长到2-3片叶时,可将其移栽到营养土中。
三、实训结果与分析1. 百合初代培养结果通过本次实训,成功诱导出百合愈伤组织,并分化出芽和根,最终形成完整的植株。
2. 实训结果分析(1)外植体选取对百合初代培养效果有较大影响。
鳞茎外植体诱导愈伤组织的效果优于叶片外植体。
百合组织培养快速繁殖

百合组织培养快速繁殖组织培养是进行植物快速繁殖的常规手段,通过组织培养可以快速获得无病毒植株,对繁殖珍贵花卉品种是简易而有效的方法。
本研究通过组培快繁再生体系的建立、试管鳞茎的增、大再分化及移栽后的生理检测对东方百合“西伯利亚”、“索邦”和铁炮百合“白天堂”的快速繁殖进行了系统的研究。
以鳞片和试管苗叶片为外植体,通过直接诱导不定芽再生的方式,对启动培养、增殖培养、生根移栽等组织培养快速繁殖各个环节的影响因素进行了分析。
研究结果表明:1、MS基本培养基中附加适宜浓度配比的NAA与6-BA可诱导不定芽再生,再生频率在80%以上。
2、试管苗叶片下部分化能力较强,是建立高频快速增殖体系的首选材料:“西伯利亚”和“白天堂”再生芽的能力要强于“索邦”;用NAA或IBA与KT组合诱导不定芽增殖效果较好,再生频率在86%以上,适宜“白天堂”“西伯利亚”“索邦”试管苗增殖的激素配比分别为NAA 0.2mg/L+KT 0.4mg/L、NAA 0.1mg/L+KT0.2mg/L、IBA 0.1mg/L+KT 0.2mg/L。
3、百合试管苗具有较强的生根能力,在继代增殖的同时就可达到生根的目的。
4、以珍珠岩:土(3:1)为移栽基质,选取鳞茎直径≥1cm的试管苗移栽,成活率在95%以上。
培养基添加物对百合快繁体系影响的研究结果表明:培养基中添加30g/L蔗糖和3mg/L多效唑分别为促进“索邦”和“西伯利亚”生长的最佳培养基。
在添加60g/L蔗糖和3mg/L多效唑的培养基中“白天堂”试管鳞茎的增大及再分化效果最佳。
在上述最佳培养基中,各供试品种出瓶直径均在1cm以上,东方百合增殖系数可达8以上。
活性炭可以提高试管苗的质量,浓度在4~10g/L时,“白天堂”、“索邦”及“西伯利亚”试管鳞茎生长情况较好。
将移栽成活的健壮试管苗移栽入土后进行多效唑叶面喷施,研究结果表明:以500mg/L多效唑处理5周,百合叶片的气体交换特性得到明显改善、叶绿素、可溶性糖、可溶性蛋白含量均有所提高,组织含水量减少,对试管苗移栽入土后的生长发育起到了显著的促进作用。
百合的组织培养

百合的组织培养一、百合叶片的组织培养(一)外植体百合鳞茎。
(二)灭菌方法取百合花茎于洗涤灵液中浸泡20min, 自来水冲洗20 min, 离花茎叶片基部上下各0.2cm 左右, 剪取0.5cm 带叶片茎段。
自叶片基部留叶片长1.5~ 2.0cm, 剪去以上大部叶片, 于0.1% 农用链霉素水溶液中浸泡1h, 自来水冲洗20 min; 无菌条件下, 75% 酒精处理2~ 3s; 0.1% 升汞溶液处理3~ 4 min, 无菌水洗5~ 6 遍, 备用接种。
(三)发育途径将叶片茎段接种于诱导分化培养基, 待诱导出芽后将芽接种于增殖培养基, 最后增殖芽进行生根诱导。
(四) 培养基以MS 和LS 为基础培养基, 细胞分裂素采用BA, 生长素采用NAA, 以二者不同浓度和比例制成诱导分化培养基和芽增殖培养基, 探求基础培养基MS 和LS 及不同浓度激素及其配比对新普百合诱导分化和不定芽增殖的效果。
生根培养基采用LS, 培养基中添加不同浓度生长素、活性炭, 研究生长素浓度及活性炭对生根苗的影响。
培养基均添加琼脂7g / L。
在103kPa、121℃条件下灭菌15min。
(五)培养条件培养室温度( 25±1℃) , 相对湿度60%~ 70% , 光强1800~ 2500lx , 光照每天12h。
(六)讨论愈伤组织的诱导及不定芽的分化设计8 种起始诱导培养基, 每种培养基接种50 片叶。
接种后, 在适宜培养基上, 15 天左右可见叶片基部膨大隆起, 继而生出黄绿色愈伤组织,20 天左右可长至0.5cm3 , 并生出绿色芽点后分化出芽, 50 天左右可长至2~ 3cm。
统计愈伤组织及不定芽诱导状况。
结果表明, 经50 天的培养后, 单一使用细胞10分裂素的处理效果不佳, 愈伤组织诱导率、不定芽分化率均较低。
因此在新普百合的诱导培养中需细胞分裂素( BA) 和生长素( NAA) 配合使用。
当BA 浓度较高时, 有利于愈伤组织的形成, 不利于不定芽的分化。
百合花栽培技术实训报告

一、实训目的通过本次百合花栽培技术实训,了解百合花的生长习性、繁殖方法、栽培技术以及病虫害防治等方面的知识,掌握百合花的栽培技巧,提高自身实践操作能力。
二、实训时间2022年X月X日至2022年X月X日三、实训地点XXX农业科技示范园四、实训内容1. 百合花的生长习性百合花原产于亚洲东部,喜光照、温暖湿润气候,耐寒性强。
对土壤要求较高,适宜生长在深厚、肥沃、排水良好的沙质壤土。
2. 百合花的繁殖方法百合花的繁殖方法主要有播种繁殖、鳞茎繁殖、分株繁殖等。
(1)播种繁殖:选择成熟、饱满的百合种子,在春季播种,经过40-60天即可发芽。
(2)鳞茎繁殖:选择健康、无病虫害的百合鳞茎,进行分切繁殖,每个鳞茎可繁殖出多个新鳞茎。
(3)分株繁殖:选择生长旺盛的百合植株,将植株分切,每株带2-3个芽,进行繁殖。
3. 百合花的栽培技术(1)土壤准备:选择深厚、肥沃、排水良好的沙质壤土,深翻30厘米,施足底肥,做成高畦。
(2)栽植时间:春季3-4月,秋季9-10月。
(3)栽植方法:按株行距10-15厘米×20厘米进行栽植,栽植深度为鳞茎高度的1/3。
(4)浇水:栽植后浇透水,生长期间保持土壤湿润,避免积水。
(5)施肥:生长前期施以氮肥,促进植株生长;生长后期施以磷、钾肥,促进花蕾形成。
(6)病虫害防治:注意观察植株生长状况,发现病虫害及时防治。
4. 百合花的采收与保鲜(1)采收:百合花盛开时,选择晴天进行采收,剪下花茎,保留10-15厘米。
(2)保鲜:将剪下的百合花放入清水中,加入适量保鲜剂,放入保鲜袋中,置于阴凉处,可保鲜3-5天。
五、实训过程1. 实训前期:了解百合花的生长习性、繁殖方法、栽培技术以及病虫害防治等方面的知识。
2. 实训中期:在农业科技示范园进行实际操作,包括土壤准备、栽植、浇水、施肥、病虫害防治等。
3. 实训后期:对百合花进行采收与保鲜,观察植株生长状况,记录生长数据。
六、实训成果1. 掌握了百合花的生长习性、繁殖方法、栽培技术以及病虫害防治等方面的知识。
最新百合组培实验报告

最新百合组培实验报告实验目的:本次实验旨在探究百合组织培养的最佳条件,以实现高效繁殖和遗传改良。
通过对比不同培养基、激素浓度和培养环境对百合组织生长的影响,确定最适合的培养参数。
实验材料:1. 百合种球2. MS培养基3. 植物生长调节剂(生长素和细胞分裂素)4. 无菌水5. 培养皿和培养箱6. 75%酒精和0.1%硝酸银用于消毒7. 称重天平和移液器实验方法:1. 种球消毒:选取健康无病虫害的百合种球,用75%酒精浸泡10分钟,再用0.1%硝酸银溶液消毒5分钟,最后用无菌水冲洗3次。
2. 组织切割:在无菌条件下,将种球切成约1平方厘米的小块。
3. 培养基制备:按照MS培养基配方,添加不同浓度的生长素和细胞分裂素,制备出一系列实验组。
4. 接种:将处理好的百合组织块接种到培养基上,每个培养基接种3块组织。
5. 培养条件:将接种好的培养皿放入培养箱中,设定温度为25°C,光照周期为16小时光照/8小时黑暗。
6. 数据记录:每天观察记录组织生长情况,包括生长速度、形态变化和任何异常情况。
实验结果:经过两周的培养,发现在添加了适量生长素和细胞分裂素的MS培养基上的百合组织生长最为良好。
其中,生长素浓度为0.5mg/L,细胞分裂素浓度为1.0mg/L的培养基上,百合组织的增殖率最高,且无明显变异现象。
结论:本实验确定了百合组织培养的最佳激素浓度,为百合的快速繁殖和遗传改良提供了科学依据。
未来工作将进一步探索其他影响因素,如培养环境的湿度、光照强度等,以优化培养条件,提高百合组织培养的成功率。
组培实验室百合组培扩繁的实习内容

组培实验室百合组培扩繁的实习内容百合属一年生草本植物,有长达25年的观赏期。
因其花开洁白如雪,故名百合。
百合为百合科植物鲜切花的干燥根和鳞茎部分,鲜切花含有花青素、原花青素等营养成分,具有很好的观赏价值、药用价值和科研价值。
百合可作药用;百合干燥根具有润肺止咳作用;百合鳞茎还可作饲料添加剂。
百合干和百合干根可以食用,鲜切花可作为鲜花出售,干燥鳞茎可作为观赏花材。
一、百合组培扩繁的目的及基本步骤从百合无菌小苗中收集具有2个以上子代的根茎叶进行培植,培养基要求以有机质、钙镁磷等无机盐为营养成分,以适宜的温度和光照为条件,培养后置于营养钵中进行增殖培养。
在培养基 pH值为6.5~7.0及一定水流量下,培养7~10天后,子代根茎叶长到1 cm左右时,选择叶片上有少许绒毛、叶片肥厚、根系完整时剪去老叶片,保留嫩茎,剪后放在培养基中进行催芽。
待萌发出幼苗后移入大盆栽培。
百合无根小苗生长迅速,为防止植株失水造成死亡,要及时采取控水措施。
由于百合根系较浅,为了避免植株倒伏、减少植株伤口感染病毒等疾病和真菌感染,要及时清理组培材料中被感染的根部并清洗干净。
在实验室进行百合小苗组培前,应先进行消毒处理,在一定条件下用50-60 mg/L波尔多液浸泡20分钟以上进行消毒。
二、百合组培扩繁过程中各步骤的操作要点1.种子处理:用1%~2%高锰酸钾溶液浸泡种子10~20分钟后捞出沥干后晾干待用。
2.扦插:用0.1%~0.3%次氯酸钠溶液扦插,时间为3~4天。
3.去杂和消毒:用1%次氯酸钠溶液先将根茎冲洗干净后置于20℃左右的条件下烘2~3小时。
4.子叶接种:使用0.1%~0.3%过氧乙酸溶液浸种3~4小时后从叶尖中抽出。
5.扩繁:可使用无性繁殖(也可扦插繁殖)或扦插繁殖(利用无性遗传繁殖原理培养基中带有致病基因)均可用无菌操作方法。
6.定芽:选取健壮无病虫害、健壮子叶上长有顶芽、有2~3片叶、3~4片叶且无病虫害的枝条用于定芽、扦插。
亚洲百合组织培养快繁研究

亚洲百合组织培养快繁研究本试验选用新中心、布鲁诺两个亚洲百合品种的鳞片,新中心的鳞茎内叶片为外植体进行培养,分别在无性培养系建立,胚性愈伤组织的增殖和分化,不定芽的增殖,生根结鳞茎和移栽五个阶段进行了研究,得出以下结果:1.无性培养系建立用新中心和布鲁诺的鳞片作为外植体接种到各种培养基中进行培养,对其污染率、诱导分化率等进行比较。
试验结果表明,新中心随着6-BA和NAA浓度的提高,诱导率也有所提高,在所试验的培养基中,MS+6-BA3.0(单位:mg/L,下同)+NAA0.1培养基最适合新中心鳞片的分化,分化率为82.4%;而布鲁诺则随着6-BA和NAA浓度的提高,其诱导率随之下降,在MS+6-BA1.0+NAA0.2配比的培养基上分化率最高,可达84.6%。
用新中心鳞茎内叶片作为外植体建立无性培养系,试验结果表明,叶片的分化时间短,分化率和分化系数高。
在所试的培养基中,MS+6-BA2.0+NAA0.2培养基的分化效果比较好。
无菌苗叶片基部诱导不定芽的试验表明,新中心的较适合培养基为MS+6-BA2.0+NAA0.1,布鲁诺为MS+6-BA2.0+NAA0.2。
2.胚性愈伤组织增殖及分化在鳞茎胚性愈伤组织增殖及分化的试验中,6-BA浓度为2.0~2.5mg/L时较适合愈伤组织的增殖和分化,新中心的较适培养基为MS+6-BA2.5+NAA0.2,布鲁诺为MS+6-BA2.0+NAA0.1。
3.不定芽增殖在不定芽增殖培养中,6-BA配合低浓度(0.1~0.2mg/L)的NAA 对两种百合不定芽增殖有促进作用,其中新中心的增殖系数较高,以MS+6-BA3.0+NAA0.2的配比较佳,增殖系数为9.6;而布鲁诺的增殖系数较低,以MS+6-BA2.0+NAA0.2的配比较佳,增殖系数为2.7。
4.生根结鳞茎在生根结鳞茎培养中,糖浓度和大量元素浓度对百合生根结鳞茎都有影响。
糖有助于两种百合生根结鳞茎,较适浓度均为60g/L。
百合组织培养实验报告

百合组织培养实验报告一、实验原理植物细胞全能性理论是植物组织培养的核心理论。
立体细胞具有生命的特征属性,在全能性的基础上,提供合适的营养和环境条件,立体细胞经历脱分化(dedifferentiation)和再分化(redifferentiation)过程,可形成再生植物。
二、实验用品实验材料:百合种球实验仪器:高压消毒锅、超净工作台、镊子、剪刀、手术刀柄、手术刀片、酒精灯、定时器、人工气候箱、分析天平、酸度计、电炉、蒸馏水机、培养皿、烧杯、量筒、移液管、吸球、药匙、玻璃棒、锥形瓶、称量纸、滤纸、枪、枪头、试剂瓶、打火机、塑料膜、绳子实验试剂:琼脂、蔗糖、75%,95%乙醇、α-萘乙酸(NAA)、6-苄氨基嘌呤(6-BA)、0.1%升汞、盐酸、大量元素(磷酸二氢钾、硝酸钾、硝酸铵、七水硫酸镁、二水合氯化钙)、微量元素(四水合硫酸猛、七水合硫酸锌、五水合硫酸铜、二水合钼酸钠、碘化钾、六水合氯化钴、硼酸)、铁盐(乙二胺四乙酸二钠、七水合硫酸亚铁)、有机物(甘氨酸、盐酸吡哆辛、盐酸硫胺素、烟酸、肌醇)三、实验操作步骤1、用分析天平去8.8g琼脂,30g蔗糖,放入烧杯中,加蒸馏水至900ml,把烧杯放在电炉上煮琼脂,并用玻璃棒搅拌,时间为50-60分钟。
2、将煮好的琼脂加蒸馏水至900ml,按顺序用移液管加50ml大量元素,5ml微量元素,10ml铁盐,10ml有机物,再用枪加1ml6-BA,0.5mlNAA,并用玻璃棒搅拌。
调ph至5.6-6.0之间。
3、将配好的培养基倒入锥形瓶中(50-60ml),用绳子将塑料膜绑好。
准备蒸馏水,并将培养皿、手术刀柄、镊子用报纸包好,同培养基一起放入高压灭菌锅灭菌,温度为121℃,时间为23min。
4、灭完菌后将培养基放至室内,冷却。
准备好洗净的百合种球,75%的酒精,0.1% 升汞(注:升汞有剧毒,注意操作),定时器,手术刀片,烧杯等,准备进行无菌操作。
5、开启紫外灯30min,关闭10min后进入,用酒精擦拭无菌操作台,在手上喷洒酒精,将酒精灯点燃放入无菌操作台中,把酒精倒满烧杯,将镊子与手术刀放入烧杯中。
药用植物组织培养-百合组培实验报告

百合的组织培养姓名:XXX学号:学院:农学院专业:中草药栽培与鉴定百合简要概述百合是百合科百合属,多年生草本球根植物。
是著名的观赏花卉,可食用,有很高的利用价值。
利用组织培养进行繁育是百合无毒化和商品化的必要途径。
由于百合的常规繁殖率低,易感染病毒,所以对繁殖技术提出了更高的要求,人工繁殖技术对百合具有重要的意义。
本实验主要通过植物组织培养手段,以MS为基本培养基,以百合鳞茎为外植体,对其进行灭菌消毒,并置于温箱中进行培养。
随后观察其生长情况,并拍照记录。
植物组织培养概述植物组织培养是一种将植物体的部分细胞或组织与母体分离,在适当的条件下加以培养,使它们能够生长、发育、分化与增殖的技术。
原理是来自植物细胞的全能性分化能力,也就是植物体内的某一类细胞,能够独立发育并且分化成为完整的植物成体。
植物组织培养是根据植物细胞具有全能性的理论,利用植物体离体的器官、组织或细胞以及原生质体,在无菌和适宜的人工培养基及温度等人工条件下,能诱导出愈伤组织、不定芽、不定根,最后形成完整的植株。
培养选用的基础培养基一般较多采用的是MS。
采用固体培养基较多,因为相比液体培养基,固体培养基在操作上更方便,被广泛使用。
在基础培养基里添加一定的外源激素,可以诱导出愈伤组织、胚状体、不定芽、根等器官,最终可获得再生植株或者次生产物。
常用的激素类型有生长素类、细胞分裂素类、赤霉素等。
百合植物组织培养实验试剂烟酸,甘氨酸,盐酸硫胺素,肌醇,盐酸吡哆醇;琼脂,蔗糖,蒸馏水,NAA,6-BA,1mol/LHCl,1mol/L NaOH;75%酒精。
仪器冰箱、天平、pH试纸、电炉、高压灭菌锅、超净工作台、光照培养箱、三角瓶、容量瓶、量筒、移液管、烧杯、培养皿、滤纸、报纸、绳、玻璃棒、镊子、刀等。
生物材料:百合实验步骤1、配制培养基母液的配制方法a)大量元素的配制:依次称取KNO319g、NH4NO316.5g、MgSO4•7H2O3.7g、KH2PO40.17g、CaCl2•2H2O4.4g,分别用少量的蒸馏水彻底溶解,然后再将它们混溶,以防互相发生反应,最后用容量瓶定容至1L,转入试剂瓶中,贴上标签,置冰箱冷藏保存。
[应用]兰州百合的植物组织培养
![[应用]兰州百合的植物组织培养](https://img.taocdn.com/s3/m/73fec35a2f3f5727a5e9856a561252d380eb208e.png)
兰州百合的组织培养技术一、实验目的1、学习并掌握植物组织培养技术2、应用植物组织培养技术快速繁殖兰州百合3、通过以百合鳞片为外植体进行组培,掌握对试验材料的消毒、接种方法,初步掌握外植体愈伤组织诱导的方法。
二、实验原理植物组织培养再生植物的理论基础是细胞全能性,是指在多细胞生物中每个体细胞的细胞核具有个体发育的全部基因,具有发育成完整个体的潜力。
离体的植物组织在一定条件下,可发生“脱分化”,即已经分化了的植物细胞重新分裂生长,形成均一的无组织结构的细胞团,即愈伤组织。
这种愈伤组织在一定条件下,又能“再分化”出根和芽等器官。
在该过程中,植物生长调节物质起着决定作用,调控愈伤组织的芽或根的分化。
三、材料1、试剂:NH4NO3, KNO3, CaCl2·2H2O, MgSO4·7H2O, KH2PO4, KI, H2BO3,MnSO4·4H2O, ZnSO4·7H2O, Na2·MoO4·2H2O, CuSO4·5H2O, CoCl2·6H2O, Na2•EDTA•2H2O,FeSO4·7H2O,烟酸,甘氨酸, 盐酸硫胺素, 肌醇, 盐酸吡哆醇;琼脂,蔗糖,蒸馏水,NAA,6-BA,1mol/LHCl,1mol/LNaOH;升汞。
2、仪器: 冰箱,天平,酸度计或pH试纸,电炉,微波炉,高压灭菌锅,烘箱,超净工作台,光照培养箱等3、基本工具:三角锥瓶、容量瓶、吸量管、量筒、移液器、烧杯、培养皿、滤纸、牛皮纸、封瓶膜、玻璃棒、镊子、剪刀等。
4、生物材料:市售兰州百合。
四、方法(一)MS培养基的配制1.配制MS培养基母液的配制方法如下:(1)大量元素的配制(10×):按母液配制表1上的量依次称取KNO319g、NH4NO316.5g 、MgSO 4·7H 2O 3.7g 、KH 2PO 4 1.7g ,分别用少量的蒸馏水彻底溶解,然后再将它们混溶,以防互相发生反应,最后用容量瓶定容至1L (如需求量不大可按比例减少),转入棕色试剂瓶中,贴上标签,置冰箱冷藏保存。
百合组织培养快速繁殖的开题报告

百合组织培养快速繁殖的开题报告一、研究背景百合是一种重要的观赏植物,也是重要的食用植物,具有很高的经济价值和生态价值。
然而,百合的育种和繁殖仍存在着一些问题。
传统的百合培育方法需要长时间的繁殖周期,并且易受外界环境的影响,不能满足大规模生产的需求。
因此,急需寻求一种快速、高效的百合繁殖方法,以满足市场需求。
二、研究目的本研究旨在培养一种快速繁殖的百合组织,为百合种植和生产提供技术支持和方案。
具体研究目标如下:1.建立适合百合组织培育的培养基配方。
2.研究不同生长调节剂对百合生长的影响,筛选出适合百合生长的生长调节剂。
3.研究不同光照条件对百合生长的影响,确定最适宜的光照条件。
4.通过组织培养技术实现百合的快速繁殖,并对其繁殖效果进行评估。
三、研究内容和方法为找到一种快速繁殖的百合组织,本研究将采用以下研究内容和方法:1. 建立适合百合组织培育的培养基将不同配比的培养基组成素,进行筛选和优化,寻找适合百合组织生长的培养基配方。
2. 研究生长调节剂对百合生长的影响通过不同浓度的生长调节剂和不同种类的生长调节剂,评估其对百合生长的影响,筛选出适合百合生长的生长调节剂。
3. 研究光照条件对百合生长的影响通过不同光照条件的设定,评估其对百合生长的影响,确定最适宜的光照条件。
4. 实现百合的快速繁殖通过组织培养技术,将百合组织进行无菌培养,实现快速繁殖,并对其繁殖效果进行评估。
四、预期成果1.建立一种适合百合组织生长的培养基配方。
2.筛选出适合百合生长的生长调节剂和最适宜的光照条件。
3.实现百合的快速繁殖,为其生产和种植提供技术支持和方案。
四、研究意义本研究通过建立适合百合组织生长的培养基配方、筛选适合百合生长的生长调节剂和确定最适宜的光照条件,实现了快速繁殖的百合组织,为百合的种植和生产提供了一种新的技术解决方案。
相关成果的推广应用,将促进百合的产业化发展,推动相关领域的研发和创新。
百合的组织培养
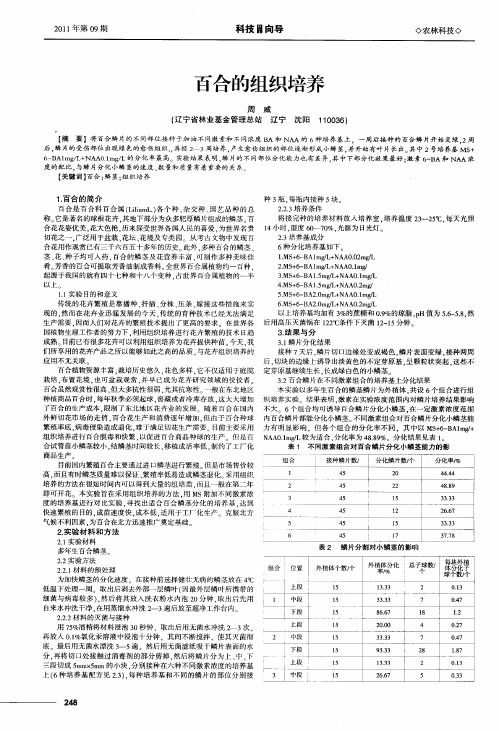
4 MS 6 BAI 5 / NAA0 2 / . + 一 .mgI+ . mg 5 MS 6 BA20 / + . + 一 .mg L NAA0 1 / . mg L 6 MS 6 BA20 / NAA0 2 / . + 一 .mgL+ . mg L
1百合 的简 介 .
以上培养基 均加有 3 %的蔗糖和 09 .%的琼脂 ,H值为 56 58 然 p .— .,后用高压灭菌锅 在 12 2 ℃条件下灭 菌 l— 5分钟 21
3结 果 与 分 .
31 片分 化 结 果 .鳞
接种 7天后 , 鳞片切 口边缘处变成褐色 , 鳞片表面变绿 . 接种两周 后, 切块的边缘上诱导出淡黄色 的不定芽原基 , 呈颗粒状突起 , 这些不 定 芽 原 基 继续 生 长 . 成 绿 白色 的小 鳞 茎 长 3 . 2百合鳞片在不同激素组合 的培养基上分化结果 木 实验以多年生百合的鳞茎鳞片为外植体 . 共设 6个组合进行组 织 培 养 实 验 。结 果 表 明 . 素在 实 验 浓 度 范 围 内对 鳞 片 培 养 结 果 影 响 激 不大。6个组合均可诱 导百合鳞片分化小鳞茎 . 在一定激 素浓 度范围 内 百 合鳞 片都 能 分 化 小 鳞茎 。 同 激素 组 合 对 百 合 鳞 片分 化 小 鳞 茎 能 不 力有明显影响 。但 各个组合 的分 化率不 同 .其 中以 MS 6 B m# + 一 Al + N A . / 为适 合 . 化 率 为 4 . % 。分 化 结果 见 表 1 A 01 L较 mg 分 88 9 表 1 不 同 激 素 组合 对 百 合 鳞 片 分 化 小鳞 茎能 力 的 影
21年第 0 期 01 9
科 技 霸向导
◇农林科技◇
百合的组织培养
东方百合组织培养和快速繁殖的研究

东方百合组织培养和快速繁殖的研究本试验选用东方百合系列的西伯利亚(Siberia)、索邦(Sorbonne)、元帅(Acapulco)、提伯(Diber)的鳞片,西伯利亚、马可波罗(Marco Polo)、元帅、卡莎布兰卡(Casa Blaca’)、黄时代的花器官作为外植体进行组织培养,分别在无性系的建立、继代增殖培养、生根结鳞茎、移栽技术四个阶段进行了研究,得出以下结果:1.无性系的建立不同品种间鳞片分化从易到难的排序为:西伯利亚,提伯,元帅,索邦;同一鳞片,基部最容易分化,其次是中部,顶部较难分化。
在所试验的培养基中,较适合西伯利亚、提伯鳞片分化的培养基为:MS+BA1.0mg/L+NAA0.1mg/L,元帅、索邦的为:MS+BA2.0mg/L+NAA0.1mg/L。
不同品种间花器官分化从易到难的排序为西伯利亚,马可波罗,元帅,黄时代,卡萨布兰卡;同一品种不同部位分化从易到难的排序为花托,子房,花冠,花丝,花柱。
在所试验的培养基中:西伯利亚的花托、子房、花柱,马可波罗、黄时代花托、子房、的为MS+6-BA1.0mg/L+NAA0.2mg/L,西伯利亚、马可波罗、黄时代的花冠、花丝,元帅、卡莎布兰卡的花托、子房、花冠、花丝的为MS+6-BA2.0mg/L+NAA0.2mg/L。
无菌苗叶片诱导试验表明较适合诱导部位为叶片基部,较适合叶片基部分化的培养基为MS+BA3.0mg/L+NAA0.3mg/L。
2.继代增殖培养西伯利亚和提伯鳞片不定芽增殖较好培养基为MS+BA1.0mg/L+NAA0.1mg/L,元帅、索邦的为MS+BA0.4mg/L+NAA0.05mg/L;西伯利亚、马可波罗花器官不定芽的增殖较好培养基为MS+BA0.5mg/L+NAA0.1mg/L,黄时代、元帅、卡莎布兰卡的为MS+BA0.3mg /L+NAA0.02mg/L。
3.生根结鳞茎与百合组培苗生根结鳞茎有关的影响因素有植物生长物质的种类和浓度、糖浓度等;NAA有利于生根,其较适合的浓度为0.5mg/L;糖对结鳞茎作用较明显,较适合浓度为60g/L;在NAA与糖组合试验中,较适合西伯利亚和马可波罗组培苗生根结鳞茎培养基为1/2MS+糖60g/L+NAA0.5mg/L,黄时代、元帅、索邦、卡莎布兰卡的为1/2MS+糖70g/L+NAA0.3mg/L。
百合组培苗栽培技术研究

百合组培苗栽培技术研究
本试验以麝香百合组培苗为材料,对百合组培苗生根、试管内结鳞茎和移栽时期的营养液和栽培基质等方面进行了研究,采用“311-A”最优混合设计,研究了营养液中氮、磷、钾不同配比对百合组培苗生长发育的影响,并利用计算机,通过建立鳞茎鲜重和淀粉含量的三元二次回归模型,模拟寻优得出高产、高淀粉的栽培营养液配方的氮、磷、钾最佳浓度和配比。
试验结果如下: 1.PP333能有效地促进百合组培苗试管内生根、结鳞茎,浓度为2mg/L时效果最佳。
2.在本实验的条件下,百合组培苗栽培的最优基质为菜园土:沙:腐殖质=1:2:1,这种基质构成良好的土壤结构,有利于百合苗的生长和扎根。
百合组培苗苗期喷施叶面肥,以1MS大量元素营养液喷施为最佳浓度。
3.不同氮磷钾配比的施肥试验表明,在11个处理中,处理11的百合株高适中、茎粗和叶面积最大、叶片最多;叶片叶绿素含量最高,叶片光合作用最强;植株全氮和全钾的含量也是各处理中最高;鳞茎品质也是各处理中最优。
4.在-2~0水平,氮、磷、钾互作对百合组培苗鳞茎鲜重和淀粉含量有一定的正向互作效应。
应用DPS数据处理系统对百合组培苗鳞茎鲜重和鳞茎淀粉含量2项指标进行综合模拟寻优得氮、磷、钾的用量分别为148.18mg/L、33.00mg/L、141.60mg/L 时,百合组培苗采收时鳞茎鲜重最重、鳞茎淀粉含量最高,此时其鳞茎鲜重和淀粉含量分别为32.18g和17.75%。
获得最佳施肥配比:氮:磷
(P<sub>2</sub>O<sub>5</sub>):钾(K<sub>2</sub>O)=1:0.22:0.96。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
百合组织培养实验报告
一、实验原理
植物细胞全能性理论是植物组织培养的核心理论。
立体细胞具有生命的特征属性,在全能性的基础上,提供合适的营养和环境条件,立体细胞经历脱分化(dedifferentiation)和再分化(redifferentiation)过程,可形成再生植物。
二、实验用品
实验材料:百合种球
实验仪器:高压消毒锅、超净工作台、镊子、剪刀、手术刀柄、手术刀片、酒精灯、定
时器、人工气候箱、分析天平、酸度计、电炉、蒸馏水机、培养皿、烧杯、
量筒、移液管、吸球、药匙、玻璃棒、锥形瓶、称量纸、滤纸、枪、枪头、
试剂瓶、打火机、塑料膜、绳子
实验试剂:琼脂、蔗糖、75%,95%乙醇、α-萘乙酸(NAA)、6-苄氨基嘌呤(6-BA)、
0.1%升汞、盐酸、大量元素(磷酸二氢钾、硝酸钾、硝酸铵、七水硫酸镁、
二水合氯化钙)、微量元素(四水合硫酸猛、七水合硫酸锌、五水合硫酸铜、
二水合钼酸钠、碘化钾、六水合氯化钴、硼酸)、铁盐(乙二胺四乙酸二钠、
七水合硫酸亚铁)、有机物(甘氨酸、盐酸吡哆辛、盐酸硫胺素、烟酸、肌
醇)
三、实验操作步骤
1、用分析天平去8.8g琼脂,30g蔗糖,放入烧杯中,加蒸馏水至900ml,把烧杯放
在电炉上煮琼脂,并用玻璃棒搅拌,时间为50-60分钟。
2、将煮好的琼脂加蒸馏水至900ml,按顺序用移液管加50ml大量元素,5ml微量元
素,10ml铁盐,10ml有机物,再用枪加1ml6-BA,0.5mlNAA,并用玻璃棒搅拌。
调ph至5.6-6.0之间。
3、将配好的培养基倒入锥形瓶中(50-60ml),用绳子将塑料膜绑好。
准备蒸馏水,
并将培养皿、手术刀柄、镊子用报纸包好,同培养基一起放入高压灭菌锅灭菌,
温度为121℃,时间为23min。
4、灭完菌后将培养基放至室内,冷却。
准备好洗净的百合种球,75%的酒精,0.1%
升汞(注:升汞有剧毒,注意操作),定时器,手术刀片,烧杯等,准备进行无
菌操作。
5、开启紫外灯30min,关闭10min后进入,用酒精擦拭无菌操作台,在手上喷洒酒
精,将酒精灯点燃放入无菌操作台中,把酒精倒满烧杯,将镊子与手术刀放入烧
杯中。
6、百合种球的灭菌方法:75%酒精泡1min→切成3段→用0.1升汞泡15min→用蒸
馏水洗5次
7、接种方法:将灭好菌的百合种球四周切去,取中间部分切成2mm×2mm×0.5mm
大小,将切好的百合快速放入培养基中,将培养基绑好。
8、将接好的百合培养基放入光照培养箱中进行培养。
