生物化学第十章5
生物化学脂类代谢

O
R C H 2C H 2C ~ S C o A
= =
脂酰CoA 脱氢酶
β α
脂酰CoA
脱氢
FAD FADH2
O
R C H =C H C ~ S C o A
加水
⊿2--烯脂酰CoA 水化酶
β α
O
R C H O H C H 2C ~ S C o A
= = =
反⊿2-烯酰CoA
H 2O
= =
L(+)-β羟脂酰CoA
细菌和植物----7个多肽
酵母菌----2个多肽
脊椎动物----1个多肽
(1)启动
ACP转移酶
乙酰和酶复合物
(2)装载
丙二酸单酰CoA-ACP转移酶
(3)缩合
β-酮脂酰-ACP合 酶
乙酰乙酰ACP
(4)还原
β-酮脂酰-ACP 还原酶
D-β- 羟丁酰ACP
(5)脱水
α,β- 反式-丁烯酰ACP
1.部位:
组 织:肝(主要) 、脂肪等组织 亚细胞: 胞液:主要合成16碳的软脂酸(棕榈酸) 肝线粒体、内质网:碳链延长
2 饱和脂肪酸的合成
脂肪酸合成的主要途径,胞质中进行,原料为乙 酰CoA,产物是长链脂肪酸(多为软脂酸)。 反应还需:酰基载体蛋白ACP, ATP, NADPH和 Mn2+等。 合成中只有一个C2物以乙酰CoA参与整个合成过 程,其余延伸的C2物均以丙二酸单酰CoA形式参 与反应。
(三)、不饱和脂肪酸的分解
不饱和脂肪酸同样需要活化和转运才能进入线 粒体氧化,在遇到不饱和双键前进行常规的b氧化, 若遇顺式双键,必须异构为反式异构物、或底 物为D(-)b-构型需经差向异构生成L-型异构体, 才能继续b-氧化,需要异构酶和还原酶。
生物化学讲义第十章物质代谢的联系和调节

生物化学讲义第十章物质代谢的联系和调节 【目的与要求】1.熟悉三大营养物质氧化供能的通常规律与相互关系。
2.熟悉糖、脂、蛋白质、核酸代谢之间的相互联系。
3.熟悉代谢调节的三种方式。
掌握代谢途径、关键酶(调节酶)的概念;掌握关键酶(调节酶)所催化反应的特点。
熟悉细胞内酶隔离分布的意义。
熟悉酶活性调节的方式。
4.掌握变构调节、变构酶、变构效应剂、调节亚基、催化亚基的概念;5.掌握酶的化学修饰调节的概念及要紧方式。
6.熟悉激素种类及其调节物质代谢的特点。
7.熟悉饥饿与应激状态下的代谢改变。
【本章重难点】1.物质代谢的相互联系2.物质代谢的调节方式及意义3.酶的变构调节、化学修饰、阻遏与诱导4.作用于细胞膜受体与细胞内受体的激素学习内容第一节物质代谢的联系第二节物质代谢的调节第一节物质代谢的联系一、营养物质代谢的共同规律物质代谢:机体与环境之间不断进行的物质交换,即物质代谢。
物质代谢是生命的本质特征,是生命活动的物质基础。
二、三大营养物质代谢的相互联系糖、脂与蛋白质是人体内的要紧供能物质。
它们的分解代谢有共同的代谢通路—三羧酸循环。
三羧酸循环是联系糖、脂与氨基酸代谢的纽带。
通过一些枢纽性中间产物,能够联系及沟通几条不一致的代谢通路。
对糖、脂与蛋白质三大营养物质之间相互转变的关系作简要说明:㈠糖可转变生成甘油三酯等脂类物质(除必需脂肪酸外),甘油三酯分解生成脂肪酸,脂肪酸经β-氧化生成乙酰CoA,乙酰CoA或者进入三羧酸循环或者生成酮体,因此甘油三酯的脂肪酸成分不易生糖,但甘油部分能够转变为磷酸丙糖而生糖,但是甘油只有三个碳原子,只占甘油三酯的很小部分。
㈡多数氨基酸是生糖或者生糖兼生酮氨基酸。
因此氨基酸转变成糖较为容易。
糖代谢的中间产物只能转变成非必需氨基酸,不能转变成必需氨基酸。
㈢少数氨基酸能够生酮,生糖氨基酸生糖后,也可转变为脂肪酸(除必需脂肪酸外),因此氨基酸转变成脂类较为容易。
脂肪酸经β-氧化生成乙酰CoA进入三羧酸循环后,即以CO2形式被分解。
[王镜岩生物化学第三版笔记]第十章 氨基酸代谢
![[王镜岩生物化学第三版笔记]第十章 氨基酸代谢](https://img.taocdn.com/s3/m/433ff601b52acfc789ebc9ff.png)
第十章氨基酸代谢植物、微生物从环境中吸收氨、铵盐、亚硝酸盐、硝酸盐等无机氮,合成各种氨基酸、蛋白质、含氮化合物。
人和动物消化吸收动、植物蛋白质,得到氨基酸,合成蛋白质及含氮物质。
有些微生物能把空气中的N2转变成氨态氮,合成氨基酸。
第一节蛋白质消化、降解及氮平衡一、 蛋白质消化吸收哺乳动物的胃、小肠中含有胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶、羧肽酶、氨肽酶、弹性蛋白酶。
经上述酶的作用,蛋白质水解成游离氨基酸,在小肠被吸收。
被吸收的氨基酸(与糖、脂一样)一般不能直接排出体外,需经历各种代谢途径。
肠粘膜细胞还可吸收二肽或三肽,吸收作用在小肠的近端较强,因此肽的吸收先于游离氨基酸。
二、 蛋白质的降解人及动物体内蛋白质处于不断降解和合成的动态平衡。
成人每天有总体蛋白的1%~2%被降解、更新。
不同蛋白的半寿期差异很大,人血浆蛋白质的t1/2约10天,肝脏的t1/2约1~8天,结缔组织蛋白的t1/2约180天,许多关键性的调节酶的t1/2均很短。
真核细胞中蛋白质的降解有两条途径:一条是不依赖A TP的途径,在溶酶体中进行,主要降解外源蛋白、膜蛋白及长寿命的细胞内蛋白。
另一条是依赖A TP和泛素的途径,在胞质中进行,主要降解异常蛋白和短寿命蛋白,此途径在不含溶酶体的红细胞中尤为重要。
泛素是一种8.5KD(76a.a.残基)的小分子蛋白质,普遍存在于真核细胞内。
一级结构高度保守,酵母与人只相差3个a.a残基,它能与被降解的蛋白质共价结合,使后者活化,然后被蛋白酶降解。
三、 氨基酸代谢库食物蛋白中,经消化而被吸收的氨基酸(外源性a.a)与体内组织蛋白降解产生的氨基酸(内源性a.a)混在一起,分布于体内各处,参与代谢,称为氨基酸代谢库。
氨基酸代谢库以游离a.a总量计算。
肌肉中a.a占代谢库的50%以上。
肝脏中a.a占代谢库的10%。
肾中a.a占代谢库的4%。
血浆中a.a占代谢库的1~6%。
肝、肾体积小,它们所含的a.a浓度很高,血浆a.a是体内各组织之间a.a转运的主要形式。
生物化学(第三版)第十章 酶的作用机制和酶的调节课后习题详细解答_ 复习重点

第十章酶的作用机制和酶的调节提要酶的活性部位对于不需要辅酶的酶来说,就是指酶分子中在三维结构上比较靠近的几个氨基酸残基负责与底物的结合与催化作用的部位,对于需要辅酶的酶来说,辅酶分子或辅酶分子上的某一部分结构,往往也是酶活性部位的组成部分。
酶活性部位有6个共同特点。
研究酶活性部位的方法有:酶分子侧链基团的化学修饰法,动力学参数测定法,X射线晶体结构分析法和定点诱变法,这些方法可互相配合以判断某个酶的活性部位。
酶是催化效率很高的生物催化剂,这是由酶分子的特殊结构所决定的。
经研究与酶催化效率的有关因素有7个,即底物和酶的邻近效应与定向效应,底物的形变与诱导契合,酸碱催化,共价催化,金属离子催化,多元催化和协同效应,活性部位微环境的影响。
但这些因素不是同时在一个酶中其作用,也不是一种因素在所有的酶中起作用,对于某一种酶来说,可能分别主要受一种或几种因素的影响。
研究酶催化的反应机制,始终是酶学研究的一个重点,通过大量的研究工作,已经对一些酶的作用机制有深入了解,该章对溶解酶、胰核糖核酸酶A、羧肽酶A、丝氨酸蛋白酶、天冬氨酸蛋白酶等的催化作用机制进行了详尽的讨论。
酶活性是受各种因素调节控制的,除了在第8章中已介绍的几种因素外,主要还有①别构调节,例如ATCase。
②酶原的激活,如消化系统蛋白酶原的激活及凝血系统酶原的激活。
③可逆共价修饰调控,如蛋白质的磷酸化,一系列蛋白激酶的作用。
通过以上作用,使酶能在准确的时间和正确的地点表现出它们的活性。
别构酶一般都是寡聚酶,有催化部位和调节部位,别构酶往往催化多酶体系的第一步反应,受反应序列的终产物抑制,终产物与别构酶的调节部位相结合,由此调节多酶体系的反应速率。
别构酶有协同效应,[S]对υ的动力学曲线呈S形曲线(正协同)或表现双曲线(负协同),两者均不符合米氏方程。
ATCase作为别构酶的典型代表,已经测定了其三维结构,详细研究了别构机制和催化作用机制。
为了解释别构酶协同效应的机制,有两种分子模型受到人们重视,即协同模型和序变模型。
生物化学(本科)第十章基因表达调控及其相关细胞信号转导通路随堂练习与参考答案

⽣物化学(本科)第⼗章基因表达调控及其相关细胞信号转导通路随堂练习与参考答案⽣物化学(本科)第⼗章基因表达调控及其相关细胞信号转导通路随堂练习与参考答案第⼀节概述第⼆节原核基因的转录调控第三节真核基因的转录调控第四节相关细胞信号转导通路1. (单选题)基因表达调控的基本控制点是( )A. 基因结构活化B. 转录起始C. 转录后加⼯D. 蛋⽩质翻译及翻译后加⼯E. mRNA从细胞核转运到细胞浆参考答案:B2. (单选题)分解代谢物基因激活蛋⽩(CAP)对乳糖操纵⼦表达的影响是( )A. 正性调控B. 负性调控C. 正性调控、负性调控都可能D. ⽆调控作⽤E. 可有可⽆参考答案:A3. (单选题)阻遏蛋⽩识别操纵⼦中的( )A.启动基因B.结构基因C.操纵基因D.内含于E.外显⼦参考答案:C4. (单选题)⽬前认为基因表达调控的主要环节是( )A. 翻译后加⼯B. 转录起始C. 翻译起始D. 转录后加⼯E. 基因活化A. 适应环境B. 调节代谢C. 维持⽣长D. 维持分裂E. 维持分化参考答案:A6. (单选题)⼀个操纵⼦通常含有( )A.⼀个启动序列和⼀个编码基因B.⼀个启动序列和数个编码基因C.数个启动序列和⼀个编码基因D.数个启动序列和数个编码基因E.两个启动序列和数个编码基因参考答案:B7. (单选题)对乳糖操纵⼦来说( )A. CAP是正性调节因素,阻遏蛋⽩是负性调节因素B. CAP是负性调节因素,阻遏蛋⽩是正性调节因素C. CAP和阻遏蛋⽩都是正性调节因素D. CAP和阻遏蛋⽩都是负性调节因素E. 在不同条件下,CAP和阻遏蛋⽩均显⽰正性或负性调节特点参考答案:A8. (单选题)lac阻遏蛋⽩由( )A. Z基因编码B. Y基因编码C. A基因编码D. I基因编码E. 以上都不是参考答案:D9. (单选题)基因表达产物是( )A. RNAB. DNAC. 蛋⽩质D. 酶和DNAE. ⼤多数是蛋⽩质,有些是RNAA. 作为阻遏物结合于操纵基因B. 作为辅阻遏物结合于阻遏物C. 使阻遏物变构⽽失去结合DNA的能⼒D. 抑制阻遏基因的转录E. 使RNA聚合酶变构⽽活性增加参考答案:C11. (单选题)顺式作⽤元件是指( )A. TATA box和CCAAT boxB. 基因的5’-侧翼序列C. 基因的3’-侧翼序列D. 具有转录调节功能的特异DNA序列E. 增强⼦参考答案:D12. (单选题)反式作⽤因⼦是指( )A. 具有激活功能的调节蛋⽩B. 具有抑制功能的调节蛋⽩C. 对另⼀基因具有激活功能的调节蛋⽩D. 对另⼀基因表达具有调节功能的蛋⽩E. 是特异DNA序列参考答案:D13. (单选题)启动⼦是指( )A. DNA分⼦中能转录的序列B. 与RNA聚合酶结合的DNA序列C. 与阻遏蛋⽩结合的DNA序列D. 有转录终⽌信号的DNA序列E. 与反式作⽤因⼦结合的RNA序列参考答案:B14. (单选题)增强⼦的作⽤是( )A. 促进结构基因转录B. 抑制结构基因转录C. 抑制阻遏蛋⽩D. 抑制操纵基因表达E. 抑制启动⼦A. 操纵基因结合B. 启动⼦上游的CAP位点结合C. DNA分⼦中任意⼀段序列结合D. 增强⼦结合E. 沉默⼦结合参考答案:B16. (单选题)通过胞内受体发挥作⽤的信息物质为 A.⼄酰胆碱B.γ-氨基丁酸C.胰岛素D.甲状腺素E.表⽪⽣长因⼦参考答案:D17. (单选题)细胞内传递信息的第⼆信使是A.受体B.载体C.⽆机物D.有机物E.⼩分⼦物质参考答案:E18. (单选题)下列哪项不是受体与配体结合的特点 A.⾼度专⼀性B.⾼度亲和⼒C.可饱和性D.不可逆性E. ⾮共价键结合参考答案:D19. (单选题)通过膜受体起调节作⽤的激素是A.性激素B.糖⽪质激素C.甲状腺素D.肾上腺素E.活性维⽣素D3参考答案:D20. (单选题)胞内受体的化学本质为F.糖脂参考答案:A21. (单选题)IP3与相应受体结合后,可使胞浆内哪种离⼦浓度升⾼A.K+B.Na+C.HCO3-D.Ca2+E. Mg2+参考答案:D22. (单选题)在细胞内传递激素信息的⼩分⼦物质称为 A.递质B.载体C.第⼀信使D.第⼆信使E.第三信使参考答案:D23. (多选题)真核⽣物基因结构特点是( )A.基因不连续性B.单顺反⼦C.含重复序列D.⼀个启动基因后接有⼏个编码基因E.含内含⼦参考答案:ABE24. (多选题)哪些是顺式作⽤元件? ( )A.启动⼦B.增强⼦C.内含⼦D.反应元件E.外显⼦参考答案:ABD25. (多选题)乳糖操纵⼦中具有调控功能的基因是( )A.A基因参考答案:CD26. (多选题)下列对增强⼦特征描述中,正确的是( )A.增强⼦可远距离发挥作⽤B.增强效应的位置和⽅向⽆关C.可通过启动⼦提⾼同⼀条链上的靶基因的转录效率D.没有基因的专⼀性,可在不同的基因组合上表现增强效应E.增强⼦是具有转录调节功能的特异DNA序列参考答案:ABCE27. (多选题)以下关于cAMP对原核基因转录的调控作⽤的叙述正确的是( )A.cAMP可与分解代谢基因活化蛋⽩(CAP)结合成复合物B.cAMP-CAP复合物结合在启动⼦前⽅C.葡萄糖充⾜时,cAMP⽔平不⾼D.葡萄糖和乳糖并存时,细菌优先利⽤乳糖E.葡萄糖和乳糖并存时,细菌优先利⽤葡萄糖参考答案:ABCE28. (多选题)以下关于反式作⽤因⼦的叙述哪些是正确的? ( )A.反式作⽤因⼦是调节基因转录的⼀类蛋⽩因⼦B.转录因⼦是⼀类反式作⽤因⼦C.增强⼦结合蛋⽩属反式作⽤因⼦D.阻遏蛋⽩是⼀类负调控反式作⽤因⼦E.RNA聚合酶是反式作⽤因⼦参考答案:ABCD29. (多选题)以下关于顺式作⽤元件的叙述哪些是正确的? ( )A.顺式作⽤元件是⼀类调节基因转录的DNA元件B.增强于是⼀类顺式作⽤元件C.启动⼦中的TATA盒和GC盒都是顺式作⽤元件D.操纵基因是原核⽣物中的⼀类负调控顺式作⽤元件E.顺式作⽤元件只对基因转录起增强作⽤参考答案:ABCD30. (多选题)受体与配体结合的特点包括A.⾼度专⼀性E 特定的作⽤模式参考答案:ABCDE31. (多选题)能与GDP/GTP结合的蛋⽩质是A.G蛋⽩B.Raf蛋⽩C.Rel A蛋⽩D.Grb-2蛋⽩E.Ras蛋⽩参考答案:AE32. (多选题)与配体结合后,⾃⾝具有酪氨酸蛋⽩激酶活性的受体是A.胰岛素受体B.表⽪⽣长因⼦受体C.⾎⼩板衍⽣⽣长因⼦受体D.⽣长激素受体E.⼲扰素受体参考答案:ABC33. (多选题)胞内受体的激素结合区能A.与配体结合B.与G蛋⽩偶联C.与热休克蛋⽩结合D.使受体⼆聚体化 E.激活转录参考答案:ACDE。
东北师范大学生物化学 第十章氨基酸代谢

必需氨基酸
(氨基酸和糖的转 变是不可逆的)
酮体
生酮兼生糖氨基酸
Tyr(酪),Phe(苯),Ile(异), Trp(色)
生酮氨基酸 Lys Leu 生糖氨基酸:
三 氨基酸合成代谢 非必需氨基酸(10) 必需氨基酸(8):
Phe 、Met 、 Thr、 Val、 Leu、 Lys、Trp、Ile
半必需氨基酸:His Arg
NAD+ + H2O + (NADP+)
+ NH4+ + NADH +H+ (NADPH)
在动物体内辅酶为NAD+,在植物体内辅酶为NADP+
非必需氨基酸由相应的α -酮酸氨基化生成
八种必需氨基酸中,除赖氨酸和苏氨酸外其余六种亦可由相 应的α-酮酸加氨生成。但和必需氨基酸相对应的α-酮酸不能 在体内合成,所以必需氨基酸依赖于食物供应。
一 蛋白质的酶促降解
(一)外源蛋白质的降解
(二)内源蛋白质的降解
(一)外源蛋白质的降解(细胞外途径)
1 蛋白质的消化
胃蛋白酶:水解芳香族氨基酸的羧基形成的肽键
胰蛋白酶:水解碱性氨基酸羧基形成的肽键
肽链内切酶
胰凝乳蛋白酶:水解芳香族氨基酸的羧基形成 的肽键
弹性蛋白酶:脂肪族氨基酸的羧基形成的肽键 氨肽酶
肝脏是合成尿素的主要器官,肾脏是排出尿素的主要器官
氨基甲酰磷酸合成酶
一种在线粒体中参与尿素的合成
一种在细胞质中参与嘧啶的从头合成
尿素合成的特点: 主要在肝脏的线粒体和胞液中进行 一分子尿素需消耗4个 高能磷酸键 精氨琥珀酸合成酶是尿素合成的关键酶 尿素分子中的两个氮原子,一个来源于NH3, 一个来源于天冬氨酸
第十章 对映异构 第5节旋光异构体的性质

学习小结
1.基本概念: 偏振光;手性;手性分子;旋光性;旋光度;手性碳;对映体; 非对映体;外消旋体;内消旋体 2.费歇尔投影式投影规则:
“主链下行、横前竖后” 3.构型的命名方法:
(1)D/L命名法 (2)R/S命名法原则 4.含一个手性碳原子的化合物: 有一个手性碳的化合物必定是手性化合物,只有一对对映体
外消旋过饱和溶液 右旋体晶种
部分右旋体结晶析出 滤液 部分外消旋体混合物
部分左旋体结晶析出
滤液
如此反复
优点是成本较低,效果较好。缺点是应用范围有限,它要求 外消旋体的溶解度要比纯对映体大
合霉素的拆分
100g(±)-合霉素
加1g(+)-氯霉素 加100ml水
80℃ 冷却 溶解 20℃
1.9g(+)-氯霉素晶体
【目标检测】
一、选择题 1. 下列化合物中不是手性分子的是( )
A
B
C
D. ClCHBrCH3
2. 下列分子中不具有旋光性的是( ) A. CH3CH2CH(OH)C2H5 B. ClCHBrCH 3
C. ClCH2Br D. CH3CH(NH2)COOH
4. 下列说法错误的是( ) A. 若分子中没有对称因素,就是手性分子 B. 凡是分子中有对称 因素,就是非手性分子 C. 含有两个相同碳原子的分子必有手性 D. 含有两个不同碳原 子的分子必有手性
谢谢观看
5.含两个手性碳原子的化合物: (1)含两个不同手性碳原子的化合物有4个旋光异构体,两 对对映异构体;含n个不同手性碳原子的化合物,可能具有的 旋光异构体的数目为2n个,组成2n-1对对映体 (2)含两个相同手性碳原子的化合物有3个旋光异构体:一 对对映异构体和一个内消旋体 6.外消旋体的拆分: 化学拆分法、诱导结晶拆分法、生物化学拆分法和色谱分离 法
生物化学_第十章_物质代谢的调节

细胞核:核酸合成
内质网:蛋白质合 成;磷脂合成
真核细胞主要代谢途径与酶的区域分布
代谢途径(酶或酶系) 细胞内分布 代谢途径(酶或酶系) 细胞内分布 糖酵解 三羧酸循环 磷酸戊糖途径 糖异生 糖原合成与分解 脂肪酸β氧化 脂肪酸合成 呼吸链 多种水解酶 磷脂合成 胞质 线粒体 胞质 胞质 胞质 线粒体 胞质 线粒体 溶酶体 内质网 氧化磷酸化(呼吸链) 线粒体 尿素合成 胞质、线粒体 蛋白质合成 内质网、胞质 DNA合成 细胞核 mRNA合成 细胞核 tRNA合成 核质 rRNA合成 核仁 血红素合成 胞质、线粒体 胆红素生成 微粒体、胞质 胆固醇合成 内质网、胞质
酮体 乳酸 游离脂酸 葡萄糖
• 以葡萄糖有氧氧化供能为主
(六)红细胞
•能量主要来自糖酵解
(七)肾脏
• 也可进行糖异生和生成酮体; • 肾髓质主要由糖酵解供能;肾皮质主要由脂酸、 酮体有氧氧化供能。
第 二 节 物质代谢的相互联系
Metabolic Interrelationships
一、在能量代谢上的相互联系
酶的隔离分布的意义 —— 避免了各种代谢途径互相干扰,而且有利于它们协调 地发挥作用。
(二)细胞内物质代谢调节的基本方式
在一个代谢途径中,其速率和方向不完全由途径的所 有酶决定和调节,而是由其中的一个或几个具有调节作用
的酶所决定,这些酶称为调节酶(regulatory enzymes)、
关键酶(key enzymes)。或限速酶(rate-limiting enzyme)。由此酶催化的反应称为限速反应。限速酶活性 改变不但可以影响整个酶体系催化反应的总速率,甚至还 可以改变代谢反应的方向。
调节或细胞水平代谢调节。
高等生物 —— 三级水平代谢调节
生物化学 第十章 生物氧化PPT课件

多糖
蛋白质
脂肪酸、甘油
葡萄糖、 其它单糖
氨基酸
乙酰CoA
磷酸化
电子传递 (氧化)
+Pi
e-
三羧酸 循环
生物体内能量产生的三 个阶段
大分子降解 成基本结构 单位
小分子化合物 分解成共同的 中间产物(如 丙酮酸、乙酰
CoA等)
共同中间物进 入三羧酸循环, 氧化脱下的氢由 电子传递链传递 生成H2O,释放 出大量能量,其 中一部分通过磷 酸化储存在ATP 中。
30
(四)电子传递链的组成成分 3、琥珀酸—Q还原酶(复合体Ⅱ)
嵌在线粒体内膜(包括琥珀酸脱氢酶) 电子传递:FADH2 Fe-S CoQ
31
Ubiquinone (Q) accepts electrons from both NADH and FADH2 in the respiratory chain
一、氧化—还原电势
e
提供电子 (还原剂)
负极
锌片溶解 Zn2+进入溶液
铜沉积 Cu2+得电子
得到电子 (氧化剂)
正极
9
ε0 =E0正极 — E0负极 电动势=正负极电极势之差
10
标准氢电极的电极势
为0,25℃、1大气压 氢压力、 H+活度为1M、pH=0
11
• 标准电动势ε0:反应中各种物质的活
ΔG°′=-nFΔE°′ ΔE°′= E0正极 — E0负极
16
NADH+H++1/2O2====NAD++H2O
正极反应:1/2O2+2H++2e H2O E+°′ 0.82
负极反应:NAD++H++2e NADH E-°′ -0.3
第十章__代谢总论--王镜岩《生物化学》第三版笔记(完美打印版)

四、信息来源
生物大分子有两种组装模式:
1.模板指导组装核酸和蛋白质的合成,都以先在的信息分子为模板。如DNA复制、转录以及反转录、翻译都是在模板指导下的聚合过程。所需的信息存在于模板分子的构件序列中,能量来自活化的构件分子或ATP等。生物大分子形成高级结构并构成亚细胞结构是自我组装过程,其信息存在于一级结构中,其能量来自非共价作用力,即组装过程中释放的自由能。
3.其它高能化合物
UTP参与多糖合成,CTP参与脂类合成,GTP参与蛋白质合成。
烯醇酯、硫酯等也是高能化合物,如磷酸烯醇式丙酮酸、乙酰辅酶A等。高能化合物根据键型可分为磷氧键型、氮磷键型、硫酯键型、甲硫键型等,绝大多数含磷酸基团。
磷酸肌酸和磷酸精氨酸可通过磷酸基团的转移作为储能物质,称为磷酸原。磷酸肌酸是易兴奋组织如肌肉、脑、神经等唯一能起暂时储能作用的物质ΔG0’为-10.3千卡/摩尔,是ATP的能量储存库。肌肉中的含量比ATP高3-4倍,可维持ATP水平的恒定。磷酸精氨酸是无脊椎动物肌肉中的储能物质,与磷酸肌酸类似。
2.酶促组装有些构件序列简单均一的大分子通过酶促组装聚合而成。其信息指令来自酶分子,不需要模板。如糖原、肽聚糖、一些小肽等,都在专一的酶指导Fra bibliotek催化下合成。
第三节 分解代谢
一、阶段性和趋同性
生物大分子的分解有三个阶段:水解产生构件分子、氧化分解产生乙酰辅酶A、氧化成二氧化碳和水。在这个过程中,随着结构层次的降低,倾向产生少数共同的分解产物,即具有趋同性。
2.ATP及其偶联作用
生物体内的放能和需能反应经常以ATP相偶联。ATP可分解为ADP或AMP。前者如各种激酶,后者如乙酰辅酶A的合成。反应过程中有的由一个酶催化,如谷氨酰胺合成酶,先生成磷酰谷氨酸中间物,它是谷氨酸的活化形式,再与氨反应;有的需多个酶参与,如蔗糖的合成需3个酶,首先生成葡萄糖6磷酸的活化形式;也有的没有ATP直接参与,如苹果酸生成草酰乙酸,是需能反应,利用下一步由草酰乙酸生成柠檬酸时高能硫酯键放能促进其反应。
大学生物化学课件物质代谢的联系和调节

(3)肝在蛋白质代谢中的作用
1. 合成多种血浆蛋白质
(四)共同代谢池
体外摄入的营养物或体内各组织细胞的代谢物, 只要是同一化学结构的物质,在进行中间代谢 时,不分彼此,参加到共同的代谢池中参与代 谢,机会均等。 葡萄糖、 氨基酸
(五)ATP是机体能量利用的共同形式 (六) NADPH是合成代谢所需还原当量
第二节 物质代谢的相互联系
一、在能量代谢上的相互联系
全部清蛋白、凝血酶原、纤维蛋白原、Apo A、B、C、 E,部分a1, a2, β球蛋白。
2. AA合成与分解的主要器官。
3. 生成尿素的器官。 肝昏迷氨中毒
(4)肝参与多种维生素和辅酶的代谢 (略)
1. 肝在脂溶性维生素吸收和血液运输中的作用 胆汁酸参与维生素A,D,E,K的吸收。 血液中的运输:视黄醇结合蛋白 维生素D结合蛋白
(二)糖代谢与AA代谢的联系
1. 糖
NEAA (12种)
2. AA 糖 (18种,糖异生,除Leu, Lys)
必需AA 生糖AA 生酮AA 生糖兼生酮AA
(三)脂类代谢与AA代谢的相互联系
1. AA CH3CO-ScoA
FA、胆固醇
2. AA 是合成PL的原料 丝AA、乙醇胺、甲硫AA、胆碱(p160) 肉碱(β-氧化,p156)
饥饿:脂肪动员,脂肪组织分解TG为甘油和FA,释放入血。
6 . 肾:
糖异生、糖酵解、酮体生成 肾髓质,无线粒体,只能酵解供能 肾皮质,主要利用FA、酮体供能
生物化学:10-糖酵解
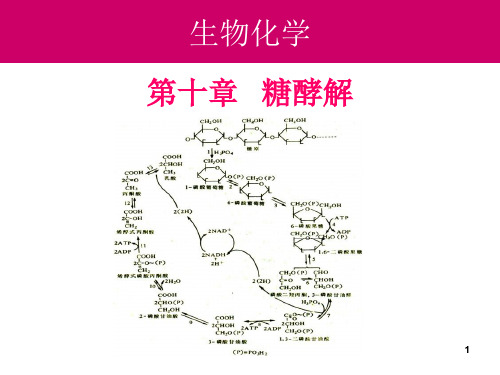
1
大分子分解 为小分子
细胞质中: 小分子进入细胞, 通过糖酵解被代 谢为丙酮酸,伴 随着少量ATP和 NADH的产生
线粒体中,有氧 条件下: 丙酮酸转变为乙 酰辅酶A,完全 氧化伴随着大量 ATP和NADH的 产生
2
本章提纲
第一节 糖的消化与吸收
第一节 第第二二节节
糖第第的概 单一二分述 糖节 节解代概 单谢 述 糖
4
唾液 淀粉酶
糖类食物
咀嚼、 部分水解
胃 HCl
第一节 糖的消化与吸收
有限水解
糖的吸收就是指游 离的葡萄糖(单糖) 进入到生物体内的 过程(肠粘膜吸 收)。
小肠
胰淀粉酶
a-糊精、麦芽糖和少量葡萄糖 糖苷酶
单糖
吸收
5
第二节 糖的分解代谢
(有氧和无氧)
6
第二节 糖的分解代谢
乳酸发酵 乙醇发酵
7
第二节 糖的分解代谢
己糖激酶与葡萄糖结合时的构象变化
21
己糖激酶具有催化相对 不专一性,对于甘露糖、 果糖和氨基葡萄糖等六 碳糖都有催化作用。
葡萄糖
己糖激酶与葡萄糖结合时的构象变化
22
第二节 糖的分解代谢
23
第二节 糖的分解代谢
2、葡萄糖-6-磷酸异构酶催化葡萄糖-6-磷酸转化为果糖6-磷酸
反应是可逆的 24
磷 酸 葡 萄 糖 异 构 酶 催 化 机 理
代谢途径中,催化不可逆反应的酶所处的部位是控 制代谢反应的有力部位 (一)、己糖激酶的调节 (二)、磷酸果糖激酶的调节(最关键) (三)、丙酮酸激酶的调节
48
第三节 糖酵解作用的调节(p83)
(一)、己糖激酶的调节
生物化学第十章 生物氧化

O TPP H3C C H
+ CO2
2. -直接脱羧
O HOOC H2 C C 草酰乙酸 丙酮酸脱羧酶 COOH H3C C 丙酮酸 COOH O
+ CO2
氧化脱羧基作用(oxidative decarboxylation)
1. -氧化脱羧
O H3C C COOH
+ CoASH + NAD+
1、电子传递过程:
还原型辅酶或辅基通过电子传递再氧化, 这个过程称电子传递过程。
2、电子传递链(呼吸链):
电子从还原型辅酶或辅基通过一系列电 子亲和力递增顺序排列的电子载体传递 到分子氧所经历的途径。
线粒体呼吸链
NADH-Q 还原酶
二、呼吸链的组成成分
呼吸链中共分为5类传递体和4类酶:
P285
1、以黄素核苷酸为辅基的脱氢酶
1 需氧黄酶(aerobic flavoenzyme) 2H 代谢物-2H 已氧化代谢物 FMN or FAD 需氧黄酶 FMNH2 or FADH2 2H O2 H 2O 2
2 不需氧黄酶(anaerobic flavoenzyme) 2H 代谢物-2H 已氧化代谢物 FMN or FAD 不需氧黄酶 FMNH2 or FADH2 2H
2H 传递体-2H 传递体 1 O2 2 H2 O
需氧脱氢酶能激活代谢物中的氢,将
脱出的氢和一对电子传递给脱氢酶的 辅酶; 在有氧条件下,还原态辅酶(FMNH2 和 FADH2 )能将由氢放出的2个电子传给 分子氧使之活化成过氧离子; 无氧条件下,还原态辅酶(FMNH2 和 FADH2 )能将由氢放出的2个电子传给 亚甲蓝或醌为受氢体而使反应进行。 如醛氧化成酸,氨基酸氧化脱氨。
生物化学与分子生物学-第十章第五节 百草枯和杀虫脒
总目录 下页
退出 返回
四、血和尿中百草枯的测定
• 分光光度法:快速检测 • 气相色谱法:衍生化,百草枯沸点高
,极性强,不具有挥发性 • 高效液相色谱法:极性强的离子型化
合物,最常用 • 毛细管电泳法 • 质谱联用法
总目录 下页
退出 返回
(一)分光光度法
1. 原理
• 尿中百草枯在pH>10条件下,与连二亚硫酸钠 反应,生成蓝色离子化合物,于395nm处测定 吸光度,用标准曲线法定量。
第五节 百草枯和杀虫脒
一、概述
(一)百草枯(paraquat):又称克芜踪、对草快等。
• 结构式
1,1-二甲基-4,4-联吡啶阳离子盐 (1,1’-dimethyl-4,4’-bipyridylium ion)
N+
N+
总目录 下页
退出 返回
• 存在形式:盐酸盐和双硫酸甲酯盐,商品多为
20%水剂或25%水剂二氯化物。
总目录 下页
退出 返回
(二)脒类农药(formamidines):广谱杀虫、杀螨剂。
• 结构通式
H
R1
RNC N
R2
• 分类:杀虫脒(chlordimeform,CDM)、双甲脒
(amitraz) 和单甲脒(mono-formamidine)。
总目录 下页
退出 返回
1. 杀虫脒(氯苯脒,克死螨、杀螟螨)
O O S O-
O N+
Cl-
N+
N+
N+ O
-O S O
O
Cl-
总目录 下页
退出 返回
• 理化性质
– 百草枯盐酸盐为无色、吸湿性晶体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
mRNA序列上紧接S-D序列后的小核苷酸序列, 可被核蛋白体小亚基蛋白rpS-1识别并结合。
(3)起始氨基酰tRNA(fMet-tRNAfMet )结合到小亚基
IF-2 GTP
5' IF-3
AUG
3' IF-1
(4)核蛋白体大亚基结合,起始复合物形成
GTP Pi IF-2 GDP
5' IF-3
程称为翻译后修饰(posttranslational modification)。 翻译后修饰包括多肽链折叠为天然的三维构象及对肽链一级 结构的修饰、空间结构的修饰等。翻译后修饰使得蛋白质组 成更加多样化,从而使蛋白质结构上呈现更大的复杂性。 蛋白质合成后被定向输送到其发挥作用的靶位点的过程称为 蛋白质的靶向输送(protein targeting)。
羟基化
甲基化
磷酸化
二硫键形成 脂性修饰
3.空间结构的修饰 (1)通过非共价键亚基聚合形成具有四级结构的蛋白 质 具有四级结构的蛋白质由两条以上的肽链通过非
共价键聚合,形成寡聚体(oligomer)。
(2)辅基连接后形成完整的结合蛋白质 结合蛋白质合成后都需要结合相应辅基,才能成 为具有功能活性的天然蛋白质。
AUG
3' IF-1
起始复合物形成过程
Pi -GTP IF-2 GTP GDP
5' IF-3
AUG
3' IF-1
真核生物的翻译起始 1.核蛋白体大小亚基分离; 2.起始氨基酰-tRNA的结合; 3.mRNA在小亚基定位结合; 4.核蛋白体大亚基结合。
2.原核生物翻译延长
指在 mRNA 模板的指导下,氨基酸依次进入 核蛋白体并聚合成多肽链的过程。
的3′侧移动,使起始二肽酰-tRNA-mRNA相对位移
进入核蛋白体P位,而卸载的tRNA则移入E位。
成肽→转位→下一轮进位
fMet fMet
Tu GTP
5'
AUG
3'
肽链合成延长(核蛋白体循环)过程
进 位
成肽 转 位
真核生物翻译延长
真核生物肽链合成的延长过程与原核生物基本
相似,但有不同的反应体系和延长因子。 另外,真核细胞核蛋白体没有E位,转位时卸载 的tRNA直接从P位脱落。
延长阶段 延长因子为EF-Tu、EF-Ts和EF-G
终止阶段 释放因子为RF-1、RF-2和RF-3
延长因子为eEF-1α、eEF-1βγ和eEF-2
释放因子为eRF
(三)肽链合成后加工过程
新生多肽链不具备蛋白质的生物学活性,必须经过复杂的加
工过程才能转变为具有天然构象的功能蛋白质,这一加工过
4.合成后蛋白质可被靶向输送至细胞特定部位 蛋白质在核蛋白体上合成后,必须分选出来,定
向输送到一个合适的部位才能行使各自的生物学功能。
蛋白质的靶向输送与翻译后修饰过程同步进行。
新生蛋白质的去向
真核生物 起始氨基酰-tRNA: Met-tRNAiMet
tRNAiMet 与 甲 硫 氨 酸 结 合 后 形 成 MettRNAiMet,可以在mRNA的起始密码子AUG处 就位,参与形成翻译起始复合物。起始密码子 只能辨认Met-tRNAiMet。 参与肽链延长的甲硫氨酰-tRNA:Met-tRNAMet
过程称为氨基酸的活化。
参与氨基酸的活化的酶:氨基酰-tRNA合成酶。 氨基酰-tRNA合成酶 氨基酸 + tRNA ATP 氨基酰- tRNA AMP+PPi
特性 氨基酰-tRNA合成酶对底物氨基酸和tRNA都有高度
特异性。
tRNA
ATP
氨基酰-tRNA合成酶
氨基酰-tRNA的表示方法
各种氨基酸和对应的tRNA结合后形成的氨基酰tRNA表示为: 氨基酸的三字母缩写-tRNA氨基酸的三字母缩写 例如: 丙氨酰-tRNA:Ala-tRNAAla
精氨酰-tRNA:Arg-tRNAArg
甲硫氨酰-tRNA: Met-tRNAMet
tRNA
原核生物翻译起始
起始氨基酰-tRNA: fMet-tRNAfMet 具有起始功能的 tRNAfMet 与甲硫氨酸结合后,
甲硫氨酸很快被甲酰化为 N- 甲酰甲硫氨酸 (N-formyl
methionine, fMet) , 于 是 形 成 N- 甲 酰 甲 硫 氨 酰 tRNA(fMet-tRNAfMet) ,可以在 mRNA 的起始密码子 AUG 处就位,参与形成翻译起始复合物。起始密码 子只能辨认fMet-tRNAfMet。
isomerase, PPI)
分子伴侣主要有: 热休克蛋白(heat shock protein, HSP)
伴侣蛋白(chaperonin)
蛋白质二硫键异构酶
多肽链内或肽链之间二硫键的正确形成对稳定
分泌型蛋白质、膜蛋白质等的天然构象十分重
要,这一过程主要在细胞内质网进行。
二硫键异构酶在内质网腔活性很高,可在较大 区段肽链中催化错配二硫键断裂并形成正确二 硫键连接,最终使蛋白质形成热力学最稳定的 天然构象。
1.多肽链折叠为天然构象的蛋白质
新生肽链的折叠在肽链合成中、合成后完成,新生肽 链N-端在核蛋白体上一出现,肽链的折叠即开始。可 能随着序列的不断延伸肽链逐步折叠,产生正确的二 级结构、模序、结构域到形成完整空间构象。 一般认为,多肽链自身氨基酸顺序储存着蛋白质折叠 的信息,即一级结构是空间构象的基础。
(1)进位 又称注册(registration), 是指一个氨基酰-tRNA按照 mRNA模板的指令进入并结 合到核蛋白体A位的过程。
进位需要延长因子
EF-Tu与EF-Ts参与。
进位的反应过程:
GTP Tu Ts
Ts Tu GDP
5'
AUG
GTP
3'
(2)成肽 成肽是在转肽酶(peptidase)的催化下,核蛋白体P 位上起始氨基酰-tRNA的N-甲酰甲硫氨酰基或肽酰tRNA的肽酰基转移到A位并与A位上氨基酰-tRNA的 α-氨基结合形成肽键的过程。
3.原核生物翻译终止 指核蛋白体A位出现mRNA的终止密码子后,多
肽链合成停止,肽链从肽酰-tRNA中释出,mRNA、
核蛋白体大、小亚基等分离的过程。 终止阶段需要释放因子RF-1、 RF-2和 RF-3参 与。
释放因子的功能
识别终止密码子 RF-1特异识别UAA、UAG; RF-2特异识别UAA、UGA。 诱导转肽酶转变为酯酶活性
体形成的聚合物称为多聚核蛋白体(polysome) 。 多聚核蛋白体的形成可以使蛋白质生物合成以高
速度、高效率进行。
多聚核蛋白体
电镜下的多聚核蛋白体
真核生物翻译终止
真核生物翻译终止过程与原核生物相似,但只有
1个释放因子eRF,可识别所有终止密码子,完成原 核生物各类RF的功能。
原核生物与真核生物肽链合成过程的主要差别
肽-脯氨酰顺反异构酶 多肽链中肽酰-脯氨酸间形成的肽键有顺反两 种异构体,空间构象有明显差别。
肽酰-脯氨酰顺反异构酶可促进上述顺反两种
异构体之间的转换。
肽酰-脯氨酰顺反异构酶是蛋白质三维构象形
成的限速酶,在肽链合成需形成顺式构型时, 可使多肽在各脯氨酸弯折处形成准确折叠。
2.蛋白质一级结构修饰主要是肽键水解和化学修饰 (1)肽链末端的修饰 (2)个别氨基酸的共价修饰 糖基化
原核生物 mRNA 一条mRNA编码几种蛋白质(多顺反子 ) 转录后很少加工 转录、翻译和mRNA的降解可同时发生 核蛋白体 30S小亚基+50S大亚基 ↔ 70S核蛋白体 起始阶段 起始氨基酰-tRNA为fMet-tRNAfMet 核蛋白体小亚基先与mRNA结合,再与 fMet-tRNAfMet结合 mRNA中的S-D序列与16S rRNA 3-端的 一段序列结合 有3种IF参与起始复合物的形成 真核生物 一条mRNA编码一种蛋白质(单顺反子) 转录后进行首尾修饰及剪接 mRNA在核内合成,加工后进入胞液,再 作为模板指导翻译 40S小亚基+60S大亚基 ↔ 80S核蛋白体 起始氨基酰-tRNA为Met-tRNAiMet 核蛋白体小亚基先与Met-tRNAiMet结合, 再与mRNA结合 mRNA中的帽子结构与帽子结合蛋白复合 物结合 有至少10种eIF参与起始复合物的形成
肽链延长在核蛋白体上连续循环式进行,又 称为核蛋白体循环(ribosomal cycle),包括以 下三步: (1)进位(positioning)/注册(registration) (2)成肽(peptide bond formation)
(3)转位(translocation)
每轮循环使多肽链增加一个氨基酸残基。
原核生物翻译起始
参与肽链延长的甲硫氨酰-tRNA:Met-tRNAMet tRNAMet 和甲硫氨酸结合后生成 Met-tRNAMet , 必要时进入核蛋白体,为延长中的肽链添加甲硫氨 酸。
Байду номын сангаас
fMet-tRNAfMet 的生成是一碳化合物转移和利用 的过程之一,反应由转甲酰基酶催化,甲酰基从N10甲酰四氢叶酸转移到甲硫氨酸的α-氨基上。
终止(termination )
1.翻译起始
指mRNA和起始氨基酰-tRNA分别与核蛋白体结
合而形成翻译起始复合物的过程。 原核生物翻译起始:
核蛋白体大小亚基分离;
mRNA在小亚基定位结合;
起始氨基酰-tRNA的结合; 核蛋白体大亚基结合。
(1) 核蛋白体大小亚基分离
IF-3
催化新生肽链与结合在P位的tRNA之间的酯键 水解,使肽链从核蛋白体上释放。
RF-3可结合核蛋白体其他部位,有GTP酶活性, 能介导RF-1、RF-2与核蛋白体的相互作用。
原核肽链合成 终止过程
