生物化学第十章6
生物化学 第十章 生物氧化

(四)电子传递链的组成成分
4、细胞色素还原酶(复合体Ⅲ) cytochrome,Cyt 是含铁的Pr 以血红素为辅基 电子传递蛋白 还原型Cyt有光谱吸收现象
通过Fe3+ Fe2+ 互变起传递电子的作用
电子传递:CoQ
Cytc
• Cyta:辅基是血红素A • Cytb:------------------B • Cytc: ------------------C ——卟啉的侧链基团不同
SH 2 NAD
+
FMNH 2 2H CoQ Fe S
FAD Fe*S 复合物II Cytb - (琥珀酸脱氢酶) 2e
2+ 2C yt-Fe
2e
1 O - 2 2
S
NADH + H 2H
-
复合物I (NADH- 泛醌还原酶)
FMN Fe S
CoQH 2
2e
-
3+ 2C yt-Fe 2H+
O2-
H2O
磷
—一对电子经呼吸链传至氧所产生的ATP
分子数
反映氧化磷酸化的效率
2、有关氧化磷酸化机理的几种假说
• 化学偶联假说 • 构象偶联假说 • 化学渗透假说
(1)化学偶联假说(1953年)(掌握要点)
chemical coupling hypothesis
认为电子传递反应释放的能量通过一系列连续的化学 反应形成高能共价中间物,最后将其能量转移到ADP中形 成ATP。 AH2+B+I-OH A I+X-H+OHA I+BH2+OHX I+A+H2O
底物磷酸化 • 没有氧的参与 • 分子内部所含能量重新分配,生成高 能磷酸键 • 也称代谢物水平磷酸化
生物化学-课件10.第十章-核苷酸代谢
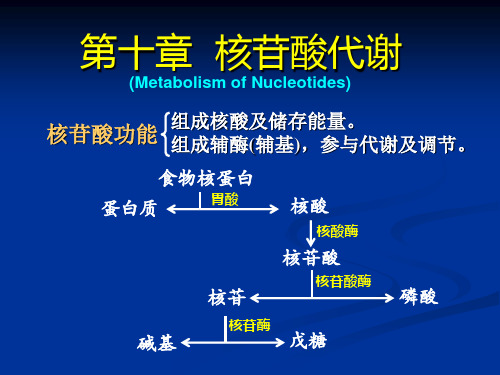
UTP CTP
嘌呤核苷酸 ATP + 5-磷酸核糖
嘧啶核苷酸
(二)嘧啶核苷酸的补救合成
1.补救合成的过程
嘧啶 + PRPP 嘧啶磷酸核糖转移酶 磷酸嘧啶核苷 + PPi
尿嘧啶核苷 + ATP 尿苷激酶 UMP +ADP
胸腺嘧啶核苷 + ATP 胸苷激酶
TMP +ADP
2.补救合成的特点 (1) 节省从头合成时的能量和氨基酸。
(2) 某些组织器官,如脑、骨髓等主要是进行 补救合成。
(三)嘧啶核苷酸的抗代谢物
1. 嘧啶类似物
O
O
HN
CH3
F HN
ON
ON
胸腺嘧啶(T)
5-氟尿嘧啶(5-FU)
2.某些改变了核糖结构的核苷类似物
NH2
NH2
NHHCl
N
N
N
ON
HO-CH2 O HH
H
H
OH OH
胞苷
ON
HO-CH2 O H HO
OH OH
N
次黄嘌呤核苷酸 (IMP)
(2)AMP和GMP的生成
HOOC-CH2-CH-COOH
O HN
N
NH
GDP+Pi N
N
NH2 延胡索酸
N
N
GTP
NN
②
NN
Asp
N
①
R 5/ P
腺苷酸代琥珀酸
H2ONADH+H+
N
O
R 5/ P AMP
O
NAD+
R 5/ P ③
HN
Gln Glu ATP HN
生物化学:第十章 三羧酸循环

The Citric Acid Cycle Oxidizes Two-Carbon Units
The cycle starts with the condensation of oxaloacetate (C4) and acetyl CoA (C2) to give citrate (C6), which is isomerized to isocitrate (C6). Oxidative decarboxylation of this intermediate gives –ketoglutarate (C5). The second molecule of carbon dioxide comes off in the next reaction, in which -ketoglutarate is oxidatively decarboxylated to succinyl CoA (C4). The thioester bond of succinyl CoA is cleaved by inorthophosphate to yield succinate, and a high phosphoryl transfer potential compound in the form of GTP is concomitantly generated. Succinate is oxidized to fumarate (C4), which is then hydrated to form malate (C4). Finally, malate is oxidized to regenerate oxaloacetate (C4). Thus, two carbon atoms from acetyl CoA enter the cycle, and two carbon atoms leave the cycle as CO2 in the successive decarboxylations catalyzed by isocitrate dehydrogenase and ketoglutarate dehydrogenase. In the four oxidation–reduction reactions in the cycle, three pairs of electrons are transferred to NAD and one pair to FAD. These reduced electron carriers are subsequently oxidized by the electrontransport chain to generate approximately 9 molecules of ATP. In addition, 1 molecule of a compound having a high phosphoryl transfer potential is directly formed in the citric acid cycle. Hence, a total of 10 molecules of compounds having high phosphoryl transfer potential are generated for each two-carbon fragment that is completely oxidized to H2O and CO 2. 44 浙江大学医学院徐立红
生物化学脂类代谢

O
R C H 2C H 2C ~ S C o A
= =
脂酰CoA 脱氢酶
β α
脂酰CoA
脱氢
FAD FADH2
O
R C H =C H C ~ S C o A
加水
⊿2--烯脂酰CoA 水化酶
β α
O
R C H O H C H 2C ~ S C o A
= = =
反⊿2-烯酰CoA
H 2O
= =
L(+)-β羟脂酰CoA
细菌和植物----7个多肽
酵母菌----2个多肽
脊椎动物----1个多肽
(1)启动
ACP转移酶
乙酰和酶复合物
(2)装载
丙二酸单酰CoA-ACP转移酶
(3)缩合
β-酮脂酰-ACP合 酶
乙酰乙酰ACP
(4)还原
β-酮脂酰-ACP 还原酶
D-β- 羟丁酰ACP
(5)脱水
α,β- 反式-丁烯酰ACP
1.部位:
组 织:肝(主要) 、脂肪等组织 亚细胞: 胞液:主要合成16碳的软脂酸(棕榈酸) 肝线粒体、内质网:碳链延长
2 饱和脂肪酸的合成
脂肪酸合成的主要途径,胞质中进行,原料为乙 酰CoA,产物是长链脂肪酸(多为软脂酸)。 反应还需:酰基载体蛋白ACP, ATP, NADPH和 Mn2+等。 合成中只有一个C2物以乙酰CoA参与整个合成过 程,其余延伸的C2物均以丙二酸单酰CoA形式参 与反应。
(三)、不饱和脂肪酸的分解
不饱和脂肪酸同样需要活化和转运才能进入线 粒体氧化,在遇到不饱和双键前进行常规的b氧化, 若遇顺式双键,必须异构为反式异构物、或底 物为D(-)b-构型需经差向异构生成L-型异构体, 才能继续b-氧化,需要异构酶和还原酶。
生物化学讲义第十章物质代谢的联系和调节

生物化学讲义第十章物质代谢的联系和调节 【目的与要求】1.熟悉三大营养物质氧化供能的通常规律与相互关系。
2.熟悉糖、脂、蛋白质、核酸代谢之间的相互联系。
3.熟悉代谢调节的三种方式。
掌握代谢途径、关键酶(调节酶)的概念;掌握关键酶(调节酶)所催化反应的特点。
熟悉细胞内酶隔离分布的意义。
熟悉酶活性调节的方式。
4.掌握变构调节、变构酶、变构效应剂、调节亚基、催化亚基的概念;5.掌握酶的化学修饰调节的概念及要紧方式。
6.熟悉激素种类及其调节物质代谢的特点。
7.熟悉饥饿与应激状态下的代谢改变。
【本章重难点】1.物质代谢的相互联系2.物质代谢的调节方式及意义3.酶的变构调节、化学修饰、阻遏与诱导4.作用于细胞膜受体与细胞内受体的激素学习内容第一节物质代谢的联系第二节物质代谢的调节第一节物质代谢的联系一、营养物质代谢的共同规律物质代谢:机体与环境之间不断进行的物质交换,即物质代谢。
物质代谢是生命的本质特征,是生命活动的物质基础。
二、三大营养物质代谢的相互联系糖、脂与蛋白质是人体内的要紧供能物质。
它们的分解代谢有共同的代谢通路—三羧酸循环。
三羧酸循环是联系糖、脂与氨基酸代谢的纽带。
通过一些枢纽性中间产物,能够联系及沟通几条不一致的代谢通路。
对糖、脂与蛋白质三大营养物质之间相互转变的关系作简要说明:㈠糖可转变生成甘油三酯等脂类物质(除必需脂肪酸外),甘油三酯分解生成脂肪酸,脂肪酸经β-氧化生成乙酰CoA,乙酰CoA或者进入三羧酸循环或者生成酮体,因此甘油三酯的脂肪酸成分不易生糖,但甘油部分能够转变为磷酸丙糖而生糖,但是甘油只有三个碳原子,只占甘油三酯的很小部分。
㈡多数氨基酸是生糖或者生糖兼生酮氨基酸。
因此氨基酸转变成糖较为容易。
糖代谢的中间产物只能转变成非必需氨基酸,不能转变成必需氨基酸。
㈢少数氨基酸能够生酮,生糖氨基酸生糖后,也可转变为脂肪酸(除必需脂肪酸外),因此氨基酸转变成脂类较为容易。
脂肪酸经β-氧化生成乙酰CoA进入三羧酸循环后,即以CO2形式被分解。
[王镜岩生物化学第三版笔记]第十章 氨基酸代谢
![[王镜岩生物化学第三版笔记]第十章 氨基酸代谢](https://img.taocdn.com/s3/m/433ff601b52acfc789ebc9ff.png)
第十章氨基酸代谢植物、微生物从环境中吸收氨、铵盐、亚硝酸盐、硝酸盐等无机氮,合成各种氨基酸、蛋白质、含氮化合物。
人和动物消化吸收动、植物蛋白质,得到氨基酸,合成蛋白质及含氮物质。
有些微生物能把空气中的N2转变成氨态氮,合成氨基酸。
第一节蛋白质消化、降解及氮平衡一、 蛋白质消化吸收哺乳动物的胃、小肠中含有胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶、羧肽酶、氨肽酶、弹性蛋白酶。
经上述酶的作用,蛋白质水解成游离氨基酸,在小肠被吸收。
被吸收的氨基酸(与糖、脂一样)一般不能直接排出体外,需经历各种代谢途径。
肠粘膜细胞还可吸收二肽或三肽,吸收作用在小肠的近端较强,因此肽的吸收先于游离氨基酸。
二、 蛋白质的降解人及动物体内蛋白质处于不断降解和合成的动态平衡。
成人每天有总体蛋白的1%~2%被降解、更新。
不同蛋白的半寿期差异很大,人血浆蛋白质的t1/2约10天,肝脏的t1/2约1~8天,结缔组织蛋白的t1/2约180天,许多关键性的调节酶的t1/2均很短。
真核细胞中蛋白质的降解有两条途径:一条是不依赖A TP的途径,在溶酶体中进行,主要降解外源蛋白、膜蛋白及长寿命的细胞内蛋白。
另一条是依赖A TP和泛素的途径,在胞质中进行,主要降解异常蛋白和短寿命蛋白,此途径在不含溶酶体的红细胞中尤为重要。
泛素是一种8.5KD(76a.a.残基)的小分子蛋白质,普遍存在于真核细胞内。
一级结构高度保守,酵母与人只相差3个a.a残基,它能与被降解的蛋白质共价结合,使后者活化,然后被蛋白酶降解。
三、 氨基酸代谢库食物蛋白中,经消化而被吸收的氨基酸(外源性a.a)与体内组织蛋白降解产生的氨基酸(内源性a.a)混在一起,分布于体内各处,参与代谢,称为氨基酸代谢库。
氨基酸代谢库以游离a.a总量计算。
肌肉中a.a占代谢库的50%以上。
肝脏中a.a占代谢库的10%。
肾中a.a占代谢库的4%。
血浆中a.a占代谢库的1~6%。
肝、肾体积小,它们所含的a.a浓度很高,血浆a.a是体内各组织之间a.a转运的主要形式。
生物化学(第三版)第十章 酶的作用机制和酶的调节课后习题详细解答_ 复习重点

第十章酶的作用机制和酶的调节提要酶的活性部位对于不需要辅酶的酶来说,就是指酶分子中在三维结构上比较靠近的几个氨基酸残基负责与底物的结合与催化作用的部位,对于需要辅酶的酶来说,辅酶分子或辅酶分子上的某一部分结构,往往也是酶活性部位的组成部分。
酶活性部位有6个共同特点。
研究酶活性部位的方法有:酶分子侧链基团的化学修饰法,动力学参数测定法,X射线晶体结构分析法和定点诱变法,这些方法可互相配合以判断某个酶的活性部位。
酶是催化效率很高的生物催化剂,这是由酶分子的特殊结构所决定的。
经研究与酶催化效率的有关因素有7个,即底物和酶的邻近效应与定向效应,底物的形变与诱导契合,酸碱催化,共价催化,金属离子催化,多元催化和协同效应,活性部位微环境的影响。
但这些因素不是同时在一个酶中其作用,也不是一种因素在所有的酶中起作用,对于某一种酶来说,可能分别主要受一种或几种因素的影响。
研究酶催化的反应机制,始终是酶学研究的一个重点,通过大量的研究工作,已经对一些酶的作用机制有深入了解,该章对溶解酶、胰核糖核酸酶A、羧肽酶A、丝氨酸蛋白酶、天冬氨酸蛋白酶等的催化作用机制进行了详尽的讨论。
酶活性是受各种因素调节控制的,除了在第8章中已介绍的几种因素外,主要还有①别构调节,例如ATCase。
②酶原的激活,如消化系统蛋白酶原的激活及凝血系统酶原的激活。
③可逆共价修饰调控,如蛋白质的磷酸化,一系列蛋白激酶的作用。
通过以上作用,使酶能在准确的时间和正确的地点表现出它们的活性。
别构酶一般都是寡聚酶,有催化部位和调节部位,别构酶往往催化多酶体系的第一步反应,受反应序列的终产物抑制,终产物与别构酶的调节部位相结合,由此调节多酶体系的反应速率。
别构酶有协同效应,[S]对υ的动力学曲线呈S形曲线(正协同)或表现双曲线(负协同),两者均不符合米氏方程。
ATCase作为别构酶的典型代表,已经测定了其三维结构,详细研究了别构机制和催化作用机制。
为了解释别构酶协同效应的机制,有两种分子模型受到人们重视,即协同模型和序变模型。
生物化学第十章核酸的酶促降解和核苷酸代谢

①腺苷酸代琥珀酸合成酶 ③IMP脱氢酶
②腺苷酸代琥珀酸裂医解学p酶pt ④GMP合成酶
19
• 嘌呤核苷酸从头合成特点
• 嘌呤核苷酸是在磷酸核糖分子上逐步合成的。 • IMP的合成需5个ATP,6个高能磷酸键。
AMP或GMP的合成又需1个ATP。
医学ppt
20
(3)嘌呤核苷酸合成补救途径
参与补救合成的酶:
医学ppt
27
(4). dTMP或TMP的生成
脱氧核苷酸还原酶
UDP
dUDP
CTP CDP dCDP dCMP
TMP合酶
dUMP
N5, N10-甲烯FH4
FH2
FH4 FH2还原酶 NADP+ NADPH+H+
脱氧胸苷一磷酸
dTMP
医学ppt
28
(5) 嘧啶核苷酸的补救合成
嘧啶 + PRPP 嘧啶磷酸核糖转移酶 磷酸嘧啶核苷 + PPi
六核苷酸,粘端切口 六核苷酸,粘端切口
Sal I
‥ ‥G T C G A C ‥‥ ‥ ‥C A G C T G ‥‥
六核苷酸,粘端切口
Sma I
‥ ‥
‥C ‥G
C G
CG GC
G C
G C
‥‥ ‥‥医学ppt
六核苷酸,平端切口 9
限制性内切酶的命名和意义
例:Eco R I,这是从大肠杆菌(Ecoli)R菌珠中分离出的一种限
AMP
AT医P学ppt ADP
21
•补救合成的生理意义
补救合成节省从头合成时的能量和一些氨 基酸的消耗。
体内某些组织器官,如脑、骨髓等只能进 行补救合成。
医学ppt
东北师范大学生物化学 第十章氨基酸代谢

必需氨基酸
(氨基酸和糖的转 变是不可逆的)
酮体
生酮兼生糖氨基酸
Tyr(酪),Phe(苯),Ile(异), Trp(色)
生酮氨基酸 Lys Leu 生糖氨基酸:
三 氨基酸合成代谢 非必需氨基酸(10) 必需氨基酸(8):
Phe 、Met 、 Thr、 Val、 Leu、 Lys、Trp、Ile
半必需氨基酸:His Arg
NAD+ + H2O + (NADP+)
+ NH4+ + NADH +H+ (NADPH)
在动物体内辅酶为NAD+,在植物体内辅酶为NADP+
非必需氨基酸由相应的α -酮酸氨基化生成
八种必需氨基酸中,除赖氨酸和苏氨酸外其余六种亦可由相 应的α-酮酸加氨生成。但和必需氨基酸相对应的α-酮酸不能 在体内合成,所以必需氨基酸依赖于食物供应。
一 蛋白质的酶促降解
(一)外源蛋白质的降解
(二)内源蛋白质的降解
(一)外源蛋白质的降解(细胞外途径)
1 蛋白质的消化
胃蛋白酶:水解芳香族氨基酸的羧基形成的肽键
胰蛋白酶:水解碱性氨基酸羧基形成的肽键
肽链内切酶
胰凝乳蛋白酶:水解芳香族氨基酸的羧基形成 的肽键
弹性蛋白酶:脂肪族氨基酸的羧基形成的肽键 氨肽酶
肝脏是合成尿素的主要器官,肾脏是排出尿素的主要器官
氨基甲酰磷酸合成酶
一种在线粒体中参与尿素的合成
一种在细胞质中参与嘧啶的从头合成
尿素合成的特点: 主要在肝脏的线粒体和胞液中进行 一分子尿素需消耗4个 高能磷酸键 精氨琥珀酸合成酶是尿素合成的关键酶 尿素分子中的两个氮原子,一个来源于NH3, 一个来源于天冬氨酸
生物化学_第十章_物质代谢的调节

细胞核:核酸合成
内质网:蛋白质合 成;磷脂合成
真核细胞主要代谢途径与酶的区域分布
代谢途径(酶或酶系) 细胞内分布 代谢途径(酶或酶系) 细胞内分布 糖酵解 三羧酸循环 磷酸戊糖途径 糖异生 糖原合成与分解 脂肪酸β氧化 脂肪酸合成 呼吸链 多种水解酶 磷脂合成 胞质 线粒体 胞质 胞质 胞质 线粒体 胞质 线粒体 溶酶体 内质网 氧化磷酸化(呼吸链) 线粒体 尿素合成 胞质、线粒体 蛋白质合成 内质网、胞质 DNA合成 细胞核 mRNA合成 细胞核 tRNA合成 核质 rRNA合成 核仁 血红素合成 胞质、线粒体 胆红素生成 微粒体、胞质 胆固醇合成 内质网、胞质
酮体 乳酸 游离脂酸 葡萄糖
• 以葡萄糖有氧氧化供能为主
(六)红细胞
•能量主要来自糖酵解
(七)肾脏
• 也可进行糖异生和生成酮体; • 肾髓质主要由糖酵解供能;肾皮质主要由脂酸、 酮体有氧氧化供能。
第 二 节 物质代谢的相互联系
Metabolic Interrelationships
一、在能量代谢上的相互联系
酶的隔离分布的意义 —— 避免了各种代谢途径互相干扰,而且有利于它们协调 地发挥作用。
(二)细胞内物质代谢调节的基本方式
在一个代谢途径中,其速率和方向不完全由途径的所 有酶决定和调节,而是由其中的一个或几个具有调节作用
的酶所决定,这些酶称为调节酶(regulatory enzymes)、
关键酶(key enzymes)。或限速酶(rate-limiting enzyme)。由此酶催化的反应称为限速反应。限速酶活性 改变不但可以影响整个酶体系催化反应的总速率,甚至还 可以改变代谢反应的方向。
调节或细胞水平代谢调节。
高等生物 —— 三级水平代谢调节
第十章__代谢总论--王镜岩《生物化学》第三版笔记(完美打印版)

四、信息来源
生物大分子有两种组装模式:
1.模板指导组装核酸和蛋白质的合成,都以先在的信息分子为模板。如DNA复制、转录以及反转录、翻译都是在模板指导下的聚合过程。所需的信息存在于模板分子的构件序列中,能量来自活化的构件分子或ATP等。生物大分子形成高级结构并构成亚细胞结构是自我组装过程,其信息存在于一级结构中,其能量来自非共价作用力,即组装过程中释放的自由能。
3.其它高能化合物
UTP参与多糖合成,CTP参与脂类合成,GTP参与蛋白质合成。
烯醇酯、硫酯等也是高能化合物,如磷酸烯醇式丙酮酸、乙酰辅酶A等。高能化合物根据键型可分为磷氧键型、氮磷键型、硫酯键型、甲硫键型等,绝大多数含磷酸基团。
磷酸肌酸和磷酸精氨酸可通过磷酸基团的转移作为储能物质,称为磷酸原。磷酸肌酸是易兴奋组织如肌肉、脑、神经等唯一能起暂时储能作用的物质ΔG0’为-10.3千卡/摩尔,是ATP的能量储存库。肌肉中的含量比ATP高3-4倍,可维持ATP水平的恒定。磷酸精氨酸是无脊椎动物肌肉中的储能物质,与磷酸肌酸类似。
2.酶促组装有些构件序列简单均一的大分子通过酶促组装聚合而成。其信息指令来自酶分子,不需要模板。如糖原、肽聚糖、一些小肽等,都在专一的酶指导Fra bibliotek催化下合成。
第三节 分解代谢
一、阶段性和趋同性
生物大分子的分解有三个阶段:水解产生构件分子、氧化分解产生乙酰辅酶A、氧化成二氧化碳和水。在这个过程中,随着结构层次的降低,倾向产生少数共同的分解产物,即具有趋同性。
2.ATP及其偶联作用
生物体内的放能和需能反应经常以ATP相偶联。ATP可分解为ADP或AMP。前者如各种激酶,后者如乙酰辅酶A的合成。反应过程中有的由一个酶催化,如谷氨酰胺合成酶,先生成磷酰谷氨酸中间物,它是谷氨酸的活化形式,再与氨反应;有的需多个酶参与,如蔗糖的合成需3个酶,首先生成葡萄糖6磷酸的活化形式;也有的没有ATP直接参与,如苹果酸生成草酰乙酸,是需能反应,利用下一步由草酰乙酸生成柠檬酸时高能硫酯键放能促进其反应。
生物化学(本科)第十章-基因表达调控及其相关细胞信号转导通路-随堂练习与参考答案

生物化学(本科)第十章基因表达调控及其相关细胞信号转导通路
随堂练习与参考答案
第一节概述第二节原核基因的转录调控第三节真核基因的转录调控第四节相关细胞信号转导通路
1. (单选题)基因表达调控的基本控制点是( )
A. 基因结构活化
B. 转录起始
C. 转录后加工
D. 蛋白质翻译及翻译后加工
E. mRNA从细胞核转运到细胞浆
参考答案:B
2. (单选题)分解代谢物基因激活蛋白(CAP)对乳糖操纵子表达的影响是( )
A. 正性调控
B. 负性调控
C. 正性调控、负性调控都可能
D. 无调控作用
E. 可有可无
参考答案:A
3. (单选题)阻遏蛋白识别操纵子中的( )
A.启动基因
B.结构基因
C.操纵基因
D.内含于
E.外显子
参考答案:C
4. (单选题)目前认为基因表达调控的主要环节是( )
A. 翻译后加工
B. 转录起始
C. 翻译起始
D. 转录后加工
E. 基因活化
参考答案:B。
大学生物化学课件物质代谢的联系和调节

(3)肝在蛋白质代谢中的作用
1. 合成多种血浆蛋白质
(四)共同代谢池
体外摄入的营养物或体内各组织细胞的代谢物, 只要是同一化学结构的物质,在进行中间代谢 时,不分彼此,参加到共同的代谢池中参与代 谢,机会均等。 葡萄糖、 氨基酸
(五)ATP是机体能量利用的共同形式 (六) NADPH是合成代谢所需还原当量
第二节 物质代谢的相互联系
一、在能量代谢上的相互联系
全部清蛋白、凝血酶原、纤维蛋白原、Apo A、B、C、 E,部分a1, a2, β球蛋白。
2. AA合成与分解的主要器官。
3. 生成尿素的器官。 肝昏迷氨中毒
(4)肝参与多种维生素和辅酶的代谢 (略)
1. 肝在脂溶性维生素吸收和血液运输中的作用 胆汁酸参与维生素A,D,E,K的吸收。 血液中的运输:视黄醇结合蛋白 维生素D结合蛋白
(二)糖代谢与AA代谢的联系
1. 糖
NEAA (12种)
2. AA 糖 (18种,糖异生,除Leu, Lys)
必需AA 生糖AA 生酮AA 生糖兼生酮AA
(三)脂类代谢与AA代谢的相互联系
1. AA CH3CO-ScoA
FA、胆固醇
2. AA 是合成PL的原料 丝AA、乙醇胺、甲硫AA、胆碱(p160) 肉碱(β-氧化,p156)
饥饿:脂肪动员,脂肪组织分解TG为甘油和FA,释放入血。
6 . 肾:
糖异生、糖酵解、酮体生成 肾髓质,无线粒体,只能酵解供能 肾皮质,主要利用FA、酮体供能
生物化学:10-糖酵解
1
大分子分解 为小分子
细胞质中: 小分子进入细胞, 通过糖酵解被代 谢为丙酮酸,伴 随着少量ATP和 NADH的产生
线粒体中,有氧 条件下: 丙酮酸转变为乙 酰辅酶A,完全 氧化伴随着大量 ATP和NADH的 产生
2
本章提纲
第一节 糖的消化与吸收
第一节 第第二二节节
糖第第的概 单一二分述 糖节 节解代概 单谢 述 糖
4
唾液 淀粉酶
糖类食物
咀嚼、 部分水解
胃 HCl
第一节 糖的消化与吸收
有限水解
糖的吸收就是指游 离的葡萄糖(单糖) 进入到生物体内的 过程(肠粘膜吸 收)。
小肠
胰淀粉酶
a-糊精、麦芽糖和少量葡萄糖 糖苷酶
单糖
吸收
5
第二节 糖的分解代谢
(有氧和无氧)
6
第二节 糖的分解代谢
乳酸发酵 乙醇发酵
7
第二节 糖的分解代谢
己糖激酶与葡萄糖结合时的构象变化
21
己糖激酶具有催化相对 不专一性,对于甘露糖、 果糖和氨基葡萄糖等六 碳糖都有催化作用。
葡萄糖
己糖激酶与葡萄糖结合时的构象变化
22
第二节 糖的分解代谢
23
第二节 糖的分解代谢
2、葡萄糖-6-磷酸异构酶催化葡萄糖-6-磷酸转化为果糖6-磷酸
反应是可逆的 24
磷 酸 葡 萄 糖 异 构 酶 催 化 机 理
代谢途径中,催化不可逆反应的酶所处的部位是控 制代谢反应的有力部位 (一)、己糖激酶的调节 (二)、磷酸果糖激酶的调节(最关键) (三)、丙酮酸激酶的调节
48
第三节 糖酵解作用的调节(p83)
(一)、己糖激酶的调节
生物化学:第十章生化分离技术与应用-习题

⽣物化学:第⼗章⽣化分离技术与应⽤-习题第⼗章⽣化分离技术和应⽤⼀、选择题⒈下列哪种⽅法可⽤于测定蛋⽩质的分⼦量()A、SDS聚丙烯酰胺凝胶电泳法;B、280/260nm紫外吸收⽐值;C、凯⽒定氮法;D、荧光分光光度法;E、Folin酚试剂法⒉氨基酸和蛋⽩质共有的理化性质为()A、胶体性质;B、两性性质;C、沉淀性质;D、变性性质;E、双缩脲性质⒊蛋⽩质溶液的稳定因素为()A、蛋⽩质溶液为真溶液;B、蛋⽩质在溶液中做布朗运动;C、蛋⽩质分⼦表⾯带有⽔化膜和同性电荷;D、蛋⽩质溶液的黏度⼤;E、以上都不对⒋关于蛋⽩质在等电点时的特性描述,哪项是错误的?()A、导电性最⼩;B、溶解度最⼩;C、黏度减⼩;D、电泳迁移率最⼩;E、以上都不对⒌今有①、②、③、④、四种蛋⽩质的混合液,等电点分别为:5.0、8.6、6.8和9.2 ,在pH8.6的条件下进⾏电泳分离,四种蛋⽩质电泳区带⾃正极的排列顺序为:()A、①、③、②、④;B、①、②、③、④;C、④、②、③、①;D、③、②、①、④;E、②、④、③、①;⒍盐析沉淀蛋⽩质的原理为()A、中和电荷,破坏⽔化膜;B、与蛋⽩质结合成不溶性盐;C、次级键断裂,蛋⽩质构象改变;D、调节蛋⽩质溶液的等电点;E、以上都不是⒎关于下列多肽Glu-His-Arg-Val-Lys-Asp的叙述,哪个是错的?()A、在pH12时,在电场中向阳极移动;B、在pH3时,在电场中向阴极移动;C、在pH5时,在电场中向阴极移动;D、在pH11时,在电场中向阴极移动;E、该肽的等电点⼤约在pH8⒏⽤下列⽅法测定蛋⽩质含量,哪⼀种⽅法需要完整的肽键()A、双缩脲反应;B、凯⽒定氮;C、紫外吸收;D、茚三酮;E、奈⽒试剂⒐蛋⽩质⽤硫酸铵沉淀后,可选⽤透析法除去硫酸铵,要确定硫酸铵是否从透析袋中除净,你选⽤下列哪⼀种试剂检查()A、茚三酮试剂;B、奈⽒试剂;C、双缩脲试剂;D、Folin-酚试剂;E、斐林试剂⒑将抗体固定在层析柱的载体上,使抗原从流经此柱的蛋⽩质样品中分离出来,这种技术属于()A、吸附层析;B、离⼦交换层析;C、分配层析;D、亲和层析;E、凝胶过滤⒒若⽤电泳分离Gly-Lys、Asp-Val和Ala-His三种⼆肽,在下列哪个pH值条件下电泳最合适()A、pH2以下;B、pH2-4;C、pH7-9;D、pH10-12;E、pH12以上;⒓进⾏疏⽔层析时,以下哪种条件⽐较合适?()A、在有机溶剂存在时上柱,低盐溶液洗脱;B、在有机溶剂存在时上柱,⾼盐溶液洗脱;C、在低盐条件下上柱,⾼盐溶液洗脱;D、在⾼盐条件下上柱,按低盐、⽔和有剂溶剂顺序洗脱;E、低盐缓冲液上柱,低盐洗脱⒔对⼀个富含His残基的蛋⽩质,在使⽤离⼦交换层析时应优先考虑()A、严格控制蛋⽩质上样液的浓度;B、严格控制盐浓度;C、严格控制NaCl的浓度;D、严格控制洗脱液的pH值;E、严格控制洗脱液的体积⒕定性鉴定20种氨基酸的双向纸层析是()A、交换层析;B、亲合层析;C、分配层析;D、薄层层析⼆、判断是⾮⒈⽤凝胶过滤法分离蛋⽩质时,总是分⼦质量⼤的蛋⽩质⾸先被洗脱下来。
食品生物化学第十章 食品添加剂与食品加工

第二节 防 腐 剂
(3)使用注意事项 配制山梨酸溶液时,可先将山梨酸溶解在乙醇、碳 酸氢钠或碳酸钠的溶液中,随后再加入食品中。 3.对羟基苯甲酸酯类 (1)性状 对羟基苯甲酸酯为无色结晶或白色结晶粉末,是苯甲酸的衍 生物。它几乎无臭、无味,稍有特殊的味觉;难溶于效力较山梨酸和苯甲酸大。对羟基苯甲酸酯类(甲、乙、丙、异丙、 丁、异丁、庚等酯)的抑菌效果比较稳定,不随pH值的变化而变化, 当pH值为4~8时效果较好;其毒性低于苯甲酸,高于山梨酸;其作 用主要是抑制细胞呼吸酶活性,破坏细胞膜结构;其抑菌作用随烷 基链的增长而增加,而溶解度则随酯基碳链的增长而下降。
第三节 抗 氧 化 剂
(1)性状 丁基羟基茴香醚为白色或微黄色粉末,对热、弱碱稳定,长 时间光照可变色,其中,3-BHA的抗氧化效果比2-BHA高1.5~2倍; 在猪油中加入50ppmBHA可使其贮藏期延长5倍,与其他抗氧化剂共 用时效果更佳,其顺序是:BHA+BHT>BHA+PG>BHT+PG。BHA与 抗氧化增效剂共用时的效果也很明显,如同柠檬酸的共用,两者混 合后有一定的协同作用。BHA对动物脂肪的抗氧化性较强,对不饱 和植物油的抗氧化性较弱。
第三节 抗 氧 化 剂
一、抗氧化剂的分类及其作用机理 抗氧化剂指能防止食品成分因氧化引起变质的一类添加剂,主要是 应用于防止油脂和其他富含脂类食品的氧化酸败,从而可以提高食 品的稳定性和延长保存期。 二、常用油溶性抗氧化剂 油溶性抗氧化剂能均匀地分布于油脂中,对油脂或含脂肪的食品可 以很好地发挥其抗氧化作用。 1.丁基羟基茴香醚(BHA)
一、食品添加剂的概念及使用要求 1.食品添加剂的概念 2.食品添加剂的由来与现状 3.食品添加剂的使用要求 二、食品添加剂的作用 1)防止食品腐败变质的添加剂有防腐剂、抗氧化剂和杀菌剂。 2)改善食品感官性状的添加剂有鲜味剂、甜味剂、酸味剂、色素、 香料、香精、发色剂、漂白剂和抗结块剂。 3)保持和提高食品质量的添加剂如组织改良剂、面粉面团质量改良 剂、膨松剂、乳化剂、增稠剂和被膜剂。 4)改善和提高食品营养的添加剂有维生素、氨基酸和无机盐。 5)便于食品加工制造的添加剂有消泡剂、净化剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
结束
干扰素的作用机制
1.干扰素诱导eIF2磷酸化而失活
2.干扰素诱导病毒RNA降解
(三)毒素
1.白喉毒素(diphtheria toxin)
某些毒素能在肽链延长阶段阻断蛋白质合成而呈
现毒性,如白喉毒素是真核细胞蛋白质合成的抑 制剂,它作为一种修饰酶,可使 eEF-2 发生 ADP 糖基化共价修饰,生成 eEF-2 腺苷二磷酸核糖衍 生物,使eEF-2失活。
生物化学
(供护理、助产专用)
ห้องสมุดไป่ตู้
海南医学院
王青松
第十一章
基因信息传递
第三节
蛋白质的生物合成(翻译)
Protein Biosynthesis (Translation)
三、蛋白质生物合成的干扰和抑制
蛋白质生物合成是很多天然抗生素和某些毒素的作 用靶点。抗生素等就是通过阻断真核、原核生物蛋 白质翻译体系某组分功能、干扰和抑制蛋白质生物 合成过程而起作用的。 可针对蛋白质生物合成必需的关键组分作为研究新 抗菌药物的作用靶点。同时尽量利用真核、原核生 物蛋白质合成体系的任何差异,以设计、筛选仅对 病原微生物特效而不损害人体的药物。
干扰素分为 α- (白细胞)型、 β- (成纤维细胞 )型和 γ- (淋巴细胞)型三大类,每类各有亚 型,分别具有其特异作用。
干扰素抑制病毒的作用机制有两方面:
一是干扰素在某些病毒双链RNA存在时,能诱导 特异的蛋白激酶活化,该活化的蛋白激酶使 eIF-2 磷酸化而失活,从而抑制病毒蛋白质合成; 二是干扰素能与双链 RNA共同活化特殊的 2ˊ-5ˊ寡 聚腺苷酸( 2ˊ-5ˊA )合成酶,催化 ATP 聚合,生 成单核苷酸间以 2ˊ-5ˊ 磷酸二酯键连接的 2ˊ-5ˊA , 经2ˊ-5ˊA活化核酸内切酶RNase L,后者可降解病 毒mRNA,从而阻断病毒蛋白质合成。
(一)许多抗生素通过抑制蛋白质生物合成发挥作用
抗生素 (antibiotics)是一类由某些真菌、细菌等
微生物产生的药物,有抑制其他微生物生长或杀死
其他微生物的能力,对宿主无毒性的抗生素可用于
预防和治疗人、动物和植物的感染性疾病。
常用抗生素抑制蛋白质生物合成的原理与应用
抗生素 四环素、土霉 素 链霉素、新霉 素、巴龙霉素 氯霉素、林可 霉素、红霉素 嘌呤霉素 放线菌酮 作用位点 原核核蛋白体小亚 基 原核核蛋白体小亚 基 原核核蛋白体大亚 基 原核、真核核蛋白 体 真核核蛋白体大亚 基 作用原理 抑制氨基酰-tRNA与小亚 基结合 应用 抗菌药
改变构象引起读码错误、 抗菌药 抑制起始 抑制转肽酶、阻断肽链延 抗菌药 长 使肽酰基转移到它的氨基 抗肿瘤药 上后脱落 抑制转肽酶、阻断肽链延 医学研究 长
嘌呤霉素作用示意图
(二)干扰素
干扰素(interferon, IFN)是真核细胞被病毒感染
后分泌的一类具有抗病毒作用的蛋白质,可抑
制病毒的繁殖。
白喉毒素的作用机理:
2.蓖麻蛋白(ricin)
蓖麻蛋白是蓖麻籽中所含的植物糖蛋白,由A、 B两条多肽链组成。
A链是一种蛋白酶,可作用于真核生物核蛋白体 大亚基的28S rRNA,催化其中特异腺苷酸发生脱 嘌呤基反应,使28S rRNA降解,使核蛋白体大亚 基失活;
B链对A链发挥毒性具有重要的促进作用,且B链 上的半乳糖结合位点也是毒素发挥毒性作用的活 性部位。
