14-夏禄华-非无菌药品共线生产风险评估(精简版)
品种共用生产线的风险评估报告

品种共用生产线的风险评估报告一、公司品种、生产线简介1、品种:我公司现有产品4个:●甲疫苗(2011S00831);●乙疫苗(2007S00826);●甲结合疫苗(2007B02129);●丙疫苗(2011S01038);2、生产线共用情况该四个品种部分生产过程存在共线生产的情况,其中甲疫苗;乙疫苗;甲结合疫苗;丙疫苗的多糖生产工序共用现有生产线的疫苗一室发酵区、纯化区;甲结合疫苗和丙疫苗的结合物原液工序共用现有生产线的疫苗二室结合物生产车间;同时四个产品的分包装为共线生产,但分装所用的配制系统、灌装系统(硅胶管、蠕动泵、陶瓷泵、分液器)均为独立系统,不存在混用的情况。
二、共用生产线风险评估GMP(2010年修订)附录3中规定如下:第十五条在生产过程中使用某些特定活生物体的阶段,应当根据产品特性和设备情况,采取相应的预防交叉污染措施,如使用专用厂房和设备、阶段性生产方式、使用密闭系统等。
第十六条灭活疫苗(包括基因重组疫苗)、类毒素和细菌提取物等产品灭活后,可交替使用同一灌装间和灌装、冻干设施。
每次分装后,应当采取充分的去污染措施,必要时应当进行灭菌和清洗。
按照GMP要求(第四十六条应当综合考虑药品的特性、工艺和预定用途等因素,确定厂房、生产设施和设备多产品共用的可行性,并有相应评估报告),针对目前公司4个品种部分工序共用生产线的情况,我们进行了质量风险评估。
1、风险识别:甲疫苗;乙疫苗;甲结合疫苗;丙疫苗的多糖生产为共用生产线,可能存在不同型别多糖的交叉污染;甲结合疫苗和丙疫苗共用多糖结合物生产线,可能存在不同品种残留的交叉污染;现有4个产品共用分包装线,可能存在不同品种残留的交叉污染。
2、风险分析:2.1疫苗原液生产线1区、2区共用生产线风险评估甲疫苗;乙疫苗;甲结合疫苗;丙疫苗共用生产线:疫苗原液生产线1区、2区甲疫苗为A群某球菌、C群某球菌发酵,提取和纯化,获得某球菌荚膜多糖抗原,混合后加入适当稳定剂冻干制成。
共线生产风险评估报告

风险评估报告一、前言我公司灌装等车间装修于2011年;为了降低污染和交叉污染的风险;并根据所生产产品的特性、工艺流程及相应洁净度级别要求;对厂房、生产设施和设备进行了合理设计、选型和布局;于2013年6月取得SGS公司颁发GMPC证书并每年验证审核;2016年1月13日、5月26日由市区质量监督质量检验所验证洁净区空气洁净度达到10万级水平、次清洁区符合标准并颁发报告..本报告拟对生产共线产品安全进行风险评估;以期对其生产安全风险能正确认识并采取降低安全风险预见的控制措施;使生产质量的风险降低到可以接受的水平..二、目的本报告是对公司多品种共线生产的安全性进行风险管理的报告;报告对多品种共线生产过程中可能产生混淆和交叉污染的风险要素进行分析判定..对于每种风险可能产生损害的严重度S和危害的发生概率P进行估计..在某一风险水平不可接受时;提出降低风险预见的控制措施;以期将剩余风险降低到可以接受的水平..三、适用范围本报告适用于综合生产车间灌装线、乳化制作生产线的产品生产四、引用资料化妆品安全技术规范2015年版、本公司ISO22716\GMPC质量管理体系文件等相关资料..五、共线产品说明1、共线产品情况2、共线产品特性3、共线产品生产工艺及预期用途4、公司厂房、公用设施、设备及防污染与交叉污染情况说明本公司生产厂房—乳化制作和灌装车间;车间为封闭式厂房;室内墙和吊顶采用表面光滑、易清洗的彩钢板防火材料;为专用生产车间..2楼灌装间内设的5台灌装生产设备;3楼灌装间为3台灌装生产设备;2楼半自动灌装生产设备生产膏霜乳液产品;其余设备生产一般液态产品..空调系统两条;灌装、静置间相互独立的送风系统;每条系统均有一台独立的中央空调箱;初、中效过滤器采用联袋式无纺布过滤袋..回风与进风混合开初效前;用止回阀防止新风倒灌;在空调箱中;新风和回风一起经初级过滤后;经温湿度调节;最后经中效过滤后;由风管送至每个房间独立的高效送风口;为生产区提供净化空气..其中灌装生产线有多组空气净化系统:模块化风冷式热水机组ZJ TCA201CC;组合式空调机组ZK012-4MR、净化通风换气柜式机组KPG065-JHT、风管送风式空调机组FG12/A2-N4;空气压缩机G22PA 85FA;储气罐1502A-80;空气干燥机ND-30 AC为灌装、静置间、储瓶洁净包材等空间十万级区域提供净化空气;排风均经过高效过滤排放;各生产线、空调系统互不干扰..纯化水系统采用一级反渗透+二级反渗透;产水量为5吨/小时..原水经砂滤、活性炭过滤、保安过滤、一级反渗透、二级反渗透后进入贮罐..贮罐中的纯化水再经紫外灯消毒后送入循环管道..贮罐和循环管道均采用内壁抛光的316L不锈钢;贮罐的通气口安装μm的疏水性除菌滤器..纯化水储罐和输送管道定期用热水及75%酒精消毒;炭滤器定期用巴氏消毒..压缩空气为采用:空气→螺杆空压机→冷却储气罐→油水分离器→冷干机→常规保护过滤器→精密过滤器→活性炭过滤器→各压缩空气使用岗位→聚四氟过滤→使用点..进入洁净车间的管道采用304不锈钢..灌装线的生产设备主要有给袋式自动包装机、半自动液体灌装机、宇航脚踏式灌装半自动订机等Modelno 自动灌装机;每台设备分别生产护肤水类2楼1、2、3机;3楼3机、护发清洁类2楼4机、啫喱类2楼5机、护肤清洁类3楼1机、护发类产品3楼2机车间工艺流程布局基本合理;人流、物流分开;生产工序按工艺要求划分为一般生产区、十万级洁净区储瓶间铝塑复合袋及膜纸等消毒区;容器具清洗间;灌装车间等;有相应的更衣室、卫生通道、缓冲区..为了防止产品的交叉污染和混淆;车间每一操作间及生产用设备、容器均有能够指明正在生产的产品或物料的名称、批号及数量等的状态标志..生产用的设备、容器、输送液体的管道等用后均立即按规定进行清洁..各生产操作严格依照公司管理规定和岗位操作法执行;有防止物料混淆、交叉污染的检查和措施..车间生产采用的是阶段性生产;一个品种生产结束清场合格后才生产另外的品种;避免了混淆的发生..车间按生产区域环境、个人、设备工具、物料的卫生要求;建立有清洁卫生制度及清洁规程;定期检查并记录..质量管理部派专职IPQC到车间代表质量管理部行使质量监督管理的职权;对产品生产的全过程实行质量监控;各工序配备兼职质检员对进入工序的原辅料、进入下道工序的中间产品、半成品进行质量监督;管理监督层次清晰;能够保证生产产品质量..品、半成品进行质量监督;管理监督层次清晰;能够保证生产产品质量..六、多品种共线生产风险识别15大类产品为化妆品一般液态单元或膏霜乳液单元;基本工艺流程相同;因此确定了制作乳化时产品共线的可行性..2沿工艺路线;产品的共线生产从配制开始;液洗锅、乳化锅在配制时等为产品共用;存在残留超标风险;包装存在清场不彻底的风险..3灌装环节共有8台2楼、3楼合计灌装设备;避免灌装环节的交叉污染风险..七、风险分析根据产品生产工艺;我们对车间生产可能出现的导致产品质量风险进行分析;认为多品种共线产品引起的交叉污染主要存在可以从以下几个方面分析:1、多品种共用生产厂房情况:厂房从设计上易于清洁、维护、保养;符合特殊产品生产要求2、工艺布局、人流、物流情况:工艺布局设计合理;人流、物流分开;各操作区域能得到有效控制..3、共用设备清洁不彻底;及清洁的有效性:①3台真空乳化锅:分别生产护发清洁类、护肤清洁类、护发类产品;且每次换线生产时;均用自来水、酒精、过滤水进行设备清洁;交叉污染的风险可以接受..②液洗锅:分别生产护肤水类产品;且每次换线生产时;均用自来水、酒精、过滤水进行设备清洁;交叉污染的风险可以接受..③称量:分别按指令称量原辅料..在称量过程可能存在交叉污染的风险④配料:不同产品共用称量设备;但分包装称量;取样器具不同;且自来水—酒精-过滤水清洁彻底;风险较小..⑤无菌过滤:滤芯专用;滤壳、管路产品共用;定期更换和清洁;风险较小..⑥灌装:8台灌装设备;针对不同类别产品灌装;风险较小..⑦封口:每条生产线有兼职检验员每件检查和专职巡检关注;风险较小..⑧烟包:人工目检;产品已密闭;产生交叉污染的风险可以接受..⑨包装:包装生产线有专职巡检和兼职检验人员关注外观和重量等指标;QA清场检查;产生混淆的风险可以接受..4、物料管理暴露状态:从物料在贮存、使用、加工过程中因物料管理及暴露可能产生污染与交叉污染的风险..七、风险等级评估方法FMEA说明1、进行风险评估所用的方法遵循FMEA 技术失效模式与影响分析;它包括以下几风险确认:可能影响产品质量、产量、工艺操作或数据完整性的风险..风险判定:包括评估先前确认风险的后果;其基础建立在严重程度、可能性及可检测性上..严重程度S:测定风险的潜在后果;主要针对可能危害产品质量、病患健康及数据完整性的影响..严重程度分为四个等级;如下:可能性程度P:测定风险产生的可能性..根据积累的经验、工艺/操作复杂性知识或小组提供的其他目标数据;可获得可能性的数值..为建立统一基线;建立以下等可检测性D:在潜在风险造成危害前;检测发现的可能性;定义如下:RPN定量分级值计算;将各不同因素相乘:严重程度、可能性及可检测性;可获得风险系数RPN = SPD高风险水平:RPN> 16 或严重程度= 4由严重程度为4 导致的高风险水平;必须将其降低至RPN最大= 8..中等风险水平:16 ≥ RPN ≥ 8低风险水平:RPN ≤ 7八、风险评估1、工艺布局、人流、物流2、共用设备清洁及清洁有效性九、结论:上述风险要素在采取相应的预防措施后;生产安全的剩余风险降低到可以接受的水平..在综合考虑产品的特性、工艺、清洁验证的结果和有效性和国家相关法规的前提下;该车间采用多品种共用厂房、设施和设备的方式进行生产;生产安全的剩余风险是可以接受的..。
12-夏禄华-非无菌药品制药用水系统(精简版)

本次培训的内容1、制药用水相关法规要求与指南;2、制药用水常见风险控制点;3、制药用水系统的验证;4、制药用水系统审计时经常出现的问题;培训前小调查1、在座的各位同仁,你们其中是否有对纯化水系统的构成、运行、验证、日常检测一点都不懂,完全不了解,请您举手示意;2、来自工程部门的请举手;3、来自生产部门的请举手;4、来自质量部门的请举手;5、对纯化水系统比较熟悉的请举手?6、请阅读下面三张图纸,不清楚的请举手;raw water in Water is kept circulatingTo water softener & DI plantcartridge filter 5 micrometerscarbon filterspray ballbreak tankair break to draincentrifugal pumpair filteroperated valvesand filterexcess water recycledfrom deioniserBranchBranch 2nd stage buffer tankCartridge filter 1 µmSecond stage RO cartridgeFirst stage filtrate feeds second stage RO with excess back to 1st stage buffer tank.1s t s t a g e r e j e c t c o n c e n t r a t eAir breakto sewerSecond stage reject water goes back to first stage buffer tankSecond stage RO water meets PharmacopoeiastandardsOutlets or storage1st stage buffer tankWater from softener or de-ioniserWater returns to 1st stage buffer tankTypical 2-stage RO schematicHygienic pumpFirst stage RO cartridgeHigh pressurepump1、制药用水相关法规要求与指南1、中国GMP要求:第六节 制药用水第九十六条 制药用水应当适合其用途,并符合《中华人民共和国药典》的质量标准及相关要求。
共线生产风险评估报告(1)

共线生产风险评估报告(1)风险评估报告一、前言我公司综合车间建于2009年,为了降低污染和交叉污染的风险,并根据所生产药品的特性、工艺流程及相应洁净度级别要求,对厂房、生产设施和设备进行了合理设计、选型和布局,于2010年3月取得药品GMP证书。
本报告拟对生产共线产品安全进行风险评估,以期对其生产安全风险能正确认识并采取降低安全风险预见的控制措施,使生产质量的风险降低到可以接受的水平。
二、目的本报告是对公司多品种共线生产的安全性进行风险管理的报告,报告对多品种共线生产过程中可能产生混淆和交叉污染的风险要素进行分析判定。
对于每种风险可能产生损害的严重度(S)和危害的发生概率(P)进行估计。
在某一风险水平不可接受时,提出降低风险预见的控制措施,以期将剩余风险降低到可以接受的水平。
三、适用范围本报告适用于综合生产车间冻干线的产品生产四、引用资料药品生产质量管理规范2010(国家食品药品监督管理局)五、共线产品说明1、共线产品情况本公司生产厂房—综合车间,车间为封闭式厂房,室内墙和吊顶采用表面光滑、易清洗的彩钢板防火材料,为青霉素专用生产车间。
内设的两条生产线,分别为冻干粉针剂生产线和粉针剂生产线,所有产品均为青霉素类。
空调系统两条生产线,共有5条HVAC系统,相互独立的送风系统,每条系统均有一台独立的中央空调箱,初、中效过滤器采用联袋式无纺布过滤袋。
回风与进风混合开初效前,用止回阀防止新风倒灌,在空调箱中,新风和回风一起经初级过滤后,经温湿度调节,最后经中效过滤后,由风管送至每个房间独立的高效送风口,为生产区提供净化空气。
其中冻干生产线有组空气净化系统:JK1-1,额定风量31000 m3/h,为冻干十万级与万级有菌区域提供净化空气;JK1-2,额定风量28000 m3/h,为冻干万级无菌区域提供净化空气;JK2-1额定风量30000 m3/h,为粉针十万级与万级有菌区域提供净化空气;JK2-3额定风量3500 m3/h,为粉针万级无菌区域(分装室)提供净化空气;JK2-2额定风量30000 m3/h,为粉针万级无菌区域(混合、称量、辅助等)提供净化空气新风风口位于本综合车间南侧,冻干线排风位于厂房东侧,粉针线排风位于厂房西侧,排风均经过NaOH及高效过滤排放;各生产线、空调系统互不干扰。
共线生产的风险评估

南为依据的阀值水平。这些水平值既可以作为一种风险识别工具,也可以用来论证用于清 洁验证的残留限度。虽然GMP指南的第三章和第五章中没有讨论API,需要时可利用本指导 方针中概述的一般性原则来推导出其风险识别的可接受水平。”
产品交叉污染(通过沉降的粉尘或残留的产 品X进入/接触产品Y); 患者摄取,IV(通过预期的给药途径)
呼吸道; 皮肤; 粘膜; 食道
职业卫生(IH)
主要暴露机制
残留(清洁不到位); 混药(错误的原料); 机械转移(残留从一个物体转移到 另一个); 空气转移(空气中的粉尘、产品或设备 接触)
吸入(沉降的粉尘可再次扬起并被吸入); 皮肤吸收(接触,通过伤口); 粘膜(被污染的工人接触粘膜); 食道摄取
现版指南– ICH
当操作涉及传染性的或高药理活性的及毒性的物料时,应考虑使用专用的生产区域,除非能 够建立和维护灭活和/
或经验证的清洁程序。
ICH Guidance for Industry: Q7A Good Manufacturing Practice Guidance for Active Pharmaceutical Ingredients. U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research. August 2001.
产品共用的可行性,并有相应评估报告; • (二)生产特殊性质的药品,如高致敏性药品(如青霉素类)或生物制品(如卡介苗或其
无菌粉针剂产品共线生产的风险评估与分析

Part 1、引言2010年版《药品生产质量管理规范》提出了质量风险管理的要求,应当根据科学知识及经验对质量风险进行评估,以保证产品质量。
此外,根据GMP第四十六条第一款要求:应当综合考虑药品的特性、工艺和预定用途等因素,确定厂房、生产设施和设备多产品共用的可行性,并有相应评估报告。
针对我国目前药品生产企业存在的多产品共线、生产设施、系统、设备共用的问题,ISPE基准指南7《基于风险分析的制药产品生产》提出了“初始暴露原理”这一观点。
初始暴露原理,即暴露/交叉污染如何产生的,应考虑以下四个基本因素:(1)混淆,即错误的物料;(2)清洁(残留),不充分的清洁;(3)机械转移过程,将残留风险从一件产品转移到另一产品;(4)空气转移,即空气中的粉尘接触产品、设备。
这四个基本因素归纳起来便是混淆与交叉污染。
因此,本文将从混淆与交叉污染两个层面,对无菌粉针剂产品共线生产的风险进行评估与分析。
Part 2、无菌粉针剂产品共线生产风险评估的目的根据无菌粉针剂产品的特性、工艺和预定用途等因素,无菌粉针剂产品共线生产风险评估的目的是:评估多产品无菌制剂生产使用的厂房、设施及设备共用的可行性,对多品种共线生产可能发生混淆、污染与交叉污染的风险点进行识别,提出降低混淆、污染与交叉污染风险的措施,并加以文件标准化。
另外,因根据风险评估的结果,指导药品生产活动的相关验证。
Part 3、无菌粉针剂产品共线生产风险评估与分析3.1产品特性的风险分析根据《药品生产质量管理规范》要求,对于生产特殊性质的药品,如高致敏性药品(如青霉素无菌制剂),必须采用专用和独立的厂房、生产设施和设备;生产β-内酰胺结构类的无菌制剂,必须使用专用设施(如独立的空气净化系统)和设备,并与其他药品生产区严格分开。
对于共线生产的无菌药品,应对它们的产品特性进行分析和识别,从产品的剂型、性状、活性成分、水中溶解度、LD50、致敏性以及共线生产产品之间是否有直接或间接的配伍禁忌等多方面综合评估,选择溶解度差、毒性及致敏性强的产品进行清洁验证,采用合适的清洁方法,防止设备、零部件、取样工具等之间的交叉污染。
共线生产风险评估报告表

≥1.50
2
低
有可能发生
≤1 in
150,0000
≥1.33
3
≤1 in 2,000
≥1.17
4
Байду номын сангаас
中
偶尔发生,但不占有大的比例
≤1 in 400
≥1.00
5
≤1 in 80
≥0.83
6
高
经常出现
≤1 in 20 ≤1 in 8
≥0.67
7
≥0.51
8
非常高
几乎不可避免
≤1 in 3 ≥1 in 2
≥0.33
共线生产风险评估报告表
s 1. :严重程度
级别
评分标准
评分
轻微
几乎不会对产品有任何影响,即使有影响,客户也不会注意
1
客户可能会注意,可能会对客户造成客装配和使用上的轻微
2
小
不便。可能会使下道工序产生轻微的返工。
3
4
中
会造成客户的不满意,造成客户抱怨,甚至会导致返工发生
5
6
可能造成客户很不满意,并导致客户重大抱怨,但不会导致
7
严重
安全事故或违反政府法规
8
导致客户停线或对产品有致命性的功能性影响,或可能导致
9
非常严重
安全事故,或违反政府法规
10
2.O 生产概率
共线生产风险评估报告表
级别
评分标准
描述
发生率
评分 Cpk
几乎不会
几乎不可能发生
≤1 in
150,0000
≥1.67
1
非常低
有轻度发生的可能
≤1 in
150,0000
药品车间冻干生产线共线产品风险评估报告

文件制修订记录一、前言我公司综合车间建于2019年,为了降低污染和交叉污染的风险,并根据所生产药品的特性、工艺流程及相应洁净度级别要求,对厂房、生产设施和设备进行了合理设计、选型和布局,于2020年3月取得药品GMP证书。
本报告拟对生产共线产品安全进行风险评估,以期对其生产安全风险能正确认识并采取降低安全风险预见的控制措施,使生产质量的风险降低到可以接受的水平。
二、目的本报告是对公司多品种共线生产的安全性进行风险管理的报告,报告对多品种共线生产过程中可能产生混淆和交叉污染的风险要素进行分析判定。
对于每种风险可能产生损害的严重度(S)和危害的发生概率(P)进行估计。
在某一风险水平不可接受时,提出降低风险预见的控制措施,以期将剩余风险降低到可以接受的水平。
三、适用范围本报告适用于综合生产车间冻干线的产品生产四、引用资料药品生产质量管理规范2010(国家食品药品监督管理局)五、共线产品说明1、共线产品情况本公司生产厂房—综合车间,车间为封闭式厂房,室内墙和吊顶采用表面光滑、易清洗的彩钢板防火材料,为青霉素专用生产车间。
内设的两条生产线,分别为冻干粉针剂生产线和粉针剂生产线,所有产品均为青霉素类。
空调系统两条生产线,共有5条HVAC系统,相互独立的送风系统,每条系统均有一台独立的中央空调箱,初、中效过滤器采用联袋式无纺布过滤袋。
回风与进风混合开初效前,用止回阀防止新风倒灌,在空调箱中,新风和回风一起经初级过滤后,经温湿度调节,最后经中效过滤后,由风管送至每个房间独立的高效送风口,为生产区提供净化空气。
其中冻干生产线有组空气净化系统:JK1-1,额定风量31000m3/h,为冻干十万级与万级有菌区域提供净化空气;JK1-2,额定风量28000m3/h,为冻干万级无菌区域提供净化空气;JK2-1额定风量30000m3/h,为粉针十万级与万级有菌区域提供净化空气;JK2-3额定风量3500 m3/h,为粉针万级无菌区域(分装室)提供净化空气;JK2-2额定风量30000 m3/h,为粉针万级无菌区域(混合、称量、辅助等)提供净化空气新风风口位于本综合车间南侧,冻干线排风位于厂房东侧,粉针线排风位于厂房西侧,排风均经过NaOH及高效过滤排放;各生产线、空调系统互不干扰。
共线生产风险评估报告

XXXXXX 有限公司共线生产风险评估报告编号: RA/05/01方案批准方案审核/批准签字日期起草人生产部审核人质管部生产部设备基建部批准人质量负责人目的和范围目的通过对多品种共线生产的安全性进行风险管理,对多品种共线生产过程中可能产生混淆和交 叉污染的风险要素进行分析判定。
通过对产品特性、生产场地、生产设备、生产人员进行定 性估计。
在某一风险水平不可接受时,提出降低风险预见的控制措施,将剩余风险降低到可 以接受的水平。
范围合用于我公司 XXX 剂药品生产车间的共线安全风险评估。
概括我公司 XXX 剂药品生产车间建于 2022 年,位于 XXXX 工业园。
根据所生产药品的特性、工艺 流程和洁净级别要求,对厂房、生产设施和设备进行了合理设计、选型和布局,有效地降低 污染和交叉污染的风险。
本报告通过对 XXX 剂生产过程风险评估,使风险能正确认识并采取 控制措施降低风险,使生产质量的风险降低到可以接受的水平。
共线生产品种描述基本生产情况我公司生产的 XXX 剂品种有 5 个品种,共 10 个规格,其中没有细胞毒性类、激素类、高 活性化学药、 β-内酰胺结构类药品、 性激素类避孕药及特殊性质的药品 (如高致敏性和生物 制品) ,所有品种均为非无菌制剂, 且为外用 XXX 剂, 属低风险品种。
共线生产的全部 10 个品种规格均为普通药品, 彼此间不存在相互反应或者配伍禁忌;配备了 先进的符合最新 GMP 要求的生产设备, 配套了完善的GMP 文件软件系统,对生产线的各 个关键操作环节进行同步监控。
品种明细规 格50ml/瓶、100ml/瓶 25ml/瓶、50ml/瓶、 100ml/瓶、250ml/瓶1%45ml/瓶批准文号 国药准字 ZXX 国药准字 ZXX 国药准字 HXX国药准字 ZXX药品名称 A1A2A3A4剂型 XXX 剂 XXX 剂XXX 剂XXX 剂 序号 1234是是 否否 常年生产3.2. 3.1. 1.1.1.2.3. 2. 1.各品种情况简介 A1【药品名称】通用名称: A1汉语拼音:【成 份】 XXXX ,XX ,XXX ,XX 。
药品共线生产风险评估报告

药品共线生产风险评估报告1. 引言药品共线生产是指在同一生产线上生产不同种类的药品。
在这种方式下,同一个生产线会加工多种原料和剂型,从而提高生产效率和降低成本。
然而,药品共线生产也面临着一定的风险,如交叉污染、混淆、误投药等。
本报告将对药品共线生产中的风险进行评估和分析,为相关企业提供决策依据。
2. 风险评估方法为了全面、客观地评估药品共线生产的风险,本次评估采用了以下方法:1. 文献研究:收集和分析过往相关研究和案例,了解共线生产可能面临的风险;2. 采访专家:邀请相关领域的专家进行访谈,获得他们的意见和建议;3. 现场调查:实地考察具体企业的生产线和生产环境,直接观察和记录相关风险点。
3. 风险评估内容3.1 交叉污染风险药品共线生产中最常见的风险之一是交叉污染。
由于生产线上加工多种原料和剂型,存在着不同药品之间相互污染的风险。
交叉污染可能导致产品质量不达标,甚至危及患者安全。
为了降低交叉污染的风险,企业应采取以下措施:- 严格执行GMP(Good Manufacturing Practice)标准,确保设备清洁和消毒;- 合理安排生产计划,避免不同药品的交叉生产;- 清晰标识和隔离不同的原料和产品,防止混淆。
3.2 混淆风险除了交叉污染,药品共线生产还存在混淆的风险。
由于生产线上可能同时存在多种不同的原料和产品,操作人员易混淆不同种类的药品,导致加工错误。
为了降低混淆的风险,企业应采取以下措施:- 严格执行SOP(Standard Operating Procedure),确保操作人员清楚和准确理解操作流程;- 提供明确的标识和包装,减少混淆可能性;- 进行员工培训,加强操作人员的技能和责任意识。
3.3 误投药风险在药品共线生产中,误投药也是一个较为严重的风险。
误投药指的是将某种药品错误地添加到另一种药品中,从而导致错误的成品。
为了降低误投药的风险,企业应采取以下措施:- 设立严格的质量控制体系,对原料、半成品和成品进行严格检验和验证;- 对每个工序进行仔细核对和确认;- 加强员工培训,提高员工的注意力和细致度。
品种共用生产线的风险评估报告

【最新资料,WORD文档,可编辑修改】品种共用生产线的风险评估报告一、公司品种、生产线简介1、品种:我公司现有产品4个:●甲疫苗(2011S00831);●乙疫苗(2007S00826);●甲结合疫苗(2007B02129);●丙疫苗(2011S01038);2、生产线共用情况该四个品种部分生产过程存在共线生产的情况,其中甲疫苗;乙疫苗;甲结合疫苗;丙疫苗的多糖生产工序共用现有生产线的疫苗一室发酵区、纯化区;甲结合疫苗和丙疫苗的结合物原液工序共用现有生产线的疫苗二室结合物生产车间;同时四个产品的分包装为共线生产,但分装所用的配制系统、灌装系统(硅胶管、蠕动泵、陶瓷泵、分液器)均为独立系统,不存在混用的情况。
二、共用生产线风险评估GMP(2010年修订)附录3中规定如下:第十五条在生产过程中使用某些特定活生物体的阶段,应当根据产品特性和设备情况,采取相应的预防交叉污染措施,如使用专用厂房和设备、阶段性生产方式、使用密闭系统等。
第十六条灭活疫苗(包括基因重组疫苗)、类毒素和细菌提取物等产品灭活后,可交替使用同一灌装间和灌装、冻干设施。
每次分装后,应当采取充分的去污染措施,必要时应当进行灭菌和清洗。
按照GMP要求(第四十六条应当综合考虑药品的特性、工艺和预定用途等因素,确定厂房、生产设施和设备多产品共用的可行性,并有相应评估报告),针对目前公司4个品种部分工序共用生产线的情况,我们进行了质量风险评估。
1、风险识别:甲疫苗;乙疫苗;甲结合疫苗;丙疫苗的多糖生产为共用生产线,可能存在不同型别多糖的交叉污染;附表1 两价多糖疫苗、四价多糖疫苗原液共用生产线风险评估表结论:通过上述评估,上述风险得到了有效的控制,其中清洁方法、表面微生物、清洁剂、换品种清场的环境污染这四个风险由于经过了验证并有日常的监测,其风险已降为低级别;对于成分残留这一风险主要是通过验证方法的有效性来加以控制,风险降低后仍残余一定的风险,因此建议按照制定的验证周期定期验证清洁方法的有效性,并在生产过程中适当的增加监测来加以控制。
14-夏禄华-非无菌药品共线生产风险评估(精简版)

本次培训的内容1、国内非无菌生产线共线的特点;2、生产线共线生产的法规解读;3、生产线共线的风险评估流程;4、共线生产与专线生产的思考;5、生产线共线生产的清洁验证;6、GMP审计中关于共线生产的注意事项;1、国内非无菌生产线共线的特点1、工厂小、品种多、批量小、产量小;2、连续生产产品少,交叉生产情况多;3、共线生产情况很多、有专线生产条件不多;4、注重大型设备的专线专用,但是对于配套设施混用情况严重;5、注重清洁验证,不注重有效防混淆措施;6、为降低生产成本,不同产品的模具是相同的;7、没有建立有效的防止混淆、差错的书面以及实际措施;1、国内非无菌生产线共线的特点9、我们为什么会存在大量的共线生产这种情况?根本的原因是什么?能否避免?10、共线生产的危害/风险是什么,会导致那些不良的后果?-污染、交叉污染、混淆、差错;11、我们该用什么样的态度看待共线生产与专线生产?12、为降低生产线共线生产过程的风险,有哪些合理的措施可以采取?1、国内非无菌生产线共线的特点13、想一想贵公司在生产过程中采取了那些措施来防止交叉污染、混淆、差错的发生?-标识区分;-分时间段生产;-颜色区分;-模具区分;-提高硬件的数量,满足多品种需求;2、生产线共线生产的法规解读1、法规的要求是什么,为什么会这样要求?中国GMP2010版,第一章 总则第三条 本规范作为质量管理体系的一部分,是药品生产管理和质量控制的基本要求,旨在最大限度地降低药品生产过程中污染、交叉污染以及混淆、差错等风险,确保持续稳定地生产出符合预定用途和注册要求的药品。
解读:GMP对于药品的生产重点之一就是防止药品生产过程中的污染、交叉污染、混淆、差错四个方面;2、生产线共线生产的法规解读1、法规的要求是什么,为什么会这样要求?中国GMP2010版,第四节 质量风险管理第十三条 质量风险管理是在整个产品生命周期中采用前瞻或回顾的方式,对质量风险进行评估、控制、沟通、审核的系统过程。
药品生产设备共线生产风险评估范例
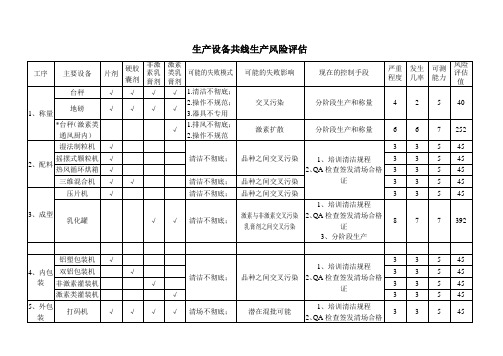
中等偏上可能性
目前的方法有中等偏上的可能性可以检测出失败模式
4
可能性大
目前的方法可以检测出失败模式的可能性大
3
非常大的可能性
目前的方法可以检测出失败模式的可能性非常大
2
几乎肯定能
目前的方法几乎可以肯定的检测出失败模式;有可靠的检测方法
1
表五:
风险评估值(R)=风险发生概率(P)×风险严重程度(S)×风险的可检测能力(D),根据风险评估值可以判定风险控制的级别:
4
较小
对生产线造成较小破坏,部分产品需进行返工。一半的顾客可以发现到缺陷
3
非常小
对生产线造成较小破坏,部分产品需进行返工。但很少有顾客可以发现到缺陷
2
无
无影响
1
表中“顾客”一词,可以是内部顾客,例如下一个工序,也可以是最终用户
表三:
失败发生的可能性
失败的几率
举例
得分
非常高:几乎不可避免失败
≥1/2
——
2、QA检查签发清场合格证
3
3
5
表一:
工序
主要设备
片剂
硬胶囊剂
非激素乳膏剂
激素类乳膏剂
可能的失败模式
风险评估值
改进的措施
可能的失败影响
现在的控制手段
严重
程度
发生
几率
可测
能力
风险评估值
3、成型
乳化罐
√
√
清洁不彻底;
392
设非激素专用配膏室
非激素间交叉污染
1、培训清洁规程
2、QA检查签发清场合格证
3、定期清洁验证
得分
绝对不可能
完全没有有效的方法可以检测出失败模式
共线生产风险评估报告

内部编号:(YUUT-TBBY-MMUT-URRUY-UOOY-DBUYI-0128)我公司综合车间建于 2022 年,为了降低污染和交叉污染的风险,并根据所生产药品的特性、工艺流程及相应洁净度级别要求,对厂房、生产设施和设备进行了合理设计、选型和布局,于 2022 年 3 月取得药品 GMP 证书。
本报告拟对生产共线产品安全进行风险评估,以期对其生产安全风险能正确认识并采取降低安全风险预见的控制措施,使生产质量的风险降低到可以接受的水平。
本报告是对公司多品种共线生产的安全性进行风险管理的报告,报告对多品种共线生产过程中可能产生混淆和交叉污染的风险要素进行分析判定。
对于每种风险可能产生伤害的严重度(S)和危害的发生概率(P)进行估计。
在某一风险水平不可接受时,提出降低风险预见的控制措施,以期将剩余风险降低到可以接受的水平。
本报告合用于综合生产车间冻干线的产品生产药品生产质量管理规范 2022 (国家食品药品监督管理局)综合车间冻干线1、注射用哌拉西林钠2、注射用哌拉西林钠他唑巴坦钠8:13、注射用哌拉西林钠他唑巴坦钠4:14、注射用哌拉西林钠舒巴坦钠 4:粉针线1、注射用美洛西林钠2、注射用阿洛西林钠3、注射用氨苄西林钠舒巴坦钠4、注射用氨苄西林钠氯唑西林钠15、注射用替卡西林钠克拉维酸钾序号共线产品名称1 注射用哌拉西林钠注射用哌拉西林钠他唑巴坦钠8:1注射用哌拉西林钠他唑巴坦钠4:14 注射用哌拉西林钠舒巴坦钠 4:1序号共线产品名称1 注射用哌拉西林钠2 注射用哌拉西林钠他唑巴坦钠8:13 注射用哌拉西林钠他唑巴坦钠4:14 注射用哌拉西林钠舒巴坦钠 4:1共线产品性质高致敏性化学药品、β-内酰氨类。
主要成份:哌拉西林钠、白色,无臭极易引湿、该品在水中或者甲醇中极易溶解,在中溶解,在中不溶,随温度升高溶解度增加。
高致敏性化学药品、β-内酰氨类。
主要成份: 1、哌拉西林钠:白色,无臭极易引湿、该品在水中或者甲醇中极易溶解,在中溶解,在中不溶,随温度升高溶解度增加。
非无菌药品质量放行体系专项监督检查风险评估标准及记录
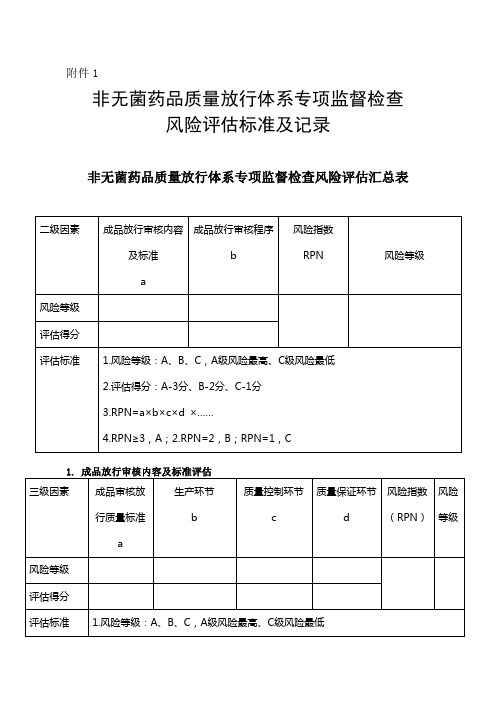
附件1非无菌药品质量放行体系专项监督检查风险评估标准及记录非无菌药品质量放行体系专项监督检查风险评估汇总表二级因素成品放行审核内容及标准a 成品放行审核程序b风险指数RPN 风险等级风险等级评估得分评估标准 1.风险等级:A、B、C,A级风险最高、C级风险最低2.评估得分:A-3分、B-2分、C-1分3.RPN=a×b×c×d ×……4.RPN≥3,A;2.RPN=2,B;RPN=1,C1. 成品放行审核内容及标准评估三级因素成品审核放行质量标准a 生产环节b质量控制环节c质量保证环节d风险指数(RPN)风险等级风险等级评估得分评估标准 1.风险等级:A、B、C,A级风险最高、C级风险最低2.评估得分:A-3分、B-2分、C-1分3.RPN=a×b×c×d ×……4.RPN≥3,A;2.RPN=2,B;RPN=1,C1.1成品审核放行质量标准评估四级因素审核标准a 放行标准b风险指数RPN 风险等级风险等级评估得分评估标准 1.风险等级:A、B、C,A级风险最高、C级风险最低2.评估得分:A-3分、B-2分、C-1分3.RPN=a×b×c×d ×……4.RPN≥3,A;2.RPN=2,B;RPN=1,C1.1.1审核标准评估五级要素成品质量标准的内容a 多级内控质量标准的建立b风险指数RPN=a×b评估得分基本要素量化评估标准1分:包括附录6中的全部内容,且对检验方法均进行了确认或验证。
2分:没有包括附录6中的全部内容,缺少或不符合款项不超过2项,对检验方法均进行了确认或验证,但内容不完整。
3分:没有包括附录6中的全部内容,缺少或不符合款项超过2项,对检验方法均未进行确认或验证。
1分:根据对历史数据的趋势分析,建立了符合本企业实际控制能力和水平的多级内控质量标准,且严于法定标准。
无菌药品风险评估大全

无菌药品风险评估大全质量风险管理本章将探讨以下问题:▲ 注射剂产品的特殊要求是什么?▲ 怎样在注射剂产品的生产过程中运用风险管理?▲ 对于注射剂车间的风险管理需考虑哪些方面?▲ 非最终灭菌产品风险管理有无特殊要求?药品生产许可持有人必须制造确保适合预期用途,符合上市许可要求的药品,不能由于安全性、质量或有效性不足而将患者置于风险。
达到该质量目标是高级管理者的职责,同时也需要企业内部各层次、各部门员工,以及企业的供应商、销售商共同参与并承担义务。
要可靠达到这样的质量目标,必须有一个综合设计、正确实施的质量系统,整合GMP法规、质量控制、质量保证体系与质量风险管理。
其应当全部文件化并对有效性进行监测。
应配备胜任人员,合适和足够的厂房、设备与设施。
建立、实施并维护一个有效的质量管理系统是为了持续稳定地生产出符合质量要求的产品,从而实现公众和个人的共同目标,即:为患者提供高质量的药品,具体表现在以下方面。
●为生产符合法规要求、注册标准,并满足内外部客户的需求的产品提供保证。
●能够减少或防止产品召回、退货或损毁,以及有缺陷的产品进人市场。
●为一系列新的概念和方法提供了实施的架构,比如:质量源于设计(指将质量管理贯穿于从产品开发开始的整个生命周期)、持续改进,以及药品生产工艺中的风险管理等。
● 企业可以根据自身的规模、工艺复杂程度和有限的资源等特定的条件,量身制定相应的质量系统。
● 使系统始终处于受控状态,即,通过对工艺运行和产品质量的有效监控,为工艺能力及其稳定性提供保障。
● 推动持续改进,包括:产品质量改进、工艺改进、降低不稳定性、技术创新、加强企业的质量系统管理等,增强企业不断地满足自身质量需求的能力。
另外,建立并实施一个有效的质量系统,同时深人理解生产工艺和产品知识,并运用风险管理方法,在这些措施的基础上对设施、设备和工艺进行变更,有可能因此减少药监部门对企业的检查次数或缩短检査时间。
本章重点讨论无菌制剂风险管理的要点与要求,质量系统的构建和管理等详细内容,请参考本丛书的《质量管理体系》分册。
共线生产风险评估报告

共线生产风险评估报告一、共线生产风险评估报告的重要性共线生产呢,就像是让不同的小伙伴在同一条跑道上奔跑,看起来很高效很有趣,但其实也隐藏着不少风险哦。
这风险评估报告就像是给这场跑步比赛做个全面的身体检查,看看哪里可能会摔倒,哪里可能会撞车。
如果没有这个报告,那就像是蒙着眼睛在赛道上跑,很容易出乱子的呢。
二、共线生产可能存在的风险1. 产品混淆风险在共线生产的时候,不同的产品在同一条生产线上来来去去的。
就像一群小朋友穿一样的衣服,很容易认错谁是谁。
比如说,一种药品和另一种很相似的药品共线生产,如果标签或者包装不小心弄混了,那可是非常严重的事情,可能会对患者的健康产生很大的威胁呢。
2. 交叉污染风险这就好比是传染病一样,一个生病的小伙伴和健康的小伙伴在一个空间里待久了,健康的小伙伴也可能会生病。
在共线生产中,如果一种产品的原料或者生产过程中的残留物,沾到了另一个产品上,那这个产品可能就被污染了。
像食品加工中,一个有过敏原的产品和普通产品共线生产,如果有残留的过敏原混到普通产品里,对过敏的人来说可就是大麻烦了。
3. 设备清洁风险生产设备就像是我们吃饭的碗,如果上一顿吃的东西没洗干净,下一顿就会有怪味道。
共线生产时,设备在生产完一种产品后,如果没有彻底清洁,就会影响下一种产品的质量。
比如生产颜料的设备没清洁好就生产食品包装材料,那颜料的残留可能就会混进包装材料里,多可怕呀。
4. 人员操作风险操作人员就像是这场共线生产大戏的演员。
如果他们没有经过足够的培训,就可能会在操作中犯错。
比如说在切换产品生产的时候,操作步骤搞错了,本来该加这个原料的加了那个原料,这就会导致产品不合格。
而且人员在不同产品的生产间穿梭,也可能会不小心把污染物带过去。
三、评估共线生产风险的方法1. 工艺流程图分析把整个共线生产的工艺过程画成一张图,就像画一幅路线图一样。
然后沿着这个图,一步一步地看哪里可能会出问题。
比如说在这个步骤里,两种产品是不是太靠近了,有没有可能混淆;在那个步骤里,设备清洁的要求是不是足够严格等等。
非最终灭菌产品共线生产质量风险评估报告

文件编号:非最终灭菌产品共线生产质量风险评估报告目 录1.目的 (1)2.范围 (1)3.责任 (1)3.1 小组成员 (1)3.2 小组职责 (1)4.内容 (1)4.1 初步危害分析(PHA)等级划分 (1)4.2 风险得分 (2)4.3 伤害的严重度水平 (2)4.4 伤害发生概率等级 (2)4.5 风险等级 (2)5. 小容量注射剂车间一楼最终灭菌生产线产品品种、规格、工艺概述 (3)5.1 品种、规格 (3)5.2 生产工艺 (4)5.3 直接接触产品生产设备 (5)5.4 厂房、空调净化系统 (5)6. 事先危害分析(PHA) (6)7. 偏差管理 (8)8.变更控制 (9)9.质量风险评估结论 (10)题 目:非最终灭菌产品共线生产质量风险评估报告 文件编号:编写部门:质量部1.目的对小容量注射剂药品生产过程存在的风险进行有效的控制,确保药品的质量和安全,保证消费者健康。
2.范围合用于药品生产过程中的风险评估。
3.责任3.1 小组成员职务 姓名组长副组长成员成员成员成员成员3.2 小组职责3.2.1 组织各方面资源确认质量保证系统日常运行、管理中存在的潜在失败点及其失败因素。
3.2.2 对潜在失败点的严重性、可能性、可测性进行评价并确定其风险等级。
3.2.3 对风险等级为高的风险点,制定风险控制措施,以期降低该风险点的风险。
3.2.4 对风险控制的效果进行评价4.内容4.1 初步危害分析(PHA)等级划分以下是为本次风险管理确定的风险可接受准则,其中伤害的严重度采用定性分析,伤害发生的概率采用半定量分析,风险可接受性以风险点的最终风险得分高低判断。
文件编号:4.2 风险得分严重性 x 可能性= 风险得分4.3 伤害的严重度水平等级名称评分风险水平定义低 1 影响产品质量纯度指标的实现;发生后不需返工、回收、重新加工处理,产品仍可以向下工序流动中 2 影响产品质量有效性指标的实现;发生后允许通过返工、回收、重新加工的方法挽回经济损失高 3 影响产品质量安全性指标的实现;发生后除报废产品外,无法减轻损失4.4 伤害发生概率等级等级名称评分风险概率定义低 1 偶发,致产品质量指标不合格中 2 少发,致产品质量指标不合格高 3 频发,致产品质量指标时常不合格4.5 风险等级可能性严 重 性低中高低低风险低风险中风险中低风险中风险高风险高中风险高风险高风险风险等级行动高此风险必须降低中此风险适当的降至尽可能低低通常可以接受的风险文件编号:5. 小容量注射剂车间一楼最终灭菌生产线产品品种、规格、工艺概述5.1 品种、规格小容量注射剂最终灭菌生产线具体生产品种、规格及药品性质如下表所列:品名 预定用途 规格 主药 主药性状维生素B12注射液 维生素类 1ml:0.5mg1ml:1mg维生素B12为深红色结晶或者结晶性粉末;无臭,无味;引湿性强。
共线生产风险评价报告

风险评估报告一、前言我公司灌装等车间装修于2011年,为了降低污染和交叉污染的风险,并根据所生产产品的特性、工艺流程及相应洁净度级别要求,对厂房、生产设施和设备进行了合理设计、选型和布局,于2013年6月取得SGS公司颁发GMPC证书并每年验证审核,2016年1月13日、5月26日由**市**区质量监督质量检验所验证洁净区空气洁净度达到10万级水平、次清洁区符合标准并颁发报告。
本报告拟对生产共线产品安全进行风险评估,以期对其生产安全风险能正确认识并采取降低安全风险预见的控制措施,使生产质量的风险降低到可以接受的水平。
二、目的本报告是对公司多品种共线生产的安全性进行风险管理的报告,报告对多品种共线生产过程中可能产生混淆和交叉污染的风险要素进行分析判定。
对于每种风险可能产生损害的严重度(S)和危害的发生概率(P)进行估计。
在某一风险水平不可接受时,提出降低风险预见的控制措施,以期将剩余风险降低到可以接受的水平。
三、适用范围本报告适用于综合生产车间灌装线、乳化制作生产线的产品生产四、引用资料化妆品安全技术规范(2015年版)、本公司ISO22716\GMPC质量管理体系文件等相关资料。
五、共线产品说明1、共线产品情况2、共线产品特性3、共线产品生产工艺及预期用途4、公司厂房、公用设施、设备及防污染与交叉污染情况说明本公司生产厂房一乳化制作和灌装车间,车间为封闭式厂房,室内墙和吊顶采用表面光滑、易清洗的彩钢板防火材料,为专用生产车间。
2楼灌装间内设的5台灌装生产设备,3楼灌装间为3台灌装生产设备;2楼半自动灌装生产设备生产膏霜乳液产品,其余设备生产一般液态产品。
空调系统两条,灌装、静置间相互独立的送风系统,每条系统均有一台独立的中央空调箱,初、中效过滤器采用联袋式无纺布过滤袋。
回风与进风混合开初效前,用止回阀防止新风倒灌,在空调箱中,新风和回风一起经初级过滤后,经温湿度调节,最后经中效过滤后,由风管送至每个房间独立的高效送风口,为生产区提供净化空气。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
本次培训的内容1、国内非无菌生产线共线的特点;2、生产线共线生产的法规解读;3、生产线共线的风险评估流程;4、共线生产与专线生产的思考;5、生产线共线生产的清洁验证;6、GMP审计中关于共线生产的注意事项;1、国内非无菌生产线共线的特点1、工厂小、品种多、批量小、产量小;2、连续生产产品少,交叉生产情况多;3、共线生产情况很多、有专线生产条件不多;4、注重大型设备的专线专用,但是对于配套设施混用情况严重;5、注重清洁验证,不注重有效防混淆措施;6、为降低生产成本,不同产品的模具是相同的;7、没有建立有效的防止混淆、差错的书面以及实际措施;1、国内非无菌生产线共线的特点9、我们为什么会存在大量的共线生产这种情况?根本的原因是什么?能否避免?10、共线生产的危害/风险是什么,会导致那些不良的后果?-污染、交叉污染、混淆、差错;11、我们该用什么样的态度看待共线生产与专线生产?12、为降低生产线共线生产过程的风险,有哪些合理的措施可以采取?1、国内非无菌生产线共线的特点13、想一想贵公司在生产过程中采取了那些措施来防止交叉污染、混淆、差错的发生?-标识区分;-分时间段生产;-颜色区分;-模具区分;-提高硬件的数量,满足多品种需求;2、生产线共线生产的法规解读1、法规的要求是什么,为什么会这样要求?中国GMP2010版,第一章 总则第三条 本规范作为质量管理体系的一部分,是药品生产管理和质量控制的基本要求,旨在最大限度地降低药品生产过程中污染、交叉污染以及混淆、差错等风险,确保持续稳定地生产出符合预定用途和注册要求的药品。
解读:GMP对于药品的生产重点之一就是防止药品生产过程中的污染、交叉污染、混淆、差错四个方面;2、生产线共线生产的法规解读1、法规的要求是什么,为什么会这样要求?中国GMP2010版,第四节 质量风险管理第十三条 质量风险管理是在整个产品生命周期中采用前瞻或回顾的方式,对质量风险进行评估、控制、沟通、审核的系统过程。
风险管理是一个用于质量管理的工具;风险管理可以是事先进行的,也可以是时候进行的;风险管理的过程包括,风险的评估、风险的控制,风险的沟通、风险的审核;问题:风险的控制包括那几个方面?风险的沟通与风险的审核该如何实施?2、生产线共线生产的法规解读1、法规的要求是什么,为什么会这样要求?第十四条 应当根据科学知识及经验对质量风险进行评估,以保证产品质量。
解读:什么是科学知识?什么是经验?第十五条 质量风险管理过程所采用的方法、措施、形式及形成的文件应当与存在风险的级别相适应。
解读:文件是风险管理的核心,没有文件就可以认为没有风险管理风险是有级别的,风险的影响程度不同,级别不同。
2、生产线共线生产的法规解读1、法规的要求是什么,为什么会这样要求?中国GMP2010版,第四章 厂房与设施,第一节 原 则 第三十八条 厂房的选址、设计、布局、建造、改造和维护必须符合药品生产要求,应当能够最大限度地避免污染、交叉污染、混淆和差错,便于清洁、操作和维护。
解读:厂房的设计需要考虑不同产品的同时生产时的污染、交叉污染、混淆、晁错的可能性;口服固体制剂车间的洁净走廊气闸、门斗、缓冲设计就是避免交叉污染;制剂厂隔壁就是一个垃圾处理中心,对产品生产有影响吗?2、生产线共线生产的法规解读第二节 生产区 第四十六条 为降低污染和交叉污染的风险,厂房、生产设施和设备应当根据所生产药品的特性、工艺流程及相应洁净度级别要求合理设计、布局和使用,并符合下列要求: (一)应当综合考虑药品的特性、工艺和预定用途等因素,确定厂房、生产设施和设备多产品共用的可行性,并有相应评估报告;解读:你们工厂是否已有已批准的共线生产的风险评估报告?清洁验证报告是否就是共线生产的风险评估报告?共线生产的风险评估报告应该考虑那些内容?2、生产线共线生产的法规解读 (二)生产特殊性质的药品,如高致敏性药品(如青霉素类)或生物制品(如卡介苗或其他用活性微生物制备而成的药品),必须采用专用和独立的厂房、生产设施和设备。
青霉素类药品产尘量大的操作区域应当保持相对负压,排至室外的废气应当经过净化处理并符合要求,排风口应当远离其他空气净化系统的进风口;解读:如果您工厂有这些产品,就不要考虑通过阶段性生产来进行这些产品与普药的共线生产;特殊药品车间的与普药生产车间的运营需要完全独立;相同产品的注射剂与口服固体制剂是可以共厂房生产的;2、生产线共线生产的法规解读 (四)生产某些激素类、细胞毒性类、高活性化学药品应当使用专用设施(如独立的空气净化系统)和设备;特殊情况下,如采取特别防护措施并经过必要的验证,上述药品制剂则可通过阶段性生产方式共用同一生产设施和设备;解读:除特殊管制产品外,细胞毒、抗肿瘤、高活性产品是可以与普药生产线共线生产,这一点非常重要;什么是特别的防护措施?防护措施一定是硬件吗?必要的验证是指什么方面的验证?清洁验证?什么是阶段性生产,如何定义?2、生产线共线生产的法规解读 (六)药品生产厂房不得用于生产对药品质量有不利影响的非药用产品。
解读:药品生产线上生产保健食品行不行?药品生产线上生产同一品种的化工中间体,可以不可以?2、生产线共线生产的法规解读 第四十七条 生产区和贮存区应当有足够的空间,确保有序地存放设备、物料、中间产品、待包装产品和成品,避免不同产品或物料的混淆、交叉污染,避免生产或质量控制操作发生遗漏或差错。
解读:足够的空间需要用什么指标来量化?生产区的中间产品的储存区在国内绝大部分都偏小,无法满足生产需求;如何避免生产区产品的混淆与差错?生产区的混淆可能性有多大?2、生产线共线生产的法规解读 第五十三条 产尘操作间(如干燥物料或产品的取样、称量、混合、包装等操作间)应当保持相对负压或采取专门的措施,防止粉尘扩散、避免交叉污染并便于清洁。
解读:相对负压措施该如何理解?空调系统的全排能不能解决交叉污染的问题?如何有效的避免粉尘的扩散、流动、污染?2、生产线共线生产的法规解读 第五十四条 用于药品包装的厂房或区域应当合理设计和布局,以避免混淆或交叉污染。
如同一区域内有数条包装线,应当有隔离措施。
解读:包装区域的设计应该遵循什么原则?包装区域的混淆、差错的可能性有多大?有效的防止混淆的措施有那些?如何避免员工由于误操作导致产品、说明书、小盒、合格证的混淆?3、生产线共线的风险评估的流程1、建立风险评估的流程:-是否存在有效的质量风险管理的程序?例如,有没有这个SOP,有没有被培训过?-是否有风险评估的工具;例如,是有SOP+表格?-是否有指定人员负责生产共线风险评估的工作?例如,有没有专人负责生产线共线评估的工作?-属地部门是否担任生产线共线风险评估的工作:例如,制粒岗位班长负责制粒工序生产线共线的风险评估。
-QA部门是否有指定人员参与风险评估报告的审核?3、生产线共线的风险评估的流程2、对生产工艺按照工艺流程、生产现场的管理、工序的分类进行划分;例如,片剂的工艺流程可以大致分为以下几个步骤:生产指令单、领料、称量、制粒、混合、压片、内包、外包、入库;3、对于每一个工序在共线生产时有可能存在交叉污染、混淆、差错的风险点进行描述;例如,生产线共线生产过程中称量工序中存在交叉污染、混淆、差错可能性有哪些?-称量前没有清场,导致交叉污染;-称量用勺子只有一把,导致交叉污染;-原料脱外包后,内包装上没有标识,导致混淆;3、生产线共线的风险评估的流程4、生产工序共线风险点描述需要从人、机、料、法、环这5个方面进行考虑;例如,在称量岗位生产线共线评估过程中,如有A片剂与B片剂共线生产,共线的风险有那些?从人员的方面来看:-制粒操作员工小张只接受A片剂生产工艺培训,但是没有接受B片剂生产工艺的培训;-制粒操作员工小王没有接受药厂防混淆程序的培训;-制粒操作员小李没有接受B产品的生产设备清洁、清洗方法的培训;-制粒操作员小赵没有按照要求及时更新生产现场产品的指示牌;3、生产线共线的风险评估的流程4、生产工序共线风险点描述需要从人、机、料、法、环这5个方面进行考虑;例如,在称量岗位生产线共线评估过程中,如有A片剂与B片剂共线生产,共线的风险有那些?从机器方面来看:-A片剂与B片剂的制粒工艺参数是一致的,但是湿法整粒的筛网的目数是有不同的,容易安装错误;-A片剂与B片剂的制粒过程中取样用、转移用工具常常混淆;-A片剂与B片剂的制粒后存放的中间产品不锈钢桶是一样,放在中间体仓库,容易混淆;-A片剂与B片剂的制粒用喷浆泵的流量不一致,容易混淆;3、生产线共线的风险评估的流程4、生产工序共线风险点描述需要从人、机、料、法、环这5个方面进行考虑;例如,在称量岗位生产线共线评估过程中,如有A片剂与B片剂共线生产,共线的风险有那些?从物料方面来看:-A片剂与B片剂的制粒前物料颜色、粒径差不多,容易混淆;-中间体仓库较小,存放称量后物料经常相互交叉挤压,存在混淆的可能性;3、生产线共线的风险评估的流程4、生产工序共线风险点描述需要从人、机、料、法、环这5个方面进行考虑;例如,在称量岗位生产线共线评估过程中,如有A片剂与B片剂共线生产,共线的风险有那些?从方法方面来看:-您认为有那些?3、生产线共线的风险评估的流程4、生产工序共线风险点描述需要从人、机、料、法、环这5个方面进行考虑;例如,在称量岗位生产线共线评估过程中,如有A片剂与B片剂共线生产,共线的风险有那些?从环境方面来看:-称量间A产品称量完成以后,没有清场、清洁,直接进行B产品的称量;-清场、清洁只关注设备表面,不关注地面、墙面、天花板;-非头孢生产线空调进风口与头孢生产线出风口临近,举例不足5米;-您认为还有那些?3、生产线共线的风险评估的流程4、在生产工序共线生产风险点寻找后,需要对这些风险发生的可能性、风险发生后的危害性、风险发生时的可探测性进行打分、评估;例如,在称量岗位生产线共线评估过程中,如有A片剂与B片剂共线生产,共线的风险有那些?从机器方面来看:-A片剂与B片剂的制粒工艺参数是一致的,但是湿法整粒的筛网的目数是有不同的,容易安装错误;已有的措施有那些?-筛网上有标记是用于判断目数;3、生产线共线的风险评估的流程可能性:较高,打8分(一年发生多少次)危害性:中等,打6分(对患者的危害)可探测性,较高,打3分(现有措施)风险系数为144分,大于100分,认为有必要采取措施;计划的措施:-计划在批记录上增加制粒前检查筛网的目数并记录;-计划在筛网的空白处对产品的代码进行标记;-筛网按模具管理上锁管理,并由专人发放;-筛网空白处用特殊的颜色进行标记;3、生产线共线的风险评估的流程再次对采取措施后的风险系数进行计算:可能性:较高,打5分危害性:中等,打6分可探测性,较高,打2分风险系数为60分,小于100分,认为可以接受;3、生产线共线的风险评估的流程5、收集整理每个工序的风险评估的报告,装订成册,提交生产部门、质量部门进行审核、批准、生效;6、共线生产的风险评估重点是呈现您对您目前工厂机产品的理解,同时已经采取了那些措施用于防止污染、交叉污染、混淆、差错的风险,同时在风险评估的基础上您又增加那些措施来避免该工序的共线生产时的污染、交叉污染、混淆、差错的风险;7、关键您对工艺的理解和认识,关键是现有措施和计划采取的措施,打多少分其实一点也不关键,不要纠结打多少分是合理的;4、共线生产与专线生产的思考1、在座的各位你们倾向与共线生产还是专线生产?2、厂房设计时采用共线生产还是专线生产的依据是建立在什么基础上?3、中国国内企业目前在产品共线生产/专线生产的现状如何?4、共线生产优点有那些?专线生产的优点有那些?5、如何看待为了满足GMP审计时的需要,而搞专线专用的思路?6、我们应该用什么样的合理的、逻辑的思维看待共线生产与专线生产?4、共线生产与专线生产的思考7、专线生产时,车间的设计需要考虑什么?8、共线生产过程中,那些过程是最容易出现交叉污染、混淆、差错?9、如何制定切实有效的防混淆、防差错的措施?10、操作人员的习惯性动作和习惯性思维的改变;11、标识是防止交叉污染、混淆、差错有效措施之一,而且费用不高;5、共线生产的清洁验证1、清洁验证目的的核心是什么?-提供文件证明活性物质A在B产品中的残留的限度是可以被接受的,问题是什么样的残留限度是可以被接受?-清洁验证是证明共线生产时交叉污染的限度是可以接受的;-清洁验证仅仅是共线生产时防止交叉污染的有效措施之一,并不是共线生产评估的全部;-混淆、差错比交叉污染对病人产生的危害更大,例如,标签贴错导致销售了错误的产品;-清洁验证不一定能避免交叉污染,例如,生产现场有明显白色粉末,员工也未能说明是什么,但是公司能够提供清洁验证报告;5、共线生产的清洁验证2、10ppm限度、千分之一日剂量限度、LD50限度的来源;-为什么选择这些标准?-这些标准的来源是什么?-这些标准是否科学?-1-0ppm的意义是什么?A产品的主药在B产品中的含量不得超过10ppm。
