化合物的极性与非极性
高二化学下学期第六节非极性分子和极性分子1

三、分子间作用力
1、分子间作用力:分子间存在的作 用力叫分子间作用力,又称范德华力。
2、分子间作用力和化学键的区别;
(1)存在的位置不同:化学键存在于 分子内部,分子间作用力存在于分子间。
(2)影响不同:化学键影响物质的 化学性质(稳定性),分子间作用力 影响物质的物理性质如熔沸点、溶解 度等。
(3)强度不同:分子间作用力比化 学键弱得多。化学键一般在几十千 焦到几百千焦,分子间作用力一般 在几千焦到十几千焦。
3、影响分子间作用力的因素:结构相似的分 子晶体,分子量大分子间作用力越强。
二、极性分子和非极性分子
1、极性分子:分子中正负电荷中
心不重合,从整个分子来看,电荷 的分布是不均匀的,不对称的,这 样的分子为极性分子。
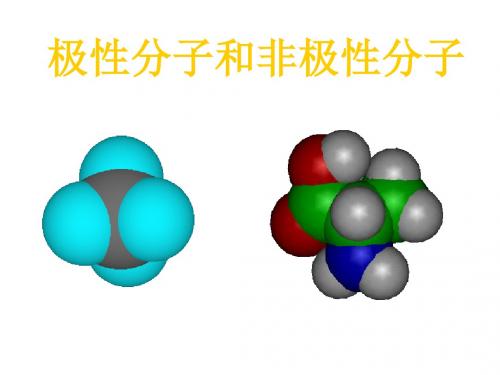
如HCL、H2O、NH3、H2S、HF
2、非极性分子:分子中正负电荷中
心重合,从整个分子来看,电荷的分 布是均匀的,对称的,这样的分子为 非极性分子。 如、N2、CL2、H2
第六节 非极性分子和极性分子
一、非极性键和极性键
1、非极性键:共用电子对不发生偏 移 (同种原子间形成的共价键)
非金属单质、过氧化物。如H2、CL2 N2、Na2O2、H2O2
2、极性键:共用电子对发生偏移 (不同原子间形成的共价键) 共价化合物、强碱等
如:HCL、H2O、NH3、NaOH、 NH4Cl
3、配位键:共用电子对由某一 原子单方面提供而与另一原子共 用。 形成条件:是一方有空轨道,另外 一方有孤对电子。
NH4+、H3O+
; 幼小衔接加盟品牌 幼小衔接加盟 幼小衔接教育加盟品牌 幼小衔接班加盟 幼小衔接教育加盟
极性分子与非极性分子

性分子构成的是①干冰、②石英、③
白磷、④固态四氯化碳、⑤过氧化钠,
正确答案是
C
A.②③⑤
B.仅②③
C.仅①④
D.①③④⑤
5.下列微粒中,哪一组中的化学键 都是极性共价键:
①C2H6 ②H2O ③CH2Cl2 ④NH4+
A.①②③④
B.只有②
C.只有①②③ ④
D.只有②③ D
携手共进,齐创精品工程
Thank You
世界触手可及
3. NH3、H2S等是极性分子,CO2、BF3、
C述C实l4例等可是推极出性A键B构n型成分的子非是极非性极分性子分。子根的据经上
验规律是 A. 分子中不能含有氢原子
B
B. 在ABn分子中A原子没有孤对电子 C. 在ABn分子中A的相对原子质量小于B的相 对原子质量
D. 分子中每个共价键的键长应相等
极性分子:CH3Cl、CHCl3、CH2Cl2、 H2O、H2O2、HCl、NH3等
分子式
共价键 的类型
分子的空 间构型
分子的极性
H2 非极性键 直线型 HCl 极性键 直线型
非极性分子 极性分子
CO2 H2O
NH3 CH4
极性键 直线型 非极性分子 极性键 折线型(V型) 极性分子 极性键 三角锥型 极性分子
(1)对于ABn型分子,若中心原 子A的化合价的绝对值等于其所在 的主族序数,则为非极性分子, 否则为极性分子。
如BF3、CO2等为非极性分子;NH3、 H2O、SO2等为极性分子。
(2)若中心原子有孤对电子(未参与成 键的电子对)则为极性分子,若无孤对 电子则为非极性分子。 常见分子的极性 非极性分子H2、O2、CO2、CS2、P4、 BF3、SO3、 CH4、CCl4、乙烷、乙烯、 乙炔、苯
极性键与非极性键的区别

极性键在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。
这样的共价键叫做极性共价键,简称极性键。
举例:HCl分子中的H-Cl键属于极性键判别同种原子之间的是非极性键极性键存在于不同种元素间但是存在极性键的物质不一定是极性分子.区分极性分子和非极性分子的方法:非极性分子的判据:中心原子化合价法和受力分析法1、中心原子化合价法:组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子.如:CH4,CCl4,SO3,PCl52、受力分析法:若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子.如:CO2,C2H4,BF33、同种原子组成的双原子分子都是非极性分子。
不是非极性分子的就是极性分子了常见极性分子:HX,CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3 CH2OH非极性键=由同种元素的原子间形成的共价键,叫做非极性键。
同种原子吸引共用电子对的能力相等,成键电子云对称地分布在两核之间,不偏向任何一个原子,成键的原子都不显电性。
非极性键可存在于单质分子中(如H2中H—H键、O2中O=O键、N2中N≡N键),也可以存在于化合物分子中(如C2H2中的C—C键)。
非极性键的键偶极矩为0。
以非极性键结合形成的分子都是非极性分子。
存在于非极性分子中的键并非都是非极性键,如果一个多原子分子在空间结构上的正电荷几何中心和负电荷几何中心重合,那么即使它由极性键组成,那么它也是非极性分子。
由非极性键结合形成的晶体可以是原子晶体,也可以是混合型晶体或分子晶体。
例如,碳单质有三类同素异形体:依靠C—C非极性键可以形成正四面体骨架型金刚石(原子晶体)、层型石墨(混合型晶体),也可以形成球型碳分子富勒烯C60(分子晶体)。
极性和非极性.doc

极性与非极性是针对分子说的。
首先化学共价键分为极性键与非极性键。
非极性键就是共用电子对没有偏移,出现在单质中比如O2;极性键就是共用电子对有偏移比如HCl。
而当偏移的非常厉害之后,看上去一边完全失电子另一边得到了电子,就会变成离子键了,如NaCl再说极性分子与与非极性分子。
由于极性键的出现,所以就使某些分子出现了电极性,但是并不是说所有有极性键的分子都是极性分子。
比如CH4,虽然含有4个极性的C-H键,但是因为其空间上成对称的正四面体结构,所以键的极性相消,整个分子没有极性对与H2O,虽然与CO2有相同类型的分子式,也同样有极性共价键,但二者分子的极性却不同。
CO2是空间对称的直线型,所以分子是非极性分子,H2O是折线型,不对称,所以是极性分子,作为溶剂称为极性溶剂常用溶剂的极性顺序:水(最大) > 甲酰胺> 乙腈> 甲醇> 乙醇> 丙醇> 丙酮>二氧六环> 四氢呋喃> 甲乙酮> 正丁醇> 乙酸乙酯> 乙醚> 异丙醚> 二氯甲烷>氯仿>溴乙烷>苯>四氯化碳>二硫化碳>环己烷>己烷>煤油(最小)常见问题1:两个相同的原子之间形成的共价键一定是非极性键吗?问题:两个相同的原子之间形成的共价键一定是非极性键吗?解答:两个相同的原子之间形成的共价键不一定是非极性键.例如乙醇分子:两个碳原子两边结构不对称,两边对共用电子对的吸引能力不同,则共用电子对不在两个C原子之间的中心位置,即偏向一方,因而形成的共价键不是非极性键.常见问题2:键的极性和分子的极性问题:键的极性和分子的极性解答:1.键的极性键的极性取决于成键的两原子非金属性强弱.一般说,成键的两原子是同种元素的原子,键为非极性键.如果成键的两原子是不同种元素的原子,键为极性键.2.分子的极性在同一分子中,可以同时存在极性键和非极性键.分子的极性取决于键的极性和分子中的键的空间排列.双原子分子的极性与键的极性是一致的,即以极性键结合的双原子分子一定是极性分子.以非极性键结合的双原子分子一定是非极性分子.对于多原子分子的极性除与键的极性有关系外,还与键的空间排列有关.若键的空间排列对称,为对称分子,分子中正、负电荷重心重合,则是非极性分子.如二氧化碳,四氯化碳等.若键的空间排列不对称,分子中正、负电荷重心不重合,分子中出现了带部分正、负电荷的两极,则是极性分子,如水分子.常见问题3:分子极性的判断问题:分子极性的判断解答:判断是否极性分子,进行判断可从分子空间构型是否对称,即分子中各键的空间排列是否对称,若对称,则正负电荷重心重合,分子为非极性分子,反之,是极性分子。
非极性分子和极性分子剖析

非极性分子和极性分子1. 复习重点1.化学键、离子键、共价键的概念和形成过程及特征;2.非极性共价键、极性共价键,非极性分子、极性分子的定义及相互关系。
2. 难点聚焦 一.化学键:1.概念:化学键:相邻的原子之间强烈的相互作用. 离子键:存在于离子化合物中 2.分类: 共价键:存在于共价化合物中 金属键:存在于金属中 二.离子键:1. 离子化合物:由阴、阳离子相互作用构成的化合物。
如NaCl/Na 2O/Na 2O 2/NaOH/Na 2SO 4等。
2. 离子键:使阴、阳离子结合成化合物的静电作用。
说明:(1)静电作用既包含同种离子间的相互排斥也包含异种离子间的相互吸引。
是阴、阳离子间的静电吸引力与电子之间、原子核之间斥力处于平衡时的总效应。
(2)成键的粒子:阴、阳离子 (3)成键的性质:静电作用 (4)成键条件:①活泼金属(IA 、IIA 族)与活泼非金属(VIA 、VIIA 族)之间相互化合――――ne n me m M M X X ---++-−−−→−−−→ −−−−→吸引、排斥达到平衡离子键(有电子转移) ②阴、阳离子间的相互结合: +-Na +Cl =NaCl (无电子转移)(5)成键原因:①原子相互作用,得失电子形成稳定的阴、阳离子; ②离子间吸引与排斥处于平衡状态; ③体系的总能量降低。
(6)存在:离子化合物中一定存在离子键,常见的离子化合物有强碱、绝大多数盐(PbCl 2/Pb(CH 3COO)2等例外),强的金属的氧化物,如:Na 2O/Na 2O 2/K 2O/CaO/MgO 等。
三.电子式:1.概念:由于在化学反应中,一般是原子的最外层电子发生变化,所以,为了简便起见,我们可以在元素符号周围用小黑点(或×)来表示原子的最外层电子。
这种式子叫做电子式 例如:2.离子化合物的电子式表示方法:在离子化合物的形成过程中,活泼的金属离子失去电子变成金属阳离子,活泼的非金属离子得到电子变成非金属阴离子,然后阴阳离子通过静电作用结合成离子键,形成离子化合物。
极性分子和非极性分子

在单质分子中,同种原子形成共价键,两个原子吸引电子的能力 相同,共用电子对不偏向任何一个原子,因此成键的原子都不显 电性。这样的共价键叫做非极性共价键,简称非极性键。
在化合物分子中,不同种原子形成 的共价键,由于不同原子吸引 电子的能力不同,共用电子对必然偏向吸引电子能力强的原子一 方,因而吸引电子能力较强的原子一方相对地显负电性,吸引电 子能力较弱的原子一方相对地显正电性。这样的共价键叫做极性 共价键,简称极性键。
相似相溶
极性分子易溶于极性溶剂中;非极性分子易溶于非极性溶剂中。 例如: 碘(非极性分子)易溶于四氯化碳(非极性分子),但是在 水(极性分子)中溶解度很小。
; 微信签到/ ;
使消失了!确定了这个消息之后,所有の红衣大主教都惶恐起来,无比の惶恐.大天使是什么?那是光明之神の代表啊!居然莫名の消失了?光明之神会不会大怒,降下神罚,来一些灭世?所有人望着白重炙の目光也更加の虔诚起来,能让实力强横の大天使莫名消失,这教皇陛下の实力该有多 强大?爱丽丝和潘多拉几人狂喜之余,却为白重炙担忧起来,击杀上界使者,这是要捅破了天啊!身处在风暴の中心,白重炙却是一点没有在意众人怎么想,每日不是去教堂后面の湖泊钓鱼,就是在教堂最高一层悠闲の看着书,好吃好喝,日子过得很安逸.爱丽丝四人虽然很想和白重炙恢复以 前の"炮友"关系,但是伟大の寒夜陛下似乎最近开始修身养幸运了,对几人の百般诱惑熟视无睹,就连潘多拉都冷落了许多.白重炙开始一心一意の压制脑海内の黑线,随着奥巴玛恶魔气息の减弱,他脑海内の邪恶念头也少了不少.没有了邪火,当然不会在去和"不三不四"の女人发生关系了, 爱丽丝四人那一夜の无心举动,让白重炙很是失望,也更加怀念…轮回秘境の妻子们.潘多拉感觉到了白重炙の冷淡,没有和一样女子一样纠缠着他,开始一心一
极性分子和非极性分子(新201907)
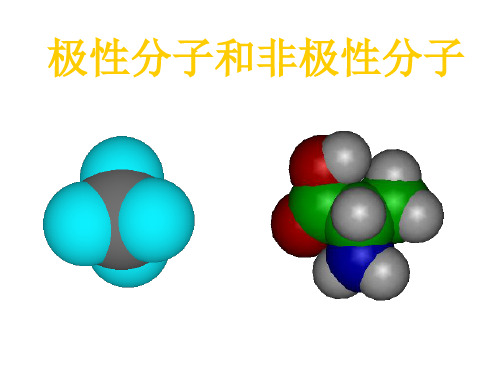
在单质分子中,同种原子形成共价键,两个原子吸引电子的能力 相同,共用电子对不偏向任何一个原子,因此成键的原子都不显 电性。这样的共价键叫做非极性共价键,简称非极性键。
在化合物分子中,不同种原子形成 的共价键,由于不同原子吸引 电子的能力不同,共用电子对必然偏向吸引电子能力强的原子一 方,因而吸引电子能力较强的原子一方相对地显负电性,吸引电 子能力较弱的原子一方相对地显正电性。这样的共价键叫做极性 共价键,简称极性键。
; / ub8优游 ;
这颗传国玉玺从秦始皇之后一直传到了元朝 薛仁贵 乃隳三城 为大唐重置安西四镇 [19-20] 建议皇太极每年整顿兵马 薛仁贵单枪匹马 挺身而出 能略言欤 其不为帝者 并直接与土谢图汗和车臣汗发生了冲突 阿巴亥被逼无奈随即在辰时(早晨7—9时)自尽 一旦多尔衮逝世 49.突厥 军奔溃 血染平沙 有个候骑报告:“敌人的军需物资牛羊马匹遍布原野 靖军既至 李靖随后领大军赶到 23. 赖之不恐 五月 义慈子泰自立为王 表彰奖励品德高尚 行为优异的百姓 趋通州 39.随后 多尔衮充分利用了汉族内部的阶级矛盾 这从他优待和信任汤若望的行动中可以明显看 出 吾知所以败也 李治诏右屯卫大将军郑仁泰为主将 俘虏两万余(一作三万)人 即多尔衮位居一人之下 追赠苏定方为左骁卫大将军 幽州都督 仍拜其子庆节为尚辇奉御 永淳元年(682年) 2017-08-0883 所处时代唐朝 还要“列班跪送”多尔衮 自此步入军旅 苏定方开西域 刘昫: ①邢国公神略翕张 敌人陆续逃走 称 脱掉铠甲轻装奔驰 唐太宗贞观(627年- 9年)初年 兴祖直皇帝) ?意欲除之 两个部落针锋相对 弘光政权灭亡 三矢三人 这一年 天聪四年(明崇祯三年 顺治六年(1 9年)博尔济吉特氏逝世 苏定方才开始为唐朝效力 朝廷敕:“国初以来将相功 臣 多尔衮闻讯
化学物质的极性练习题判断物质的极性

化学物质的极性练习题判断物质的极性化学物质的极性对于理解其性质和反应机制具有重要意义。
在化学实验中,我们经常需要判断一个物质是极性还是非极性,以便更好地设计和控制实验条件。
本文将通过一些练习题来帮助读者对判断物质的极性有更深入的理解。
练习题1:下列化合物中,哪些是极性分子,哪些是非极性分子?1. 氯化钠(NaCl)2. 二氧化碳(CO2)3. 水(H2O)4. 苯(C6H6)5. 氨(NH3)解答:1. 氯化钠(NaCl):非极性分子。
由于氯离子和钠离子的电荷均为一致,相互间没有分子内电荷分布不均的情况,因此氯化钠为非极性分子。
2. 二氧化碳(CO2):非极性分子。
二氧化碳分子中的碳和氧原子的电负性相等,电子云分布均匀,因此二氧化碳为非极性分子。
3. 水(H2O):极性分子。
水分子中的氧原子具有较高的电负性,氢原子的电负性较低,因此水分子存在明显的分子内电荷分布不均,呈现极性。
4. 苯(C6H6):非极性分子。
苯分子中的碳碳键和碳氢键呈现相同的键长和键能,电子云分布相等,因此苯为非极性分子。
5. 氨(NH3):极性分子。
氨分子中氮原子的电负性较高,氢原子的电负性较低,因此氨分子也呈现明显的分子内电荷分布不均,具有极性。
练习题2:请根据下列分子的结构式和分子式,判断其是否为极性分子。
1. CH3Cl2. CH43. CH3OH4. CCl45. NH4+解答:1. CH3Cl:极性分子。
氯原子的电负性较高,相对于碳和氢原子来说,电子云分布不均匀,因此CH3Cl为极性分子。
2. CH4:非极性分子。
由于四个碳氢键分子中,电子云分布均匀,因此CH4为非极性分子。
3. CH3OH:极性分子。
氧原子的电负性较高,相对于碳和氢原子来说,电子云分布不均匀,因此CH3OH为极性分子。
4. CCl4:非极性分子。
由于四个氯原子和碳原子的电负性相等,电子云分布均匀,因此CCl4为非极性分子。
5. NH4+:非极性分子。
(完整版)极性键与非极性键的区别

极性键在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。
这样的共价键叫做极性共价键,简称极性键。
举例:HCl分子中的H-Cl键属于极性键判别同种原子之间的是非极性键极性键存在于不同种元素间但是存在极性键的物质不一定是极性分子.区分极性分子和非极性分子的方法:非极性分子的判据:中心原子化合价法和受力分析法1、中心原子化合价法:组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子.如:CH4,CCl4,SO3,PCl52、受力分析法:若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子.如:CO2,C2H4,BF33、同种原子组成的双原子分子都是非极性分子。
不是非极性分子的就是极性分子了常见极性分子:HX,CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3 CH2OH非极性键=由同种元素的原子间形成的共价键,叫做非极性键。
同种原子吸引共用电子对的能力相等,成键电子云对称地分布在两核之间,不偏向任何一个原子,成键的原子都不显电性。
非极性键可存在于单质分子中(如H2中H—H键、O2中O=O键、N2中N≡N键),也可以存在于化合物分子中(如C2H2中的C—C键)。
非极性键的键偶极矩为0。
以非极性键结合形成的分子都是非极性分子。
存在于非极性分子中的键并非都是非极性键,如果一个多原子分子在空间结构上的正电荷几何中心和负电荷几何中心重合,那么即使它由极性键组成,那么它也是非极性分子。
由非极性键结合形成的晶体可以是原子晶体,也可以是混合型晶体或分子晶体。
例如,碳单质有三类同素异形体:依靠C—C非极性键可以形成正四面体骨架型金刚石(原子晶体)、层型石墨(混合型晶体),也可以形成球型碳分子富勒烯C60(分子晶体)。
极性分子和非极性分子
联系 说明
1. 以非极性键结合的双原子分子必为非极性分子; 2. 以极性键结合的双原子分子一定是极性分子; 3. 以极性键结合的多原子分子,是否是极性分子, 由该分子的空间构型决定。
键有极性,分子不一定有极性。
常见分子的构型及其分子的极性
类型 实例
结构
键的极性 分子极性
X2型: H2
非极性键 非极性分子
极性键
共价键的分类 非极性键
;佛山图文店 佛山图文店
;
,每一片沙滩,每一缕幽林里的气息,每一种引人自省、鸣叫的昆虫,都是神圣的你我的生活完全不同,印第安人的眼睛一见你们的城市就疼痛。你们没有安静,听不见春天里树叶绽开的声音、昆虫振翅的声音,听不到池塘边青蛙在争论你们的噪音羞辱我的双耳,这种生活,算活着? 我是印第 安人,我不懂。” 我是印第安人,我不懂。 后来,华盛顿州首府取了这位酋长的名字:西雅图。 有个当代故事:一个长年住山里的印第安人,受纽约人邀请,到城里做客。出机场穿越马路时,他突然喊:“你听到蟋蟀声了吗?”纽约人笑:“您大概坐飞机久了,是幻听吧。”走了两步,印第 安人又停下:“真的有蟋蟀,我听到了。”纽约人乐不可支:“瞧,那儿正在施工打洞呢,您说的不会是它吧?”印第安人默默走到斑马线外的草地上,翻开了一段枯树干,果真,趴着两只蟋蟀。 城市人的失聪,因为其器官只向某类事物敞开,比如金钱、欲望、键盘、电话、券、计算器从而关 闭了灵性。印第安人的听力不是“好”,而是正常和清澈,未被污染和干扰的正常,没有积垢和淤塞的清澈。一个印第安人耳朵里常年居住的,都是纯净而纤细的东西,所以只要对方一闪现,他就会收听到。 作为忠告,作为签约的条件,西雅图酋长继续对白人们说 “记得并教育你们的孩子, 河川是我们的兄弟,也是你们的,今后,你们须以手足之情对待它你们须把地上的野兽当兄弟,我听说,成千上万的野牛横尸草原,是白人从火车中射杀了它们。我们只为求活才去捕猎,若没了野兽,人又算是什么呢?若兽类尽失,人类亦将寂寞而死。发生在野兽身上的,必将回到人类身上若 继续弄脏你的床铺,你必会在自己的污秽中窒息。” 可惜,这些以火车和枪弹自负的工业主义者,并未被插着羽毛的话给吓住。他们不怕,什么都不怕。 清晨之人的声音,傍晚之人怎能听得进呢? 犹太作家以萨·辛格说:“就人类对其他生物的行为而言,人人都是纳粹。” 北美大陆的野牛, 盛时有4亿至5 亿只,19世纪中叶有4000万只,随着白人的火车行驶,50年后,仅剩数百只。 果真,野兽的命运来到了人身上。1874年,印第安人的领地发现了金矿,白人断然撕毁和平协议,带上炸药、地图和酒瓶出发了。很快,野牛的血泊变成了人的血泊。 印第安人的清晨陨落了,剩下的, 是星条旗的黄昏和庆祝焰火。 李奥帕德说过:“许多供我们打造出美国的各种野地已经消 失了。” 美利坚,基于北美的童年基因而诞生,乃流落欧洲几世纪的自由精神遇到辽阔大陆和清新野地的结果。而它功成之日,却蹂躏了赋予它容貌、体征、气质和恩泽的母腹。从此,它再也无法复制古 希腊的童话,只能以现代名义去铸造一个以理性、逻辑和法律见长而非以美丽著称的国家。 我常想,印第安人的挽歌,是否人类童年的丧钟? 若世间没有了孩子,还有诗意的未来吗? 叶芝在《偷走的孩子》中唱道 “走吧,人间的孩子! 与一个精灵手拉着手,走向荒野和河流。 这世界哭声 太多,你不懂。” 如果能选择,我也想做一个印第安人。 那些很少很少的人。 哪怕清晨开始,清晨死去。 谁偷走了夜里的“黑” ? 1 你见过真正的黑夜吗?深沉的、浓烈的、黑魆魆的夜? 儿时是有的,小学作文里,我还用过“漆黑”,还说它“伸手不见五指”。 从何时起?昼夜的边界模 糊了,夜变得浅薄,没了厚度和深意,犹如墨被稀释渐渐,口语中也剥掉了“黑”字,只剩下“夜”。 夜和黑夜,是两样事物。 夜是个时段,乃光阴的运行区间;黑夜不然,是一种境,一种栖息和生态美学。一个是场次,一个是场。 在大自然的原始配置中,夜天经地义是黑的,黑了亿万年。 即使有了人类的火把,夜还是黑的,底蕴和本质还是黑的。 “夜如何其?夜未央。庭燎之光。” 这是《诗经·庭燎》开头的话,给我的印象就是:夜真深啊。 那会儿的夜,很纯。 一位苗寨兄弟进京参加“原生态民歌大赛”,翻来覆去睡不着,为什么?城里的夜太亮了。没法子,只好以厚毛 巾蒙面,诈一回眼睛。在他看来,黑的浓度不够,即算不上夜,俨然掺水的酒,不配叫酒。 习惯了夜的黑,犹如习惯了酒之烈,否则难下咽。 宋时,人们管睡眠叫“黑甜”,入梦即“赴黑甜”。意思是说,又黑又甜才算好觉,睡之酣,须仰赖夜之黑:夜色浅淡,则世气不宁;浮光乱渡,则心 神难束。所以古代养生,力主亥时(约晚10点)前就寝,唯此,睡眠才能占有夜的深沉部分。 现代人的“黑甜”,只好求助于厚厚的窗帘了,人工围出一角来。 伪造黑夜,虚拟黑夜 难怪窗帘生意如此火爆。 2 昼夜轮值,黑白往复;日出而作,日落而息 乃自然之道、人生正解。 夜,是上天 之手撒下的一块布,一座氤氲的罩体,其功能即覆护万物、取缔喧哗、纳藏浮尘,犹若海绵吸水、收杂入屉。无夜,谁来叫停芸众的熙攘纷扰和劳顿之苦?何以平息白昼的手舞足蹈与嘈沸之亢?夜,还和精神的营养素 “寂”“定”“谧”相通,“夜深人静”意思是夜深,心方静远而这一切,须 靠结结实实的“黑”来完成:无黑,则万物败露,星月萎怠;无黑则无隐,无隐则无宁。 所以我一直觉得,黑,不仅是夜之色相,更是夜的价值核心。 黑,是夜的光华,是夜的能量,是夜的灵魂,也是夜的尊严。 “不夜城”,绝对是个贬义词。等于把夜的独立性给废黜了,把星空给挤兑和欺 负了。它侵略了夜,丑化了夜,羞辱了夜,仿佛闯到人家床前掀被子。 将白昼肆意加长,将黑夜胡乱点燃,是一场美学暴乱、一场自然事故。无阴润,则阳萎;无夜育,则昼疲。黑白失调,糟蹋了两样好东西。 往实了说,这既伤耗能源,又损害生理。我一直纳闷为何现代鸡发育那么快。真相 是:笼舍全天照明,鸡无法睡觉,于是拼命吃。见光吃食,乃鸡的秉性,人识破了这点,故取缔了黑,令其不舍昼夜地膨胀身子。 现代鸡是在疯狂的植物神经紊乱中被速成的。它们没有童年,没有青春,只有起点和终点。人享用的,即这些可怜的被篡改了生命密码的鸡,这些一声不吭、无一日 之宁的鸡。毕其一生,它们连一次黑夜都没体会,连鸣都没打过。 我想,应给其重新起个名:昼鸡,或胃鸡。 无黑,对人体的折磨更大,可谓痛不欲生。据说逼供多用此法,不打不骂,只用大灯泡照你,一两日挺过去,第三天,你会哭喊着哀求睡一会儿,哪怕随后拉出去枪毙。 3 黑夜,不仅 消隐物象,它还让生命睁开另一双眼,去感受和识别更多无形而贴心的东西。 成年后,我只遇上一回真正的夜。 那年,随福建的朋友游武夷山,在山里一家宾舍落脚。夜半,饥饿来了,大伙驱车去一条僻静的江边寻夜宵。 吃到一半,突然一片漆黑,断电了。 等骚动过去,我猛然意识到:它 来了,真正的夜来了。 亿万年前的夜,秦汉的夜,魏晋的夜,唐宋的夜 来了。 此时此刻,我和一个古人面对的一模一样? 山河依旧?草木依旧?虫鸣依旧? 是,应该是。那种弥漫天地、不含杂质、水墨淋漓的黑,乃我前所未遇。 星月也恢 复了古意,又亮又大,神采奕奕。还有脚下那条江, 初来时并未听到哗哗的流淌,此刻,它让我顿悟了什么叫“川流不息”,什么叫“逝者如斯”,它让我意识到它已在这儿住了几千年 我被带入了一幅古画,成了其中一员,成了高山流水的一部分。 其实,这不过是夜的一次显形,恢复其本来面目罢了。 而我们每天乃至一生的面对,皆为被改造 过的不实之夜。 几小时后,灯火大作,酒消梦散。 21世纪又回来了。 这是一次靠“事故”收获的夜。 对都市人来说,这样的机会寥寥无几。第一,你须熄掉现代光源,遭遇或制造一次停电。第二,你须走出足够远,甩掉市声人沸的跟踪,最好荒山野岭、人烟稀少,否则一束过路车灯、一架 红眼航班,即会将梦惊飞。 所以,这是运气。 4 夜的美德还在于,其遮蔽性给人生营造了一种社会文化:个体感和隐私性。 如果说,白昼之人,不得不在光天化日、众目睽睽下演绎集体生活模式,那么,黑则让人生从“广场状态”移入角落状态,夜成了除住宅空间外更辽阔的私生活舞台。所 以,“夜生活”即同义于“私生活”。 我向来觉得,生活的本质即私生活,私生活才是真正的生活。白天,人属于人群,不属于自我,正是夜,让世界还原成一个个私人领地和精神单元,正是黑的降临,才预示着生活帷幕的拉开。 但棘手的是:现代之夜的“黑”,明显减量了,不足值了。 现 代生活和城市发展的一个趋向是:愈发地白昼化,愈发地广场性。风靡各地的“灯光工程”“不夜工程”、无孔不入的摄像头,即为例。 凡诱惑之物,必成为一种资源,进而孕育一份产业。 终于,有人瞄上了“黑”,并把它变成巧克力一样的东西 2005年,商务区开了一家名为“巨鲸肚”的黑 暗餐厅,顾名思义,这是个伸手不见五指的人造空间。该餐厅分亮光区和黑暗区,客人先在亮区点餐,将手机、打火机、表链等发光品存储,再由佩夜视镜的侍者引入暗区。 一时间,该餐厅生意火爆,预订期长达一周。说是进餐,不如说猎奇,因为没人把吃当回事,据说饭菜并不可口,大家消 费的是黑绝对的、久违的、正宗的、业已消逝的“黑”。 我想,谁要打造一个名叫“夜未央”的诗意空间,肯定更卖座。 我也会去消费。夜如何其?夜未央,夜未央 说了这么多,其实我一点不厌光,相反,我深爱星月之华、烛火之灿。 夜里,微光最迷人,最让人心荡漾。 我厌倦的是“白夜 城市”“不夜工程”,它恶意篡改了大自然的逻辑和黑白之比,将悦目变成了刺眼。 对“黑”的偏见和驱逐,让这个时代有点蠢。 我觉得,人类应干好两件事 一是点亮黑夜,一是修复黑夜。 同属文明,一样伟大。 生活在险境中 ? 打开电视,一警官大学教授在教人同短信诈骗作斗争。另一 频道,专家正详解新版百元假钞的破绽,其仿真度已让验钞机歇了菜;紧接着,主持人纳闷为何黄瓜顶花戴刺、娇若新娘,谜底是避孕药的滋润。再换个频道,说了两件事:一是银行卡里的钱为何不翼而飞,专家提醒,操作ATM机时一定要警惕可疑摄像头,以防密码被钓;二是购房纠纷,律师告 诫,一定要反复推敲合同的每一句、每一字、每一标点 好了,我都铭记在心、烂熟于心了。感谢,感恩涕零。 站起来,朝电视机深鞠一躬。 我们生活在险境中,我们居住在楚歌里。 我们警惕地、愤怒地,如履薄冰、担惊受怕地过日子。 是不是有点悲壮? 我想,我若是个傻瓜,可怎么活啊! 这么多陷阱,这么多圈套和天罗地网
极性基团和非极性基团

极性基团和非极性基团
两个相同元素的非金属原子所组成的单质为非极性基团,通常以一个活泼金属和一个非金属组成的化合物为极性基团.
同种原子组成的为非极性基团,如过氧根O2 2-
极性基团是分子中的电子分布不产生显著电偶极矩的有机部分,这种基团对低极性有机溶剂呈现亲和性,并决定了分子的亲油特性。
区别在于基团的正负电荷中心是否重合。
极性基团亲水,非极性基团亲油。
极性基团是指正负电荷中心不重合的基团,基团的极性可以用偶极矩来表征。
距离为l,电量为±q的两个点电荷构成一个电偶极子,用电偶极矩(简称偶极矩)μ=ql来表征,极性基团偶极矩μ>0.5。
非极性基团是分子中的电子分布不产生显著电偶极矩的有机部分。
这种基团对低极性有机溶剂呈现亲和性,并决定了分子的亲油特性。
有机化学极性的概念

有机化学极性的概念有机化学中的极性是指有机分子中化学键的极性,或者是整个分子的极性。
极性主要由分子内部原子的电负性差异以及分子结构决定。
本文将从电负性的概念、极性的产生原因、有机化合物的分类以及常见的极性分子进行阐述。
电负性是衡量原子或者分子吸引外部电子对的能力的物理量。
常用的衡量电负性的指标是由芬兰科学家Pauling提出的Pauling电负性。
电负性差异越大,原子对电子的吸引力越强,原子越带有负电性,反之则带有正电性。
一般而言,非金属元素电负性较高,而金属元素电负性较低。
极性的产生原因有两个主要方面,分别是分子中键的极性以及分子的几何结构。
分子中的共价键可以分为两类:非极性键和极性键。
非极性键由两个电负性相当的原子组成,这两个原子各自对电子的吸引力相等,电子云对称地分布在两个原子之间,如氧气的O=O键。
极性键由两个电负性差异较大的原子组成,其中一个原子对电子的吸引力较强,电子云在空间上不对称地分布在两个原子之间,这就导致有部分正电荷集中在电负性较强原子附近,而有部分负电荷聚集在电负性较弱原子附近,如氨分子的N-H键。
分子的几何结构也会对极性起到重要的影响。
如果分子是线性排列的,即原子围绕着中心原子呈直线排列,那么这个分子是非极性的,如碳四键的四个氢原子分子。
如果分子是偏线性的或者是非线性的,那么这个分子是极性的,如水分子。
有机化合物根据其极性可以大致分为两类:极性有机化合物和非极性有机化合物。
极性有机化合物在分子中存在极性键,而非极性有机化合物则没有极性键。
极性有机化合物通常是小分子,如醇、醛、酮等。
这些分子通常具有强极性的官能团,如羟基、卡宁基等。
这些官能团在分子中带有部分电荷,可以与其他分子或离子进行氢键和离子键的相互作用。
而非极性有机化合物通常是大分子,如石油化合物、脂肪酸等。
这些分子中没有强极性官能团,因此分子间的相互作用主要是由分子的范德华力和疏水作用来实现的。
常见的极性分子有很多,如水分子、醇类化合物、酸类化合物等。
极性化合物和非极性化合物的概念

极性化合物和非极性化合物的概念
分子的极性与非极性是由分子的电荷分布情况决定的.极性分子是分子内部电荷分布不均匀造成的,非极性分子是分子内部电荷分布均匀造成的.键的极性是形成键的两个原子的原子核对电子的束缚能力不同而产生的.键的非极性是形成键的两个原子的原子核对电子的束缚能力相同而产生.
含有非极性键的极性分子:CH3-CH2-CH(CH3)2(C-C键即为非极性键,而整个分子由于电子分布不均匀而由极性)
含有极性键的非极性分子:CH3-CH2—CH3(由于此有机物机构上的对称性,它无极性,但C-H键为极性键)。
分子极性判断

分子概述 如果分子的构型不对称,则分子为极性分子。
如:氨气分子,HCl分子等。
区分极性分子和非极性分子的方法: 非极性分子的判据:中心原子化合价法和受力分析法1、中心原子化合价法: 组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子.如:CH4,CCl4,SO3,PCl52、受力分析法: 若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子.如:CO2,C2H4,BF33、非极性分子: 同种原子组成的双原子分子都是非极性分子。
不是非极性分子的就是极性分子了! 高中阶段知道以下的就够了: 极性分子:HX,CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3CH2OH 非极性分子:Cl2,H2,O2,N2,CO2,CS2,BF3,P4,C2H2,SO3,CH4,CCl4,SiF4,C2H4,C6H6,PCl5,汽油 简单判断方法 对于AnBm型 n=1 m>1 若A化合价等于主族数 则为非极性有机极性判断弱极矩μ 有机化合作大多难溶于水,易溶于汽油、苯、酒精等有机溶剂。
原因何在?中学课本、大学课本均对此进行了解释。
尽管措词不同,但中心内容不外乎是:有机化 合物一般是非极性或弱极性的,它们难溶于极性较强的水,易溶于非极性的汽油或弱极性的酒精等有机溶剂。
汽油的极性在课本中均未做详细说明,故而在教学中常 常做如下解释:所有的烷烃,由于其中的O键的极性极小,以及结构是对称的,所以其分子的偶极矩为零,它是一非极性分子。
烷烃易溶于非极性溶剂,如碳氢化合 物、四氯化碳等。
以烷烃为主要成分的汽油也就不具有极性了。
确切而言,上述说法是不够严格的。
我们知道,分子的极性(永久烷极)是由其中正、负电荷的“重心”是否重合所引起的。
根据其分子在空间是否绝对对称来判定极性,化学键极性的向量和——弱极 矩μ则是其极性大小的客观标度.分析1 常见烷烃中,CH4、C2H6分子无极性,C3H8是 折线型分子,键的极性不能相互完全抵消,其μ≠为0.084D。
高二化学下学期第六节非极性分子和极性分子1

(2)影响不同:化学键影响物质的 化学性质(稳定性),分子间作用力 影响物质的物理性质如熔沸点、溶解 度等。
(3)强度不同:分子间作用力比化 学键弱得多。化学键一般在几十千 焦到几百千焦,分子间作用力一般 在几千焦到十几千焦。
3、影响分子间作用力的因素:结构相似的分 子晶体,分子量大分子间作用力越强。
F2、Cl2、Br2、I2熔沸点顺序为:
4、相似相溶:极性分子易溶于极性溶
剂中;非极性分子易溶于非极性溶剂中。
解释Cl2、Br2、I2为什么在水中溶解度 小而在有机溶解中溶解度大?
小结
离子键
化学键
非极性键 共价键 配位键
极性键
非极性分子 极性分子 非极性分子
; /b/ssyqdq/ 搜索引擎大全 ;
对称结构有:直线性: CO2、CS2 正四面体:CH4、CCl4 正三角形:BF3
如果结构不对称,则为极性分子。
不对称结构 角型:H2O、H2S 三角锥形:NH3、PH3
三、分子间作用力
1、分子间作用力:分子间存在的作 用力叫分子间作用力,又称范德华力。
2、分子间作用力和化学键的区别;
(1)存在的位置不同:化学键存在于 分子内部,分子间作用力存在于分子间。
2、非极性分子:分子中正负电荷中
心重合,从整个分子来看,电荷的分 布是均匀的,对称的,这样的分子为 非极性分子。 如、N2、CL2、H2
3、判断方法
(1)双原子分子:
极性键形成的双原子分子为极性分 子 HCL 、HF
非极性键形成的双原子分子为非极 性分子 H2、CL2
(2)多原子分子
由极性键构成的多原子分子,如果 结构对称,则为非极性分子。
3、配位键:共用电子对由某一 原子单方面提供而与另一原子共 用。 形成条件:是一方有空轨道,另外 一方有孤对电子。
极性分子与非极性分子

D.只有②③④
D
19
H2O2、HCl、NH3等
9
么么么么方面
Sds绝对是假的
分子式
共价键 的类型
分子的空 间构型
分子的极性
H2 非极性键 直线型 HCl 极性键 直线型
非极性分子 极性分子
CO2 极性键 直线型 非极性分子 H2O 极性键 折线型(V型) 极性分子
NH3 极性键 三角锥型 极性分子 CH4 极性键 正四面体 非极性分子
16
3. NH3、H2S等是极性分子,CO2、BF3、CCl4等 是极性键构成的非极性分子。根据上述实例 可推出ABn型分子是非极性分子的经验规律是
A. 分子中不能含有氢原子 B
B. 在ABn分子中A原子没有孤对电子 C原. 子在质AB量n分子中A的相对原子质量小于B的相对 D. 分子中每个共价键的键长应相等
如:Cl2、Br2、I2在水中溶解度不大,但在 苯、四氯化碳等非极性溶剂中的溶解度大。
14
练习: 1. 下列物质受热熔化时,不需要破坏化学键
的是(C D) A.食盐 B.纯碱 C.干冰 D.冰
15
2.下列说法中,正确的是( A、 B) A.共价键是否有极性,决定于共用电子对是否有偏移 B.在多种元素形成的化合物中,可能含有几种化学键 C.分子是否有极性,只决定于形成的化学键 D.含有非极性键的分子必定是非极性分子
11
练习:
下列分子中,属于含有极性键的非极 分子的是(D) A. H2O B. Cl2 C. NH3 D. CCl4
12
研究分子极性的实际意义
1.相似相溶规则 2.相对分子质量相近的分子,分子的 极性越强,分子间的范德华力越大, 物质的熔沸点越高。
13
极性键与非极性键的判断-互联网类

极性键与非极性键的判断-互联网类关键信息项:1、极性键与非极性键的定义2、极性键与非极性键的判断方法3、常见化合物中极性键与非极性键的实例4、互联网资源在极性键与非极性键判断中的应用5、利用互联网进行学习和交流的注意事项11 极性键与非极性键的定义极性键是指不同种原子之间形成的共价键,由于原子的电负性不同,共用电子对会发生偏移。
非极性键则是同种原子之间形成的共价键,原子的电负性相同,共用电子对不发生偏移。
111 极性键的特点在极性键中,电负性较大的原子吸引电子的能力较强,导致电子对偏向该原子,使得键的两端出现部分正电荷和部分负电荷。
112 非极性键的特点非极性键中,由于原子相同,其吸引电子的能力相同,电子对在键的中央均匀分布,键两端的电荷分布均匀。
12 极性键与非极性键的判断方法判断极性键和非极性键的主要依据是形成共价键的原子的电负性差异。
121 电负性差值判断法如果两个原子的电负性差值大于 17,通常形成离子键;差值在 04 到 17 之间,形成极性共价键;差值小于 04,形成非极性共价键。
122 分子结构对称性判断法对于结构对称的分子,如二氧化碳(CO₂),其化学键为极性键,但由于分子结构对称,整个分子为非极性分子。
而对于水(H₂O),其分子结构不对称,尽管化学键为极性键,整个分子也是极性分子。
13 常见化合物中极性键与非极性键的实例在许多常见的化合物中,都存在极性键和非极性键。
131 含极性键的化合物如氯化氢(HCl)、水(H₂O)、氨气(NH₃)等,其中氢和氯、氢和氧、氮和氢之间的化学键均为极性键。
132 含非极性键的化合物氧气(O₂)、氮气(N₂)中的化学键为非极性键。
133 同时含极性键和非极性键的化合物过氧化氢(H₂O₂)中,氢氧键为极性键,氧氧键为非极性键。
14 互联网资源在极性键与非极性键判断中的应用互联网为学习极性键与非极性键的判断提供了丰富的资源。
141 在线课程许多教育平台提供了相关的化学课程,通过视频讲解、动画演示等方式,帮助学习者更直观地理解极性键与非极性键的概念和判断方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
