专题 无机推断
高考化学无机化学推断题专题复习
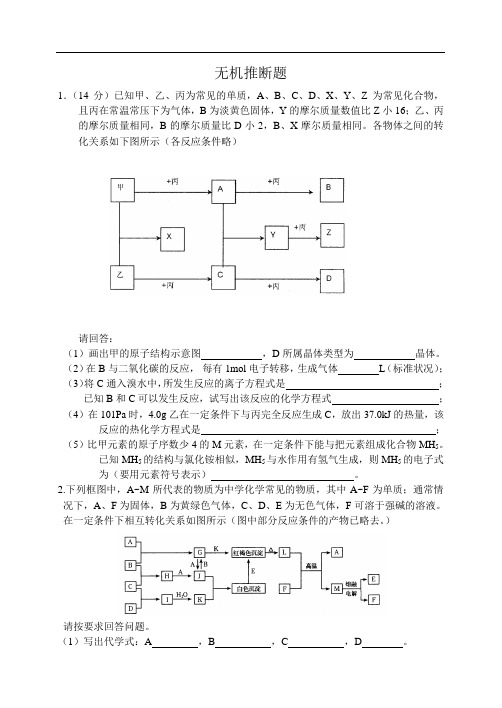
无机推断题1.(14分)已知甲、乙、丙为常见的单质,A、B、C、D、X、Y、Z为常见化合物,且丙在常温常压下为气体,B为淡黄色固体,Y的摩尔质量数值比Z小16;乙、丙的摩尔质量相同,B的摩尔质量比D小2,B、X摩尔质量相同。
各物体之间的转化关系如下图所示(各反应条件略)请回答:(1)画出甲的原子结构示意图,D所属晶体类型为晶体。
(2)在B与二氧化碳的反应,每有1mol电子转移,生成气体L(标准状况);(3)将C通入溴水中,所发生反应的离子方程式是;已知B和C可以发生反应,试写出该反应的化学方程式;(4)在101Pa时,4.0g乙在一定条件下与丙完全反应生成C,放出37.0kJ的热量,该反应的热化学方程式是;(5)比甲元素的原子序数少4的M元素,在一定条件下能与把元素组成化合物MH5。
已知MH5的结构与氯化铵相似,MH5与水作用有氢气生成,则MH5的电子式为(要用元素符号表示)。
2.下列框图中,A~M所代表的物质为中学化学常见的物质,其中A~F为单质;通常情况下,A、F为固体,B为黄绿色气体,C、D、E为无色气体,F可溶于强碱的溶液。
在一定条件下相互转化关系如图所示(图中部分反应条件的产物已略去。
)请按要求回答问题。
(1)写出代学式:A ,B ,C ,D 。
(2)I的电子式为,I与E在催化剂(如铂等)存在的条件下,发生反应的化学方程式为。
(3)将G的水溶液加热、蒸干、灼烧,最后得到的固体是;G与K反应的离子方程式为。
(4)写出下列反应的化学方程式:①L+F→A+M 。
②M→E+F 。
3.设X、Y、Z、A、B分别代表五种短周期元素,已知:①Y m-和Z n-两种离子具有相同的电子层结构;②Y和X可以形成原子个数比为1:1的化合物甲和原子个数比为1:2的化合物乙,甲和和乙都是共价化合物;③Z和X可以形成原子个数比为1:1的化合物丙,其分子与乙的分子所含质子数相同;④Y和A是同周期相邻的两种元素,Y 和B是同主族相邻的两种元素;⑤Y、A、B三种元素的原子序数之和为31。
高考化学高无机综合推断(大题培优 易错 难题)

高考化学高无机综合推断(大题培优易错难题)一、无机综合推断1.现有H、N、O、Na、S、Cl、Fe、Cu八种常见元素,回答下列问题:(1)Cl在周期表中的位置____________________;(2)Na+离子的结构示意图为__________________;(3)能说明非金属性Cl比S强的事实是_____________(用化学方程式表示);(4)物质A~L是由上述八种元素中的一种、二种或三种组成,A的摩尔质量166g·mol-1,其焰色反应呈黄色;B是最常见的液体;C中两元素的质量比为96∶7; D、E都为氢氧化物,E呈红褐色。
F、G、H、I为单质,其中F、G是无色气体,H是紫红色固体,I是黄绿色气体;L是常见的强酸。
它们有如下图所示的关系(部分反应条件及产物已略去):①C的化学式为____________________;②D的电子式为____________________;③L的稀溶液与H反应的离子方程式为_________________;④反应(a)的化学方程式为_______________。
【答案】第3周期ⅦA族 Cl2+H2S=S↓+2HCl Cu3N 3Cu + 8H++2NO3-=3Cu2++2NO↑+4H2O 4Na2FeO4 +10H2O = 4Fe(OH)3↓+8NaOH + 3O2↑【解析】【分析】前三问考查了元素周期表中“位构性”三者关系,后一问为无机推断大题,其推导思路: B 是最常见的液体则为水;E呈红褐色为氢氧化铁,D、E属同类物质,且D应该也含有钠元素故为氢氧化钠;F、G、H、I为单质,其中F、G是无色气体,H是紫红色固体即为Cu,C 中两元素的质量比为96:7,C分解得到G和H,可知生成Cu和氮气,故C为Cu3N,G为氮气;氮气与氧气放电生成NO,故F为氧气,J为一氧化氮,与氧气反应生成K为二氧化氮,二氧化氮与水反应生成L是常见的强酸硝酸;I是黄绿色气体则为氯气;A的摩尔质量为166g·mol-1,其焰色反应呈黄色,则含有钠元素,结合D、E、F可推知A为Na2FeO4。
伊宁县二中高三化学无机推断题_解题思路及经典总结课件

生成H 活泼的金属单质,Na、 生成H2:活泼的金属单质,Na、K、Mg(加热)、Fe(高温生成Fe3O4) Mg(加热 加热) Fe(高温生成 高温生成Fe 生成O 非金属单质(F 生成O2:非金属单质(F2),金属过氧化物(Na2O2),等 金属过氧化物(Na 金属碳化物: 金属碳化物:CaC2等; 金属氮化物: AlN; 金属氮化物:Mg3N2、AlN; 金属硫化物: 金属硫化物:Al2S3 等。
例1
下图中, 为常见的四种单质, 下图中, X、Y、Z、W为常见的四种单质,常温下 是固体, 是液体, 是无色气体, 为黄绿色气体, X是固体,Y是液体,Z是无色气体,W为黄绿色气体,B 的溶液显强酸性。 的溶液显强酸性。则: (1)X、 的化学式分别为: (1)X、Y、Z的化学式分别为:X Fe ,Y Br2 ,Z H2 。 (2)X元素在周期表中的位置是 元素在周期表中的位置是: 周期, (2)X元素在周期表中的位置是:第 四 周期,第 Ⅷ 族。 (3)写出 的水溶液与X 写出A (3)写出A的水溶液与X反应的离子方程 式: Fe + 2Fe3+ = 3Fe2+ 。 (4)写出 与过量W 写出C (4)写出C与过量W反应的离子方程 式: 2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ + 2Br2 + 6Cl- 。 Cl2 Br2 Br2 H2 HBr H2
特别提醒: 特别提醒:根据要求回答 近几年高考中出现很多考生不按要求答题而失分 失分。 近几年高考中出现很多考生不按要求答题而失分。 把答案写在密封线内,阅卷时无法看到答案而不给分; 如把答案写在密封线内,阅卷时无法看到答案而不给分; 要求写元素名称而错写成元素符号 而要求写元素符号 元素名称而错写成元素符号, 要求写元素名称而错写成元素符号,而要求写元素符号 又答成元素名称或分子式;要求写物质名称而错写成分 又答成元素名称或分子式;要求写物质名称而错写成分 子式;要求写结构简式的错写成分子式或名称 写结构简式的错写成分子式或名称; 子式;要求写结构简式的错写成分子式或名称;要求写 离子方程式而错写成化学方程式;要求画离子结构示意 离子方程式而错写成化学方程式;要求画离子结构示意 图而错答为原子结构示意图; 相对原子质量、 图而错答为原子结构示意图;把相对原子质量、相对分 子质量、摩尔质量的单位写成“ 把物质的量、 子质量、摩尔质量的单位写成“克”;把物质的量、摩 尔浓度、气体体积、质量、溶解度、密度、压强等的单 尔浓度、气体体积、质量、溶解度、密度、压强等的单 位漏掉;化学方程式、离子方程式不配平 不配平; 位漏掉;化学方程式、离子方程式不配平;热化学方程 不注明物质的状态等 式不注明物质的状态等。因此答题时必须按题目要求来 回答,避免不必要的失分。 回答,避免不必要的失分。
无机化合物推断训练

中考期间无机推断专题练习二1、右图示,A 为一种常见的单质,B 、C 、D 、E 是含A 元素的常见化合物,它们的焰色反应均为黄色,反应①的条件为加热。
填写下列空白:⑴写出B 电子式: ,B 中含有的化学键类型:C 的电子式 。
⑵写出下列反应化学反应方程式:① 。
③ ⑥ 。
⑶写出下列反应的离子方程式:② ,⑤ 。
⑷写出反应④的化学方程式并找出氧化剂还原剂以及单线桥标出电子转移的数目和方向。
⑸工业上如何制取物质A?用方程式表示:⑹可通过重要的工业反应来制取C ,用离子方程式表示:2、由短周期元素组成的单质A 、B 、C 和甲、乙、丙、丁四种化合物有如图所示的转化关系,已知C 为密度最小的气体,甲是电解质。
根据以上转化关系回答:⑴写出下列物质的化学式: A________,B________,乙________⑵组成A 的元素的原子结构示意图_____________,丙的电子式为______________。
⑶写出下列变化的方程式:①A 与NaOH 溶液反应的离子方程式:_________________ __。
②乙与适量的HCl 反应的离子方程式:______________________________ _______。
如将HCl 改为其它气体,则不需控制气体的量,写出相应的离子方程式:③甲与NaOH 溶液反应的化学方程式:_________________ ____________________。
④工业上如何制取A 物质,其方程式:⑤写出其丁的电离方程式: ⑥写出A 与氧化铁反应的化学方程式: 。
如何引发该反应? ⑷写出A 的两种用途: 、3、下图是部分元素的单质及其化合物的转化关系图(有关反应的条件及部分反应物或生成物已略去);已知:C 、D 、F 均为单质,其中C 、D 在常温、常压下是气体;反应②是化工生产中的重要反应,生成物E 具有漂白性;J 、K 均为不溶于水的沉淀,其中J 为红褐色。
无机化学推断题知识汇总

27 无机化学推断题知识汇总(一)化学中物质的颜色种类较多,但分散在各个知识中,比较零碎,而在物质推断题中常常用到颜色进行分析和判断,为了便于查找和记忆,规类总结如下:1.黄色黄色:AgI、Ag3PO4、P4(黄磷)、溴水(黄→橙)、FeS2、Al2S3、甲基橙在弱酸性、中性或碱性环境中、某些蛋白质加浓硝酸。
淡黄色:S、Na2O2、TNT、PCl5、AgBr、浓HNO3(混有NO2)、浓HCl(混有Fe3+)、(混有NO2)。
灰黄色:Mg3N 2棕黄色:FeCl3溶液、碘水(深黄→褐)。
2.黑色:CuS、Ag2S、Cu2S、HgS(黑色或红色)、FeS、FeO、Fe3O4、MnO2、CuO、Ag2O、I2(紫黑色)、Si(灰黑色)、C、Ag(粉末)、KMnO4(固体)、石油。
3.绿色:CuCl2溶液、Cu2(OH)2CO3、FeSO4·7H2O(浅绿色)、F2(淡黄绿色)、Cl2(黄绿色)、氯水(淡黄绿色)。
4.红色:Cu2O、Cu、甲基橙在酸性环境中、紫色石蕊试液在酸性环境中、酚酞在碱性环境中、品红试液、Fe(SCN)2+、Br2(深红棕)、红磷(暗红)、Br2的CCl4溶液(紫红)、苯酚被空气氧化(粉红)。
5.棕色:固体FeCl3、固体CuCl2、NO2(红棕)、Fe2O3(红棕)。
6.紫色:KMnO4溶液、I2的CCl4溶液。
7.灰色:As、Sn、Fe3C。
8.褐色:碘酒、2Fe2O3·3H2O、Fe(OH)3(红褐)。
9.蓝色:CuSO4·5H2O、Cu(OH)2、淀粉遇碘、紫色石蕊试液加碱、Cu2+的稀溶液。
(二)、无机推断知识规律1.同一元素的气态氢化物和气态氧化物反应,生成该元素的单质和水,元素可能是硫或氮。
2.同一元素的气态氢化物和最高价氧化物对应的水化物化合,生成盐的元素一定是氮。
3.两溶液混合生成沉淀和气体,这两种溶液的溶质可能分别是①Ba(OH)2与(NH4)2SO,;②可溶性铝盐与可溶性金属硫化物或可溶性碳酸盐或碳酸氢盐;③可溶性铁盐与可溶性碳酸盐或碳酸氢盐;④硫代硫酸盐与强酸(如盐酸、稀H2S04等)。
无机推理专题

@谚穆,陵确确随心推断题是目前最常见的题型之一,它浓缩了元素及其化合物的知识,具有考查知识点灵活、形式多样、能较高层次考查学生的综合应用能力等特点。
推断题能否顺利过关,是高考能否取得理想成绩的重要一环。
以下是无机推断题中寻找题眼的常用方法。
Q萎露蚕,根据物质的特殊性质进行推断1.常温下呈液态的单质和化合物Hg,Br2、H20、H2 022.带有颜色的物质(1)黑色物质:C、Mn02、CuO、FeO、Fe304(2)白色物质:BaSO,、BaC03、AgO、Mg(OH):、AI(OH)3(3)淡黄色物质:S、Na202、AgBr(4)黄色物质:AgI、Ag3 P04(5)红色物质:Cu20、Cu、Fe(SCN)3(6)紫色物质:KMn04、I:、[Fe(C6H50)6]3-(7)蓝色物质:Cu2、CuSO。
.5H20、Cu(OH):3.火焰颜色(1)苍白色火焰——氢气在氯气中燃烧(2)蓝色--CO在空气中燃烧(3)淡蓝色——甲烷、氢气、硫化氢在空气中的燃烧(4)黄色——含钠元素的物质在灯焰上灼烧(5)紫色(透过蓝色钴玻璃)——含钾元素的物质在灯焰上灼烧4.雾或烟雾的现象(1)在空气中出现白雾:HC1、HF、HBr、HI、NH3、HN03(极易溶于水的气态物质)(2)燃烧出现白色烟雾的是:P在C12中燃烧(3)燃烧出现棕黄色的烟:Fe、Cu在C12中燃烧5.具有唯一性的现象(1)溶于水显碱性的气体只有NH3。
(2)在空气中迅速由无色变为红棕色的气体只有NO。
(3)在一定条件下能漂白有色物质的淡黄色固体只有Na20:。
(4)在空气中能自燃的固体物质只有白磷。
(5)遇SCN-显/]L色的只有Ee3+,遇苯酚显紫色的只有re3+。
蠛小㈧试㈣身㈤手黼1.1根据反应框图25 -l填空,已知反应①一⑤均为工业生产及应用中常见的反应,其中B、G、I、J、L均为常见单质,且B、J、L均为气体。
A是工业生产中矿石原料的主要成分,其相对分子质量为120。
高三化学无机推断题专项练习

高三化学无机推测题专项练习1.A~H 都是初中化学中常有的物质,已知 B 为黑色固体, D 为红色固体单质, F 为红色固体,H 溶液中的溶质是一种盐.它们的转变关系以下图.请回答:(1)物质 B、E 和 F 的化学式为 B、E、F;(2)反响①的化学方程式为:,其反响种类为。
2.以下图是无机物A~ M 在必定条件下的转变关系(部分产物及反响条件未列出)。
此中, I 是由第三周期元素构成的单质中熔点最高的金属, K 是一种红棕色气体。
请填写以下空白:(1)在周期表中,构成单质 I 的元素位于第 __________周期 _________族。
(2)在反响⑦中氧化剂与复原剂的物质的量之比为 ___________________。
(3)在②、③、⑥、⑨中既属于化合反响又属于非氧化复原反响的是__________(填序号)(4)反响④的离子方程式是__________________________________。
(5)将化合物 D 与 KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。
该反响的化学方程式是_________________________。
3.(12 分)以下均为中学化学常有物质,存在以下转变关系( 部分产物已省略 ) 。
往常C为气体单质,G为紫黑色固体单质。
实验室中,常用固体 E 在 B 的催化下加热制取气体单质H。
(1)G的化学式; F 的电子式(2)反响②的离子方程式;(3)写出此外一种实验室制取 H的化学方程式;(4)D 溶液中阳离子的焰色反响火焰呈色;可用试剂查验 D 溶液中大批存在的阴离子。
4.(8 分) 现有 A、B、C、D四种短周期元素,A 分别与B、C、D 联合生成甲、乙、丙三种化合物, 且甲、乙、丙3 分子中含同样数量的质子数, C、D 联合生成化合物丁。
有关元素的单质和甲、乙、丙、丁四种化合物的转变关系以以下图:(1)写出B+乙→甲 +C 的化学反响方程(4)写出反响④的化学方程式。
无机推断题详解(常用知识)

常见气体单质气体:H2、O2、N2、Cl2(黄绿色)、F2(淡黄绿色)气态氢化物:NH3(无色有刺激性气味,易液化,极易溶于水,能使湿润的红色石蕊试纸变蓝,遇到HCl形成白烟)HCl(无色有刺激性气味,极易溶于水,能使湿润的蓝色石蕊试纸变红,在空气中形成白雾,遇到NH3形成白烟)H2S(无色有臭鸡蛋气味,蛋白质腐败的产物,能溶于水,能使湿润的醋酸铅试纸变黑)非金属气态氧化物:CO、CO2(直线型非极性分子)、NO(遇到空气变红棕色)、NO2(红棕色,加压、降温会转变成无色N2O4)、SO2(无色、有刺激性气味、能使品红溶液褪色)[固态氧化物]:SO3(无色晶体、易挥发)、P2O5(白色固体、易吸湿,常用作干燥剂)、SiO2(不溶于水、不溶于普通酸的高熔点固体,但溶于氢氟酸和强碱溶液)气态卤代烃:一氯甲烷(CH3Cl)、氯乙烯(CH2=CHCl)气态醛:甲醛(HCHO)2.题眼二:气体溶解性归纳难溶于水的:H2、N2、CO、NO、CH4、C2H4;微溶于水的:O2、C2H2;能溶于水的:Cl2(1:1)、H2S(1:2.6)、SO2(1:40);极易溶于水的:NH3(1:700)、HCl(1:500)、HF、HBr、HI。
3.题眼三:常见液态物质无机物:液溴Br2、水(H2O)、过氧化氢(H2O2)、二硫化碳(CS2)、三氯化磷(PCl3)有机物:一般5个碳原子以上的低级烃;除一氯甲烷、氯乙烯之外的低级卤代烃;低级醇;除甲醛之外的低级醛;低级羧酸;低级酯。
常见物质的颜色①红色:Fe(SCN)3(红色溶液);Cu2O(红色固体);Fe2O3(红棕色固体);液溴(深红棕色);Fe(OH)3(红褐色固体);Cu(紫红色固体);溴蒸气、NO2(红棕色)②紫色:Fe3+与苯酚反应产物(紫色);I2(有金属光泽紫黑色固体)KMnO4固体(紫黑色);MnO4-(紫红色溶液)钾的焰色反应(紫色)I2蒸气、I2在非极性溶剂中(紫色)③橙色:溴水(橙色)K2Cr2O7溶液(橙色)④黄色:AgI(黄色固体);AgBr(淡黄色固体);FeS2(黄色固体);Na2O2(淡黄色固体);S(黄色固体);I2的水溶液(黄色);Na的焰色反应(黄色);工业浓盐酸(黄色)(含有Fe3+);Fe3+的水溶液(黄色);久置的浓硝酸(黄色)(溶有分解生成的NO2);浓硝酸粘到皮肤上(天然蛋白质)(显黄色);⑤绿色:Cu2(OH)2CO3(绿色固体);Fe2+的水溶液(浅绿色);FeSO4?7H2O(绿矾);Cl2、氯水(黄绿色);F2(淡黄绿色);CuCl2的浓溶液(蓝绿色);⑥棕色:FeCl3固体(棕黄色);CuCl2固体(棕色)⑦蓝色:Cu(OH)2、CuSO4?5H2O、Cu2+在水溶液中(蓝色);淀粉遇I2变蓝色;Cu(OH)2溶于多羟基化合物(如甘油、葡萄糖等)的水溶液中(绛蓝色);⑧黑色:FeO;Fe3O4;FeS;CuO;CuS;Cu2S;MnO2;C粉;Ag2S;Ag2O;PbS;AgCl、AgBr、AgI、AgNO3光照分解均变黑;绝大多数金属在粉末状态时呈黑色或灰黑色。
无机推断题常见突破口归纳

无机推断题常见突破口归纳一.特殊颜色(1)火焰颜色S在空气中燃烧→淡蓝色火焰S在氧气中燃烧→蓝紫色火焰H2在空气中燃烧→淡蓝色火焰H2在氯气中燃烧→苍白色火焰CO在空气中燃烧→蓝色的火焰CH4在空气中燃烧→蓝色的火焰H2S在空气中燃烧→蓝色的火焰Na在空气中燃烧→黄色的火焰K在空气中燃烧→紫色的火焰红热Cu丝在Cl2里燃烧→棕黄色的烟铁丝在Cl2里燃烧→棕黄色的烟(2)有色溶液离子:Fe2+Fe3+ Cu2+MnO4—颜色:浅绿色黄色蓝色紫色(3)有色气体黄绿色:Cl2浅黄绿色:F2红棕色:NO2(4)絮状沉淀Fe(OH)2(白色絮状)、A1(OH)3(白色絮状)、Cu(OH)2(蓝色絮状)(5)有色固体.红色:1.Cu、Cu2O、Fe(SCN)3、有关指示剂(甲基橙在PH<3.1;酚酞在PH>10;石蕊在PH<5时)是红色的。
2.红磷是暗红棕色的粉末;Fe2O3是红棕色的粉末;Br2(g)、NO2是红棕色的气体;液溴是深红棕色的液体。
3.苯酚在空气中易被氧化而成粉红色;酚酞在PH=8~10时显浅红色。
4.Fe(OH)3是红褐色的沉淀。
5.溴在有机溶剂中的颜色一般可描述为橙红色;碘在有机溶剂中的颜色一般可描述为紫红色。
绿色1.碱式碳酸铜、绿矾(FeSO4·7H2O )、CuCl2的浓溶液、铜的焰色反应都是绿色的。
2.Fe2+ 是浅绿色的。
蓝色:1.水合铜离子、胆矾晶体、Cu(OH)2是兰色的、淀粉遇碘单质发生化学反应显蓝色、铜与稀硝酸反应后生成的溶液是兰色的。
2.多羟基化合物(如甘油、葡萄糖等)遇新制Cu(OH)2悬浊液显绛蓝色。
黑色:1.CuO、FeO、Fe3O4、MnO2、Ag2S、Ag2O、CuS、FeS、Cu2S、PbS、HgS、细小的某些金属粉末如:AgBr 分解后形成的Ag的颗粒等都是黑色的。
2、KMnO4、I2固体都是紫黑色的;原油是黑褐色的粘稠的液体。
3.C是无色或黑色的固体,Si是灰黑色的固体。
历年高考化学无机推断题集锦

历年高考化学无机推断题集锦高考复习面广量大,不少学生感到既畏惧,又无从下手。
同学们如何才能提高复习的针对性和实效性呢?下面来看看高考化学无机推断题,相信对你的复习有很大帮助~1.( 14分)下图是无机物A~N在一定条件下的转化关系(部分产物及反应条件未列出)。
其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
N中只含有两种元素,N可作为工业生产C的原料。
请填写下列空白:(1)在周期表中,组成单质G的元素位于第__________周期_______族。
(2)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_________(填写序号)。
(3)反应⑩的离子方程式是:_______ ______。
(4)反应④ 的离子方程式是:___________________________________。
(5)将化合物D 与KNO3、KOH 共融,可制得一种"绿色"环保高效净水剂K2FeO4 (高铁酸钾).同时还生成KNO2和H2O 。
该反应的化学方程式是:________________________________________________________________(6 )现有1molN参加反应,假设各步反应均完全,生成C的质量为490g,生成G 的质量为224g,则反应①的化学方程式为_______________________。
2.(10分)无机框图下图为中学化学中几种常见物质的转化关系(部分产物已略去)。
已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做致冷剂。
(1)写出化学式F ,写出电子式G ;(2)鉴定G中阳离子的实验方法和现象__________________________________;(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式和③的化学方程式。
(4)工业上电解B溶液制得一系列化工原料,写出其电解的化学方程式,并标出电子转移的方向和数目。
无机推断题 0611
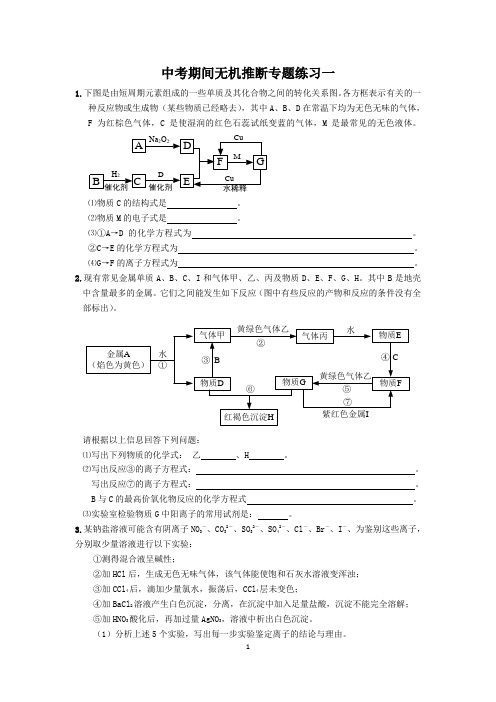
中考期间无机推断专题练习一1.下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。
各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无味的气体,F为红棕色气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。
⑴物质C的结构式是。
⑵物质M的电子式是。
⑶①A→D的化学方程式为。
②C→E的化学方程式为。
⑷G→F的离子方程式为。
2.现有常见金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H。
其中B是地壳中含量最多的金属。
它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:⑴写出下列物质的化学式:乙、H 。
⑵写出反应③的离子方程式:。
写出反应⑦的离子方程式:。
B与C的最高价氧化物反应的化学方程式。
⑶实验室检验物质G中阳离子的常用试剂是:。
3.某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-、为鉴别这些离子,分别取少量溶液进行以下实验:①测得混合液呈碱性;②加HCl后,生成无色无味气体,该气体能使饱和石灰水溶液变浑浊;③加CCl4后,滴加少量氯水,振荡后,CCl4层未变色;④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;⑤加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一步实验鉴定离子的结论与理由。
实验①;实验②;实验③;实验④;实验⑤;(2)上述5个实验不能确定是否存在的离子是4.下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。
(反应条件图中已省略。
)(1)A、B、C、D代表的物质分别为、、、(填化学式);(2)反应①中的C、D均过量,该反应的化学方程式是;(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是、(填化学式);(4)反应③产物中K的化学式为;(5)反应④的离子方程式为。
无机推断题(原卷版)

无机推断题一、元素或物质推断题1.某河道两旁建有甲、乙两化工厂,某兴趣小组的同学分别收集了两厂排放的污水带回学校进行实验探究,工厂的师傅告诉同学们甲、乙厂排放的工业废水中含有下列离子中的三种(各不相同)。
阳离子K+、Ag+、Fe3+阴离子Cl-、OH-、-NO3(1)甲同学测得甲厂的废水明显呈碱性,因此甲厂中所含有的离子:______;乙厂中所含有的离子:______(2)乙同学看到工厂师傅给出的离子后,认为可以在某工厂的废水中加入一种金属,从而回收另一种金属。
请写出反应过程中的离子方程式_________(3)丙同学认为将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子完全转化为沉淀,写出甲、乙两厂废水混合过程中反应的离子方程式________(4)经上述处理后废水的主要成份为:________2.下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色试验均为黄色。
请填写下列填空:(1)写出下列化学式:B___,C___;(2)按要求写出下列反应的方程式:①B→D反应的化学方程式:___;②A→C反应的离子方程式:___;③C→E反应的离子方程式:___。
3.已知A、D是两种金属单质,A燃烧时火焰呈黄色,A、B、C均含有同种元素,其中D是生活中应用最广泛的金属。
请回答下列问题A 2O Δ−−→B 2H O −−−→CD 2O 点燃−−−→E 24H SO→稀 F (1)根据上述反应推断B 、E 的化学式:B___________,E___________。
(2)金属单质A 露置在空气中,最终形成___________(填化学式)。
(3)写出B 生成C 的化学反应方程式: ___________。
(4)请写出E 与稀硫酸反应得到F 溶液的离子方程式___________。
(5)请设计实验验证溶液F 中所含的高价态金属阳离子: ___________。
4.各物质间的转化关系如下图所示,请完成下列空白(1)写出C 和H 的化学式:C_____;H ______。
元素化合物无机推断---2010年11月第一卷教师版

元素化合物无机推断专题(一)一、选择题专题1、【河北省】下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。
当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
下列说法中不正确的是( C )A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3 C.无论X是强酸还是强碱时,上面的一系列反应中都需要经历3个化合反应D.A是一种离子化合物2、【河北省】下列物质中不能通过置换反应生成的是 ( A )A.F2 B.CO C.Fe3O4D.S3、【河北省】下列物质不能通过化合反应直接制得的是 ( C )A.FeCl2 B.NaHSO3C.Cu(OH)2D.Fe(OH)34.[吉林省大安 ]下列变化一定属于化学变化的是( B )①导电②爆炸③缓慢氧化④品红褪色⑤无水硫酸铜由白变蓝⑥工业制O2⑦白磷转化为红磷⑧久置浓硝酸变黄A.②③④⑦⑧ B.③⑤⑦⑧ C.②③⑤⑥⑦ D.③④⑤⑦⑧5.[吉林省大安 ]某无色气体可能含有H2S、SO2、CO2、HI、HCl、NO2气体中的一种或几种,将气体通入过量氯水后,得到无色溶液,向该溶液中滴入BaCl2溶液,有白色沉淀生成,则下列叙述正确的是( A )A.该气体中肯定含有SO2 B. 该气体中肯定含有H2S和SO2C. 该气体中肯定含有SO2和CO2D. 该气体中肯定含有H2S、CO2和HI6.[吉林省 ]下列物质不能通过化合反应得到的是( C )A.Fe(OH)3 B.FeCl3C.H2SiO3D.NaHCO37.【贵州省兴义市第一次月考】不能实现下列物质间直接转化的元素是( D ) 氧化物酸或碱盐+O2+H2OA.碳 B.硫 C.钠 D.铜8、【贵州省兴义市崇文中学 】将某些化学知识用数轴表示,可以收到直观、简明、易记的效果,用数轴表示的下列知识正确的是【 C 】A.硫及其化合物的化合价与氧化还原反应的关系:B.分散系的分类:C.AlCl 3溶液与NaOH 溶液反应后铝元素的存在形式:D.CO 2与NaOH 溶液反应后的产物:9. [ 河北省正定中学 ]在以下物质间的多步转化过程中,其中含有不能通过一步反应实现的是( B )A .Fe →FeCl 2 → Fe(OH)2 → Fe(OH)3B .Al → Al 2O 3→ Al(OH)3 → NaAlO 2C .S →SO 2 →H 2SO 4→MgSO 4D .N 2→NO →NO 2 →HNO 310.【河北滦平汇英中学 】下列物质中,既能与NaOH 溶液反应,又能与盐酸反应,还能发生水解反应的是【 B 】① AlCl 3 ② NaHSO 4 ③ (NH 4)2CO 3 ④ ⑤ NaHCO 3 A .① ④ ⑤ B .③ ⑤ C .④ ⑤D .全部11.[2010届玉林高中理科综合]下列各组物质间反应,其中水既不作氧化剂又不作还原剂的氧化还原反应是[ D ] ①F 2和H 2O ②Na 和H 2O ③Na 2O 2和H 2O④NO 2和H 2O ⑤CaO 和H 2O ⑥Cl 2和H 2OA .③④⑤⑥B .①⑤C .②③⑤D .③④⑥12.[2010届广西禾池中学 ]下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( A )A .NaHSO 4和Ba(OH)2B .AlCl 3和NaOHC .NaAlO 2和H 2SO 4D .Na 2CO 3和HCl13.【陕西省镇安中学】在前一种分散系申漫慢滴加后一种试剂,能观察到先沉淀后变澄清的是( A ) ①氯化铝溶液中滴加氢氧化钠溶液 ②偏铝酸钠溶液中滴加盐酸 ③氢氧化钠溶液中滴加氯化铝溶液 ④氯化铝溶液中滴加氨水 ⑤硝酸银溶液中滴加氨水 ⑥氢氧化铁胶体中滴加硫酸A .①②⑤⑥B .②③④⑤C .①②④D .③④⑤3322()()+-3Al OHn n +4S+6S23233()()2CO OHn n -3例1、(06全国)下图是部分短周期...........H.2.O.已....元素的单质及其化合物的转化关系图(有关反应的条件及生成的略去..),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。
高三专题复习课件《无机推断题解题思路》【教学PPT课件 高中化学优质课】

CuO B H2JSO4CCFuuS2+NOa4 OH 试剂X
可用于检验糖尿病
△ H2O
A
C
Cu2(OH)2CO3
CH
CO2 化合物D Mg 金属E
非金属L O2
电解
浓溶液J
H2S△O4
SO2
M
酸性KMnO4H2SJO4
金属K Cu
化合物G
L
O2
金属E+化合物D→非金属H+化合物I 单质H+单质L→化合物G
无机推断题解题思路
高三专题复习课件
化学用语 的表达能力
信息处理能力 逻辑推理能力
基本理论 元素化合物知识
审 找 推 验 答
审
审:审清题意,从题干→框
找
图→问题浏览一遍,尽量在 框图中把相关信息表示出来。
推
验
答
例1:下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件 未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是 一种红棕色气体。
M的溶液
L O2红棕K色气H体2O J的溶液
第三周期熔
点最高金属 I
G
F的溶液 NaOH E
D
H
C的溶液
B H2O
A O2
FeS2 O2
审 找 推 验 答
审
找
找:找“题眼”,即找到解 题的突破口。
推 寻找特征反应或特殊现象
表现特殊的物理或化学性质的物质,或在反应中产生
验 的特殊现象,这些往往可以作为解推断题的突破口。 寻找利用高频信息 题中有一种元素或物质出现的频率特别高,与其它元
丙 Br2 Z FeBr3
Fe 乙
Y
高考化学无机推断题集锦

2021高考化学无机推断题集锦“无机框图推断题〞题眼知识准备:物质颜色L有色固体:白色:Fe〔0H〕2、CaCOS. BaSO4, AgCk BaSO3、筱盐,白色或黄色腊状固体:白磷淡黄色或黄色:S黄或浅黄、FeS2黄、Agl黄、Au黄、Na2O2浅黄、AgBr浅黄、Ag3Po4 浅黄等.红色或红棕色:Cu紫红、Cu20红、Fe2O3红棕色、Fe〔0H〕3红褐色.黑色:C、CuS、Cu2S、FeS、Mn02、FeO. Fe3O4 〔磁性物质〕、CuO. PbS、Ag20 棕黑紫黑色:12紫黑、KhfnO4紫黑.2有色溶液:Cu2+蓝、Mn04紫红、Fe2+浅绿、Fe3+棕黄、Fe 〔SCN〕 3血红、N02浅黄.——氯水浅黄绿色、滨水橙黄色、碘水棕黄色、溟的有机溶液橙红一红棕、12的有机溶液紫红3气体小结1、有颜色的包体:F2 〔淡黄绿色〕,C12 〔黄绿色〕,N02 〔棕色〕,澳蒸气〔红棕色〕、12 〔紫色〕、03 〔淡蓝色〕.其余均为无色气体.2、有刺激性的气体:HF, HCL HBr, HL NH3, S02, N02, F2, C12,溟蒸气.有臭鸡蛋气味的气体:H2S3、易溶于•水的气体:HF, HCL HBr, HI, NH3, S02和N02«能溶于水的‘〔体:C02,C12, H2S和溪蒸气.4、易液化的气体:NH3, SO 2, C125、有毒的气体:F2, HF, C12, H2S, S02, CO, NO, N02 和汰蒸气.6、在空弋中易形成白雾的气体:HF, HCL HBr, HI7、常温下由于发生化学反响而不能共存的气体:H2s和S02, H2s和C12, HI和C12, NH3 和HCL NO 和02, F2 和H28、其水溶液呈酸性且能使紫色石浅试液变红色的气体:HF. HC1, HBr, HI, H2S, S02, C02, N02和漠蒸气.可使紫色石蕊试液先变红后褪色的包体:C12.可使紫色石蕊试纸变蓝且水溶液呈弱碱性的气体:NH39、有漂白作用的气体:C12 〔有水时〕和S02.10、能使澄清石灰水变浑浊的气体:C02, S02, HFo11、能使无水CuS04变蓝的气体:水蒸气.12、在空气中可燃的气体:H2, CH4, C2H2, C2H4, CO, H2S.在空气中点燃后火焰呈淡蓝色的气体:H2S, CH4, CO, H2o13、具有氧化性的气体:F2, C12,浪蒸气,NO2, 02.具有复原性的气体:H2S, H2, CO, NH3, HI, HBr, HC1, NO.S02和N2通常既可显示氧化性又可技示复原性.14、与水可发生反响的气体:C12, F2, N02,澳蒸气,C02, SO2, NH3.其中C12, F2, N02,滨蒸气和水的反响属于氧化复原反响.15、在空气中易被氧化变色的气体:NO.16、能使湿润的KI淀粉试纸变蓝的气体:C12, N02,澳蒸气.17、遇AgN03溶液可产生沉淀的气体:H2S, C12,溟蒸气,HCL HBr, HI, NH3.其中NH3通入AgN03溶液产生的沉淀当NH3过量时会溶解.18、能使滨水和酸性KMnO4溶液褪色的气体:H2S, SO2, C2H2, C2H4.19、由于化学性质稳定,通常可作为保护气的气体:N2和Ar.20、制得的气体通常为混合气的是:NO2和N2O4,4物质的状态、气味硬度等:呈液态的金属单质:Hg 呈液态的非金属单质:Br2 呈液态的化合物:H2O常温呈气态的单质:H2> 02、C12、N2、F2、稀有气体等.地壳中元素的含量:0、Si、Al、Fe、硬度最大的单质:C (金刚石)形成化合物种类最多的元素:C方法二、根据特征反响现象推断知识准备:特征反响现象1焰色反响:Na+ (黄色)、K+ (紫色)2能使品红溶液褪色的化体可能是:加热恢发原颜色的是SO2,不恢兔的是C12、NaClO. Ca(C10)2等次氯酸盐、氯水、过氧化钠、过氧化氢、活性碳等3白色沉淀[Fe(OH)2]空气红褐色[Fe(0H)3](由白色—灰绿一>红褐色)4能在空气中自燃:P45在空气中变为红棕色:NO6能使石灰水变浑浊:C02、S027通C02变浑浊:石灰水(过最变清)、Na2SiO3、饱和Na2co3、浓苯酚钠、NaA1028体燃烧呈苍白色:H2在C12中燃烧:在空气中点燃呈蓝色:CO、H2、CH49遇酚猷显红色或湿润红色石蕊试纸变蓝的气体:NH3 (碱性气体)10使湿润的淀粉碘化钾试纸变蓝:C12, Br2> FeC13,碘水等.11加狗盼显紫色或加SCN-、显血红色或加碱产生红褐色沉淀,必有Fe3+12遇BaC12生成不溶于硝酸的白色沉淀,可能是:SO42、Ag+、SO32 ——13遇HC1 生成沉淀,可能是:Ag+、S1O32、A1O2. S2O32------------14遇H2so4 生成沉淀,可能是:Ba2+、Ca2+、S2O32. S1O32、A1O2 ------------15.与H2s反响生成淡黄色沉淀的气体有C12、02、S02、N0216电解时阳极产生的气体一般是:C12、02,阴极产生的气体是:H217两种气体通入水中有沉淀的是2H2S+SO2=3S+2H2O ;同一元素的气态氯化物和最高价氧化物对应的水化物生成盐的元素一定是氮(NH4NO3)18.两种溶液混介生成沉淀和气体,这两种溶液的溶质可能是①Ba(0H)2 hi(NH4)2SO4 或(NH4)2CO3 或(NH4)2SQ3②强烈双水解③可溶性铁盐与可溶性碳酸盐或碳酸氢盐④Na2s203 溶液与强酸H20 CO32 HCO3 CO2 Al OH 3 H2OAI3 与S2 HS H2S Al OH 3H2O Al OH 3 A10219.能使滨水褪色的物质:H2s和S02及它们相对应的盐、活泼金属、不饱和烧、醛、酚、碱20.两物质反响先沉淀后溶解的有:C02与Ca9H)2或Ba(0H)2、NaOH与铝盐、氨水与AgN03、强酸与偏铝酸盐知识准备:依据特征结构1.正四面体型分子:CH4、31H4、CC14、31cl4、P4 等.2.直线型分子:乙快、二氧化碳、二硫化碳等.3 .平面型分子:苯、乙烯等.4 .含有非极性共价键的离子化合物:过氧化钠(Na2O2)、二硫化亚铁(FeS2). C 心等.5 .含有 10 个电子的粒子:离子:02、F 、Ne 、Na+、Mg2+> A13+、NH4+、H3O+、OH 、 NHZ 分子: --------- CH4、NH3、H2O 、HF6 .电子总数为 18 的粒子:分子:Ar 、F2、S1H4、PH3、H2S 、HCk H2O2、C2H6、CH3OH. CH3NH2. CH3F 、NHZ OH 、NHZ —NH2 等:离子:K+、Ca2+> HS —、S2—、Cl —、 022—7 . 9 个电子的粒子:一OH 、—CHS. —NH2、F 方法三、根据特殊反响条件推断知识准备:熟悉具仃特殊反响条件的反响,多数是重要工业生产反响 1、高温条件C+H20co2+2H2, 3Fe+4H2OFe3O4+4H2, CaCO3CaO+CO2,高温 高温 SiO24-CaCO3CaSiO34-CO2, SQ2 + 2CS1 +2coT ,SiOCaSiO3, 2+ CaO 高温 高温 4FeS2+llO22FeNa2SiO3 + CO2 2O3 + 8SO2, SiO2+Na2CO3 2、高温高压催化剂:N2+3H23、催化剂、加热: 催化剂 高温高压H2+C0, C + 2H2O2NH3催化剂 4NH3 + 5O24NO + 6H2O 2SO2 + O2A MnO 2H202 2H2O + O2T △ 催化剂 加热 2s032KC103Mn0△ 2KC1 +302T4、放电:N24-O22NO302203方法四、根据特征转化关系推断知识准备:1、一般思路是找出特别的变化关系,用可能的几种情况试探,得出介理答案2、掌握一些特别的连续变化关系33、注意几个典型转化关系 三角转化:4、置换反响:或H2O1.金属盐金属盐活泼金屈(Na 、Mg 、Fe) H M2 (1)金属一>金属 (2)金属一>非金属 点燃2铝热反响 2MgO C 2Mg CO22F2 2H2O 4HF 02 高温 Si 2CO 〔3〕非金属一非金属 2c SiO2高温 CO H2 c H2OCl 〔Br 、I 〕 HS S 2HC1 〔HBi\ HI 〕 2 222H2金属氧化物高温 金属H2O 〔4〕非金属一>金属 高温 金属〔1〕 O2O22OA B C OOHO222 〔气体〕 NO 222②H2s 〔气体〕 SO2222 CO CO2 222 Na2O Na2O2〔2〕A 与强酸或强碱的反响H D 〔酸或粉NO2 HNO3 ①NH3 S03 H2SO4 OOHOH2CO3 ③C 〔固体〕00H0 NaOH @Na 〔固体〕00H0A 为弱酸的钱盐:(NH4)2CO3或NH4HCO3; 〔KH4〕2S 或 NH4HS ; 〔NH4〕2SO3, NH4HS0C02 C金属氧化物5、与碱反响产生气体Ak Si OH H2 碱⑪单质2Al 2NaOH 2HO 2NaAlO 3H ⑫核盐:NH4 NH3 H2O 222 Si 2NaOH H20 Na2SiO3 2H26、与酸反响产生气体HC1 H2 浓H2SO4SO2 金属HNO3NO2、NO ⑪®浓HS04NO2 单质SO2 、CO2 2 C 浓HNO3CO2非金属浓HS04SO2 2 S 浓HN03SO2 、NO2H CO32 HCO3 CO2H化合物S2 HS H2S2 H SOHSO SO23 37、既能酸反响,又能与碱反响Al、A12O3、Al〔0H〕3.弱酸的酸式盐〔NaHC03、NaHSOS. NaHS 等〕、弱酸的氨盐[NH4HCO3、〔NH4〕2CO3. NH4HSO3、〔NH4〕2SO3. 〔NH4〕2S. NH4Hs 等]、氨基酸等;8、与水反响产生气体2Na2O2 2H2O 4NaOH 022Na 2H2O 2NaOH H2 Mg3N2 3H2O 3Mg OH 2 2NH3 〔 1 〕单质〔 2 〕化合物2F2 2H2O 4HF 02 AI2S3 6H2O 2AI OH 3 3H2S CaC 2HOCa OH CH222229、气体反响特征〔1〕苍白色:H2在C12中燃烧:〔2〕蓝色:CO在空气中燃烧:〔3〕淡蓝色:H2S.CH4、CH3CH2OH. 3等在空气中燃烧:〔4〕明亮的蓝紫色:3在纯氧中燃烧;〔5〕金属的焰色反响烟、雾〔1〕在空气中形成白雾的:HCk HBr 、HI 、NH3等气体及浓盐酸、浓硝酸;〔2〕相遇形成白烟或固体的:NH3+HCR NH3+HBr 、NH3+HNO3, H2S+SO2. H2S+C12: 〔3〕燃烧时出现白色烟雾的:〔P+C12〕; 〔4〕燃烧时出现棕黄色烟的:〔CuC12〕.10、受热分解产生2种或3种气体的反响: NH4HCO3[(NH4)2CO3] NH3 CO2 2Cu(NO3)2 2CuO 4NO2 02 酸盐 NH SO HO 43423322NH3 H2S NH4HS[(NH4)2S](3)硝酸:4HNO3=2H2O+4NO2f+O2T(4)碱式碳酸铜:Cu2(0H)2co3=2CuO + CO2T +H20 (5)碳酸氢盐:ZNaHCO △ 2CO3+H2O4-CO2; Ca(HCO3)2rajmlCaO+H2O4-2CO2方法五、根据特殊工业生产推断知识准备:重要工业生产反响1、煨烧石灰石2、煨烧黄铁矿3、二氧化硫的催化氧化4、氨的催化氧化5、合成氨6、电 解饱和食盐水7、工业制盐酸8、高炉炼铁9、工业制取漂粉精10、工业制水煤气11、硅酸 盐工业方法六、根据特征数据推断知识准备:近两年计算型推断题成为高考热点之一,解这类题时要善「抓住物质转化时相 为分子质量的变化〔例C0—C02, NO T N02, SO2—SO3转化时分子中都增加1个氧原 子,相对分子质量变化均为16 〕:放出气体的体积或生成沉淀的量:化合物中各元素的含 量:气体的相对密度:相对分子质量;离子化合物中离子个数比:反响物之间的物质的量比: 电子总数;质子总数等重要数据. 能够做喷泉实验的气体1、NH3、HCL HBr 、HI 等极易溶于水的气体均可做喷泉实验.2、C02、C12、S02与氢氧化钠溶液;3、C2H2、C2H2与澳水反响“10电子〞、“18电子〞的微粒小结 1.2. 4,18H2O(1)钱盐 NHHSO[(NH)SO] (2)硝 2Ag 2NO2 02 2AgNO3几个很有必要熟记的相等式量能使酸性高钵酸钾溶液褪色的物质〔-〕无机1 . 一2价破的化合物〔H2S 、氢硫酸、硫化物〕;2 . +4价硫的化合物〔SO2、H2s03及亚硫酸盐〕:3 .双氧水〔H2O2,其中氧为一1价〕 元素的一些特殊性质4 .周期表中特殊位置的元素①族序数等于周期数的元素:H 、Be 、Al 、Ge ②族序数等于周期数2倍的元素:C 、So ③族序数等于周期数3倍的元素:0. ④周期数是族序数2倍的元素:Li 、Ca o ⑤周期数是族序数3倍的元索:Na 、B⑥最高正价与最低负价代数和为零的短周期元素:Co ⑦最高正价是最低负价绝对值3倍的短周期元素:So ⑧除H 外,原子半径最小的元素:F . ⑨短周期中离子半径最大的元 素:Po5 .常见元素及其化合物的特性①形成化合物种类最多的元索、单质是自然界中硬度最大的物质的元素或气态氢化物中氢 的质量分数最大的元素:Co②空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N a③地壳中含量最多的元素、气态氢化物沸点最高的元素或氢化物在通常情况下呈液态的元 素:Oo④最轻的单质的元素:H :最轻的金属单质的元素:Li .⑤单质在常温卜.呈液态的非金属元素:Br :金属元素:Hg o⑥最高价氧化物及其对应水化物既能与强酸反响,又能与强碱反响的元索:Be 、Ak Zno ⑦元素的气态氨化物和它的最高价氧化物对应水化物能起化合反响的元素:N:能起氧化还 原反响的元素:So⑧元索的气态氢化物能和它的氧化物在常温卜;…生.成核兀素单质的兀素•: SoNe 3 Fe CuOAr20 KHCO3 56 CaO 80 SO3 40 Ca HF 3N2 KOH NaOHBr. NH4NO3 MgO N2 H2SO4 C3H8 28 C2H4 98 44 CH3CH2CH2OH CO H3PO4 N2O 1.常用相对分子质量 Na2O2: 78Na2c03: 106 BaS04: 233 Al (OH)3: 78 CuSO4 CH3COOH CO2 64 160 Fe2O3 Br2 HCOOCH3 NaHCOS : 84 C6H12O6:Na2so4: 14260⑨元素的单质在常温下能与水反响放出气体的短周期元素:Li、Na、Fo ⑩常见的能形成同素异形体的元素:C、P、0、So。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三、根据特征转化关系推断
• 知识准备: • 1、一般思路是找出特别的变化关系,用可能的几 种情况试探,得出合理答案. • 2、掌握一些特别的连续变化关系 • A为NH3、H2S、S、CH4、C、Na, D为O2; • A为Cl2,D为Fe; • A为Al3+,D为OH- A为AlO2-,D为H+ • A为C, D为H2O • A为HNO3,D为Fe • A为NaOH D为CO2(SO2)
专题 无机推断
(一)无机框图推断题
解题思路
• 无论推断题属于哪种物质形式,均 遵循这样的推理思路:迅速浏览、 整体扫描、产生印象、寻找突破口 、注意联系、大胆假设、全面分析 (正推或逆推)、验证确认。解题的 关键是仔细审题,依物质的特性或 转化特征来确定“突破口”,顺藤 摸瓜。
框图题的“题眼”主要有以下几方 面
1、物质的特有颜色; 2、特征反应现象; 3、特征转化关系; 4、特殊反应条件; 5、重要工业生产反应;
一、根据物质的特有颜色推断
• 常见的有颜色的物质 • 黄色:S、Na2O2、AgBr、AgI久置的浓硝酸(溶有NO2)、工业盐酸( 含Fe3+); • 白色:无水CuSO4、AgCl、BaSO4、CaCO3、Al(OH)3、Mg(OH)2 黑色粉末、晶体:MnO2、Fe3O4、CuS、C、CuO;FeS 、 • 紫黑色固体:KMnO4、I2; 红色固体:Cu、Cu2O; • 红棕色粉末:Fe2O3、红磷; 红褐色沉淀:Fe(OH)3; • 红棕色气体:Br2、NO2;紫红色溶液:MnO4-;红色溶液Fe(SCN)3 • 橙(红)色溶液:Br2水(Br2CCl4溶液);蓝色晶体CuSO4•5H2O; 蓝 色沉淀:Cu(OH)2; 蓝色溶液:Cu2+;浅绿色溶液:Fe2+; 棕黄色溶 液:Fe3+; 黄绿色气体:Cl2。 • 火焰:淡蓝色:H2、CO、CH4、S在空气、S在纯氧(蓝紫色) 苍白色 :H2在Cl2中燃烧. 黄色:Na的燃烧 棕色的烟:CuCl2 白色的烟:HCl 与NH3反应
• i:能使湿润的红色石蕊试纸变蓝的气体是NH3; • j:遇碱反应产生气体的物质是Al、Si、铵盐,产 生气体一般是H2、NH3; • k:遇水反应产生气体的物质一般是Na、F2、Na2O2 ; • l:既能与酸反应又能与碱反应的物质是Al、Al2O3 、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐 • m:即产生沉淀又产生气体的物质一般是CaC2、n :一种物质分解产生三种物质的物质有NH4HCO3, (NH4)2CO3,KMnO4,HNO3,NaHCO3
置换反应:
• 1)金属→金属 (2)金属→非金属
1.金属 盐 金属 盐 2.铝热反应
2 活泼金属(Na、Mg、Fe) H 或H H 2 O 2Mg CO2 点燃 2MgO C
(3)非金属→非金属
2 F2 2 H 2 O 4 HF O2 高温 2C SiO2 Si 2CO 高温 C H 2 O CO H 2 Cl ( Br 、I ) H S S 2 HCl(HBr、HI) 2 2 2 2
• 4)非金属→金属 H 金属氧化物高温 金属 H O 2 2
C 金属氧化物高温 金属 CO2
四、根据特殊反应条件推断
• 熟悉具有特殊反应条件的反应,如:高温
ห้องสมุดไป่ตู้
• 高温高压催化剂
• 加热、催化剂
• 电解
五、根据重要工业生产反应推断
• • • • • • 我们学过哪些重要工业生产反应? 1、煅烧石灰石 2、煅烧黄铁矿 3、二氧化硫的催化氧化 4、氨的催化氧化 5、合成氨 6、电解饱和食盐水 7、工业制盐酸 8、高炉炼铁 9、工业制取漂粉精 10、工业制水煤气 11、 硅酸盐工业
二.利用特殊反应现象推断
• a:焰色反应显黄色的元素是Na,显紫色(透过蓝色钴玻璃)的元素 是K; • b:有臭鸡蛋气味或能使湿润的Pb(AC)2试纸变黑的气体是H2S; • c:在空气中有无色迅速变为红棕色的气体是NO; • d:使品红溶液褪色的往往是SO2(Cl2使品红溶液褪色后不恢复); • e:能使淀粉变蓝的是I2; • f:与碱溶液反应生成白色沉淀且放置空气中变灰绿色最终变红褐色的 离子是Fe2+; • g:滴入SCN—溶液显血红色以及遇苯酚显紫色的离子是Fe3+; • h:既能与酸反应又能与碱反应且生成气体的物质一般是 • Al,NH4HCO3、 (NH4)2CO3,
