无源医疗器械的生物性能检验
无菌医疗器械产品检测

无菌医疗器械产品检测无菌医疗器械产品检测1. 简介无菌医疗器械产品的检测是确保产品在生产过程中不被细菌、真菌和其他微生物污染的关键步骤。
无菌器械通常用于直接接触体内组织或者系统,必须保持无菌状态,以防止感染和交叉感染的发生。
无菌器械产品的检测是一个综合性的过程,包括多个方面的,如微生物检测、物理性能、生物安全性评估等。
这些旨在确保产品的质量和安全性,对于制造商和使用者来说都至关重要。
2. 检测方法2.1 微生物检测微生物检测是无菌医疗器械产品检测的核心内容之一。
常见的微生物检测方法包括菌落总数测定、细菌培养、真菌培养等。
这些方法可用于检测产品表面、空气中以及其他潜在的污染源中的微生物污染情况。
2.2 物理性能物理性能是评估无菌医疗器械产品的关键指标之一。
这些通常包括产品的力学性能、密封性能、生物相容性等方面的。
力学性能可以评估产品的强度和耐久性,密封性能可以评估产品的封闭性能,生物相容性可以评估产品与人体组织的相容性。
2.3 生物安全性评估生物安全性评估是对无菌医疗器械产品进行风险评估的重要环节。
这些评估通常包括对产品材料的毒性、致病性以及其他潜在风险的评估。
通过生物安全性评估,可以对无菌器械产品的安全性进行全面的评估和控制。
3. 检测流程无菌医疗器械产品的检测流程通常遵循以下步骤:1. 样品采集:从生产线上取得一定数量的产品样品,确保样品的代表性。
2. 微生物检测:对样品进行微生物检测,包括菌落总数、细菌培养、真菌培养等。
3. 物理性能:对样品进行物理性能,包括力学性能、密封性能、生物相容性等。
4. 生物安全性评估:对样品进行生物安全性评估,包括对产品材料的毒性、致病性以及其他潜在风险的评估。
5. 结果分析:根据结果进行数据分析和评估,确定样品是否符合无菌医疗器械产品的要求。
6. 报告输出:根据分析结果,检测报告,包括数据、评估结果和建议。
4. 检测标准无菌医疗器械产品的检测通常参考相关的国家和地区标准。
无源医疗器械检测内容

无源医疗器械检测内容无源医疗器械检测是指对于没有外部电源,不需要通过电线等方式与外界通信的医疗器械进行检测,确保它们的性能和质量符合标准,为医疗保健提供更加安全、高效的设备支持。
下面,我们分步骤来阐述无源医疗器械检测内容。
第一步:了解无源医疗器械的类别无源医疗器械主要包括温度计、血压计、血糖仪、心电图仪等。
这些器械没有自身的能量来源,需要借助外界能量来工作,且通常不需要进行数据传输。
因此,无源医疗器械检测的重点是对其基本参数进行测试,如精度、重复性、线性等。
第二步:检测器械符合标准要求无源医疗器械检测的目的是确保其符合国家相关标准要求。
例如,国家药品监管局颁布的《医疗器械质量管理规范》中规定了无源医疗器械在生产、质量控制、性能测试、标志标识、储存等各个环节应遵循的规定。
检测员需要根据这些规定对无源医疗器械进行全面检测,确保器械质量完好。
第三步:设备稳定性测试由于无源医疗器械没有自身的能量来源,它们的工作稳定性、数据精度受到环境噪声的影响比较大。
因此,测试人员需要检查这些设备在不同环境条件下的稳定性。
他们需要将无源医疗器械放在低温、高湿等不同环境下测试,以确保这些设备能够在各种不同的环境中正常工作。
第四步:维护保养在检测过程结束后,仪器的维护保养也是非常重要的一个环节。
无源医疗器械通常比较小巧、易于操作,但这并不意味着它们不需要维护保养。
测试人员需要根据厂商提供的说明书对这些设备进行清洁、消毒和保养,以确保它们的寿命和性能。
综上所述,无源医疗器械检测的核心内容是对设备基本参数的测试、遵循国家相关标准要求、设备稳定性测试和设备保养维护。
这样的检测可以确保无源医疗器械的工作性能和质量可以满足严格的生产和使用要求,有利于提高医疗保健的质量和安全性。
医疗器械的质量标准及检验方法

医疗器械的质量标准及检验方法医疗器械在医疗行业中扮演着重要的角色,它们的质量直接关系到患者的生命安全和治疗效果。
为了确保医疗器械的质量,制定了一系列的标准及相应的检验方法。
本文将介绍医疗器械的质量标准及常见的检验方法。
一、质量标准医疗器械的质量标准是制定者提出的对医疗器械质量的要求。
这些标准根据医疗器械的种类和用途不同而有所区别。
一般来说,医疗器械的质量标准包括以下几个方面:1. 强度和稳定性强度和稳定性是评价医疗器械质量的重要指标之一。
医疗器械在使用过程中需要承受一定的力量和压力,因此其强度和稳定性必须能够满足相应的要求。
例如,手术钢器械的强度要求高,需要能够承受高压和高温的冲击。
2. 生物相容性医疗器械与人体接触时,必须保证其生物相容性良好,不产生不良反应。
生物相容性包括对人体的刺激性、过敏性和细胞毒性等方面的评估。
3. 材料安全性医疗器械的材料必须符合相关的安全性要求,不能对人体造成伤害。
例如,耐腐蚀性的材料在接触人体液体时不会产生有害物质。
4. 环境适应性医疗器械在不同的环境条件下必须能够正常工作,不受外界因素的干扰。
环境适应性的评估包括对温度、湿度、气压等因素的考虑。
二、检验方法为了确保医疗器械的质量符合标准要求,采用一系列的检验方法进行检测。
常见的检验方法包括以下几种:1. 外观检查外观检查是最基本的一种检验方法,通过对医疗器械的外观进行观察来评估其表面是否有瑕疵、变形或污染等问题。
2. 功能性能测试功能性能测试是评价医疗器械是否满足其预期功能的一种方法。
通过模拟实际使用情况,测试医疗器械在不同条件下的工作情况。
3. 物理性能测试物理性能测试包括力学性能测试、磨损性能测试、耐腐蚀性测试等。
通过对医疗器械的物理性能进行测试,评估其强度、耐久性等指标。
4. 包装测试包装测试主要针对医疗器械的包装材料和包装方式进行评估。
测试包括外包装的完整性和内部包装的保护性能等。
5. 生物学性能测试生物学性能测试主要用于评估医疗器械与人体接触时是否会产生不良反应。
医疗器械生产质量管理规范无菌医疗器械检查评定标准

医疗器械生产质量管理规范无菌医疗器械检查评定标准无菌医疗器械对于手术和治疗过程中的感染控制具有至关重要的作用。
为了确保无菌医疗器械的质量安全,医疗器械生产企业需遵循一定的质量管理规范,并根据相关标准进行无菌医疗器械的检查和评定。
本文将详细介绍医疗器械生产质量管理规范以及无菌医疗器械的检查评定标准。
一、医疗器械生产质量管理规范1. 设备和环境管理:医疗器械生产企业应确保生产环境的洁净度,必要时需要对关键设备进行验证和监控。
对于与无菌医疗器械相关的生产设备,则需要进行更严格的管理和控制,以确保无菌环境中的生产过程符合要求。
2. 人员培训和操作规范:医疗器械生产企业应对从事无菌医疗器械生产的人员进行必要的培训,并建立相应的操作规范。
培训的内容包括无菌操作技术、无菌器械生产流程、质量控制要求等。
同时,企业还需建立健全的人员考核和纪律管理制度。
3. 原材料和辅料管理:无菌医疗器械的质量安全与所使用的原材料和辅料密切相关。
医疗器械生产企业应确保所采购的原材料和辅料符合相关的标准和要求,并建立相应的接收检验和质量控制制度。
同时,对于与无菌医疗器械直接接触的原材料和辅料,还需进行更为严格的检验和管理。
4. 工艺控制和质量检验:医疗器械生产企业应建立完善的工艺控制和质量检验流程。
在无菌医疗器械的生产过程中,需要采取适当的消毒和灭菌措施,以确保器械的无菌性。
同时,还需要对生产过程中的各个环节进行监控和验证,确保质量控制的有效性和可追溯性。
二、无菌医疗器械检查评定标准1. 外观检查:无菌医疗器械在外观上应无明显的污染、破损和其他缺陷。
外观检查应包括对器械表面、包装和标志的检查,确保无菌医疗器械在运输和存储过程中没有受到污染或损坏。
2. 性能检验:无菌医疗器械的性能应符合相关的技术要求和标准。
性能检验的内容包括对器械的使用功能、材料的可靠性和耐久性进行测试。
通过性能检验,可以评估无菌医疗器械是否具备满足临床需求的基本功能。
医疗器械型式检验、检测生物、化学送样数量说明
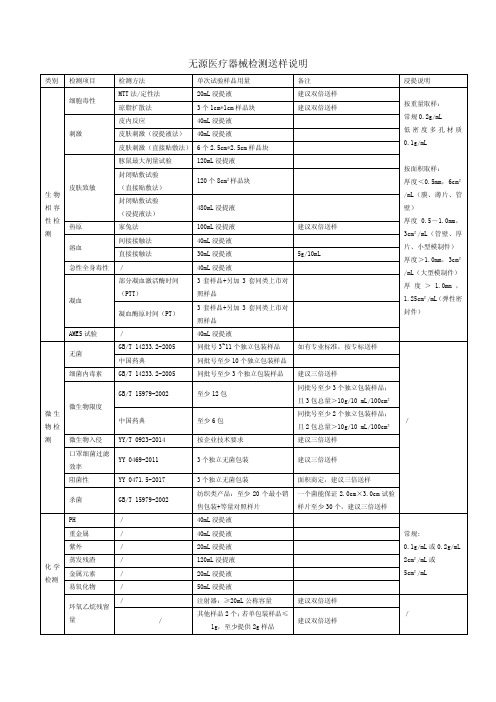
类别 检测项目
检测方法
单次试验样品用量
备注
浸提说明
细胞毒性 刺激
MTT 法/定性法
20mL 浸提液
琼脂扩散法
3 个 1cm*1cm 样品块
皮内反应
40mL 浸提液
皮肤刺激(浸提液法) 40mL 浸提液
皮肤刺激(直接贴敷法) 6 个 2.5cm*2.5cm 样品块
建议双倍送样 建议双倍送样
1g,至少提供 2g 样品
480mL 浸提液
100mL 浸提液
建议双倍送样
40mL 浸提液
30mL 浸提液
5g/10mL
40mL 浸提液
3 套样品+另加 3 套同类上市对
照样品
3 套样品+另加 3 套同类上市对
照样品
按面积取样: 厚度<0.5mm,6cm² /mL(膜、薄片、管 壁) 厚度 0.5~1.0mm, 3cm²/mL(管壁、厚 片、小型模制件) 厚度>1.0mm,3cm² /mL(大型模制件) 厚 度 > 1.0mm , 1.25cm²/mL(弹性密 封件)
AMES 试验
/
40mL 浸提液
无菌
GB/T 14233.2-2005 中国药典
同批号 3~11 个独立包装样品 同批号至少 10 个独立包装样品
如有专业标准,按专标送样
细菌内毒素 GB/T 14233.2-2005
同批号至少 3 个独立包装样品 建议三倍送样
微生 物检
微生物限度
GB/T 15979-2002 中国药典
效率
ቤተ መጻሕፍቲ ባይዱ
3 个独立无菌包装
建议三倍送样
阻菌性
YY 0471.5-2017
《无源医疗器械检测技术》教学方案的探讨

《无源医疗器械检测技术》教学方案的探讨无源医疗器械检测技术指的是依靠自身无源能量或环境无源能量完成检测的技术。
相比于有源医疗器械检测技术,无源医疗器械检测技术无需外部电源供电,具有更高的安全性和便携性。
因此,探讨《无源医疗器械检测技术》的教学方案对于培养学生的创新能力和实践能力具有重要意义。
一、课程目标及重要性1.1课程目标本课旨在让学生掌握无源医疗器械检测技术的基本原理、方法和应用,培养学生独立思考、创新实践的能力。
1.2重要性无源医疗器械检测技术是医疗器械领域的前沿技术之一,对于提高器械的无源性能、减少对外部能源的依赖具有重要意义。
通过学习该技术,可以培养学生的科研能力和工程实践能力,为其未来的工作和研究奠定基础。
二、教学内容与方法2.1教学内容2.1.1无源医疗器械检测技术概述:介绍无源医疗器械检测技术的定义、基本原理和应用领域。
2.1.2无源能量收集技术:介绍环境能量收集技术、体内生物能量收集技术等。
2.1.3无源传感技术:介绍无线能量传输技术、无线数据传输技术等。
2.1.4无源医疗器械检测技术的应用:介绍无源医疗器械检测技术在健康监测、病理诊断、康复治疗等方面的应用。
2.2教学方法2.2.1理论授课:通过讲解、演示等方式,向学生传授相关的理论知识。
2.2.2实验操作:设计实验让学生亲自动手操作,加深对无源医疗器械检测技术的理解。
例如设计能量收集实验、无线数据传输实验等。
2.2.3研究性学习:鼓励学生阅读最新的相关研究文献,进行独立思考和探索。
三、教学评价与考核3.1评价方式3.1.1平时成绩占比较大:包括课堂参与、小组讨论、实验报告等。
3.1.2期末考核:包括闭卷考试和课程设计。
3.2考核内容从基础理论知识、实验操作技能、研究探索能力和综合知识运用能力等方面进行考核。
四、教学资源与保障4.1教学资源4.1.1书籍:选用相关的教材和参考书,如《无线传感器网络技术》、《医疗电子学》等。
4.1.2实验设备:配备实验室需要的相关设备和仪器,如能量收集芯片、无线传输模块等。
无源医疗器械老化试验项目

无源医疗器械老化试验项目
无源医疗器械老化试验项目是指对无源医疗器械进行老化试验的项目。
无源医疗器械是指不需要外部能量输入即可完成其功能的医疗设备,如手术刀、注射器、吸引器等。
无源医疗器械老化试验旨在模拟实际使用条件下的老化过程,评估器械的使用寿命和性能稳定性。
通过老化试验,可以了解器械在长时间使用后的性能变化和损耗情况,为器械的设计、生产和使用提供参考依据。
无源医疗器械老化试验项目一般包括以下内容:
1. 功能测试:测试器械是否能够正常完成其预定的功能,如手术刀的切割性能、注射器的注射性能等。
2. 耐久性测试:测试器械在重复使用、重复操作的情况下的耐久性,如手术刀的切割次数、注射器的注射次数等。
3. 材料老化测试:测试器械所使用的材料在长时间使用后的老化情况,如塑料材料的硬度、强度、耐磨性等。
4. 清洁性能测试:测试器械的清洁性能,如手术刀的易清洁性、注射器的易清洁性等。
5. 安全性能测试:测试器械在使用过程中的安全性能,如注射器的密封性能、手术刀的刀锋安全性等。
通过无源医疗器械老化试验项目的评估,可以为医疗器械的设计改进、使用规范和质量控制提供科学依据,确保器械的可靠性和安全性。
(完整版)无源医疗器械研究资料-模板

研究资料(一)产品性能研究1、xxxx是由公司开发并生产的新产品,该产品使用方便。
根据国家药品监督管理局xxxx年x月下发的《医疗器械分类目录》规定,本品属“68xx xxxx器械”,管理类别为x类医疗器械。
2、主要技术指标2.1 外观组成:2.2 尺寸2.3 材料2.4 物理性能2.5 化学性能.........3、性能指标的依据1)外观组成,根据使用要求制定;2)尺寸,根据xxxx标准制定;.........4、标准及参考文献标准列表(二)生物相容性评价研究生物相容性评价研究评价者:评价产品:一次性使用配药用注射器1、生物相容性评价的依据和方法该评价是对公司生产的xxxx产品进行的医疗器械生物学评价,所有产品采用同样的材料进行生产。
根据GB/T16886.1提供的生物学评价流程图制定本产品的生物学评价方法选择流程图为:2、结论公司生产的xxxx产品属非接触人体器械,使用时间为<24h,产品用于临床抽取或配置药液,无需进行材料的生物相容性评价。
(三)生物安全性研究本品不含同种异体材料、动物源性材料或生物活性物质等,不是有生物安全风险类产品,不用提供相关材料及生物活性物质的生物安全性研究资料。
(四)灭菌/消毒工艺研究1、研究依据本品属于无菌类产品,含xxxx组件组成,采用环氧乙烷灭菌。
参照GB18279-2000医疗器械环氧乙烷灭菌确认和常规控制要求进行一次性使用配药用注射器的环氧乙烷灭菌,由ISO11135-1:2007验证试验与相关资料,以保证满足一次性医疗器械的无菌要求。
2、灭菌工艺的研究2.1 生物负载xxxx产品的初始污染菌为5.1(平均生物负载)。
根据GB18279-2000、ISO11135-1:2007和初始污染菌(平均生物负载),确定灭菌剂充入量、操作温度、湿度控制、真空度、灭菌时间及换气排残指标。
2.2 灭菌剂充入量根据GB18279-2000附录A3.2.2和附录C3.1,选择浓度30%的环氧乙烷(EO),设定xxxx 产品的环氧乙烷灭菌值为0.5kg/m3(相当于500mg/L)。
无菌医疗器械生化检验

常用浸提液制备方法
见附页
化学分析
1.浊度和色泽的测定
1.1 浊度的测定 1.1.1 仪器 a)分析天平:精确至0.1mg; b)分光光度计。 1.1.2溶液的配制 a)浊度标准贮备液的制备:称取于105℃干燥恒重的硫酸肼1.00g,
置于100mL容量瓶中,加水适量使溶解,必要时可先置于洁净烧杯中 在40℃的水浴中温热溶解,再用水转移至100mL容量瓶中,并稀释至 刻度,摇匀,放置4h~6h,取此溶液与等容量的10% 六亚甲基四胺 (乌洛托品)溶液混合,摇匀,于25℃避光静置24小时。标准贮备液 应置冷处避光保存,在两个月内使用,用前摇匀。 b) 浊度标准原液的制备:取浊度标准贮备液15.0mL,置1000mL容 量瓶中,加水稀释至刻度,摇匀,取适量,置1cm吸收池中,在 550nm处测定其吸光度值,结果应在0.12~0.15范围内。标准原液应 在48小时内使用,用前摇匀。
解,冷却后稀释定容。 cm)ocl/(LN草a2酸C2钠O4标)=0准.0溶05液m适o量l/L,草加酸水钠准标确准稀溶释液1:0倍用。前取0.05 d酸) 钾C(标1准/5溶KM液n:O4取)3=.30g.1高m锰ol/酸L 钾[c(,KM加n水O41)0=500.0m2Lm,o煮l/L沸]高1锰5
学研究设计 GB/T 16886.17-2005 医疗器械生物学评价 第17部分:可滤沥物允许限量的建立 GB/T 16886.20-200 医疗器械生物学评价 第20部分:医疗器械免疫毒理学试验原理和
方法 GB/T 16175-2008 医用有机硅材料生物学评价试验方法
GB14233.2-2005 医用输液、输血、注射器具检验方法 第2部分:生物学试验方法
医疗器械的生物学性能及评价原则

用于表征材料在特定应用状态与生物体相互作用的生物学行为。 内容:血液相容性,组织相容性,力学相容性 表现:宿主(生物机体〕反应:生物机体对植入材料的反应(组织反应、血液反应、
免疫反应) 。 评价: Evaluation
体外试验:材料溶出物测定、溶血、细胞毒性等试验。 体内试验:急性全身毒性、刺激、致突变、肌肉埋置等试验。
13
二、材料与生物体的相互作用
The interaction of materials and organisms
血液反应
免疫反应 生物反应
材料与生物 体相互作用
组织反应
血小板血栓 凝血系统激活 纤溶系统激活 溶血反应 一次性白血球减少 ……………… 补体系统激活 抗原—抗体反应(体液性免疫) 免疫细胞的激活(细胞性免疫) ………………
8
二、材料与生物体的相互作用 The interaction of materials and organisms
(3)陶瓷材料 Ceramic material
陶瓷降解(b-磷酸三钙): Ceramic degradation (b-tricalcium phosphate) 体液的溶解:材料植入人体内与组织液接触后,组织液使其粘结剂发生水解,材料分离成颗粒、分子或离子的过程。 细胞的吞噬和吸收:溶解的材料被细胞(主要是破骨细胞和吞噬细胞)吞噬、吸收,其代谢产物可参与新骨形成, 从而完成了由无生命材料转变为有生命组织一部分的过程。
无菌医疗器械产品检验相关标准(附件1)

附件1:无菌医疗器械质量检验相关标准1、医疗器械生物相容性试验GB/T 16886.3医疗器械生物学评价第3部分:遗传毒性、致癌性和生殖毒性试验GB/T 16886.4医疗器械生物学评价第4部分:与血液相互作用试验选择GB/T 16886.5医疗器械生物学评价第5部分:体外细胞毒性试验GB/T 16886.6医疗器械生物学评价第6部分:植入后局部反应试验GB/T 16886.7医疗器械生物学评价第7部分:环氧乙烷灭菌残留量GB/T 16886.8医疗器械生物学评价第8部分:生物学试验参照样品的选择和定性GB/T 16886.9医疗器械生物学评价第9部分:潜在降解产物的定性与定量总则GB/T 16886.10医疗器械生物学评价第10部分:刺激与致敏试验GB/T 16886.11医疗器械生物学评价第11部分:全身毒性试验GB/T 16886.12医疗器械生物学评价第12部分:样品制备和参照样品GB/T 16886.13医疗器械生物学评价第13部分:聚合物医疗器械降解产物的定性与定量GB/T 16886.14医疗器械生物学评价第14部分:陶瓷降解产物的定性与定量分析GB/T 16886.15医疗器械生物学评价第15部分:金属与合金降解产物的定性与定量GB/T 16886.16医疗器械生物学评价第16部分:降解产物与可溶出物的毒代动力学研究设计)GB/T 16886.17医疗器械生物学评价第17部分:根据健康风险评价确定可溶出物允许极限的方法GB/T 16886.18医疗器械生物学评价第18部分:材料化学定性GB/T 16886.19医疗器械生物学评价第19部分:材料物理化学、形态学和表面特性表征GB/T 16886.20医疗器械生物学评价第20部分:医疗器械免疫毒理学试验原理和方法GB/T 16175医用有机硅材料生物学评价试验方法YY/T 0473外科植入物聚交酯共聚物和共混物体外降解试验YY/T 0474外科植入物用聚L-丙交酯树脂及制品体外降解试验YY/T 0616一次性使用橡胶手套生物学评价要求与试验方法YY/T 0618细菌内毒素试验方法常规监控与跳批检验2、医用输液(血)、注射器具标准GB 8368一次性使用输液器GB 8369一次性使用输血器GB 18671一次性使用静脉输液针GB 14232.1人体血液及血液成分袋式塑料容器第1部分:传统型血袋GB 14232.2人体血液及血液成分袋式塑料容器第2部分:图形符号GB 14232.3人体血液及血液成分袋式塑料容器第3部分:含特殊组件的血袋系统GB/T14233.1医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14233.2医用输液、输血、注射器具检验方法第2部分:生物试验方法GB 15593输血(液)器具用软聚氯乙烯塑料GB 15810一次性使用无菌注射器GB 15811一次性使用无菌注射针GB 19335一次性使用血路产品通用技术条件YY 0114医用输液、输血、注射器用聚乙烯专用料YY 0242医用输液、输血、注射器用聚丙烯专用料YY/T 0806医用输液、输血、注射及其他医疗器械用聚碳酸酯专用料YY 0286.1专用输液器第1部分:一次性使用精密过滤输液器YY 0286.2专用输液器第2部分:一次性使用滴定管式输液器YY 0286.3专用输液器第3部分:一次性使用避光式输液器,重力输液式YY 0286.4专用输液器第4部分:一次性使用压力输液装置用输液器YY 0286.5专用输液器第5部分:一次性使用吊瓶式和分液袋式输液器YY 0286.6专用输液器第6部分:一次性使用非PVC输液器YY 0286.7专用输液器第7部分:一次性使用流量可设定输液器YY 0611一次性使用静脉营养输液袋YY 0451一次性使用输注泵YY 0614一次性使用高压造影注射器及附件YY 0581.1输液连接件第1部分:穿刺式连接件(肝素帽)YY 0581.2输液连接件第2部分:无针连接件YY 0585.1压力输液设备用一次性使用液路及附件第1部分:液路YY 0585.2压力输液设备用一次性使用液路及附件第2部分:附件YY 0585.3压力输液设备用一次性使用液路及附件第3部分:过滤器YY 0585.4压力输液设备用一次性使用液路及附件第4部分:防回流阀YY 0586输液用肝素帽YY/T 0582.1输液瓶悬挂装置第1部分:一次性使用悬挂装置YY/T 0582.2输液瓶悬挂装置第2部分:多用悬持装置YY 0113一次性使用采血器YY 03282一次性使用机用采血器YY 0326.1一次性使用离心式血浆分离器第1部分:血浆分离杯YY 0326.2一次性使用离心式血浆分离器第2部分:血浆管路YY 0326.3一次性使用离心式血浆分离器第3部分:血浆袋YY 0327一次性使用紫外线透疗血液容器YY 0329一次性使用去白细胞过滤器YY 0031硅橡胶输液(血)管YY 0584一次性使用离心杯式血液成分分离器YY 0613一次性使用离心袋式血液成分分离器YY/T 0289一次性使用微量采血吸管YY 0314一次性使用人体静脉血样采集容器YY/T 0617一次性使用人体末梢血样采集容器YY 0464一次性使用血液灌流器YY 0465一次性使用空心纤维血浆分离器YY 0485一次性使用心脏停跳液贯注器YY/T 0243一次性使用无菌注射器用橡胶活塞YY/T 0282注射针YY 0666针尖锋利度和强度试验方法YY/T 0820牙科筒式注射器YY/T 0821一次性使用配药用注射器3、医用导管、插管标准GB/T 15812.1非血管内导管第1部分:一般性能试验方法GB/T 15812.2非血管内导管第2部分:弯曲性能试验方法YY 0285.1一次性使用血管内导管第1部分:通用要求YY 0285.2一次性使用无菌血管内导管第2部分:造影导管YY 0285.3一次性使用无菌血管内导管第3部分:中心静脉导管YY 0285.4一次性使用无菌血管内导管第4部分:球囊扩张导管YY 0285.5一次性使用无菌血管内导管第5部分:套针外周导管YY/T 0586医用高分子制品X透射线不透性试验方法YY 0450.1一次性使用无菌血管内导管辅件第1部分:导引器械YY 0450.2一次性使用无菌血管内导管辅件第2部分:套针外周导管管塞YY 0450.3一次性使用无菌血管内导管辅件第3部分:球囊扩张导管扩张泵YY 0030腹膜透析管YY 0325一次性使用无菌导尿管YY 0489一次性使用无菌引流导管及其辅助器械YY 0488一次性使用无菌直肠导管YY 0483一次性使用肠营养导管、肠给养器及其连接件设计与试验方法YY 1040.1麻醉和呼吸设备圆锥接头第1部分:锥头与锥套YY 0337.1气管插管第1部分:常用型插管及接头YY 0337.2气管插管第2部分:柯尔型插管YY 0338.1气管切开插管第1部分:成人用插管及接头YY 0338.2气管切开插管第2部分:小儿用气管切开插管YY 0339呼吸道用吸引导管YY 0461麻醉机和呼吸机用呼吸管路4、植入物标准YY 0484外科植入物双组分加成型硫化硅橡胶YY 0334硅橡胶外科植入物通用要求YY 0332植入式给药装置YY 0333软组织扩张器YY 0487一次性使用无菌脑积水分流器及其组件YY 1116可吸收性外科缝线YY 0308医用透明质酸钠凝胶YY/T 0694球囊扩张支架弹性回缩的标准测试方法YY/T 0807预装在输送系统上的球囊扩张血管支架稳固性能标准测试方法YY/T 0808血管支架体外脉动耐久性标准测试方法YY/T 0818.1医用有机硅弹性体、凝胶、泡沫标准指南第1部分:组成和未固化材料YY/T 0818.2医用有机硅弹性体、凝胶、泡沫标准指南第2部分:交联和制作YY/T 0858球囊扩张血管支架和支架系统三点弯曲试验方法YY/T 0859均匀径向载荷下金属血管支架有限元分析方法指南5、卫生材料、敷料YY/T 0471.1接触性创面敷料试验方法第1部分:液体吸收性YY/T 0471.2接触性创面敷料试验方法第2部分:透气膜敷料水蒸汽透过率YY/T 0471.3接触性创面敷料试验方法第3部分:阻水性YY/T 0471.4接触性创面敷料试验方法第4部分:舒适性YY/T 0471.5接触性创面敷料试验方法第5部分:阻菌性YY/T 0471.6接触性创面敷料试验方法第6部分:气味控制YY/T 0471.7创伤敷料试验方法第7部分:颗粒脱落YY/T0471.8创伤敷料试验方法第8部分:关于粘连(创面和皮肤)YY/T 0472.1医用非织造敷布试验方法第1部分:敷布生产用非织造布YY/T 0472.2医用非织造敷布试验方法第2部分:成品敷布YY 0330医用脱脂棉YY 0331脱脂棉纱布和脱指棉与粘胶纱布性能要求和试验方法YY 0594外科纱布敷料通用要求YY 0469医用外科器口罩YY/T 0148医用粘贴胶带通用要求YY/T 0506.2病人、医护人员和器械用手术单、手术衣和洁净服第2部分:性能要求和性能水平YY/T 0506.3病人、医护人员和器械用手术单、手术衣和洁净服第3部分:试验方法YY/T 0506.4病人、医护人员和器械用手术单、手术衣和洁净服第4部分:干态落絮试验方法YY/T 0506.5病人、医护人员和器械用手术单、手术衣和洁净服第5部分:干态阻菌试验方法YY/T 0506.6病人、医护人员和器械用手术单、手术衣和洁净服第6部分:湿态阻菌试验方法YY/T 0506.7病人、医护人员和器械用手术单、手术衣和洁净服第7部分:阻污染气溶胶穿透试验方法YY/T0506.8病人、医护人员和器械用手术单、手术衣和洁净服第8部分:抗激光性试验方法YY 0852一次性使用无菌手术膜YY 0854.1全棉非织造布外科敷料性能要求第1部分:敷料生产用非织造布YY 0854.2全棉非织造布外科敷料性能要求第2部分:成品敷料YY/T 0855.手术单和/或病人防护覆盖物抗激光试验方法和分类第1部分:初级点燃和穿透YY/T 0855.2手术单和/或病人防护覆盖物抗激光试验方法和分类第2部分:次级点燃6、其他标准YY/T 0720一次性使用产包自然分娩用YY 0321.1一次性使用麻醉穿刺包YY 0321.2一次性使用麻醉用针YY 0583一次性使用胸腔引流装置水封式YY 0167非吸收性外科缝线YY 1116可吸收外科缝合线GB 7543橡胶医用手套GB 10213一次性使用橡胶检查手套YY/T 0698.1最终灭菌医疗器械包装材料第1部分:吹塑包装复合塑料膜要求和试验方法YY/T 0698.2最终灭菌医疗器械包装材料第2部分:灭菌包裹材料要求和试验方法YY/T 0698.3最终灭菌医疗器械包装材料第3部分:纸袋、组合袋和卷材生产用纸要求和试验方法YY/T 0698.4最终灭菌医疗器械包装材料第4部分:纸袋要求和试验方法;YY/T0698.5最终灭菌医疗器械包装材料第5部分:纸与塑料膜组合的热封和自封袋和卷材要求和试验方法;YY/T0698.6最终灭菌医疗器械包装材料第6部分:用于低温灭菌过程或辐射灭菌的无菌屏障系统生产用纸要求和试验方法;YY/T0698.7最终灭菌医疗器械包装材料第7部分:环氧乙烷或辐射灭菌的医用无菌屏障系统生产用可密封涂胶纸要求和试验方法;YY/T 0698.8最终灭菌医疗器械包装材料第8部分:蒸汽灭菌器用重复性使用灭菌容器要求和试验方法;YY/T0698.9最终灭菌医疗器械包装材料第9部分:可密封组合袋、卷材和盖材生产用无涂胶聚烯烃非织造布材料要求和试验方法;YY/T0698.10最终灭菌医疗器械包装材料第10部分:可密封组合袋、卷材和盖材生产用涂胶聚烯烃非织造布材料要求和试验方法。
无源植入医疗器械技术审评及常见问题举例分析

医疗器械注册法规要求
质量体系核查(境内)
第三十四条 食品药品监督管理部门在组织产品技术审评时可 以调阅原始研究资料,并组织对申请人进行与产品研制、 生产有关的质量管理体系核查。 境内第二类、第三类医疗器械注册质量管理体系核查, 由省、自治区、直辖市食品药品监督管理部门开展,其中 境内第三类医疗器械注册质量管理体系核查,由国家食品 药品监督管理总局技术审评机构通知相应省、自治区、直 辖市食品药品监督管理部门开展核查,必要时参与核查。 省、自治区、直辖市食品药品监督管理部门应当在30个工 作日内根据相关要求完成体系核查。 境内第二类、第三类体系核查,均由省局开展。第三 类由总局器械审评中心发起, 2015年6月8日,总局组织制 定了《境内第三类医疗器械注册质量管理体系核查工作程 序(暂行)》
无源植入医疗器械技术审评要求 及常见问题举例分析
研发部 朱立武
2016年10月
主要内容
医疗器械注册法规要求;
植入类医疗器械生物学评价;
动物源医疗器械技术审评要求;
医疗器械技术审评要求及常见问题举例分析。
医疗器械注册法规要求
注册与备案
第八条 第一类医疗器械实行产品备案管理,第二类、第
医疗器械注册法规要求 说明书、标签
第二十七条 医疗器械应当有说明书、标签。说明书、标签的内容应当与经注 册或者备案的相关内容一致。 医疗器械的说明书、标签应当标明下列事项: (一)通用名称、型号、规格; (二)生产企业的名称和住所、生产地址及联系方式; (三)产品技术要求的编号; (四)生产日期和使用期限或者失效日期; (五)产品性能、主要结构、适用范围; (六)禁忌症、注意事项以及其他需要警示或者提示的内容; (七)安装和使用说明或者图示; (八)维护和保养方法,特殊储存条件、方法; (九)产品技术要求规定应当标明的其他内容。 第二类、第三类医疗器械还应当标明医疗器械注册证编号和医疗器 械注册人 的名称、地址及联系方式。 由消费者个人自行使用的医疗器械还应当具有安全使用的特别说明。
无源植入性医疗器械稳定性研究指导原则

验证试验的产品
医疗器械货架有效期验证试验宜采用与常规生产相同的终产品进 行,适宜项目(如包装系统性能)可采用无产品或模拟产品的包 装进行验证。
注册申请人可对试验产品进行设计最差条件下的验证试验以保证 试验产品可代表最恶劣的生产情况,如进行一个标准的灭菌周期 后,附加一个或多个灭菌周期,或采用几种不同的灭菌方法。
证,如光照等。
验证的试验测试与评价项目
无论加速稳定性试验还是实时稳定性
试验测试
试验,注册申请人均需在试验方案中 01 设定测试项目、测试方法及判定标准。
当测没试有项判目定仅标需准评时估,产可品采随用时零间老点化时的间 性相包评价能关装项目数性系据能统作,性为包能测括测试器试项械两目自 方的身面参性。照能其测中指试包标和装。 02 系统性能测试主要目的是为了验证包 装系统对微生物的屏障性能,即无菌
范例
外原部材料影/响组件因自素身主随时要间包发括生退:化
某些高分子材料退化等
• 原储材存料条/件组,件例自如身温发度生、的湿相度互、作光用照、通风情况、气压、污染等;
•
运输条件,例如运输过程中的震动、冲撞。 原材料/组件与包装材料发生的相互作用
原材料/组件和包装材料因生产工艺而造成的影响 灭菌工艺等
《无源植入性医疗器械
稳定性研究指导原则》
>
目录
CONTENTS
1.适用范围 2.货架有效期影响因素 3.货架有效期验证过程 4 . 使用和运输稳定性研究
01
适用范围
本指适导用原则范主围要适用于无源植入性医疗器械的稳定 性研究及相关注册申报资料的准备
无源非植入性医疗器械根据产品实际情况和风险分
无源可重复使用医疗器械使用寿命验证方案

无源可重复使用医疗器械使用寿命验证方案从无菌与非无菌两个角度来讨论无源医疗器械的注册检验。
①首先,两者都需要进行生物学检测,ISO10993系列标准是医疗器械生物学评价通用标准。
根据接触时长、接触类型等选择需要进行的生物学检测项目,一般需要2-3个月时间。
②其次,两者都需要适当的标准进行性能检测。
无源医疗器械的主要类别有:眼科产品、口腔产品、外科植入类产品、手术器械和穿刺器械及生育器具。
比如手术衣,在进行CE认证过程中需要采用EN13795-1标准进行性能检测,性能检测周期为15天左右。
③有效期验证/货架寿命试验。
医疗器械货架寿命关乎着医疗器械产品正常发挥,并起到保护医疗器械的作用。
货架的寿命到头,就预示着该器械不再具有性能指标与其功能,在使用中可能会发生不可预知的风险。
加速稳定性试验和实时稳定性试验这两种试验是医疗器械货架寿命的主要验证方式。
后者的试验周期比较长,在注册的时候,可采用加速稳定性试验进行临时货架寿命的确认。
④灭菌验证,这项验证方式主要针对无菌医疗器械,根据产品性质需要选择适当的灭菌工艺。
主要的灭菌方式有三类,分别是:湿热灭菌、辐照灭菌、EO灭菌。
送检的前提下就是灭菌验证。
灭菌工艺确认好之后,就要对产品进行杀菌,后续再进行生物学、包装、性能验证。
以EO灭菌验证为例,其周期一般在80天左右。
⑤无菌医疗器械,需要对产品包装性能进行验证。
不同类型的包装需要根据实际选择包装验证试验,常见的包装测试标准有:密封强度试验:ASTMF88/F88M-15、密封完整性:ASTMF1886/F1886M-16、染色渗漏试验:ASTMF1929-15、无菌屏障系统试验:DIN58953-6:2016等。
⑥无菌医疗器械,还需要模拟运输验证。
保证产品在运输过程中导致破损,导致产品不合格。
无源医疗器械的生物性能检验

样品注射
结果观察(24h、48h、72h)
检验时间:5d
注射0.2mL 0.9 %氯化钠注射 液制备的浸提 供试液
注射0.2mL 0.9 %氯化钠注射 液对照液
头
1¤
1¤
2¤
2¤
3¤
3¤
4¤
4¤
5¤
5¤
6¤ 7¤ 8¤ 9¤ 10¤
6¤ 7¤ 8¤ 9¤ 10¤
由于材料和器械的复杂性和使用的多样性, 不能规定一套硬性的合格或不合格指标
否则会出现两种可能, 一种可能是受到不必要的限制, 另一种可能是产生虚假的安全感
因此一般是在最终产品的标准中确定 合格/不合格的指标,
或接受/不可接受的限度
当最终产品投放市场后
• 如果制造产品的材料来源或技术条件发生变化; • 产品的配方、工艺、初级包装或灭菌条件改变; • 储存期内产品发生变化; • 产品用途发生变化; • 有迹象表明产品用于人体时会产生副作用时; • 都要对产品重新进行生物学评价
生物学评价试验和选择(GB/T 16886-1)
器械分类
基本评价的生物学试验
补充评价的 生物学试验
接触部位
接触时间
细 致 刺激或皮 全 亚 遗 植 血 慢 致 生 生
A:一时接触 胞
内反应 身 慢 传
液性癌殖物
(≤24h)
毒
B:短、中期接 性 敏
急性毒
相毒性与降
性亚性入容性
发解
触(>24h-30 日)
检验时间:5d
结果判断
根据眼损伤计分系统对观察到的反应进行记分并 记录。
根据试验眼与对照眼之间的差异性进行判断,试 验眼反应应不大于对照眼。
医疗器械的常见理化性能要求及检测办法

第二节 医疗器械的常见化学性能要求
作为与人体接触的医疗器械,在生理条件下必须 具有长期稳定的化学性质,才能保证应用的安全 可靠性。
第二节 医疗器械的常见化学性能要求
医疗器械化学物质允许限量的建立我就不详细介 绍了,因为这是一个十分复杂的学科。
那么我们在实际中如何确定医疗器械化学物质 允许限量的?我们多数采用参照同类产品的国家 标准、行业标准、国际标准的化学性能的要求来 规定。
形。
第一节 医疗器械的常见物理性能要求
2、撕裂强度 用两个相反的力拉材料试样使之分离或破裂所
需的力。
第一节 医疗器械的常见物理性能要求
3、硬度(P203)
是指材料抗压痕或抗划痕的能力。 (1)压入硬度试验方法主要用于测试橡胶硬度。 单位有邵氏A;邵氏D (2)洛氏硬度测量法是最常用的。单位符号是HR。 (3)布氏硬度测量法主要用于测量金属材料硬度。
第二节 医疗器械的常见化学性能要求
2、检验项目及方法 6)重金属总含量 (P214)
方法一(目视比色法) 原理 在弱酸性溶液中,铅,铬,铜,锌等重金属能与硫代乙酰胺作用生成 不溶性有色硫化物。 以铅为代表制备标准溶液进行比色,测定重 金属的总含量。 方法二(硫化钠法) 原理 在碱性溶液中,铅、铬、铜、锌等重金属能与硫化钠作用生成 不溶性有色硫化物。以铅为代表制备标准溶液进行比色,测定重 金属的总含量。
第三节 医疗器械的灭菌及环氧乙烷残留量
二、辐射灭菌(P221)(GB18280):
GB 18280-2000医疗保健产品灭菌 确认和常规控制辐射灭菌.pdf
第三节 医疗器械的灭菌及环氧乙烷残留量
在讲EO灭菌机残留量之前我先讲讲EO的特性 • 中文名称:环氧乙烷,氧化乙烯,一氧三环。 英文名称:Ethylene oxide,Oxirane,poxyethane,
无源医疗器械产品原材料变化评价指南

无源医疗器械产品原材料变化评价指南医疗器械产品获批上市后,注册人为进一步提高产品质量、满足法规及标准要求,或完善供应链等原因常需要对产品的生产设备、原材料、生产工艺、检验方法、质量控制标准等进行改变。
根据医疗器械生产质量管理体系要求,当选用的材料、零件或者产品功能的改变可能影响到医疗器械产品安全性、有效性时,应当评价因改动可能带来的风险,必要时采取措施将风险降低到可接受水平,同时应当符合相关法规的要求。
注册人建立有效的变更控制程序是确保生产管理体系持续改进以实现生产高质量产品的关键,也是医疗器械生产质量管理体系中的重要环节。
一般来说,变更控制程序包括变更的识别、发起、分析、评审、验证、确认、批准、实施等环节。
其中,对变化内容进行分析、验证和/或确认、评审是企业应着重完成的工作。
原材料是医疗器械产品实现其预期功能的重要载体,也是其安全性和有效性的重要保障,使得医疗器械原材料变化的变更控制在各项变更事项中显得尤为重要。
因此,当生产产品所用的原材料发生变化时,注册人应充分评估原材料变化对最终医疗器械产品可能带来的影响,以将变化引起的风险降低至可接受范围,并根据法规要求评估是否需要进行注册审批。
本指南旨在给出系统的、具有指导意义的无源医疗器械产品原材料变化进行风险分析的指南性文件,用于指导注册人规范相关产品的设计开发、注册申报及质量控制,同时也用于指导监管部门对相关无源医疗器械原材料变化引起的注册申请的技术审评。
—2—本指南是对无源医疗器械产品原材料变化的一般评价流程,注册人应依据具体产品的特性对评价的内容进行充实和细化,还应依据具体产品的特性确定其中的具体内容是否适用。
若不适用,需详细阐述其理由及相应的科学依据。
本指南是对注册人和审查人员的指导性文件,不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其它方法,也可以采用,但是需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指南。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
迟发型超敏反应试验
最大剂量试验 封闭式敷贴试验
所需样品量:
•直接接触材料:
片材/薄膜--厚度不超过0.5cm的至少需要700cm²
凝胶状--50g以上
液体--50ml以上
•浸提液材料:
固体--15g以上
液体--50ml以上
试验流程(最大剂量法)
皮内诱导阶段(进行试验样品注射)
7d(±1d)
局部诱导阶段(试验样品敷贴48±2h) 14 (±1d)
毒急
性
育
C:长期接触
性性
毒
(>30 日)
毒
性
性
A
XX
X
皮肤
B
XXX
表 面 粘膜 接
C A B
XXX XXX XXX
触
C
XXX
A
XXX
损伤
B
XXX
表面
C
XXX
XX XX
生 物 学 评 价 试 验 和 选 择 ( GB/T 16886-1)
器械分类
基本评价的生物学试验
补充评价的
生物学试验
接触时间
细致刺全亚遗植血慢致生生
样品敷贴:4h/24h
结果观察:1h、24h、48h、72h 检验时间:5~7d
结果判断
根据原发性刺激指数PⅡ进行判定
注意:
GB/T 16886.10-2005
新西兰兔原发性刺激指数为0,按标准判定,供试品皮肤刺激
反应类型为极轻微
GB/T 16175-2008
新西兰兔原发性刺激指数为0,按标准判定,供试品皮肤刺激
1099311
环氧乙烷灭菌残留量 潜在降解产物的定性和定量框架
刺激和迟发型超敏反应试验
全身毒性试验
2002 1999 2002
GB/T 16886.7-2001(采用1995版) GB/T 16886.9-2001(采用1999版) GB/T 16886.10-2005(采用2002版)
2006 GB/T 16886.11-1997(采用1993版)
试验流程
样品制备
样品切成条状,5g/10ml 水浴30min
家兔心脏采血
抗凝稀释后加入样品中
水浴 60min 离心,吸取上清液测量吸光度(545nm)
试验时间:1d
溶血率≤5%是可接受的
样品制备 制成浸提液(生理盐水/植物油)
样品注射
结果观察(24h、48h、72h)
检验时间:5d
注射0.2mL 0.9 %氯化钠注射 液制备的浸提 供试液
注射0.2mL 0.9 %氯化钠注射 液对照液
头
1¤
1¤
2¤
2¤
3¤
3¤
4¤
4¤
5¤
5¤
6¤ 7¤ 8¤ 9¤ 10¤
6¤ 7¤ 8¤ 9¤ 10¤
这样可控制和减少最终产品对生物体的危害
考虑到灭菌可能对生物材料 和医疗器械的潜在作用,以 及伴随灭菌而产生的毒性物
质
因此,在进行生物学评价试验时,应该 用最后灭菌过的产品或最后灭菌过的产 品中有代表性的样品作为试验样品或作
为制备浸提液样品
在进行生物学评价试验时为了减少动物使 用量和节约时间,一般是先进行体外试验, 后进行动物试验
由于材料和器械的复杂性和使用的多样性, 不能规定一套硬性的合格或不合格指标
否会出现两种可能, 一种可能是受到不必要的限制, 另一种可能是产生虚假的安全感
因此一般是在最终产品的标准中确定 合格/不合格的指标,
或接受/不可接受的限度
当最终产品投放市场后
• 如果制造产品的材料来源或技术条件发生变化; • 产品的配方、工艺、初级包装或灭菌条件改变; • 储存期内产品发生变化; • 产品用途发生变化; • 有迹象表明产品用于人体时会产生副作用时; • 都要对产品重新进行生物学评价
无源医疗器械的生物性能检验 2019
为什么要进行医疗器械生物性能检验?
• 医疗器械与人体接触、介入或植入体内后会与
人体发生非常复杂的反应过程:
• 组织反应、血液、免疫反应,以及这三种反应
所引起的全身反应
以上三种生物反应在临床上的表现:
渗出物反应; 感染; 钙化; 血栓栓塞; 肿瘤
因此,临床前的生物学试验或生物安全 性评价是必要的!
无源医疗器械生物性能检验依据的标准
• GB/T 14233.2-2005 医用输液、输血、注射
器具检验方法 第2部分:生物学试验方法
• GB/T 16175-2008 医用有机硅材料生物学
评价试验方法
• ISO 10993-GB/T 16886系列标准
ISO 10993系列标准及采标情况
标准号
10993-1 10993-2
如果体外试验都通不过,就不必做动物试验
根据我们的经验,一般是先进行溶血试验和 细胞毒性试验。特别是溶血试验具有很高的 灵敏度,是一个很好的粗筛试验
进行生物学试验必须要在专业实验室(应通 过国家药品监督管理局的认可),并由经过 培训且具有实践经验的专业人员进行,其试 验结果应具有可重复性。
在对最终产品作出评价结论时,也应考虑到 产品的具体应用及有关文献(包括临床使用 资料)
反应分级为无刺激
皮内反应试验
将浸提液(极性和非极性)注射到动物 皮内,观察浸提液对动物的刺激作用 常见的产品:透析器、氧合器、管路、过滤器、 输血输液、注射器具、经皮椎体成型手术器械等
GB/T 14233.2-2005 GB/T 16175-2008 GB/T 16886.10-2005
试验流程
A
XXX
体 骨 /牙
B
XX * * *XX
内
C
XX * * *XX
X
接 循环
A
XXXX
X
触 血液
B
XXXX *X *X
C
XXXXXX * XXX
组织/
A
XXX
体
骨
B
XX * * *XX
内
C
XX * * *XX
XX
植
A
XXXX *
XX
入 血液
B
XXXX *XXX
C
XXXXXXXXXX
注:应考虑各器械的主要特长
10993-12 10993-13 10993-14 10993-15 10993-16 10993-17 10993-18 10993-19 10993-20 10993-21
样品制备与参照材料
聚合物降解产物的定性与定量
陶瓷制品降解产物的定性和定量 涂层和未涂层金属和合金降解产物的
定性与定量 降解产物和可沥滤物毒性动力学研究
再去评价它的生物性能。但是直到目前材料的尺 寸和表面形态对人体组织的影响还未进行深入研 究,在现有的标准中都未涉及到这一问题
实际上
对一个产品的生物学评价, 不仅和制备产品的材料的性能有关,
而且还和加工工艺有关
所以应该考虑加入材料中的各种添加剂,以及 材料在生理环境中可浸提出的物质或降解的产物
在产品标准制定时,应对最终产品的可浸提物质的 化学成分进行定性和定量的要求和分析
和血液相互作用试验选择 细胞毒性试验:体外法
2002 2005
GB/T 16886.4-2003(采用2002版) GB/T 16886.5-2003(采用1999版)
10993-6
植入后局部反应试验
2007 GB/T 16886.6-1997(采用1994版)
10993-7
10993-9
1099310
200 0 GB/T 16886.15-2003(采用2000版)
199 7 GB/T 16886.16-2003(采用1997版)
200 2 GB/T 16886.17-2005(采用2002版)
200 5
200 6
200 6
200 0
试验/评价项目的选择
GB/T 16886.1 医疗器械生物学 评价 第1部分:评价与试验
A:一时接触 胞
激身慢传
液性癌殖物
接触部位
( ≤ 24h)
毒
或急性毒
相毒性与降
B:短 、中期 接 性 敏 皮 性 亚 性 入 容 性
发解
触( > 24 h- 30 日 )
内毒急
性
育
C: 长期 接 触
反性性
毒
( >30 日 )
应
毒
性
性
由 血路
A
XXXX
X
体 间接
B
XXXX
X
外
C
XX
XXX
XXX
与 组织/
应的评价试验
例如:某些缝线可用于表皮缝合, 也可用于组织内缝合,有的还可用 于心脏手术缝合,这时缝线就必须 进行以上三类要求的所有生物学试 验。
几个原则
• 一般是在完成基本评价试验后再考虑补充评价试验 • 如果材料和器械用于计划生育或生殖系统部位时,
就必须补充做生殖和发育毒性试验
• 如果材料和器械在体内会发生降解,就必须补充做
GB/T 14233.2-2005
GB/T 16175-2008
GB/T 16886.10-2005
(原发性)皮肤刺激试验
样品 退热贴、口罩、手术衣、手术包巾、外
用液体用瓶、凝胶、造口护肤粉等。
GB/T 16175-2008 GB/T 16886.10-2005
试验流程
样品制备 (粉剂、液体、固体、浸提液)
B 泌尿系统用导管:尿道用导管、膀胱留置导管
C 人工食道、接触眼镜、宫内节育器 A 外科用敷料 B 急救绷带(大号) C 创伤、愈合和保护用敷料(烫伤用敷料、硅橡胶纱布等)
