第五周 慕课 分子间作用力----北大卞江普通化学原理
高二化学选择性必修课件分子间作用力分子晶体

由于分子间作用力较弱,分子晶体在化学反应中通常表现出较高的化学
稳定性。
02
分子内共价键对化学稳定性的影响
分子内部的共价键越强,分子晶体的化学稳定性越高。
03
外界条件对化学稳定性的影响
高温、高压或催化剂等条件可能破坏分子间的弱作用力,导致分子晶体
的化学性质发生变化。
03
分子间作用力在物质性质中作用
物质熔沸点变化规律解析
定性具有重要作用。
酶催化作用
酶在催化生物化学反应时 ,其活性中心往往通过氢 键与底物结合,从而降低 反应的活化能,提高反应
速率。
05
实验探究:测定分子间作用力大小
实验原理和方法介绍
分子间作用力
分子间作用力是分子之间存在的相互作用力,包括范德华力和氢键等。这些力决定了分子的物理性质 和化学性质,如熔点、沸点、溶解度等。
讨论
本实验通过测量液体的表面张力来间 接测定分子间作用力大小,具有一定 的局限性。在实际应用中,还需要考 虑其他因素的影响,如分子的极性、 分子量等。此外,还可以采用其他方 法来测定分子间作用力大小,如粘度 法、热力学方法等,以获得更全面准 确的结果。
06
知识拓展:其他类型晶体简介
离子晶体
构成微粒:阴、阳离子
微粒间作用力:离子键
物理性质:熔点较高、沸点高,较硬而脆 常见离子晶体:活泼金属氧化物、强碱、 绝大多数的盐等
金属晶体
微粒间作用力:金属键
构成微粒:金属阳离子和 自由电子
物理性质:熔点差别大、 硬度大、导电性、导热性 、延展性
常见金属晶体:金属单质 与合金
原子晶体
构成微粒:原子
微粒间作用力:共价键
测量表面张力
2025年高考化学一轮复习基础知识讲义—分子间作用力(新高考通用)
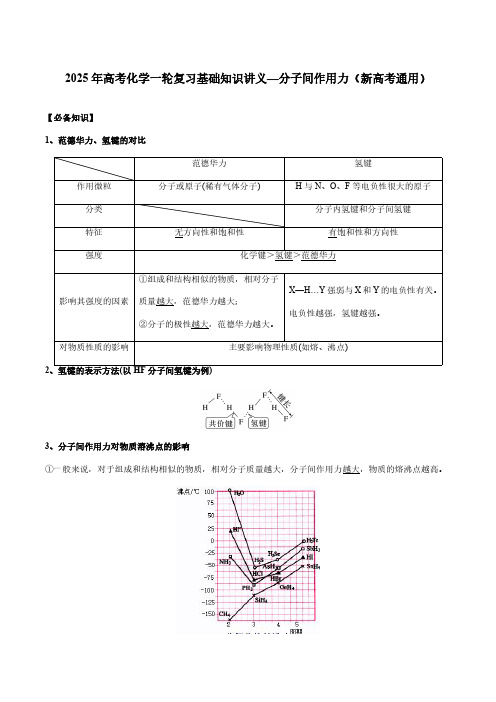
2025年高考化学一轮复习基础知识讲义—分子间作用力(新高考通用)【必备知识】1、范德华力、氢键的对比范德华力氢键作用微粒分子或原子(稀有气体分子)H与N、O、F等电负性很大的原子分类分子内氢键和分子间氢键特征无方向性和饱和性有饱和性和方向性强度化学键>氢键>范德华力影响其强度的因素①组成和结构相似的物质,相对分子质量越大,范德华力越大;②分子的极性越大,范德华力越大。
X—H…Y强弱与X和Y的电负性有关。
电负性越强,氢键越强。
对物质性质的影响主要影响物理性质(如熔、沸点)2、氢键的表示方法(以HF分子间氢键为例)3、分子间作用力对物质溶沸点的影响①一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔沸点越高。
②分子间氢键使物质熔、沸点升高。
例如熔沸点:H2O>HF>NH3>CH4③分子内氢键可以使分子更稳定,且分子内氢键会削弱分子间氢键形成,故一般熔沸点较低。
如已知邻羟基苯甲醛()与对羟基苯甲醛()的沸点相差很大,其中沸点较高的是________,请画出上述两种物质形成氢键的情况:__________________________________。
【答案】邻羟基苯甲醛形成分子内氢键:;对羟基苯甲醛形成分子间氢键:4、氢键对分子其他性质的影响(1)氨极易液化,因为NH3分子液化时形成分子间氢键。
(2)水结冰时体积膨胀、密度减小,因为结冰时形成氢键。
(3)溶质与溶剂若能形成氢键,能增大溶解度。
比如NH3极易溶于水,小分子醇能与水以任意比互溶。
例、有关物质的熔、沸点,解答下列问题。
(1)有机物A()的结构可以表示为(虚线表示氢键),而有机物B()只能形成分子间氢键。
工业上用水蒸气蒸馏法将A和B进行分离,首先被蒸出的成分是______________________,原因是:________________________________________________________________________。
分子间作用力ppt课件

H
H
O HH
δ+ δ+
2δ-
δ+
2δ-
δ+ 2δ-
δ+
δ+
2δ- δ+
δ+ 2δ-
δ+ δ+
δ+
δδ-
δ+ δ+
2δδ+
氢键
X—H…Y
氢键
(1)含X—H强极性键 (2)X、Y为电负性大、
半径小的原子 (如F、O、N)
作用力 微粒 特点
(1)强于范德华力弱于化学键的分子间作用力 (2)有饱和性和方向性
氢键应用
[问题解决2]: 解释下列现象
(1)NH3极易溶于水生成NH3·H2O
H
H N …H O
H
H
H
H
O… H N
H
H
结论2:溶质与溶剂分子间存在氢键,使溶质的溶解度增加, 温度升高,氢键断裂,溶解度降低。
氢键应用
[问题解决2]: 解释下列现象 (2)低级醇(如甲醇、乙醇)、
乙醛、乙酸易溶于水
外,对物质的溶解度、硬度等也有影响 D.氢键是一种特殊的化学键,它广泛地存在
于自然界中
练习
5.用氢键解释 (1)氨易液化 (2)H2SO4和H3PO4的相对分子质量,
但硫酸的熔点比磷酸高, 水溶液中,硫酸酸性比磷酸弱。
O HO—S—OH
O
O HO—P—OH
OH
δδ-
δ+
角型分子
O
H
H
示意图
δ- δ-
O
δ+H
Hδ+
δ- δ-
O
δ+H
《分子间作用力》教案公开课

《分子间作用力》教案公开课第一章:引言1.1 课程背景1.2 分子间作用力的概念及其重要性1.3 教学目标与内容安排第二章:分子间作用力的基本概念2.1 分子间作用力的定义2.2 分子间作用力的分类2.3 分子间作用力的测量与表达第三章:分子间作用力的来源3.1 范德华力3.2 氢键3.3 电吸引力3.4 排斥力第四章:分子间作用力与物质性质的关系4.1 分子间作用力与物质状态的关系4.2 分子间作用力与物质溶解性的关系4.3 分子间作用力与物质沸点的关系第五章:分子间作用力的应用5.1 分子间作用力在材料科学中的应用5.2 分子间作用力在药物化学中的应用5.3 分子间作用力在生物化学中的应用本章节主要介绍了分子间作用力的基本概念、来源以及与物质性质和应用的关系。
通过本章的学习,学生将能够理解分子间作用力的定义和重要性,掌握分子间作用力的分类和来源,并了解分子间作用力与物质性质和应用之间的联系。
第六章:分子间作用力的实验测定6.1 分子间作用力的实验方法6.2 分子间作用力的测定技术6.3 实验数据的处理与分析第七章:分子间作用力在化学反应中的角色7.1 分子间作用力对化学反应速率的影响7.2 分子间作用力对化学平衡的影响7.3 分子间作用力在催化反应中的应用第八章:分子间作用力在生物分子中的应用8.1 分子间作用力在蛋白质结构中的作用8.2 分子间作用力在DNA双螺旋结构中的作用8.3 分子间作用力在酶催化中的作用第九章:分子间作用力在材料科学中的应用9.1 分子间作用力在高分子材料中的应用9.2 分子间作用力在纳米材料中的应用9.3 分子间作用力在新能源材料中的应用第十章:分子间作用力的研究前沿与展望10.1 分子间作用力研究的最新进展10.2 分子间作用力在新技术开发中的应用10.3 分子间作用力研究的未来挑战与机遇这五个章节主要讨论了分子间作用力的实验测定方法、在化学反应和生物分子中的应用,以及在材料科学和研究前沿中的重要角色。
分子间作用力课件

诱导力
由于一个分子的诱导磁场与另 一个分子的磁场的相互作用产
生的力。
交换力
由于分子之间的电子云的相互 重叠和交换产生的力。
分子间作用力的物理意义
01
分子间作用力是决定物 质物理性质的重要因素 ,如熔点、沸点、溶解 度等。
02
分子间作用力可以影响 物质的物理性质,如密 度、粘度、表面张力等 。
极性分子由于正负电荷的中心不重合,会产生电偶极,使得极性分子之间存在 较强的相互作用。
非极性分子间作用力较弱
非极性分子之间的电性对称,相互之间的作用力较弱。
电荷分布影响
电荷分布越不均匀,作用力越大
分子中电荷的分布情况对分子间作用力有显著影响。若分子中的电荷分布不均匀 ,会引起其他分子电荷的强烈响应,从而产生较强的相互作用。
互作用。
分子束实验
将单分子或分子束定向射向表面 ,通过观察射向表面和反射的分 子分布,研究分子与表面相互作
用的机制。
理论计算方法
量子化学方法
利用量子化学理论计算分子间的相互作用能,分析分子间的电子 结构和能量变化。
分子力学方法
基于经典力学原理,构建分子模型,通过计算分子间的相对位置和 受力情况,分析分子间的相互作用。
通过复合不同性质的材料 ,实现多功能性,进一步 揭示分子间作用力的多样 性和复杂性。
对分子间作用力的深入理解
基础理论
01
深入研究分子间作用力的基础理论,如量子力学、统计力学等
,为理论预测和模拟提供更准确的模型和算法。
跨学科研究
02
结合物理学、化学、生物学等多学科的研究方法和技术,全面
揭示分子间作用力的机制和规律。
高二化学选择性必修课件分子间的作用力

氢键形成条件与性质
形成条件
氢键是一种特殊的分子间作用力,它通常存在于含有氢原子的分子之间。氢键的形成需要满足以下条 件:一是必须存在电负性较大的原子(如F、O、N等)与氢原子形成的共价键;二是氢原子与另一个 电负性较大的原子之间存在足够的接近距离。
性质
氢键是一种比范德华力更强的分子间作用力,它对于物质的物理和化学性质有着重要影响。氢键的存 在可以影响物质的熔点、沸点、溶解度等物理性质,同时也可以影响物质的化学性质和反应活性。
06
分子间作用力在生活生产中应用
表面活性剂降低表面张力原理
表面活性剂分子结构
具有亲水基团和疏水基团,能在液体表面定向排列,降低表面张 力。
降低表面张力的原理
表面活性剂分子在液体表面形成一层单分子膜,使液体表面分子间 的距离增大,相互作用力减弱,从而降低表面张力。
应用实例
洗涤剂、乳化剂、润湿剂等。
在材料科学中,分子间 作用力对于材料的物理 和化学性质有着重要的 影响。例如,聚合物的 性质和行为在很大程度 上取决于其分子间的相 互作用。
在化学工程中,了解和 利用分子间作用力对于 优化工艺流程和设计新 的化学产品具有重要的 意义。例如,在催化剂 的设计和选择中,需要 考虑催化剂与反应物之 间的相互作用。
产物的生成与分离
分子间作用力可以影响产物的生成和分离。在某些情况下,产物分子间的强作用力可能导 致产物难以从反应体系中分离出来。此时,可以通过调节反应条件或加入适当的分离剂来 改变分子间作用力的强度,从而实现产物的有效分离。
05
实验方法与技术手段研究分子间作用力
红外光谱法研究范德华力和氢键
红外光谱法原理
其他实验方法简介
01
02
分子间的作用力课件-高二上学期化学人教版(2019)选择性必修2

过氧化氢(H2O2)是一种医用杀菌消毒剂,已知H2O2分子的结构如下图所示。H2O2分子不是直线形,两个H原子犹如在半展开的书的两面纸上,书面夹角为93°52′,而两个O—H键与O—O键的夹角均为96°52′。试回答: (1)下列关于的说法正确的是_______。 a.该分子中有极性键 b.该分子中有非极性键 c.该分子中氧原子的轨道发生sp2杂化 d.该分子是非极性分子(2)H2O2分子间易形成氢键,该氢键的表示式是_____________。(4)H2O2易溶于水,主要原因是_______________________________。
归纳总结
填写下列空格:(1)N2的沸点比CO的沸点___(填“高”或“低”),其原因是________________________________________________________________________________。(2)BCl3的沸点比BF3的___(填“高”或“低”),其原因是_________________________________________________________。
ab
O—H···O
H2O2易与H2O分子间形成氢键且H2O和H2O2均为极性分子
影响
物质熔沸点
影响
物质溶解度
影响
分子极性
化学键极性
空间结构
影响
影响
与水分子间能形成氢键,能增大溶解度
使冰的密度小于水的密度
【例1】 下列现象与氢键有关的是( ) 。
B
的熔、沸点比第 族其他元素氢化物的高 ②水分子高温下也很稳定 ③接近水的沸点的水蒸气的相对分子质量测定值比用化学式 计算出来的相对分子质量大一些④邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低A.①②③④ B.①③④ C.①②③ D.①②④
3.4.1分子间作用力课件高二下学期化学选择性必修2

范德华(1837-1923) 荷兰物理学家
一 范德华力
Q3:水的两种变化分别破坏了什么?
破坏化学键 H-O-H
破坏分子间作用力
一 范德华力
范德华力特征: ➢ 范德华力比化学键能量小
化学键是强烈的相互作用(100~600 kJ·mol-1), 范德华力只有2~20 kJ·mol-1
➢ 一般没有方向性和饱和性。
二 氢键
观察思考2 观察图表,你能得到什么结论?
➢ 分子间存在氢键,熔沸点升高
二 氢键
观察思考3
邻羟基苯甲醛 熔点:2℃ 沸点:196.5℃
邻羟基苯甲醛和对羟基苯甲醛的相对分子质量接近,均 含有氢键,但二者沸点不一致,请解释原因。
对羟基苯甲醛 熔点:115℃ 沸点:250℃
OH
CO H
分子内氢键
随范德华力的增大 物质的熔沸点增大
【典例 3】关于氢键,下列说法正确的是( B )
A.分子中有 N、O、F 原子,分子间就存在氢键
B.因为氢键的缘故,
比
熔、沸点高
C.由于氢键比范德华力强,所以 H2O 分子比 H2S 分子稳定 D.“可燃冰”——甲烷水合物(例如:8CH4·46H2O)中 CH4 与 H2O 之间存在氢键
Q4: 氢键的能量有多大?
氢键键能(kJ·mol-1) 共价键键能(kJ·mol-1)
F—H … F 28.1 568
➢ 范德华力< 氢键 < 化 学 键
O—H … O 20.9 462.8
N—H … N 18.8 390.8
二 氢键
Q5: 氢键特征是什么? X—H···Y ➢方向性 (分子间氢键的X—H···Y三个原子尽可能在同一条直线上)
三种戊烷的同分异构体沸点
分子间作用力[1]
![分子间作用力[1]](https://img.taocdn.com/s3/m/f47798de79563c1ec4da71a5.png)
\℃
分子间作用力
沸 点
一些氢化物的沸点 周期
分子间作用力
二.氢键
1.氢键的形成:
和原子半径小、电负性很强元素的原子形成共价键 的氢原子与另一原子半径小、电负性很强元素的原子的 孤电子对接近产生的相互作用
分子间作用力
2.表示方法
X-H•••Y
X 和 Y:N 、 O 、 F等
分子间作用力
3.氢键对物质性质的影响
分子间氢键
增强分子间力
分子内氢键
削弱分子间力
练习
1.实现下列变化时需克服相同类型作用力的是( C D)
A.金刚石和干冰的熔化 C.液溴和水的气化
B.食盐和冰醋酸的熔化 D.碘和萘的升华
2.固体乙醇晶体中不存在的作用力是 A.极性键 B.非极性键 C.离子键
( C) D.氢键
练习
3.关于氢键,下列说法中,正确的是
(D )
A.氢键比范德华力强,所以它属于化学键
B.水是非常稳定的化合物是由氢键所致
C.碘化氢的沸点比氯化氢的沸点高是由于碘化氢分子
间存在氢键
D.分子间的形成的氢键使物质的熔点和沸点升高
练习
4.已知氟化氢分子间氢键键能为28kJ•mol-1,水分子间 氢键键能为19.28kJ•mol-1,为什么水分子常温下呈液体, 而HF常温下为气体?
分子间作用力
分子间作用力
一.范德华力
范德华力是一种普遍存在于分子之间的作用力 1.范德华力与共价键的区别
(1)范德华力比共价键弱的多 (2)没有方向性和饱和性
分子间作用力
2.影响范德华力的主要因素
(1)质同或相似 (2) 量同
分子的相对分子质量 分子的结构
思考
