专题04 化学平衡图像-2019高考复习专题-化学反应速率和化学平衡(解析版)
化学反应速率和平衡图像课件

时达到平衡,即升高温度,化学反应速率增大;反应体系的温度越高,H2BO3 的转化 率越大,说明升高温度有利于平衡向正反应方向移动,正反应为吸热反应,则 ΔH>0。
答案:(1)6H2
(2)①升高温度,反应速率加快,平衡向正反应方向移动 ②>
(3)依题意
H3BO3(aq)+H2O(l)
4]-(aq)+H+(aq)
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较大
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
解析:增大压强能加快反应速率,缩短达到平衡的时间,且使平衡向正反应方向移
动,故 A 正确;根据勒·夏特列原理,增大压强,B 的转化率应增大,故 B 错误;升 高温度,反应速率加快,但升温使平衡逆向移动,B 的转化率降低,故 C 正确;图 Ⅲ中甲达到平衡所用的时间比乙少,但甲、乙平衡状态一样,D 正确。
(5)其他:如图4所示曲线是其他条件不变时,某反应物的最大转化率(α)与温度(T)的 关系曲线,图中标出的1、2、3、4四个点,表示v正>v逆的点是3,表示v正<v逆的点 是1,而2、4点表示v正=v逆。
技能应用提升系列 阅卷现场系列报告16
阅卷现场系列报告17
各可逆反应达平衡后,改变反应条件,其变化趋势正确的是 ( )
SO2、O2、SO3 物质的量变化如图,反应处于平衡状态的时间是____________。
(4)据图判断,反应进行至 20 min 时,曲线发生变化的原因是
__________________________________________________________________。
(用文字表达)。10 min 至 15 min 的曲线变化的原因可能是________(填写编号)。
化学反应速率和化学平衡--图像专题

V正
V正= V逆
平衡状态Ⅰ
V逆
0
t1
t2
t(s)
练习4:反应X(g)+3Y(g)
2Z(g)
△H<
0在不同温度、
不同压强(P1>P2)下,达到平衡时,混合气体中Z的体积
分数随温度变化曲线为(
Z% Z%
B
)
Z%
P2
P1
P1
P2
P2
P1
T
T
T
A
B
C
下列图象中,不能表示反应
A2(g)+3B2(g) 的是…( D )
右图是反应速率与反应进程的关系图,请回答:
(1)处于平衡状态的时间段
t0~t1,t2~t4,t5~t6 是_________________________
(2)t1、t3、t4时刻体系中分
ν
ν逆 ν正 ν逆 ν正
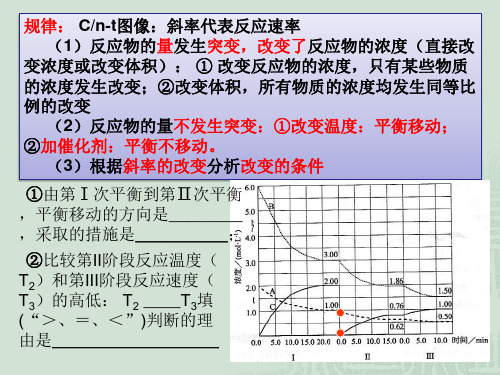
别是什么条件发生了变化? t1:升温; t0 t1 t2 t 3 t4 t3:加催化剂; t4:减压 (3)下列各时间段,氨的体积分数最高的是( A ) A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
t5 t6 t
2.浓度(C)-时间(t)图
例2:
①反应类型为:可逆反应 ②方程式为: 2A ③反应物的转化率:
2B+C
50%
④化学反应速率: V(A)=0.1mol/(L.min) 曲线的起点、转折点及变化趋势
练习2:
现有正反应放热的可逆反应(所有物质为气态),
反应开始后变化如图所示: X、Y (1)该反应的反应物是______;
X+Y Z (2)化学方程式为_________________
化学平衡图像专题(超详细版)

一、浓度 - 时间图:
例:
c
0.9 0.6 0.3
可用于:
1)写出化学反应方程式:
C A B
t
A+2B 3C A的转化率=33.3% B的转化率=66.7%
2)求反应物的转化率:
200℃ 300℃
pC(g)+qD(g)
正反应吸热 m+n=p+q
P
判断m+n与p+q的关系?正反应是放热 还是吸热?
对于2A(g)+B(g) C(g)+3D(g)(正反应 吸热)有如下图所示的变化,图中Y轴可 能表示:
Y
A. B物质的转化率
B. 正反应的速率
300℃
200℃ C. 平衡体系中的A% 100℃ P D. 平衡体系中的C%
2、该反应正向是:啊
(吸、放)热反应。
啊气体物质的量(增大、减源自)的反应。三、某物质的转化率(或百分含量)时间-温度(或压强)图:
对于反应mA(g)+nB(g)
pC(g)+qD(g)
A
的 转
T1
化 率
T2
t
判断正反应是放热还是吸热?
正反应吸热
三、某物质的转化率(或百分含量)时间-温度(或压强)图:
c
练: 0.4
0.3
B
0.2
A
0.1
C
t
1) 写出化学反应方程式: 5A 3B+2C
2) 求反应物的转化率: A的转化率=62.5%
二、速度-时间图: 可用于:
高考化学:选择题题型04 化学反应速率与平衡图像分析

题型04化学反应速率与平衡图像分析1.物质的量(浓度)、速率——时间图像如Zn 与足量盐酸的反应,反应速率随时间的变化出现如图情况。
例如,某温度时,在定容L)容器中,X 、Y 、Z 三种物质的物质的量随时间的变化曲线高考化学:选择题题型如图所示。
(2)根据图像可进行如下计算:①某物质的平均速率、转化率,如v (X)=n 1-n 3V ·t 3mol·L -1·s -1,Y 的转化率=n 2-n 3n 2×100%。
②确定化学方程式中的化学计量数之比如X 、Y 、Z 三种物质的化学计量数之比为(n 1-n 3)∶(n 2-n 3)∶n 2。
2.含量(或转化率)—时间—温度(压强)图像(1)“先拐先平,3.恒温(压)图像分析(1)无论是用某一反应物表示还是用某一生成物表示,由于Δc是取浓度变化的绝对值,因此,其化学反应速率都取正值,且是某一段时间内的平均速率。
(2)化学反应速率可用反应体系中一种反应物或生成物浓度的变化来表示,一般是以最容易测定的一种物质表示,书写时应标明是什么物质的反应速率。
(3)在一定温度下,固体和纯液体物质,其单位体积里的物质的量保持不变,即物质的量浓度为常数,因此它们的化学反应速率也被视为常数。
由此可知,现在采用的表示化学反应速率的方法还有一定的局限性。
(4)在同一反应中,用不同的物质表示同一时间的反应速率时,其数值可能不同,但这些数值所表达的意义是相同的即都是表示同一反应的速率。
各物质表示的反应速率的数值有相互关系,彼此可以根据化学方程式中的各化学计量数进行换算。
(5)一般来说在反应过程中都不是等速进行的,因此某一时间内的反应速率实际上是这一段时间内的平均速率。
(6)由于固体和纯液体的浓度可视为常数,故改变其用量反应速率不变。
但当固体颗粒变小时,其表面积增大将导致反应速率增大。
(7)压强对化学反应速率的影响是通过改变反应物浓度实现的,所以分析压强的改变对反应速率的影响时,要从反应物浓度是否发生改变的角度来分析。
化学平衡和速率图像

3.“平台”类 v-t 图——催化剂(或压强)对化学反应 速率的影响
图像中 v′(正)、v′(逆)都是突然增大,且增大的程度 相同,t1 时刻,图像中出现了“平台”,化学平衡不发生移 动,改变的条件可能是使用了催化剂也可能是对反应前后气 体总体积不发生变化的反应增大了压强。
(2)解题原则——“先拐先平数值大”。 在化学平衡图像中,先出现拐点的反应则先达到平衡,先出 现拐点的曲线表示的温度较高(如图Ⅰ中 T2>T1)、压强较大(如图 Ⅱ中 p2>p1)或使用了催化剂(如图Ⅲ中 a 使用了催化剂)。
Ⅰ.表示 T2>T1,生成物的百分含量降低,说明正反应是放热 反应,温度升高,平衡逆向移动。
图像Ⅱ中,v′(正)渐变,v′(逆)突变,t1 时刻图像中有一条线是 连续的,且 v′(正)>v′(逆),说明 t1 时刻改变的条件是减小了生成 物的浓度,使 v′(逆)突变,平衡正向移动。
2.“断点”类 v-t 图——温度(或压强)对化学反应速率的影响
图像Ⅰ中,v′(正)、v′(逆)都 是突然增大的,t1 时刻,图像中出现 了“断点”,且 v′(正)>v′(逆), 平衡正向移动,说明该反应的正反 应可能是吸热反应(或气体总体积减 小的反应),改变的外界条件B(g) pC(s)+qD(g)反应过程中,
其他条件不变时,产物 D 的质量分数 D%与温度 T 或压强 p
的关系如图所示,请判断下列说法正确的是
A( )
A.降温,化学平衡向正反应方向移动
高三化学高考备考一轮复习化学反应速率与化学平衡图像课件

B.t2时改变的条件:向容器中加入C
C.平衡时A的体积分数φ:φ(Ⅱ)>φ(Ⅰ)
D.平衡常数K:K(Ⅱ)<K(Ⅰ)
B.根据图像变化曲线可知,t2~t3过程中,t2时v正瞬间不变,平衡过程中不断增大,则说
明反应向逆反应方向移动,且不是“突变”图像,属于“渐变”过程,所以排除温度与催化剂等
B.t1时,c(X) =c(Y) =c(Z)
Z
X
C.t2时,Y的消耗速率大于生成速率
Y
D.t3后,c(Z)=2c0—c(Y)
【分析】由题中信息可知,反应X=Z经历两步:①X→Y;②Y→2Z。因此,图中呈不断
减小趋势的a线为X的浓度c随时间t的变化曲线,呈不断增大趋势的线为Z的浓度c随时间t
的变化曲线,先增大后减小的线为Y的浓度c随时间t的变化曲线。
(四)化学反应速率与化学平衡图像
10.(2022·广东)反应X=Z经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随
时间t的变化曲线如图所示。下列说法不正确的是
A.a为c(X)随t的变化曲线
B.t1时,c(X) =c(Y) =c(Z)
C.t2时,Y的消耗速率大于生成速率
Z
X
Y
D.t3后,c(Z)=2c0—c(Y)
化学反应速率与化学平衡图像
命题方向
2023届
高考化学复习
回眸高考
模型建构
考题预测
教学策略
命题方向
2023届
高考化学复习
回眸高考
模型建构
考题预测
教学策略
回眸高考
(一)化学反应速率的测定与实验数据处理
(二)化学平衡状态的判断与理解
高中化学第二章化学反应速率与化学平衡重难点十化学平衡的图像含解析

重难点十化学平衡的图像1.化学平衡图象分析方法:对于化学反应速率和化学平衡的有关图象问题,可按以下方法进行分析:①认清坐标系,搞清纵、横坐标所代表的意义,并与平衡移动原理(勒夏特列原理)挂钩;②结合可逆反应的特征,搞清正反应方向使吸热还是放热,体积增大还是减小、不变,有无固体、纯液体物质参加或生成等;③看清速率的变化及变化量的大小,在条件与变化之间搭桥;④看清起点、拐点、终点,看清曲线的变化趋势和图象中线的斜率;⑤先拐先平,数值大.例如,在转化率--时间图上,先出现拐点的曲线先达到平衡,此时逆向退离可得该变化的温度高、浓度大、压强高;⑥定二议一.当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系,例如做等温线、等压线;2.常见图象分类:(1)反应速率--时间图象:判断引起平衡变化的因素.(2)物质的量(浓度)--时间图象:①书写化学方程式;②求反应物的转化率注意事项:①何为反应物、生成物;②反应物、生成物的化学计量数关系;③是否为可逆反应.(3)百分含量--温度、压强--时间图象;(4)转化率--温度、压强--时间图象;(5)百分含量--压强--温度图象。
【重难点点睛】一、化学平衡图形问题的解题步骤:(1)看懂图象:①看面(即弄清纵坐标与横坐标的意义);②看线(即弄清线的走向和变化的趋势);③看点(即弄清起点、拐点、交点、终点的意义);④看是否要作辅助线(如等温线、等压线);⑤看定量图象中有关量的多少.(2)联想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律.(3)作出判断:根据图象中表现的关系与所学规律相对比,作出符合要求的判断.二、原则(1)“定一议二”原则在化学平衡图象中,包括纵坐标、横坐标和曲线所表示的三个量,确定横坐标所示的量后,讨论纵坐标与曲线的关系或确定纵坐标所示的量后,讨论横坐标与曲线的关系.(2)“先拐先平,数值大”原则在化学平衡图象中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高或表示的压强较大。
化学反应速率与化学平衡——图像专题(共52张)
v
pC(g)+qD(g),条件改变时有
右图变化反应;b.___加__压___,
m+n__>_p+q;平衡向__正__反应 方向移动。
v
②若对上述反应降温或减小 压强,画出平衡移动过程中 的 v-t图。
v正 v逆
t1
t2 t
v逆
v正
t1
t2 t
2.速率----时间图像
(3) 催化剂 压强变化b
①对于mA(g)+nB(g)
v
pC(g)+qD(g),条件改变时有
右图变化,改变的条件可能
为:a.__加__正__催__化__剂__;
b.__加__压____,m+n__=_p+q;平
衡向__正__反应方向移动。 v
②若对上述反应加负催化剂 或减小压强,画出平衡移动 过程中的 v-t图。
v正 v逆
t1
t
v正 v逆
t1
t
2.速率----时间图像
原因分类:
(1)若a、b无断点,则平衡移动肯定是改变某一物质的浓 度导致。
(2)若a、b有断点,则平衡移动原因可能是:①改变反应 体系的压强;②改变反应体系的温度;③同时不同程度地改 变反应物(或生成物)的浓度;
(3)若改变条件后,正、逆反应速率仍相等,则原因可能 是:①反应前后气体分子体积不变;②使用了催化剂;③等 效平衡
__增__大__反__应__物__浓__度___,
平衡将向__正__反应方向移动。
②引起平衡移动的因素是: v
__减__小__生__成__物__浓__度___, 平衡将向_正___反应方向移动。
v正
v逆
t1
t2 t
化学反应速率和化学平衡图像课件

P2 P1
答 P1 > P2 案 m+n > p+q
0
上 页
下 页
时间
首 页
返 回
2023/12/26
4.转化率——时间曲线
mA(g)+nB(g) pC(g)+qD(g) ΔH=Q
问题: m+n<p+p还是
A
m+n>p+p
m+n<p+q
的
转
化
1.01106Pa
率
1.01107Pa
0
上 页
t1
下 页
V
突变
V逆
答:从逆反应开 始。
降温或减压。
V正 V'正 V'逆
平衡向正反应 方向移动。
t
上 页
下 页
首 页
返 回
2023/12/26
看图:说出反应起始时是从正反应;还是从逆反应开 始?然后是改变什么条件?化学平衡向什么方向移动?
V V正 V'正 = V'逆
突变
V逆
答:正、逆反 应同时开始。
加催化剂
1、化学反应速率图象分析
2.V-t图象
V
V'正
V正
V'逆
V逆
分清正反应和逆反应; 分 清放热反应和吸热反应; 分清“突变”和“渐变”
此图表示:增大 反应物浓度时, 正反应、逆反应 的速率变化情况, 平衡向正反应方 向移动。
t
上 页
下 页
首 页
返 回
2023/12/26
看图:说出反应起始时是从正反应,还是从逆反应开始? 然后是改变什么条件?化学平衡向什么方向移动?
化学反应速率和化学平衡图像(课件PPT)

E.降温
F.减小压强
2.反应速率—温度(压强)图象
可逆反应mA(g)+ nB(g) xC (g) +yD( g)
[例2] 改变压强后,速率变化如图:则m+n > x+y
[小结]
看图,分析图像特点→V正、V逆的交点是平衡点 →当改变条件后,V正、V逆的变化情况→判断平衡 的移动方向
[练习2]
下列各图是温度(或压强)对正、逆反应速率的影 响,曲线交点表示建立平衡时的温度或压强,其 中正确的是( A )
53、希望是厄运的忠实的姐妹。 54、辛勤的蜜蜂永没有时间悲哀。 55、领导的速度决定团队的效率。 56、成功与不成功之间有时距离很短只要后者再向前几步。 57、任何的限制,都是从自己的内心开始的。 58、伟人所达到并保持着的高处,并不是一飞就到的,而是他们在同伴誉就很难挽回。 59、不要说你不会做!你是个人你就会做! 60、生活本没有导演,但我们每个人都像演员一样,为了合乎剧情而认真地表演着。 61、所谓英雄,其实是指那些无论在什么环境下都能够生存下去的人。 62、一切的一切,都是自己咎由自取。原来爱的太深,心有坠落的感觉。 63、命运不是一个机遇的问题,而是一个选择问题;它不是我们要等待的东西,而是我们要实现的东西。 64、每一个发奋努力的背后,必有加倍的赏赐。 65、再冷的石头,坐上三年也会暖。 66、淡了,散了,累了,原来的那个你呢? 67、我们的目的是什么?是胜利!不惜一切代价争取胜利! 68、一遇挫折就灰心丧气的人,永远是个失败者。而一向努力奋斗,坚韧不拔的人会走向成功。 69、在真实的生命里,每桩伟业都由信心开始,并由信心跨出第一步。 70、平凡的脚步也可以走完伟大的行程。 71、胜利,是属于最坚韧的人。 72、因害怕失败而不敢放手一搏,永远不会成功。 73、只要路是对的,就不怕路远。 74、驾驭命运的舵是奋斗。不抱有一丝幻想,不放弃一点机会,不停止一日努力。3、上帝助自助者。 24、凡事要三思,但比三思更重要的是三思而行。 25、如果你希望成功,以恒心为良友,以经验为参谋,以小心为兄弟,以希望为哨兵。 26、没有退路的时候,正是潜力发挥最大的时候。 27、没有糟糕的事情,只有糟糕的心情。 28、不为外撼,不以物移,而后可以任天下之大事。 29、打开你的手机,收到我的祝福,忘掉所有烦恼,你会幸福每秒,对着镜子笑笑,从此开心到老,想想明天美好,相信自己最好。 30、不屈不挠的奋斗是取得胜利的唯一道路。 31、生活中若没有朋友,就像生活中没有阳光一样。 32、任何业绩的质变,都来自于量变的积累。 33、空想会想出很多绝妙的主意,但却办不成任何事情。 34、不大可能的事也许今天实现,根本不可能的事也许明天会实现。 35、再长的路,一步步也能走完,再短的路,不迈开双脚也无法到达。
化学平衡图像分析 课件-高二化学人教版(2019)选择性必修1

1、正反应是 反应 (放热、吸热)
放热
ΔH<0
【练习】可逆反应:A(g) + B(g)⇌2C(g)在不同温度下经过一定时间,混合物中C的体积分数(C%)与温度的关系如图所示,回答下列问题:(1)由T1向T2变化,υ(正)__υ(逆)(填>、<或 =)。
【练习】mM(s)+ nN(g) ⇌ pQ(g) △H<0 。在一定温度下平衡时N%与压强的关系如图,下列有关叙述正确的是A、A点时混合物的V(正)> V(逆)B、A点比B点反应速率快 C、n>pD、m+n>p
A
3
【练习】可表示为可逆反应2A(g)+B(g) ⇌ 2C(g) △H < 0的图象是( )
B
化学平衡图像题的解题方法
1、一看轴,即横坐标和纵坐标的意义。2、二看点,即一些特殊点如起点、拐点、交点、终点、最高点的意义。3、三看线即弄清图像中线的走向和变化趋势。4、四看辅助线弄清图像斜率的大小。 5、五看量的变化如浓度、温度、转化率、物质的量斜率的变化等。
化学平衡图像技巧
1、交点、最高点、最低点、与x轴的平行线往往代表平衡状态
放热
>
放热
<
可逆反应 mA(g) + nB(g) pC(g) +qD(g)
定一议二”
【练习】如图所示,反应:X(g)+3Y(g) ⇌ 2Z(g);△H<0 。在不同温度、不同压强(P1>P2)下达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为( )
C
五、物质的量/物质的量浓度--时间图象
2.3.3 化学反应速率与化学平衡-图像专题

图像专题 化学
学习目标
①掌握不同因素影响下的速率-时间(v-t)
曲线; ②掌握不同温度、压强下的浓度(转化率、
百分含量)—时间曲线
一. v-t (速率—时间) 图像
(1) 改变浓度
v
v'正 v正
v'逆 v逆
t C反应物↑
v
v'逆 v正
v'正 v逆
t C生成物↑
v
v正 v'正
(3) 气体物质的量 增大 (增大、减少)的反应。
二.浓度(转化率、百分含量)—时间—压强(温度)曲线
mA(g)+nB(g) pC(g)+qD(g) ΔH 0 先拐先平数值大
C%
T2
C%
T2
T1
T1>T2
ΔH<0
T1 T1<T2 ΔH>0
0 t1
t2 时间
0 t1 t2 时间
A% 0 t1
T2
T1 t2 时间
(1) 分清反应物和生成物,浓度减小的是反应物, 浓度增大的是生成物。
(2) 浓度(物质的量)变化量之比=计量系数之比 (3) 是否为可逆反应
物质的量
物质的量
2.0 1.5 1.0 0.5
0
2A + B
C A B
时间
3C
2.0 1.5 1.0 0.5
0
A + 2B
A B C
时间
C
例1. 下图表示反应X(g) 4Y(g)+Z(g) △H<0, 在某温度时的浓度随时间变化的曲线,下列有关
mA(g)+nB(g) pC(g)+qD(g)
化学反应速率和平衡图像.doc

化学反应速率和平衡图像一、回顾1.影响化学反应速率的外界因素2.影响化学平衡的外界因素二、内容1.速率—时间图解法识记:1.增加反应物浓度,v正跳上得更大;减小反应物浓度,v正跳下得更大2.增加生成物浓度,v逆跳上得更大;减小生成物浓度,v逆跳下得更大3.升高温度,吸热方向跳上得更大;降底温度,吸热方向跳下得更大4.增大压强,计量数减小方向跳上得更大;减小压强,计量数减小方向跳下得更大若v正在v逆的上方,即平衡向正反应方向移动;若v逆在v正的上方,即平衡向逆反应方向移动。
2.浓度(或物质的量)—时间图1.可逆反应a X(g)+b Y(g) c Z(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)—时间(t)图象如图,则下列说法中正确的是()A.若a+b=c,则t0时只能是增大了容器的压强B.若a+b=c,则t0时只能是加入了催化剂C.若a+b≠c,则t0时只能是增大了容器的压强D.若a+b≠c,则t0时只能是加入了催化剂【典例2】(2013·成都模拟)可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。
1)根据图1请写出合成氨的热化学方程式______________________________________(热量用E1、E2或E3表示)。
(2)图1中虚线部分是通过改变化学反应中的___________条件,该条件的改变与图2中哪一时刻条件的改变相同_________(用“t1…t6”表示)。
(3)图2中t3时刻改变的条件是_______________,t5时刻改变的条件是___________。
答案:(1)N2(g)+3H2(g) 2NH3(g)ΔH=-2(E3-E1)kJ·mol-1(2)催化剂t2…t3 (3)减小压强升高温度赠送以下资料我对化学学科核心素养的理解高中化学核心素养在某种程度上表明了新形势下化学学科的教学目标、育人要求,将化学知识转化为一种具体的能力用以解决生活、工作和学习中的具体问题。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题04 化学平衡图像1.某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:下列说法中正确的是A. 30 min~40 min 间该反应使用了催化剂B. 反应方程式中的x=1,正反应为吸热反应C. 30 min 时降低温度,40 min 时升高温度D. 30 min时减小压强,40 min时升高温度【答案】D【解析】分析:由图象可以知道,30 min~40 min之间,反应速率降低了,平衡不移动,反应物与生成物的浓度瞬时降低,催化剂不能改变浓度,故不能是温度变化,而是降低了压强;由开始到达到平衡,A、B的浓度减少的量相同,由此可以知道x=1。
则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,以此解答该题。
详解:A. 由图象可以知道,30 min~40 min只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,故A错误;B.由开始到达到平衡,A、B的浓度减少的量相同,由此可以知道x=1,反应前后气体体积不变,则增大压强平衡不移动,40 min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡逆向移动,应是升高温度,则正反应为放热反应,故B错误;C.降低温度,平衡发生移动,则正逆反应速率不相等,故C错误;D.由图象可以知道,30 min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,40 min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,所以D选项是正确的。
所以D选项是正确的。
2.下列说法正确的是A. 由图甲可知,升高温度醋酸钠的水解程度增大B. 由图乙可知,a点的数值比b点的数值大C. 由图丙可知,反应是吸热反应D. 由图丁可知,反应金刚石,石墨,的焓变【答案】A【解析】分析:升高温度醋酸钠溶液的pH增大,故其水解程度增大;只与温度有关;T2对应的化学反应速率较大,故T2温度较高,C的平衡时的体积分数较小,故反应是放热反应;反应金刚石,石墨,是放热反应,由盖斯定律可知,。
详解:A. 由图甲可知,升高温度醋酸钠溶液的pH增大,故其水解程度增大,A正确;B.只与温度有关,a点的数值与b点的数值相等,B不正确;C. 由图丙可知,T2对应的化学反应速率较大,故T2温度较高,C的平衡时的体积分数较小,故反应是放热反应,C不正确;D. 由图丁可知,反应金刚石,石墨,是放热反应,由盖斯定律可知,,D不正确。
本题选A。
3.工业上常用一氧化碳和氢气反应生甲醇。
一定条件下,在体积为VL的密闭容器中,CO(g)+2H2(g) CH3OH(g),下图表示该反应在不同温度下的反应过程。
关于该反应,下列说法正确的是A. 反应达平衡后,升高温度,平衡常数K增大B. 工业生产中温度越低,越有利于甲醇的合成C. 500℃反应达到平衡时,该反应的反应速率是v(H2)= mol/(L·min)D. 300℃反应达到平衡后,若其他条件不变,将容器体积扩大为2VL,c(H2)减小【答案】D【解析】分析:A.依据图象分析,先拐先平,温度高甲醇物质的量减小,说明正向反应是放热反应;B、温度越低,反应速率越小;C、甲醇和氢气速率之比等于1:2,依据速率概念计算;D、扩大体积相当于减小压强,平衡逆向进行,但体积增大平衡后氢气浓度减小.详解:A、由图象分析,温度越高,甲醇的物质的量越小,说明温度越高平衡逆向进行,平衡常数减小,故A错误;B. 温度过低,反应速率太小,不利于甲醇的合成,故B错误;C. 500℃反应达到平衡时,甲醇和氢气速率之比等于1:2,用氢气物质的量浓度减少表示该反应的反应速率是v(H2)=2×mol/(L•min),故C错误;D、300℃反应达到平衡后,若其他条件不变,将容器体积扩大为2VL,平衡左移,但体积增大平衡后氢气浓度减小,故D正确;答案选D。
4.下列关于各图像的解释或结论正确的是A. 图甲表示常温下向20mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系B. 图乙表示2SO2(g)+O2(g)2SO3(g) △H<0的平衡常数K与温度和压强的关系C. 图丙表示一定条件下的合成氨反应,N2的起始量恒定时,NH3的平衡体积分数随H2起始体积分数的变化,图中a点N2的转化率等于b点D. 图丁表示反应2SO2+O2 2SO3,t1时刻降低温度符合图示变化【答案】D【解析】分析:A.醋酸是弱酸,pH=3的醋酸溶液比pH=11的NaOH溶液浓度大的多,a点时二者反应,醋酸过量,溶液呈酸性;B.平衡常数K只与温度有关,和压强无关;C.图象分析可以知道,随氢气体积分数增大,平衡正向进行氨气平衡体积分数增大,但随氢气量的增大超过平衡移动量的增大,氨气的体积分数会减小,但增大氢气的浓度,氮气转化率增大; D.由图象看以看出在t1时正反应速率减小,与图象相符。
详解:A.醋酸是弱酸,部分电离,pH=3的醋酸溶液比pH=11的NaOH溶液浓度大的多,a点时二者等体积反应,醋酸过量,溶液呈酸性,故A错误;B.平衡常数K只与温度有关,和压强无关,所以B选项是错误的;C.增大氢气的浓度,提高氮气的转化率,所以随H2起始体积分数增大,N2的转化率增大,即a点N2的转化率小于b点,所以C选项是错误的;D.降低体系温度,正逆反应速率都减小,平衡向正反应方向移动,与图象相符,故D正确。
所以D选项是正确的。
5.反应:2X 在不同温度和压强下的产物Z的物质的量和反应时间t的关系如下图所示:下列判断正确的是A.B.C.D.【答案】A【解析】根据温度对反应速率的影响可知,温度越高,反应速率越大,则达到平衡用的时间越少,曲线的斜率越大,故有:T1>T2;根据压强对反应速率的影响可知,压强越大,反应速率越大,则达到平衡用的时间越少,曲线的斜率越大,先拐先平压强大,故有:P1>P2,温度越高Z物质的量越少说明升温平衡逆向进行,正反应为放热反应,△H<0;本题选A。
6.下列图示与对应的叙述相符的是甲乙丙丁A. 图甲表示常温下稀释pH均为11的MOH溶液和NOH溶液时pH的变化,由图可知溶液的碱性:MOH>NOHB. 图乙表示常温下0.100 0 mol·L-1醋酸溶液滴定20.00 mL0.100 0 mol·L-1 NaOH溶液的滴定曲线C. 图丙表示反应CH4(g)+H2O (g)CO(g)+3H 2(g)的能量变化,使用催化剂可改变E b﹣E a的值D. 图丁表示反应2CO(g)+2NO(g)N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率c>b>a【答案】D【解析】分析:本题考查对图像的理解和分析能力,涉及强弱电解质的稀释,中和滴定,能量变化和化学平衡。
详解:A、因为稀释能促进弱碱的电离,所以稀释pH均为11的MOH溶液和NOH溶液时pH变化大的碱性强,所以碱性:MOH<NOH,A错误;B. 常温下0.100 0 mol·L-1醋酸溶液滴定20.00 mL0.100 0 mol·L-1 NaOH溶液,当加入20.00mL醋酸时,二者恰好反应生成醋酸钠,水解显碱性,而不是中性,所以B错误;C.反应中加入催化剂会降低活化能,但不影响反应热,即使用催化剂不改变E b﹣E a的值,C错误;D、反应2CO(g)+2NO(g)N2(g)+2CO2(g),在其他条件不变的情况下增大起始物CO的物质的量,使一氧化氮转化率增大,NO的转化率c>b>a,D正确;因此本题答案为D。
7.在容积不变的密闭容器中存在如下反应:2SO2 (g)+O2 (g)2SO3 (g) ΔH<0。
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是()A. 图Ⅰ表示的是t1时刻增大压强对反应速率的影响B. 图Ⅲ表示的是温度对平衡的影响,且T甲小于T乙C. 图Ⅲ表示的是催化剂对化学平衡的影响,乙使用了催化剂D. 图Ⅱ表示的是t1时刻加入催化剂对反应速率的影响【答案】C【解析】分析:A.增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大;B.加入催化剂,平衡不发生移动;C.正反应放热,升高温度,平衡向逆反应方向移动;D.加入催化剂,正逆反应速率都增大,但速率相等,平衡不移动。
详解:A.增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大,图Ⅰ应是增大压强的原因,选项A正确;B.图Ⅲ甲、乙两个平衡状态不同,而加入催化剂,平衡不发生移动,选项B正确;C.乙到达平衡时间较短,乙的温度较高,正反应放热,升高温度,平衡向逆反应方向移动,SO3的转化率减小,选项C不正确;D.图Ⅱ在t0时刻正逆反应速率都增大,但仍相等,平衡不发生移动,应是加入催化剂的原因,选项D正确;答案选C。
8.T℃时,对于可逆反应:A(g)+B(g)2C(g) +D(g) △H>0。
下列各图中正确的是【答案】D【解析】分析:根据方程式可知正反应是吸热的体积增大的可逆反应,结合外界条件对反应速率和平衡状态的影响分析判断。
详解:A、升高温度平衡向正反应方向进行,C的浓度增大,A错误;B、升高温度平衡向正反应方向进行,A的转化率增大。
增大压强平衡向逆反应方向进行,A的转化率降低,B错误;C、增大压强正逆反应速率均增大,C错误;D、升高温度平衡向正反应方向进行,C的质量分数增大。
增大压强平衡向逆反应方向进行,C的质量分数降低,D正确,答案选D。
9.如图所示为密闭容器中反应C(s)+H2O(g)CO(g)+H2(g)ΔH>0达到平衡后,由于条件改变而引起正、逆反应速率的变化以及平衡移动的情况。
下列说法错误..的是A. 起始反应物为CO和H2B. 改变条件后平衡逆向移动C. 新平衡时CO的浓度比原平衡小D. 改变的条件是增大压强【答案】C【解析】分析:A项,起始正反应速率为0,起始反应物为CO和H2;B项,改变条件后υ逆ˊυ正ˊ,平衡逆向移动;C项,由于改变条件后正、逆反应速率都加快且υ逆ˊυ正ˊ,所以改变的条件是增大压强,根据勒夏特列原理,新平衡时CO的浓度比原平衡大;D项,由于改变条件后正、逆反应速率都加快且υ逆ˊυ正ˊ,所以改变的条件是增大压强。
详解:A项,起始正反应速率为0,起始反应物为CO和H2,A项正确;B项,改变条件后υ逆ˊυ正ˊ,平衡逆向移动,B项正确;C项,由于改变条件后正、逆反应速率都加快,改变的条件不可能是增大浓度,该反应的正反应为气体分子数增大的吸热反应,改变条件后υ逆ˊυ正ˊ,改变的条件不可能是升高温度或使用催化剂,则改变的条件是增大压强,增大压强平衡逆向移动,根据勒夏特列原理,新平衡时CO的浓度比原平衡大,C项错误;D项,由于改变条件后正、逆反应速率都加快且υ逆ˊυ正ˊ,所以改变的条件是增大压强,D项正确;答案选C。
