常见典型晶体晶胞结构.doc
常见晶体模型与晶胞计算 Word版含解析

常见晶体模型与晶胞计算1.典型晶体模型晶体晶体结构晶体详解原子晶体金刚石(1)每个碳与相邻4个碳以共价键结合,形成正四面体结构(2)键角均为109°28′(3)最小碳环由6个C 组成且六原子不在同一平面内(4)每个C 参与4条C —C 键的形成,C 原子数与C —C 键数之比为1∶2SiO 2(1)每个Si 与4个O 以共价键结合,形成正四面体结构(2)每个正四面体占有1个Si,4个“12O”,n (Si)∶n (O)=1∶2(3)最小环上有12个原子,即6个O,6个Si分子晶体干冰(1)8个CO 2分子构成立方体且在6个面心又各占据1个CO 2分子(2)每个CO 2分子周围等距且紧邻的CO 2分子有12个离子晶体NaCl 型(1)每个Na +(Cl -)周围等距且紧邻的Cl -(Na +)有6个,每个Na +周围等距且紧邻的Na +有12个(2)每个晶胞中含4个Na +和4个Cl -CsCl 型(1)每个Cs+周围等距且紧邻的Cl -有8个,每个Cs +(Cl-)周围等距且紧邻的Cs+(Cl-)有6个(2)如图为8个晶胞,每个晶胞中含1个Cs+、1个Cl-金属晶体简单立方堆积典型代表Po ,配位数为6,空间利用率52%面心立方最密堆积又称为A 1型或铜型,典型代表Cu 、Ag 、Au ,配位数为12,空间利用率74%体心立方堆积又称为A 2型或钾型,典型代表Na 、K 、Fe ,配位数为8,空间利用率68%六方最密堆积又称为A3型或镁型,典型代表Mg 、Zn 、Ti ,配位数为12,空间利用率74%2.晶胞中微粒的计算方法——均摊法【重难点指数】★★★【重难点考向一】常见晶胞类型和结构特点【典型例题1】(1)【2015·高考全国卷Ⅰ,37(5)】碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:石墨烯晶体金刚石晶体①在石墨烯晶体中,每个C原子连接________个六元环,每个六元环占有________个C原子。
晶胞结构

(与CO2分子距离最近的CO2分子共有12个)
四、离子晶体
练习:
1、最近科学家发现一种由钛原子和碳原子构成的气态分子,如右图所示。顶角和面心的原于是钛原子,棱的中心和体心的原子是碳原子,则它的分子式是( )
A.TiCB.Ti4C4C.Ti14C13D.Ti13C14
晶体中每个C原子和4个C原子形成4个共价键,成为正四面体结构,C原子与碳碳键个数比为1:2,最小环由6个C原子组成,每个C原子被12个最小环所共用;平均每个最小环含有1/2个C原子。每个C原子被4个碳碳键所共用;每个碳碳键含有2个C原子,平均每个碳碳键含有1/2个C原子。故平均每个最小环含有1个碳碳键
2.SiO2
晶体中的最小环为十二元环,其中有6个Si原子和6个O原子,含有12个Si-O键;每个Si原子被12个十二元环共有,每个O原子被6个十二元环共有,每个Si-O键被6个十二元环共有
三、分子晶体
(1)只有范德华力,无分子间氢键-分子密堆积(每个分子周围有12个紧邻的分子,如:C60、干冰、I2、O2)----晶胞结构都属于面心立方
(2)若A的核外电子排布与Ar相同,B的电子排布与Ne相同,则该离
子化合物的化学式是___________________;
(3)阳离子周围距离最近的阴离子数为_____,阴离子周围距离最近的阳离子数_____。
(4)已知A的离子半径为r m,则该晶胞的体积是___________m3。
晶胞结构
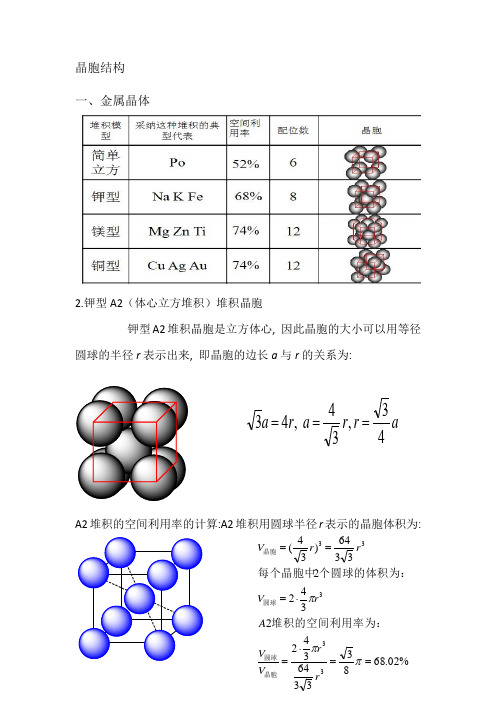
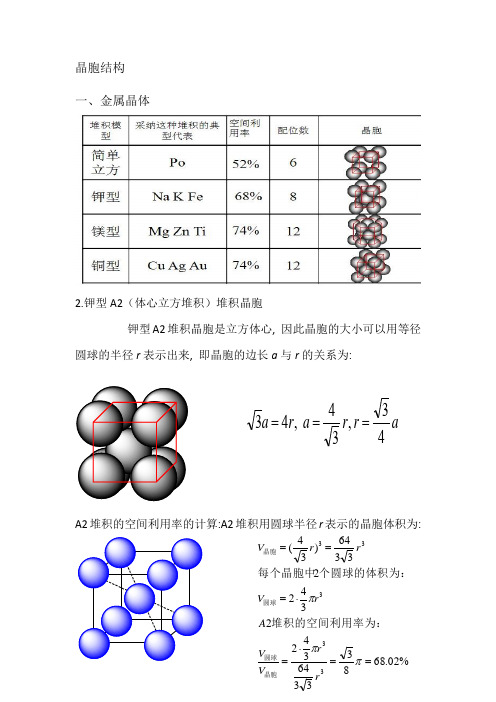
一、金属晶体
2.钾型A2(体心立方堆积)堆积晶胞
钾型A2堆积晶胞是立方体心,因此晶胞的大小可以用等径圆球的半径r表示出来,即晶胞的边长a与r的关系为:
13几种常见的晶体结构

但有些元素晶体和所有化合物晶体,其最小重复单 位(基元)至少包含 2个或 2 个以上的原子,它们的每 一个原子虽然都构成同样的点阵类型(即同样的周期排 列方式),但绘成晶胞时,要绘出基元原子之间位置上 的相互关系,所以是同样的点阵类型的叠加,我们称这 些晶体具有复式晶格。
例如:CsCl晶体是两个原子各自构成简立方点阵后,沿 晶胞对角线方向移动二分之一距离的叠加。
由上述方法定义的晶向和晶面指数有重要意义: 1. 晶轴方向是最重要的方向,晶向指数最简单; 2. 晶面指数最简单的晶面族,晶面间距最大。
三. 晶面间距:晶面间距是指两个相邻的平行晶面间 的垂直距离。以米勒指数表示的晶面间距在晶体结 构的测定中是一个很常用的参数,必须掌握。
可以证明:(见习题)
立方晶系: 四方晶系: 六角晶系:
下图标出了简立方点阵的几组最重要的晶面系的晶面 指数和晶向指数。从中可以明显看出晶面指数最简单 的晶面族面间距最大,它们也是以后经常讨论到的最 重要的晶面。
六角晶系晶面 指数的表示与其它 晶系不同,晶体学 中往往采用四轴定 向的方法,这样的 晶面指数可以明显 地显示出 6 次对称 的特点。
晶面指数小结
的面间距较大,而往往成为晶体的解理面。
(2)用于计算不同晶面族之间的夹角。一般而言,密
勒指数分别为(h1k1l1) 和(h2k2l2)的晶面族的2个平面之间 的夹角的余弦为:
cos
(h12
h1h2 k 1k 2 l l1 2
k12
l12
)
1 2
(h22
k22
l22
)
1 2
在X射线衍射和结晶学中,密勒指数不一定为互质整数, 例如,面心立方中一些平行于(100)的晶面而截a轴 于1/2处的面,其指数为(200),其原因是晶胞并非 是晶体中的最小重复单元。
常见的晶体结构及其原胞晶胞

§1-2 常见的晶体结构及其原胞、晶胞1) 简单晶体的简单立方(simple cubic, sc) 它所构成的晶格为布喇菲格子。
例如氧、硫固体。
基元为单一原子结构的晶体叫简单晶体。
其特点有: 三个基矢互相垂直(),重复间距相等,为a,亦称晶格常数。
其晶胞=原胞;体积= ;配位数(第一近邻数) =6。
(见图1-7)图1-7简单立方堆积与简单立方结构单元2) 简单晶体的体心立方( body-centered cubic, bcc ) , 例如,Li,K,Na,Rb,Cs,αFe,Cr,Mo,W,Ta,Ba等。
其特点有:晶胞基矢, 并且,其惯用原胞基矢由从一顶点指向另外三个体心点的矢量构成:(见图1-9 b)(1-2)其体积为;配位数=8;(见图1-8)图1-8体心立方堆积与体心立方结构单元图1-9简单立方晶胞(a)与体心立方晶胞、惯用原胞(b)3) 简单晶体的面心立方( face-centered cubic, fcc ) , 例如,Cu,Ag,Au,Ni,Pd,Pt,Ne, Ar, Xe, Rn, Ca, Sr, Al等。
晶胞基矢,并且每面中心有一格点, 其原胞基矢由从一顶点指向另外三个面心点的矢量构成(见图1-10 b):(1-3)其体积=;配位数=12。
,(见图1-10)图1-10面心立方结构(晶胞)(a)与面心立方惯用原胞(b)4) NaCl结构(Sodium Chloride structure),复式面心立方(互为fcc),配位数=6(图1-11 a)。
表1-1 NaCl结构晶体的常数5) CsCl结构(Cesuim Chloride structure),复式简单立方(互为sc),配位数=8(图1-11 b)。
表1-2 CsCl结构晶体的常数图1-11 NaCl结构和CsCl结构6) 金刚石结构(Diamond structure), 两套fcc格子相互沿对角线位移1/4处套合。
晶胞结构
晶胞结构一、金属晶体2.钾型A2(体心立方堆积)堆积晶胞钾型A2堆积晶胞是立方体心, 因此晶胞的大小可以用等径圆球的半径r 表示出来, 即晶胞的边长a 与r 的关系为:A2堆积的空间利用率的计算:A2堆积用圆球半径r 表示的晶胞体积为:ar r a r a 43,34 ,43===%02.68833364342234223364)34(33333==⋅=⋅===πππr r V V A rV rr V 晶胞圆球圆球晶胞堆积的空间利用率为:个圆球的体积为:每个晶胞中3.六方最密堆积(4)A1(面心立方最密堆积)A1是ABCABCABC······型式的堆积,从这种堆积中可以抽出一个立方面心点阵,因此这种堆积型式的最小单位是一个立方面心晶胞。
A1堆积晶胞是立方面心, 因此晶胞的大小可以用等径圆球的半径r 表示出来, 即晶胞的边长a 与r 的关系为:A1堆积空间利用率的计算:A1堆积用圆球半径r 表示的晶胞体积为:(5)A4堆积形成晶胞A4堆积晶胞是立方面心点阵结构, 因此晶胞的大小可以用等径圆球的半径r 表示出来, 即晶胞的边长a 与r 的关系为:A4堆积的空间利用率的计算:A4堆积用圆球半径r 表示的晶胞体积为: ra r a 22 ,42==%05.742312163441344 4216)22(33333==⋅=⋅===πππr r V V A r V r r V 晶胞圆球圆球晶胞堆积的空间利用率为:个圆球的体积为:每个晶胞中ar r a r r a 83,38 ,8243===⨯=%01.34163335123484348 833512)38(33333==⋅=⋅===πππr r V V A r V r r V 晶胞圆球圆球晶胞堆积的空间利用率为:个圆球的体积为:每个晶胞中二、原子晶体1.金刚石立体网状结构,每个碳原子形成4个共价键,任意抽出2个共价键,每两个单键归两个六元环所有,而不是只归一个六元环所有(如图所示,红色的两个碳碳单键,可以构成蓝色和紫红色的两个六元环)。
常见九种典型的晶体结构
如果金刚石晶胞沿一个L3立起来,金刚石似乎显示出层状结 构特征,虽然不是很特征,但金刚石的确平行{111}存在中等 解理。
由于C-C键的键能大(347 kJ/mo),价电子都参与了共价键 的形成,使得晶体中没有自由电子,所以金刚石是自然界中最 坚硬的固体,熔点高达3550 ‴。
金刚石及其等结构物质比较
5.5-6A
层电荷的来源
(1) 来源于四面体片的 Al->Si替代。这时,与配 平电荷的层间阳离子距离 较近,称之为“近电”。
记为
Xt
(2) 来源于八面体片的 Mg->Al替代。这时,于配 平电荷的层间阳离子距离 较远,称之为“远电”。
属于该结构的物质主要有:T、V、W、La、Ce、 Pr、Nd、Yb、Eu、Ti、U、Ba、Sr、K、Na、Ca、 Mg等单质。
值得指出的是,部分元素的单质可以在不同条件下 形成不同的结构,或者可以有不同的结构状态共存。 如单质铁:
α-铁(Iron-alpha) ---(奥氏体) --立方体心 γ-铁(Iron-gama) --(马氏体)--立方面心 ε-铁(Iron- Epsilon) --六方结构
(200)
(220)
6 闪锌矿结构
空间群 F-43m,立方面心格子。 Zn分布于晶胞的角顶及面心。如果把晶胞8等分,S分 布于间隔的小立方体的中心。
闪锌矿的晶体结构:球键图(左)、配位多面体连接图(右)
结构中,S2- 和Zn2+配位数都是4,配位多面体都 是四面体。四面体共角顶相联。
从图可看出,[SZn4] 四面体([ZnS4] 四面体 也是一样)共角顶联成的 四面体基元层与[111]方 向垂直。
氯化锶(SrCl2)
反萤石型 氧化钠(Na O) 2 结构 氧化锂(Li2O)
1-2+常见的晶体结构及其原胞、晶胞

§1-2 常见的晶体结构及其原胞、晶胞1) 简单晶体的简单立方(simple cubic, sc) 它所构成的晶格为布喇菲格子。
例如氧、硫固体。
基元为单一原子结构的晶体叫简单晶体。
其特点有: 三个基矢互相垂直(),重复间距相等,为a,亦称晶格常数。
其晶胞=原胞;体积=;配位数(第一近邻数) =6。
(见图1-7)图1-7简单立方堆积与简单立方结构单元2) 简单晶体的体心立方 ( body-centered cubic, bcc ) , 例如,Li,K,Na,Rb,Cs,αFe,Cr,Mo,W,Ta,Ba等。
其特点有:晶胞基矢, 并且,其惯用原胞基矢由从一顶点指向另外三个体心点的矢量构成:(见图1-9 b)(1-2)其体积为;配位数=8;(见图1-8)图1-8体心立方堆积与体心立方结构单元图1-9简单立方晶胞(a)与体心立方晶胞、惯用原胞(b)3) 简单晶体的面心立方 ( face-centered cubic, fcc ) , 例如,Cu,Ag,Au,Ni,Pd,Pt,Ne, Ar, Xe, Rn, Ca, Sr, Al等。
晶胞基矢,并且每面中心有一格点, 其原胞基矢由从一顶点指向另外三个面心点的矢量构成(见图1-10 b):(1-3)其体积=;配位数=12。
,(见图1-10)图1-10面心立方结构(晶胞)(a)与面心立方惯用原胞(b)4) NaCl结构(Sodium Chloride structure),复式面心立方(互为fcc),配位数=6(图1-11 a)。
表1-1 NaCl结构晶体的常数5) CsCl结构(Cesuim Chloride structure),复式简单立方(互为sc),配位数=8(图1-11 b)。
表1-2 CsCl结构晶体的常数图1-11 NaCl结构和CsCl结构6) 金刚石结构(Diamond structure), 两套fcc格子相互沿对角线位移1/4处套合。
常见晶胞结构特点

常见晶胞结构特点1、分子晶体:干冰:(1)粒子分布,一个干冰晶胞中个CO2分子(2)配位数:(一个CO2分子紧邻个CO2分子)冰:(1)一个H2O分子紧邻个H2O分子,构成结构(2)在晶体中,1molH2O 含mol氢键。
密度:干冰冰2、离子晶体NaCl晶体:(1)粒子分布:每个晶胞含Na+个、Cl—个。
(2) Na+配位数:,几个Cl—在空间构成结构(3) Na+周围等距最近的Na+有个。
Cl—周围等距最近的Cl—有个。
CsCl晶体:(1)粒子分布:每个晶胞含Cs+个、Cl—个(2) Cs+的配位数Cl—的配位数.(3) Cs+周围等距最近的Cs+有个。
Cl—周围等距最近的Cl—有个。
CaF2晶体:(1) 粒子分布:Ca2+,F—,每个晶胞含Ca2+个、F—个(2) Ca2+的配位数F—的配位数.(3) Ca2+周围等距最近的Ca2+有个。
F—周围等距最近的F—有个。
(4) 距离最近的Ca2+,F—之间的距离为 a (a为晶胞边长)3、原子晶体:金刚石:(1)粒子分布:每个晶胞含个C原子(2)配位数:(一个C原子紧邻个C原子,构成结构)(3) 1mol金刚石拥有molC—C键。
(4) 最小的环为元环,每个C被最小环共用,每个最小环平均拥有个C(5)最近两C原子之间的距离为2r = a(a为晶胞边长,r为C原子半径)SiO2晶体:(1)1molSiO2晶体拥有mol Si—O键,(2)最小的环为元环,(3)一个Si原子周围个O原子构成结构,一个O原子周围个Si原子。
5、混合型晶体(过渡型晶体)石墨晶体:(1)C的杂化方式为(2)含有的作用力有。
(3)最小碳环为元环,每个C原子被个环共用,每个环平均拥有个C原子。
(4) 1mol石墨晶体拥有mol C—C键,C原子与C—C键的个数比。
晶胞结构
晶胞结构一、金属晶体2.钾型A2(体心立方堆积)堆积晶胞钾型A2堆积晶胞是立方体心, 因此晶胞的大小可以用等径圆球的半径r 表示出来, 即晶胞的边长a 与r 的关系为:A2堆积的空间利用率的计算:A2堆积用圆球半径r 表示的晶胞体积为:ar r a r a 43,34 ,43===%02.68833364342234223364)34(33333==⋅=⋅===πππr r V V A rV rr V 晶胞圆球圆球晶胞堆积的空间利用率为:个圆球的体积为:每个晶胞中3.六方最密堆积(4)A1(面心立方最密堆积)A1是ABCABCABC······型式的堆积,从这种堆积中可以抽出一个立方面心点阵,因此这种堆积型式的最小单位是一个立方面心晶胞。
A1堆积晶胞是立方面心, 因此晶胞的大小可以用等径圆球的半径r 表示出来, 即晶胞的边长a 与r 的关系为:A1堆积空间利用率的计算:A1堆积用圆球半径r 表示的晶胞体积为:(5)A4堆积形成晶胞A4堆积晶胞是立方面心点阵结构, 因此晶胞的大小可以用等径圆球的半径r 表示出来, 即晶胞的边长a 与r 的关系为:A4堆积的空间利用率的计算:A4堆积用圆球半径r 表示的晶胞体积为: ra r a 22 ,42==%05.742312163441344 4216)22(33333==⋅=⋅===πππr r V V A r V r r V 晶胞圆球圆球晶胞堆积的空间利用率为:个圆球的体积为:每个晶胞中ar r a r r a 83,38 ,8243===⨯=%01.34163335123484348 833512)38(33333==⋅=⋅===πππr r V V A r V r r V 晶胞圆球圆球晶胞堆积的空间利用率为:个圆球的体积为:每个晶胞中二、原子晶体1.金刚石立体网状结构,每个碳原子形成4个共价键,任意抽出2个共价键,每两个单键归两个六元环所有,而不是只归一个六元环所有(如图所示,红色的两个碳碳单键,可以构成蓝色和紫红色的两个六元环)。
常见晶胞结构最强整理

常见晶胞结构最强整理常见晶体结构及其详解晶体晶体结构晶体详解原⼦晶体⾦刚⽯(1)每个碳采取杂化⽅式与4个碳以共价键结合,形成结构,键⾓均为 (2)最⼩碳环由个C 组成且六原⼦不在同⼀平⾯内,平均每个碳原⼦被个六元环共⽤,每根C -C 键被个六元环共⽤。
(3)每个C 参与4条C -C 键的形成, C 原⼦个数与C -C 键数之⽐为 ,1mol ⾦刚⽯中,碳碳键为 molSiO 2(1)每⼀个硅原⼦紧邻个氧原⼦,每⼀个氧原⼦紧邻个硅原⼦,形成了由Si-O 键(极性或⾮极性)键构成的元环的最⼩环状结构。
⼀个环上有个硅原⼦,个氧原⼦(2)1mol SiO 2中,硅氧键为 molSiC每个C 原⼦最近的Si 原⼦有个,每个C 原⼦最近的C 原⼦有个分⼦晶体⼲冰(1)⼀个⼆氧化碳晶胞中含有个⼆氧化碳分⼦(2)8个CO 2分⼦构成⽴⽅体且在6个⾯⼼⼜各占据1个CO 2分⼦ (3)每个CO 2分⼦周围等距且紧邻的CO 2分⼦有个冰⼀个⽔分⼦形成个氢键,平均1mol 冰中含有 mol 氢键C 60(1)⾜球烯的分⼦是由60个碳原⼦构成的,空间构型有12个正五边形,20个正六边形(2)⼀个C 60分⼦中含有根单键,根双键 (3)C 60晶胞中与⼀个C 60最近的C 60分⼦有个(与⼲冰的晶胞相似)离⼦晶体NaCl (型)(1)每个Na +周围等距且紧邻的Cl -有个,每个Cl -周围等距且紧邻的Na +有个。
每个Na +周围等距且紧邻的Na +有个,同理Cl -也然。
(2)每个晶胞中含个Na +和4个Cl -。
CsCl (型)(1)每个Cs +周围等距且紧邻的Cl -有个,每个Cl -周围等距且紧邻的Cs +有个。
(2)左图为个晶胞;右图为⼀个晶胞,每个晶胞中含个Cs +,个Cl -。
CaF 21、1个晶胞中含有个Ca 2+,个F -,Ca 2+的配位数为个,F -配位数为个2、Ca 2+周围等距离最近的Ca 2+ 个,F —周围等距离最近的F — 个⾦属晶体简单⽴⽅堆积典型代表空间利⽤率配位数为体⼼⽴⽅堆积典型代表空间利⽤率配位数为⾯⼼⽴⽅堆积典型代表空间利⽤率配位数为六⽅最密堆积典型代表空间利⽤率配位数为混合晶体⽯墨1、碳原⼦的杂化⽅式为,键⾓为2、⽯墨晶体的⽚层结构中,每个六元碳环含有个碳原⼦数,每个六元碳环所含有的共价健数是个3、⽯墨同层C 原⼦间以连接,熔化需要破坏碳碳之间作⽤⼒,故熔沸点较⾼;层与层之间的作⽤⼒为,作⽤⼒⽐较弱,故⽯墨的硬度较低。
常见九种典型的晶体结构
反萤石型结构
球键图
阳离子四面体配位 阴离子立方体配位
反萤石型结构可看作:阴离子做立方最紧密堆积,阳离 子充填在全部的四面体空隙中。
结构类型 物质名称 萤石(CaF2)
萤石型结 氯化锶(SrCl2)
构
氯化钡(BaCl2)
氟化铅(PbF2)
氧化钾(K2O)
反萤石型 结构
氧化钠(Na2O)
氧化锂(Li2O)
闪锌矿的晶体结构:球键图(左)、配位多面体连接图(右)
结构中,S2- 和Zn2+配位数都是4,配位多面体都 是四面体。四面体共角顶相联。
从图可看出,[SZn4] 四面体([ZnS4] 四面体 也是一样)共角顶联成的 四面体基元层与[111]方 向垂直。
由于S2-和Zn2+都呈配位四面体,所以闪锌矿只用一种配位 多面体结构形式表达(S和Zn互换是一样的)。
(Fe3+(Fe2+Fe3+)2O4)。
当结构中四、八面体孔隙被A2+和B3+无序占据时, 叫混合尖晶石结构,代表晶相是镁铁矿(Fe, Mg)3O4。
具有尖晶石型结构的部分物质
Fe3O4 VMn2O4 NiAl2O4 NiGa2O4 Co3S4 TiZn2O4 γ-Fe2O3 LiTi2O4 CoAl2O4 MgGa2O4 NiCo2S4 VZn2O4 MnFe2O4 MnTi2O4 ZnAl2O4 MnGa2O4 Fe2SiO4 SnMg2O4 MgFe2O4 ZnCr2O4 Co3O4 ZnIn2S4 Ni2SiO4 TiMg2O4 Ti Fe2O4 CoCr2O4 GeCo2O4 MgIn2O4 Co2SiO4 WNa2O4 LiMn2O4 CuMn2O4 VCo2O4 CuV2S4 Mg2SiO4 CdIn2O4
晶体晶胞图

CsCl的晶体结构及晶胞构示意图
---Cs+
---Cl-
Cs+的配位数为:8 Cl-的配位数为:8
• 找出NaCl、CsCl两种离子晶体中阳离子和 阴离子的配位数,它们是否相等?
离子 阴离子的 阳离子的 阴阳离子配 晶体 配位数 配位数 位数的比值
N体结构图中分割出来的部分 结构图,试判断NaCl晶体结构的图象是 B、 C
①②③
④
A、① B、② C、③ D、④
A、① B、② C、③ D、④
CsCl型晶体属简单立方点阵,Cl-作简单立方堆积,Cs+填在立方体空隙中,正负离子配位数均为8,
下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断NaCl晶体结构的图象是
• 3.ZnS型
• ZnS晶体结构有两种型式,即立方ZnS和 六方ZnS
• 4.CaF2型 • CaF2晶体属立方
面心点阵,F-作 简单立方堆积, Ca2+数目比F- 少一半,所以填
了一半的立方体
空隙,每一个 Ca2+由八个F- 配位,而每个F- 有4个Ca2+配位
NaCl晶体中阴、阳离子的配位数
ZnS晶体结构有两种型式,即立方ZnS和六方ZnS CsCl型晶体属简单立方点阵,Cl-作简单立方堆积,Cs+填在立方体空隙中,正负离子配位数均为8, 下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断NaCl晶体结构的图象是 CaF2晶体属立方面心点阵,F-作简单立方堆积,Ca2+数目比F-少一半,所以填了一半的立方体空隙,每一个Ca2+由八个F-配 位,而每个F-有4个Ca2+配位 CsCl型晶体属简单立方点阵,Cl-作简单立方堆积,Cs+填在立方体空隙中,正负离子配位数均为8, ZnS晶体结构有两种型式,即立方ZnS和六方ZnS ZnS晶体结构有两种型式,即立方ZnS和六方ZnS 找出NaCl、CsCl两种离子晶体中阳离子和阴离子的配位数,它们是否相等? A、① B、② C、③ D、④ CsCl型晶体属简单立方点阵,Cl-作简单立方堆积,Cs+填在立方体空隙中,正负离子配位数均为8, CaF2晶体属立方面心点阵,F-作简单立方堆积,Ca2+数目比F-少一半,所以填了一半的立方体空隙,每一个Ca2+由八个F-配 位,而每个F-有4个Ca2+配位 ZnS晶体结构有两种型式,即立方ZnS和六方ZnS 下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断NaCl晶体结构的图象是 CaF2晶体属立方面心点阵,F-作简单立方堆积,Ca2+数目比F-少一半,所以填了一半的立方体空隙,每一个Ca2+由八个F-配 位,而每个F-有4个Ca2+配位 NaCl晶体中阴、阳离子的配位数 下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断NaCl晶体结构的图象是 CsCl型晶体属简单立方点阵,Cl-作简单立方堆积,Cs+填在立方体空隙中,正负离子配位数均为8, 下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断NaCl晶体结构的图象是 CsCl型晶体属简单立方点阵,Cl-作简单立方堆积,Cs+填在立方体空隙中,正负离子配位数均为8,
常见的晶体结构

晶胞分子数:Z=2;
晶胞中:2个八面体空隙 4个四面体空隙;
(2)质点坐标:
111 Ti : 000, 222
4
1 1 1 1 1 1 O : uuo, 1 u 1 u 0, u u , u u 2 2 2 2 2 2
1、金刚石结构
——立方晶系
(1)金刚石是面心立方格子
(2)碳原子位于立方体的8个
顶点,6个面心及立方体内4个
小立方体的中心。 (3)单位晶胞原子数:n=8
(4)晶胞内各原子的空间坐标: 000, ½ ½ 0, ½ 0 ½ , 0 ½ ½ , ¼ ¼ ¾ , ¼ ¾ ¼, ¾ ¼ ¼ , ¾ ¾ ¾
体结构中,每一个负离子电荷数等于或近似等于相邻正离 子分配给这个负离子的静电键强度的总和,其偏差1/4 价”。
静电键强度
S=
正离子电荷数 Z , 正离子配位数 n
Z Z Si i ni i i
则负离子电荷数
。
电价规则有两个用途: 其一,判断晶体是否稳定;
其二,判断共用一个顶点的多面体的数目。
离子半径、电中性、阴离子多面体之间的连接
1、NaCl型结构
(1)密堆积情况: Cl- 离子面心立方堆积; Na+离子填充八面体空隙;
——立方晶系
晶胞分子数:Z=4;
晶胞中:4个八面体空隙
8个四面体空隙;
Na+离子填充全部八面体空隙
(2)质点坐标:
11 1 1 11 Cl : 000 , 0, 0 ,0 22 2 2 22
连接(2个配位多面体共用一个顶点),或者和另外3个[MgO6]八面体
常见晶胞类型

思考:金属原子在形成晶体时有几种堆积方式? 比较不同方式堆积时金属晶体的配位数、原子的 空间利用率、晶胞的区别。
.
金属晶体的原子空间堆积模型1
• 简单立方堆积(Po)
晶胞的形状是什么? 含几个原子?
.
1、简单立方堆积 钋型
.
金属晶体的原子空间堆积模型2
• 体心立方堆积( IA,VB,VIB)
常见晶胞类型
.
1、一个干冰晶胞中平均有几个CO2分子? 2、与一个CO2分子距离最近且相等的CO2分子共有 多少个?
.
分子的密堆积
每个二氧化碳分子周围. 有12个二氧化碳分子。
分子的密堆积
氧(O2)的晶体结构
碳60的晶胞
(与每个分子距离最近的相同分子共有12个 )
.
冰晶体
.
分子的非密堆积
冰中1个水分子周围有4个水分子
.
资
金属之最
料
熔点最低的金属是-------- 汞
熔点最高的金属是-------- 钨
密度最小的金属是-------- 锂
密度最大的金属是-------- 锇
硬度最小的金属是-------- 铯
硬度最大的金属是-------- 铬
延性最好的金属是-------- 铂
展性最好的金属是-------- 金
单质硼有无定形和晶体两种,参考下列数据回答:
金刚石
晶体硅
晶体硼
熔点(K) 沸点(K) 硬度(moh)
>3823 5100 10
1683 2628 7.0
2573 2823 9.5
(1)晶体硼的晶体类型属于_________晶体。
(2)已知晶体硼的基本结构单元是由B原子 构成的正二十面体,其中有20个等边三角 形的面和一定数目的顶点,每个顶点各有 一个B原子。通过观察图形及推算,可知此 结构单元是由___________个B原子构成, 其中B—B键间的夹角是_______________。
典型的晶体结构

典型的晶体结构1. 铁铁原⼦可形成两种体⼼⽴⽅晶胞晶体:910 C以下为a—Fe,⾼于1400 C时为S—Fe。
在这两种温度之间可形成丫-⾯⼼⽴⽅晶。
这三种晶体相中,只有丫- Fe能溶解少许C。
问:1 ?体⼼⽴⽅晶胞中的⾯的中⼼上的空隙是什么对称?如果外来粒⼦占⽤这个空隙,则外来粒⼦与宿主离⼦最⼤可能的半径⽐是多少?2?在体⼼⽴⽅晶胞中,如果某空隙的坐标为(0, a/2, a/4),它的对称性如何?占据该空隙的外来粒⼦与宿主离⼦的最⼤半径⽐为多少?3. 假设在转化温度之下,这a—Fe和丫⼀F两种晶型的最相邻原⼦的距离是相等的,求丫铁与a铁在转化温度下的密度⽐。
4?为什么只有丫― Fe才能溶解少许的C ?在体⼼⽴⽅晶胞中,处于中⼼的原⼦与处于⾓上的原⼦是相接触的,⾓上的原⼦相互之间不接触。
1 ?两个⽴⽅晶胞中⼼相距为a,也等于2r + 2r h [如图①],这⾥r h是空隙“ X ”的半径,a= 2r +2r h = (4/ , 3 )rr h/r = 0.115 (2 分)⾯对⾓线(...2 a )⽐体⼼之间的距离要长,因此该空隙形状是⼀个缩短的⼋⾯体,称扭曲⼋⾯体。
(1分)2?已知体⼼上的两个原⼦(A和B)以及连接两个晶体底⾯的两个⾓上原⼦[图②中C和D]。
连接顶部原⼦的线的中⼼到连接底部原⼦的线的中⼼的距离为a/2;在顶部原⼦下⾯的底部原⼦构成晶胞的⼀半。
空隙“ h”位于连线的⼀半处,这也是由对称性所要求的。
所以我们要考虑的直⾓三⾓形⼀个边长为a/2,另⼀边长为a/4 [图③],所以斜边为... 5/16a°(1分)r+ r h= J5/16 a= 5/3 rr h/r = 0.291 (2 分)f—1-3?密度⽐=4、2 : 3?-3 = 1.09(2分)4. C原⼦体积较⼤,不能填充在体⼼⽴⽅的任何空隙中,但可能填充在⾯⼼⽴⽅结构的⼋⾯体空隙中(r h/r= 0.414 )。
(2 分)2. 四氧化三铁科学研究表明,Fe3O4是由Fe2+、Fe3+、O2—通过离⼦键⽽组成的复杂离⼦晶体。
固体物理第2课常见晶格结构-

6a y
(326)
晶面间距的计算
低指数的晶面晶面间距较大,高指数的则较小。晶 面间距越大,该面上原子排列愈密集,否则越疏。
注意点:
本节的晶向、晶面及其指数主要针对布喇 菲格子而言。
如以原胞基矢为坐标轴建立坐标系,则晶 向指数和晶面指数的通式一般为[l1 l2 l3]、 (h1 h2 h3)。
cos a b
ab
氯化钠型结构
氯化钠型结构
复式面心立方结构:KCl、LiH、PbS
返回
氯化铯型结构
氯化铯型结构
晶胞和原胞
复式简立方结构:TlBr溴化铊、TlI(碘化钛)、 CuPd(钯铜)、AgMg、AlNi
返回
金钢石结构 1Biblioteka 金刚石 3返回金钢石结构 2
返回
金刚石和闪锌矿结构(1)
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa
U
Np
Pu Am
C m
Bk
Cf
Es Fm Md No
Lr
金刚石结构
闪锌矿结构
闪锌矿结构又称为立方硫化锌
金刚石和闪锌矿结构(2)
复式面心立方结构:两个面心立方的布喇菲晶格沿对 角线平移1/4长度套构而成,但原子价键取向不同。 Si、Ge、GaAs、InP、InSb(用途?)
InSb 探测器阵列 320×240制冷 目前11所和211所已做 出来。
金刚石和闪锌矿结构(2)
晶体管的发明
1947年12月23日 第一个点接触式 NPN Ge晶体管
发明者: W. Schokley J. Bardeen W. Brattain
获得1956年 Nobel物理奖
晶体晶胞结构

晶体晶胞结构(总10页) -CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除物质结构要点1、核外电子排布式外围核外电子排布式价电子排布式价电子定义:1、对于主族元素,最外层电子2、第四周期,包括3d与4S 电子电子排布图熟练记忆 Sc Fe Cr Cu2、S能级只有一个原子轨道向空间伸展方向只有1种球形P能级有三个原子轨道向空间伸展方向有3种纺锤形d能级有五个原子轨道向空间伸展方向有5种一个电子在空间就有一种运动状态例1:N 电子云在空间的伸展方向有4种N原子有5个原子轨道电子在空间的运动状态有7种未成对电子有3个 ------------------------结合核外电子排布式分析例23、区的划分按构造原理最后填入电子的能级符号如Cu最后填入3d与4s 故为ds区 Ti 最后填入能级为3d 故为d区4、第一电离能:同周期从左到右电离能逐渐增大趋势(反常情况:S2与P3 半满或全满较稳定,比后面一个元素电离能较大)例3、比较C、N、O、F第一电离能的大小 --------------- F >N>O>C例4、某元素的全部电离能(电子伏特)如下:回答下列各问:(1)I6到I7间,为什么有一个很大的差值这能说明什么问题 _________________________(2)I4和I5间,电离能为什么有一个较大的差值_________________________________(3)此元素原子的电子层有 __________________层。
最外层电子构型为 ______________5、电负性:同周期从左到右电负性逐渐增大(无反常)------------F> O >N >C6、对角线规则:某些主族元素与右下方的主族元素的性质有些相似,被称为“对角线规则”如:锂和镁在空气中燃烧的产物,铍和铝的氢氧化物的酸碱性以及硼和硅的含氧酸酸性的强弱7、共价键:按原子轨道重叠形式分为:σ键和π键 (具有方向性和饱和性)单键 -------- 1个σ键双键------1个σ键和1个π键三键---------1个σ键和2个π键8、等电子体:原子总数相等,价电子总数相等----------具有相似的化学键特征例5、N2 CO CN-- C22-互为等电子体CO2 CS2 N2O SCN-- CNO-- N3- 互为等电子体从元素上下左右去找等电子体,左右找时及时加减电荷,保证价电子相等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
典型晶体晶胞结构1.原子晶体
(金刚石 )
2.分子晶体
3.离子晶体
+
Na
-
Cl
4.金属晶体
堆积模型简单立方钾型镁型铜型典型代表Po Na K Fe Mg Zn Ti Cu Ag Au 配位数 6 8 12 12
晶胞
5.混合型晶体——石墨
1.元素是Cu 的一种氯化物晶体的晶胞结构如图 13 所示,该氯化物的化学
式,它可与浓盐酸发生非氧化还原反应,生成配合物H n WCl 3,反应的化
学方程式为。
2.( 2011 山东高考)CaO 与NaCl 的晶胞同为面心立方结构,已知CaO 晶体密度为ag·cm-3,N A表示阿伏加德罗常数,则CaO 晶胞体积为cm3。
2.( 2011 新课标全国)六方氮化硼BN 在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚
石相当,晶苞边长为361.5pm ,立方氮化硼晶胞中含有______各氮原子、 ________各硼原子,立方氮化硼的密度是_______g ·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为N A)。
解析:描述晶体结构的基本单元叫做晶胞,金刚石晶胞是立方体,其中8 个顶点有8 个碳原子, 6 个面各有 6 个碳
原子,立方体内部还有 4 个碳原子,如图所示。
所以金刚石的一个晶胞中含有的碳原子数=
8×1/8+6 ×1/2+4=8 ,因此立方氮化硼晶胞中应该含有 4 个 N 和 4 个 B 原子。
由于立方氮化硼的一个晶胞中含有 4 个
4 25g 是,立方体的体积是(361.5cm)3,因此立方氮化硼的密度是
N 和 4 个 B 原子,其质量是
1023
6.02
g·cm-3。
3.( 4)元素金( Au )处于周期表中的第六周期,与Cu 同族, Au 原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu 原子处于面心, Au 原子处于顶点位置,则该合金中Cu 原子与 Au 原子数量之比为 _______;该晶体中,原子之间的作用力是________;
( 5)上述晶体具有储氢功能,氢原子可进入到由Cu 原子与 Au 原子构成的四面体空隙中。
若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为_____。
4.( 2010 山东卷)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心, O2-处于晶胞棱边中心,该化合物化学式为,每个 Ba2+与个 O2-配位。
5.(4) CaC2晶体的晶胞结构与NaCl晶体的相似(如右图所示),但 CaC2晶体中含有的中哑
铃形 C 22 的存在,使晶胞沿一个方向拉长。
CaC 2晶体中1个 Ca 2 周围距离最近的 C 22 数目
为。
6.( 09 江苏卷 21 A )③在 1 个 Cu2O 晶胞中(结构如图所示),所包含的Cu 原子数目
为。
