高考化学一轮复习 7.2 化学平衡状态 化学平衡常数课件
高考化学一轮复习 第1课时 化学平衡状态 化学平衡常数课件

(1)化学平衡研究的对象:封闭体系的可逆反应。只有可逆反应才有可能存在化学 平衡状态。 (2)“v(正)=v(逆)”,是化学平衡状态微观本质的条件,其含义可简单地理解为:对 反应物或生成物中同一物质而言,其生成速率等于消耗速率。“反应混合物中各 组分的浓度不变”是平衡状态的宏观表现,是v(正)=v(逆)的必然结果。 (3)平衡状态直接规定了在一定条件下可逆反应进行的程度大小,也是可逆反应进 行到最大限度的结果。 (4)从化学平衡的特征判断可逆反应是否达到化学平衡时,要特别注意外界条件 的限制及反应本身的特点,如“恒温、恒容”、“体积可变”、“体积不变”、 “全是气体参加”等。
(2)若将2 molN2和4 molH2放入起始体积相同的恒容容器中,在与(1)相同的温 度下达到平衡,试比较平衡时NH3的浓度:(1)________(2)(填“>”、“<”或 “=”)。
解析:①由反应:N2(g)+3H2(g) 起始物质的量
2NH3(g)
(mol)
2
4
0
转化物质的量
(mol)
x
正反应进行的程度 越高 。
3.平衡常数的应用和注意事项 (1)在不同条件下进行的同一可逆反应,K值越大,反应物的转化率 越大 , 正反应进行的程度 越高 。
(2)平衡常数只与 温度 有关,与其他因素无关。 (3)固体 和纯液体 的浓度通常看作常数“1”,不计入平衡常数表达式中。
思考:
反应:①3H2+N2
1.应用 (1)判断、比较可逆反应进行程度的大小。 K值越大,反应进行的程度越大; K值越小,反应进行的程度越小。 (2)判断可逆反应是否达到化学平衡状态 对于可逆反应aA(g)+bB(g) cC(g)+dD(g), 在一定温度下的任意时刻, 反应物与生成物浓度有如下关系: 浓度商Q=
高考化学一轮复习化学平衡常数与平衡图像复习讲义
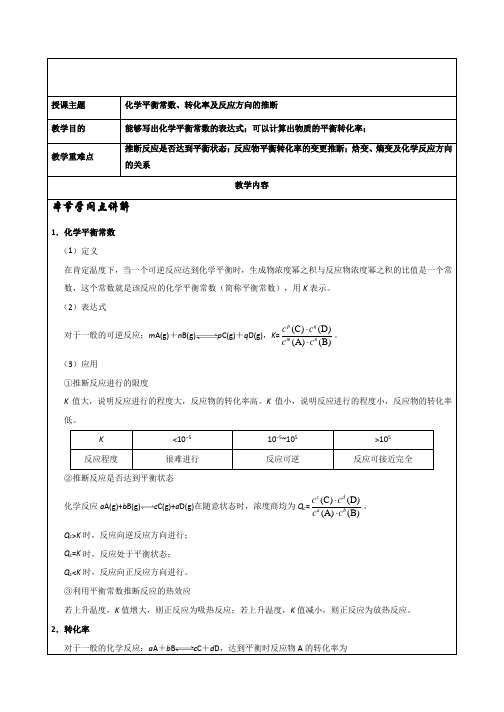
授课主题化学平衡常数、转化率及反应方向的推断教学目的能够写出化学平衡常数的表达式;可以计算出物质的平衡转化率;教学重难点推断反应是否达到平衡状态;反应物平衡转化率的变更推断;焓变、熵变及化学反应方向的关系教学内容本节学问点讲解1.化学平衡常数(1)定义在肯定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数(简称平衡常数),用K表示。
(2)表达式对于一般的可逆反应:m A(g)+n B(g)p C(g)+q D(g),K=(C)(D) (A)(B)p qm nc cc c⋅⋅。
(3)应用①推断反应进行的限度K值大,说明反应进行的程度大,反应物的转化率高。
K值小,说明反应进行的程度小,反应物的转化率低。
K <10−510−5~105>105反应程度很难进行反应可逆反应可接近完全②推断反应是否达到平衡状态化学反应a A(g)+b B(g)c C(g)+d D(g)在随意状态时,浓度商均为Q c=(C)(D) (A)(B)c da bc cc c⋅⋅。
Q c>K时,反应向逆反应方向进行;Q c=K时,反应处于平衡状态;Q c<K时,反应向正反应方向进行。
③利用平衡常数推断反应的热效应若上升温度,K值增大,则正反应为吸热反应;若上升温度,K值减小,则正反应为放热反应。
2.转化率对于一般的化学反应:a A+b B c C+d D,达到平衡时反应物A的转化率为α(A)=A AA的初始浓度-的平衡浓度的初始浓度×100%=0(A)(A)(A)c cc×100%[c0(A)为起始时A的浓度,c(A)为平衡时A的浓度]反应物平衡转化率的变更推断推断反应物转化率的变更时,不要把平衡正向移动与反应物转化率提高等同起来,要视详细状况而定。
常见有以下几种情形:反应类型条件的变更反应物转化率的变更有多种反应物的可逆反应m A(g)+n B(g)p C(g)+q D(g) 恒容时只增加反应物A的用量反应物A的转化率减小,反应物B的转化率增大同等倍数地增大(或减小)反应物A、B的量恒温恒压条件下反应物转化率不变恒温恒容条件下m+n>p+q反应物A和B的转化率均增大m+n<p+q反应物A和B的转化率均减小m+n=p+q反应物A和B的转化率均不变只有一种反应物的可逆反应m A(g)n B(g)+p C(g) 增加反应物A的用量恒温恒压条件下反应物转化率不变恒温恒容条件下m>n+p反应物A的转化率增大m<n+p反应物A的转化率减小m=n+p反应物A和B的转化率不变3.化学反应进行的方向一、自发过程1.含义在肯定条件下,不须要借助外力作用就能自动进行的过程。
人教版高考化学复习精品课件 专题七 化学反应速率 化学平衡 第21讲 化学平衡 化学平衡常数及计算

考向2 平衡标志的判断
①混合气体平均相对分子质量不再改变 ②恒温时,气体压强不再改变
√
续表
[对点训练2] (2023·苏州模拟)在恒温恒容密闭容器中,可以作为合成氨反应达到化 学平衡状态的标志的是( D )
乙丁戊
甲
乙
丙
丁
戊
己
02 考点2 化学平衡常数及计算
必备知识·梳理
1.概念 在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂 之积的比值是一个常数,即化学平衡常数,用符号___表示。
温度
4.平衡常数的意义及应用 (1)判断可逆反应进行的程度
反应程度
很难进行
反应可逆
反应接近完全
正 平衡
逆 (3)判断可逆反应的热效应
关键能力·提升
考向1 化学平衡常数与化学方程式的关系
B
考向2 化学平衡常数的应用
700
800
0.6
0.9
830
1000
1200
1.0
1.7
2.6
回答下列问题: 吸热
正反应
逆反应
二、化学平衡
1.化学平衡状态:在一定条件下,__可__逆__反应中正反应速率与逆反应速率__相__等__,反 应混合物中各组成成分浓度、含量保持__不__变__的状态,叫做化学平衡状态。
最大
零
小
大
平衡状态既可从正反应方向开始达到平衡,也可以从逆反应方向开始达到平衡。
3.化学平衡的特点: 动态
等于
不 行
向逆反应方向进
容器编号
温度
Ⅰ
0.2
0.2
0.05
Ⅱ
0.2
0.2
高中化学《平衡常数一轮复习》最新公开课PPT课件

的Kp=
(用表达式表示)。
平衡常数表达式Βιβλιοθήκη 高考真题回顾乙苯催化脱氢制苯乙烯反应:
(2)维持体系总压强 p 恒定,在温度 T 时,物质的量为 n 、体积
为 V 的乙苯蒸汽发生催化脱氢反应,已知乙苯的平衡转化率
为 a ,则在该温度下反应的平衡常数 K =
(用 a 等
符号表示)
平衡常数计算
知识整合
表明反应 进行程度
数表达式。
4、写出次氯酸根离子水解的离子方程式,并写出其对应的平
衡常数表达式。
基础巩固Ⅱ—平衡常数的影响因素
思考:升高温度,K怎样变化?
Ka、Kw、Kh 怎样变?
2SO2(g)+O2(g) 2SO3(g)。某温度下,SO2的平衡转化率(a)与 体系总压强(p)的关系如图所示。根据图示回答下列问题: (1)平衡状态由A变到B时,平衡常数K(A)____K(B)。
后,溶液显中性
基础巩固Ⅲ—平衡常数的意义
1、化学平衡常数K 的大小能说明反应进行的程度。 K 越大,表示反应进行的越_______。
2、Ka、Kb的大小表示弱酸、弱碱的相对强弱。
Ka 越大,弱酸的酸性越____; Kb 越大,弱碱的碱性越____。
3、Kh 越大,盐水解程度越_____……
基础巩固Ⅲ—平衡常数的意义
意义
表达式 影响因素
概 念
应用
平衡常数
判断反应进行方向 计算反应物转化率
化
电盐
学
离水
平
平解
衡
衡常
常
常数
数
数
基础巩固Ⅰ—平衡常数表达式
1、写出下列反应的平衡常数表达式
注(意1):N1H、2C表OO达NH式4(s中) ,固2体NH、3 (纯g)+液C体O2 (一g) 般不写;
《化学平衡状态》课件

总结词
详细描述
反应速率受温度、浓度、压力和催化剂等 因素影响。
温度越高,反应速率越快;浓度越高,反 应速率越快;压力越大,反应速率越快; 适当使用催化剂可以加快反应速率。
化学反应的方向
总结词
反应方向决定了化学平衡的移 动方向。
详细描述
根据勒夏特列原理,如果改变 影响平衡的条件,平衡就会向 着减弱这种改变的方向移动。
在制药工业中,化学平衡状态对于药物的合成和分离过程至关重要,通过调节平衡 条件可以获得高纯度的药物。
环境保护中的应用
化学平衡状态在环境保护中也有着重 要的应用,例如在大气污染控制中, 通过化学反应原理来降低大气中的污 染物浓度。
在土壤污染修复中,通过调节土壤中 的化学平衡来降低重金属等有害物质 的活性,从而减少对生态环境的危害 。
用率。
促进环境保护
通过研究化学平衡状态,可以减少 有害物质的排放,促进环境保护。
推动科学研究
化学平衡状态是化学反应动力学和 热力学研究的重要内容,有助于深 入了解化学反应的本质和规律。
02
化学平衡状态的建立
化学反应的速率
总结词
详细描述
反应速率是化学平衡状态建立的关键因素 。
化学反应速率决定了反应进行的快慢,对 于可逆反应,正逆反应速率相等是平衡状 态的特征之一。
《化学平衡状态》ppt课件
目录
• 化学平衡状态的定义 • 化学平衡状态的建立 • 化学平衡状态的移动 • 化学平衡状态的应用 • 化学平衡状态的实验验证
01
化学平衡状态的定义
什么是化学平衡状态
01
化学平衡状态是指在一定条件下 ,可逆反应进行到正、逆反应速 率相等且不再改变的状态。
02
高考化学一轮总复习配套课件第七章课时2化学平衡状态及其移动

________。
(2)在恒压容器中进行,达到平衡状态的标志是________。
①单位时间内生成 n mol O2 的同时生成 2n mol NO2 ②单位 时间内生成 n mol O2 的同时生成 2n mol NO ③用 NO2、NO、 O2 的物质的量浓度变化表示的反应速率的比为 2∶2∶1 的状 态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度
考素点养深优度化
⑥中,由⑤中的分析可知,混合气体的总物质的量不再变化, 说明反应已达到平衡;⑦中,消耗A的量与生成B的量之比与 它们在化学方程式中的计量数之比相等,也就是反应正向进 行和逆向进行的速率相等,说明反应已达到平衡;⑧中,A、 B、C的分子数之比为1∶3∶2只是反应进程中的某一时刻的 状态,不能说明反应已达到平衡。 答案 A
考素点养深优度化
解析 (1)由图可知 10 min 时反应达到平衡,所以 v(CO)=0.03 mol·L-1/10 min=0.003 mol·L-1·min-1,方程式的化 学计量数之比等于反应时物质转化的浓度之比,所以反应达平衡 时,c(H2)=c(CO2)=0.03 mol·L-1。(2)反应达到平衡的标志是反应 体系组成不变,正、逆反应速率相等且不为零。CO 减少的化学 反应速率是正反应速率,CO2 减少的化学反应速率是逆反应速率。 所以选①③。 答案 (1)0.003 mol·L-1·min-1 0.03 mol·L-1 (2)①③
1.可逆反应 (1)定义 在 同一条件下既可以向 正 反应方向进行,同时又可以向 逆 反应方向进行的化学反应。
考素点养深优度化
(2)特点 ①二同:a.相同条件下;b.正逆反应同时进行。 ②一小:反应物与生成物同时存在,任一组分的转化率都 小于 (填 “大于”或“小于”)100%。 (3)表示 在方程式中用“ ”表示。
2013届高三化学一轮复习课件:7.2化学平衡状态及其平衡常数(人教版)

2.(选一选)下列关于化学平衡状态的说法中不正确的是( 能达到的限度
)
A.一个可逆反应达到的平衡状态就是这个反应在该条件下所 B.当一个可逆反应达到平衡状态时,正向反应速率和逆向反 应速率相等且都等于0 C.在一定条件下,化学平衡的建立与反应途径无关Βιβλιοθήκη 相同 逆反应正反应
同时
小于
2.化学平衡状态——化学反应的限度 (1)建立过程(以N2+3H2 2NH3为例) 向密闭容器中充入一定量的N2和H2,使其反应。 最大 ①反应刚开始时,反应物浓度最大,正反应速率_________; 生成物浓度为0,逆反应速率为________。 0 ②反应进行中,反应物浓度逐渐减小,正反应速率逐渐 减小 增大 _________,生成物浓度逐渐增大,逆反应速率逐渐________。 相等 ③达到平衡时,正反应速率与逆反应速率___________,此时 反应物、生成物的浓度均保持_________。 不变
【解析】 (1)固体 FeO 和 Fe 不写入表达式中; (2)温度下降,平衡逆向移动,K 变小; L 1 cCO2 0.025 mol· (3) = =0.25<K=0.263; cCO 0.1 mol· -1 L
-
反应没有处平衡状态,应向正向进行,v(正)>v(逆)。
cCO2 (1) cCO cCO2 = cCO
(3)对于吸热或放热反应,绝热体系的温度不变,说明反
应处于平衡状态。
(2012·广东质检题组合)在一定温度下向a L密闭容器中加入 1 mol NO2(g)发生2NO2(g)N2O4(g),此反应达到平衡的标 志是________。
A.v(NO2)正=v(N2O4)逆
2023届高三化学一轮复习 化学平衡图像 课件

包含非平衡产率和平衡产率
反应达到平衡后升高温 度,平衡逆向移动; 催化剂活性降低。
非平衡产率 平衡产率
a点的转化率比c点高的原因是 该反应为放热反应,升温,平衡逆向移动, 转化率降低
大本P170 T3(3) 2CO(g)+O2(g) =2CO2(g)
a、b、c、d四点中, 达到平衡状态的是__b_c_d_。
zC(g)
在一定的温度下只要A、B 起始物质的量之比刚好等于 平衡化学方程式化学计量数 之比,平衡时生成物C的体 积分数就最大
大本P166 T3
Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+ 2H2O(g)。如图为刚性容器中,进料浓度比c(HCl)∶c(O2) 分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化
NO分解反应是放热 反应,升高温度, 平衡逆向移动。
小本P340 T13(3) CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-48.9 kJ·mol-1
在490 K之前,甲醇产率随 着温度升高而增大的原因 是:反应尚未达到平衡,
温度越高化学反应 速率越快。 490 K之后,甲醇产率 下降的原因是:
p1>p2,正反应为气体系数和减小的反应
生成物百分含量
反应物百分含量
p1>p2,正反应为气体系数和增大的反应
4、恒压线与恒温线 (α表示反应物的平衡转化率,c表示反应物的平衡浓度)
定一议二
图ΔH①<,0若;p1>p2>p3,则正反应为气体体积 减小 的反应, 图②,若T1>T2,则正反应为 放热 反应。
相同量的 反应物Tn
5、几种特殊图像
①对于化学反应mA(g)+nB(g) ⇌ pC(g)+qD(g)
高考化学一轮复习 第七章 化学反应速率和化学平衡 3 化学平衡常数 化学反应进行的方向课件

增大压强,平衡正向移动,X的体积分数减小,但X的 浓度增大,C项正确;升高温度,正、逆反应速率都增 大,D项错误。
3.(2016·广州模拟)已知:反应①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1,反应②Fe(s)+H2O(g)
FeO(s)+H2(g)的平衡常数为K2,不同温度下K1、 K2的值如下表所示:
【解析】选C。实验①中,若5 min时测得n(M)= 0.050 mol,浓度是0.005 0 mol·L-1,则根据反 应的化学方程式可知,同时生成N的浓度也是 0.005 0 mol·L-1,因此0至5 min时间内,用N表 示的平均反应速率为v(N)=1.0×10-3mol·L-1·min-1, A错误;实验②中,平衡时M和N的浓度都是 0.008 0 mol·L-1,消耗X与Y的浓度均是
2.化学平衡的计算方法——“三段式法” “三段式法”是有效解答化学平衡计算题的“万能钥 匙”。解题时,要注意清楚有条理地列出起始量、转 化量、平衡量,按题目要求进行计算,同时还要注意 单位的统一。
(1)计算步骤:
(2)注意事项: ①注意反应物和生成物的浓度关系:反应物: c(平)=c(始)-c(变);生成物:c(平)=c(始)+c(变)。
(2)分析表中数据可知,随着温度的升高,K值逐渐增
大,说明正反应是吸热反应。
(3)某温度下,由3c(CO2)·c(H2)=5c(CO)·c(H2O)
得出 ccCCOO2ccHH =2O20.6=53K,查表知K=0.6时对
应温度是700℃。
(4)只要温度不变,K数值就不变,故830℃条件下,K
的数值是1.0。
第三节 化学平衡常数 化学反应进行的方向
人教版新高考化学一轮复习课件--化学平衡常数及转化率 化学反应的调控
N(g)
P(g)+
Q(g)
初始浓度
(mol ·L -1 )
4
a
0
0
转化浓度
(mol ·L -1 )
2
2
2
2
平衡浓度
(mol ·L -1 )
2
a-2
2
2
2mol ·L -1
M 的转化率=4mol ·L -1 ×100%=50%
0.6×0.6
温度不变,平衡常数不变,K=0.4×1.8
=
2×2
2×(-2)
①Kp含义:在化学平衡体系中,用各气体物质的分压代替浓度,计算出的平
衡常数叫压强平衡常数。
②计算方法:第一步,用“三段式”法计算平衡体系中各物质的物质的量或
物质的量浓度;第二步,计算各气体组分的物质的量分数或体积分数;第三
步,根据分压计算公式,求出各气体物质的分压,某气体的分压=气体总压强
×该气体的体积分数(或物质的量分数);第四步,根据压强平衡常数计算公
1
SO2(g)+2O2(g)的
1
K'=50 。(
2SO3(g)的 K=50,那么该温度下 SO3(g)
× )
(5)升高温度,平衡常数 K 增大。( × )
2.反应 H2(g)+I2(g)
2HI(g)的平衡常数为 K1;反应 HI(g)
1
1
H2(g)+2I2(g)
2
的平衡常数为 K2(平衡常数为同温度下的测定值),则 K1、
1
H
2(g)+ I2(g)的平衡常
2
2
知识点2
平衡转化率及化学平衡的相关计算
知识筛查
精品:2015届高考化学大一轮课件:7-22化学平衡 化学平衡常数

助学微博
三种应用 化学平衡常数的三种应用 1. 化学平衡常数数值的大小是可逆反应进行程度的标志。 2.可以利用平衡常数的值作标准判断: (1)正在进行的可逆反应是否平衡。 (2)化学平衡移动的方向。
助学微博
3.利用 K 可判断反应的热效应 若升高温度,K 值增大,则正反应为吸热反应; 若升高温度,K 值减小,则正反应为放热反应。
助学微博
我的警示 从反应速率的角度来判断反应是否达到平衡时, 速率必须 是一正一逆(不能同是 v 正或 v 逆), 且反应速率之比等于化学计 量数之比。
四、化学平衡常数 1.在一定温度下,当一个可逆反应达到化学平衡时,生 22 浓度化学计量数次幂的乘积 成物□
浓度化学计量数次幂的乘积
23 与其反应物□
4 逆反应 。 右向左的过程称作□
2.可逆反应指反应物和产物必须同时存在于 5 同一反应体系中 ,而且在□ 6 相同 □ 7 自动进行 。 都能够□ 条件下,正、逆反应
二、化学平衡状态的含义 1.构成化学平衡体系的基本要求是反应物和所有产物均 8 同一反应体系中 处于□ 9 反应条件 保持不变。 ,□
2.对一般可逆反应 mA(g)+nB(g)
29 浓度 变化无关,即在一定温度下,平衡常数 或生成物的□ 保持不变。
助学微博
四个注意 使用化学平衡常数应注意的问题 1. 化学平衡常数 K 值的大小是可逆反应进行程度的标志, 它能够表示可逆反应进行的完全程度。一个反应的 K 值越大, 表明平衡时生成物的浓度越大, 反应物的浓度越小, 反应物的 转化率也越大。 可以说, 化学平衡常数是在一定温度下一个反 应本身固有的内在性质的定量体现。
5.可根据 K 随温度的变化情况判断反应的热效应。(√) 解析:若升高温度,K 值增大,则正反应为吸热反应;若 升高温度,K 值减小,则正反应为放热反应。 6. 化学平衡常数和转化率都能体现反应进行的程度。 (√) 解析:化学反应达平衡时,各反应物的转化率达最大。 化学平衡常数本身就是化学平衡时各物质浓度的关系。故平 衡常数和转化率是从两个不同的角度来反映化学反应进行的 程度。
