博士无机化学入学考核试卷
北京化工大学 高等无机化学样题 博士研究生考研考博入学考试

北 京 化 工 大 学攻读博士学位研究生入学考试高等无机化学 样题注意事项1. 答案必须写在答题纸上,写在试卷上均不给分。
2. 答题时可不抄题,但必须写清题号。
3. 答题必须用蓝、黑墨水笔或圆珠笔,用红色笔或铅笔均不给分。
1. 联苯C 6H 5-C 6H 5有三种不同构象,两苯环的二面角(α)分别为:(a) α = 0, (b) α = 90o , (c) 0<α<90o , 试判断这三种构象的点群。
2. 利用价层电子对互斥理论说明AsH 3, ClF 3, SO 3, SO 32-和CH 3+等分子和离子的几何形状,并指出哪些分子有偶极矩。
3. 金属钽为体心立方结构,a = 330 pm ,试计算:(a) 钽的原子半径;(b) 金属钽的理论密度(Ta 的相对原子质量为181);(c) 试证明晶胞中钽原子的空间占有率为68%。
4. 已知在碱性溶液中溴元素的电势图为:BrO 3― BrO ― Br 2 Br ―(a) 求E o (BrO 3―/BrO ―), E o (BrO ―/Br ―)和E o (BrO 3―/Br 2);(b) 判断哪些物质能发生歧化反应,写出歧化反应的离子方程式; (c) 将液溴与NaOH 溶液混合,最稳定的产物是什么?5. 试用一种试剂将硫化物、多硫化物、亚硫酸盐和硫酸盐区分开,并写出反应现象及所涉及到的主要反应方程式。
0.61 V 0.45 V 1.07 V6.CaC2O4⋅2H2O的热分析曲线如下图所示。
试分析CaC2O4⋅2H2O的热分解过程及相应的热分解反应方程式。
说明DSC、TG及DTG曲线代表的物理意义及三者间的关系。
7.钛是一种重要的金属元素,请写出金属钛的制备方法,并列出你所知道的有关钛化合物的可能用途。
华侨大学 综合考试(无机化学+有机化学) 2017年博士研究生考博真题

9.共价键和孤对电子之间具有排斥力,下列键角中, 角度最小的是
。
10.下列卤代烃,发生 SN2 反应时,反应速率最快的是
。
二、填空题,有立体选择性的需注明(每空格 2 分,共 26 分) : 1.BeH2、 CCl4 分子中中心原子的杂化方式及空间结构分别为____ (1) ___, ___(2)___ __。 2.下列反应组成原电池(M 为金属) :M(s)+2H+(1 mol· L-1)→M2+(0.1 mol· L-1)+H2(100kPa), 测得其电池的电动势为 0.50V,则 EӨ (M2+/M)= (4) 。 (5) 。 (3) ,该反应的平衡常数 KӨ=
3
4. 酰胺用溴 ( 或氯 ) 在碱性条件下处理转变为少一个碳原子的伯胺,此反应也称为
Hofmann 重排(降解)反应。试以 RCONH2 为列,写出以上反应的机理与产物。 (6 分) 五、合成题(共 12 分,每题 6 分) 1.频哪醇重排反应是构建螺环烃的重要方法,请利用此反应合成以下化合物。
2.在 1.0L 溶液中, 当 Na2SO4 初始浓度为多少时, 才能将 0.20molBaCO3 完全转化为 BaSO4 沉淀?如果需要将 0.20molBaSO4 完全转化为 BaCO3,则需要 1.0L 多大初始浓度的 Na2CO3 溶液。 (5 分)已知 KspӨ (BaCO3)=5.1× 10-9 , KspӨ (BaSO4)=1.1× 10-10 3.-卤代酮在氢氧化钠水溶液中加热重排生成含相同碳原子数的羧酸, 此反应也称之为 Favorskii 重排反应。试以-溴代酮为原料,写出以上反应的机理与产物。 (6 分)
1.776
H2O,EBӨ/V:O2 -0.08 HO2- 0.87 H2O 。 (B) 只有在碱性溶液中才能发生 (D) 在酸、碱性溶液中都不能发生
2014年中科院长春应化所博士研究生无机化学考博真题,真题解析,复试真题,真题笔记

考博详解与指导专业名称(代码)研究方向070301无机化学指导教师考试科目01稀土光功能材料的研发与应用苏锵*①英语一②高等无机化学或高等分析化学或高等有机化学或高等物理化学或高分子化学与物理或生物化学或固体物理③配位化学或结构化学或电化学与电分析化学或催化化学或分子光谱或核磁共振波谱学或质谱学或量子力学或高等数学(三)或分子生物学或细胞生物学或萃取化学或化学软件工程学02稀土有机/无机杂化材料发光性能的研究;新型纳米材料的构筑及性能的研究;稀土及过渡金属电致发光材料及器件张洪杰*03纳/微米结构发光材料及其在FED 显示及照明领域的应用;稀土纳米发光材料及其在生物医学领域的应用林君04光、电、磁功能材料合成与结构;镁合金组织结构与性能研究孟健05新型硬质合金的合成、结构和性质马贤锋06生物无机化学、分子生物学,纳米材料在生物上的应用倪嘉缵*刘琼◇07生物分子构像与功能、生物纳米材料、生物电化学、药物合成曲晓刚08纳米生物化学,化学生物学,药物筛选,无机/有机化学任劲松09离子液体;绿色分离材料;稀土绿色分离化学与清洁工艺陈继10微孔结构材料的合成及应用王成11LED 等用高效发光材料的合成与应用;纳米光信息功能材料的合成与应用尤洪鹏12稀土分离化学与低碳清洁冶金;金属-杯芳烃配位化合物与超分子化学廖伍平13功能配合物、分子磁性唐金魁14铜基薄膜太阳能电池材料与器件潘道成15清洁能源材料和高能化学电源张新波16稀土光功能材料的研发与应用李成宇17稀土配位化学及材料化学;稀土金属有机化合物与Zintl 相反应性研究;稀土催化孙忠明18结晶物理化学过程薛冬峰19微/纳米结构材料及其生物医学、环保领域等应用张吉林20生物安全性纳米材料的重新设计、纳米材料调控下的干细胞分化行为张海元21能源材料-实验与理论刘孝娟22刺激响应性质的纳米复合材料在生物领域的应用程子泳23微纳米孔材料的合成及其在能源、生物医药领域中的应用逄茂林第一部分、传统面试问题(Sample Traditional Interview Questions )1、What can you tell me about yourself?(关于你自己,你能告诉我些什么?)这一问题如果面试没有安排自我介绍的时间的话。
复旦大学2023年博士入学考试化学真题

复旦大学2023年博士入学考试化学真题问题1:请根据以下反应式,回答问题1至问题3:3FeS2 + 10HNO3 → 3Fe(NO3)2 + 2NO + 4H2O + 6S1. 在这个反应中,氧化态发生了什么样的变化?在这个反应中,硫的氧化态由-1变为0,氮的氧化态由+5变为+2,铁的氧化态由0变为+2。
2. 在这个反应中,是否发生了还原反应?请简要解释。
是的,这个反应中发生了还原反应。
还原反应是指物质损失氧或得到氢,或两者同时进行的反应。
在这个反应中,硫由-1的氧化态还原到0的氧化态,铁由0的氧化态还原到+2的氧化态。
因此,可以确定这是一个还原反应。
3. 在这个反应中,哪种物质是氧化剂?哪种物质是还原剂?请简要解释。
在这个反应中,硫是氧化剂,而硝酸是还原剂。
氧化剂是指在氧化还原反应中能够氧化其他物质的物质,而还原剂则是指在氧化还原反应中能够还原其他物质的物质。
在这个反应中,硫将铁的氧化态从0氧化到+2,硝酸则将硫的氧化态从-1氧化到0,因此可以确定硫是氧化剂,硝酸是还原剂。
问题2:请根据以下情景,回答问题4至问题5:材料科学研究人员正在开发一种可重复使用的太阳能电池。
该电池的关键部件是由特殊材料制备的光催化剂,它可以将太阳能转化为电能。
研究人员发现,在该太阳能电池中,光催化剂的稳定性是一个关键的问题。
4. 请说明为什么光催化剂的稳定性对太阳能电池的性能至关重要。
光催化剂的稳定性对太阳能电池的性能至关重要,因为太阳能电池的工作原理是将光能转化为电能。
如果光催化剂不稳定,它的效果将会受到影响,无法有效地将太阳能转化为电能。
因此,光催化剂的稳定性直接决定了太阳能电池的性能。
5. 请提出一种可能的方法来提高光催化剂的稳定性。
一种可能的方法来提高光催化剂的稳定性是改进其材料结构。
通过优化材料的组成和结构,可以增加光催化剂的稳定性,使其能够在长时间的工作中保持较高的效率。
此外,可以采用包覆技术将光催化剂包覆在稳定且具有良好导电性的材料上,以增加其耐用性和稳定性。
最新中科大9901无机化学及答案0

中科大9901无机化学及答案0中科院系统99-01年研究生入学考试无机化学试题汇编99年无机化学试题一选择题(30分): 1 下列溶剂最能溶解离子型溶质的是------------------------------------------------------------()A CCl4;B CH3OH;C C5H12;D (C2H5)2O。
2 下列物质中碱性最强的是-----------------------------------------------------------------------( )A R4NOH; B R3NHOH; C R2NH2OH; D NH3(aq)。
3 硼酸晶体中质点间的作用力是-----------------------------------------------------------------( )A 氢键,范德华力;B 共价键;C 离子键;D 离子键,共价键。
4 对于常见分子筛的成分中,硅铝比越大,下列说法正确的是-------------------------()A 耐酸性强,热稳定性差;B 耐酸性差,热稳定性差;C 耐酸强,热稳定性强;D 耐酸怀差,热稳定强。
5 下列金属中,熔沸点相差最大的是-----------------------------------------------------------()A Li;B Al;C Ga;D In。
6 NCl3的水解产物是---------------------------------------------------------------------------------()A NH3+HOCl; B NH3+HCl; C HNO2+HCl; D NH2OH+HCl。
7 已知某反应的活化能为114kj.mol-1,采用一种催化剂可使其活化能降低一半,该反应速率将加快倍数约是---------------------------------------------------------------------------------()A 1×102;B 1×1010;C 1×106;D 1×108。
2014年中山大学博士生入学考试试题纸

获奖理由:超越光学显微镜的局限——超高分辨率荧光显微镜的发展19世纪末,恩斯特·阿贝将光学显微镜的分辨率极限大致确定在可见光波长的一半,即0.2微米左右。
这意味着科学家们可以分辨单个细胞,以及一些被称为细胞器的细胞成分。
然而他们无法用这样的显微镜分辨尺寸更小的物体,例如常规尺寸的病毒,或者单个的蛋白质。
而2014年的诺贝尔奖获得者通过荧光分子,机智地解决了这一问题。
他们突破性的工作将光学显微镜带进了纳米尺度。
埃里克•白兹格、斯蒂芬•黑尔、和威廉•莫尔纳由于超越了0.2微米这个极限而被授予2014年的诺贝尔化学奖。
由于他们的贡献,现在通过光学显微镜我们可以观察到纳米世界。
通过纳米显微镜(nanoscopy),科学家们可以在细胞中观察到单个分子的运动。
他们可以看到分子在脑的两个神经细胞之间如何产生突触;能够在导致帕金森病和亨廷顿舞蹈病的蛋白质聚集时观察它们,可以在受精卵分裂成胚时跟踪单个蛋白质的走向。
此次诺贝尔化学奖授予两项不同的工作。
其中一项是斯蒂芬•黑尔在2000年开发的STED显微镜技术(图2)。
这项技术同时使用两束激光,其中一束激发荧光分子发光,另外一束将除了一个纳米尺寸之外的荧光全部猝灭掉。
这样,通过一个纳米一个纳米地扫描样品,我们可以获得分辨率高于阿贝极限的图像另一项工作来自于埃里克•白兹格和威廉•莫尔纳,他们各自独立地建立了单分子显微镜(single molecule microscopy)的基础(图4)。
这项成果可以将单个分子的荧光打开或者关掉。
科学家们对同一区域反复成像,每次只允许几个分散的分子发光。
将这些图像叠加就获得了分辨率达到纳米尺度的图像。
在2006年,Eric Betzig首次使用了这种方法。
今天,纳米显微技术在世界范围被广泛使用,通过这种技术,每天都在产生为人类带来极大益处的新知识。
2012年诺贝尔化学家瑞典皇家科学院10日宣布,美国科学家罗伯特·莱夫科维茨和布赖恩·科比尔卡分享2012年诺贝尔化学奖,以表彰他们在“G蛋白偶联受体”方面的研究。
2015年北京大学物理学院化学与分子工程学院无机化学考博专业介绍,考博真题,真题解析
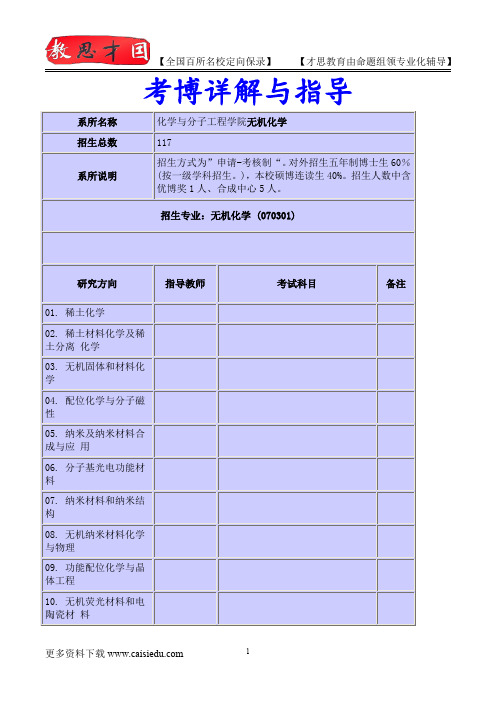
考博详解与指导系所名称化学与分子工程学院无机化学招生总数117系所说明招生方式为”申请-考核制“。
对外招生五年制博士生60%(按一级学科招生。
),本校硕博连读生40%。
招生人数中含优博奖1人、合成中心5人。
招生专业:无机化学(070301)研究方向指导教师考试科目备注01.稀土化学02.稀土材料化学及稀土分离化学03.无机固体和材料化学04.配位化学与分子磁性05.纳米及纳米材料合成与应用06.分子基光电功能材料07.纳米材料和纳米结构08.无机纳米材料化学与物理09.功能配位化学与晶体工程10.无机荧光材料和电陶瓷材料11.碳原子簇材料与纳米空间化学12.稀土合成与材料化学13.无机固体化合物的结构、性质14.沸石分子筛;钙钛矿相关结构15.分子光谱的基础研究和应用研究16.配位化学17.配位化学和无机-有机杂化材料18.光电功能材料及器件19.超分子板块法构筑功能材料化学20.配位化学和生物矿化21.金属有机化学22.生物无机化学,金属有机化学,化学生物学1.自我介绍(self-introduce)Good morning.I am glad to be here for this interview.First let me introducemyself.My name is***,24.I come from******,the capital of*******Province.I graduated from the******* department of*****University in July,2001.In the past two years I have been prepareing for the postgraduate examination while I have been teaching*****in NO.****middle School and I was a head-teacher of a class in junior grade two.Now all my hard work has got a result since I have a chance to be interview by you.I am open-minded,quick in thought and very fond of history.In my spare time,I have broad interests like manyother youngers.I like reading books,especially those about*******.Frequently I exchange with other people by making comments in the forum on line.In addition,during my college years,I was once a Net-bar technician.So,I have a comparative good command of network application.I am able to operate the computer well.I am skillful in searching for information in Internet.I am a football fan for years.Italian team is my favorite.Anyway,I feel great pity for our country’s team.I always believe that one will easily lag behind unless he keeps on learning.Of course,if I am given a chance to study******in this famous University,I will stare no effort to master a good command of advance******.2.考研原因(reasons for my choice)There are several reasons.I have been deeply impressed by the academic atmosphere when I came here last summer.In my opinion,as one of the most famous******in our country,it provide people with enough room to get further enrichment.This is the first reason.The second one is I am long for doing research in******throughout my life.Its a pleasure to be with my favorite ******for lifetime.I suppose this is the most important factor in my decision.Thirdly,I learnt a lot from my*****job during the past two years.However,I think further study is still urgent for me to realize self-value.Life is precious.It is necessary to seize any chance for self-development,especially in this competitive modern world.In a word,I am looking forward to making a solid foundation for future profession after two years study here.3.研究生期间你的计划(plans in the postgraduate study)First,I hope I can form systematic view of*****.As for******,my express wish is to get a complete comprehension of the formation and development as well as**************.If possible,I will go on with my study for doctorate degree.In a word,I am looking forward to making a solid foundation for future profession after two years study here.4.介绍你的家乡(about hometown)I am from,a famous city with a long history over2,200years.It is called“Rong Cheng”because there were lots of banians even900years ago.The city lies in the eastern part of the province.It is the center of politics, economy and culture.Many celebrities were born here,for instance,Yanfu,Xie Bingxin,Lin Zexu and so on..You know,there is a saying that“The greatness of a man lends a glory to a place”.I think the city really deserves it. The top three artware are Shoushan Stone,cattle-horn combs and bodiless lacquerware.In addition,it is famous for the hot springs.Theyare known for high-quality.Visitors athome and abroad feel it comfortable bathing here.There is my beloved hometown.5.你的家庭(about family)There are four members in my family;my parents,my cute cat of9years old andme.My father is a technician in the Fujian TV station.He often goes out on business.So most of the housework is done by my industrious mom.Climbing at weekends is our common interest.The fresh air and natural beauty can help us get rid of tiredness.They can strengthen our relation,too.During my prepareing for coming here,my parents’love and support have always been my power.and I hope in future I wil be able to repay them.6.你的大学(about university)**********University is the oldest one in the province.It was founded in*******and covers an area ofover*******mu.The building area is************square meters.It develops into a comprehensive university with efforts of generations,especially after the reform and opening up.It takes the lead among the*********universities with nice teaching and scientific research ability.The library has a storage of*******books..various research institutes are set up including52research centers.There are teaching research experimental bases.For example,the computer center,analyzing-test center,modern education technical center and so on.。
北京化工大学博士研究生入学考试高等无机化学考试大纲

北京化⼯⼤学博⼠研究⽣⼊学考试⾼等⽆机化学考试⼤纲北京化⼯⼤学博⼠学位研究⽣⼊学考试《⾼等⽆机化学》考试⼤纲及参考书第⼀部分理论⽆机化学第⼀章原⼦及分⼦结构1.1原⼦结构、原⼦参数及其周期性1.1.1原⼦结构基本理论1.1.2电离能及其周期性变化规律1.1.3电⼦亲和能及其周期性变化规律1.1.4原⼦半径及其周期性变化规律1.1.5电负性及其周期性变化规律1.2键参数与分⼦构型1.2.1键参数1.2.2分⼦⽴体构型的确定1.3分⼦对称性与点群1.3.1对称操作和对称元素1.3.2对称群第⼆章固体⽆机化学2.1晶体的结构和类型2.1.1空间点阵2.1.2晶胞和晶系2.1.3晶体的类型2.2离⼦晶体2.2.1⼏种典型的离⼦晶体2.2.2离⼦半径和配位⽐2.3⾦属晶体2.3.1⾦属晶体的紧密堆积结构2.3.2⾦属键与能带理论2.4晶体的缺陷2.4.1点缺陷2.4.2线缺陷2.4.3⾯缺陷第三章配位化学3.1配合物基本概念3.1.1配合物的组成和命名3.1.2配合物的基本类型3.2配合物的异构现象3.2.1⼏何异构现象3.2.2旋光异构现象3.2.3其他异构现象3.3过渡元素配合物的成键理论3.3.1晶体场理论和配位场理论3.3.2分⼦轨道理论3.3.3配合物⼏何构型的理论预测-⾓重叠模型第⼆部分元素⽆机化学第四章p区元素4.1氧族元素化合物4.1.1氧化物及其⽔合物4.1.2⽆机含氧酸盐的溶解性和热稳定性4.2卤素元素化合物4.2.1互卤化物、卤氧化物4.2.2含卤配合物与多卤化物第五章d区元素5.1d区元素通论5.1.1d轨道的特性与电⼦构型5.1.2d区元素的氧化态及其稳定性5.2部分⾦属元素的化合物及性质5.2.1钛的化合物及性质5.2.2锰的化合物及性质5.2.3钴、镍的化合物及性质5.2.4铜、锌的化合物及性质5.2.5银的化合物及性质第六章稀⼟元素6.1稀⼟元素分组及基本性质6.1.1稀⼟元素的分组6.1.2稀⼟元素的基本性质6.2稀⼟元素的化合物6.2.1氢氧化物6.2.2氧化物6.2.3配位化合物6.3稀⼟元素的应⽤第三部分现代⽆机化学及分析表征⽅法第七章现代⽆机化学专题7.1⽆机材料化学7.1.1⽆机层状结构与⽆机功能材料7.1.2磁性材料7.1.3发光及光屏蔽材料7.1.4⽆机固体电解质材料7.2⽣物⽆机化学7.2.1⽣命必需元素7.2.2主族元素的⽣物学效应7.2.3d区过渡⾦属的⽣物学效应7.2.4稀⼟元素的⽣物学效应7.3超分⼦化学7.3.1超分⼦化学的基本概念7.3.2分⼦识别7.3.3分⼦组装及分⼦器件第⼋章⽆机分析表征⽅法8.1粉末X射线衍射分析⽅法及结果解析8.2X射线光电⼦能谱分析⽅法及结果解析8.3核磁共振及谱图解析8.4热分析及结果解析8.5扫描电镜及透射电镜分析8.6红外光谱分析8.7紫外-可见分光光度法8.8其他⽆机分析表征⽅法考试参考书1.《中级⽆机化学》,唐宗薰主编,⾼等教育出版社,2003年2.《⾼等⽆机化学》,陈慧兰主编,⾼等教育出版社,2005年。
博士考试综合化学试题及答案

博士考试综合化学试题及答案一、选择题(每题2分,共20分)1. 以下哪种化合物不属于有机化合物?A. 水 H2OB. 甲烷 CH4C. 二氧化碳 CO2D. 乙醇 C2H5OH2. 根据IUPAC命名规则,CH3CH2CH2CH3的正确名称是:A. 丁烷B. 正丁烷C. 异丁烷D. 丁烯3. 以下哪个反应是可逆反应?A. 碳酸钙受热分解B. 铁与盐酸反应C. 氢气与氧气燃烧D. 氯化铵受热分解4. 根据酸碱质子理论,以下哪个物质不是酸?A. 硫酸B. 氢氧化钠C. 碳酸D. 磷酸5. 以下哪个元素的原子半径最大?A. 氢B. 氧C. 钠D. 氯...(此处省略其他选择题)二、简答题(每题10分,共30分)1. 简述化学平衡的概念及其影响因素。
2. 解释什么是氧化还原反应,并给出一个具体的例子。
3. 描述什么是同位素,并说明它们在化学分析中的应用。
三、计算题(每题15分,共30分)1. 某化学反应的速率常数k=0.02 min^-1,反应物A的初始浓度为0.1 mol/L。
如果该反应是一级反应,求10分钟后反应物A的浓度。
2. 给定一个酸碱中和反应,酸的浓度为0.05 mol/L,碱的浓度为0.03 mol/L,反应后溶液的pH值为4.5。
假设酸是强酸,碱是弱碱,求碱的解离常数Kb。
四、论述题(每题20分,共20分)1. 论述绿色化学的重要性及其在现代工业中的应用。
博士考试综合化学试题答案一、选择题答案1. C2. B3. D4. B5. C...(此处省略其他选择题答案)二、简答题答案1. 化学平衡是指在一定条件下,可逆反应中正向反应速率和逆向反应速率相等的状态。
影响因素包括温度、压力、浓度和催化剂等。
2. 氧化还原反应是指在化学反应中,原子或离子之间发生电子转移的过程。
例如,铁与氧气反应生成铁锈,铁失去电子被氧化,氧气获得电子被还原。
3. 同位素是具有相同原子序数但不同质量数的原子。
它们在化学分析中用于示踪研究、确定年代和测量环境污染物等。
博士学位研究生入学考试试题

北 京 科 技 大 学2011年博士学位研究生入学考试试题=============================================================================================================试题编号: 试题名称:综合化学 (共 页)适用专业:材料合成化学080521 说明: 所有答案必须写在答题纸上,做在试题或草稿纸上无效。
=============================================================================================================(第一部分,无机化学试题, 共50分)一、单项选择题 ( 每小题1分,共20小题 20分 )1. 下列配离子属于反磁性的是……………………………………………………………( )(A) [Mn(CN)6]4- (B) [Cu(en)2]2+ (C) [Fe(CN)6]3- (D) [Co(CN)6]3-2. 下列反应方程式中,正确的是…………………………………………………………( )(A) 5NaBiO 3 + 14HCl + 2MnCl 2 = 2NaMnO 4 + 5BiCl 3+ 3NaCl + 7H 2O(B) Sb 2O 5+ 10HCl = 2SbCl 3+ 5H 2O + 2Cl 2(C) 2Na 3AsO 3 + 3H 2S = As 2S 3↓ + 6NaOH(D) Bi(OH)3 + Cl 2+ 3NaOH = NaBiO 3 + 2NaCl + 3H 2O3. 溶解金的试剂是……………………………………………………………………… ( )(A) 硝酸 (B) 硫酸 (C) KCN 溶液 (D) 硝酸和磷酸的混合酸4. 气体反应 CO + H 2O =CO 2 + H 2,此反应的Δr G m 和r m G ∆与体系总压的关系是…( )(A) Δr G m 与r m G ∆均与体系总压无关 (B) Δr G m 与r m G ∆均与体系总压有关(C) Δr G m 与体系总压有关,r m G ∆与总压无关 (D) Δr G m 与体系总压无关,r m G ∆与总压有关5. 由于La系收缩,导致下列元素中性质相似的一组是………………………………()(A) Ti和V (B) Hg和Pb (C) Nb和Ta (D) Mn和Re6. 下列氢氧化物中,溶解度最小的是…………………………………………………()(A) Ca(OH)2(B) La(OH)3(C) Tb(OH)3(D) Ce(OH)47. [CrCl2(NH3)4]+具有几何异构体的数目是……………………………………………()(A) 2 (B) 3 (C) 4 (D) 68. 关于五氯化磷(PCl5),下列说法中不正确的是……………………………………()(A) 它由氯与PCl3反应制得(B) 它容易水解生成磷酸(H3PO4)(C) 它在气态时很稳定(D) 它的固体状态是结构式为[PCl4+][PCl6-]的晶体9. 下列各含氧酸中,三元酸是…………………………………………………………()(A) H3PO4(B) H3PO2(C) H3PO3(D) H3BO310. 将K2MnO4溶液调节到酸性时,可以观察到的现象是……………………………()(A)紫红色褪去(B)绿色加深(C)有棕色沉淀生成(D)溶液变成紫红色且有棕色沉淀生成11. 根据价层电子的排布,预料下列化合物中为无色的是……………………………()(A) TiCl3(B) ScF3(C) MnF3(D) CrF312. 在由Cu2+/Cu和Ag+/Ag组成的原电池的正负极中,加入一定量的氨水,达平衡后[NH3·H2O] = 1mol·dm-3,则电池的电动势比未加氨水前将……………………………………………………()(Cu(NH3)+24的K稳= ⨯ 1013,Ag(NH3)+2的K稳= ⨯ 107)(A)变大(B)变小 (C) 不变(D) 无法判断13. 下列物质的氧化性与惰性电子对效应无关的是…………………………………()(A) Pb(IV) (B) Bi(V) (C) Cr(VI) (D) Tl(III)14. 下列各混合溶液中,具有缓冲作用的是…………………………………………()(A) HCl (1 mol·dm-3) + NaAc (2 mol·dm-3)(B) NaOH (1 mol·dm-3) + NH3 (1 mol·dm-3)(C) HCl (1 mol·dm-3) + NaCl (1 mol·dm-3)(D) NaOH (1 mol·dm-3) + NaCl (1 mol·dm-3)Hg中汞原子之间的化学键为……………………………………………………()15. +22(A) 离子键(B) σ键(C) π键(D) 配位键16. 下列各组元素中,性质最相似的两种元素是……………………………………()(A) Mg和Al (B) Zr和Hf (C) Ag和Au (D) Fe和Co17. 下列离子中氧化性最强的是………………………………………………………()(A) CoF-36(B) Co(NH3)+33(C) Co(CN)-36(D) Co3+18. 下列配制溶液的方法正确的是…………………………………………………… ( )(A) 在溶解Na 2S 2O 3的水中加入少量Na 2CO 3溶液(B) 为抑制Na 2S 2O 3水解,在Na 2S 2O 3溶液中加少量稀H 2SO 4(C) 将SnCl 2·2H 2O 用水溶解即得到SnCl 2溶液(D) 用分析天平准确称取NaOH 固体,加水溶解后,用容量瓶稀释到所要求的体积19. 弱场中,八面体和四面体配合物的 CFSE 相等的是……………………………( )(A) Fe 2+ (B) Ni 2+ (C) Mn 2+ (D) Cu 2+20. 金属锂、钠、钙的氢化物,氮化物,碳化物( 乙炔化物 )的相似点是…………………( )(A) 都可以和水反应,生成气态产物 (B) 都可以和水反应,生成一种碱性溶液(C) 在室温条件下,它们都是液体 (D) (A)和(B)二、填空题 ( 每小题1分,共10题 10分 )1. 将CO 2、NO 2、O 3、SO 2按氧化能力由强到弱排列的顺序为 。
三峡大学《无机化学》考试试卷

三峡大学《无机化学》考试试卷试卷(一)一、填空题( 每空1分,共30分)1.测定溶液酸碱性的方法很多,定性测定可用_______________.定量测定可用____________.2.原子轨道组成分子轨道的原则是: 对称性原则、________________原则、_________________原则。
3.已知下列元素在周期表中的位置,写出它们的外层电子构型和元素符号.(1) 第四周期第ⅣB族________________________;(2) 第五周期第ⅥA族________________________.4.空气中的SO2与水作用并经氧化,生成___________ 使大理石转化为_________, ________,因而使雕象遭到破坏.5.分子分散系是一种单相体系, 粗分散系是一种_________, 胶体分散系是一种_________.6.已知反应: 2NO+Cl2 =2NOCl,当CNO 增大一倍,其反应速度为原来的4倍,而C(Cl2) 增大一倍,其反应速度为原来的2倍,其反应速度方程为______________,该反应为___________级反应.7.含醋酸,醋酸钠各0.1mol·L-1的溶液90mL,加入10mL0.01mol·L-1的NaOH,加NaOH前溶液的pH值是________,加入NaOH后溶液的pH是_______. 已知KHAc=1.8×10-58.从水的E—pH图可知:(b)线代表_________________________________________处于电化学平衡时电极电势和pH值的关系线,(a) (a) 线代表________________________________________处于电化学平衡时电极电势和pH值的关系线。
9.稀有气体的第一个化合物—————————,,是由————————于————————年制备的。
博士生无机化学

中国原子能科学研究院博士研究生入学考试大纲无机化学一、指定参考书1.《无机化学》—武汉大学、吉林大学等校编第三版(高等教育出版社)二、考试范围和要求第一章绪论只作一般了解。
第二章物质的状态理解、掌握理想气体的状态方程、分压定律、扩散定律;深入理解气体分子的速度和能量分布规律。
理解液体蒸发过程与分子能量分布之间的关系;理解、掌握克劳修斯-克拉贝龙方程。
了解晶体和非晶体的区别;了解晶体外形与晶系的关系;了解晶格与晶胞的意义。
第三章原子结构理解波尔理论并理解波尔理论的缺陷;理解量子化的含义和原因;理解微观粒子的波粒二象性和有关规则。
掌握核外电子排布和元素周期系之间的规律,掌握核外电子排布的规则和屏蔽效应;要求能从元素在周期表中的位置判断元素的性质包括一些重要参数的量级如原子半径、电离能、电子亲和能和元素的电负性。
第四章化学键与分子结构理解离子键形成的物理基础和特点,理解离子的特征及其参数的意义;理解离子晶体的特性和晶格能的物理意义。
理解共价键形成的物理基础、规则及其特性;掌握杂化轨道理论及其基本要点,理解杂化轨道的类型;了解价层电子对互斥理论;掌握分子轨道理论及其基本要点;理解原子轨道线性组合的类型和原则。
理解键参数与分子性质之间的关系;了解分子晶体与原子晶体的区别,掌握分子间作用力与分子结构之间的关系,理解氢键理论和离子极化规律。
第五章氢和稀有气体了解氢元素的同位素,掌握氢的成键特性、氢的化学性质;了解稀有气体的性质和相关化合物。
第六章化学热力学初步了解化学热力学的意义、作用和局限性;掌握热力学第一定律及其基本概念,理解可逆过程的特点;深入理解和掌握热化学的原理和盖斯定律;理解生成热及其定义;理解利用键能计算反应热的道理;能根据热力学参数判断反应的方向;理解焓的物理意义和对化学反应方向的影响;掌握反应物和生成物的状态函数-吉布斯自由能,理解其使用规则,注意标准生成吉布斯自由能和生成热的区别。
第七章化学反应的速率理解化学反应速率的定义,掌握其表示方法;理解碰撞理论和过渡状态理论;深刻理解浓度、温度对化学反应速率的影响及其作用机理;了解催化剂的作用。
2011中科院长春应用化学研究所考博试题高等无机化学

2011 中科院长春应用化学研究所考博试题高等无机化学中国科学院长春应用化学研究所2011年招收攻读博士学位研究生入学考试试题科目名称:高等无机化学一、选择题 (每题1分,共40分)1. 在石墨晶体中碳原子层与碳原子层之间的作用力为( ) (A) 配位键 (B) 共价键 (C) 双键 (D) 范德华力2. 下列氢化物中,不属于典型的离子氢化物的是( ) (A) NaH (B) KH (C) BeH (D) BaH 223. 下列各物种中,属于有机金属化合物的是 ( )3+(A) Co(bipy) (B) Co(NO)(CO) 335+(C) [η-(C5H5)Co] (D) CHONa 225---4. CIO、BrO、和IO氧化性能力大小的顺序是 ( ) 444------(A) CIO>BrO>IO (B) CIO> IO > BrO 444444------ (C) CIO<BrO>IO (D) IO >BrO> CIO4444445. 下列轨道上的电子,在xy平面上的电子云密度为零的是 ( )2(A) 3S; (B) 3P (C) 3P (D) 3d xzz6. 镧系收缩的后果之一是使下列一对元素性质相似的是 ( ) (A) Mn 和 Tc(B) Ru 和 Rh (C) Nd和 Ta (D) Zr和 Hf 7. 下列各金属制容器中,能用来贮存汞的容器为 ( ) (A) 铁制 (B) 铅制 (C) 铜制 (D) 锌制8. 熔融SiO晶体时,需要克服的作用力主要是 ( ) 2(A) 离子键 (B) 氢键 (C) 共价键 (D) 范德华力第 1 页共 6 页9. 下列化合物中肯定不存在的是 ( )(A) BN (B) POCl (C) NCl (D) SiF 35410. 下列各氧化态的含氧酸中,酸性最强的是 ( )(A) Ti (IV)(B) V (V)(C) Cr (VI) (D) Mn (VII)-13-111. 当速率常数的单位为mol?dm?s时,反应级数为 ( )(A) 一级(B) 二级(C) 零级 (D) 三级12. 下列物质中,能溶于硫化铵溶液的是 ( )(A) SnS(B) SnS(C) PtS (D) BiS 223-3 13. 将0.1 mol?dm下列溶液加水稀释1倍后,pH变化最小的是 ( )(A) HCl(B) HSO(C) HNO (D) HAc 24314. 空气中含有NO、CO、CH、O、含氟化物等等会引起光化学x243污染、空洞效应、温室效应等破坏环境的作用。
2018年华侨大学考博试题3081综合考试(无机化学+有机化学)

华侨大学2018年博士研究生入学考试专业课试卷(答案必须写在答题纸上)招生专业材料科学与工程科目名称综合考试(无机化学+有机化学)科目代码3081无机化学部分(每题10分,共50分)1.有一放热的可逆反应2A(g) + B(s) C(g),达到平衡时,如果改变下述条件,各项常数或化学平衡将如何变化?改变条件正反应速率速率常数k正平衡常数平衡移动方向增加C的分压①不变②向左增加总压力③④不变⑤升高温度变大变大⑥⑦使用催化剂增大⑧⑨⑩2.①已知CO(g)的标准摩尔生成焓为△f H mӨ(CO,g)=-110.53 kJ·mol-1,则反应2C(s)+O2(g) ==2 CO(g)的热效应为△r H mӨ= ?②能量守恒定律用公式可表示为:ΔU=Q+W。
对于恒压条件下,且只做体积功时的化学反应,该式变为△r U mӨ=△r H mӨ+W =△r H mӨ-pΔV,试问反应2C(s)+O2(g) ==2 CO(g)在298K和恒压100kPa条件下,△r U mӨ为多少?(提示:恒压条件下的体积功可通过理想气体状态方程加以转换)3.①什么是稀溶液的依数性,试举出两种依数性,并针对这两种依数性说明在生活或生产上的应用。
②1Kg水中含45.0g某非电解质的溶液于-0.465℃时结冰,则该非电解质的相对分子质量约为多少?已知水的凝固点下降常数K f= 1.86 K·mol -1·kg-1。
4.①某吸热反应A(g)+2B(g)==3C(g),其速率方程为v=k[A]0.5[B]2.5,问为了加快该反应的速率,最有效的措施是什么?除了这一措施你还可以采用哪些方法加快反应速率?用碰撞理论具体说明这些措施是如何增大反应速率的。
②反映温度对速率常数k 影响的阿仑尼乌斯公式为:RTEa Aek-=,请说明活化能Ea 的大小对反应速率的影响,并举一例说明实际应用中是如何实行的。
5.能斯特方程是反映非热力学标态下,各种因素对电极电位的影响。
化学专业《无机化学》试卷及答案解析

化学专业《无机化学》试卷及答案解析一、单项选择题(在每小题列出的四个选项中只有一个选项是符合题目要求的,请选出正确选项并在“答题卡”的相应位置上涂黑。
多涂、少涂、错误均无分。
每小题2分,共60分)1、设氨水的解离平衡常数为θb K 。
浓度为m mol·L -1的氨水溶液,若将其用水稀释一倍,则溶液中OH -的浓度(mol·L -1)为 ( ) Am 21 B θb K m ⋅21 C 2/m K b ⋅θD 2m2、已知θsp K (Ag 3PO 4) = 1.4×10-16,其溶解度为( )A 1.1×10-4mol·L -1;B 4.8×10-5mol·L -1;C 1.2×10-8mol·L -1;D 8.3×10-5mol·L -1 3、下列各组物质,能自发发生反应的是 ( )A Cu 、Cu 2+;B Cr 2O 72-、Cr 3+;C MnO 2、Mn 2+;D SnCl 4、Sn4、3d 轨道的磁量子数可能是 ( )A 1,2,3B 0,1,2C 0,±1D 0, ±1, ±25、下列各分子中,以sp 3不等性杂化轨道成键的是 ( ) A BeCl 2 B PCl 3 C BF 3 D SiH 46、熔化下列晶体时,只需克服色散力的是 ( )A HFB AgC KFD CO 27.已知V E A/θ:Cr 2O 72- +1.36 Cr 3+ -0.41 Cr 2+-0.86 Cr ,则判断发生歧化反应的是 ( )A 都不能B Cr 2O 72-C Cr 3+D Cr 2+ 8.下列各物质中,熔点最高的是 ( )A K 2OB MgOC CaOD Na 2O9.反应 A + B C ,焓变小于零,若温度升高10℃,其结果是 ( )A.对反应没有影响B. 使平衡常数增大一倍C.不改变反应速率D.使平衡常数减小10.在HAc-NaAc 缓冲溶液中,若[HAc]>[NaAc],则该缓冲溶液 ( )A.抗酸能力强于抗碱能力B.抗酸能力弱于抗碱能力C.抗酸能力等于抗碱能力D.无法判断11.在室温下,0.0001mol .L -1 NH 3水溶液中的pKw 是 ( ) A. 14 B. 10 C.4 D.812.按酸碱质子理论考虑,在水溶液中既可作酸亦可作碱的物质是 ( ) A.Cl-B. NH 4+C. HCO 3-D. H 3O +13.AgCl 在纯水中溶解度比0.10 mol·L -1NaCl 溶液中 (AgCl: K sp =1.77×10-10 ) ( )A.大B.小C.一样大D.无法判断14.CaSO4在0.1mol.L-1NaNO3溶液中的溶解度比在纯水中( )A.略有减小B.略有增加C.相等D.无法判断15.已知:Ksp,AgCl=1.8×10-10,Ksp,Ag2CrO4=1.1×10-12在等浓度的CrO42-和Cl-的混合溶液中,逐滴加入AgNO3时:()A.先产生AgCl↓B.先产生Ag2CrO4↓C.两种同时沉淀D.两者都不沉淀16.在酸性溶液中,当适量的KMnO4与Na2SO3反应时出现的现象是()A. 棕色沉淀B. 紫色褪去C.绿色溶液D.都不对17.下列电对中值最大的是( )A . (Ag+/Ag)B . (Ag(NH3)2+/Ag)C . (AgCl /Ag)D . (AgI/Ag)18.当pH = 10 时,氢电极的电极电势是- ( )A.-0.59 VB. -0.30 VC. 0.30 VD. 0.59 V19.4s电子的径向分布图有: ( )A.3个峰B.2个峰C.4个峰D.1个峰20.属于主量子数n= 3 的一个电子的四个量子数n,l,m,m s 取值正确的是( )A. 3,2,1,0B.3,2, -1,C. 3,3,1,D. 3,1, 2,21.量子力学中所说的原子轨道是指( ) A.波函数ψn,l,m,ms B.电子云C.波函数ψn,l,m D.概率密度22.ψ(4,2,1)代表简并轨道中的一个轨道是( ) A.4p轨道B.4d轨道C.4s轨道D.4f轨道23.下列轨道上的电子,在xy平面上的电子云密度为零的是()A.3S B.3P x C.3Pz D.3Py24.某元素原子基态的电子构型为[Ar] 3d 8 4s2 ,它在元素周期表中的位置是()A.s区B.p区C.d区D.f区25. Ag的价电子层结构是()A.3d 10 4s1 B.3d 9 4s2C.4d 10 5s1D.4d 10 4s226.下列各分子中,偶极矩为零的分子为( )A.H2 O B.NH3 C.BF3 D.HCl27.下列化合物中没有氢键的是( )A.C2H4B.NH3C.HFD.H2O28.NH3中N原子采取的杂化方式是:()A. SP2B. SP3等性C. SP2dD. SP3不等性29.[Ni(en)3]2+离子中镍的价态和配位数是()A.+2,3 B.+3,6 C.+2,6 D.+3,330. Fe(Ⅲ)形成的配位数为6 的外轨配合物中,Fe3+离子接受孤对电子的空轨道是( )A.d2sp3B.sp3d2 C.p3d3D.sd5二、判断题(判断正确答案,选项并在“答题卡”的相应位置填涂,认为正确的涂“A”错误的涂“B ”。
无机化学北大试题及答案

无机化学北大试题及答案无机化学是化学学科的一个重要分支,它主要研究无机物质的结构、性质、反应及其应用。
以下是一份模拟的无机化学试题及其答案,供参考。
一、选择题(每题2分,共20分)1. 以下哪种元素的原子序数为26?A. 铁B. 铜C. 锌D. 铁答案:C. 锌2. 哪种化合物的化学式为NaCl?A. 氯化钠B. 氯化钾C. 氯化镁D. 氯化钙答案:A. 氯化钠3. 以下哪种元素属于碱土金属?A. 锂B. 钠C. 钾D. 钙答案:D. 钙4. 哪种元素的电子排布为1s² 2s² 2p⁶ 3s² 3p⁶?B. 氧C. 氮D. 氖答案:D. 氖5. 以下哪种化合物是共价化合物?A. NaClB. HClC. MgOD. Fe答案:B. HCl6. 哪种元素的原子半径最大?A. 氢B. 氦C. 锂D. 铯答案:D. 铯7. 以下哪种化合物是离子化合物?A. H₂OB. CO₂C. NaClD. CH₄答案:C. NaCl8. 哪种元素的电子排布为[Ar] 3d⁵ 4s¹?A. 铬B. 锰C. 铁答案:C. 铁9. 以下哪种化合物是酸性氧化物?A. CO₂B. SO₂C. NO₂D. SiO₂答案:D. SiO₂10. 哪种元素的原子序数为29?A. 铜B. 镍C. 钴D. 锌答案:B. 镍二、填空题(每空1分,共20分)1. 元素周期表中,第IA族元素的价电子数为____。
答案:12. 元素的电负性越大,其非金属性越____。
答案:强3. 元素周期表中,第VIII族元素的价电子数为____。
答案:84. 在周期表中,同一周期的元素,从左到右,原子半径逐渐____。
答案:减小5. 元素的电离能越大,其金属性越____。
答案:弱6. 元素的电负性越小,其非金属性越____。
答案:弱7. 元素周期表中,第IIIA族元素的价电子数为____。
答案:38. 在周期表中,同一族的元素,从上到下,原子半径逐渐____。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.简述晶体状态与结构。
4.简述化学电源的分类,并举例说明。
七、任选两题回答(每题5分 =乙二胺)的所有几何异构体,指出那几个是手性离子。
2.请给出[Rh(CO)2I2]-离子催化甲醇羰基化催化循环图并指出其中的氧化加成和还原消除反应。
2.碱金属Na,K等可在液氨中溶解。它们的稀溶液呈什么颜色,由什么引起的?可以用什么实验手段来验证,说明原理。
3.什么是“镧系收缩”?哪些镧系元素显示有非+3价态?
4.简述储氢材料与技术。
5.你知道哪些生命元素(即生命体必需的元素)?其中哪些是微量元素?
四、简述下列实验方法的基本原理(任选二题,每题5分,共10分)
3.简述能斯特方程与电极反应电势之关系。
4.例举2种中文及3种英文全称的化学专业学术期刊。
3.
A.给出4d3组态的一个原子或离子的基谱项。
B.给出下列给定量子数(L, S)的Russel-Saunders谱项符号:
(a) (0, 5/2), (b) (3, 3/2), (c) (2, 1/2)
4.简述水热合成。
三、回答下列问题(任选二题,每题5分,共10分)
1.简述二种以上实验室保护气中微量氧气的去除方法,说明其优缺点。
二、下列三题中任选二题(每题10分,共20分)
1.简述原子的电子结构与元素周期系。
2.回答下列问题:
A.化合物closo-1,2-C2B10H12亲核反应优先发生在哪个位置?请画出其结构示意图。
B.下列离子:Al3+, Sn2+, Sn4+, Fe2+中哪些不能形成反馈键,为什么?
C.V(CO)6具有顺磁性,而Mn(CO)4(NO)具有抗磁性,试加以解释。
2.讨论下列化合物中羰基伸缩频率的变化趋势。
化合物Py3Mo(CO)3(Ph3P)3Mo(CO)3(Ph3As)3Mo(CO)3(Cl3As)3Mo(CO)3
吸收峰/cm-11888, 1746 1949,1835 1957, 1847 2031, 1992
六、任选两题回答(每题5分,共10分)
1.请画出Cr(CO)4L2同分异构体并讨论他们的红外活性
南开大学2010年博士研究生入学考试试题
学院:051化学学院
考试科目:2301高等无机化学
专业:无机化学、材料物理与化学
注意:请将所有答案写在专用答题纸上,答在此试题上无效!!答题时注明题号。
一、解释下列术语(任选15小题,每小题2分,共计30分)
(1)π酸配体(2)氢能源(3)热核反应(4)配合物的配位数(5)晶体的点缺陷(6)金属有机化合物(7)热重反应(8)Jahn-Teller效应(9)纳米科技(10)等瓣关系(11)原子簇化合物(12)分子筛(13)无机功能材料(14)Wade规则(15)18电子规则(16)电子给体与电子受体(17)非晶硅(18)溶胶-凝胶合成法(19)金属蛋白与金属酶(20)配位聚合物(21)空隙化合物(22)分子基材料(23)化学光谱系列(24)轻稀土元素(25)非化学计量比化合物(26)金属羰基化合物(27)禁带能(28)螯合效应(29)席夫碱(30)模板效应
1.X射线衍射(XRD)
2.扫描电镜(SEM)和透射电镜(TEM)
3.红外-拉曼光谱(IR-Raman)
4.X射线光电子能谱(XPS)
5.BET表面积
6.热分析(如TG等)
7.核磁共振(NMR)
8.电子顺磁共振(ESR)
五、下列两题任选一题(10分)
1.何谓无机固相反应,在固相反应过程中,通常应包括哪些基本步骤。
