(完整版)2017年上海市宝山区高考化学二模试卷
上海市高考化学二模试卷

上海市高考化学二模试卷姓名:________ 班级:________ 成绩:________一、选择题 (共8题;共16分)1. (2分) (2017高一上·清远期中) NA表示阿伏伽德罗常数,下列说法正确的是()A . 16g氧气和臭氧的混合物中含有的氧原子数为NAB . 标准状况下,22.4 L水中含有的氧原子数为NAC . NA个氯气分子的体积为22.4LD . 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有的Cl﹣个数为NA2. (2分) (2018高一下·宝坻月考) 工业上制硫酸的一步重要的反应是SO2在400-500℃下催化氧化反应:2SO2+O2 2SO3 ,该反应是个正反应放热的可逆反应。
如果反应在密闭容器中进行,下列有关说法中错误的是()A . 使用催化剂的目的是加快反应速率,提高生产效率B . 在上述条件下,SO2不可能100%地转化为SO3C . 增加O2的浓度,可以提高SO2的转化率D . 当SO2和SO3的浓度相等时,反应一定达到平衡3. (2分)一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2﹣.下列说法正确的是()A . 在熔融电解质中,O2﹣向正极定向移动B . 电池的总反应是:2C4H10+13O2═8CO2+10H2OC . 通入空气的一极是正极,电极反应为:O2+4e﹣+2H2O═4OH﹣D . 通入丁烷的一极是负极,电极反应为:C4H10+26e﹣+13O2﹣═4CO2↑+5H2O4. (2分) 2009年4月22日是第40个世界地球日,今年世界地球日的主题是“绿色世纪”。
下列行为不符合这一主题的是()A . 分类回收、利用垃圾,减少资源浪费B . 推广使用一次性木筷,减少疾病传染C . 开发风能等洁净能源,减少使用化石燃料D . 研究煤和石油脱硫新技术,减少酸雨发生5. (2分) (2016高三上·晋城期末) CuSO4是一种重要的化工原料,有关制备途径及性质如图所示.下列说法错误的是()A . 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2B . 相对于途径①、③,途径②更好地体现了绿色化学思想C . 生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②<③D . 利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol6. (2分) (2019高二下·杭州月考) 将装有60mLNO2、NO混合气的量筒倒立于水槽中,反应后气体体积缩小为40mL,则混合气体中NO2和NO的体积比是()A . 5︰3B . 2︰3C . 1︰1D . 2︰17. (2分)在溶液(NH4)2SO4中,离子浓度大小顺序正确的是()A . c(NH4+)>c(SO42﹣)>c(H+)>c(OH﹣)B . c(SO42﹣)>c(NH4+)>c(OH﹣)>c(H+)C . c(NH4+)>c(SO42)>c(OH﹣)>c(H+)D . c(SO42﹣)>c(H+)>c(NH4+)>c(OH﹣)8. (2分)下列选项错误的是()A . 在NH4C1晶体中含有离子键和共价键B . 设想把“H2+Cl22HCl”设计成燃料电池,用于工业制盐酸,并进行发电C . 某反应△H>0,△S>0,该反应是个非自发反应D . 25℃时,NaNO2溶液的pH=8,c(Na+)-c(NO2-)=9.9×10-7mol·L-1二、解答题 (共9题;共49分)9. (6分)如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已省略).(1)装置A是氯气的发生装置,期中盛放浓盐酸的仪器名称是________,请写出反应的化学方程式:________.(2)装置B中的饱和食盐水的作用是________.(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入的物质的组合应该是________.(填字母编号)编号I II IIIa干燥的有色布条碱石灰湿润的有色布条b干燥的有色布条无水硫酸铜湿润的有色布条c湿润的有色布条浓硫酸干燥的有色布条d湿润的有色布条无水氯化钙干燥的有色布条(4)装置F的作用是________,其烧杯中的溶液不能选用下列中的________.a.饱和NaOH溶液 b.饱和Ca(OH)2溶液c.饱和Na2SO3溶液 d.饱和Na2CO3溶液.10. (9分)在两支试管中分别加入3mL稀盐酸(均足量),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中.(1)①Ⅰ试管和Ⅱ试管中分别发生反应的离子方程式:________②两支试管中的现象为________③两试管中气球大小(不包含试管)体积之比约为Ⅰ:Ⅱ=________(填最简单整数比)④甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3粉末的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.甲得出的结论是否正确________.(填“正确”或“不正确”)(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):序号试剂1试剂2混合前温度混合后最高或最低温度①50mL水 2.5gNaHCO3固体20℃18.5℃②35mL水 3.2gNa2CO3固体20℃23.3℃③35mL稀盐酸含2.5gNaHCO3的饱和溶液15mL20℃18.8℃④50mL稀盐酸含3.2gNa2CO3的饱和溶液15mL20℃21.2℃⑤50mL稀盐酸 2.5gNaHCO3固体20℃17.4℃⑥50mL稀盐酸 3.2gNa2CO3固体20℃24.4℃请你帮助填写相关内容:该实验中所用的仪器除试管、药匙(或V形纸槽)、气球、环形玻璃搅拌棒、胶头滴管、烧杯、量筒、保温瓶外,还需要的仪器名称为________和________.通过上述实验可得出三条结论:a:NaHCO3的溶解是________(吸热或放热)过程b:Na2CO3的饱和溶液和盐酸的反应是________(吸热或放热)反应;C:NaHCO3的饱和溶液和盐酸的反应是________(吸热或放热)反应.11. (9分)(1)下列反应中,属于放热反应的是________ ,属于吸热反应的是________ .①煅烧石灰石②木炭燃烧③炸药爆炸④酸碱中和⑤生石灰与水作用制熟石灰⑥食物因氧化而腐败(2)用铜、银与硝酸银设计一个原电池,此电池的负极是Cu ,负极的电极反应式是________ .(3)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25g,铜表面析出了氢气________ L(标准状况),导线中通过________ mol电子.(4)某化学反应,设反应物的总能量为E1 ,生成物的总能量为E2 ,若E1>E2 ,则该反应为________ 热反应,该反应过程可以看成________ .中和反应都是________ 热反应,其实质是(用化学语言填空)________ .12. (8分)(2018·重庆模拟) 药物F具有抗肿瘤、降血糖、降血压等多种生物活性,其合成路线如下:已知:M的结构简式为:。
2017二模实验大题汇编-教师版

2017二模实验大题汇编1. (宝山区)孔雀石主要含Cu 2(OH)2CO 3,以及少量Fe 、Si 的化合物。
可以用孔雀石为原料制备胆矾(CuSO 4·5H 2O ),步骤如下:请回答下列问题:35. 试剂①是一种常见的酸,写出其化学式 。
过滤所需要的玻璃仪器有 。
36. 实验室检验Fe 3+的常用方法是 。
37. 溶液A 中的金属离子有Cu 2+、Fe 2+、Fe 3+,上述流程中需要用试剂②将溶液A 中的Fe 2+全部转化为Fe 3+,从而形成溶液B ,则试剂②能否用氯水 (填“能”或“不能”,若“不能”,请解释原因)。
38. 由溶液C 获得胆矾,需要经过 、 、过滤等操作。
39. 取25.00mL 溶液A ,用1.000×10-2mol/LKMnO 4标准溶液滴定。
反应离子方程式为:5Fe 2++MnO 4-+8H +→5Fe 3++Mn 2++4H 2O ,若消耗标准溶液20.00mL ,则溶液A 中Fe 2+的浓度为 。
35. H 2SO 4;漏斗、烧杯、玻璃棒36. 取样,向其中滴加KSCN 溶液,溶液呈血红色,则含有Fe 3+。
37. 不能,会引入新的杂质 38. 蒸发浓缩;冷却结晶 39. 0.040mol/L2. (崇明区)化学实验是进行科学探究、探求新知识的重要途径。
某学习小组的同学设计如下装置探究铜片与稀硫酸的反应(加热、夹持装置略去)。
探究Ⅰ SO2的性质:孔雀石2SiO 2溶液A 试剂②溶液BFe(OH)3溶液C胆矾A 中铜片与稀硫酸的反应方程式为:___________________________________。
实验进行一段时间后,发现C 中产生白色沉淀,经检验该沉淀为BaSO 4。
同学甲分析: A 中温度过高, 产生副产物 SO 3, SO 3 进入 C 中与 BaCl 2反应生成 BaSO 4。
你认为甲的分析合理吗?请说明理由。
2018年上海市宝山区高三二模化学试卷(精校版Word版含答案)

C. V1=V2>V3
D. V3>V2=V1
二、综合题
(一)本题共15分
海洋是资源的宝库。占地球上储量99%的溴分步在海洋中,我国目前是从食盐化工的尾料中提取溴,反应原理是:Cl2+2Br-→2Cl-+Br2。
21.氯原子最外层电子轨道表示式是______________,氯气属于________分子(填写“极性”或“非极性”)。
C.H2和H+
D.冰和干冰
6.配制500mL0.1mol/L的Na2CO3溶液时,不需要用到的仪器是
A.烧杯
B.干燥器
C.玻璃棒
D. 500mL容量瓶
7.下列关于Fe的性质错误的是
A.有银白色光泽
B.能被磁铁吸引
C.遇硫酸钝化
D.能和水蒸气反应
8.下列固体溶于水时吸热的是
A.氯化铵
B.氢氧化钠
C.氧化钙
D.通电一段时间后,溶液pH值减小
17.漂粉精的有效成分是Ca(ClO)2,它会和空气中的CO2发生反应,生成具有消毒作用的HClO。下列表示该过程的离子方程式正确的是
A.Ca2++2ClO-+CO2+H2O→CaCO3↓+2HClO
B. ClO-+CO2+H2O→HCO3-+HClO
C. Ca2++2ClO-+2CO2+2H2O→Ca(HCO3)2+2HClO
D. Ca(ClO)2+2CO2+2H2O→Ca2++2HCO3-+2HClO
18.有学生为了证明SO2是一种酸性氧化物,做了以下实验:向滴有酚酞的氢氧化钠溶液中通入过量的SO2气体,溶液褪色。关于该实验下列说法错误的是
2020届上海市宝山区2017级高三下学期二模考试理科综合化学试卷及答案

2020届上海市宝山区2017级高三下学期二模考试
理科综合化学试卷
★祝考试顺利★
考生注意:
1.本试卷满分 100 分,考试时间 60 分钟。
2.本试卷设试卷和答题纸两部分,试卷包括试题与答题要求;所有答案必须涂或写在答题纸上;做在试卷上一律不得分。
3.答题前,考生务必在答题纸上用钢笔或圆珠笔在答题纸正面清楚地填写姓名、准考证号。
4.答题纸与试卷在试题编号上是一一对应的,答题时应特别注意,不能错位。
相对原子质量:O—16 Na—23 Cl—35.5 H—1 Fe—56 S—32
C—12
一、选择题(共 40 分,每小题 2 分,每题只有一个正确选项)
1.下列不属于合金的是
A.生铁B.黄金C.硬铝D.黄铜
2.某原子的轨道表示式如下, 从中得到的信息错误的是
A.有 2 个电子层B.有 3 种能量不同的电子
C.最外层有 3 个电子D.有 7 种运动状态不同的电子
3.清洁的水对人类的生存非常重要,关于 H2O 的描述正确的是
A.含有非极性键和极性键B.纯水几乎不导电,属于非电解质
C.带静电的玻璃棒接近,水流会发生偏转D.水分子间作用力大,所以加热很难分解
4.“浓硫酸使蔗糖脱水”实验中浓硫酸没有体现出的性质是A.酸性B.吸水性C.脱水性D.强氧化性
5.把少量硫酸铜固体加入饱和硫酸铜溶液中,不可能出现的是
A.溶液颜色变浅B.有固体析出C.溶液浓度不变D.溶液体积减小
6.已知:4Al(s)+ 3O2(g) →2Al2O3 (s)+Q kJ(Q>0)。
下列能量图与该反应所体现的能量关系匹配的是
A B C D
7.硝酸是一种常见的强酸,下列关于浓、稀硝酸的描述错误的是。
2017上海各区二模化学卷答案详解6

2017上海各区二模化学习题答案详解6一、2017年上海市嘉定区二模卷答案详解44 Na2OH+H2SO4==Na2SO4+H2OA 对Na2OH+CuSO4== Na2SO4+Cu(OH)2↓B 错误BaCl2+ H2SO4==BaSO4↓+2HCl, BaCl2+ Na2SO4== BaSO4↓+2NaCl H2SO4和Na2SO4都能与BaCl2反应生成白色沉淀C 对氢前金属与酸反应生成氢气D 对酚酞遇碱变红45 氢氧化钠变质的方程式2NaOH+CO2==Na2CO3+H2O1)对Na2CO3+2HCl==2NaCl+CO2↑,CO2+Ca(OH)2==CaCO3↓+H2O 能检验是否变质2)错Na2CO3+Ca(OH)2== CaCO3↓+2NaOH, 滤液中存在反应后生成的NaOH,加酚酞只能显示滤液呈碱性,不能说明样品里是否含有NaOH,有可能存在完全变质的情况,而这种方法不能确定成分。
3)错Na2CO3+2HCl==2NaCl+CO2↑+H2O,NaOH+HCl==NaCl+H2O 因为氢氧化钠固体能吸收水和CO2气体,导致反应后的CO2质量测量不准确,无法测定纯度。
4)对,Na2CO3+Ca(OH)2== CaCO3↓+2NaOH,反应后得到NaOH,故滤掉固体得到纯净的NaOH。
答案 D(14)46 A 错,锌与足量盐酸反应完之后质量应该为零,图中不为0B 错误,Cu+2AgNO3==Cu(NO3)2+2Ag, 1mol的铜质量为63.5克,生成2mol的银质量为216克,因此固体质量是逐渐增加的,与图相反。
C正确Zn+2HCl==ZnCl2+H2↑Mg+2HCl==MgCl2+H2↑2mol稀盐酸,需要24克镁,65克锌,镁的活性强,产生氢气的速度更快。
D 错误,2KClO3=MnO2=2KCl+3O2↑反应时氯酸钾不断消耗,固体质量不断减少,而锰元素的质量不变,所以质量分数反而慢慢变大。
上海市宝山区2017年高三二模化学试卷(含解析)

2017年上海市宝山区高考化学二模试卷一、选择题:(本题共40分,每小题2分,毎题只有一个正确选项.)1.甲状腺大的病人需要多吃海带,这是因为海带中含有较多的()A.氯元素B.钠元素C.碘元素D.铁元素2.酸雨的pH值是()A.<7 B.<6.5 C.<6 D.<5.63.属于工业固氮的是()A.N2与O2反应生成NOB.由NH3转变成 NH4HCO3C.N2与H2在一定条件下反应生成NH3D.豆科植物的根瘤吸收氮4.有关HF和HCl判断正确的是()A.键长:HF>HClB.键能:HF>HClC.稳定性:HCl>HFD.共用电子对偏移程度:HCl>HF5.不能用来鉴别乙醛、乙酸的试剂是()A.水B.石蕊试液C.银氨溶液 D.新制的氢氧化铜溶液6.将两种互不相溶的液体分离的方法是()A.分液 B.结晶 C.纸层析D.过滤7.按照有机物的命名规则,下列命名正确的是()A.1,2﹣二甲基戊烷 B.2﹣乙基丁烷C.3﹣乙基己烷D.3,4﹣二甲基戊烷8.下列试剂中,可以鉴别二氧化碳和二氧化硫的是()A.澄清石灰水B.品红溶液C.湿润的蓝色石蕊试纸D.硝酸银溶液9.某老师批阅学生实验报告,下列哪些学生是以科学的态度记录实验数据的()A.甲学生用电子天平称取NaOH固体1.220gB.乙学生用广泛pH试纸测定溶液的酸碱性:pH=14.5C.丙学生用碱式滴定管取25.0mL0.lmol/L的盐酸D.丁学生用50mL 量筒量取46.70mL浓盐酸10.下列事实与盐类水解无关的是()A.氯化铝溶液蒸干后灼烧得不到无水氯化铝B.氯化铁溶液常用作制印刷电路板的腐蚀剂C.常用热的纯碱溶液除去油污D.长期施用硫酸铵易使土壤酸化11.下列物质的工业生产原理不涉及氧化还原反应的是()A.氨气 B.纯碱 C.硫酸 D.烧碱12.用如图所示装置电解氯化钠溶液(X、Y 是碳棒).下列判断正确的是()A.X电极为阴极B.Y电极为负极C.X电极表面发生氧化反应D.Y电极表面有氯气生成13.在密闭容器中,反应2SO2(g)+O2(g)=2SO3(g)达到平衡后,若将容器体积缩小一半,对反应产生的影响是()A.V(正)减小,V(逆)增大B.V(正)增大,V(逆)减小C.V(正)、V(逆)都减小 D.V(正)、V(逆)都增大14.布洛芬片常用来减轻感冒症状,其结构简式如图,下列有关说法错误的是()A.布洛芬的分子式为C13H18O2B.布洛芬与苯乙酸是同系物C.1mol 布洛芬最多能与3mol 氢气发生加成反应D.布洛芬在苯环上发生取代反应,其一氯代物有4种。
11、学2017年高三二模-有机大题
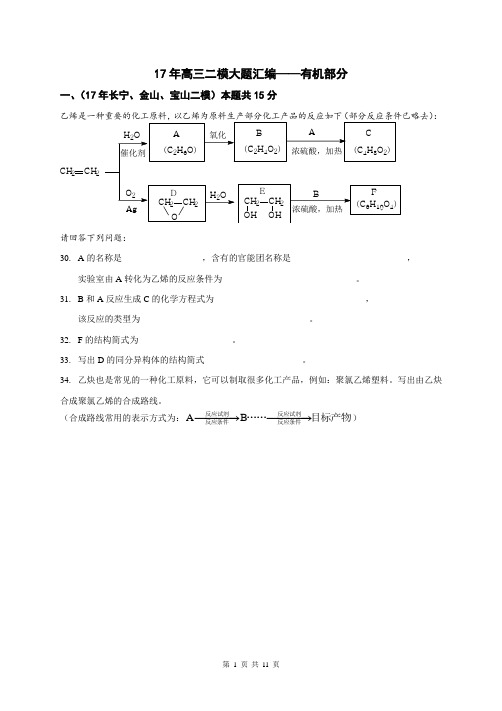
17年高三二模大题汇编——有机部分一、(17年长宁、金山、宝山二模)本题共15分:请回答下列问题:30. A 的名称是__________________,含有的官能团名称是__________________________,实验室由A 转化为乙烯的反应条件为______________________________。
31. B 和A 反应生成C 的化学方程式为__________________________________,该反应的类型为______________________________________。
32. F 的结构简式为_____________________。
33. 写出D 的同分异构体的结构简式______________________。
34. 乙炔也是常见的一种化工原料,它可以制取很多化工产品,例如:聚氯乙烯塑料。
写出由乙炔合成聚氯乙烯的合成路线。
(合成路线常用的表示方式为:A B −−−−→−−−−→反应试剂反应试剂反应条件反应条件……目标产物)CH 2CH 2有机物F是合成多种药物的重要中间体,一种合成路线如下:回答下列问题:38.写出反应类型。
反应①是_____________反应,反应④是______________反应。
39.化合物A中有___________种官能团,写出含氧官能团的结构式________________________ 。
40.化合物C的俗名是肉桂醛,其分子式是________________________。
写出肉桂醛跟新制Cu(OH)2在煮沸条件下发生反应的化学方程式__________________________________________ 。
41.由肉桂醛()和乙酸制备的合成路线如下:________________________________________________________________________请将该合成路线补充完整(无机试剂任选)。
2017-2018学年上海各区高三化学二模II卷大题专题汇编——有机化学((精校Word含答案版))
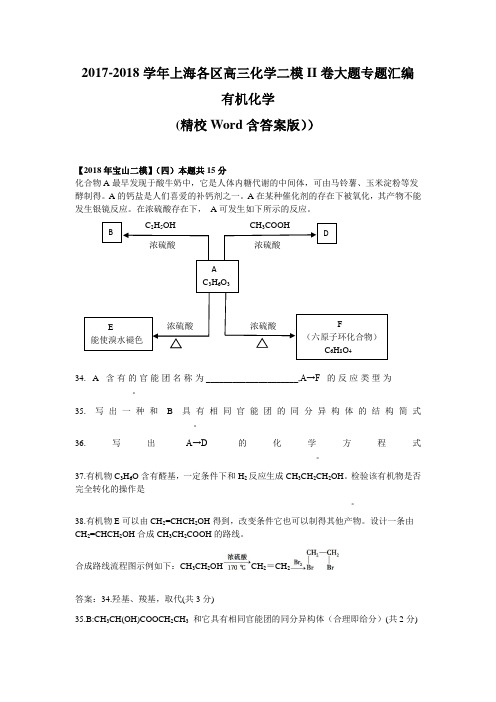
B DAC3H6O3E能使溴水褪色F(六原子环化合物)C6H8O42017-2018学年上海各区高三化学二模II卷大题专题汇编有机化学(精校Word含答案版))【2018年宝山二模】(四)本题共15分化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得。
A的钙盐是人们喜爱的补钙剂之一。
A在某种催化剂的存在下被氧化,其产物不能发生银镜反应。
在浓硫酸存在下,A可发生如下所示的反应。
C2H5OH CH3COOH浓硫酸浓硫酸浓硫酸浓硫酸34. A含有的官能团名称为_____________________,A→F的反应类型为____-_____________。
35. 写出一种和B具有相同官能团的同分异构体的结构简式___________________________。
36.写出A→D的化学方程式_______________________________________________________。
37.有机物C3H6O含有醛基,一定条件下和H2反应生成CH3CH2CH2OH。
检验该有机物是否完全转化的操作是_______________________________________________________________。
38.有机物E可以由CH2=CHCH2OH得到,改变条件它也可以制得其他产物。
设计一条由CH2=CHCH2OH合成CH3CH2COOH的路线。
合成路线流程图示例如下:CH3CH2OH CH2=CH2答案:34.羟基、羧基,取代(共3分)35.B:CH3CH(OH)COOCH2CH3和它具有相同官能团的同分异构体(合理即给分)(共2分)浓硫酸36. CH3CH(OH)COOH+CH3COOH →CH3CH(COOH)OOCCH3+H2O (共3分)37.取样,加入新制氢氧化铜,煮沸,观察是否有砖红色沉淀生成,若有砖红色沉淀生成,则未全部转化;若没有砖红色沉淀生成,则已全部转化。
2017学年宝山区高三化学等级考二模试题与参考答案

宝山区2017学年第二学期期中高三年级化学学科等级考质量监测试卷考生注意:K本试卷满分100分,考试时间60分钟。
2、本试卷设试卷和答题纸两部分,试卷包括试题与答题要求;所有答案必须涂或写在答题纸上;做在试卷上一律不得分。
3、答题前,考生务必在答题纸上用钢笔或圆珠笔在答题纸正面清楚地填写姓名、准考证号。
4、答题纸与试卷在试题编号上是一一对应的,答题时应特别注意,不能错位。
相对原子质量:H—1 0—16 F—19 S i —28 Na—23 C—12一、选择题(本题共40分,每小题2分,每题只有一个正确选项)1. 下列物质属于纯净物的是A.硬铝B.胆矶C.生铁D.钢2. 下列离子在稳定人体血液的pH中起作用的是A. Na +B. Fe2+3. 属于人工固氮的是A. 分离液态空气制氮气C.闪电时N2转化为N04. 下列不属于煤干f留产物的是A.焦炭B.煤焦油C. HCOsD. CIB.工业合成氨D.豆科作物根瘤N2转化为NHaC.焦炉气D.人造石油C. H2和HD.冰和干冰7. 下列关于Fe的性质错误的是A.有银白色光泽B.能被磁铁吸引8. 下列固体溶于水时吸热的是A.氯化钱B.氢氧化钠9. 关于乙烯的说法错误的是A.含有两种共价键C.形成的晶体是原子晶体10.蒸气放出确的是C.遇硫酸钝化 D.能和水蒸气反C.氧化钙 D.过氧化钠B. 能使溟水褪色D.可作果实催熟已知1mol氢气和氧气完全燃烧生成水241.8千焦热量,下列热化学方程式正5. 下列微粒中,互为同位素的是A. 12C 和14CB. 02 和03 6.配制500mL0. 1mol/L的Na2COs溶液时,不需要用到的仪器是A.烧杯B.干燥器C.玻璃棒D. 500mL容量瓶A. 2H 2 (g) +O2 (g) T2H20 (g) +241.8kJB. H2 (g) +1/202 (g) TH2O (s)+241.8 kJC. H2 (g) +1/202 (g) TH2O (g) -241.8 kJD. H2O (g) TH2 (g) +1/202 (g) 一241.8 kJ11. 不能鉴别乙醇和乙酸的方法是 A.观颜色B.闻气味C.加石蕊试液D.用pH 试纸12.工业制硫酸的适宜条件不包括A.矿石粉碎成粉末可加快反应速率 C. S02转化为S03时用铁触媒作催B.原料气进入接触室之前需净13. S 、CI 是常见的两种非金属元素,下列半能縄翟的是A.最外层电子数:S<CIB.原子半径:n m cc no/ iMnhh 工玄;ffi 久 nTX il/r gc.C.热稳定性:H2S<HC ID.非金属性:S<CI15.下列关于实验室制备乙酸乙酯和乙酸丁酯的描述正确的是 A.均采用水浴加热B.均采用边反应边蒸憎的方法C.制备乙酸乙酯时乙醇过量D.制备乙酸丁酯时正丁醇过量16.右图是电解CuCl2溶液的装置,其中c 、d 为石墨电 极。
2017届上海市虹口区宝山区崇明区黄浦区高三化学二模4份组合卷(含答案)

虹口区2016 学年度高三化学二模试卷相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Fe-56 Cu- 64一、选择题(本题共40分,每小题2分,每题只有一个正确选项)1.下列变化属于物理变化的是()A.煤的干馏B.钢铁生锈C.石油分馏D.粮食酿酒2.下列有关化学用语表达正确的是()A.氟化氢的电子式:B.氯原子的结构示意图:C.丙烯的结构简式:C3H6 D.硫原子的最外层电子排布式:3s23p4 3.14C 常用于测定年代,关于其说法正确的是()A.比12C 多两个质子B.与12C 化学性质相似C.与12C 互为同素异形体D.质子数与中子数相等4.下列有关性质的比较,错误的是()A.酸性:H2SO4 > H2CO3 B.沸点:CBr4>CCl4C.碱性:Al(OH)3 > NaOH D.热稳定性:HF > HCl5.下列有机物的系统命名正确的是()A.2-乙基丁烷B.3,3-二甲基丁烷C.2-甲基-1,3-丁二烯D.2,2-二甲基-3-戊炔6.下列变化需要克服共价键的是()A.干冰的升华B.硅的熔化C.氯化钾的溶解D.汞的气化7.下列关于实验室制取乙酸丁酯的叙述,正确的是()A.使用过量的乙酸B.采用边反应边蒸馏的方法C.反应采用水浴加热D.用氢氧化钠溶液提纯乙酸丁酯8.下列生成CO2 的化学反应中,能用2H+ + CO32—→ H2O + CO2↑离子方程式表示的是()A.稀盐酸与碳酸钙B.稀硫酸与碳酸氢钠C.稀醋酸与碳酸钠D.稀硝酸与碳酸钾9.右图是工业合成氨反应的速率-时间图像,在t1 时刻改变某一条件,到t2 时重新达到平衡,判断t1 时刻可能改变条件是()A.使用催化剂B.升高温度C.增大压强D.提高N2 浓度10.室温下,由水电离出的c(H+) = 10-11mol/L 溶液中,一定能大量存在的离子是()A.Fe3+ B.CH3COO- C.HCO3- D.NO3-11.已知:KClO3 + 6HCl(浓)→ KCl + 3Cl2 + 3H2O,氧化产物与还原产物物质的量之比为()A.5 : 1 B.1 : 5 C.6 : 1 D.1 : 612.电解CuCl2 溶液的装置如右图所示,下列分析正确的是()A.b 电极的质量不变B.b 电极是该装置的正极C.a 电极上发生氧化反应D.电子由b 电极经溶液流向a 电极1314.海带提碘实验中,不会用到的装置是()A.B.C.D.15.向0.1 mol/L 醋酸溶液中加水稀释,下列变化叙述错误的是()A.溶液的pH 逐渐增大B.溶液中的c(OH-)逐渐减小C.醋酸的电离程度逐渐增大D.溶液的导电能力逐渐减小16.室温下,H 2 + Cl2 2HCl 生成0.1 mol HCl,下列说法正确的是()A.生成0.1 N A 根共价键B.消耗反应物总体积2.24LC.转移了2 N A 个电子D.产物溶于水后,溶液pH=117.已知25℃、101kPa 下,石墨、金刚石燃烧的热化学方程式如下:C(石墨)+O2(g) → CO2(g)+393.51kJ;C(金刚石)+O2(g) → CO2(g)+395.41kJ,下列说法正确的是()A.金刚石比石墨稳定B.石墨转化为金刚石需要吸热C.金刚石燃烧产物更稳定D.等质量时,石墨所含能量高18.下列关于有机化学实验的说法正确的是()A.除去苯中的甲苯,可使用酸性KMnO4 和NaOH,然后分液B.除去乙醇中混有的少量乙酸,加NaOH 溶液,然后分液C.检验溴乙烷中溴元素,直接加入硝酸银溶液生成浅黄色沉淀D.实验室制备乙烯时,产生的气体直接通入溴水,溴水褪色,证明有乙烯生成19.将等体积、等物质的量浓度的NaClO 与NaOH 溶液混合,下列离子浓度关系正确的是()A.c(ClO-) = c(OH-) B.c(ClO-) + c(OH—) = c(Na+)C.c(OH-) = c(HClO) + c(H+) D.2c(ClO-) + 2c(HClO) = c(Na+)20.将6.4 g 铜与140 mL 一定浓度的硝酸反应,铜完全溶解产生的NO 和NO2 混合气体的体积为 3.36 L(标准状况),其中NO 的体积为(标准状况)A.0.56 L B.1.344 L C.2.016 L D.2.8 L二、综合题(一)本题共15分Na2S 常用作皮革脱毛剂,工业上用反应 Na2SO4 +2C 850 1000℃ Na2S+2CO2↑ 进行制取。
2017上海各区化学二模卷答案详解1

2017上海各区二模化学习题答案详解1一、2017年上海市闵行区二模卷答案详解41 A错,锌和铁都是氢前金属,都能与酸反应产生氢气,无法比较2者活动性强弱。
应该用一种金属与含另一种金属的盐的置换反应来证明。
B 错,H2O2溶液是浓度不同,不能比,变量只能有1个C 错,溶质、溶剂都不同,不能比D 正确,浓盐酸有挥发性,能使石蕊试剂变红42 NaOH变质CO2+NaOH==Na2CO3+H2OA 正确,CO2不能Na2CO3反应,无法证明B 错Na2CO3+Ca(OH)2==CaCO3↓+2NaOH,有白色沉淀C 错Na2CO3+BaCl2==BaCO3↓+NaCl,有白色沉淀D 错CaCO3+2HCl==CaCl2+H2O+CO2↑有气泡产生44 除去杂质的要点:⑴选择的试剂不能与需要提纯的物质反应⑵试剂与杂质反应的产物可以是需要提纯的物质,也可以是新物质(必须是↑↓H2O),不能是可溶性的新物质A错,铁丝在含氧量太少的氮气中无法燃烧,不能除去O2B错,H2O+CaO==Ca(OH)2,选择的试剂与需要提纯的物质反应了C正确,Cu(NO3)2不与Cu反应,Cu+2AgNO3== Cu (NO3)2+2Ag,铜能置换硝酸银中的银,生成物恰好是Cu (NO3)2D错,KNO3不能与CuSO4反应(无↑↓H2O产生),CuSO4+2KOH ==K2SO4+Cu(OH)2↓Cu(OH)2↓可过滤,但引入了新的杂质K2SO445 CaCO3=煅烧= CaO+CO2↑1 1 1100g/100g/mol=1mol m Cao=1*(40+16)=56g<78g所以有部分CaCO3未完全分解成CaO,CO2,这部分CaCO3与稀盐酸反应生成了CO2 CaCO3=煅烧= CaO+CO2↑CaCO3+2HCl==CaCl2+H2O+CO2↑X X Y Y设Xmol的CaCO3分解,生成Xmol CO2;Y mol的CaCO3与酸反应生成Ymol CO2 X+Y=1mol 所以共生成1 mol CO2 答案:DA 正确,Zn (NO3)2,Cu (NO3)2不与稀盐酸反应,NaCl+AgNO3==AgCl↓+NaNO3,所以是上表5的情况,固体是AgB 正确,溶液甲是蓝色,说明含有,Cu (NO3)2,上表345都符合,一定有Ag,3有CuC正确,固体乙有Ag Cu Zn,是上表1,溶液是Zn (NO3)2D错误,氢前金属与稀盐酸反应生成氢气,说明固体乙一定含Zn,符合上表1情况,此时溶液甲中只有Zn (NO3)2,不符合47①根据物质分类,甲橱放非金属单质,所以放甲橱。
2017全国高考上海化学试卷及答案

2017全国高考上海化学试卷及答案2017全国高考上海化学试卷考生注意:1.本试卷满分150分,考试时间120分钟。
2.本考试设试卷和答题纸两部分,试卷包括试题与答题要求;所有答案必须涂或写在答题纸上,做在试卷上一律不得分。
3.答题前,考生务必在答题纸上用钢笔或圆珠笔在答题纸正面清楚地填写姓名、准考证号,并将核对后的条形码贴在指定位置上,在答题纸反面清楚地填写姓名。
4.答题纸与试卷在试题编号上一一对应的,答题时应特别注意,不能错位。
相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32Cl-35.5 Fe-56一、选择题(本题共10分,每小题2分,每题只有一个正确选项)1.轴烯是一类独特的星形环烃。
三元轴烯()与苯A.均为芳香烃B.互为同素异形体C.互为同系物D.互为同分异构体2.下列化工生产过程中,未涉及氧化还原反应的是A.海带提碘B.氯碱工业C.氨碱法制碱D.海水提溴3.硼的最高价含氧酸的化学式不可能是A.HBO2B.H2BO3C.H3BO3D.H2B4O74.下列各组物质的熔点均与所含化学键的键能有关的是A.CaO与CO2B.NaCl与HClC.SiC与SiO2D.Cl2与I25.烷烃的命名正确的是A.4-甲基-3-丙基戊烷B.3-异丙基己烷C.2-甲基-3-丙基戊烷D.2-甲基-3-乙基己烷二、选择题(本题共36分,每小题3分,每题只有一个正确选项)6.能证明乙酸是弱酸的实验事实是A.CH3COOH溶液与Zn反应放出H2B.0.1 mol/L CH3COONa溶液的pH大于7C.CH3COOH溶液与NaCO3反应生成CO2D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红7.已知W、X、Y、Z为短周期元素,原子序数依次增大。
W、Z同主族,X、Y、Z同周期,其中只有X为金属元素。
下列说法一定正确的是A.原子半径:X>Y>Z>WB.W的含氧酸的酸性比Z的含氧酸的酸性强C.W的气态氢化物的稳定性小于Y的气态氢化物的稳定性D.若W与X原子序数差为5,则形成化合物的化学式为X3W28.图1是铜锌原电池示意图。
【上海市宝山区】2017届高考二模化学试卷(附详细答案)

上海市宝山区2017届高考二模化学试卷一、选择题:(本题共40分,每小题2分,每题只有一个正确选项。
) 1.甲状腺大的病人需要多吃海带,这是因为海带中含有较多的( ) A .氯元素 B .钠元素 C .碘元素 D .铁元素2.酸雨的pH 值是( ) A .<7 B .<6.5 C .<6 D .<5.63.属于工业固氮的是( ) A .2N 与2O 反应生成NO B .由3NH 转变成43NH HCOC .2N 与2H 在一定条件下反应生成3NHD .豆科植物的根瘤吸收氮4.有关HF 和HCl 判断正确的是( ) A .键长:HF HCl > B .键能:HF HCl > C .稳定性:HCl HF >D .共用电子对偏移程度:HCl HF > 5.不能用来鉴别乙醛、乙酸的试剂是( ) A .水 B .石蕊试液 C .银氨溶液D .新制的氢氧化铜溶液6.将两种互不相溶的液体分离的方法是( ) A .分液 B .结晶 C .纸层析 D .过滤7.按照有机物的命名规则,下列命名正确的是( ) A .1,2﹣二甲基戊烷 B .2﹣乙基丁烷 C .3﹣乙基己烷D .3,4﹣二甲基戊烷8.下列试剂中,可以鉴别二氧化碳和二氧化硫的是( ) A .澄清石灰水 B .品红溶液C .湿润的蓝色石蕊试纸D .硝酸银溶液9.某老师批阅学生实验报告,下列哪些学生是以科学的态度记录实验数据的( ) A .甲学生用电子天平称取NaOH 固体1.220 g B .乙学生用广泛pH 试纸测定溶液的酸碱性:pH=14.5 C .丙学生用碱式滴定管取25.0 mL 0.l mol/L 的盐酸 D .丁学生用50 mL 量筒量取46.70 mL 浓盐酸 10.下列事实与盐类水解无关的是( ) A .氯化铝溶液蒸干后灼烧得不到无水氯化铝 B .氯化铁溶液常用作制印刷电路板的腐蚀剂 C .常用热的纯碱溶液除去油污 D .长期施用硫酸铵易使土壤酸化11.下列物质的工业生产原理不涉及氧化还原反应的是( ) A .氨气 B .纯碱 C .硫酸 D .烧碱12.用如图所示装置电解氯化钠溶液(X 、Y 是碳棒)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2017年上海市宝山区高考化学二模试卷一、选择题:(本题共40分,每小题2分,毎题只有一个正确选项.)1.甲状腺大的病人需要多吃海带,这是因为海带中含有较多的()A.氯元素B.钠元素C.碘元素D.铁元素【答案】C。
【解析】碘是合成甲状腺激素的主要元素,缺乏会患甲状腺肿大,碘的摄入主要是通过食用海产品和加碘盐食,故选C。
2.酸雨的pH值是()A.<7 B.<6.5 C.<6 D.<5.6【答案】D【解析】正常雨水溶有二氧化碳,饱和二氧化碳溶液的pH=5.6,酸雨溶有二氧化硫、硝酸等,酸性较强,则pH小于5.6,故选D。
3.属于工业固氮的是()A.N2与O2反应生成NOB.由NH3转变成NH4HCO3C.N2与H2在一定条件下反应生成NH3D.豆科植物的根瘤吸收氮【答案】C【解析】工业固氮是人为将空气中游离态的氮转化为含氮化合物的过程.A、N2+O22NO,属于自然固氮,故A错误;B、由NH3转变成NH4HCO3,显然是含氮化合物之间的相互转化,不符合氮的固定定义,故B错误;C、工业上将N2合成氨,N2→NH3,氮气是单质,是游离态的氮,转变为化合态NH3,符合氮的固定定义,属于工业固氮,故C正确;D、豆科植物根瘤菌将N2转化为氮肥,是将空气中游离态的氮转化为含氮化合物的过程,属于生物固氮,故D错误;故选C。
4.有关HF和HCl判断正确的是()A.键长:HF>HClB.键能:HF>HClC.稳定性:HCl>HFD.共用电子对偏移程度:HCl>HF【答案】B【解析】A、原子半径越小,共价键的键长越短,原子半径:F<Cl,则键长:HF <HCl,故A错误;B、原子半径越小,共价键的键长越短,共价键键能越大,原子半径:F<Cl,则键能:HF>HCl,故B正确;C、共价键键能越大,共价键越稳定,则稳定性:HCl<HF,故C错误;D、元素的非金属性越强,其原子吸引电子能力越强,元素的非金属性:F>Cl,吸引电子能力:F>Cl,则共用电子对偏移程度:HCl<HF,故D错误;故选B。
5.不能用来鉴别乙醛、乙酸的试剂是()A.水B.石蕊试液C.银氨溶液D.新制的氢氧化铜溶液【答案】A【解析】A、二者都易溶于水,没有明显不同现象,不能鉴别,故A选;B、乙酸具有酸性,可使紫色石蕊变红,可鉴别,故B不选;C、乙醛含有醛基,与银氨溶液反应有银镜现象生成,而乙酸不反应,可以鉴别,故C不选;D、乙醛含有醛基,与新制氢氧化铜浊液有砖红色沉淀生成,乙酸能与氢氧化铜反应生成盐,溶液呈蓝色,现象不同,可以鉴别,故D不选;故选A。
6.将两种互不相溶的液体分离的方法是()A.分液B.结晶C.纸层析D.过滤【答案】A【解析】解:两种互不相溶的液体分层,可用分液的方法分离,而结晶、层析法和过滤与物质的溶解性有关,分别用于分离可溶性或不溶的固体或离子,只有A 正确,故选A。
7.按照有机物的命名规则,下列命名正确的是()A.1,2﹣二甲基戊烷B.2﹣乙基丁烷C.3﹣乙基己烷D.3,4﹣二甲基戊烷【答案】C【解析】A、主链选择错误,烷烃中1号碳上无甲基,正确命名为:3﹣甲基己烷,故A错误;B、主链选择错误,烷烃中2号碳上无乙基,正确的命名为:3﹣甲基戊烷,故B 错误;C、名称符合系统命名方法,故C正确;D、编号错误,应从靠近支链一端开始,正确的命名为:2,3﹣二甲基戊烷,故D错误;故选C。
8.下列试剂中,可以鉴别二氧化碳和二氧化硫的是()A.澄清石灰水B.品红溶液C.湿润的蓝色石蕊试纸D.硝酸银溶液【答案】B【解析】A、二氧化碳、二氧化硫都能使澄清石灰水变浑浊,所以不能用澄清石灰水鉴别二氧化碳、二氧化硫,故A错误;B、二氧化硫具有漂白性、二氧化碳没有漂白性,所以品红溶液能鉴别二氧化碳、二氧化硫,故B正确;C、二者的水溶液都呈酸性,可使蓝色石蕊试液变红色,不能鉴别,故C错误;D、通入硝酸银溶液,虽然二氧化硫可被氧化,但都没有沉淀生成,故D错误.9.某老师批阅学生实验报告,下列哪些学生是以科学的态度记录实验数据的()A.甲学生用电子天平称取NaOH固体1.220gB.乙学生用广泛pH试纸测定溶液的酸碱性:pH=14.5C.丙学生用碱式滴定管取25.0mL 0.1mol/L的盐酸D.丁学生用50mL 量筒量取46.70mL浓盐酸【答案】A【解析】A、甲学生用电子天平称取NaOH固体1.220g,故A正确;B、广泛pH试纸的读数只能读出整数,且读数范围为0﹣14,无法读出14.5,故B错误;C、滴定管最小读数为0.01mL,盐酸为酸,应该用酸式滴定管,故C错误;D、量筒的最小读数为0.1ml,无法量取46.70mL的浓盐酸,故D错误;故选A。
10.下列事实与盐类水解无关的是()A.氯化铝溶液蒸干后灼烧得不到无水氯化铝B.氯化铁溶液常用作制印刷电路板的腐蚀剂C.常用热的纯碱溶液除去油污D.长期施用硫酸铵易使土壤酸化【答案】B【解析】A、氯化铝水解生成氢氧化铝和HCl,加热HCl挥发促进水解,最终得不到无水氯化铝,故A不选;B、氯化铁溶液与铜反应生成氯化亚铁和氯化铜,发生了氧化还原反应,与盐类水解无关,故B选;C、纯碱为Na2CO3,在溶液中水解显碱性,加热碱性增强,而油脂属于酯类,在碱性条件下发生水解,故纯碱能去油污,故C不选;D、铵根离子在溶液中会水解显酸性,所以长期施用硫酸铵易使土壤酸化,故D故选B。
11.下列物质的工业生产原理不涉及氧化还原反应的是()A.氨气B.纯碱C.硫酸D.烧碱【答案】B1:氧化还原反应.【解析】A、工业制用氮气与氢气反应制取氨气,属于氧化还原反应,故A不选;B、氨碱法生产纯碱涉及的方程式为:NH3+CO2+H2O+NaCl NaHCO3+NH4Cl、2NaHCO3Na2CO3+CO2↑+H2O,这几个方程式中都没有电子的转移,所以不涉及氧化还原反应,故B选;C、硫酸工业中存在S~SO2~SO3的转化,化合价发生变化,为氧化还原反应,故C不选;D、工业制取烧碱涉及的反应为:2NaCl+2H2O Cl2↑+H2↑+2NaOH,该反应中有电子的转移,属于氧化还原反应,故D不选;故选B。
12.用如图所示装置电解氯化钠溶液(X、Y 是碳棒).下列判断正确的是()A.X电极为阴极B.Y电极为负极C.X电极表面发生氧化反应D.Y电极表面有氯气生成【答案】C【解析】A、X连接电源的正极,为电解池的阳极,故A错误;B、Y为阴极,故B错误;C、X为阳极,发生氧化反应,氯离子被氧化,故C正确;D、Y为阴极,表面生成氢气,故D错误;13.在密闭容器中,反应2SO2(g)+O2(g)=2SO3(g)达到平衡后,若将容器体积缩小一半,对反应产生的影响是()A.V(正)减小,V(逆)增大B.V(正)增大,V(逆)减小C.V(正)、V(逆)都减小D.V(正)、V(逆)都增大【答案】D【解析】解:若将容器体积缩小一半,则压强增大,气体的浓度增大,单位体积活化分子的数目增多,正逆反应速率都增大,故选D。
14.布洛芬片常用来减轻感冒症状,其结构简式如图,下列有关说法错误的是()A.布洛芬的分子式为C13H18O2B.布洛芬与苯乙酸是同系物C.1mol 布洛芬最多能与3mol 氢气发生加成反应D.布洛芬在苯环上发生取代反应,其一氯代物有4种【答案】D【解析】A、由结构简式可知布洛芬的分子式为C13H18O2,故A正确;B、含有一个苯环、一个羧基,与苯乙酸是同系物,故B正确;C、能与氢气发生加成反应的只有苯环,则1mol 布洛芬最多能与3mol 氢气发生加成反应,故C正确;D、结构对称,则布洛芬在苯环上发生取代反应,其一氯代物有2种,故D错误.故选D。
15.配制一定物质的量浓度的Na2CO3溶液时,下下列因素会导致溶液浓度偏高的是()A.溶解时有少量液体溅出B.洗涤液未全部转移到容量瓶中C.容量瓶使用前未干燥D.定容时液面未到刻度线【答案】R1:配制一定物质的量浓度的溶液.【解析】A、溶解时有少量液体溅出,n偏小,则浓度偏低,故A不选;B、洗涤液未全部转移到容量瓶中,n偏小,则浓度偏低,故B不选;C、容量瓶使用前未干燥,对实验无影响,故C不选;D、定容时液面未到刻度线,V偏小,则导致溶液浓度偏高,故D选;故选D。
16.下列溶液中氢离子浓度最小的是()A.10L0.10mol/LCH3COOH 溶液B.2L 0.05mol/L H2SO4溶液C.lL0.10mol/LHNO3溶液D.2L0.1mol/LHCl溶液【答案】5C:物质的量浓度的相关计算;D5:弱电解质在水溶液中的电离平衡.【解析】解:B、C、D中为强酸,B、C、D中氢离子浓度分别为0.05mol/L×2=0.1mol/L、0.1mol/L、0.1mol/L,只有A中醋酸为弱酸,不能完全电离,则氢离子浓度小于0.1mol/L,故选A。
17.等量的铁粉分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的物质的量之比是()A.1:1 B.3:4 C.2:3 D.4:3【答案】B【解析】解:令Fe的物质的量为1mol,则:Fe +2HCl FeCl2+H2↑1mol 1mol3Fe+4H2O(g)Fe3O4+4H21mol mol,相同条件下体积之比等于物质的量之比,则两反应中生成氢气体积之比为1mol:mol=3:4,故选B。
18.25℃时,将10mL质量分数为50%(密度1.4g/mL)的硫酸稀释成100mL,下列说法正确的是()A.纯硫酸的摩尔质量为98B.上述100mL稀硫酸中含溶质14gC.上述稀释过程所需要的蒸馏水为90mLD.质量分数为50%的硫酸物质的量浓度为7.14mol/L【答案】D【解析】A、摩尔质量的单位是g/mol,所以硫酸的摩尔质量为98g/mol,故A 错误;B、c===7.14mol/L,而稀释过程中溶质的质量不变,所以上述100mL稀硫酸中含溶质7.14mol/L×0.01L×98g/mol=6.99g,故B错误;C、上述稀释后溶液的密度不知,所以无法求所需要的蒸馏水的质量,故C错误;D、根据c===7.14mol/L,所以质量分数为50%的硫酸物质的量浓度为7.14mol/L,故D正确;故选D。
19.溶质都为1mol的NaHCO3溶液和Ba(OH)2溶液混合,能完整表示该反应的离子方程式是()A.CO32﹣+Ba2+BaCO3B .HCO3﹣+OH﹣H2O+CO32﹣C .HCO3﹣+Ba2++OH﹣H2O+BaCO3D .2HCO3﹣+Ba2++OH﹣BaCO3+2H2O+CO32﹣【答案】C【解析】解:溶质都为1mol的NaHCO3溶液和Ba(OH)2溶液混合,氢氧根离子过量,反应生成碳酸钡、NaOH和水,反应的离子方程式为HCO3﹣+Ba2++OH﹣=H2O+BaCO3,故选C。
