氨(AMM)测定试剂盒(谷氨酸脱氢酶法)产品技术要求百奥泰康
氨(AMM)测定试剂盒(谷氨酸脱氢酶法)产品技术要求sainuopu

氨(AMM)测定试剂盒(谷氨酸脱氢酶法)适用范围:用于体外定量测定人体血清中氨的含量。
1.1 试剂盒包装规格试剂:1×20ml;2×60ml;3×40ml;4×60ml;4×400ml;2×30ml。
校准品(选配):1×1ml;1×3ml。
质控品(选配):1×1ml;1×3ml。
1.2 试剂盒主要组成成分2.1 外观试剂:无色至淡黄色澄清液体。
校准品:无色至淡黄色澄清液体。
质控品:无色至淡黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度在37℃、340nm波长、1cm光径条件下,试剂空白吸光度应不小于1.0。
2.4 分析灵敏度测定浓度为88μmol/L样本时,吸光度变化值(ΔA)应在(0.02,0.2)范围内。
2.5 线性范围在(0,350)μmol/L线性范围内,线性相关系数r不小于0.996。
在(100,350)μmol/L范围内的线性相对偏差不大于±10%;测定结果(0,100]μmol/L时线性绝对偏差不大于±10μmol/L。
2.6 重复性重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于5%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于10%。
2.8 准确度回收试验:回收率应在85%~115%之间。
2.9质控品赋值有效性测定结果在靶值范围内。
2.10 校准品溯源性依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至企业工作校准品。
2.11 稳定性效期稳定性:试剂盒在2℃~8℃下有效期为12个月,取失效期的试剂盒进行检验,试验结果满足2.1、2.3、2.4、2.5、2.6、2.8、2.9的要求。
γ-谷氨酰基转移酶(γ-GT)测定试剂盒(GCANA底物法)产品技术要求百奥泰康

γ-谷氨酰基转移酶(γ-GT)测定试剂盒(GCANA底物法)适用范围:该试剂盒用于体外定量测定人血清中γ-谷氨酰基转移酶的活性。
1.1 产品规格试剂1:60mL×5,试剂2:12mL×5;试剂1:60mL×5,试剂2:60mL×1;试剂1:60mL×2,试剂2:12mL×2;试剂1:60mL×2,试剂2:24mL×1;试剂1:80mL×4,试剂2:16mL×4;试剂1:80mL×4,试剂2:64mL×1;试剂1:80mL×2,试剂2:16mL×2;试剂1:80mL×2,试剂2:32mL×1;试剂1:50mL×3,试剂2:10mL×3;试剂1:50mL×3,试剂2:30mL×1;试剂1:40mL×3,试剂2:24mL×1;试剂1:50mL×4,试剂2:20mL×2;试剂1:50mL×4,试剂2:40mL×1;试剂1:60mL×1,试剂2:12mL×1;试剂1:50mL×1,试剂2:10mL×1;试剂1:40mL×1,试剂2:;8mL×1;试剂1:500mL×1,试剂2:100mL×1;试剂1:5000mL×1,试剂2:1000mL×1;1.2 组成成分该试剂盒由试剂1(R1)和试剂2(R2)组成。
1.2.1试剂组成试剂1: Tris缓冲溶液≥50.0mmol/L 双甘肽≥100.0mmol/L 试剂2:L-g-谷氨酰-3-羟基-4-硝基苯胺≥3.0mmol/L2.1 外观a) R1应为无色溶液,无混浊,无未溶解物。
b) R2应为淡黄色溶液,无混浊,无未溶解物。
单胺氧化酶测定试剂盒(谷氨酸脱氢酶法)产品技术要求lepu
单胺氧化酶测定试剂盒(谷氨酸脱氢酶法)适用范围:本试剂用于体外定量测定人血清中单胺氧化酶的活性。
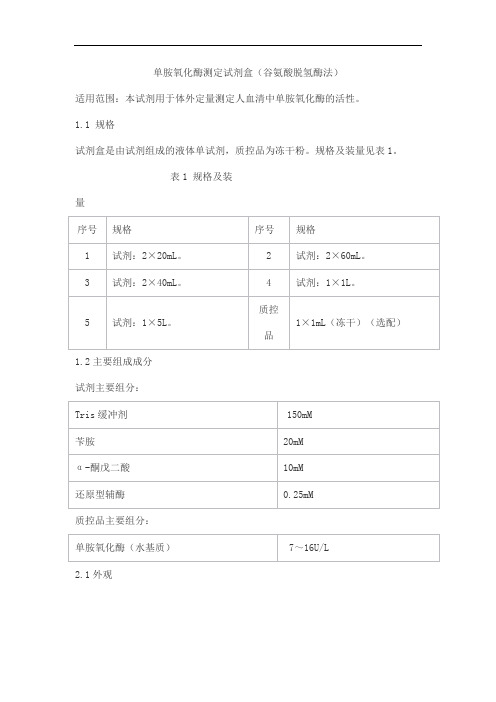
1.1 规格试剂盒是由试剂组成的液体单试剂,质控品为冻干粉。
规格及装量见表1。
表1 规格及装量1.2主要组成成分试剂主要组分:质控品主要组分:2.1外观试剂为无色透明澄清液体,液体试剂不得有沉淀和絮状物;质控品为白色至浅黄色冻干粉,复溶后为无色至浅黄色透明液体。
试剂盒外观应整洁,文字符号标识清晰。
2.2装量试剂瓶内液体装量不应低于规定规格的标准体积。
2.3 空白吸光度当用纯化水作样本分析时,波长340nm(副波长405nm), 比色光径1cm, 反应温度37℃检测,吸光度大于1.0。
2.4分析灵敏度测定浓度为20U/L的样品时吸光度差值:△A≥0.005。
2.5线性2.5.1在(1,98]U/L区间内,线性回归的相关系数r应不低于0.990;2.5.2(1,45)U/L区间内绝对偏差不超过±6.75U/L;[45,98]U/L区间内相对偏差不超过±15%。
2.6重复性重复测试控制血清,变异系数(CV)应<10%。
2.7 准确度参照EP9-A2的方法,用比对试剂盒同时测试40例线性区间内的不同浓度的血清样本。
其相关系数(r)不小于0.990。
每个浓度点在(1,45)U/L区间内绝对偏差不超过±6.75U/L;[45,98]U/L区间内相对偏差不超过±15%。
2.8批间差试剂(盒)批间相对极差应<15%。
2.9 质控品批内瓶间差变异系数(CV)应≤10%。
2.10质控品赋值有效性质控品测值应在靶值范围内。
2.11 稳定性2.11.1效期稳定性原包装的试剂盒在2℃~8℃条件下贮存达到18个月后的试剂进行检测,应符合本标准2.2、2.3、2.4、2.5、2.6、2.7、2.10之规定。
2.11.2复溶稳定性质控品复溶后在2℃~8℃密闭避光保存,稳定期为7天,稳定期满后1天内,性能应符合2.10的要求。
单胺氧化酶测定试剂盒(谷氨酸脱氢酶法)产品技术要求huayu

单胺氧化酶测定试剂盒(谷氨酸脱氢酶法)适用范围:用于体外定量测定人血清中单胺氧化酶的活性。
1.1 产品型号/规格1×32 ml;2×25 ml;1×45 ml;2×45 ml;4×45 ml ;1×50 ml ;2×50 ml;4×50 ml;8×50 ml;1×60 ml;2×60 ml;2×70 ml;6×70 ml;2×100 ml;4×100 ml;2×16 ml;4×24 ml;8×24 ml;1×25 ml;4×60 ml;8×60 ml。
1.2 主要组成成分Tris缓冲液 150 mmol/Lα-酮戊二酸10 mmol/L 乙二胺四乙酸(ETDA) 2 mmol/L谷氨酸脱氢酶 1 KU/L苄胺20 mmol/L烟酰胺腺嘌呤二核苷酸(NADH)0.25 mmol/LProclin-300 0.1%2.1 外观和性状2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;中文包装标签应清晰、准确、牢固。
2.1.2 试剂应为无色至浅黄色澄清液体。
2.2 净含量不少于标示值。
2.3 试剂空白2.3.1 试剂空白吸光度在光径1 cm、主波长340 nm下,以纯化水为检测样本时,吸光度应不小于0.800。
2.3.2 试剂空白吸光度变化率在光径1 cm、主波长340 nm下,以纯化水为检测样本时,吸光度变化率(△A/min)应小于0.01。
2.4 分析灵敏度MAO含量为6 U/L时,测定吸光度变化率(△A/min)应不小于0.001。
2.5 线性范围MAO试剂在线性范围[0.5,100] U/L内:(a)相关系数r应不小于0.990;(b)在[0.5,10]U/L范围内,线性绝对偏差应不超过±1 U/L;(c)在(10,100]U/L范围内,线性相对偏差应不超过±10 %。
AMM氨测定试剂盒(谷氨酸脱氢酶法)产品说明书

AMM氨测定试剂盒(谷氨酸脱氢酶法)产品说明书AMM氨测定试剂盒(谷氨酸脱氢酶法)一、产品概述AMM氨测定试剂盒是一种基于谷氨酸脱氢酶法的高精度、高灵敏度氨测定试剂盒,用于测量生物体内氨浓度。
本试剂盒可广泛应用于医学、生物科学研究以及临床实验室等领域。
其准确度和可靠性得到了专业机构的认可。
二、试剂组成1. 测定液:包含谷氨酸脱氢酶、NADH(二磷酸腺苷二核苷酸)、缓冲液等。
2. 校准液:含有已知浓度的氨溶液,用于校准仪器。
3. 样本提取液:用于提取样本中的氨,使其能够反应产生信号。
三、试剂储存和稳定性1. 试剂的储存温度应为2-8摄氏度,避免阳光直接照射。
2. 开封后的试剂应储存在2-8摄氏度,并尽快使用。
3. 严禁冷冻试剂,以免造成试剂失效。
4. 正确存放条件下,试剂的稳定期为12个月。
四、仪器要求本试剂盒适用于多种型号的分光光度计,要求光敏器件工作稳定、精密度高,峰值吸光度范围在340-380nm之间。
五、操作步骤1. 准备工作a. 取出试剂,放置于室温下30分钟,使其回温到室温。
b. 将待检样本从冰箱取出后,回温至室温。
c. 开机并调整光源和光敏器件,确保仪器正常工作。
2. 样本制备a. 取适量样本加入样本提取液中,按照规定的比例稀释,混匀待用。
3. 样本测定a. 取适量测定液加入试管或微孔板中,作为反应底物。
b. 加入适量样本提取液,搅拌均匀。
c. 读取反应开始后一段时间内的吸光度值。
d. 将读数输入分光光度计或计算机,根据标准曲线计算样品中氨的浓度。
4. 结果判定a. 根据标准曲线上的吸光度值和已知浓度的校准液所对应的吸光度值,计算样品中氨的浓度。
b. 根据实验需求,判断测量结果的可靠性和准确性。
六、注意事项1. 操作前请阅读使用说明书。
2. 所有操作都必须在规定的温度下进行,以保证试剂和样本的稳定性。
3. 使用量杯、试管和微孔板等器具时,应保证其清洁干燥,以免发生干扰现象。
4. 实验过程中应避免直接接触皮肤和吸入试剂,如有意外接触,请立即清洗。
AMM氨测定试剂盒(谷氨酸脱氢酶法)产品说明书

氨测定试剂盒(谷氨酸脱氢酶法)说明书【产品名称】通用名称:氨测定试剂盒(谷氨酸脱氢酶法)英文名称:Blood ammonia Assay Kit(AMM)【包装规格】R1:2⨯60ml 、R2:2⨯15ml ;R1:2⨯40ml 、R2:2⨯10ml;R1:1⨯40ml 、R2:1⨯10ml;R1:2⨯20ml、R2:2⨯5ml;校准品(选配):2⨯2ml(水平1:1⨯2ml;水平2:1⨯2ml)。
【预期用途】用于体外定量测定人血浆中氨的含量。
临床上主要用于肝性脑病的辅助诊断。
【检验原理】过量的α-酮戊二酸、NADH 和足量谷氨酸脱氢酶(GLDH)存在的条件下,NADH 转变成NAD+,在340nm 监测吸光度下降速率与样本中氨的含量成正比。
GLDHNH 4++α-酮戊二酸+NADH→谷氨酸+NAD ++H2O【主要组成成分】由试剂R1、R2和校准品组成。
试剂R1:谷氨酸脱氢酶(GLDH)3.5KU/L、α-酮戊二酸(C 5H 6O 5)6.55mmol/L、氯化钠(NaCl)140mmol/L;试剂R2:叠氮钠(NaN 3)0.1%、还原型辅酶(NADH)1.1mmol/L;校准品:含醋酸铵的水溶液。
校准品可溯源至贝克曼血氨参考品439770,注:浓度见每批瓶标示。
不同批号试剂盒中各组分不可以互换。
【储存条件及有效期】试剂和校准品在2℃~8℃无腐蚀性气体中避光储存,若无污染,可稳定至失效期。
有效期365天。
试剂和校准品开瓶后2℃~8℃可稳定7天。
备注:生产日期及失效日期见外盒或瓶标签。
【适用仪器】日立7180、奥林巴斯AU680、贝克曼LX-20/DXC800、迈瑞BS-380、朕江T900全自动生化分析仪。
【样本要求】1、静脉采血,EDTA 抗凝血浆样本。
2、样本采集后需尽快分离,如不能做到这一点,应该将收集来的血样立即放在冰块上或放置冰箱内,并且在30分钟内离心,分离后的血浆请置于2℃~8℃并在2小时内进行测定。
尿素(UREA)测定试剂盒(尿素酶-谷氨酸脱氢酶法)产品技术要求百奥泰康

尿素(UREA)测定试剂盒(尿素酶-谷氨酸脱氢酶法)适用范围:该试剂盒用于体外定量测定人血清中尿素的浓度。
1.1 产品规格1.2 组成成分该试剂盒由试剂1(R1)、试剂2(R2)和校准品(选配)组成。
1.2.1试剂组成试剂1: Tris缓冲液≥20.0mmol/La-酮戊二酸≥5.0mmol/L 二磷酸腺苷(ADP)≥0.6mmol/L烟酰胺腺嘌呤二核苷酸(NADH)≥0.2mmol/L试剂2:脲酶(Urease)≥6.0KU/L谷氨酸脱氢酶(GLDH)≥1.0KU/L1.2.2 校准品组成尿素目标浓度:8.50mmol/L该校准品为水基质液体校准品2.1 外观a) R1应为无色溶液,无混浊,无未溶解物。
b) R2应为无色溶液,无混浊,无未溶解物。
c) 校准品应为无色溶液,无混浊,无未溶解物。
2.2 净含量液体组分不少于标示值。
2.3 试剂空白2.3.1试剂空白吸光度应不小于1.000。
2.3.2试剂空白吸光度变化率应不大于0.004/min2.4 分析灵敏度UREA试剂盒测定浓度20.00mmol/L的被测物时,吸光度变化率(ΔA/min)应不小于0.025。
2.5 准确度测试参考物质,相对偏差应不超过±10%。
2.6 精密度2.6.1重复性变异系数应不大于5%。
2.6.2批间差批间相对极差(R)应不大于10%。
2.7 线性在(0,40.00]mmol/L范围内,UREA试剂盒的线性相关系数r应不低于0.9900;在(0,10.00]范围内绝对偏差应不超过1.00mmol/L,在(10.00,40.00]范围内相对偏差应不超过±10%。
2.8校准品溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品控制物质赋值的计量学溯源性》及有关规定提供尿素校准品的来源、赋值过程以及测量不确定度等内容。
校准品溯源至国家标准物质GBW09175。
2.9稳定性原包装的UREA试剂盒在2℃~8℃避光保存,有效期为18个月。
氨测定试剂盒(谷氨酸脱氢酶法)产品技术要求zhongshengbeikong

氨测定试剂盒(谷氨酸脱氢酶法)适用范围:本产品用于体外定量测定人血清中氨的浓度。
1.1包装规格冻干粉型试剂1(R1):5mL×5,试剂2(R2):0.26mL×2,校准品:1mL×3 (1个浓度)1.2主要组成成分1.1.1试剂1(R1)(冻干粉)三乙醇胺缓冲液(pH8.6)0.15mol/Lα-酮戊二酸15mmol/LNADH0.2mmol/L1.2.2 试剂2(R2)(液体)谷氨酸脱氢酶≥13000U/L1.2.3 校准品(液体)水基质、硫酸铵,目标浓度58.8μmol/L。
(每批定值,值有批特异性,详见值单)2.1 外观试剂盒中各组件的外观应满足:2.1.1 试剂1(R1)应为白色冻干粉,外包装完整无破损;2.1.2 试剂2(R2)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;2.1.3 校准品应为无色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长340nm处(光径1cm),试剂空白吸光度(A)应≥1.200。
2.4准确度测定GBW(E) 080421,相对偏差应不超过±10%。
2.5分析灵敏度对应于浓度为58.8μmol/L的氨所引起的吸光度差值(△A)的绝对值应≥0.01。
2.6批内瓶间差重复测试同一样本,变异系数(CV)应≤5%。
2.7批间差测定同一样本,批间差(R)应≤5%。
2.8线性范围在[15,300]μmol/L范围内,线性相关系数(r)应≥0.990;在(60,300]μmol/L范围内,线性相对偏差应不超过±10%;在[15,60]μmol/L范围内,线性绝对偏差应不超过±6μmol/L。
2.9试剂稳定性2.9.1效期稳定性原包装的试剂盒中试剂2(R2)在2℃~8℃避光贮存,有效期为12个月。
原包装的试剂盒中试剂1(R1)在2℃~8℃避光贮存,有效期为24个月。
谷氨酸脱氢酶(GLDH)测定试剂盒(α-酮戊二酸底物法)产品技术要求百奥泰康

谷氨酸脱氢酶(GLDH)测定试剂盒(α-酮戊二酸底物法)适用范围:该产品用于体外定量测定人血清或血浆中谷氨酸脱氢酶的活性。
1.1 产品规格试剂1:60mL×2,试剂2:20mL×2 ;试剂1:60mL×1,试剂2:20mL×1;试剂1:45mL×2,试剂2:15mL×2;试剂1:45mL×1,试剂2:15mL×1;试剂1:30mL×1,试剂2:10mL×3;试剂1:30mL×2,试剂2:10mL×6;试剂1:300mL×1,试剂2:100mL×1;试剂1:15mL×1,试剂2:5mL×1;试剂1:3000mL×1,试剂2:1000mL×1;192人份(试剂1:51mL,试剂2:17mL);1.2组成成分2.1 外观试剂R1为无色澄清液体;试剂R2为无色或淡黄色澄清液体.2.2 净含量液体试剂的净含量应不少于标称量。
2.3 试剂空白2.3.1试剂空白吸光度空白吸光度应≥0.8000。
2.3.2 空白吸光度变化率试剂空白吸光度变化率(ΔA/min)应≤0.02。
2.4 分析灵敏度浓度为30 U/L时,其吸光度变化率应≥0.00502.5线性在[1,120] U/L范围内,线性相关系数r≥0.990,在[1,40] U/L范围内绝对偏差应不超过4 U/L,在(40,120] U/L范围内相对偏差应不超过±10%。
2.6精密度变异系数(CV%)应≤8%。
2.7 批间差不同批号之间测定结果的相对极差应≤10%。
2.8准确度回收试验:回收率90%-110%。
2.9稳定性原包装试剂,在2℃~8℃下有效期为12个月,取失效期的试剂盒检测其试剂空白、分析灵敏度、线性、精密度、准确度应分别符合2.3、2.4、2.5、2.6、2.8的要求。
谷氨酸脱氢酶测定试剂盒(α-酮戊二酸底物法)产品技术要求baiding

谷氨酸脱氢酶测定试剂盒(α-酮戊二酸底物法)适用范围:用于体外定量测定人血清中谷氨酸脱氢酶的含量。
1.1 规格1.2 组成:2.1 外观2.1.1试剂1:无色液体,无浑浊,无不溶物。
2.1.2试剂2:无色至淡黄色液体。
2.1.3包装外观应整洁,标签字迹清晰,不易脱落。
2.2 净含量液体试剂的净含量不低于标示体积。
2.3 试剂空白2.3.1试剂空白吸光度试剂空白吸光度≥0.8。
2.3.2试剂空白吸光度变化率试剂空白吸光度变化率(ΔA/分)≤0.02。
2.4 分析灵敏度样本浓度为30U/L时,吸光度变化率(ΔA/分)≥0.0030。
2.5 线性在[4,120] U/L的范围内,线性相关系数r≥0.990。
测试浓度在[4,40] U/L时,绝对偏差应不超过±4 U/L;测试浓度在(40,120] U/L时,相对偏差应不超过±10%。
2.6 精密度2.6.1重复性用高、低2个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于10%。
2.6.2批间差用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。
2.7 准确度与已上市产品进行对比试验,在[4,120] U/L的范围内,线性相关系数r≥0.975。
测试浓度在[4,40] U/L时,绝对偏差应不超过±4 U/L;测试浓度在(40,120] U/L时,相对偏差应不超过±10%。
2.8 效期稳定性原包装试剂盒在2℃~8℃密封避光保存条件下有效期为12个月。
有效期满后3个月内测试,应满足2.3、2.4、2.5、2.6.1、2.7的要求。
氨测定试剂盒(谷氨酸脱氢酶法)产品技术要求aipuyi

氨测定试剂盒(谷氨酸脱氢酶法)适用范围:本试剂适用于体外定量测定人血清或血浆中氨含量。
1.1包装规格试剂1(R1):4×70ml 试剂2(R2):1×70ml试剂1(R1):4×50ml 试剂2(R2):2×25ml试剂1(R1):2×64ml 试剂2(R2):2×16ml试剂1(R1):2×80ml 试剂2(R2):1×40ml试剂1(R1):4×45ml 试剂2(R2):1×45ml2.1外观2.1.1包装完整,标签清晰;2.1.2试剂为无色透明溶液、无悬浮物、无沉淀物;2.2净含量试剂盒内液体的装量应不低于标示值。
2.3试剂空白吸光度用试剂盒测定空白样本,记录试剂盒在340nm左右波长条件下,吸光度A应不小于1.1。
2.4分析灵敏度测定100µmol/L样本时,吸光度变化率(ΔA/min)应符合:0.020~0.570。
2.5线性范围试剂盒线性范围在[10.0 ,500.0] µmol/L:线性相关系数r≥0.990;[10.0,50.0]µmol/L范围内,线性绝对偏差应不超过±5.0µmol/L;(50.0,500.0]µmol/L范围内,线性相对偏差不超过±10%。
2.6测量精密度2.6.1重复性用2个水平的血清样品或质控品测试同一批号试剂盒,测试结果应符合CV≤10%。
2.6.2批间差用3个不同批号的试剂盒测定同一份样本,测得结果极差R≤10%。
2.7准确度回收率 90%-110%.2.8稳定性试剂盒在2℃-8℃保存条件下贮存到12个月效期后,效期后一个月内进行检测,检测结果应符合2.3、2.4、2.5、2.6.1、2.7技术指标要求。
6.氨测定试剂盒说明书

氨测定试剂盒(谷氨酸脱氢酶法)说明书【产品名称】通用名称:氨测定试剂盒(谷氨酸脱氢酶法)英文名称:AMM Determination Kit【包装规格】试剂1a/试剂1b/试剂2:80ml×3/16ml×3/16ml×3、80ml×1/16ml×1/16ml×1、60ml×2/12ml×2/12ml×2、60ml×1/12ml×1/12ml×1、45ml×4/9ml×4/18ml×2、45ml×1/9ml×1/9ml×1、20ml×1/4ml×1/4ml×1【预期用途】本试剂用于体外定量测定人血清中氨的含量,临床上主要用于肝性脑病的辅助诊断。
【检验原理】在LDH的作用下,血清中干扰氨(AMM)测定的丙酮酸在预反应中被除去。
AMM在GLDH的作用下与α-KG和NADH反应,与同样处理的校准液比较,可计算出血清中AMM的含量。
【主要组成成分】试剂1a Tris缓冲液50mmol/L pH 8.0、乳酸脱氢酶(LDH)2KU/L试剂1b α-酮戊二酸(α-KG)18mmol/L、烟酰胺腺嘌呤二核苷酸(NADH)0.18mmol/L试剂2 谷氨酸脱氢酶(GLDH)25KU/L【储存条件及有效期】1.试剂在2~8℃密封避光保存,有效期12个月。
2.已开瓶试剂注意避免污染,试剂1a与试剂1b以5:1比例混合,形成应用试剂1,2~8℃可稳定4天。
【适用仪器】本产品适用于所有开放式的半自动或全自动生化分析仪。
【样本要求】新鲜血清样本:用真空采血管静脉采血,采集后尽快(2h内)分离,避免溶血,送检应及时,注意密封,将样本置于冰屑或冰水混合物中并须保证样本与制冷物充分接触;不能及时检测应于2~8℃冰箱保存,在2h内不能完成或者需贮存2h以上,应于-20℃保存,可保存24h;保持密封,避免反复冻融。
谷氨酸脱氢酶测定试剂盒(α-酮戊二酸底物法)产品技术要求huayu

谷氨酸脱氢酶测定试剂盒(α-酮戊二酸底物法)适用范围:用于体外定量测定人血清中谷氨酸脱氢酶的活性。
1.1 产品型号/规格试剂1:1×30 ml,试剂2:1×10 ml;试剂1:2×30 ml,试剂2:2×10 ml;试剂1:4×30 ml,试剂2:4×10 ml;试剂1:8×30 ml,试剂2:8×10 ml;试剂1:1×45 ml,试剂2:1×15 ml;试剂1:2×45 ml,试剂2:2×15 ml;试剂1:3×50 ml,试剂2:2×25 ml;试剂1:1×60 ml,试剂2:1×20 ml;试剂1:2×60 ml,试剂2:2×20 ml;试剂1:2×90 ml,试剂2:2×30 ml;试剂1:2×90 ml,试剂2:3×20 ml;试剂1:4×90 ml,试剂2:4×30 ml;试剂1:2×15 ml,试剂2:2×5 ml ;试剂1:4×15 ml,试剂2:4×5 ml ;试剂1:8×15 ml,试剂2:8×5 ml ;试剂1:16×15 ml,试剂2:16×5 ml。
校准品:1 ml/瓶×1瓶(选配)1.2 主要组成成分试剂1:三乙醇胺缓冲液50 mmol/L乙二胺四乙酸(EDTA) 3.0 mmol/L醋酸铵120 mol/L二磷酸腺苷(ADP)≥1.35 mmol/L烟酰胺腺嘌呤二核苷酸(NADH)0.25 mmol/L乳酸脱氢酶(LDH)≥2 U/L试剂2:三乙醇胺缓冲液8.0 mmol/Lα-酮戊二酸 40 mmol/L校准品(选配):Tris缓冲液100 mmol/L Proclin-300 0.5‰谷氨酸脱氢酶目标浓度100.00U/L注:校准品浓度具有批差异性,具体浓度见校准品瓶签。
单胺氧化酶测定试剂盒(谷氨酸脱氢酶法)产品技术要求meigaoyi

单胺氧化酶测定试剂盒(谷氨酸脱氢酶法)适用范围:用于体外定量测定人血清中单胺氧化酶的活性。
1.1包装规格a) 试剂1:1×60ml,试剂2:1×15ml;b) 试剂1:2×60ml,试剂2:2×15ml;c) 试剂1:4×60ml,试剂2:1×60ml;d) 试剂1:2×40ml,试剂2:2×10ml;e) 试剂1:2×400ml,试剂2:2×100ml;f) 试剂1:2×80ml,试剂2:2×20ml;g)试剂1:6×16ml,试剂2:6×4ml;h)试剂1:1×20ml,试剂2:1×5ml。
1.2主要组成成分试剂1主要组成成分:Tris缓冲液 (PH 7.0-10.0) ≥200mmol/LNADPH ≥0.2mmol/L试剂2主要组成成分:Tris缓冲液 (PH 6.0-9.0) ≥200mmol/Lα-酮戊二酸≥10mmol/L苄胺≥30mmol/L2.1 外观和性状2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2 试剂1应为无色或淡黄色透明溶液;试剂2应为无色或淡黄色透明溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白2.3.1 试剂空白吸光度测定试剂空白吸光度,应≥0.5。
2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率△A/min≤0.1。
2.4 分析灵敏度测试180U/L的被测物时,吸光度变化率(ΔA/min)应不低于0.003。
2.5 准确性回收率,应在80%~120% 范围内。
2.6 重复性变异系数(CV)应不超过5%。
2.7 线性2.7.1 在(1,200)U/L范围内,线性回归的相关系数应不低于0.990;2.7.2 测试浓度(30,200)U/L的样品,相对偏差≤15%;测试浓度(1,30]U/L 的样品,绝对偏差≤5U/L。
单胺氧化酶测定试剂盒(谷氨酸脱氢酶法)产品技术要求haifeng

单胺氧化酶测定试剂盒(谷氨酸脱氢酶法)适用范围:适用于体外定量测定人血清中单胺氧化酶(MAO)的含量。
1.1 产品规格1.2 主要组成成分注:质控品具有批间特异性,具体值详见靶值单。
2.1 外观2.1.1 试剂盒标签标识清晰,外包装完整无破损;2.1.2 试剂:无色或淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;2.1.3 质控品:无色或浅黄色干粉,复溶后不得有任何沉淀及絮状悬浮物。
2.2 净含量净含量不低于标示值。
2.3 试剂空白2.3.1 空白吸光度测定待检试剂在主波长340nm、副波长405nm、37℃条件下:A≥0.8;2.3.2 空白吸光度变化率空白吸光度变化率△A/min≤0.004。
2.4 线性范围(7,100)U/L范围内,相关系数r≥0.990;(7,20]U/L范围内,绝对偏差不超过±2U/L;(20,100)U/L范围内,相对偏差不超过±10.0%。
2.5 分析灵敏度在产品说明书规定参数设定条件下,测定50U/L样本时,吸光度变化率△A/min≥0.020。
2.6 精密度2.6.1批内重复性CV≤10.0%。
2.6.2 批间差相对偏差R≤10.0%。
2.7 准确度与已上市产品比对:(7,100)U/L范围内,相关系数r≥0.990;(7,20]U/L 线性范围内,绝对偏差不超过±2U/L;(20,100)U/L线性范围内,相对偏差不超过±10.0%。
2.8 质控品2.8.1 赋值有效性:测定值在质控靶值范围内;2.8.2 均一性:CV≤5.0%;2.8.3 瓶间差:CV≤10.0%。
2.9 稳定性未开封试剂2℃~8℃储存,可稳定12个月。
取到效期后2个月内产品进行检测, 检测结果应满足2.3、2.4、2.5、2.6.1、2.7、2.8.1和2.8.2的要求。
单胺氧化酶(MAO)测定试剂盒(谷氨酸脱氢酶法)产品技术要求利德曼

单胺氧化酶(MAO)测定试剂盒(谷氨酸脱氢酶法)适用范围:本产品用于体外定量测定人体血清中单胺氧化酶(MAO)的含量。
1.1包装规格试剂(R):1×20mL;1×40mL;2×40mL;4×40mL;1×80mL;2×80mL;4×80mL。
校准品(选配):单水平1×1mL;1×3mL。
质控品(选配):单水平1×1mL;1×3mL。
1.2 主要组成成分注:校准品和质控品浓度具有批特异性,具体数值见瓶标签。
2.1外观液体单试剂:无色或淡黄色澄清液体。
校准品:无色或淡黄色澄清液体。
质控品:无色或淡黄色澄清液体。
2.2净含量液体试剂、校准品和质控品的净含量不得低于标示体积。
2.3试剂空白2.3.1试剂空白吸光度在37℃、(340 nm±10%范围内的)波长、1cm光径条件下,用去离子水或(生理盐水)作为样品加入试剂测试时,试剂空白吸光度应>1.0 。
2.3.2空白吸光度变化率在37℃、(340nm±10%范围内的)波长、1cm光径条件下,用去离子水或(生理盐水)作为样品加入试剂测试时,试剂空白吸光度变化率(ΔA/min)应<0.004 。
2.4分析灵敏度浓度为50U/L时,吸光度变化率绝对值应≥0.015。
2.5线性在[1,100]U/L线性范围内,线性相关系数r2 ≥0.990。
在(10,100]U/L范围内测定结果的相对偏差应不大于±15%;在[1,10]U/L范围内测定结果的绝对偏差应不大于±3.0 U/L。
2.6重复性2.6.1 试剂重复性变异系数CV应<10%。
2.6.2 校准品和质控品重复性校准品和质控品的变异系数CV应<10%。
2.7批间差不同批号之间测定结果的相对极差应<15%。
2.8 准确度与选定试剂盒进行比对试验,样本浓度在[1,100]U/L范围内,相关系数r2≥0.990,样本测定结果在(10,100]U/L范围内的相对偏差应不大于±15%;在[1,10]U/L范围内的绝对偏差应不大于±3.0 U/L。
单胺氧化酶测定试剂盒(谷氨酸脱氢酶法)产品技术要求zhongshengbeikong

单胺氧化酶测定试剂盒(谷氨酸脱氢酶法)适用范围:本产品用于体外定量测定人血清中单胺氧化酶的浓度。
1.1规格液体单剂型试剂(R):40mL×1;试剂(R):40mL×2;试剂(R):60mL×2;选配质控品:冻干粉型(2个水平):1mL×2。
1.2规格划分说明根据净含量、复溶体积划分规格。
1.3主要组成成分试剂盒由试剂(R)液体和选配质控品冻干粉组成。
1.3.1 试剂(R)液体:Tris缓冲液200mmol/L还原型辅酶I 0.2g/Lα-酮戊二酸≥10mmol/L苄胺≥30mmol/L谷氨酸脱氢酶≥2KU/L1.3.2 质控品冻干粉:人血清定值范围:水平1:2 U/L~15U/L;水平2:10 U/L~45U/L(每批定值)2.1 外观试剂盒中各组件的外观应满足:a)试剂(R)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;b)质控品应为白色或淡黄色冻干粉,复溶后应为无色或浅黄色溶液,无混浊,无未溶解物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度和试剂空白吸光度变化率在波长340nm(光径1cm)处,试剂空白吸光度(A)应≥0.8000;试剂空白吸光度变化率(△A/min)绝对值≤0.0100。
2.4准确度测定单胺氧化酶纯品,回收率在80%~120%范围内。
2.5 分析灵敏度对应于浓度为11.5U/L的单胺氧化酶所引起的吸光度变化率(△A/min)的绝对值应≥0.001。
2.6重复性重复测定高、低浓度样本,变异系数(CV)应≤15%。
2.7批间差测定同一样本,批间差(R)应≤15%。
2.8线性范围在[5,100] U/L范围内,线性相关系数(r)应≥0.990;在[5,25] U/L范围内,线性绝对偏差应不超过±3.75U/L;在(25,100] U/L范围内,线性相对偏差应不超过±15%。
谷氨酸脱氢酶测定试剂盒(连续监测法)产品技术要求北检

谷氨酸脱氢酶测定试剂盒(连续监测法)适用范围:本产品用于体外定量测定人血清中谷氨酸脱氢酶的活性。
1.1规格具体产品规格见下表:1.2组成成分试剂1:三羟甲基氨基甲烷缓冲液100mmol/Lα-酮戊二酸10mmol/L试剂2:硫酸铵100mmol/L 还原型辅酶Ⅰ0.5mmol/L2.1 外观2.1.1 外包装完整无破损;2.1.2 试剂1:无色澄清透明无杂质液体;2.1.3 试剂2:无色澄清透明无杂质液体。
2.2 净含量净含量不低于标示值。
2.3 试剂空白2.3.1 试剂空白吸光度在主波长340nm、副波长405nm、37℃条件下,试剂空白吸光度不小于1.0;2.3.2 试剂空白吸光度变化率在主波长340nm、副波长405nm、37℃条件下,试剂空白吸光度变化率不大于0.004。
2.4 线性2.4.1 线性范围[5.0,120.0]U/L,相关系数r>0.990。
2.4.2 线性偏差[16.0,120.0]U/L线性范围内,相对偏差不超过±15%;[5.0,16.0)U/L线性范围内,绝对偏差不超过±2.4U/L 。
2.5 分析灵敏度检测浓度为25.0U/L的样本时,吸光度变化率不小于0.003。
2.6 重复性测试(20.0±5.0)U/L的血清样本或质控品,重复测试10次,CV≤10%。
2.7 批间差用三个不同批号的试剂测试同一样本,重复测试3次,相对极差R≤10%。
2.8 准确度回收率在85%~115%范围内。
2.9 稳定性原包装试剂2~8℃避光储存,有效期12个月。
有效期后1个月,检测结果应符合2.3、2.4和2.8的要求。
氨测定试剂盒(谷氨酸脱氢酶法)产品技术要求北检

氨测定试剂盒(谷氨酸脱氢酶法)适用范围:氨测定试剂盒(谷氨酸脱氢酶法)1.1规格具体产品规格见下表:1.2组成成分Tris-HCl缓冲液100mmol/Lα-酮戊二酸 14mmol/LGLDH 3000U/LNADH 0.23mmol/L2.1 外观2.1.1 外包装完整无破损;2.1.2 试剂:无色澄清透明无杂质的液体。
2.2 净含量净含量不低于标示值。
2.3 试剂空白2.3.1 试剂空白吸光度在主波长340nm、副波长405nm、37℃条件下,试剂空白吸光度不小于1.0;2.3.2 试剂空白吸光度变化率在主波长340nm、副波长405nm、37℃条件下,试剂空白吸光度变化率不大于0.004。
2.4 线性2.4.1 线性范围[15,400]µmol/L,相关系数r≥0.990。
2.4.2 线性偏差(60,400]µmol/L线性范围内,相对偏差不超过±10%;[15,60]µmol/L线性范围内,绝对偏差不超过±6µmol/L。
2.5 分析灵敏度检测浓度为100µmol/L的样本时,吸光度变化率不小于0.004。
2.6 重复性测试高、低浓度的新鲜人血清或质控品,重复测试至少20次,CV≤10%。
2.7 批间差用三个不同批号的试剂测试同一样本,重复测试3次,相对极差R≤10%。
2.8 准确度回收率在90%~110%范围内。
2.9 稳定性原包装试剂2~8℃避光储存,有效期12个月。
有效期后1个月,检测结果应符合2.3、2.4和2.8的要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氨(AMM)测定试剂盒(谷氨酸脱氢酶法) 适用范围:该产品用于体外定量测定人血浆中氨的浓度。
1.1 产品规格
1.2 组成成分
1.2.1 试剂组成
试剂1: Tris缓冲液(pH=9.0)>50mmol/L;
谷氨酸脱氢酶(GLDH )<15KU/L;
α-酮戊二酸(α-KG)<18.0mmol/L;
烟酰胺腺嘌呤二核苷酸(NADH)>0.25mmol/L;
稳定剂 0.1%
1.2.2校准品的组成:
单水平的液态校准品,在水基质中添加氯化铵,稳定剂<0.1%;定值范围:范围(60-120)μ
mol/L。
1.2.3质控品的组成
两个水平的液体质控品,在水基质中添加氯化铵,稳定剂<0.1%。
定值范围:(30-70)μmol/L和(80-120)μmol/L。
2.1 外观
液体单试剂:无色至淡黄色澄清液体。
校准品:无色至淡黄色澄清液体。
质控品:无色至淡黄色澄清液体。
2.2 净含量
液体试剂的净含量不得低于标示体积。
2.3 空白吸光度
在规定参数下,试剂空白吸光度应≥1.0 。
2.4 分析灵敏度
浓度为88.0μmol/L时,吸光度变化≥0.01
2.5 线性
在(0,350.0]μmol/L,线性范围内,线性相关系数r≥0.990。
(0,100.0]μmol/L 时绝对偏差不超过10μmol/L,在(100,350.0]μmol/L ,范围内的相对偏差不超过±10%。
2.6 精密度
变异系数CV应≤8%。
2.7 批间差
不同批号之间测定结果的相对极差应≤10 %。
2.8 准确度
回收率:回收率应在90%-110%。
2.9质控品赋值有效性
测定值在质控靶值范围内。
2.10校准品溯源性要求
根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品控制物质赋值的计量学溯源性》及有关规定提供氨校准品的来源、赋值过程以及测量不确定度等内容。
校准品溯源至氯化铵纯品(Sigma)。
2.11效期稳定性
试剂在2℃~8℃下有效期为18个月,校准品和质控品在2℃~8℃下有效期为18个月,取失效期的试剂盒检测其空白吸光度、分析灵敏度、线性、精密度、准确度和质控品赋值有效性,试验结果满足2.3、2.4、2.5、2.6、2.8和2.9
的要求。
