山梨醇含量检测试剂盒说明书 可见分光光度法
食品安全国家标准食品中木糖醇、山梨醇、麦芽糖醇、赤藓糖醇的测定

食品安全国家标准食品中木糖醇、山梨醇、麦芽糖醇、赤藓糖醇的测定1范围本标准规定了口香糖、饼干、糕点、饮料中木糖醇、山梨醇、麦芽糖醇、赤藓糖醇的高效液相色谱一示差折光检测和蒸发光散射检测测定方法。
本标准适用于口香糖、饼干、糕点、饮料中木糖醇、山梨醇、麦芽糖醇、赤藓糖醇含量的测定。
第一法高效液相色谱一示差折光检测法2原理试样经沉淀蛋白质后过滤,上清液进高效液相色谱仪,经氨基色谱柱或阳离子交换色谱柱分离,示差折光检测器检测,外标法定量。
3试剂和材料注X:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1试剂IJ3.1.1乙腈:色谱纯。
3.2试剂配制3.2.1三氯乙酸溶液:称取10g三氯乙酸,加水溶解并定容至100 mL。
3.2.2碳酸钠溶液:称取2.12g碳酸钠,加水溶解并定容至100mL,现用现配。
3.3标准品3.3.1木糖醇纯度>9%。
3.3.2山梨醇纯度三99 %。
3.3.3麦芽糖醇纯度三99 %。
3.3.4赤藓糖醇纯度三99 %。
3.4标准溶液配制3.4.1标准储备液:分别称取1g (精确至0.1mg)木糖醇、山梨醇、麦芽糖醇、赤藓糖醇标准品,加入约25g水溶解,称量(精确至).1mg),溶液每克相当于40mg赤藓糖醇、木糖醇、山梨醇、麦芽糖醇,放置4c密封可贮藏一个月。
3.4.2标准工作液:用移液器分别准确移取各种糖醇标准储备液(3.4.1)40、60、80、100、120、150gL 于液相色谱样品瓶中,并加水至1mL。
4仪器和设备4.1高效液相色谱仪:具有示差折光检测器。
4.2色谱柱:氨基色谱柱(4.6 mmx250 mm, 5 ^m)或阳离子交换色谱柱(6.5mmx300mm)。
4.3食品粉碎机。
4.4离心机:10000X g。
4.5超声波清洗机:工作频率40KHz,功率500W。
5分析步骤5.1试样制备5.1.1口香糖取有代表性的口香糖样品至少200g,用刀片切成小碎块,置于密闭的容器内混匀。
1,5-脱水-D-山梨醇测定试剂盒(吡喃糖氧化酶法)产品技术要求huayu

1,5-脱水-D-山梨醇测定试剂盒(吡喃糖氧化酶法)适用范围:用于体外定量测定人血清中1,5-脱水-D-山梨醇的含量。
1.1 产品型号/规格试剂1:1×30 ml,试剂2:1×10 ml;试剂1:2×30 ml,试剂2:2×10 ml;试剂1:4×30 ml,试剂2:4×10 ml;试剂1:8×30 ml,试剂2:8×10 ml;试剂1:1×45 ml,试剂2:1×15 ml;试剂1:2×45 ml,试剂2:2×15 ml;试剂1:3×50 ml,试剂2:2×25 ml;试剂1:1×60 ml,试剂2:1×20 ml;试剂1:2×60 ml,试剂2:2×20 ml;试剂1:2×90 ml,试剂2:2×30 ml;试剂1:2×90 ml,试剂2:3×20 ml;试剂1:4×90 ml,试剂2:4×30 ml;试剂1:2×15 ml,试剂2:2×5 ml ;试剂1:4×15 ml,试剂2:4×5 ml ;试剂1:8×15 ml,试剂2:8×5 ml ;试剂1:16×15 ml,试剂2:16×5 ml。
校准品:1 ml/瓶×1瓶(选配)1.2 主要组成成分试剂1:对羟基苯甲基酸盐26 mmol/L葡萄糖氧化酶≥0.7 KU/mol磷酸盐缓冲液100 mmol/L4-氨基安替比林0.6 mmol/L过氧化物酶≥2.1 KU/L试剂2:磷酸盐缓冲液0.1 mol/L吡喃糖氧化酶≥1.6 KU/L牛血清白蛋白0.02%校准品(选配):Tris缓冲液100mmol/LProclin-300 0.5‰1,5-脱水-D-山梨醇目标浓度153.00μmol/L注:校准品浓度具有批差异性,具体浓度见校准品瓶签。
10山梨醇检验标准操作规程

山梨醇检验标准操作规程1范围本标准建立了山梨醇的检验标准操作规程。
本标准适用于山梨醇的质量控制与检验。
2规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款,其最新版本适用于本标准。
《中华人民共和国药典》 2010版二部《微生物限度检查检验标准操作规程》编号《山梨醇质量标准》编号3职责检验人员、复核人员对实施本标准负责。
4操作规程4.1试剂与试药甘油、氯仿、乙醚、氢氧化钠试液、碘试液、酚酞指示液、氢氧化钠滴定液(0.02mol/L)、磷酸溶液(1→10)、5%高锰酸钾溶液、10%焦亚硫酸钠溶液、硫酸溶液(3→4)、1%变色酸溶液、标准甲醇溶液、盐酸、高锰酸钾滴定液(0.02mol/L)、磷酸氢二钠的饱和溶液、高锰酸钾的饱和溶液、1%糠醛溶液、10%氢氧化钠溶液、0.001%丙酮溶液、95%硫酸。
4.2仪器与设备碱式滴定管、50ml具塞量筒、垂熔玻璃漏斗、温度计、水浴锅、比重瓶、蒸发皿、试管、干燥箱、恒温培养箱、比重瓶、干燥器。
4.3检验项目4.3.1性状4.3.1.1操作方法(1)取本品,在明亮光线下,用目测法观察其外观;用鼻闻和口尝其气;并依法观察其特性。
(2)将本品溶于水、乙醇、三氯甲烷或乙醚中,观察溶解情况。
(3) 比旋度取本品约5g,精密称定,置50ml量瓶中,加硼砂6.4g与水适量,振摇使完全溶解,并稀释至刻度(如溶液不澄明,应滤过),依法测定(附录Ⅵ E)。
4.3.1.2记录记录其外观、气味、特性、溶解情况,测比旋度4.3.1.3结果判断(1)本品为白色结晶性粉末;无臭,味甜;有引湿性;(2)在水中易溶,在乙醇中微溶,在三氯甲烷或乙醚中不溶;(3)比旋度为+4.00至+7.00。
判为符合规定。
4.3.2鉴别4.3.2.1 取本品约50mg,加水3ml溶解后,加新制的10%儿茶酚溶液3ml,摇匀,加硫酸6ml,摇匀,即显粉红色。
判为符合规定。
4.3.2.2 本品的红外光吸收图谱应与对照的图谱(光谱集26图)一致。
氟尿嘧啶山梨醇注射液的配制和含量检测

氟尿嘧啶山梨醇注射液的配制和含量检测摘要:目的:建立氟尿嘧啶山梨醇注射液的配制和含量检测。
方法:配制:用氟尿嘧啶注射液、山梨醇注射液配制并浓缩所得。
含量测定:氟尿嘧啶:紫外分光光度法,以0.1mol/LHCL溶液为溶剂,检测波长为265nm;结果:含量测定:氟尿嘧啶:紫外分光光度法重复性和精密度良好,山梨醇对测定无干扰;关键词:氟尿嘧啶;山梨醇;注射液;紫外分分光度法;氟尿嘧啶药代动力学研究证明,口服吸收差,多采用注射给药,提高疗效。
所以考虑研发氟尿嘧啶山梨醇注射液。
本制剂以氟尿嘧啶为主药,山梨醇为辅料。
作为初步研发,以氟尿嘧啶注射液与山梨醇注射液配制浓缩而成,仅供研发和检测使用。
氟尿嘧啶为白色或结晶性粉末,略溶于水,微溶于乙醇,几乎不溶于氯仿。
它的化学名称为5-氟-2,4(1H,3H)-嘧啶二酮,分子式为C4H3FN2O2。
山梨醇是白色或类白色结晶性粉末,极易溶于水,作为大输液的平衡液。
氟尿嘧啶山梨醇注射液的含量测定采用药典收载的紫外分光光度法来测定氟尿嘧啶的含量,山梨醇在氟尿嘧啶的吸收峰处无吸收。
[实验内容和结果]1.氟尿嘧啶氟尿嘧啶山梨醇注射液是以氟尿嘧啶为主药,辅料以山梨醇调节渗透压,为控制本品的质量,需制定本制剂的质量标准,为此进行实验,确定一种测定氟尿嘧啶含量的分析方法。
测定本制剂氟尿嘧啶含量的分析方法,参照中国药典收载的氟尿嘧啶注射液的检测方法[2],采用紫外分光光度法来测定单方制剂中的氟尿嘧啶含量。
1.1仪器与试药1.1.1仪器Shimadzu UV-2401PC紫外分光光度计,Mettler AE-200电子分析天平(精度0.1mg)1.1.2试药氟尿嘧啶山梨醇注射液(批号161008、161009、161010,自制),山梨醇(分析纯),0.1mol/LHCL溶液,0.1mol/LNaOH溶液,甲醇(分析纯),蒸馏水1.2方法学研究1.2.1方法精密量取本品适量,用0.1mol/L盐酸溶液定量稀释至每1ml约含氟尿嘧啶10μg的溶液,照分光光度法在265nm的波长处测定吸收度,按C4H3FN2O2的吸收系数(E 1%1cm)为552计算,即得。
荷移分光光度法测定茶碱

荷移分光光度法测定茶碱
检测茶碱采用色谱分离—能量转换电荷移分光光度法,检测原理如下:将茶碱通过色谱分离,将茶碱分离成茶喹酮和山梨醇苷。
利用能量转换电荷移分光光度法,检测茶喹酮和山梨醇苷的含量,从而检测茶碱的总量。
具体检测步骤如下:
1.将样品分离:将样品通过色谱的分离,将茶碱分离成茶喹酮和山梨醇苷两个组分。
2.电荷移分光光度定量测定:用能量转换电荷移分光光度法测定每个组分,可以准确地定量测定其中所含的茶碱含量。
3.计算总量:对测定结果求和,即可得出茶碱总量。
本法有良好的准确性、灵敏度、重现性和特异性,能够定性和定量地分析茶碱。
它可以实现样品快速,准确地检测,且简单易操作,适用于茶碱的检测。
本法的试验步骤简单易操作,操作过程安全可靠,仪器参数稳定可靠,并可实现实验操作自动化,得出茶碱总量准确,实验结果可靠。
因此,本法可以快速、准确地检测茶碱,具有良好的应用价值。
山梨糖醇实验报告

一、实验目的1. 熟悉山梨糖醇的提取方法;2. 掌握山梨糖醇的鉴定方法;3. 了解山梨糖醇的化学性质。
二、实验原理山梨糖醇(Sorbitol)是一种白色结晶性固体,具有甜味,分子式为C6H14O6。
它是一种多元醇,广泛应用于食品、医药、化妆品等领域。
本实验通过水提醇沉法提取山梨糖醇,并利用旋光仪测定其比旋光度进行鉴定。
三、实验仪器与试剂1. 仪器:旋光仪、分析天平、烧杯、玻璃棒、漏斗、滤纸、容量瓶、移液管、锥形瓶、滴定管等。
2. 试剂:山梨糖醇、无水乙醇、蒸馏水、苯酚、氯化钠、浓硫酸等。
四、实验步骤1. 提取(1)称取10g山梨糖醇样品,置于烧杯中。
(2)加入50ml蒸馏水,搅拌均匀。
(3)加入50ml无水乙醇,搅拌均匀。
(4)将混合溶液倒入漏斗中,用滤纸过滤。
(5)将滤液倒入锥形瓶中,加入适量的氯化钠,搅拌至沉淀完全。
(6)将沉淀过滤,用蒸馏水洗涤沉淀。
(7)将沉淀转移至烧杯中,加入适量蒸馏水,加热溶解。
(8)将溶液倒入容量瓶中,定容至100ml。
2. 鉴定(1)旋光度测定:取一定量的山梨糖醇溶液,放入旋光仪中,测定其比旋光度。
(2)苯酚法:取一定量的山梨糖醇溶液,加入苯酚试剂,观察颜色变化。
五、实验结果与分析1. 旋光度测定实验测得山梨糖醇溶液的比旋光度为-42.3°(c=1,1ml,20℃),与文献值-42.0°(c=1,1ml,20℃)基本一致,表明所提取的山梨糖醇纯度较高。
2. 苯酚法实验中加入苯酚试剂后,山梨糖醇溶液呈现淡紫色,与文献描述的苯酚法鉴定结果相符。
六、实验结论1. 本实验通过水提醇沉法成功提取了山梨糖醇,并利用旋光仪测定了其比旋光度,证明了所提取的山梨糖醇纯度较高。
2. 实验结果表明,苯酚法可以用于山梨糖醇的鉴定。
3. 本实验为山梨糖醇的提取与鉴定提供了可行的方法,具有一定的实际应用价值。
七、实验讨论1. 实验过程中,应注意无水乙醇的添加量,以避免影响山梨糖醇的提取效果。
建立A中药注射液中聚山梨酯80的测定方法

建立A中药注射液中聚山梨酯80的测定方法目的:研究A注射液中的聚山梨酯-80,测定其在A注射液中的含量,并为其用量提供依据;研究项目:A注射液中聚山梨酯-80含量测定方法的建立,主要从紫外-可见分光光度法来考察;结果:A注射液中聚山梨酯-80含量测定紫外-可见分光光度法方法学考察项目均在可接受标准范围内,本试验为聚山梨酯-80在A注射液中应用的进一步研究奠定了基础。
标签:A注射液;聚山梨酯-80;含量测定聚山梨酯-80,其化学名称为聚氧乙烯-20-山梨醇酐单油酸酯[1],商品名为吐温-80[2],是一种亲水型非离子型表面活性剂[3],为药物制剂中常见的辅料之一。
由于其具有较好的助溶作用,在制备难溶性药物注射剂时,常用作助溶剂、乳化剂和稳定剂[4]。
有文献报道,聚山梨酯-80的纯度与不良反应可能具有一定的关系[5]。
因此在应用该辅料时应注意对注射用聚山梨酯-80加强质量控制。
1紫外-可见分光光度法[6]硫氰酸钴铵溶液与聚山梨酯-80反应,生成物在三氯甲烷液中能够显蓝色[7],采用紫外-可见分光光度法测定A注射液中聚山梨酯-80的含量。
1.1仪器设备。
UV-2450紫外-可见分光光度计、XS105电子天平、DK-S24恒温水浴锅、分液漏斗、移液管、试管、容量瓶1.2试剂。
硫氰酸钴铵试液(硫氰酸铵17.4g与硝酸钴2.8g加水至100ml)、三氯甲烷、A注射液,聚山梨酯-80对照品,纯化水1.3试验过程1.3.1溶液稳定性1.3.1.1反应温度。
精密量取A注射液成品1.0ml,加纯化水补足至6.0ml,精密加入硫氰酸钴铵试液9.0ml,摇匀,精密加入三氯甲烷10.0ml分别在0℃、25℃、50℃水浴条件下,每30min振摇一次,观察反应状况,确定反应温度。
1.3.1.2反应时间。
精密量取A注射液成品1.0ml,加纯化水补足至6.0ml,精密加入硫氰酸钴铵试液9.0ml,精密加入三氯甲烷10.0ml,摇匀,在冰水浴中每30min振摇一次,测定前等待30min分层时间,在一段时间内连续测定吸光度,确定其稳定时间。
山梨醇脱氢酶试剂盒说明书

山梨醇脱氢酶(sorbitol dehydrogenase,SH)试剂盒说明书分光光度法50管/48样注意:正式测定前务必取2-3个预期差异较大的样本做预测定测定意义:SH(EC 1.1.1.14)催化山梨醇脱氢生成果糖,是调控生物体内山梨醇含量的关健酶之一。
测定原理:SH催化山梨醇脱氢生成果糖,同时还原NAD+生成NADH,测定340nm吸光度增加速率可以计算SH活性。
需自备的仪器和用品:紫外分光光度计、台式离心机、水浴锅、可调式移液器、1mL石英比色皿、研钵、冰和蒸馏水。
试剂组成和配制:提取液:液体60mL×1瓶,4℃保存;试剂一:液体20mL×1瓶,4℃保存;试剂二:粉剂×1瓶,4℃保存;临用前每瓶加入15mL蒸馏水,用不完的试剂仍4℃保存。
试剂三:粉剂×1瓶,-20℃保存;临用前每瓶加入15mL蒸馏水,用不完的试剂仍-20℃保存。
粗酶液提取:1、细菌或培养细胞:先收集细菌或细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细菌或细胞加入1mL提取液),超声波破碎细菌或细胞(冰浴,功率20%或200W,超声3s,间隔10s,重复30次);8000g 4℃离心10min,取上清,置冰上待测。
2、组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液),进行冰浴匀浆。
8000g 4℃离心10min,取上清,置冰上待测。
3、血清(浆)样品:直接检测。
测定步骤:1、分光光度计预热30min以上,调节波长至340nm,蒸馏水调零。
2、样本测定试剂名称(μL)测定管试剂一400试剂二300试剂三300混匀,37℃(哺乳动物)或25℃(其它物种)准确水浴5min样本50将上述试剂按顺序加入1 mL玻璃比色皿中,加样本的同时开始计时,记录20秒时的初始吸光度A1和2分20秒时的吸光度A2,计算ΔA=A2-A1。
1,5-脱水-D-山梨醇测定试剂盒(吡喃糖氧化酶法)产品技术要求baiding
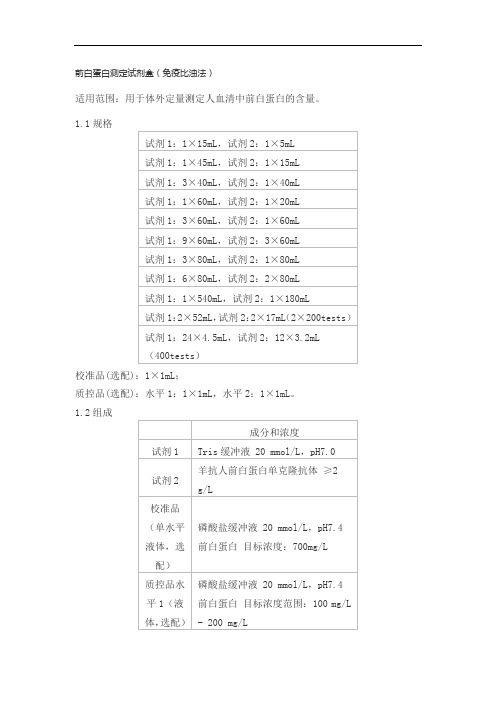
前白蛋白测定试剂盒(免疫比浊法)适用范围:用于体外定量测定人血清中前白蛋白的含量。
1.1规格校准品(选配):1×1mL;质控品(选配):水平1:1×1mL,水平2:1×1mL。
1.2组成注:校准品靶值、质控品质控范围详见包装标签。
2.1 外观2.1.1试剂1:无色液体,无浑浊,无不溶物。
2.1.2试剂2:无色至淡黄色液体,无浑浊,无不溶物。
2.1.3校准品:无色至淡黄色液体。
2.1.4质控品:无色至淡黄色液体。
2.1.5包装外观应整洁,标签字迹清晰,不易脱落。
2.2 净含量液体试剂的净含量不低于标示体积。
2.3 试剂空白吸光度试剂试剂空白吸光度≤0.5。
2.4 分析灵敏度样本浓度为50 mg/L时,△A≥0.015。
2.5 线性区间在[70,600] mg/L范围内,线性相关系数r≥0.990;测定浓度在[70,150] mg/L时,绝对偏差不超过±15 mg/L,测定浓度在(150,600] mg/L时,相对偏差不超过±10%。
2.6 精密度2.6.1 批內精密度用高、中、低3个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于10%。
2.6.2批间差用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。
2.7准确度测试国家标准物质GBW(E)090619,测试值与靶值的相对偏差应不大于10%。
2.8 质控品赋值有效性测试结果在质控范围内。
2.9 瓶内均匀性校准品和质控品瓶内均匀性(CV)应不大于10%。
2.10 量值溯源校准品量值溯源至国家标准物质GBW(E)090619。
2.11 稳定性2.11.1校准品开瓶稳定性校准品开瓶后2℃~8℃避光保存可稳定3天。
稳定期过后4小时内进行测试,测试结果与靶值的相对偏差不超过±10%。
2.11.2质控品开瓶稳定性质控品开瓶后2℃~8℃避光保存可稳定3天。
《中国药典》2020版—山梨醇溶液国家药用辅料标准

附件:山梨醇溶液Shanlichun RongyeSorbitol Solution本品为山梨醇、少量的单糖、多糖及其他麦芽糖醇、甘露醇等的混合物,系部分水解淀粉经氢化制得。
本品含D-山梨糖醇(C6H14O6)不少于45.0%(g/g)(非结晶山梨醇溶液);含D-山梨糖醇(C6H14O6)不少于64.0%(g/g)(结晶山梨醇溶液)。
【性状】本品为澄清、无色、糖浆状液体。
旋光度取本品约7.0g,置50ml 量瓶中,加硼砂6.4g 与水适量。
静置1h,偶尔摇动,用水稀释至刻度。
(如溶液不澄清,应滤过),依法测定(通则0621),比旋度应为+1.5°至+ 3.5°(非结晶山梨醇溶液);旋光度应为0°至+ 1.5°(结晶山梨醇溶液)。
电导率取本品50.0ml,作为供试品溶液;另取新沸放冷的纯化水100ml 作为空白溶液。
将供试品溶液与空白溶液置25℃±1 ℃的水浴中保温1 小时后,缓缓搅拌,用电导率仪测定,以铂黑电极作为测定电极,先用空白溶液冲洗电极3 次后,测定空白溶液的电导率,其电导率值应不得过5.0µS/cm。
取出电极,再用供试品溶液冲洗电极3 次后,测定供试品溶液的电导率,经空白校正后,不得过10µS/cm。
【鉴别】(1)取本品约1.4g,加水75ml 使溶解,作为供试品溶液;取上述溶液3ml 至15cm 试管,加新制的10%邻苯二酚试液3ml,摇匀,加硫酸6ml,摇匀,加热30s,即显深粉色或酒红色。
(2)在含量测定项下记录的色谱中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
【检查】酸度取本品1.4g,加水至10ml,依法检查(通则0631),pH 值应为5.0~7.5。
溶液的澄清度与颜色取本品7.0g,置50ml 量瓶中,用水稀释至刻度,混匀,依法检查(通则0901 与通则0902),溶液应澄清无色。
还原糖取本品适量(含无水物3.3g),置锥形瓶中,加3ml 水使溶解,加碱性枸橼酸铜试液20ml,加玻璃珠或沸石数粒,加热使在4~6 分钟内沸腾,保持沸腾3 分钟。
山梨醇溶液(1.1molL,无菌)

北京雷根生物技术有限公司
山梨醇溶液(1.1mol/L,无菌)
产品简介:
山梨醇(Sorbitol)又称山梨糖醇、己六醇、D-山梨醇等,是一种不挥发多元糖醇。
CAS 号为50-70-4,分子量为182.17。
用于日化行业作为保湿剂、防冻剂等;用于食品行业作为保鲜剂、甜味剂等;用于医药行业作为维生素C的生产原料等。
Leagene Sorbitol solution用于染色剂的衬染剂、分离细胞核等,经高压灭菌处理。
产品组成:
注意事项:
1、为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期:6个月有效。
相关产品:
产品编号 产品名称
CC0007 磷酸缓冲盐溶液(10×PBS,无钙镁)
CS0001 ACK红细胞裂解液(ACK Lysis Buffer)
CS0151 山梨醇溶液(1mol/L,无菌)
CT0026 MTT细胞增殖及细胞毒性检测试剂盒
CZ0063 改良台氏液(Tyrode's solution)
DA0020 Hoechst33342/PI细胞凋亡染色试剂盒
DG0005 糖原PAS染色液
NA0030 Tris-乙酸电泳缓冲液(50×TAE)
NH0043 SSC缓冲液(20×,pH7.0)。
山梨醇溶液总糖含量计算_概述说明以及解释

山梨醇溶液总糖含量计算概述说明以及解释1. 引言1.1 概述山梨醇溶液总糖含量的计算是针对山梨醇溶液中糖分含量的评估和测定。
作为一种重要的指标,总糖含量可以用来评估山梨醇溶液的甜度和品质,并且在食品工业中有广泛的应用。
本文将介绍山梨醇溶液总糖含量计算的方法和原理,并对其重要性进行解释。
1.2 文章结构本文共分为五个部分。
引言部分将介绍文章的背景和目的,以及文章结构。
第二部分将探讨山梨醇溶液总糖含量在食品工业中的应用以及对溶液质量的影响。
第三部分将详细阐述计算山梨醇溶液总糖含量的方法和原理,包括蒸发法、光学测定法和酶解法等。
第四部分将展示样品测试数据并进行结果分析与解释,同时比较结果与期望值之间的差异和误差。
最后,第五部分将给出主要发现与结果总结,并提出未来研究方向和改进建议。
1.3 目的本文的目的是全面解释和说明计算山梨醇溶液总糖含量的方法和原理,并探讨其在食品工业中的重要性。
通过展示实际测试数据并进行分析,将进一步验证这些方法的准确性并提出改进建议。
最终,本文的目标是为相关研究人员和食品工业从业者提供一个全面而可靠的了解山梨醇溶液总糖含量计算的指南。
2. 山梨醇溶液总糖含量的重要性2.1 山梨醇溶液在食品工业中的应用山梨醇溶液作为一种常用的食品添加剂,在食品工业中具有广泛的应用。
它被广泛用于制造各种食品和饮料,如蛋糕、糕点、冰淇淋、果冻、罐头等。
山梨醇不仅可以增加食品的甜度,还能起到保湿、口感改善等多种功能。
因为山梨醇具有与蔗糖相似的甜度,但卡路里含量较低,并且对血糖和胰岛素的影响也相对较小,所以它被广泛使用在一些需要减少糖分摄入的产品中。
此外,山梨醇还具有耐高温性和抗水分损失等特点,使其成为一种理想的替代品。
2.2 总糖含量对山梨醇溶液质量的影响山梨醇溶液中总糖含量是评价其质量的重要指标之一。
总糖含量的高低会直接影响到山梨醇溶液的甜度和质地。
如果总糖含量太高,可能会导致产品过于甜腻,口感不佳;而总糖含量过低,则可能无法达到预期的甜度要求。
中国药典山梨醇含量测定

中国药典山梨醇含量测定1.引言1.1 概述在撰写长文《中国药典山梨醇含量测定》时,引言部分的第一小节是概述。
在这一小节中,我们可以对文章的主要内容进行简要介绍,并概括提及山梨醇以及其在中国药典中的重要性。
下面是一个可能的内容示例:概述山梨醇(Sorbitol)是一种重要的天然物质,广泛存在于植物和动物体内。
它具有甜味、无毒、膳食纤维特性以及对人体的一些生理活性作用,因此在医药、食品、化妆品等领域有着广泛的应用。
作为一种重要成分,山梨醇在中国药典中也备受关注并有着相应的质量标准。
文章的目的主要是探究山梨醇在中国药典中的含量测定方法与应用意义。
通过对文献资料和相关研究的综合分析,我们将论述山梨醇的定义、特性以及它在中国药典中的重要性。
在结论部分,我们将重点介绍山梨醇含量测定的方法、原理、应用以及其对药物质量控制的意义。
这篇长文旨在为读者提供关于山梨醇的综合性了解,并为药品生产和质量控制部门提供参考和指导,以确保药物中山梨醇含量的准确测定和合理控制。
1.2文章结构文章结构:本文主要包括引言、正文和结论三个部分。
引言部分主要概述了本文的主题和背景,并介绍了山梨醇在中国药典中的重要性。
其中,概述部分对山梨醇含量测定的目的进行了简明扼要的说明,文章结构部分的内容则主要对整篇文章的结构进行了介绍,让读者能够清晰了解文章的组织架构。
正文部分主要包括了山梨醇的定义和特性,以及山梨醇在中国药典中的重要性。
在山梨醇的定义和特性部分,将对山梨醇的性质进行详细描述,包括其化学性质、物理性质以及在生物学和医药领域的应用等方面,通过这些内容,读者能够对山梨醇有一个全面的了解。
而在山梨醇在中国药典中的重要性部分,则主要介绍了山梨醇在中国药典中的地位和作用,以及其在临床应用中的重要价值。
结论部分主要包括了山梨醇含量测定的方法和原理,以及其应用和意义。
在山梨醇含量测定的方法和原理部分,将详细介绍目前常用的测定山梨醇含量的方法和所依据的原理,以及该方法的优缺点。
山梨醇的还原糖检测方法 -回复

山梨醇的还原糖检测方法-回复山梨醇是一种天然的多元醇,也被称为山梨糖醇或山梨醇糖。
它广泛用于食品和药物工业中,作为甜味剂、保湿剂和稳定剂。
而针对山梨醇的还原糖检测方法,可以通过以下几个步骤进行。
第一步:样品制备首先,需要准备待测的样品。
如果是食品中的山梨醇,可以选择将样品进行粉碎或者搅拌均匀,以确保样品中的山梨醇分布均匀。
然后,根据需要,可以将样品进行稀释,以便在检测中获得更准确的结果。
第二步:还原糖的选取在进行山梨醇的还原糖检测之前,需要选择一种适合的还原糖。
常用的还原糖有邻苯二甲酸二乙酯(EDTNA)和邻苯二甲酸二取代甲酯(EDTMA)等。
选择还原糖的关键是要确定其与山梨醇之间的反应性和选择性。
第三步:样品与还原糖的反应将待测样品与选定的还原糖混合,然后在一定的温度和时间下进行反应。
在这个反应过程中,山梨醇会与还原糖发生反应,产生还原糖的还原端和一个具有较强吸收能力的产物。
第四步:产物的检测检测产物可以使用光学分析技术,如紫外-可见吸收光谱法(UV-Vis)或荧光光谱法。
还原糖的产物通常在特定波长下具有吸收或荧光峰,通过测量这些吸收或荧光信号的强度,可以确定山梨醇的含量。
第五步:定量分析为了进行定量分析,可以根据还原糖产物的吸光度或荧光强度构建标准曲线。
首先,制备一系列已知浓度的山梨醇标准溶液,并对这些标准溶液进行上述步骤的处理和检测。
然后,根据标准曲线的结果,可以通过测量待测样品的吸光度或荧光强度来确定山梨醇的含量。
第六步:数据处理和结果分析最后,根据测得的样品吸光度或荧光强度值和建立的标准曲线,计算出待测样品中山梨醇的浓度。
对于复杂样品,可能需要采用前处理技术,如液相色谱-质谱联用技术(LC-MS)或气相色谱-质谱联用技术(GC-MS)来帮助分离和鉴定山梨醇。
引用文献:1. Zhang, W., et al. (2011). Determination of xylitol in food by high performance liquid chromatography coupled to electrospray quadrupole-time-of-flight mass spectrometry. Food Chemistry, 128(4): 1084-1089.2. Okiyama, A., et al. (1999). Untargeted glycerolipidomics reveals active lipid metabolism in embryos of the oilseed crop Ricinuscommunis. Analytical Chemistry, 93(21): 4707-4716.请注意,这只是一种一般的还原糖检测方法,具体的步骤和实验条件可能因实验目的、设备和样品的不同而有所调整。
山梨醇脱氢酶诊断试剂盒及山梨醇脱氢酶活性浓度测定方法[发明专利]
![山梨醇脱氢酶诊断试剂盒及山梨醇脱氢酶活性浓度测定方法[发明专利]](https://img.taocdn.com/s3/m/7e9fc87f2f3f5727a5e9856a561252d380eb208c.png)
[19]中华人民共和国国家知识产权局[12]发明专利申请公布说明书[11]公开号CN 101173896A[43]公开日2008年5月7日[21]申请号200610097310.5[22]申请日2006.10.30[21]申请号200610097310.5[71]申请人苏州艾杰生物科技有限公司地址215021江苏省苏州市工业园区机场路328号国际科技园122B[72]发明人王尔中 [51]Int.CI.G01N 21/78 (2006.01)G01N 21/25 (2006.01)C12Q 1/32 (2006.01)C12Q 1/00 (2006.01)权利要求书 2 页 说明书 6 页[54]发明名称山梨醇脱氢酶诊断试剂盒及山梨醇脱氢酶活性浓度测定方法[57]摘要本发明涉及一种利用酶比色法技术的山梨醇脱氢酶诊断试剂盒,同时本发明还涉及测定山梨醇脱氢酶活性浓度的方法原理、试剂的组成及成分,属于医学检验测定技术领域。
本发明的试剂盒主要成分包括:缓冲液、辅酶、山梨醇及稳定剂;通过将样品与试剂按一定的体积比混合,使之发生一系列的酶促反应,再将反应物置于紫外/可见光分析仪下,检测主波长340nm处吸光度上升的速度,从而测算出山梨醇脱氢酶的活性浓度大小。
采用本发明完全可以通过紫外/可见光分析仪器得出所需的测定结果。
200610097310.5权 利 要 求 书第1/2页1.一种利用酶比色法技术的山梨醇脱氢酶活性浓度测定方法,其方法原理如下:山梨醇+辅酶山梨醇脱氢酶 山梨糖+还原型辅酶将最终反应物置于紫外/可见光分析仪或半、全自动生化分析仪下,检测主波长340n m吸光度上升的速度,测算出山梨醇脱氢酶的活性浓度大小测定结果。
2.一种山梨醇脱氢酶诊断试剂盒,主要成分包括: 缓冲液 20-500mmol/L稳定剂 1-50mmol/L辅酶 1-6mmol/L山梨醇 1-50mmol/L其特征在于:试剂盒可以是干粉状态,在使用前加水溶解后使用;也可以配制成液体试剂,直接使用。
1,5-脱水-D-山梨醇测定试剂盒(酶法)[1,5-AG]产品技术要求豪迈
![1,5-脱水-D-山梨醇测定试剂盒(酶法)[1,5-AG]产品技术要求豪迈](https://img.taocdn.com/s3/m/330d55db8e9951e79a89272e.png)
1,5-脱水-D-山梨醇测定试剂盒(酶法)[1,5-AG]适用范围:本试剂用于体外定量测定人血清中1,5-脱水山梨醇[1,5-AG]的浓度。
1.1包装规格1.2主要组成成分本试剂由试剂1(R1)和试剂2(R2)组成试剂1(R1):磷酸氢二钠 2.84g/L磷酸二氢钾 10.88g/L4-氨基安替比林 1.5mmol/L己糖激酶 4KU/L腺嘌呤核苷三磷酸1mmol/L丙酮酸激酶 3KU/L磷酸烯醇式丙酮酸 4mmol/L抗坏血酸氧化酶 5KU/LTritonX-100 0.5g/L酶稳定剂k-80 1.5g/Lproclin300 0.5g/L试剂2(R2):磷酸氢二钠 2.84g/L磷酸二氢钾 10.88g/L羟基甲苯磺酰碘苯 4.5mmol/L过氧化物酶 5KU/L酶稳定剂k-80 2g/L吡喃糖氧化酶 7KU/Lproclin300防腐剂 0.5g/L2.1 外观试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰;R1试剂应为无色澄清液体,R2试剂应为无色或淡黄色澄清液体。
液体试剂不得有沉淀和絮状物。
2.2 净含量用通用量具测量,液体试剂的净含量应不少于标示值。
2.3 试剂空白在548nm处测定试剂空白吸光度,应≤1.8A。
2.4 分析灵敏度测试200umol/L的被测物时,吸光度变化(ΔA)应不低于0.005A。
2.5 准确性参照EP9-A2的方法,用比对试剂盒同时测试40例线性范围内的不同浓度的血清样本,其相关系数(r)不小于0.990;每个浓度点在[6.2,30)umol/L范围内绝对偏差不超过±3umol/L;[30,300]umol/L范围内相对偏差不超过±10%。
2.6 重复性用两个水平的样本检测,检测结果批内变异系数(CV)应不超过7%。
2.7 线性2.7.1在[6.2,300]umol/L范围内,线性相关系数r应不低于0.990;2.7.2 在[6.2,30)umol/L范围内绝对偏差不超过±3umol/L;[30,300]umol/L 范围内相对偏差不超过±10%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
山梨醇含量检测试剂盒说明书可见分光光度法
注意:正式测定前务必取2-3个预期差异较大的样本做预测定
货号:BC2520
规格:50T/48S
产品内容:
试剂一:液体15mL×1瓶,4℃保存;
试剂二:液体15mL×1瓶,4℃保存;
标准品:粉剂10mg×1支,4℃保存。
产品说明:
山梨醇广泛存在于动物、植物、微生物和培养细胞中,不仅是糖运输形式之一,而且与生物抗逆性和食物风味密切相关。
因此,在糖代谢、抗逆性和食品研究中经常需要检测山梨醇含量变化。
山梨醇在碱性溶液中与铜离子形成蓝色络合物,在655nm波长有特征吸收峰。
需自备的仪器和用品:
可见分光光度计、水浴锅、可调式移液器、1mL玻璃比色皿、研钵、冰和蒸馏水。
操作步骤:
一、山梨醇的提取:
按照组织质量(g):蒸馏水体积(mL)为1:5~10的比例(建议称取约0.2g组织,加入2mL蒸馏水),研磨成匀浆,95℃水浴10分钟(盖紧,以防止水分散失),冷却后,8000g,25℃离心10min,取上清液待测。
标准样品准备:将标准液用1ml蒸馏水溶解,溶液浓度为10mg/ml,稀释至2、1、0.5、0.25、0.125、0mg/ml。
二、测定步骤
1、分光光度计预热30min以上,调节波长至655nm,蒸馏水调零。
2、加样表(在EP管中依次加入下列试剂):
试剂(μL)标准管测定管
试剂一150150
试剂二140140
样本1000
标准液1000
混匀后室温静置15min,10000g,25℃离心10min,取上清液测655nm下吸光值A。
三、山梨醇含量计算:
1、根据标准溶液的浓度和吸光度建立标准曲线;y为标准品浓度(mg/mL),x为吸光值。
计算样本中山梨
醇的含量y值(mg/ml)。
2、按照样本质量计算
山梨醇含量(mg/g鲜重)=y×V1÷(W×V1÷V2)=2×y÷W
3、按照样本蛋白浓度计算
山梨醇含量(mg/mg prot)=y×V1÷(V1×Cpr)=y÷Cpr
V1:加入样本体积,1mL;
V2:加入提取液体积,2mL;
Cpr:样本蛋白质浓度,mg/mL;
W:样本质量,g。
