实验2-化合物的晶体结构
第二部分晶体的结构

第⼆部分晶体的结构第⼆部分晶体结构2.1 晶体学基础概述根据结合键类型不同,晶体可分为⾦属晶体、离⼦晶体、共价晶体和分⼦晶体。
晶体结构:晶体中原⼦(离⼦或分⼦)在三维空间的具体排列⽅式。
空间点阵与晶胞1.相关概念空间点阵(lattice)晶格(space lattice)阵点(结点)晶胞(cell)选取晶胞应遵循⼀定的原则晶胞⼤⼩和形状表⽰⽅法⼆、晶系和布拉菲点阵根据晶体的对称性和每个阵点周围具有相同的环境,布拉菲运⽤数学⽅法推算,将花样繁多的晶体结构归纳为14种空间点阵(称为布拉菲点阵)。
根据晶格常数a、b、c及α、β、γ是否相等,⼜将14中空间点阵归属于七⼤晶系。
晶体结构和空间点阵之间的区别空间点阵(space lattice):晶体中质点排列的⼏何学抽象,⽤以描述和分析晶体结构的周期性和对称性。
由于各阵点的周围环境相同,只有14种类型。
晶体结构(crystal structure):晶体中原⼦(离⼦或分⼦)在三维空间的具体排列⽅式。
由于组成晶体的物质质点及其排列⽅式不同,晶体结构是⽆限的,但总能按其原⼦(分⼦或离⼦)排列的同期性和对称性,归属于14种空间点阵中的⼀种。
七⼤晶系:1.三斜晶系(triclinic system):a≠b≠c,α≠β≠γ≠ 90°2.单斜晶系(monoclinic system ):a≠b≠c,α=γ=90°≠β2.正交(斜⽅)晶系(orthogonal system ):a≠b≠c,α=β=γ= 90°4.四(正)⽅晶系(tetragonal system ):a=b ≠ c,α=β=γ=90°5.⽴⽅晶系(cubic system ):a=b=c,α=β=γ=90°6.六⽅晶系(hexagonal system ):a=b ≠ c,α=β=90°,γ=120°7.菱形晶系(rhombohedral system):a=b=c,α=β=γ≠90°⼗四种空间点阵:1 简单⽴⽅点阵:a=b=c,α=β=γ =90°2 体⼼⽴⽅点阵:a=b=c,α=β=γ =90°3 ⾯⼼⽴⽅点阵:a=b=c,α=β=γ =90°4 简单四⽅点阵:a=b ≠ c,α=β=γ =90°5体⼼四⽅点阵:a=b ≠ c,α=β=γ =90°6 简单菱⽅点阵:a=b=c,α=β=γ≠ 90°7 简单六⽅点阵:a=b ≠ c,α=β=90°,γ =120°8 简单正交点阵:a≠b≠c,α= β= γ = 90°9 底⼼正交点阵:a≠b≠c,α= β= γ = 90°10 体⼼正交点阵:a≠b≠c,α= β= γ = 90°11 ⾯⼼正交点阵:a≠b≠c,α= β= γ = 90°12 简单单斜点阵:a≠b ≠c α= β =90°≠γ12 底⼼单斜点阵:a≠b ≠c α= β =90°≠γ14 简单三斜点阵:a≠b≠c α≠β≠γ≠90°⾦属晶体的结构主要为:FCC、BCC、HCP三、晶向指数和晶⾯指数1.⽴⽅晶系中的晶向指数晶向指数的确定⽅法晶向指数规律2.⽴⽅晶系中的晶⾯指数晶⾯指数的确定⽅法晶⾯指数规律2.六⽅晶系的晶向和晶⾯指数4.晶带晶带(zone)——相交或平⾏于某⼀直线的所有晶⾯的组合晶带轴:此直线为晶带轴。
无机化合物的晶体结构与性质

无机化合物的晶体结构与性质无机化合物是由元素形成的化合物,其晶体结构与性质在化学研究中起着重要的作用。
本文将探讨无机化合物晶体结构与性质之间的关系,并介绍一些相关的实例。
一、晶体结构对性质的影响无机化合物的晶体结构直接影响其性质。
不同无机物质的晶体结构具有不同的对称性、原子组织和间隙结构,从而导致不同的物理和化学性质。
1. 对称性晶体的对称性是指在三维空间中可以通过操作将其自身重复的性质。
不同的对称性可以影响晶体的光学、电学、声学和磁学等性质。
例如,具有六角晶系结构的石英具有优异的光学性质,可以广泛应用于光学仪器领域。
2. 原子组织晶体结构中的原子或离子排列方式对化合物的性质具有重要影响。
例如,金刚石的晶体结构由碳原子组成,每个碳原子与周围四个碳原子形成共价键,使得金刚石具有良好的硬度和热导性。
3. 间隙结构某些无机化合物的晶体结构存在空隙,这些空隙可以容纳其他原子或分子。
这种间隙结构可以影响化合物的吸附能力、催化性能和电导率等。
例如,氢氧化镁晶体结构中的水分子可以嵌入晶格空隙,使其具有吸湿性能。
二、无机化合物的晶体结构类别无机化合物的晶体结构可以分为离子晶体、共价晶体、金属晶体和化合物晶体等。
1. 离子晶体离子晶体由阳离子和阴离子通过离子键相互组合而成。
其晶体结构通常具有高对称性,例如岩盐结构、螺旋晶格和封闭晶格等。
离子晶体中的阳离子和阴离子之间的电荷平衡是维持稳定结构的关键。
2. 共价晶体共价晶体由原子通过共价键相互连接而成。
其晶体结构通常较为复杂,如硅晶体、钻石结构等。
共价键的形成使得共价晶体具有较高的硬度和熔点。
3. 金属晶体金属晶体由金属原子通过金属键连接而成。
金属晶体的晶体结构通常具有高密度和可塑性,且有电子在晶格中自由运动的特性。
典型的金属晶体结构包括面心立方晶格和体心立方晶格等。
4. 化合物晶体化合物晶体是由两种或多种不同的原子或离子通过离子键、共价键或金属键相互连接而成的。
化合物晶体的晶体结构通常是由多个单元晶体构成的复杂结构,如NaCl型结构、锌蓝型结构和钙钛矿结构等。
第二章 晶体结构

第二章晶体结构【例2-1】计算MgO和GaAs晶体中离子键成分的多少。
【解】查元素电负性数据得,,,,则MgO离子键%=GaAs离子键%=由此可见,MgO晶体的化学键以离子键为主,而GaAs则是典型的共价键晶体。
【提示】除了以离子键、共价键结合为主的混合键晶体外,还有以共价键、分子间键结合为主的混合键晶体。
且两种类型的键独立地存在。
如,大多数气体分子以共价键结合,在低温下形成的晶体则依靠分子间键结合在一起。
石墨的层状单元内共价结合,层间则类似于分子间键。
正是由于结合键的性质不同,才形成了材料结构和性质等方面的差异。
从而也满足了工程方面的不同需要。
【例2-2】NaCl和MgO晶体同属于NaCl型结构,但MgO的熔点为2800℃, NaC1仅为80l℃,请通过晶格能计算说明这种差别的原因。
【解】根据:晶格能(1)NaCl晶体:N0=6.023×1023 个/mol,A=1.7476,z1=z2=1,e=1.6×10-19 库仑,,r0===0.110+0.172=0.282nm=2.82×10-10 m,m/F,计算,得:E L=752.48 kJ/mol(2)MgO晶体:N0=6.023×1023个/mol,A=1.7476,z1=z2=2,e=1.6×10-19库仑,r0==0.080+0.132=0.212 nm=2.12×10-10 m,m/F,计算,得:E L=3922.06 kJ/mol则:MgO晶体的晶格能远大于NaC1晶体的晶格能,即相应MgO的熔点也远高于NaC1的熔点。
【例2-3】根据最紧密堆积原理,空间利用率越高,结构越稳定,但是金刚石的空间利用率很低,只有34.01%,为什么它也很稳定?【解】最紧密堆积的原理只适用于离子晶体,而金刚石为原子晶体,由于C-C共价键很强,且晶体是在高温和极大的静压力下结晶形成,因而熔点高,硬度达,很稳定。
3-常见晶体结构

小结和作业
1 典型金属的晶体结构(面、体、密)
2 常见无机化合物晶体结构
以立方晶系为主 离子取代原子
重点:各典型金属的晶体结构的晶体学参数
3 固溶体的晶体结构(置换、间隙) 4 固溶体的性能(固溶强化)
作业:1、试从晶体结构的角度说明间隙固溶体、间隙相以及间隙化合物 之间的区别; 2、有一正交点阵,点阵常数a=b、c=a/2,某晶面在3个晶 轴上的截距分别为2个,3个和6个原子间距,求该晶面的密勒指数。 3、解释概念:配位数 、致密度、固溶强化
V K= V 0
V
V0
一个晶胞中原子所占的体积
一个晶胞的体积
在元素周期表一共约有110种元素,其中80
多种是金属,占2/3。而这80多种金属的晶体 结构大多属于三种典型的晶体结构。它们分 别是: 体心立方、面心立方、密排六方
二 典型金属的晶体结构
结构特点:以金属键结合,靠失去外层电子的金属离子 与自由电子的吸引力。无方向性,对称性较高的密 堆结构。 常见结构:
图2-45 面心立方结构
面心立方结构ABCABC排列
沿着面心立方的体对角线观察,就可以看到(111)面的这种堆 垛方式
密排六方结构:属于六方紧密堆积,以ABAB ...的堆积方式堆 积,具有这种结构的金属有:Mg、Zn、α-Ti等
图2-46 密排六方结构
体心立方结构:属于体心立方紧密堆积,原子是以体 心立方空间点阵的形式排列,具有这种结构的金属 有: α-Fe 、Cr、 V、Mo、W等
有序化
EAB结合能与EAA+EBB/2
原子间结合能是指原子结合时克服原子 间相互作用力外力所作的功。结合能越 大,原子越不容易结合。
第二章 晶体结构-3

钙钛矿结构
• 正交晶系和立方晶系两种变体(600℃)
立方钙钛矿
Ca2+占据顶角,O2-占据面心, Ti4+位于晶胞中心
(b)反映Ca2+配位的晶胞结构 (另一种晶胞取法)
Ca2+
O2- Ti4+
Ca2+
O2-和Ca2+半径相似,共同构成面心立方堆积, Ca2+占据顶角,O2-占据面心,Ti4+填充 1/4[TiO6]八面体空隙. Ti4+,CN=6; Ca2+ CN=12 晶胞分子数1
3.立方ZnS(闪锌矿,zincblende)型结构
闪锌矿属于立方晶系,点群3m,空间群F3m,其结构与 金刚石结构相似,如图1-17所示。 结构中S2-离子作面心立方堆积,Zn2+离子交错地填充于8 个小立方体的体心,即占据四面体空隙的1/2,正负离子的配
位数均为4。一个晶胞中有4个ZnS“分子”。整个结构由Zn2+
和S2-离子各一套面心立方格子沿体对角线方向位移1/4体对角 线长度穿插而成。由于Zn2+离子具有18电子构型,S2-离子又 易于变形,因此,Zn-S键带有相当程度的共价键性质。常见 闪锌矿型结构有Be,Cd,Hg等的硫化物,硒化物和碲化物以
及CuCl及-SiC等。
3)闪锌矿ZnS结构(立方-ZnS)
4)纤锌矿ZnS结构(六方-ZnS)
• 六方晶系 a=0.382nm,c= 0.625nm • S2-构成六方密堆积 • Zn2+填充1/2四面体空隙 •Zn2+和S2-离子的配位数均为 4.[ZnS4]及[SZn4] •晶胞分子数为2 •可看成Zn、S各一套穿插而成
常见纤锌矿结构的晶体有BeO、ZnO、CdS、 GaAs等
(a)晶胞结构图
晶体结构(共78张PPT)

山东大学材料科学基础
共价键结合,有方 向性和饱和性,键 能约80kJ/mol
Si,InSb, PbTe
金属键结合, 无方向性,配 位数高,键能 约80kJ/mol
Fe,Cu,W
范得华力结合 ,键能低, 约 8-40 kJ /mol
Ar,H2,CO2
熔点高
强度和硬度由中到 高,质地脆
闪锌矿〔立方ZnS〕结构 S
Zn
属于闪锌矿结构的晶体有β-SiC,GaAs,AlP,InSb
山东大学材料科学基础
•
•
•
•
萤石〔CaF2〕型结构
立方晶系Fm3m空间群,
a0=0.545nm, Z=4。 AB2型化合物, rc/ra>0.732〔0.975〕 配位数:8:4
Ca2+作立方紧密堆积,
F-填入全部四面体 空隙中。 注意:所有八面 体空隙都未被占据。
山东大学材料科学基础
钙钛矿〔CaTiO3〕结构
Ti
ABO3型
立方晶系:以
•
一个Ca2+和3个
O2-作面心立方
Ca
密堆积,
Ti4+占1/4八面体C空aT隙iO3。晶胞 配位多面体连接与Ca2+配位数
Ti4+配位数6,rc/ra=0.436(0.414-0.732)
Ca2+配位数12,rc/ra=0.96
O2-配位数6;
取决温度、组成、掺杂等条件,钙钛矿结构呈现立方、
四方、正交等结构形式。
山东大学材料科学基础
许多化学式为ABO3型的化合物,其中A与B两种阳 离子的半径相差颇大时常取钙钛矿型结构。在钙钛矿 结构中实际上并不存在一个密堆积的亚格子,该结构 可以看成是面心立方密堆积的衍生结构。较小的B离 子占据面心立方点阵的八面体格位,其最近邻仅是氧 离子。
晶体结构2

第二讲—化合物晶体结构
主讲:王宇斌
2010-2011学年第Ⅰ学期
• 原子晶体、分子晶体和金属晶体结构
• 典型无机化合物晶体结构
– NaCl型、闪锌矿型、萤石型
– 钙钛矿型、纤锌矿型、金红石型
– 金刚石和石墨、CsCl型 • 硅酸盐晶体结构质是晶体内部结构的反应 • 晶体结构概述 • 1.原子晶体结构 • 代表:惰性气体 结构特点:以单原子分子 形式存在,满电子层结构,不形成化学键, 且具有球形对称结构;惰气通过范德华力 凝聚成晶体,原子配置近似“钢球”密堆 积:FCC or HCP
3
2013-7-10
• 2.分子晶体结构 • 代表:白磷 • 结构特点:构成晶体 的结构单元为分子, 分子内原子靠共价键 结合,分子之间靠范 德华力结合
结构决定性质:范德华很弱,分子晶体在较低 温度下即能熔融或升华,分解为分子单位;分 子内共价键为强键,分子自身离解需很高温度
2013-7-10
• 3.金属晶体结构 • 如上章所讲,金属原子看作刚性球体,作 紧密堆积 • 堆积方式:面心立方,体心立方和六方紧 密堆积
[ZnS4]四面体以反向“一坐三”的方式在空间中堆积
25
+++++++
------+ + + + + + +
+
+ -
+++++++
----------
26
• 二. AX型结构 • 1). 萤石结构CaF2 – 立方晶系:a=0.545nm – r +/r-=0.975 – CN(Ca2+)=8 – 面心立方格子Ca2+一套,F -两套穿插而成 – 可看成:Ca2+按面心立方密 堆积,F-填充全部四面体空隙 – 立方体晶胞共棱连接 – 一半立方体空隙未填充
无机材料科学基础第二章-晶体结构-第6节(3)

CaO静电键强度与MgO相同,但晶体结构疏松,不稳定,易水 化。因为Ca2+离子半径大,使O2-离子的立方密堆积紧密程度变 松。 CaO 的晶格能为3469KJ/mol ,熔点2560 ℃。
6
2、CsCl型
r+/r- = 0.93(大于0.732)
CsCl晶体为Pm3m空间群(立方原始格子); a0=0.411nm; Cl-按简立方形式堆积,位于立方体的8个角顶上;Cs+填充在立方体 中心。 Cl-、Cs+的配位数均为8;单位晶胞中的分子数Z=1;
r+/r- = 0.102/0.181=0.56 (0.414~0.732)
3
②球体紧密堆积方法:Cl-按面心立方紧密堆积,Na+填入 全部八面体空隙(Na︰Cl=1︰1); ③配位多面体及其连接方式:[NaCl6]八面体以共棱方式 连接,该描述方法适宜于复杂晶体结构。
NaCl中的正八面体结构
4
属于NaCl型结构的晶体很多,表2-7所示。
按离子堆积分析, O2-按变 形的六方密堆积, Ti4+只填 充了O2-所形成的八面体空隙 的一半(Ti︰O=1 ︰2)。
16
晶胞中质点的坐标为:Ti4+(000),(1/2 1/2 1/2);
O2-(uu0),((1-u) (1-u) 0),((1/2+u)(1/2-u)1/2),
1号点 2号点 4号点 3号点
单位晶胞中质点的坐标如图所示。 属于CsCl结构的晶体有CsBr、CsI、NH4Cl 等。
7
3、闪锌矿(立方ZnS)型结构(共价晶体)
闪锌矿为Fm3m 空间群, a0=0.540nm。面心立方格子,S=按立方 紧密堆积,Zn2+交错处于八分之一小立方体中心,占据四面体空 隙的一半; 质点坐标及投影图如图所示。
§2-5 合金与金属间化合物常见晶体结构

2.3合金相结构[1]虽然纯金属在工业中有着重要的用途,但由于其强度低等原因,因此,工业上广泛使用的金属材料绝大多数是合金。
所谓合金是指由两种或两种以上的金属或金属与非金属经熔炼、烧结或其他方法组合而成并具有金属特性的物质。
组成合金的基本的独立的物质称为组元。
组元可以是金属和非金属元素,也可以是化合物。
例如,应用最普遍的碳钢和铸铁就是主要由铁和碳所组成的合金;黄铜则为铜和锌的合金。
改变和提高金属材料的性能,合金化是最主要的途径。
欲知合金元素加人后是如何起到改变和提高金属性能的作用,首先必须知道合金元素加人后的存在状态,即可能形成的合金相及其组成的各种不同组织形态。
而所谓相是合金中具有同一聚集状态、同一晶体结构和性质并以界面相互隔开的均匀组成部分。
由一种相组成的合金称为单相合金,而由几种不同的相组成的合金称为多相合金。
尽管合金中的组成相多种多样,但根据合金组成元素及其原子相互作用的不同,固态下所形成的合金相基本上可分为固溶体和中间相两大类。
固溶体是以某一组元为溶剂,在其晶体点阵中溶入其他组元原子(溶质原子)所形成的均匀混合的固态溶体,它保持着溶剂的晶体结构类型;而如果组成合金相的异类原子有固定的比例,所形成的固相的晶体结构与所有组元均不同,则称这种合金相为金属化合物。
这种相的成分多数处在A在B中溶解限度和B在A中的溶解限度之间,因此也叫做中间相。
合金组之间的相互作用及其所形成的合金相的性质主要是由它们各自的电化学因素、原子尺寸因素和电子浓度三个因素控制的。
2.3.1固溶体固溶体晶体结构的最大特点是保持着原溶剂的晶体结构。
根据溶质原子在溶剂点阵中所处的位置可将固溶体分为置换固溶体和间隙固溶体两类,下面即来分别加之讨论。
1.置换固溶体当溶质原子溶入溶剂中形成固溶体时,溶质原子占据溶剂点阵的阵点,或者说溶质原子置换了溶剂点阵的部分溶剂原子,这种固溶体就称为置换固溶体。
金属元素彼此之间一般都能形成置换固溶体,但溶解度视不同元素而异,有些能无限溶解,有的只能有限溶解。
第二章 晶体结构(3)-无机单质及化合物晶体结构

远。双层之间原子不接触,每一单层内的原子(即
构成平面六角形的各原子)也不接触,它们只和同 一双层中的另一单层内的最近邻原子相接触,因而
配位数是3,如图中示出原子1的3个最近邻配位原
子是2、3和4。由此可见,共价键存在于双层内, 而双层与双层之间则是分子键。
层状结构: 层内六节环,C-C原子间距 0.142nm,共价键相连; 层间C -C原子间距0.335nm, 范德华键相连。 C原子四个外层电子在层内形成三个共价键,配位数为3, 多余一个电子可在层内移动,与金属中自由电子类似,因此,
平行于碳原子层方向具有良好导电性。
第二章 晶体结构——2.3~4无机单质及化合物晶体结构
对角线位移1/2体对角线长度穿插而成。
第二章 晶体结构——2.3~4无机单质及化合物晶体结构
CsCl晶胞结构
CsCl晶胞结构
CsCl晶体结构
资源加工与生物工程学院
3. 立方ZnS(闪锌矿)型结构
闪锌矿属立方晶系,点群3m,空间群F3m,与金刚石
结构相似;S2-作面心立方堆积,Zn2+占据1/2四面体空隙,
即交错填充于8个小立方体体心,正负离子配位数均为4; 晶胞分子数Z=4;整个结构由Zn2+和S2-各一套面心立方格 子沿体对角线方向位移1/4体对角线长度穿插而成。 Zn2+具有18电子构型,S2-易于变形,则Zn-S键带有相
当程度共价键性质。
常见闪锌矿型结构有Be、Cd、Hg等的硫化物、硒化物 和碲化物以及CuCl及-SiC等。 第二章 晶体结构——2.3~4无机单质及化合物晶体结构
ZnS型
0.414~0.225
§2-6 无机非金属化合物常见晶体结构
1.7.2.6金红石结构
金红石是TiO2的一种通常的晶体结构类型,TiO2还有板钛矿及锐钛矿结构,但金红石是稳定型的结构。
无机非金属常见晶体结构[1]
1.7.2二元化合物典型的晶体结构
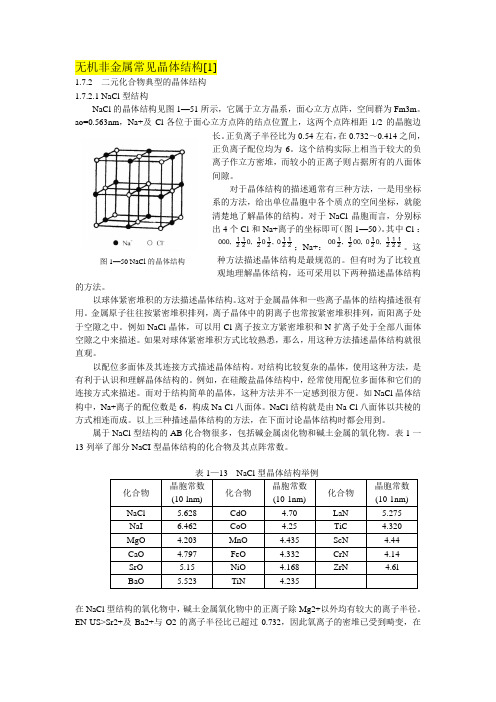
1.7.2.1 NaCl型结构
NaCl的晶体结构见图1—51所示,它属于立方晶系,面心立方点阵,空间群为Fm3m。ao=0.563nm,Na+及Cl-各位于面心立方点阵的结点位置上,这两个点阵相距1/2的晶胞边长。正负离子半径比为0.54左右,在0.732~0.414之间,正负离子配位均为6。这个结构实际上相当于较大的负离子作立方密堆,而较小的正离子则占据所有的八面体间隙。
金红石结构为四方晶系P42/mnm空间群。a0=0.459nm,c0=0.296nm,Z=2。金红石为四方原始格子,Ti4+离子位于四方原始格子的结点位置,体中心的Ti4+离子不属于这个四方原始格子,而自成另一套四方原始格子,因为这两个Ti4+离子周围的环境是不相同的,所以,不能成为一个四方体心格子(见图1—55),O2-离子在晶胞中处于一些特定位置上。晶胞中质点的坐标为Ti4+:000, 。其中u=0.3l。从图1—56中可以看出,Ti4+离子的配位数是6,O2-离子的配位数是3。如果以Ti—O八面体的排列看,金红石结构有Ti—O八面体以共棱的方式排列成链状,晶胞中心的八面体共棱方向和四角的Ti-O八面体共棱方向相差90°。链与链之间是Ti—O八面体共顶相连(图1—56)。此外,还可以把O2-离子看成近似于六方紧密堆积,而Ti4+离子位于二分之一的八面体空隙中。
镍(Ⅱ)配合物[Ni(mip)(1,3-Bip)]n的合成及晶体结构
![镍(Ⅱ)配合物[Ni(mip)(1,3-Bip)]n的合成及晶体结构](https://img.taocdn.com/s3/m/9b5d9d237dd184254b35eefdc8d376eeaeaa1729.png)
第4期 收稿日期:2020-11-25基金项目:贵州省科技厅、毕节市科技局、贵州工程应用技术学院联合基金(黔科合LH字[2017]7013号);贵州省化学工程与技术重点支持学科(黔学位合字ZDXK[2015]32号);贵州省应用化学特色重点学科作者简介:孙小媛(1980—),女,河南驻马店人,硕士,讲师,主要从事功能配合物研究。
镍(II)配合物[Ni(mip)(1,3-Bip)]n的合成及晶体结构孙小媛,罗树常,李 佳(贵州工程应用技术学院化学工程学院,贵州毕节 551700)摘要:合成了镍的配合物[Ni(mip)(1,3-Bip)]n,(mip=五甲基间苯二甲酸根离子,1,3-Bip=1.3-二(咪唑)-丙烷),结构分析表明:该化合物的化学式为C18H20N4NiO5,晶体属三斜晶系,P-1空间群,晶胞参数:a=9 4771(14)?,b=b=10.1323(15)?,c=c=11.2206(16)?,α=108.138(2),β=105.692(2),γ=103.081(2)°,Z=2,Dc=1.544mg/m3,F(000)=448,V=927.2(32)?3。
配合物镍(II)离子处于六配位的变形八面体构型中。
关键词:晶体结构;合成;镍配合物中图分类号:O614.121 文献标识码:A 文章编号:1008-021X(2021)04-0077-02SynthesisandCrystalStructureof-Ni(II)ComplexofPyridineCarboxylicAcidSunXiaoyuan,LuoShuchang,LiJia(SchoolofChemicalEngineering,GuizhouUniversityofEngineeringScience,Bijie 551700,China)Abstract:Thetitlecompoundof[Ni(mip)(1,3-Bip)]nwassynthesizedandcharacterizedstructurallybysinglecrystalX-raydiffraction.Thiscompoundcrystallizesintriclinicsystem,spacegroup(P-1)witha=9.4771(14)?,b=b=10.1323(15)?,c=c=11.2206(16)?,α=108.138(2),β=105.692(2),γ=103.081(2)°,V=927.2(32)?3,Z=2,Dc=1.544mg/m3,F(000)=448,V=927.2(2)?3.TheNi(II)ionissix-coordinatedintoadistortedoctahedralgeometry.Keywords:Ni(II)complex;synthesis;crystalstructure 目前国内外科学家们的对配位聚合物的合成研究,主要都是由三部分合成得到:羧酸类桥联配体、联唑类配体及金属离子[1-4]。
第1章 晶体结构基础04

硅酸盐结构的分类: 根据硅氧四面体在空间的组合情况,可将硅酸盐结构分 为四种: 岛状、链状、层状、骨架状
矿物化学式的两种表达方式: 分子式:以组成元素或分子的数目来表示.
如:高岭土写成Al2O3·2SiO2·2H2O,绿柱石写成3BeO·Al2O3·6SiO2.
结构式:接近其结构的表达形式.
如:高岭土写成Al2[Si2O5](OH)4,绿柱石写成Be3Al2[Si6O18].
BaTiO3 立方晶系 简单立方点阵
配位数
Ti4+:6 Ba2+: 12 O2-:6
部分钙钛矿型结构晶体 氧化物 (1+5) NaNbO3 KNbO3 NaWO3 CaTiO3 SrTiO3 BaTiO3 PbTiO3 CaZrO3 氧化物 (2+4) SrZrO3 BaZrO3 PbZrO3 CaSnO3 BaSnO3 CaCeO3 BaCeO3 PbCeO3 BaPrO3 BaHfO3 氧化物 (3+3) YAlO3 LaAlO3 LaCrO3 LaMnO3 LaFeO3 氧化物 (1+2) KNgF3 KniF3 KZnF3
属于NaCl型结构的化合物很多,包括碱金属卤化物和碱土金属氧化物. NaCl结构氧化物中,碱土金属氧化物中的正离子除Mg2+外,均有较大 的离子半径,尤其Sr2+及Ba2+与O2-的离子半径比超过0.732,因此氧离 子密堆畸变,在结构上比较开放,容易被水分子渗入而水化.
② CsCl型结构(P47)
A(二价金属离子):Ca2+,Ba2+,Pb2+ B(四价正离子):Ti4+,Zr4+
坐标系法
Z=1
Ba2+ Ti4+ O2-
§2-3 固溶体的晶体结构

四. 金属间化合物的性质和应用
金属间化合物由于原子键合和晶体结构的多样性,使得这种 化合物具有许多特殊的物理、化学性能,已日益受到人们的重 视,不少金属间化合物特别是超结构已作为新的功能材料和耐热 材料正在被开发应用。 ¾ 具有超导性质的金属间化合物,如Nb3Ge、Nb3Al、Nh3Sn、 V3Si,NbN等; ¾ 具有特殊电学性质的金属间化合物,如InTe-PbSe、GaAsZnSe等;
间隙固溶体类型:
① 原子填隙: 金属晶体中比较容易发生,原子半径较小的 H、C、 B 等元素易进入晶格间隙中形成间隙型固溶体,钢: C 溶 于 Fe 中 。 ② 阳离子填隙: 大部分无机离子晶体不容易出现,仅少数情况下能 够发生。 CaO 加到 ZrO2 中,加入量 < 15% 时且 1800°C 才 生成:
这类化合物大多是以第Ⅰ族或过渡族金属元素与 第Ⅱ至第Ⅴ族金属元素结合而成。它们也可以用分子 式表示,但大多不符合正常化学价规律。 键型:金属键(金属—金属),有金属特性。
三. 受原子尺寸因素控制的金属间化合物
形成条件:组元A、B间的电负性较大,且Δr>41% 通常是由过渡族金属原子与原子半径小于0.1nm的非金属元 素碳、氮、氢、氧、硼所组成。 由于非金属元素(X)与金属元素(M)原子半径比不同,结构也 有所不同: ¾ 当rX/rM<0.59时,形成具有简单晶体结构的化合物,如fcc、 bcc、hcp或简单立方,通常称它们为间隙相,相应的分子式也 较简单,如M4X、M2X、MX、MX2等。 ¾ 当rX/rM>0.59时,形成的化合物的晶体结构复杂,通常称它 们为间隙化合物,相应的分子式也较复杂,如钢中常见的Fe3C、 Cr7C3、Cr23C6等。
拓扑密堆相(TCP相) 定义:大小金属原子的一定比例搭配(固定的原子比),形成 的新相配位数大于12,或致密度大于0.74,统称为拓扑密堆结 构相。属于这类结构的有:Laves相、σ相结构等。 ¾ ¾ ¾ ¾ ¾ ¾ Laves相 化学式:AB2 形成条件:A原子半径大,B原子半径小,rA:rB=1.25 代表:MgCu2、MgZn2、MgNi2(Mg合金中的重要强化相) σ相 化学式:AB或AxBy 存在于过渡族金属元素组成的合金中 对合金性能有害:不锈钢中出现σ相,引起晶间腐蚀和脆性 耐热钢中出现σ相,引起脆性
晶体结构

[SiO4]四面体
围绕c轴的螺旋状链
链连接形成的格架
α-石英平行(0001)的结构
β-石英平行(0001)的结构 空间群P642,ao=0.501nm,co=0.547nm。
α-石英晶体沿一个二次轴受压后正负电荷 重心分离,产生表面电荷
④ 赤铜矿(Cu 2 O)型结构
等轴晶系,空间群为Pn3m,a0=0.426nm,Z=2。 等效点的坐标为;O2- 是 0,0,0;1/2,1/2,1/2; Cu+ ,1/4,1/4,1/4;3/4,1/4,3/4;1/4,3/4,1/4; 3/4,3/4,1/4。
Th、U… ❖ 氧化物(AO),A=Sr2+、Ba2+、Ca2+、Ti2+、Sn2+、Pb2+ ❖ 氢化物 (AH), A=Li+、Na+、K+、Ru+、Cs+
典型结构分析
化学式为:NaCI CI-
Na+
典型结构分析
结构描述:
(1)立方晶系,a=0.563nm,Z=4
(2)Na+ CI-离子键,NaCI为离子晶体. (3)CN+=CN-=6 (4)--- CI-离子按立方最紧密堆积方式堆积, Na+离子充
均属于 A1 型。
6.3 非金属单质的晶体结构
原子之间多以共价键结合。 原子配位数一般符合CN = 8-N规则。 N:非金属原子在元素周期表中的族数。
① 金刚石型
共价键 covalent bond: 杂化
Carbon: | | 1s 2s 2p
金刚石的结构-sp3杂化
填于全部八面体空隙。
--- Na+ 离子的配位数是6,构成Na--Cl八面体。NaCI结 构是由Na--Cl八面体以共棱的方式相连而成。 --- Na+ 离子位 于面心格子的结点位置上, Cl-离子也位于另一套这样的格 子上,即后一个格子与前一个格子相距1/2晶棱的位移。
12典型的无机化合物晶体结构解析

1、闪锌矿(立方 ZnS)β-ZnS
?立方ZnS 立方晶系(β-ZnS)闪锌矿
?a=0.540nm,晶胞分子数=4 ?可看作:Zn和S各对应一套面心立方格
子沿体对角方向相互穿叉,位移a/4
2018/10/5
杨为中 材料物理化学
的四面体空隙, Ca处于小立方体中心; ?⑤一个晶胞中有 4CaF2分子,立方体之间共棱相
连;
? ⑥晶胞中心存在巨大的空隙,这种结构有利于离 子的迁移。
?属于这类结构的化合物有: BaF 2、PbF 2、SrF 2、 ZrF2、UO2、CeO2、 ThO 2等。
?应用:由于萤石型结构的 化合物中存在较大的空隙, 质点易于移动,所以萤石
?1、Na离子,Cl离子顶点位置 图1 ?2、NaCl晶体结构的晶胞 图2 ?3、Na离子处于八面体空隙 图3
三、CsCl型结构 ?r+/r-=1.69/1.81=0.733 ?在0.732~1.00之间立方晶胞
Cl-位于顶角 Cs+位于中心 CN=8,晶报分子数1 ?看作:由Cs +和Cl -各对应一套立方原 始格子沿体对角线方向相套而成
2、纤锌矿(六方 ZnS)α-ZnS 六方堆积:
ABAB………
?纤锌矿ZnS型α-ZnS
?六方晶系 ?a=0.382nm,c=0.625nm ?六方原始格子 ?Zn、S各一套穿插而成 ?晶胞分子数为2 ?S2-构成六方密堆积
Zn2+填充1/2四面体空隙
15
? 六方ZnS中:R+/R-=0.436,极化造成一定共 价成分,CN不为6,CN=4
杂。 2 、投影法 —也叫标高法 优点:可了解质点在该结构中的排列特点。 3 、多面体的连接方式
第二章 晶体结构

第二章晶体结构内容提要大多数无机材料为晶态材料,其质点的排列具有周期性和规则性。
不同的晶体,其质点间结合力的本质不同,质点在三维空间的排列方式不同,使得晶体的微观结构各异,反映在宏观性质上,不同晶体具有截然不同的性质。
1912年以后,由于X射线晶体衍射实验的成功,不仅使晶体微观结构的测定成为现实,而且在晶体结构与晶体性质之间相互关系的研究领域中,取得了巨大的进展。
许多科学家,如鲍林(Pauling)、哥希密特(Goldschmidt)、查哈里阿生(Zachariason)等在这一领域作出了巨大的贡献,本章所述内容很多是他们研究的结晶。
要描述晶体的微观结构,需要具备结晶学和晶体化学方面的基本知识。
本章从微观层次出发,介绍结晶学的基本知识和晶体化学基本原理,以奠定描述晶体中质点空间排列的理论基础;通过讨论有代表性的无机单质、化合物和硅酸盐晶体结构,以掌握与无机材料有关的各种典型晶体结构类型,建立理想无机晶体中质点空间排列的立体图像,进一步理解晶体的组成-结构-性质之间的相互关系及其制约规律,为认识和了解实际材料结构以及材料设计、开发和应用提供必要的科学基础。
2.1 晶体化学基本原理由于天然的硅酸盐矿物和人工制备的无机材料制品及其所用的原料大多数是离子晶体,所以在这一节主要讨论离子晶体的晶体化学原理。
一、晶体中键的性质(键性的判别)过去的教学中,以电子云的重要情况讨论键型。
Na-Cl认为是典型的离子键。
硅酸盐晶体中比较典型的结合键方式:Si-O Al-O M e-O (M代表许多碱、碱土金属)Me-O、Al—O键通常认为是比较典型的离子键,而Si-O键中Si-O键离子键、共价键成分相当。
为了方便,通常也认为是离子键。
那么键的成分是如何确定的?即通常如何判断键的类型呢?Pauling通过大量的研究发现,可以根据各元素的电负性差别判断键的类型(由于电负性反映元素粒子得失电子的能力)。
元素电子的电负性x=元素电子的电离能力I+元素原子的电子亲和能E。
mob2的某种晶体结构与 aib2不同。mo 原子沿c轴方向的堆积方式

mob2的某种晶体结构与aib2不同。
mo 原子沿c轴方向的堆积方式1. 引言1.1 背景介绍在材料科学领域,研究晶体结构的差异对于探索新材料的性质以及应用具有重要意义。
其中,mob2和aib2这两种晶体结构引起了广泛的关注。
mob2是一种具有特殊晶体结构的化合物,而aib2是另外一种常见的晶体结构类型。
本文将重点比较mob2与aib2之间在mo原子沿c轴方向上堆积方式上的差异。
1.2 研究意义研究mob2和aib2这两种晶体结构之间的差异对于深入理解它们的性质及应用潜力具有重要意义。
通过揭示其晶体结构中不同原子间的排列方式以及堆积方式,我们可以更好地理解其电子、磁性、光学等性质,并可能为未来材料设计与合成提供新思路。
1.3 研究问题本研究主要关注于mo原子沿c轴方向的堆积方式上mob2和aib2之间存在什么样的差异,并探讨这些差异对晶体性质的影响。
通过分析两种晶体结构的特点和性质,我们将进一步探索堆积方式对物性的影响,并基于实验验证与推断预测其可能的应用潜力。
以上就是文章引言部分的内容,主要介绍了研究背景、意义以及研究问题。
在后续章节中,我们将详细讨论mob2和aib2晶体结构的特点、差异比较以及mo 原子沿c轴方向的堆积方式对物性的影响等内容,并提出结论和未来研究方向。
2. mob2的晶体结构:Mob2是一种具有特殊晶体结构的化合物,由Mo和B元素组成。
在这一部分中,我们将详细介绍Mob2的晶体结构以及与其他类似化合物的区别。
2.1 mo原子的堆积方式:在Mob2晶体中,Mo原子以特定方式进行堆积。
这种堆积方式对于确定晶体结构和性质具有重要意义。
通过研究发现,在Mob2晶格中,Mo原子沿着c轴方向进行排列。
2.2 c轴方向的结构分析:进一步分析Mo原子在c轴方向上的结构是理解Mob2晶体结构的关键。
研究表明,在c轴方向上,Mo原子形成了紧密排列的层状结构。
这种层状结构在整个晶体中不断重复,并通过强相互作用力保持稳定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验2 化合物的晶体结构
一、实验目的:
巩固化合物晶体结构知识。
二、实验内容:
典型的化合物的晶体结构有:
1. NaCl型结构
NaCl晶体结构是如图6-1所示的立方面心格子,属立方晶系Fm3m空间群,a0=0.5628nm。
阴离子按立方最紧密方式堆积,阳离子充填于全部的八面体空隙中,阴、阳离子的配位数都是6。
属于NaCl型晶体结构的晶体有很多,列于表6-1中。
表6-1 NaCl型结构的晶体
化合物晶胞参数(nm) 化合物
晶胞参数
(nm) 化合物晶胞参数(nm) 化合物
晶胞参数
(nm)
NaCl 0.5628 BaO 0.5523 NiO 0.4168 CrN 0.4140 NaI 0.6462 CdO 0.4700 TiN 0.4235 ZrN 0.4610 MgO 0.4203 CoO 0.4250 LaN 0.5275
CaO 0.4797 MnO 0.4435 TiC 0.4320
SrO 0.5150 FeO 0.4332 ScN 0.4440
(A) 立方面心格子(B) 晶胞(C) 晶胞绘制图
图2-1 氯化钠晶体结构
2. CsCl型结构
CsCl晶体结构是立方原始格子(图6-2),属立方晶系Pm3m 空间群,a0=0.411nm。
Cl-处于立方原始格子的八个角顶上,Cs+位于立方体中心,阴、阳离子的配位数都是8。
属于CsCl型晶体结构的晶体有CsBr、CsI、TlCl、NH4Cl。
图2-2 CsCl晶体结构图2-3 纤锌矿晶体结构
3. 纤锌矿(α-ZnS)型结构
纤锌矿(α-ZnS)的晶体结构属立方晶系P63mc空间群,a0=0.382nm,c0=0.625nm,Z=2。
在纤锌矿结构中(图6-3),S2-按六方紧密堆积排列,Zn2+充填于1/2的四面体空隙中,阴、阳离子的配位数都是4。
属于纤锌矿(α-ZnS)型晶体结构的晶体有BeO、ZnO和AlN。
4. 闪锌矿(β-ZnS)型结构
F34空间群,闪锌矿(β-ZnS)的晶体结构属立方晶系m
a0=0.540nm,Z=4。
如图6-4所示的闪锌矿结构是立方面心格子,S2-位于立方面心的结点位置,Zn2+交错地分布于立方体内的1/8小立方体的中心,阴、阳离子的配位数都是4。
如果将S2-看成是作立方最紧密堆积,则Zn2+充填于1/2的四面体空隙中。
属于闪锌矿(β-ZnS)型晶体结构的晶体有β-SiC、GaAs、AlP 和InSb。
图2-4 闪锌矿的晶体结构
5. CaF2型结构
萤石的晶体结构如图6-5所示,属立方晶系Fm3m空间群,a0=0.545nm,Z=4。
Ca2+位于立方面心的结点位置,F-位于立方体内的八个小立方体的中心,Ca2+的配位数是8,F-的配位数是4。
在萤石结构中可以将Ca2+看成是作立方紧密堆积,F-充填于全部四面体空隙中,而全部的八面体空隙都没有被充填,因此,在结构中八个F-离子之间就形成一个“空洞”,这些“空洞”为F-离子的扩散提供了条件。
属于萤石型晶体结构的晶体有BaF2、PbF2、SnF2、CeO2、ThO2和UO2,还有一些晶体的结构与萤石的完全相同,只是阴、阳离子的位置完全互换,如Li2O、Na2O、K2O等。
图2-5 萤石晶体结
6. 金红石(TiO2)型结构
金红石(TiO2)的晶体结构以及结构中Ti—O八面体链的排列示于图6-6中,金红石结构属四方晶系P42/mnm空间群,a0=0.459nm,c0=0.459nm,Z=2。
金红石结构为四方原始格子,Ti4+位于四方原始格子的结点位置,体中心的Ti4+自成另一套四方原始格子,O2-在晶胞中处于一些特定位置上,Ti4+的配位数是6,O2-的配位数是3。
金红石结构中Ti-O八面体以共棱的方式排成链状,晶胞中心的链和四角的Ti-O八面体链的排列方向相差90 ,链与链之间由Ti-O八面体以共顶相连。
如果把O2-看成近似于六方紧密堆积,则Ti4+位于1/2的八面体空隙之中。
属于金红石型晶体结构的晶体有GeO2、SnO2、PbO2、MnO2、MoO2、NbO2、WO2、CoO2、MnF2、MgF2。
图2-6 金红石晶体结构以及结构中Ti-O八面体链的排列
7. CdI2型结构
P3空间群,a0=0.424nm,CdI2型晶体结构属于三方晶系m
c0=0.684nm,Z=1。
Cd2+在单位晶胞中占有六方原始格子的结点位置,I-交叉分布在三个Cd2+形成的三角形中心的上、下方,因此,CdI2结构就相当于两层I-离子中间夹一层Cd2+离子。
Cd2+的配位数是6,I-的配位数是3。
属于CdI2型晶体结构的晶体有Ca(OH)2、Mg(OH)2、CaI2、MgI2等。
图2-7 CdI2型晶体结构(A)及层状多面体连接方式(B)
8. α-方石英型结构
α-方石英属于立方晶系Fd3m空间群,a0=0.713nm,Z=8。
如图6-8所示,α-方石英的晶胞中Si4+占有全部面心立方结点的
位置和立方体内相当于八个小立方体中心的四个。
每个Si4+都和四个O2-相连,硅氧四面体层与层之间以顶角相连。
图2-8 α-方石英的晶体结构及结构中硅氧四面体的连接方式
9. 刚玉(α-Al2O3)型结构
R3空间群,刚玉(α-Al2O3)型晶体结构属三方晶系c
a0=0.514nm,α=55︒17’,Z=2。
如果用六方大晶胞表示,a0=0.475nm,c0=1.297nm,Z=6(图6-9)。
刚玉结构中O2-按六方紧密堆积排列,Al3+充填于2/3的八面体空隙,Al3+在结构中有如图6-9中所示的三种分布形式。
属于刚玉型晶体结构的晶体有a-Fe2O3、Cr2O3、Ti2O3、V2O3等。
图2-9 刚玉晶体结构(菱面体晶胞)和结构中Al3+的三种不同排列方式10. 钙钛矿型结构
钙钛矿的通式是ABO3,其中A代表一价或二价金属离子,B代表四价或五价金属离子。
具有钙钛矿型晶体结构的主要晶体列于表6-2中,其典型矿物为CaTiO3。
CaTiO3在高温下属立方晶系Pm3m空间群,a0=0.385nm,Z=1。
低于600 C时为正交晶系PCmm空间群,a0=0.537nm,b0=0.764nm,c0=0.544nm,Z=4。
CaTiO3结构中Ca2+占有立方面心的角顶位置,O2-处于立方面心的面心位置,所以,CaTiO3结构可以看成是由O2-和半径较大的Ca2+共同组成立方紧密堆积,Ti4+充填在1/4的八面体空隙中(图6-10),Ti4+的配位数是6,Ca2+的配位数是12。
表2-2
具有钙钛矿型结构的主要晶体
氧化物
(1+5)
氧化物
(2+4)
氧化物
(3+3)
氧化物
(1+2) NaNbO3CaTiO3SrZrO3CaCeO3YAlO3KNgF3 KNbO3SrTiO3BaZrO3BaCeO3LaAlO3KniF3 NaWO3BaTiO3PbZrO3PbCeO3LaCrO3KZnF3 PbTiO3CaSnO3BaPrO3LaMnO3
CaZrO3BaSnO3BaHfO3LaFeO3
图2-10 CaTiO3的晶体结构
11. 尖晶石型结构
尖晶石的通式是AB2O4,其中A代表二价金属离子,B代表三价金属离子,典型晶体是MgAl2O4,其晶体结构以及结构中多面体的连接方式如图6-11所示,属立方晶系Fd3m空间群,a0=0.808nm,Z=8。
结构中O2-可看成是立方紧密堆积,Mg2+充填于1/8的四面体空隙中,Al3+充填于1/2的八面体空隙中,八面体之间以共棱方式、八面体与四面体之间以共顶方式相连。
具有尖晶石型晶体结构的主要晶体列于表6-3中。
表2-3具有尖晶石型结构的主要晶体
氟、氰化合物氧化物硫化物BeLi2F4TiMg2O4ZnCr2O4CoCo2O4MgAl2O4MnCr2S4 MoNa2F4VMg2O4CdCr2O4CuCo2O4MnAl2O4CoCr2S4 ZnK2(CN)4MgV2O4ZnMn2O4FeNi2O4FeAl2O4FeCr2S4 CdK2(CN)4ZnV2O4MnMn2O4GeNi2O4MgGa2O4FeNi2S4 MgK2(CN)4MgCr2O4MgFe2O4TiZn2O4CaGa2O4
FeCr2O4FeFe2O4SnZn2O4MgIn2O4
NiCr2O4CoFe2O4FeIn2O4
图2-11 尖晶石的晶体结构以及结构中多面体的连接方式
实验内容:
1. 就以上11种典型的化合物晶体结构,对照模型,搞清各
晶体结构中正负离子的配位关系、密堆关系,熟悉其晶胞。
2. 试作1~2种晶体模型。
三、思考题
1. 试列举10种典型的化合物晶体结构。
2. 请说明你所制作的晶体模型的晶体结构特征。
