一轮复习氧化还原反应
氧化还原反应的综合考查 2024一轮复习(解析版)

氧化还原反应的综合考查一、氧化还原反应几组概念间的关系二、氧化还原反应的“四大规律”及其应用1.强弱律(1)氧化性:氧化剂>氧化产物常考物质氧化性强弱顺序:KMnO4>Cl2>Br2>Fe3+>Cu2+(2)还原性:还原剂>还原产物常考物质还原性强弱顺序:SO2>I->Fe2+>Br->Cl-(3)应用:比较物质氧化性或还原性强弱,判断反应能否进行2.价态律(1)氧化还原反应发生时,其价态一般先变为邻位价态(2)同种元素不同价态之间的反应,高价态的元素化合价降低,低价态的元素化合价升高,但升高与降低的化合价只接近而不交叉(3)应用:判断物质的氧化产物或还原产物3.优先律(1)同时含有几种还原剂加入氧化剂,按还原性由强到弱依次反应(如向FeI2溶液中通入少量Cl2,I-优先反应)(2)同时含有几种氧化剂加入还原剂,按氧化性由强到弱依次反应(如含Fe3+、H+的混合液中加入铁,Fe3 +优先反应)(3)应用:判断物质的稳定性及反应的先后顺序4.守恒律(1)内容:氧化剂得电子总数=还原剂失电子总数,即氧化剂降价总数=还原剂升价总数(2)应用:①直接计算参与氧化还原反应物质间的数量关系;②配平氧化还原反应方程式1(2023·浙江嘉兴·统考二模)关于反应S+2KNO3+3C=K2S+N2↑+3CO2↑,下列说法正确的是A.该反应的氧化剂是硝酸钾B.生成标准状况下2.24LN2,反应共转移1mol电子C.氧化产物与还原产物的物质的量之比为3∶1D.电负性:O>N>C>K【答案】D【详解】A.反应S+2KNO3+3C=K2S+N2↑+3CO2↑中,N和S元素化合价降低,该反应的氧化剂是S和KNO3,故A错误;B.生成标准状况下2.24LN2,物质的量为0.1mol,则生成0.3molCO2,C元素由0价上升到+4价,转移1.2mol电子,故B错误;C.反应S+2KNO3+3C=K2S+N2↑+3CO2↑中,N和S元素化合价降低,C元素化合价上升,CO2为氧化产物,K2S和N2为还原产物,则氧化产物与还原产物的物质的量之比为3∶2,故C错误;D.非金属性越强,电负性越强,所以电负性:O>N>C>K,故D正确;故选D。
2024届高考一轮复习-05氧化还原反应的基本概念
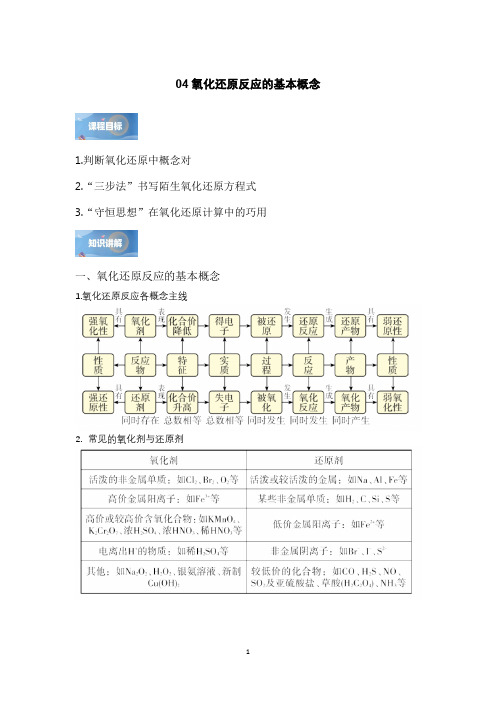
04氧化还原反应的基本概念1.判断氧化还原中概念对2.“三步法”书写陌生氧化还原方程式3.“守恒思想”在氧化还原计算中的巧用一、氧化还原反应的基本概念1.氧化还原反应各概念主线2.常见的氧化剂与还原剂高考真题演练1.(2023·浙江·高考真题)关于反应322222NH OH 4Fe N O O =4Fe 4H H ++++↑+++,下列说法正确的是A .生成21molN O ,转移4mol 电子B .2NH OH 是还原产物C .2NH OH 既是氧化剂又是还原剂D .若设计成原电池,2Fe +为负极产物2.(2022·山东·高考真题)实验室制备4KMnO 过程为:①高温下在熔融强碱性介质中用3KClO 氧化2MnO 制备24K MnO ;②水溶后冷却,调溶液pH 至弱碱性,24K MnO 歧化生成4KMnO 和2MnO ;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得4KMnO 。
下列说法正确的是 A .①中用瓷坩埚作反应器 B .①中用NaOH 作强碱性介质 C .②中24K MnO 只体现氧化性D .2MnO 转化为4KMnO 的理论转化率约为66.7%3.(2022·山东·高考真题)古医典富载化学知识,下述之物见其氧化性者为A .金(Au):“虽被火亦未熟"B .石灰(CaO):“以水沃之,即热蒸而解”C .石硫黄(S):“能化……银、铜、铁,奇物”D .石钟乳(3CaCO ):“色黄,以苦酒(醋)洗刷则白”二、氧化还原反应的基本规律(1) 价态表现规律元素处于最高价态时只有氧化性,处于最低价态时只有还原性,处于中间价态时既具有氧化性又具有还原性。
(2) 价态转化规律① 含同种元素的不同价态的物质之间发生氧化还原反应时要遵循“只靠拢不交叉不重叠”的归中反应规律。
② 含同种元素的同一价态的物质发生氧化还原反应时,则遵循着从中间价态分别向高价态与低价态转化的歧化反应规律。
高三化学一轮复习—— 氧化还原反应的“三大”基本规律及其应用

高三化学一轮复习—— 氧化还原反应的“三大”基本规律及其应用知识梳理1.氧化还原反应规律(1)价态规律 ①元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性。
如Fe 3+、Cu 2+只有氧化性,S 2-、I -只有还原性,Cl 2、Fe 2+既有氧化性又有还原性。
②价态归中规律不同价态的同种元素间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价―→中间价”。
而不会出现交叉现象。
简记为“两相靠,不相交”。
如在反应KClO 3+6HCl===KCl +3Cl 2↑+3H 2O 中,氧化产物是Cl 2,还原产物是Cl 2,1 mol KClO 3反应时转移电子数是5N A .③歧化反应规律“中间价―→高价+低价”。
具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应,如:Cl 2+2NaOH===NaCl +NaClO +H 2O 。
1 mol Cl 2反应时转移电子数为N A 。
(2)强弱规律①自发进行的氧化还原反应,一般遵循强氧化剂制弱氧化剂,强还原剂制弱还原剂,即“由强制弱”。
在反应中,较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。
如根据反应Cl 2+S 2-===S ↓+2Cl -,可以确定氧化性Cl 2>S ,还原性S 2->Cl -。
②先后规律a .同时含有几种还原剂时――→加入氧化剂将按照还原性由强到弱的顺序依次反应。
如:在FeBr 2溶液中通入少量Cl 2时,因为还原性Fe 2+>Br -,所以Cl 2先与Fe 2+反应。
b .同时含有几种氧化剂时――→加入还原剂将按照氧化性由强到弱的顺序依次反应。
如在含有Fe 3+、Cu 2+、H +的溶液中加入铁粉,因为氧化性Fe 3+>Cu 2+>H +,所以铁粉先与Fe 3+反应。
(3)守恒规律氧化还原反应中,氧化剂得电子总数等于还原剂失电子总数。
高三化学第一轮复习《氧化还原反应》课件.ppt

KClO3 6HCl KCl 3Cl2 3H2O (√)
得到
4、就近律
5e
-
同种元素相邻价态间不发生氧化还原反应。
【例7】
下列气体不能用浓硫酸干燥的有( C)
A、H2 C、H2S
B、SO2 D、Cl2
【例8 】
在含有Cu(NO3)2、Mg(NO3)2和AgNO3的
溶液中加入适量锌粉,首先置换出的是(C )
(3)若反应过程中转移了0.3mol 电子,则生成水的 质量是_______。
C.NO2、Na、Br2 D.O2、SO2、H2O
3、价态律
(1)价态表现规律
当元素处于最高价时,只具有氧化性; 当元素处于最低价时,只具有还原性; 当元素处于中间价态时既具有氧化性又具有还原 性。
3、价态律
(2)只靠近不交叉
失去 6e-
KClO3 6HCl KCl 3Cl2 3H2O (×)
(二)根据“三表两池”判断 三表
(1)根据金属活动顺序表 失电子能力逐渐增强,还原性逐渐增强
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
其阳离子得电子能力逐渐增强,氧化性逐渐增强
(2)根据非金属活动顺序判断
F2 Cl2 O2 Br2 I2 S
氧化性逐渐减弱
(1) 2、5、8、10、2、16H+ (2) 4、10、1、4、1、3H2O (3) 3、1、10KOH、3、2、、8
39
【练合练习1】
某一反应体系中有反应物和生成物共五种物 质:S、H2S、HNO3、NO、H2O。已知水是反应产 物之一。 (1)该反应中的还原剂是________,该反应中的 还原产物是__________。 (2)写出该反应的化学方程式并标出电子转移方 向和数目_______________________________。
高中化学一轮复习氧化还原反应

KY、KZ 均是一元酸的钾盐,由以上条件推知在 KX 中氯的化合价是( )
A.+1
B.+3
C.+5
D.+7
5.硫代硫酸钠可作为脱氯剂,已知 25.0 ml 0.100 mol/L Na2S2O3 溶液恰好把 224 ml(标准 状况下)Cl2 完全转化为 Cl-,则 S2O32−将转化为( )
A.S2−
3
(1)G→Q+NaCl
(2)Q+H2O→X+H2
(3)Y+NaOH→G+Q+H2O
(4)Z+NaOH →Q+X+H2O
这五种化合物中氯的化合价由低到高的顺序为( )
A.QGZYX
B.GYQZX
C.GYZQX
D.ZXGYQ
5.在一定条件下 KClO3 与 I2 按下式反应:2KClO3+I2===2KIO3+Cl2,下列判断正确的是
B.CaCN2 是氧化产物,H2 为还原产物
C.HCN 仅作氧化剂
D.CO 为氧化产物,H2 为还原产物
10.用 H2O2 溶液处理含 NaCN 的废水的反应原理为 NaCN+H2O2+H2O=NaHCO3+NH3,已
知:HCN 酸性比 H2CO3 弱。下列有关说法正确的是(
)
A. 该反应中氮 元素被氧化
(5) 不同物质间同种元素之间发生氧化还原反应( )
4
(6) 发生在不同物质间,只部分被氧化或只部分被还原的反应( )
A.CuO+H2
Cu+H2O
B.2KClO3 2KCl+3O2↑
C.Cl2+2NaOH=NaCl+NaClO+H2O
D.KClO3+6HCl=KCl+3Cl2↑+3H2O
E.MnO2+4HCl
A.+2
高三化学一轮复习——氧化还原反应

【课前预习检测】1、下列变化需要加入氧化剂才能实现的是()A、NaOH→NaClB、H2SO4→H2C、HCl→Cl2D、CaCO3→CO22、在3Cu + 8HNO3(稀)= 3Cu(NO3) 2 + 2NO↑+ 4H2O的反应中,还原剂是_______,氧化剂是_______,还原产物是______,氧化产物是_________,若有2molHNO3参加反应,其中被还原的是mol。
3、在下列反应中,水既不作氧化剂,又不作还原剂的是()A、2Na+2H2O=2NaOH+H2↑B、Na2O + H2O=2NaOHC、H2O H2↑+O2↑D、C+H2O CO+H24、浓硫酸、SO2、S、S2-四种物质中,只有氧化性的是;只有还原性的是;既有氧化性又有还原性的是。
5、根据反应式:(1)2Fe3++2I-=2Fe2++I2,(2)Br2+2Fe2+=2Br-+2Fe3+,可判断出离子的还原性从强到弱的顺序是( )A.Br-、Fe2+、I-B.I-、Fe2+、Br-C.Br-、I-、Fe2+D.Fe2+、I-、Br-【考纲要求】1. 掌握氧化还原反应的基本概念。
2.氧化性还原性强弱的比较.3. 简单氧化还原的配平.4. 判断电子转移的方向和数目5.了解限定条件下氧化还原反应的书写【课堂探究】考点一:氧化还原反应基本概念【例1】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2Si3N4+6CO,对该反应下列说法正确的是()A.该反应的氧化剂是SiO2和N2B.该反应的还原产物为Si3N4C.该反应中氧化剂和还原剂质量比为9∶7 D.1 mol Si3N4生成时共转移6 mol电子【变式1】对于反应3S + 6KOH == 2K2S + K2SO3 + 3H2O,下列说法正确的是()A、硫是氧化剂,氢氧化钾是还原剂B、反应中转移的6个电子C、还原剂与氧化剂质量比是2:1D、氧化产物与还原产物分别为K2SO3和K2S[规律总结拓展]:1.从化合价变化及电子转移的角度定义氧化还原反应中的概念2.氧化还原反应中电子转移方向和数目的表达(注意数目的计算)如:标出下列反应中电子转移的方向和数目3S + 6KOH == 2K2S + K2SO3 + 3H2O Al2O3+N2+3C2AlN+3CO考点二:物质的氧化性强弱、还原性强弱的比较【例2】根据下列反应判断有关物质的还原性由强到弱的顺序正确的是( )①H2SO3+I2+H2O=2HI+H2SO4②2FeCl3+2HI=2FeCl2+2HCl+I2③3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3A.H2SO3>I->Fe2+>NO B.I->H2SO3>Fe2+>NOC.Fe2+>I->H2SO3>NO D.NO>Fe2+>H2SO3>I-【变式2】已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是()A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+B.I2+SO2+2H2O=H2SO4+2HIC.H2O2+H2SO4=SO2+O2+2H2O D.2Fe2++I2=2Fe3++2I-【变式3】下列有关氧化还原反应的叙述不正确的是()A.金属单质的活泼性越强其还原性越强B.非金属单质非金属性越强其氧化性越强C.金属原子失电子越多其还原性越强,D.Cu2+比Fe3+氧化性弱,Fe比Cu还原性强[规律总结拓展]:①氧化性还原性强弱的本质是:__________________________________②氧化性还原性强弱的判断常用方法:Ⅰ类:运用理论知识判断:Ⅱ类;运用氧化还原反应事实判断:③影响氧化性还原性强弱的因素温度: ____________ __. 浓度: ________ _____ . 酸碱性: _________ __.④常见的氧化剂及还原剂考点三:氧化还原反应方程式书写及配平【例3】Na2S溶液长期放置有硫析出,原因为_______________(用离子方程式表示)【例4】(2005上海)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2已知该反应中H2O2只发生如下过程:H2O2→ O2(1)该反应中的还原剂是。
氧化还原反应的基本概念--2024年高考化学一轮复习(拔高)(学生版)

第01讲氧化还原反应的基本概念氧化还原反应基础一、氧化还原反应的基本概念1.定义:凡是有元素化合价升降的化学反应称之为氧化还原反应2.特征:元素的化合价在反应前后发生了变化。
3.本质:发生了电子的转移,包括电子得失、共用电子对的偏移两种情况。
(1)从原子结构来看,钠原子的最外电子层上有1个电子,氯原子的最外电子层上有7个电子。
当Na与Cl2反应时,钠原子失去1个电子,带1个单位正电荷,成为钠离子(Na+);氯原子得到1个电子,带1个单位负电荷,成为氯离子(Cl-),这样双方最外电子层都达到了8个电子的稳定结构(如图)。
反应中钠元素的化合价从0价升高到+1价,Na被氧化;氯元素的化合价从0价降低到-1价,Cl2被还原。
在这个反应中,发生了电子的得失,Na发生了氧化反应,Cl2发生了还原反应。
(2)H2与Cl2的反应则与此不同。
氢原子的最外电子层上有1个电子,可获得1个电子而形成2个电子的稳定结构;氯原子的最外电子层上有7个电子,也可获得1个电子而形成8个电子的稳定结构。
在发生反应时,它们都未能把对方的电子夺取过来,而是双方各以最外层的1个电子组成一个共用电子对,这个电子对受到两个原子核的共同吸引,使双方最外电子层都达到稳定结构。
由于氯原子对共用电子对的吸引力比氢原子的稍强一些,所以,共用电子对偏向于氯原子而偏离于氢原子。
因此,氢元素的化合价从0价升高到+1价,H2被氧化;氯元素的化合价从0价降低到-1价,C12被还原。
在这个反应中,发生了共用电子对的偏移,H2发生了氧化反应,C12发生了还原反应。
二、两剂两产物(升失氧降的还)1.氧化剂:在氧化还原反应中得到电子(或电子对偏向)的物质,具有氧化性。
2.还原剂:在氧化还原反应中失去电子(或电子对偏离)的物质,具有还原性。
3.氧化产物:还原剂发生氧化反应得到的产物(即化合价升高的生成物)。
4.还原产物:氧化剂发生还原反应得到的产物(即化合价降低的生成物)。
人教版高考化学一轮复习第一章 第3讲 氧化还原反应的概念和规律

氧化还原反应的概念和规律
复 1.了解氧化还原反应的概念。
习 目
2.会用“单、双线桥”分析电子转移的方向和数目。
标 3.掌握氧化性、还原性强弱的比较及价态规律的应用。
考点一 氧化还原反应及相关概念
内
容
索
考点二 氧化性、还原性的强弱及影响因素
引
练真题 明考向
< 考点一 >
氧化还原反应及相关概念
提升 关键能力
⑥Fe和浓HNO3常温下钝化,加热继续反应;Fe和稀HNO3反应,HNO3被还原 成NO。 ⑦Fe和浓H2SO4常温下钝化,加热继续反应;Fe和稀H2SO4反应生成FeSO4和H2。
提升 关键能力
5.铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发 生:①Tl3++2Ag===Tl++2Ag+,②Ag++Fe2+===Ag+Fe3+,③Fe+2Fe3+ ===3Fe2+。则Fe2+、Ag+、Tl3+的氧化性由强到弱的顺序是_T_l_3_+_>_A_g_+__>_F_e_2_+_。
提升 关键能力
3.已知NaBH4与水反应的化学方程式为NaBH4+2H2O===NaBO2+4H2↑。 (1)氧化剂为_H_2_O__,还原剂为__N_a_B_H__4_。 (2)用“单线桥”标出电子转移的方向和数目:_____________________________, 其中氧化产物与还原产物的质量比为_1_∶__1_。 (3)若生成标准状况下4.48 L H2,则转移电子的物质的量为_0_._2_m__o_l_。
整合 必备知识
特别提醒
分析氧化还原反应,走好关键第一步——正确标出元素的化合价。 请标出下列陌生物质中指定元素的化合价: Li2NH:N-3,LiNH2:N-3,N2H4:N-2, Na2S2O3:S+2,S2O28-:S+6、O-1、-2, C2O24-:C+3,HCN:C+2、N-3,BH4-:B+3、H-1, CuH:Cu+1、H-1,MnO(OH):Mn+3, FePO4:Fe+3,CrO24-:Cr+6,K2FeO4:Fe+6, LiFePO4:Fe+2,CuFeS2:Fe+2。
高三化学一轮复习 第3讲 氧化还原反应

1.下列反应中不属于氧化还原反应的是( ) A.Cl2+H2O===△HCl+HClO B.3CO+Fe2O3=====2Fe+3CO2
有: 高温
①TiO2+2C+2Cl2=====TiCl4+2CO 高温
②TiCl4+2Mg=====2MgCl2+Ti 下列叙述正确的是( )
A.反应①是置换反应
B.反应②是复分解反应
C.反应①中TiO2是氧化剂
D.反应②中金属镁是还原剂
解析: 反应①不属于置换反应,其中Cl2为氧化剂;反应②为置
换反应,其中Mg为还原剂。
◎ 判断下列说法是否正确:
1.(2010·安徽高考T7-B)Li2NH+H2 氧化剂又是还原剂( )
LiH+LiNH2中H2既是
2.(2010·江苏化学T8-D)相同条件下,溶液中Fe3+、Cu2+、Zn2+ 的氧化性依次减弱( )
3.(2010·全国ⅡT10-C)若(NH4)2SO4在强热时分解的产物是SO2、 N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之 比为2∶1( )
第3讲 氧化还原反应
考纲展示
热点定位
1.了解氧化还原反应的 本质是电子的转移。 2.了解常见的氧化还原 反应。
1.判断氧化剂、还原剂、氧化产物、还 原产物。 2.氧化性、还原性相对强弱的比较。 3.氧化还原反应中电子守恒的计算。 4.以元素化合物知识为载体,综合考查 氧化还原反应、电化学、能量变化。
2.下列物质中,按只有氧化性、只有还原性、既有氧化性又有还
2024届氧化还原反应(高考一轮复习)

三、氧化性、还原性强弱的比较方法
1、根据化学方程式判断
氧化反应 :失ne-
(弱还原性)
氧化剂+还原剂 = 还原产物+氧化产物
还原反应:得ne-
(弱氧化性)
氧化性: 氧化剂>氧化产物 还原性: 还原剂>还原产物
特别提醒
C+SiO2、Na+KCl等在特定条件下的反应 不能说明各元素还原性的强弱。(化学平衡移动原理解释)
(1:1) : 含有1molFeI2的溶液中通入22.4LCl2(标准状况下)
2I- + Cl2 = I2 + 2Cl-
向FeBr2的溶液中通入Cl2
先:2Fe2+ + Cl2 = 2Fe3+ + 2Cl- 后:2Br- + Cl2 = Br2 + 2Cl- 少量: 向FeBr2的溶液中通入少量Cl2
方向,仅表示电子转移前后的变化
③线桥只出现在反应物中
应用 举例
3Cu(NO3)2+2NO↑+4H2O
例3、用双线桥法标出MnO2+4HCl(浓=)=△=== MnCl2+Cl2↑+2H2O反应电子转 移的
方向和数目:_______________________________。此反应中氧化剂是_M__n_O__2 , 还原剂是__H_C_l_,氧化产物是__C_l_2_,还原产物是__M_n__C_l2_,MnO2发生__还__原___反 应,HCl发生__氧__化__反应;生成1 mol Cl2时转移电子数目为__2_N__A_,被氧化的 HCl的物质的量是_2__ mol,盐酸表现的性质是__还__原__性和__酸__性。
( 2 ) 温度:同一种物质,温度越高其氧化性越强。如:热的浓硫酸的氧化性 比冷的浓硫酸的氧化性强。HNO3(浓) + C(木炭)在常温下不反应,但在加热 时则剧烈反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质氧化性与还原性强弱的判断。 物质氧化性与还原性强弱的判断
66. 、氧氧化化还还原原反反应应方方程程式式的的配配平平。
77、. 有有关关氧计化算还原反应的计算。
一.氧化还原反应的基本概念
化合价升高,被氧化,发生氧化反应
失去电子
0
0
+1 -1
2 Na + Cl2 = 2NaCl
得到电子
化合价降低,被还原,发生还原反应
为反应生成的CrO5溶于乙醚所致。CrO5的结构如右:
。
上述反应的离子方程式为:Cr2O72-+4H2O2+2H+=2CrO5+5H2O。
(已知:-O-O- 中的氧为-1价)对以上实验事实分析正确的是( C )。
A. Cr2O72-被氧化为CrO5
B. CrO5化合物中Cr为+10价
C. 该反应不属于氧化还原反应 D. 该反应中K2Cr2O7是还原剂
[基础训练]标出下列反应的电子转移方向和数目:
(用双线桥和单线桥法)
1. 3S + 3Ca(OH)2 = 2CaS + CaSO3 + 3H2O 2. 2Na2O2 + 2H2O = 4NaOH + O2 ↑ 3. 2H2S + SO2 = 2H2O + 3S 4. KClO3 + 6HCl(浓) = KCl + 3H2O + 3Cl2 ↑
化合价升高,被氧化,发生氧化反应
电子对偏离
0
0
+1 -1
H2+ C电l2子=对偏2向HCl
化合价降低,被还原,发生还原反应
1.特征: 有化合价改变的反应。
2. 本质: 有电子得失的化学反应。
3. 氧化反应:被氧化元素化合价升高,失去电子 (或 电子对偏离)。还原反应:被还原反应化合价 降低,得到电子(或电子对偏向)。 4. 几对概念:氧化剂、还原剂,氧化反应、还原 反应,氧化产物、还原产物,氧化性、还原性。
四.氧化还原反应的一般规律
1.电子守恒规律:
2.价态规律:最高价态的元素只有氧化性,最低价态的 元素只有还原性,中间价态的元素既有氧化性,又有还
原性。
3.性质强弱规律:氧化性——氧化剂>氧化产物; 还原性——还原剂>还原产物。 如:2FeCl3+Cu = 2FeCl2+CuCl2, 氧化性:Fe3+>Cu2+,还原性:Cu>Fe2+。
高三化学一轮复习
氧化还原反应
[考纲要求]
1. 1.
氧化还原反应的基本概念。 氧化还原反应的基本概念
2. 2.
电电子子转转移移的的表表示示方方法法((单单、、双双线线桥桥法法))。
3. 3.
重要的氧化剂和还原剂。 重要的氧化剂和还原剂
4. 4.
氧氧化化还还原原反反应应的的一一般般规规律律。
5. 5.
为“夺命杀手”。我国科学家尝试用含硒化合物Na2SeO3消除人
Байду номын сангаас
体内的活性氧,在消除活性氧时,Na2SeO3的作用是(A )。
A.还原剂
B.氧化剂
C.既是氧化剂,又是还原剂 D.以上均不是
[变式练习](2010年永州一中模拟)在稀硫酸酸化的K2Cr2O7的
H2O2溶液中加入乙醚后液体分层,在乙醚层中出现深蓝色,这是因
H2S、 S2—、H S—、HBr、Br—、HI、I—、 浓HCl、Cl—、H2SO3 、HSO3—。 (5)变价元素中元素低价态时的盐、碱。 Na2SO3、Na2S、FeSO4、Na2S2O3、Fe(OH)2。 (6)其它:S、Sn2+、NH3。
[例1](2011年湖南师大附中模拟)吸进人体内的O2有2%转化为 氧化性极强的活性氧副产物,这些活性氧能加速人体衰老,被称
⑴置换反应一定是氧化还原反应。 ⑵复分解反应一定不是氧化还原反应。 ⑶有单质参加的化合反应通常属于氧化还原反应。; ⑷有单质生成的分解反应通常属于氧化还原反应。
[例2]下列反应既是分解反应,又是氧化还原反应的是
( B )。
△
A. Cu2(OH)2CO3=====2CuO+H2O+CO2 ↑
通电
B. 2H2O===== 2H2 ↑ + O2 ↑
△
5. 5NH4NO3 ==== 4N2 ↑ + 2HNO3 + 9H2O
三.中学常见的氧化剂和还原剂
1.重要的氧化剂
(1)活泼非金属单质:F2 、 Cl2、 Br2 、I2 、 O2、O3。 (2)高价氧化物:MnO2、PbO2、 CO2。 (3)高价态酸:HNO3、HClO3、HClO4、浓H2SO4。 (4)高价态盐:KNO3(H+)、 KMnO4(酸性、中性、
△ 1、3CO+Fe2O3=2Fe+3CO2
△ 2、4HCl+MnO2=MnCl2+Cl2↑+2H2O
3、 2FeCl2 + Cl2 = 2FeCl3
4 4FeS2 11O2
2Fe2O3 8SO2
[思考与交流] 氧化还原反应与四种基本类型的关系:
化合反应
氧化还原反应 分解反应
置换反应
复分解反应
5.十字口诀:失升氧还氧,得降还氧还
五组概念之间的相互关系:
反
具 氧有 化 剂
发
氧 得到 被 生
化 性
电子
还 原
还 原 反 应
生 成
还 原 产 物
生
应
成
物
物
具 还有 原 剂
发
还 失去 被 生
原
氧
性 电子 化
氧 化 反 应
生 成
氧 化 产 物
例1、判断下列反应哪些是氧化剂、还原剂、氧化产物、 还原产物
碱性)、 KClO3、FeCl3、K2Cr2O7。 (5)过氧化物:H2O2、Na2O2、 CaO2、 BaO2、 K2O2。 (6)其它:HClO、NaClO、漂白粉、NO2。 (7) 弱氧化剂:能电离出H+的物质、银氨溶液、新制
的 Cu(OH)2。
2.重要的还原剂
(1)金属单质:IA、IIA、金属活动性顺序表。 (2)非金属单质:H2、C、Si。 (3)变价元素中元素低价态氧化物:SO2、CO。 (4)变价元素中元素低价态的酸、阴离子。
C. 8NH3+ 3Cl2 = 6NH4Cl + N2
D. 3CuS+8HNO3 = 3Cu (NO3)2+2NO↑+3S↓+4H2O
[例3] 见学案
二.氧化还原反应电子转移的表示方法 1.单线桥法:表示氧化还原反应中电子转移的方向和数目。 而且箭头方向一定是由还原剂指向氧化剂。
2.双线桥法:表示同一元素得失电子变化情况。箭头都是 由反应物指向生成物,在线桥上一定要注明“得”或“失”
4.反应先后规律:如把Cl2通入FeBr2溶液中, 由于还原性Fe2+>Br-,当通入少量Cl2时, 根据先后规律,Cl2首先将Fe2+氧化;但Cl2足量 时,就可将Fe2+、Br-一并氧化。
