化学:高考化学平衡图像大全1
化学平衡图像总结

A T1<T2,p1<p2,a+b>c,正反应吸热 B T1>T2,p1<p2,a+b<c,正反应吸热 C T1<T2,p1<p2,a+b<c,正反应放热 D T1>T2,p1<p2,a+b>c,正反应放热
B%
T2 P2
T1 P2
T1 P1
0
t
习题2 看图:说出反应起始时是从正反应;还 是从逆反应开始?正反应是放热还是吸热?
V
V逆 V正
突变
V'正 V'逆
答:从逆反应开始。 降温或减压。 平衡向正反应方向移
动。
t
化学平衡图像总结
看图:说出反应起始时是从正反应;还是从逆反应开 始?然后是改变什么条件?化学平衡向什么方向移动?
V V正 V'正 = V'逆
答:正、逆反应 同时开始。
突变
V逆
加催化剂平衡 不移动。
起始量不为0_逆__反_应__方向移动,则方程式
中左右两边系数大小是_________。 b<(c+d)
压强
解题原则:(2)定一议二
练习:
1.下图表示外界条件(温度、压强)的变化对下列反 应的影响 A(s) + B(g) 2C(g) △H > 0,在图中,Y
轴是指( B )
A. 平衡混合气体中C的体积分数
V
V正
答:正、逆
同时反应开
V逆
始。
正反应是
吸热反应。
T(温度)
温馨提示:为更好地满足您的学习和使用需求,课件在下载后可以自由编辑,请您根据实际情况进行调整!Thank you for
例2:可逆反应:aX(s) + bY(g) cZ(g) +dW(g)达到平
高考化学:化学平衡图像

量 变
Ⅰ C2H6(g) C2H4(g)+ H2(g) ΔH1=136 kJ·mol−1 Ⅱ C2H6(g)+CO2(g) C2H4(g)+H2O(g)+CO(g) ΔH2=177 kJ·mol−1 Ⅲ C2H6(g)+2CO2(g) 4CO(g)+3H2(g) ΔH3
化、Ⅳ CO2(g)+H2(g) CO(g)+H2O(g) ΔH4=41 kJ·mol−1 已知:298K时,相关物质的相对能量(如图1)。
A
转 化
B
E
率
CD
0
T
3、已知可逆反应aA+bB cC中,物质 的含量A%和C%随温度的变化曲线如图所
示,下列说法正确的是( B )
A.该反应在T1、T3温度时达到过化学平衡 B.该反应在T2温度时达到化学平衡 C.该反应的逆反应是放热反应过程
D.升高温度,平衡会向正反应方向移动
4、在下列反应中:A2(g)+B2(g)
能 量 变 化 、 物 质 变 化
反应速率大小(Ea)比较、(正)催 化剂对反应速率(反应历程)的影响
➢ 放热反应为什么需要点燃或加热?
反应的进行需要最初的反应动力? — 活化能
点燃 C + O2 === CO2
点燃 2H2 + O2 === 2H2O
加热 Fe + S === FeS
反应物的能量总和
2AB
(g)(正反应放热)当其达到平衡时,在下图的
曲线中,符合勒夏特列原理的曲线是( D )
A ①② B ③④ C ① D ①⑤
3、速率-压强(温度)图
符合下图的反应为( B )
A.H2(g) +I2(g) 2HI(g)
B.3NO2(g)+H2O(l) 2HNO3(l)+NO(g)
化学平衡图像专题(超详细版)

一、浓度 - 时间图:
例:
c
0.9 0.6 0.3
可用于:
1)写出化学反应方程式:
C A B
t
A+2B 3C A的转化率=33.3% B的转化率=66.7%
2)求反应物的转化率:
200℃ 300℃
pC(g)+qD(g)
正反应吸热 m+n=p+q
P
判断m+n与p+q的关系?正反应是放热 还是吸热?
对于2A(g)+B(g) C(g)+3D(g)(正反应 吸热)有如下图所示的变化,图中Y轴可 能表示:
Y
A. B物质的转化率
B. 正反应的速率
300℃
200℃ C. 平衡体系中的A% 100℃ P D. 平衡体系中的C%
2、该反应正向是:啊
(吸、放)热反应。
啊气体物质的量(增大、减源自)的反应。三、某物质的转化率(或百分含量)时间-温度(或压强)图:
对于反应mA(g)+nB(g)
pC(g)+qD(g)
A
的 转
T1
化 率
T2
t
判断正反应是放热还是吸热?
正反应吸热
三、某物质的转化率(或百分含量)时间-温度(或压强)图:
c
练: 0.4
0.3
B
0.2
A
0.1
C
t
1) 写出化学反应方程式: 5A 3B+2C
2) 求反应物的转化率: A的转化率=62.5%
二、速度-时间图: 可用于:
化学平衡图像专题完整各类型图像

or personal use only in study and research; not for commercial use化学平衡图像专题解题思路:一看轴(纵、横坐标的意义),二看线(线的走向和变化趋势),三看点(起点、折点、交点、终点、零点的意义),四看要不要作辅助线(等温线、等压线、平衡线),五看量的变化(如浓度变化、温度变化等),六想规律(外界条件对反应速率的影响规律和化学平衡移动规律)1. 速率-时间图1. 对于达平衡的可逆反应X+Y W+Z,增大压强则正、逆反应速度(v)的变化如上图,分析可知X,Y,Z,W的聚集状态可能是()。
(A)Z,W为气体,X,Y中之一为气体(B)Z,W中之一为气体,X,Y为非气体(C)X,Y,Z皆为气体,W为非气体(D)X,Y为气体,Z,W中之一为气体2. 在一定条件下,反应A(g)+B(g)C(g)(正反应为放热反应)达到平衡后,根据下列图象判断A. B. C. D.E.(1)升温,达到新的平衡的是( )(2)降压,达到新的平衡的是( )(3)减少C的量,移向新平衡的是( )(4)增加A的量,移向新平衡的是( )(5)使用催化剂,达到平衡的是( ) 2. 浓度(物质的量)-时间图3. 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如右图,下列表述中正确的是()A.反应的化学方程式为:2 M NB.t2时,正逆反应速率相等,达到平衡C.t3时,正反应速率大于逆反应速率 D.t1时,N的是M浓度的2倍3. 含量-时间-温度(压强)图4. 可逆反应m A(s)+n B(g ) e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是()。
(A)达平衡后,加入催化剂则C%增大(B)达平衡后,若升温,平衡左移(C)化学方程式中n>e+f(D)达平衡后,增加A的量有利于平衡向右移动5. 在密闭容器中进行下列反应:M(g)+N(g )R(g)+2L此反应符合下面图像,下列叙述是正确的是()(A) 正反应吸热,L是气体(B) 正反应吸热,L是固体(C) 正反应放热,L是气体(D) 正反应放热,L是固体或液体6. 可逆反应m A(s) + n B(g) p C(g) + q D(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图(T2>T1),根据图中曲线分析,判断下列叙述中正确的是()(A)到达平衡后,若使用催化剂,C的质量分数增大(B)平衡后,若升高温度,平衡则向逆反应方向移动(C)平衡后,增大A的量,有利于平衡向正反应方向移动(D)化学方程式中一定n>p+q7. 现有可逆反应A(气)+B(气)3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则__ _曲线是表示有催化剂时的情况。
化学平衡图像完美版资料

(一)速率图像
1、浓度-时间图 2、速率-时间图 3、速率-温度 (或压强)图
(二)常见化学平衡图像
1、某物质的转化率(或百分含量)-时间-温度 (或压强)图 2、某物质的转化率(或百分含量)-- 温度-压强图
1、某物质的转化率(或百分含量)-时间-温度 (或压强)图:P51
转 (B)平衡后,若升高温度,则平衡向逆反应方向移动
化 的 •对于2A(g)+B(g) C(g)+3D(g)(正反应吸热)有如下图所示的变化,图中Y轴可能表示:
例:对于反应mA(g)+nB(g)
率 1.01*10 Pa 例:对于反应mA(g)+nB(g)
pC(g)+qD(g) pC(g)+qD(g)
例:对于反应mA(g)+nB(g)
A的转 化率
B的
T1
转化 率
T2
pC(g)+qD(g)
P1 P2
0
t0
t
T1 > T2;
正反应 吸 热
< P1 P2; m+n< p+q
例1、可逆反应mA(s)+nB(g)
pC(g)+qD(g)。反应中,
当其它条件不变时,C的质量分数与温度(T)和压强
(P)的关系如上图,根据图中曲线分析,判断下列叙
C、平衡体系中的A%
300℃ D、平衡体系中的C%
200℃
100℃
0
P
A、D
练习2.P49 9、已知:
4NH3(g)+5O2(g)=4NO(g)+6H2(g). △H=-1025kJ/mol该
化学平衡图像
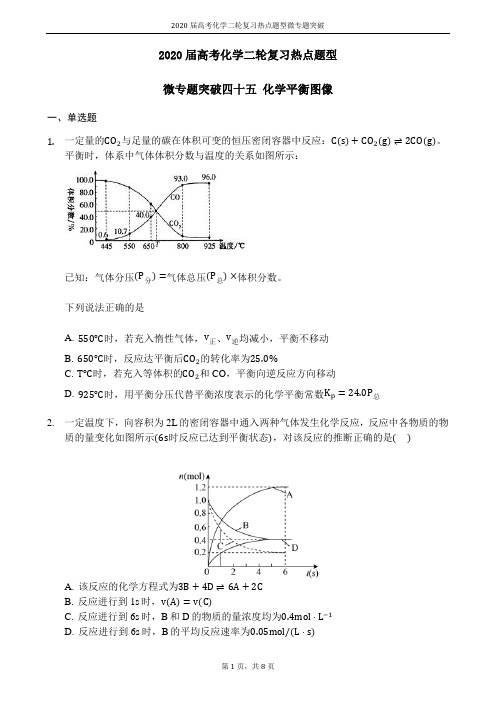
2020届高考化学二轮复习热点题型微专题突破2020届高考化学二轮复习热点题型微专题突破四十五化学平衡图像一、单选题1.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)⇌2CO(g)。
平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(P分)=气体总压(P总)×体积分数。
下列说法正确的是A. 550℃时,若充入惰性气体,v正、v逆均减小,平衡不移动B. 650℃时,反应达平衡后CO2的转化率为25.0%C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数K p=24.0P总2.一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是()A. 该反应的化学方程式为3B+4D⇌6A+2CB. 反应进行到1s时,v(A)=v(C)C. 反应进行到6s时,B和D的物质的量浓度均为0.4mol⋅L−1D. 反应进行到6s时,B的平均反应速率为0.05mol/(L⋅s)3.在一定条件下,使10mol SO3在体积固定为2L的密闭容器中发生反应:2SO2(g)+O2(g)⇌2SO3(g),则下图中正确的是(M表示混合气体的平均相对分子质量)()A. B.C. D.4.如图所示的各图中,表示2A(g)+B(g)⇌2C(g)(△H<0)这个可逆反应的正确图象为(注:Φ(C)表示C的质量分数,P表示气体压强,C表示浓度)()A. B.C. D.5.下列叙述与图象对应符合的是()A. 对于达到平衡状态的N2(g)+3H2(g)⇌2NH3(g)在t0时刻充入了一定量的NH3,平衡逆向移动B. 对于反应2A(g)+B(g)⇌C(g)+D(g)△H<0,p2>p1,T1>T2C. 该图象表示的化学方程式为:2A=B+3CD. 对于反应2X(g)+3Y(g)⇌2Z(g)△H<0,y可以表示Y的百分含量6.在密闭容器中,反应X2(g)+Y2(g)⇌2XY(g)△H<0达到甲平衡,仅改变某一条件后,达到乙平衡.对此过程的分析正确的是()A. 可能是减小了反应物的浓度,反应物X2转化率一定减小B. 可能是加入了催化剂,反应物X2百分含量(X2%)将增大2020届高考化学二轮复习热点题型微专题突破C. 可能是缩小了容器的体积,但该反应的平衡常数保持不变D. 可能是升高了温度,该反应的平衡常数一定减小7.反应:2X (g)+Y(g)⇌2Z(g)在不同温度和压强下的产物Z的物质的量和反应时间t的关系如下图所示,下列判断正确的是()A. P1>P2T1>T2△H<0B. P1>P2T1<T2△H<0C. P1<P2T1>T2△H>0D. P1<P2T1<T2△H>08.在一个固定容积的密闭容器中,可发生以下反应:A(g)+B(g)⇌xC(g)△H=?,符合图(a)所示的关系,其中w(C)为C的质量分数,由此推断关于图(b)的说法正确的是()A. P3>P4,y轴表示A的转化率B. P3<P4,y轴表示B的体积分数C. P3<P4,y轴表示混合气体的平均相对分子质量D. P3>P4,y轴表示混合气体的密度9.图中表示2NO(g)+O2(g)⇌2NO2(g)△H<0,能正确反映该可逆反应变化的图象是()A. B.C. D.10.某化学研究小组探究外界条件对化学反应mA(g)+n(B)(g)⇌pC(g)的速率和平衡的影响图像如下,下列判断正确的是()A. 由图1可知,T1<T2,该反应正反应为吸热反应B. 由图2可知,该反应m+n<pC. 图3中,表示反应速率v(正)>v(逆)的是点3D. 图4中,若m+n=p,则a曲线一定使用了催化剂11.在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)ΔH<0下列分析中正确的是()A. 图Ⅱ研究的只是t0时使用催化剂对反应速率的影响B. 图Ⅰ研究的是t0时缩小容器体积对反应速率的影响C. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高D. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂12.某密闭容器中发生如下反应:2X(g)+Y(g)⇌Z(g);△H<0如图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的用量.则下列说法中不正确的是()A. t3时降低了压强B. t5时提高了温度C. t1−t2时该反应的平衡常数小于t6时反应的平衡常数D. t6时刻后反应物的转化率最低二、填空题13.汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)⇌2NO(g)△H>0,已知该反应在240℃,平衡常数K=64×10−4.请回答:(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是______(填字2020届高考化学二轮复习热点题型微专题突破母序号).14.元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4−(绿色)、Cr2O72−(橙红色)、CrO42−(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:(2)CrO42−和Cr2O72−在溶液中可相互转化。
化学选修4《化学平衡》化学平衡图像共28页

11、用道德的示范来造就一个人,显然比用法律来约束他更有价值。—— 希腊
12、法律是无私的,对谁都一视同仁。在每件事上,她都不徇私情。—— 托马斯
13、公正的法律限制不了好的自由,因为好人不会去做法律不允许的事 情。——弗劳德
14、法律是为了保护无辜而制定的。——爱略特 15、像房子一样,法律和法律都是相互依存的。——伯克
▪
26、要使整个人生都过得舒适、愉快,这是不可能的,因为人类必须具备一种能应付逆境的态度。——卢梭
▪
27、只有把抱怨环境的心情,化为上进的力量,才是成功的保证。——罗曼·罗兰
▪
28、知之者不如好之者,好之者不如乐之者。——孔子
▪
29、勇猛、大胆和坚定的决心能够抵得上武器的精良。——达·芬奇
▪
30、意志是一个强壮的盲人,倚靠在明眼的跛子肩上。——叔本华
谢谢!28Fra bibliotek
化学平衡图像及等效平衡

练习3
右图表示在密闭容器中反应:2SO2+O2 2SO3+Q达到平衡时 ,由于条件改变而引起反应 速度和化学平衡的变化情况,ab过程中改变 的条件可能是 ;bc过程中改变的条件可能 是 ; 若增大压强时,反应速度变化情况 画在c—d处.
V正
V逆
升温
减小[SO3]
三、x% – t 图
x% (或用φ(C) 表示) 可以表 示反应物、生成物在反应体系中的 物质的量百分数(体积分数)、或 表示反应物的转化率等; t表示时间;
V
V正 V逆
A t
V正
V逆 D t
V正
B t
V正
C t
说明
上述图象的特点是有一速 率改变,随后正逆反应速率再 发生变化,直至两者相等建立 新的平衡。是改变某一物质浓 度而引起化学平衡移动的特征。
二、v – t 图
练习2
练习2
在密闭容器,一定条件下进行反应, mA(g)+nB(g) pC(g)+qD(g) 若增大压强或升高温度,重新达到平衡,变化过 程均如图所示,则对该反应叙述正确的是(BD ) A.正反应是吸热反应 B.逆反应是吸热反应 C.m+n>p+q D.m+n<p+q
例3:下列图线分别有哪些含义?
V V V V
V正 V逆 A
t
V正 V逆
V逆 V正
V逆 V正
t
B
t
C
D
t
A.升温时,正、逆反应速率均增大,但吸热反应方 向的速率增得更多,正反应为吸热反应; 或气体反应时增压,正逆反应速率均增大,但气体 体积大的增大得更多,正反应为气体缩小的反应。 C与A 正、逆相反。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
此图在t2时,如果是加热,那
浓
么正反应是放热还是吸热?如
度
果是减压,那么m+n与p的关系
如何?
C
0
A或B
t1 t2 t3
时间
•正反应吸热 t
•m+n<p+q t
A%
C%
T1
T2
•正反应放热 t
P1
P2
•m+n=p+q t
三、某物质的转化率(或百分含量)-时间温度(或压强)图:
•对于反应mA(g)+nB(g) pC(g)+qD(g)
B%
T2P2 T1P2 T1P1
t •m+n<p+q •正反应吸热
四、某物质的转化率(或百分含量)-温度 (或压强)图:
•已知对某一平衡改变温度时有如下图变化,
则温度的变化是
升(升高高或降低),平衡
向 反正应方向移动,正反应是 热吸反应。
v
v
v正
v逆
v逆
v正
t1
t2 t
t1
t2 t
•若对一正反应吸热的可逆反应平衡后降低
温度,画出平衡移动过程中的 v - t 图。
二、速度-时间图:
•对于mA(g)+nB(g) pC(g)+qD(g),改变压强 时有如下图变化,则压强变化是 增大 (增 大或减小),平衡向 逆 反应方向移动,m+n < (>、<、=)p+q。
C%
1.01*106Pa 1.01*105Pa
A%
1.01*104Pa
200℃
300℃
T
P
•正反应吸热 m+n>p+q
•正反应吸热 m+n=p+q
四、某物质的转化率(或百分含量)-温度
(或压强)图:
•对于2A(g)+B(g) C(g)+3D(g)(正反应吸热)有 如下图所示的变化,图中Y轴可能表示:
一、浓度 - 时间图: 可用于:
例:
1)写出化学反应方程式:
c
C
A+2B 3C
A 2)求反应物的转化率:
B
t A的转化率=33.3% B的转化率=66.7%
练:
1)写出化学反应方程式:
c
5A 3B+2C
0.4 0.3
B 2)求反应物的转化率:
0.2 0.1
A C
A的转化率=62.5%
t
二、速度-时间图:可用于:
A、B物质的转化率
Y
B、正反应的速率
C、平衡体系中的A%
300℃ D、平衡体系中的C%
200℃
100℃
P
A、D
五、其它:对于反应mA(g)+nB(g) pC(g)+qD(g)
v
v正
v
v正 v逆
v逆
T1
T2
•正反应吸热
T
•正反应吸热 T
Байду номын сангаас
C%
A%
450℃
•正反应放热
T
P1
P
•m+n<p+q
2、化学平衡图象分析
1) 已知引起平衡移动的因素,判断反应是
吸热或放热,反应前后气体体积的变化。
2) (已知反应)判断引起平衡移动的因素。
v v正
•引起平衡移动的因素是
v逆
t1
t2
增大反应物浓度,平衡 t 将向 正 方向移动。
v v正
•引起平衡移动的因素是 减小生成物浓度,平衡
v逆
t1
t2
t 将向 正 方向移动。
二、速度-时间图:
v
v逆
v
v正
t1
t2 t
v逆
v正
t1
t2 t
•若对以上反应已知m+n>p+q,平衡后降低
压强时,画出相关的 v – t 图。
二、速度-时间图:
•对于反应A(g)+3B(g) 2C(g)+D(g)(正反应放 热)有如下图所示的变化,请分析引起平衡 移动的因素可能是什么?并说明理由。
v
v逆
•由于v正、v逆均有不同程 度的增大,引起平衡移动
v正
的因素可能是 a.升高温度
b.增大压强。根据反应方
t1
t2 t 程式,升高温度平衡向逆
反应方向移动,与图示相符;增大压强平衡
向正反应方向移动,与图示不相符。故此题
中引起平衡移动的因素是升高温度。
二、速度-时间图:
•对于反应mA(g)+nB(g) pC(g)+qD(g)有如下 图所示的变化,请分析t1时的改变因素可能 是什么?并说明理由。
NO
转
A
化 率
BE
CD
0
T
练 2、如图所示,图中a曲线表示X(g) +Y(g) 2Z(g)+ W(s)+ Q的反应过程,若使a曲线变为
习:b曲线,可采取的措施是( A.D)
A. 加入催化剂
Z%
B. 增大Y的浓度 C. 降低温度
D. 增大体系压强
b
a
0
t
2、化学平衡图象分析
(6)浓度——时间曲线
mA(g)+nB(g) pC(g)+qD(s)
•对于反应mA(g)+nB(g) pC(g)+qD(g)
A的
A%
500℃
转 化
200℃
率
1.01*107Pa
1.01*106Pa
1.01*105Pa
T
P
•正反应放热 m+n>p+q
•正反应放热 m+n<p+q
四、某物质的转化率(或百分含量)-温度 (或压强)图:
•对于反应mA(g)+nB(g) pC(g)+qD(g)
(6)浓度——时间曲线
mA(g)+nB(g) pC(g)+qD(s)
此图在t2时,如果是加热,那
浓
么正反应是放热还是吸热?如
度
果是减压,那么m+n与p的关系
如何?
C
0
A或B
t1 t2 t3
时间
练 1、下图是在其它条件一定时,反应2NO+O2 2NO2+ Q(Q>0)中NO 的最大转化率与温度的关
习:系曲线。图中坐标有A、B、C、D、E 5点,其中表 示未达平衡状态且V正>V逆的点是 C点 。
v
v正 v逆
•由于v正、v逆相同程 度的增大,t1时的改变
因素可能是 a.加入(正)
t1
t
催化剂 b.当m+n=p+q 时增大压强。平衡没有
移动。
三、某物质的转化率(或百分含量)-时间-
温度(或压强)图:
•对于反应mA(g)+nB(g) pC(g)+qD(g)
A的 转化率
B的
T1
转 化
T2
率
P1 P2
