化学平衡图像经典例题
高二化学(必修一)化学平衡图象练习题

高二化学(必修一)化学平衡图象练习题(含答案解析)学校:___________姓名:___________班级:___________一、单选题1.在2A(g)+B(g)=3C(g)+5D(g)反应中,表示该反应速率最快的是()A.v(A)=2mol·L-1·min-1B.v(B)=0.3mol·L-1·s-1C.v(C)=0.8mol·L-1·s-1D.v(D)=1mol·L-1·s-12.a A(g)+b B(g)⇌c C(g)+d D(g)Δ H=Q,同时符合两图中各曲线规律的是()A.a+b>c+d T1>T2 Q>0B.a+b>c+d T1>T2 Q<0C.a+b>c+d T1<T2 Q<0D.a+b<c+d T1<T2 Q<03.CuCl2溶液中存在平衡:[Cu(H2O)4]2+(蓝色)+4Cl-⇌[CuCl4]2-(黄色)+4H2O,下列说法中错误的是()A.[CuCl4]2-中铜的化合价是+2价B.1mol[Cu(H2O)4]2+中σ键的物质的量为12molC.向溶液中加入AgNO3可使黄绿色的CuCl2溶液变成蓝色D.若升高CuCl2溶液温度,溶液pH不变4.在某恒容密闭容器中充入一定量的O2(g)和O3(g),发生反应2O3(g)3O2(g) △H<0,下列说法正确的是()A.若混合气体的密度不再随时间而改变,则该反应达到平衡B.加入合适的催化剂,反应达到平衡后,O2的体积分数增大C.该反应的生成物的总能量大于反应物的总能量D.若起始时充入少量的稀有气体,则该反应的反应速率保持不变5.中国科学技术大学设计出一种“松果结构”的铂金属催化剂,在催化电解水制氢效果不变的情况下,铂金属的用量降低到传统商业催化剂的175,下列说法不正确的是()A.催化剂的结构会影响催化效果B.使用“松果结构”的铂金属催化剂能够极大提高水的转化率C.使用铂金属催化剂能够降低电解水的活化能D.氢能是一种高能、洁净的可再生能源6.以Cu/Zn O/Al2O3为催化剂,乙醇直接合成乙酸乙酯过程中发生的可逆反应如下:C2H5OH(g)=CH3CHO(g)+H2(g);Δ H=59kJ·mol-12CH3CHO(g)+H2O(g)=C2H5OH(g)+CH3COOH(g);Δ H=-86kJ·mol-1CH3COOH(g)+C2H5OH(g)=CH3COOC2H5(g)+H2O(g);Δ H=-25kJ·mol-12C2H5OH(g)=C2H5OC2H5(g)+H2O(g);Δ H=-44kJ·mol-1其他条件相同,将无水乙醇经预热气化后以一定流速通过装有催化剂的反应管,将出口处收集到的乙酸乙酯、乙醛、乙醚、乙酸、乙醇冷凝,测得部分有机物占全部有机物的质量分数与反应温度的关系如图所示。
化学平衡图像例题
例3:在密闭容器中进行下列反应:M(g)+N(g) R(g)+2L,在不同条件下R的百分含量R% 的变化情况如下图,下列叙述正确的是( ) A、正反应吸热,L是气体 B、正反应吸热,L是固体 C、正反应放热,L是气体 D、正反应放热,L是固体或液体
例4:25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量 金属锡(Sn),发生反应: Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s), 体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。 下列判断正确的是( ) A.往平衡体系中加入金属铅后,c(Pb2+)增大 B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 D.25℃时,该反应的平衡常数K=2.2
例5:如图曲线是其它条件不变时某反应物的 最大转化率(α)与 温度(T)的关系曲线 ,图中标出 的1、2、3、4,四个点, 表示V正=V逆的点是 V正>V逆的点是 。
例6.对于可逆反应: A2(g)+3B2(g) 2AB3(g) △H<0,下列图像中正确的是( )
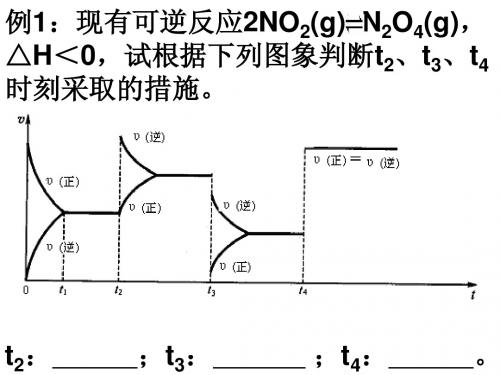
练习:(2014.1)一定条件下,0.3 mol X(g)与0.3 mol Y(g)在体积为1L的密闭容器 中发生反应:X(g)+3Y(g) 2Z(g),下 逆反应2NO2(g) N2O4(g), △H<0,试根据下列图象判断t2、t3、t4 时刻采取的措施。
t2 :
; t3 :
;t4:
。
例2:对于反应mA(g) + nB(g) pC(g)+qD(g) △H=QkJ/mol,分析 下列图像:
P一定,△H T一定,m+n T一定,m+n
0 p+q p+q
化学平衡图像题目

化学平衡和速率图像1.速率-时间(v-t )图像方法:A. 首先分清图像的“突变”和“渐变”,出现渐变的为改变浓度。
如下图甲乙甲图中v 正突然变大、v 逆在t1渐变,可见改变的为增加反应物的浓度。
乙图中v 正突然变小、v 逆在t1渐变,可见改变的为减少反应物的浓度。
B.如果图像都为突变,则改变的可能是温度、压强、催化剂等,以及同时改变反应物和生成物的浓度。
这类图像要先看速率,再看平衡。
首先分析速率较之前的大小变化,如果变大,为增大温度、增大压强、加催化剂,再分析此时v 正、v 逆的相对大小,如果v 正>v 逆,表示平衡正向移动,再从上述条件里选择使平衡正向移动的条件。
例1,N 2+ 3H 22NH 3,△H<0建立平衡后加热对速率的影响如图1。
123图1υ图2如图1所示,t 2时刻后,图像突变,速率较之前都变大,为升温、升压、加催化剂,又因为v 逆>v 正,平衡逆向移动,上述可以使此反应逆向移动的为升温。
如图2所示,t 2时刻后,图像突变,速率较之前都变大,为升温、升压、加催化剂,又因为v 正>v 逆,平衡正向移动,上述可以使此反应正向移动的为升压。
如图3所示,t2时刻后,图像突变,速率较之前都变小,为降温降压,又因为v 逆>v 正,平衡逆向移动,上述可以使此反应逆向移动的为降温。
图3练习1.下列图像为反应H 2(g)+I 2(g)2HI(g);△H>0 的速率-时间图像,分析下列三个图像改变的条件图1中,t2时刻后,图像突变,速率较之前都变大,为升温、升压、加催化剂,又因为v 正>v逆,平衡正向移动,上述可以使此反应正向移动的为升温。
图2中,t1时刻后,图像渐变,v逆突然变小,V正渐渐变小,为减少生成物即HI的浓度。
图3中,t0时刻后,图像突变,速率都变大,为升温、升压、加催化剂,又因为v正=v逆,平衡不移动,根据此反应,为升压或者加催化剂。
练习2一密封体系中发生下列反应:N+3H2 2NH3 +Q,下图是某一时间段中反应速率2与反应进程的曲线关系图:回答下列问题:(1)处于平衡状态的时间段是______.(2)t1、t3、t4时刻体系中分别是什么条件发生了变化?、、(3)下列各时间段时,氨的百分含量最高的是______.A.t0~t1B.t2~t3C.t3~t4D.t5~t6【答案】(1)t0~t1、t2~t4、t5~t6(2)升高温度,加了催化剂,降低压强(3)t0~t1练习3一定温度下可逆反应aX(g)+bY(g)cZ(g)在一密闭容器内达到平衡后,t0时刻改变某一外界条件,化学反应速率()随时间(t)变化如图所示。
专题五 化学平衡图像

专题五化学平衡图像1、速率—时间图例题1.对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图1所示,则图象中关于X、Y、Z、W四种物质的聚集状态为()A.Z、W均为气体,X、Y中有一种是气体B.Z、W中有一种是气体,X、Y皆非气体C.X、Y、Z、W皆非气体D.X、Y均为气体,Z、W中有一种为气体练1:A(g)+3B(g) 2C(g) △H<0达到平衡,改变下列条件,正反应速率始终增大,一直达到新平衡的是()A.升温B.加压C.增大c(A) D.降低c(C) E.降低c(A)2、浓度—时间图1.图2表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间.试回答:(1)该反应的反应物是______;(2)反应物的转化率是______;(3)该反应的化学方程式为______.2、为了研究碳酸钙与盐酸反应的反应速率,某同学通过下图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线,在该实验过程中发现锥形瓶温度升高。
请分析讨论以下问题。
3.反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是()A.10~15 min可能是加入了正催化剂B.10~15 min可能是降低了温度C.20 min时可能是缩小了容器体积D.20 min时可能是增加了B的量3、含量—时间—温度(压强)图1.同压、不同温度下的反应:A(g)+B(g)C(g);△HA的含量和温度的关系如图3所示,下列结论正确的是()A.T1>T2,△H>0 B.T1<T2,△H>0C.T1>T2,△H<0 D.T1<T2,△H<02.现有可逆反应A(g)+2B(g)nC(g);△H<0,在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图4,其中结论正确的是()A.p1>p2,n>3 B.p1<p2,n>3C.p1<p2,n<3 D.p1>p2,n=34、恒压(温)线1.对于反应2A(g)+B(g)2C(g);△H<0,下列图象正确的是()和T2)2.反应2X(气)+Y(气) 2Z(气)(正反应为放热反应),在不同温度(T及压强(P1和P2)下,产物Z的物质的量[n(z)]与反应时间(t)的关系如图所示。
高考化学小题精练系列专题34化学平衡图像(含解析)

专题34 化学平衡图像(满分42分时间20分钟)姓名:班级:得分:1.在密闭容器中,反应2X(g)+ Y 2(g) 2XY(g)△H<0,达到甲平衡。
在仅改变某一条件后,达到乙平衡,下列分析正确的是A.图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2B.图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低C.图Ⅱ中,t时间是增大了压强D.图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲【答案】D考点:考查化学平衡图像分析。
2.如图是关于反应A2(g)+B2(g) 2C(g)+D(g) △H<0的平衡移动图像,影响平衡移动的原因可能是A .温度、压强不变,充入一些A 2(g)B .压强不变,降低温度C .压强、温度不变,充入一些与之不反应的惰性气体D .升高温度,同时加压 【答案】A【考点定位】考查化学反应速率与化学平衡【名师点晴】该题的难点是压强对平衡状态的影响,特别是“惰性气体”对化学平衡的影响:①恒温、恒容条件:原平衡体系−−−−→−充入惰性气体体系总压强增大→体系中各组分的浓度不变→平衡不移动。
②恒温、恒压条件:原平衡体系−−−−→−充入惰性气体容器容积增大,各反应气体的分压减小→体系中各组分的浓度同倍数减小(等效于减压),平衡向气体体积增大的方向移动。
3.在某容积一定的密闭容器中,有下列的可逆反应:A (g)+B (g)xC (g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T 表示温度,P 表示压强,C%表示C 的体积分数)A .P 3>P 4,y 轴表示B 的转化率 B .P 3<P 4,y 轴表示B 的体积分数C .P 3<P 4,y 轴表示混合气体的密度D .P 3<P 4,y 轴表示混合气体的平均摩尔质量 【答案】A【考点定位】考查化学平衡图象【名师点晴】本题旨在考查学生对化学平衡图象的理解.解答这类图象题,首先要“译”出其化学含义。
完整化学平衡移动图像专题

0
A
B
C
E
D
T
NO转化率
3 、图表示反应N2(g)+3H2(g) 2NH3(g);ΔH=-92.2kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是 ( ) A t0~t1 B t2~t3 C t3~t4 D t5~t6
AB
练习:
D
下列图象中,不能表示反应A2(g)+3B2(g) 2AB3(g)(△H<0)平衡体系的是…( )
练习:
2、下图是在其它条件一定时,反应2NO+O2 2NO2+ Q(Q>0)中NO 的最大转化率与温度的关系曲线。图中坐标有A、B、C、D、E 5点,其中表示未达平衡状态且V正>V逆的点是 。
•对于反应mA(g)+nB(g) pC(g)+qD(g)有如下图所示的变化,请分析t1时的改变因素可能是什么?并说明理由。
二、速度-时间图:
v逆
t1
t
v
v正
由于v正、v逆相同程 度的增大,t1时的改变因素可能是 a.加入(正)催化剂 b.当m+n=p+q时增大压强。平衡没有移动。
t
v
v正
增大
逆
<
•若对以上反应已知m+n>p+q,平衡后降低压强时,画出相关的 v – t 图。
t1 t2
t
v
v逆
v正
二、速度-时间图:
v逆
t1 t2
t
v
v正
•对于反应A(g)+3B(g) 2C(g)+D(g)(正反应放热)有如下图所示的变化,请分析引起平衡移动的因素可能是什么?并说明理由。
25化学平衡图像专题
25化学平衡图像专题1.在密闭中充入A 、B 或G 、H 进行可逆反应:aA 〔g 〕+ bB 〔g 〕 gG 〔g 〕+ hH 〔g 〕+Q ,图甲、图乙分不表示在虚线所示部位改变温度〔T 学平稳与反应速率〔v 〕的阻碍〔t 表示时刻〕,那么以下结论中正确的选项是〔 〕 A .开始时充入G和H ,a+b <g+h ,Q <0 B .开始时充入G 和H ,a+b <g+h ,Q >0 C .开始时充入G 和H,a+b >g+h ,Q >0 D.开始时充入A 和B ,a+b >g+h,Q >02.在A+B C 〔正反应是放热反应〕中,如图能正确表示反应速率〔纵坐标〕与温度〔横坐标〕关系的是〔 〕3.以下反应符合如图中两个图像的是〔v 表示反应速率,P 表示压强,x%表示反应物的百分含量,t 表示时刻〕〔 〕 A .N 2O 3〔g 〕 NO 2〔g 〕+ NO 〔g 〕〔正反应吸热〕B .4NH 3〔g 〕+ 5O 2〔g〕 4NO 〔g 〕+ 6H 2O 〔吸热反应〕C .3NO 2〔g 〕+ H 2O 〔g 〕 HNO 3〔g 〕+ NO 〔g 〕〔正反应放热〕 D.CO 2〔g 〕+ C 〔s 〕2CO 〔g 〕〔正反应吸热〕4.化学反应X 2〔g 〕+ Y 2〔g 〕 2XY 〔g〕〔正反应放热〕,达到平稳状态时,如图中5〔g.可逆反应mA 〔s 〕+nB 〔g 〕 pC 〔g 〕〔正反应放热〕B .m+n <p B .n >p.x 点时混合物的v 正>v 逆D .x 点比y 点混合物的反应速率慢 7.在容积固定的密闭容器中存在如下反应:A 〔g 〕+ 3B 〔g 〕 2C 〔g 〕〔正反应放热〕,某研究小组研究了其他条件不变时,改变某一条件对上述反应的阻碍,并依照实验数据作出以下关系图:甲 乙B C DA D A CA以下判定正确的选项是〔 〕 A .图I 研究的是不同催化剂对反应的阻碍,且乙使用的催化剂效率较高B .图Ⅱ研究的是压强对反应的阻碍,且甲的压强较大C .图Ⅱ研究的是温度对反应的阻碍,且甲的温度较高D .图Ⅲ研究的是不同催化剂对反应的阻碍,且甲使用的催化剂效率较高 8.可逆反应:2X+Y 2Z 〔g 〕+Q ,气体的平均摩尔质量〔M 〕随温度变化如下图,那么以下讲法正确的选项是〔 〕 A .X 和Y 可能差不多上固体 B .X 和Y 一定差不多上气体 C .假设Y 为固体,X 一定是气体 D .X 和Y 不可能差不多上气体 【化学平稳图像专题】 1.B 、2.B 、3. C 、4. A 、5.D 、6.C D 、7. AB 、8.C 练习: 1.在恒温时,一固定容积的容器内发生如下反应:2NO 2〔g 〕N 2O 4(g),达到平稳时,再向容器内通入一定量的NO 2〔g 〕,重新达到平稳后,与第一次平稳时相比,NO 2的体积分数 〔 〕 A .不变 B .增大 C .减小 D .无法判定 2.在一密闭容器中,反应 a A 〔g 〕b B 〔g 〕达平稳后,保持温度不变,将容器体积增加一倍,当达到新的平稳时,A 的浓度变为原先的60%,那么〔 〕A .平稳向正反应方向移动了B .平稳向逆反应方向移动了C .物质B 的质量分数增加了D .a <b 3.甲为恒温恒压容器,乙为恒温恒容容器。
化学平衡图像题例析 (带答案)

十类化学平衡图像题例析化学平衡图像题,一是以时间为自变量的图像;二是以压强或温度为自变量的图像。
从知识载体角度看,其一判断化学平衡特征;其二应用勒夏特列原理分析平衡移动过程;其三逆向思维根据图像判断可逆反应的有关特征;其四综合运用速率与平衡知识进行有关计算。
解题关键一是读图,弄清图像含义,通过观察弄清横坐标、纵坐标的含义及单位;搞清特殊点的意义,如坐标轴的“0”点,曲线的起点、终点、交叉点、极值点、转折点等;分析曲线的变化趋势如斜率大小、升降。
二是识图,进行信息提取,挖掘隐含信息、排除干扰信息、提炼有用信息,在统摄信息的基础上进行逻辑推理或运用数据计算。
三是用图,联想化学原理解答问题。
1. 以速度-时间(v-t)图像计算平衡浓度例1 在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g) 2Z(g),并达平衡,以Y的浓度改变表示的反应速度与时间t的关系如图所示,则Y的平衡浓度表达式正确的是(式中S是对应区域的面积)()A、2-S aobB、1-S aobC、2-S abdoD、1-S bod解析根据v-t曲线计算反应物的平衡浓度,初看题目似乎无从下手,若静心思考,从定义出发,Y减少的浓度△C Y=vt,随着反应进行,逆反应同时生成部分Y,因此Y的平衡浓度为初始浓度与消耗浓度之差。
瞬时速率与时间的乘积即为微小矩形的面积,累积计算则Y 减少的浓度表示为S aobd,Y增加的浓度表示为S obd,则Y的平衡浓度表示为:1-(S aodb-S obd)=1-S aob,故选B。
2. 以v-t图像描述化学平衡移动的本质例2 已知合成氨的反应为:N2+3H22NH3; △H=-92.4KJ/mol,一定条件下达到化学平衡,现升高温度使平衡发生移动,下列图像中能正确描述正、逆反应速率(v)变化的是()解析此题易误选D,以为逆反应速率升高了正反应速率必然降低,其实升高温度放热、吸热方向的反应速率都增大,但吸热反应增大的幅度大,因此平衡向吸热反应方向移动,合成氨的正反应为放热反应,应选C。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第 1 页 共 3 页
专题五 化学平衡图像
考点1化学平衡图象常见类型
解题策略:
(1)首先要看清楚横轴和纵轴意义(特别是纵轴。
表示转化率和表示反应物的百分含量情况就完全相反)以及曲线本身属等温线还是等压线。
(当有多余曲线及两个以上条件时,要注意“定一议二”)
(2)找出曲线上的特殊点,并理解其含义。
(如“先拐先平数值大”)
(3)根据纵轴随横轴的变化情况,判定曲线正确走势,以淘汰错误的选项。
1、速率—时间图
此类图象定性地揭示了v 正、v 逆随时间(含条件改变对速率的影响)而变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向.
6.对达到平衡状态的可逆反应X+Y Z+W ,在其他条件不变的情况下,增大压强,反应速率变化图象如图1所示,则图象中关于X 、Y 、Z 、W 四种物质的聚集状态为( )
A .Z 、W 均为气体,X 、Y 中有一种是气体
B .Z 、W 中有一种是气体,X 、Y 皆非气体
C .X 、Y 、Z 、W 皆非气体
D .X 、Y 均为气体,Z 、W 中有一种为气体 2、浓度—时间图
此类图象能说明各平衡体系组分(或某一成分)在反应过程中的变化情况.解题时要注意各物质曲线的折点(达平衡时刻),各物质浓度变化的内在联系及比例符合化学方程式中化学计量数关系等情况.
7.图2表示800℃时A 、B 、C 三种气体物质的浓度随时间 的变化情况,t1是到达平衡状态的时间.试回答:
(1)该反应的反应物是______; (2)反应物的转化率是______; (3)该反应的化学方程式为______.
3、含量—时间—温度(压强)图
这类图象反映了反应物或生成物的量在不同温度(压强)下对时间的关系,解题时要注意一定条件下物质含量不再改变时,应是化学反应达到平衡的特征.
8.同压、不同温度下的反应:A (g )+B (g )C (g );△HA 的含量和温度的关系如图3所示,下列结论正确的是 ( )
A .T 1>T 2,△H>0
B .T 1<T 2,△H>0
C .T 1>T 2,△H<0
D .T 1<T 2,△H<0
4、恒压(温)线
该类图象的纵坐标为物质的平衡浓度或反应物的转化率,横坐标为温度或压强. 10.对于反应2A (g )+B (g )2C (g );△H<0,下列图象正确的是 ( )
第 2 页 共 3 页
应时间(t)的关系如图所示。
下列判断正确的是( )
A .T 1<T 2,P 1<P 2
B .T 1<T 2,P 1>P 2
C .T 1>T 2,P 1>P 2
D .T 1>T 2,P 1<P 2
考点2化学平衡综合知识图象
解平衡图象要注意识图方法,总的来说有以下12345点: 一看面(即横坐标和纵坐标); 二看线(即看线的走向、变化的趋势);
三看点(看线是否通过原点,两条线的交点及线的拐点)(重点理解); 四看辅(要不要作辅助线,如等温线、等压线); 五看数 (定量图像中有关数值的多少大小)。
【例1】(08全国Ⅰ卷)已知:4NH 3(g)+5O 2(g)=4NO(g)+6H 2(g). △H=-1025kJ/mol 该反应是一个可逆反应。
若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
( )
巩固专题
1.下图是可逆反应A+2B 2C+3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
A .正反应是放热反应
B .若A 、B 是气体,则D 是液体或固体
C .逆反应是放热反应.
D .A 、B 、C 、D 均为气体
解析:AB 通过观察图可知,降温时平衡向正反应方向移动,故正反应为放热反应,A 选项正确;加压时平衡向正反应方向移动,故B 正确。
2.(
四川理综·8)在密闭容器中进行如下反应:H 2(g) +
时 间
第 3 页 共 3 页
I 2(g)
2HI(g),在温度T 1和T 2时,产物的量与反应时间的关系如下图所示.符合图示的正确判断是
A .T 1>T 2,ΔH >0
B .T 1>T 2,ΔH <0
C .T 1<T 2,ΔH >0
D .T 1<T 2,ΔH <0
3.( 高考全国理综卷I ·13)如图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与
示意图不相符合....
的是 .w.k.s.5.u.c.o.m
反应时间
反应速率
A .反应达平衡时,正反应速率和逆反应速率相等
B .该反应达到平衡态I 后,增大反应物浓度,平衡发生移动,达到平衡态II
C .该反应达到平衡态I 后,减小反应物浓度,平衡发生移动,达到平衡态II
D .同一种反应物在平衡态I 和平衡态II 时浓度不相等 4.( 高考江苏卷·13)一定温度下可逆反应:A(s)+2B(g)
2C(g)+D(g); H <0。
现将1 mol A 和2 mol
B 加入甲容器中,将4 mol
C 和2 mol
D 加入乙容器中,此时控制活塞P ,使乙的容积为甲的2倍,t 1时两容器内均达到平衡状态(如图1所示,隔板K 不能移动)。
下列说法正确的是BD
1
2
速率
1
2
图1 图2 图3
A .保持温度和活塞位置不变,在甲中再加入1 mol A 和2 mol
B ,达到新的平衡后,甲中
C 的浓度是
乙中C 的浓度的2倍
B .保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B 的体积分数均增大
C .保持温度不变,移动活塞P ,使乙的容积和甲相等,达到新的平衡后,乙中C 的体积分数是甲中C
的体积分数的2倍
D .保持温度和乙中的压强不变,t 2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化
情况分别如图2和图3所示(t 1前的反应速率变化已省略)。
