高考化学与硫及其化合物有关的压轴题附答案解析
高考化学硫及其化合物-经典压轴题含答案解析

高考化学硫及其化合物-经典压轴题含答案解析一、高中化学硫及其化合物1.实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
(1)如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,图中可选用的发生装置是 ______ (填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36 L(标准状况)二氧化硫,如果已有40%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠 ______ g (保留一位小数)。
(3)某热电厂上空大气中所含二氧化硫严重超标,现对该区域雨水样品进行探究。
首先用pH 试纸测定雨水样品的pH,操作方法为______,测得样品pH约为3;为进一步探究由SO2所形成酸雨的性质,将一定量的SO2通入蒸馏水中,配成pH为3的溶液,然后将溶液分为A、B两份,将溶液B久置于空气中,与密闭保存的A相比,久置后的溶液B中水的电离程度将 ______(填“增大”、“减小”或“不变”)。
【答案】ae 31.5 取一条试纸放在干燥洁净的表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取雨水样品滴在试纸中央,半分钟后待变色,再与对照标准比色卡读数。
减小【解析】【分析】(1)用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率;(2)由硫守恒可得:Na2SO3~SO2,根据关系式及二氧化硫的物质的量计算出需要亚硫酸钠的质量;结合亚硫酸钠的质量分数,再计算出需要变质后的亚硫酸钠的质量;(3)测定pH,可用玻璃棒蘸取溶液,然后与比色卡对比;将溶液B久置于空气中,亚硫酸被氧化生成硫酸,溶液酸性增强。
【详解】(1)用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,由于反应不需要加热,排除装置d;由于亚硫酸钠是细小颗粒,不可选用装置c;装置b无法可知反应速率,故可选用的发生装置为:ae;(2)若用硫酸和亚硫酸钠反应制取二氧化硫,根据反应方程式:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,根据反应方程式可知:Na2SO3~SO2,n(SO2)=3.36?22.4?/molLL=0.15 mol,则需亚硫酸钠的质量为:m(Na2SO3)= 0.15 mol×126g/mol=18.9 g;如果已有40%亚硫酸钠(质量分数),被氧化成硫酸钠,则含亚硫酸钠的质量分数为60%,至少需称取该亚硫酸钠的质量为18.9? 60%g ==31.5 g ; (3)测定pH ,可用玻璃棒蘸取溶液,滴在pH 试纸上,半分钟后与比色卡对比,操作方法为取一条试纸放在干燥洁净的表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取雨水样品滴在pH 试纸上,半分钟后待变色,再对照标准比色卡读数;将溶液B 久置于空气中,亚硫酸被氧化生成硫酸,导致溶液酸性增强,溶液中c (H +)增大,对水电离的抑制作用增强,则水的电离程度减小。
高考化学大一轮复习 考点 硫及其化合物(含解析考点位及命题意图)
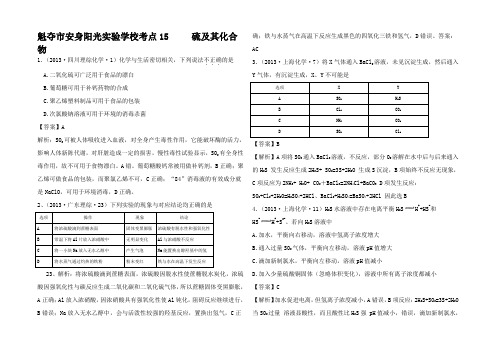
魁夺市安身阳光实验学校考点15 硫及其化合物1.(2013·四川理综化学·1)化学与生活密切相关,下列说法不正确...的是A.二氧化硫可广泛用于食品的漂白B.葡萄糖可用于补钙药物的合成C.聚乙烯塑料制品可用于食品的包装D.次氯酸钠溶液可用于环境的消毒杀菌【答案】A解析:SO2可被人体吸收进入血液,对全身产生毒性作用,它能破坏酶的活力,影响人体新陈代谢,对肝脏造成一定的损害,慢性毒性试验显示,SO2有全身性毒作用,故不可用于食物漂白。
A错。
葡萄糖酸钙常被用做补钙剂,B正确;聚乙烯可做食品的包装,而聚氯乙烯不可,C正确;“84”消毒液的有效成分就是NaClO,可用于环境消毒,D正确。
2、(2013·广东理综·23)下列实验的现象与对应结论均正确的是选项操作现象结论A 将浓硫酸滴到蔗糖表面固体变黑膨胀浓硫酸有脱水性和强氧化性B 常温下将Al片放入浓硝酸中无明显变化Al与浓硝酸不反应C 将一小块Na放入无水乙醇中产生气泡Na能置换出醇羟基中的氢D 将水蒸气通过灼热的铁粉粉末变红铁与水在高温下发生反应23、解析:将浓硫酸滴到蔗糖表面,浓硫酸因脱水性使蔗糖脱水炭化,浓硫酸因强氧化性与碳反应生成二氧化碳和二氧化硫气体,所以蔗糖固体变黑膨胀,A正确;Al放入浓硝酸,因浓硝酸具有强氧化性使Al钝化,阻碍反应继续进行,B错误;Na放入无水乙醇中,会与活泼性较强的羟基反应,置换出氢气,C正确;铁与水蒸气在高温下反应生成黑色的四氧化三铁和氢气,D错误。
答案:AC3.(2013·上海化学·7)将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是选项X YA SO2H2SB Cl2CO2C NH3 CO2D SO2 Cl2【答案】B【解析】A项将SO2通入BaCl2溶液,不反应,部分O2溶解在水中后与后来通入的H2S 发生反应生成2H2S+ SO2=3S+2H2O 生成S沉淀,B项始终不反应无现象,C项反应为2NH3+ H2O+ CO2+BaCl2=2NH4Cl+BaCO3 D项发生反应:SO2+Cl2+2H2O=H2SO4+2HCl、BaCl2+H2SO4=BaSO4+2HCl 因此选B4.(2013·上海化学·11)H2S水溶液中存在电离平衡H2S H++HS-和HS-H++S2-。
高考化学硫及其化合物-经典压轴题含详细答案

高考化学硫及其化合物-经典压轴题含详细答案一、高中化学硫及其化合物1.某小组同学用如图所示装置进行铜与浓硫酸的反应,并探究产物的性质 (夹持装置已略去)。
(1)试管①中反应的化学方程式是______;(2)若试管②中的试剂为品红溶液,实验中观察到的现象是______;若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,则说明生成的气体具有______性。
(3)试管③中的试剂为NaOH溶液,其作用是______,反应的离子方程式是______。
【答案】Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O 品红溶液褪色还原吸收尾气SO2+2OH-=SO32-+H2O【解析】【分析】(1)铜与浓硫酸在加热时反应生成硫酸铜和二氧化硫气体;(2)二氧化硫能使品红溶液褪色;若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,二氧化硫与高锰钾发生氧化还原反应而褪色;(3)二氧化硫是有毒的酸性氧化物,不能直接排放空气中,所以用NaOH溶液吸收尾气。
【详解】(1)铜与浓硫酸在加热条件下发生反应生成硫酸铜和二氧化硫气体和水,反应方程式为:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O;(2)SO2气体具有漂白性,能使品红溶液褪色,所以试管②品红溶液褪色;SO2气体具有强的氧化性,可以被强氧化剂氧化为硫酸,若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,二氧化硫与高锰钾发生氧化还原反应而褪色,体现二氧化硫的还原性;(3) SO2是有毒气体,不能直接排放空气中,由于SO2属于酸性氧化物,所以可用NaOH溶液进行尾气处理,反应的离子方程式为:SO2+2OH-=SO32-+H2O。
【点睛】本题考查性质实验方案的设计。
把握实验装置的作用、元素化合物知识、实验技能为解答的关键,注意元素化合物知识与实验的结合,题目侧重考查学生的分析能力与实验能力。
2.形成酸雨的原理之一可表示如下:请回答下列问题:(1)未污染的雨水的pH一般小于7大于5.6,这是由于溶解了___的缘故;酸雨的pH小于5.6,主要含有硫酸、___和一些有机酸等。
高考化学复习硫及其化合物专项易错题及答案解析

(3)溶液2中含有的溶质有Al2(SO4)3、H2SO4;
(4)操作④是加热Al(OH)3,Al(OH)3不稳定,受热发生分解反应,化学方程式为:2Al(OH)3 2Al2O3+3H2O;
(5)金属Cu与浓硫酸混合加热,发生氧化还原反应,产生CuSO4、SO2、H2O,反应方程式为:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,所以反应产生的气体为SO2。
(1)若A、D的水溶液均呈酸性,且D为强酸。
①A、D分别为A:,D:。(填写化学式,下同)
②写出B→C转化的化学方程式:。
③简述检验B物质的方法。
④写出D的浓溶液和Cu在加热条件的化学方程式。
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使蓝色的湿润石蕊试纸变红。
①工业上合成A的化学方程式:___________。在实验室中则用加热固体混合物的方法制取气体A,其化学方程式为。
高考化学复习硫及其化合物专项易错题及答案解析
一、高中化学硫及其化合物
1.(1)古代锻造刀剑时,将炽热的刀剑快速投入水中“淬火”,反应为:3Fe+4H2O(g) Fe3O4+4H2。该反应பைடு நூலகம்H2O作__________(填“氧化剂”或“还原剂”);
(2)检验某溶液中是否含有SO42-,先加盐酸,再加______(填“BaCl2”或“NaCl;
①用四氯化碳可擦去圆珠笔油②自来水厂用液氯消毒③可用食醋洗掉水垢
(3)当前,环境治理已成为重要的民生工程。
①我国城市发布的“空气质量日报”中,下列物质不列入首要污染物的是_____(填字母代号)。
A.二氧化硫B.二氧化碳C.二氧化氮D.可吸入颗粒物
高考化学与硫及其化合物有关的压轴题及详细答案

高考化学与硫及其化合物有关的压轴题及详细答案一、高中化学硫及其化合物1.硫酸是重要的基础化工原料之一,是化学工业中最重要的产品,号称“工业之母”。
在中学化学教材中有多处涉及其应用。
(1)利用浓硫酸配制稀硫酸已知某浓硫酸的密度为1.84g/ml ,质量分数为98%,则该浓硫酸的物质的量浓度为_______;现用该浓硫酸配制480ml 浓度为1.84mol/L 的稀硫酸,在配制过程中除量取浓硫酸的仪器、烧杯、胶头滴管外,还需用到的玻璃仪器有______________________;(2)硫酸与无机物的反应实验室在用稀硫酸与锌反应制取氢气时,常向其中滴加少量硫酸铜溶液以加快反应速率,请写出发生的离子反应方程式______________________________;不活泼金属铜在与浓硫酸反应中,体现了浓硫酸的___________________性质;非金属碳在加热条件下也能与浓硫酸反应,若要你设计实验检验反应生成的气体产物,则检验出气体产物的正确顺序为______________________;(3)硫酸在有机中的应用利用硫酸的性质可以制取多种有机物,比如烈性炸药TNT 、硝基化合物、酯类物质、不饱和烃等。
请写出制取TNT 的化学方程式________________________________________;请写出用乙醇制取乙烯的化学方程式________________________________________;稀硫酸还可以使蔗糖、淀粉等多种有机物发生水解,请写出蔗糖水解的产物名称_________。
【答案】18.4mol/L 500ml 容量瓶 Zn +Cu 2+=Cu +Zn 2+、Zn +2H +=H 2↑+Zn 2+ 强氧化性和强酸性 H 2O 、SO 2、CO 2 +3HNO 324H SO Δ−−−−→浓+3H 2O C 2H 5OHCH 2=CH 2↑+ H 2O 葡萄糖、果糖【解析】【分析】(1)根据c=1000ρwM 计算出该浓硫酸的浓度;配制该溶液的步骤是:称量、溶解、冷却、转移、洗涤、转移、定容、摇匀,根据配制一定物质的量浓度的溶液的步骤选用仪器;(2)硫酸铜溶液加快氢气生成的速率,原因是形成原电池反应;【详解】(1)该浓硫酸的物质的量浓度为:c=1000×1.84×98%÷98mol/L=18.4mol/L ;实验室没有480mL 的容量瓶,配制时需要选用500mL 容量瓶,实际上配制的是500mL1mol/L 的硫酸溶液,配制该溶液的步骤是:称量、溶解、冷却、转移、洗涤、转移、定容、摇匀,配制过程中需要使用的仪器为:药匙、托盘天平、烧杯、玻璃棒、500mL 容量瓶、胶头滴管,所以还缺少的仪器为: 500mL 容量瓶,故答案为:18.4mol/L ;500mL 容量瓶;(2)锌为活泼金属,加入硫酸铜,发生Zn+CuSO 4=ZnSO 4+Cu ,置换出铜,与锌形成原电池反应,化学反应速率加快,离子方程式是Zn +Cu 2+=Cu +Zn 2+、Zn +2H +=H 2↑;铜与浓硫酸反应生成硫酸铜,二氧化硫和水,硫元素的化合价降低表现硫酸的氧化性,生成盐和水体现硫酸的酸性,故硫酸表现的性质是酸性和氧化性;碳和浓硫酸加热生成二氧化硫,二氧化碳和水,检验气体的顺序是水,二氧化硫,二氧化碳,故答案为:Zn +Cu 2+=Cu +Zn 2+、Zn +2H +=H 2↑;强氧化性和强酸性 ;H 2O 、SO 2、CO 2; (3)制取TNT 需要甲苯,浓硫酸和浓硝酸的混合酸加热,反应的化学方程式是+3HNO 324H SO Δ−−−−→浓+3H 2O ;向乙醇中加入浓硫酸,加热到170度,可以制取乙烯,方程式是C 2H 5OH CH 2=CH 2↑+ H 2O ;蔗糖水解产生葡萄糖和果糖, 故答案为:+3HNO 324H SO Δ−−−−→浓+3H 2O ;C 2H 5OH CH 2=CH 2↑+ H 2O ;葡萄糖、果糖。
2020届高考化学二轮复习考点精炼:硫及其化合物(解析版)

硫及其化合物1.硫代硫酸钠(Na2S2O3)是一种常见的滴定剂和重要化工原料。
实验室制备硫代硫酸钠的流程如图:已知:Na2S2O3易溶于水,受热、遇酸均反应下列说法不正确...的是()A.“溶解”使用的水必须先煮沸一段时间,然后冷却至室温待用B.为了提高硫代硫酸钠的产量,“反应”需要通入过量的SO2C.“结晶”时应小火蒸发浓缩,再冷却结晶D.粗产品可能含有的杂质是Na2CO3、NaHCO3、Na2SO3、Na2SO4和S等其中的一种或几种2.下列关于硫及其化合物的说法中正确的是()A.自然界中不存在游离态的硫B.SO2和SO3的水溶液都是强酸C.二氧化硫能使品红溶液褪色D.浓硫酸可用来干燥NH3等气体3.下列现象或事实可用同一原理解释的是()A.氯水和过氧化钠使红色墨水褪色B.浓硫酸和浓硝酸长期暴露在空气中浓度降低C.亚硫酸钠和石灰水长期暴露在空气中变质D.SO2可使品红和酸性高锰酸钾溶液褪色4.有关下列化学实验的说法正确的是()A.用CCl4可提取水溶液中的Br2B.实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取C.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小D.通入SO2气体,可使石蕊试液褪色,加热后,溶液颜色又恢复5.如图所示是一系列含硫化合物的转化关系(部分反应产物已略去),下列说法正确的是()A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性B.若反应②中生成物n(Na2SO3)∶n(NaHSO3)=1∶1,则反应物n(SO2)∶n(NaOH)=1∶2 C.反应③④⑤均属于氧化还原反应D.工业上可利用反应②和反应④回收SO26.现有如下所示4个装置图,以下说法中正确的是()A.①装置可用于比较NaHCO3和Na2CO3的稳定性B.用酒精萃取溴水中的溴可选择②装置C.如③装置进行实验可看到酸性KMnO4溶液褪色D.④装置可用于实验室制取并收集少量SO27.下列物质中属于酸性氧化物,但不能与水反应的是()A.Na2O B.SiO2C.CO D.SO28.在给定条件下,下列选项所示的物质间转化均能实现的是()A.MgCO3MgCl2(aq)MgB.NaCl(aq) NaHCO3(s)Na2CO3(s)C.SiO2Si SiCl4D.AgNO3 [Ag(NH3)2]OH(aq)Ag9.在NH3、HNO3、H2SO4的工业生产中,具有的共同点是()A.使用吸收塔设备B.使用H2作原料C.使用尾气吸收装置D.使用催化剂10.下列操作能达到实验目的的是()A.A B.B C.C D.D11.(1)写出下列物质的化学式:胆矾_____________________ 铁红_____________________苏打_____________________ 明矾__________________(2)把SO2气体通入品红溶液中,现象为_____,将该溶液加热后,现象为________。
高考化学—硫及其化合物的综合压轴题专题复习附详细答案

高考化学—硫及其化合物的综合压轴题专题复习附详细答案一、高中化学硫及其化合物1.硫和氮及其化合物在生产生活中应用广泛。
请回答:(1)将SO2通入品红溶液中,现象为品红溶液________,加热后溶液颜色________。
(2)已知反应:SO2+Cl2+2H2O ═ 2HCl+H2SO4,该反应中的氧化产物是__________。
(3)木炭与浓硫酸共热的化学反应方程式为:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O,若生成0.5 mol CO2,则转移电子的物质的量是_________mol。
(4)工业上可以通过氮气和氢气在一定条件下合成氨气。
下列关于氨气的性质和用途描述正确的是____________。
A.氨气易液化,液氨可作制冷剂 B.可用排水法收集氨气C.氨气是一种无色无味的气体 D.向氨水中滴加酚酞,溶液变红(5)实验室检验试管里氨气是否收集满的方法是___________________(写出一种即可)。
(6)汽车尾气常含有NO、NO2、CO等,会污染空气。
在汽车尾气排放管处安装一个催化转化器,可使尾气中有害气体CO和NO反应转化为两种无毒气体,该反应的化学方程式为__________________________。
【答案】褪色变红 H2SO4 2 AD 用湿润的红色石蕊试纸靠近试管口,若试纸变蓝,则说明氨气已收集满(或用玻璃棒蘸取浓盐酸靠近试管口,若出现大量白烟,则说明氨气已收集满)。
(或其他合理答案) 2CO+2NO N2+2CO2【解析】【分析】(1)SO2具有漂白性,但漂白是有选择的、暂时性的,加热后无色产物会分解,重新生成品红。
(2)反应SO2+Cl2+2H2O ═ 2HCl+H2SO4中,氧化产物是含有价态升高元素的生成物。
(3)在反应C+2H2SO4(浓)CO2↑+2SO2↑+2H2O中,有如下关系:CO2——4e-,由此可计算出生成0.5 mol CO2,转移电子的物质的量。
压轴题01 实验装置图分析(解析版)-高考化学压轴题专项训练(江苏专用)
压轴题01 实验装置图分析综合近几年江苏高考对于实验的考查形式,2023年江苏高考仍然是必考重点。
实验装置图分析涉及实验操作、实验原理、操作、现象的分析判断,所以要求考生了解题型的知识点及要领,对于常考的模型要求有充分的认知。
从实验原理、实验装置、实验操作、现象等角度对实验进行分析,注重元素及其化合物基础知识的掌握。
1.(2023·江苏南通·统考二模)3FeCl 易水解、易升华,是有机反应中常用的催化剂。
实验室用如图所示装置制备少量3FeCl 。
下列说法正确的是A .实验开始,先点燃酒精灯,再滴加浓盐酸B .实验时若不足量,则可能生成2FeClC .装置丙的作用是收集3FeClD .装置丁中2CaCl 的作用是吸收未反应的2Cl 【答案】C【详解】A .实验开始,先滴加浓盐酸,利用生成的氯气排尽装置内的空气,以免铁粉与氧气发生反应,故A 错误;B .铁与氯气只能生成氯化铁,即使少量氯气也不能生成氯化亚铁,故B 错误;C .装置丙的作用是收集冷凝后的固体氯化铁,故C 正确;D .2CaCl 与氯气不能反应,其目的是防止NaOH 溶液中的水蒸气进入丙中使3FeCl 水解,故D 错误;故选:C 。
2.(2022秋·江苏扬州·高三扬州中学校考阶段练习)实验室采用如图装置制取氨气,正确的是A .AB .BC .CD .D【答案】D 【详解】A .氯化铵受热分解生成HCl 和氨气,HCl 和氨气在试管口遇冷又会化合生成氯化铵,不能用加热氯化铵来制取氨气,A 错误;B .浓硫酸能与氨气反应,不能用浓硫酸来干燥氨气,B 错误;C .氨气密度比空气小,应该用向下排空气法收集氨气,导管应该伸到试管底部,C 错误;D .氨气极易溶于水,尾气吸收应采取防倒吸的措施,D 正确;故答案选D 。
3.(2022秋·江苏泰州·高三泰州中学校考开学考试) 从火山附近的温泉到硫磺香皂,从中国引以为豪的黑火药到今天的重要的化工产品硫酸,这些物质中都含有硫元素。
高考化学压轴题专题复习—硫及其化合物的综合附答案解析

高考化学压轴题专题复习—硫及其化合物的综合附答案解析一、高中化学硫及其化合物1.硫元素具有可变价态,据此完成以下有关含硫化合物性质的试题。
(1)将H2S气体通入FeCl3溶液中,现象是_____________________________;反应的离子方程式是______________________________________。
(2)为了探究-2价硫的化合物与+4价硫的化合物反应的条件,设计了下列实验。
实验操作实验现象实验1将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合无明显现象实验2将H2S通入Na2SO3溶液中未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀实验3将SO2通入Na2S溶液中有浅黄色沉淀产生已知:电离平衡常数:H2S K1 =1.3×10-7;K2 = 7.1×10-15H2SO3 K1 =1.7×10-2;K2 = 5.6×10-8①根据上述实验,可以得出结论:在_________条件下,+4价硫的化合物可以氧化-2价硫的化合物。
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是______(选填编号)。
A. B. C.D.(3)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水。
要证明Na2SO3具有还原性,应选用的试剂有______________,看到的现象是____________________。
要证明Na2SO3具有氧化性,应选用的试剂有___________________,反应的离子方程式是________________________________。
(4)文献记载,常温下H2S可与Ag发生置换反应生成H2。
现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应_____________________。
高考化学与硫及其化合物有关的压轴题附答案

高考化学与硫及其化合物有关的压轴题附答案一、高中化学硫及其化合物1.某研究性学习小组的甲、乙同学分别设计了以下实验来验证元素周期律。
(Ⅰ)甲同学在 a、b、c 三只烧杯里分别加入 50 mL 水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象。
①甲同学设计实验的目的是______②反应最剧烈的烧杯是______(填字母);③写出 b 烧杯里发生反应的离子方程式______(Ⅱ)乙同学设计了下图装置来探究碳、硅元素的非金属性强弱,根据要求完成下列各小题(1)实验装置:(2)实验步骤:连接仪器、______、加药品后,打开 a、然后滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)①铜与浓硫酸反应的化学方程式是______,装置 E 中足量酸性 KMnO4溶液的作用是______。
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是______;③试管 D 中发生反应的离子方程式是______。
【答案】验证锂、钠、钾的金属性强弱; c 2Na+2H2O=2Na++2OH¯+ H2↑检查装置气密性 Cu+2H2SO4(浓)ΔCuSO4+ 2H2O+ SO2↑除去CO2中混有的SO2盛有硅酸钠溶液的试管出现白色沉淀; SO2+ HCO3¯= CO2+ HSO3¯【解析】【分析】乙同学设计实验探究碳、硅元素的非金属性强弱。
先用浓硫酸和铜在加热条件下制备二氧化硫气体,通入D试管与饱和碳酸氢钠反应生成二氧化碳,混合气体通入试管E,除去混有的二氧化硫,剩余的二氧化碳通入试管F与硅酸钠溶液反应,会出现白色沉淀。
该实验需要改良的地方尾气处理装置,以及防干扰装置(防止空气中的二氧化碳进入装置F,干扰实验结构,可以加一个球星干燥管,内盛放碱石灰)。
【详解】(Ⅰ)①由某研究性学习小组设计实验验证元素周期律可得,甲同学设计的实验目的是:验证锂、钠、钾的金属性强弱;②金属性:K>Na>Li,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是c;’③b 烧杯里发生反应的离子方程式:2Na+2H2O=2Na++2OH¯+ H2↑;(Ⅱ)(2)实验步骤:有气体参与反应,先连接仪器、检查装置气密性、加药品(先加固体,后加液体)后,打开 a、然后滴入浓硫酸,加热。
备战高考化学压轴题专题硫及其化合物的经典综合题含答案解析

备战高考化学压轴题专题硫及其化合物的经典综合题含答案解析一、高中化学硫及其化合物1.在空气中加热S 粉和Fe 粉的混合物,可观察到下列现象:(1)有淡蓝色火焰,且生成刺激性气味的气体。
(2)混合粉末变红,放出热量,最后变成黑色固体。
(3)不时有火星从混合物中射出。
请分别写出以上三种情况发生反应的化学方程式:__________、__________、__________。
【答案】S +O 2SO 2 Fe +S FeS 3Fe +2O 2Fe 3O 4 【解析】【分析】【详解】(1)S 在空气中燃烧产生淡蓝色火焰,生成SO 2,反应方程式为:S+O 2∆SO 2;(2)混合粉末变红,放出热量,最后变为黑色固体是因为Fe 与S 反应生成FeS ,反应方程式为:Fe+S ∆FeS ;(3)有火星射出是因为Fe 与O 2反应生成Fe 3O 4,反应方程式为:3Fe+2O 2∆Fe 3O 4。
2.我国云南东川铜矿富含辉铜矿(主要成分Cu 2S ),因含铜成分高而成为重要的炼铜原料。
资料表明,当蓝矾溶液渗入地下遇硫铁矿(主要成分:二硫化亚铁FeS 2)时,可生成辉铜矿Cu 2S ,其化学方程式为:14CuSO 4+5FeS 2+12H 2O=7Cu 2S+5FeSO 4+12H 2SO 4。
硫铁矿也是一种重要化工原料,其主要成分可在沸腾炉中鼓入空气高温煅烧生成Fe 2O 3和一种对环境有污染的有毒气体,回答下列问题:(1)在化合物FeS 2和Cu 2S 中,硫元素的化合价分别为__、__。
(2)在上述生成辉铜矿的反应中,氧化剂与还原剂的物质的量之比为__。
由题中信息可推知Cu 2S 的溶解情况是:__溶于水(填“不”或“能”,下同),__溶于稀硫酸。
(3)写出硫铁矿的主要成分鼓入空气高温煅烧的化学方程式:__,若反应中有2.2mol 电子发生转移时,可生成标准状况下的有毒气体的体积为__L 。
【答案】-1 -2 35:3 不 不 4FeS 2+11O 22Fe 2O 3+8SO 2 8.96【解析】【分析】 422242414CuSO +5FeS +12H O=7Cu S+5FeSO +12H SO 该反应中铜和7个负一价硫的化合价降低,3个负一价硫的化合价升高。
2024年高考化学总复习专题09氧硫及其化合物和环境保护习思用练习含解析

氧、硫及其化合物和环境爱护考点1 硫单质1. [2024黑龙江齐齐哈尔第八中学高三第一次测试]下列化合物能用相应元素的单质干脆化合生成的是( )①CuS ②FeS ③Al2S3④Fe2S3⑤Cu2S ⑥FeCl2⑦H2S ⑧FeCl3A.②③⑤⑦⑧B.①④⑥⑦C.①②③⑦⑧D.②③⑤⑥⑦⑧2. 下列关于硫及其化合物的说法中正确的是( )A.自然界中存在游离态的硫B.二氧化硫的排放会导致光化学烟雾的产生C.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性D.可用pH试纸测浓硫酸的pH3. [2024成都毕业班摸底考试]如图是硫元素在自然界中的循环示意图,下列有关说法不正确的是( )A.硫元素在自然界中既有游离态又有化合态B.过程⑤可在土壤的缺氧区实现C.硫元素的循环过程中只有硫的还原D.若生物体有机硫的成键方式为,则过程④中S未发生氧化还原反应4. [2024郑州高三1月一模,10]在给定条件下,下列物质间转化均能实现的是( )A.S SO3 H2SO4B.粗硅 SiCl4 SiC.NH3 NO HNO3D.Cu CuS H2S考点2 硫的氢化物和重要的氧化物5. [2024北京理综,10,6分]依据SO2通入不同溶液中的试验现象,所得结论不正确的是( )溶液现象结论A 含HCl、BaCl2的FeCl3溶液产生白色沉淀SO2有还原性B H2S溶液产生黄色沉淀SO2有氧化性C 酸性KMnO4溶液紫色溶液褪色SO2有漂白性D Na2SiO3溶液产生胶状沉淀酸性:H2SO3> H2SiO36. [高考组合改编题]下列说法正确的是( )A.[2024四川理综,1C改编]SO2作纸浆的漂白剂没有发生化学改变B.[2015重庆理综,2D]SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4C.[2015安徽理综,9C]H2、SO2、CO2三种气体都可用浓H2SO4干燥D.[2014重庆理综,2A]用KOH溶液鉴别SO3(g)和SO27.下列有关物质用途的说法不符合事实的是( )A.SO2可用于杀菌、消毒B.氧化铝可用于制耐火坩埚C.浓硫酸可用于干燥SO2D.SiO2可用于制太阳能电池8.如图所示是探讨二氧化硫性质的微型试验装置。
2021届高考化学复习:专题三 硫及其化合物(有答案和详细解析)

专题三硫及其化合物(有答案和详细解析)一、选择题1.常温下单质硫主要以S8形式存在。
加热时,S8会转化为S6、S4、S2等。
当温度达到750 ℃时,硫蒸气主要以S2形式存在(占92%)。
下列说法中正确的是( )A.S8转化为S6、S4、S2属于物理变化B.不论哪种硫分子,完全燃烧时都生成二氧化硫C.S2、S4、S6、S8都是硫元素形成的单质,为同种物质D.把硫单质在空气中加热到750 ℃即得S2答案 B解析物理变化是没有新物质生成的变化,S8、S6、S4、S2是不同的物质微粒,S8转化为S6、S4、S2属于化学变化,A错误;不论哪种硫分子,由于组成元素都是只有硫元素,所以燃烧产物都是二氧化硫,B正确;S2、S4、S6、S8是硫元素形成的不同单质,由于每一个分子中含有的S原子个数不同,所以它们为同素异形体,不是同种物质,C错误;硫单质在空气中加热时,硫单质会和氧气之间发生反应,不会得到纯净的硫单质,D错误。
2.下列制取SO2、验证其性质的装置(尾气处理装置已省略)和原理不能达到实验目的的是( )答案 B解析浓硫酸具有强氧化性,与铜在加热条件下反应生成二氧化硫气体,可用于制备少量二氧化硫,故A 正确;二氧化硫具有还原性,与高锰酸钾发生氧化还原反应,故B错误;溶液的颜色变浅,说明铁离子被还原,可说明二氧化硫具有还原性,被铁离子氧化,故C正确;二氧化硫中S元素的化合价为+4价,处于中间价态,具有氧化性,二氧化硫和硫化氢发生氧化还原反应可生成硫,故D正确。
3.有关硫及其化合物说法正确的是( )A.有浓硫酸参与的反应都是氧化还原反应B.硫在足量空气中燃烧生成大量SO3C .SO 2能使酸性高锰酸钾溶液褪色,体现了漂白性D .二氧化硫可用于抑制酒类中细菌生长,可在葡萄酒中微量添加 答案 D解析 氢氧化钠与浓硫酸的反应是酸碱中和反应,无元素化合价发生变化,属于非氧化还原反应,所以有浓硫酸参与的反应不一定是氧化还原反应,故A 错误;硫与氧气反应只能生成二氧化硫,不能生成三氧化硫,故B 错误;SO 2使酸性高锰酸钾溶液褪色,该反应是氧化还原反应,体现的是SO 2的还原性而不是漂白性,故C 错误;二氧化硫可用于抑制酒类中细菌生长,少量的二氧化硫对人体健康无害,故D 正确。
备战高考化学压轴题专题复习——硫及其化合物的综合附答案解析

备战高考化学压轴题专题复习——硫及其化合物的综合附答案解析一、高中化学硫及其化合物1.在50 mL 4 mol·L-1的氢氧化钠溶液中,通入一定量的硫化氢,反应完毕,在常温减压条件下,用氮气把溶液吹干,得到白色固体7.92 g,通过计算确定白色固体的组成及各组分的质量。
_________________【答案】白色固体有两种组合。
一种可能是由Na2S(3.12g)和NaOH(4.80g)组成的混合物;另一种可能是由Na2S(7.52 g)和NaHS(0.40 g)组成的混合物。
【解析】【分析】NaOH的物质的量为n(NaOH)=c·V=4mol/L× 0.05L =0.2mol,0.2mol的NaOH跟H2S反应,若全部生成Na2S时,白色固体的质量m(Na2S)=78g/mol×0.2mol2=7.8g,0.2mol的NaOH跟H2S反应,若全部生成NaHS时,白色固体(NaHS)的质量为m(NaHS)=56g/mol×0.2mol=11.2g,因为7.8g<7.92g<11.2g,所以得到的白色固体有两种可能的组合:一种是Na2S和NaOH的混合物;另一种是Na2S和NaHS的混合物,根据题意列方程式进行计算即可。
【详解】氢氧化钠的物质的量为n(NaOH)=c·V=4mol/L× 0.05L =0.2mol,0.2mol的NaOH跟H2S反应,若全部生成Na2S时,m(Na2S)=78g/mol×0.2mol2=7.8g;0.2 mol的NaOH跟H2S反应,若全部生成NaHS时,m(NaHS)=56g/mol×0.2mol=11.2g,因为7.8 g<7.92 g<11.2 g,所以得到的白色固体有两种可能的组合:①Na2S和NaOH的混合物;②Na2S和NaHS的混合物。
①设Na2S为xmol,则有(0.2-2x) mol NaOH,78 g/mol×xmol+40g/mol(0.2-2x)=7.92g,解得x=0.04mol;Na2S的质量m(Na2S)=0.04 mol×78 g/mol=3.12g,NaOH的质量m(NaOH)=7.92 g-3.12g=4.80 g;②设Na2S为ymol,则有(0.2-2y)mol NaHS。
2015届高考化学总复习 第三章 第二节硫及其重要化合物试题(含解析)

一、单项选择题 1.下列溶液中,能除去CO 2中SO 2杂质气体的是( ) ①石灰水 ②稀硝酸 ③KMnO 4溶液 ④溴水 ⑤酸化的Ba(NO 3)2溶液 ⑥品红溶液 A .①⑤ B .②③④⑤⑥ C .③④ D .①③解析:SO 2和CO 2都是酸性气体,都与澄清的石灰水反应,①不能;②③④⑤均与SO 2反应,均能除去SO 2,但②⑤中又生成新的气体杂质NO 气体,所以只有③④可以;品红溶液只能鉴别SO 2气体,不能用来除去SO 2气体,⑥不能。
答案:C2.下列现象或事实可用同一原理解释的是( ) A .浓硫酸和浓盐酸长期暴露在空气中浓度降低 B .氯水和活性炭使红墨水褪色C .漂白粉和水玻璃长期暴露在空气中变质D .乙炔和乙烯使溴的四氯化碳溶液褪色解析:浓硫酸易吸水而浓盐酸易挥发,故原理不同,A 错误;氯水中HClO 表现强氧化性,而活性炭是表现了吸附作用,B 错误;漂白粉变质是先与空气中CO 2反应生成HClO ,HClO 又分解才失效,而水玻璃(Na 2SiO 3)与空气中CO 2反应后即失效,原理不同,C 错误;都是加成反应,原理相同,D 正确。
答案:D3.单质X 与浓H 2SO 4共热,反应中X 与H 2SO 4的物质的量之比为12,则X 元素在生成物中的化合价可能为( )①+1 ②+2 ③+3 ④+4A .②④B .③④C .①②D .①③解析:若X 为金属,发生反应可表示为:X +2H 2SO 4=====△XSO 4+SO 2↑+2H 2O ,则X为+2价;若X 为非金属,发生反应可表示为:X +2H 2SO 4=====△XO 2+2SO 2↑+2H 2O ,则X 为+4价。
答案:A3题变式3-1.高温下FeSO 4发生如下反应:2FeSO 4=====高温Fe 2O 3+SO 2↑+SO 3↑,若将生成的气体通入BaCl 2溶液中,得到的沉淀物是( )A .BaSO 3和BaSO 4B .BaSC .BaSO 3D .BaSO 4解析:SO 3通入溶液中发生反应:SO 3+H 2O===H 2SO 4,SO 2-4与Ba 2+结合生成BaSO 4沉淀,由于H 2SO 3是弱酸不与强酸盐BaCl 2反应,故没有BaSO 3沉淀,本题正确选项为D 。
高考化学硫及其化合物(大题培优 易错 难题)及答案

高考化学硫及其化合物(大题培优易错难题)及答案一、高中化学硫及其化合物1.某研究性学习小组的甲、乙同学分别设计了以下实验来验证元素周期律。
(Ⅰ)甲同学在 a、b、c 三只烧杯里分别加入 50 mL 水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象。
①甲同学设计实验的目的是______②反应最剧烈的烧杯是______(填字母);③写出 b 烧杯里发生反应的离子方程式______(Ⅱ)乙同学设计了下图装置来探究碳、硅元素的非金属性强弱,根据要求完成下列各小题(1)实验装置:(2)实验步骤:连接仪器、______、加药品后,打开 a、然后滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)①铜与浓硫酸反应的化学方程式是______,装置 E 中足量酸性 KMnO4溶液的作用是______。
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是______;③试管 D 中发生反应的离子方程式是______。
【答案】验证锂、钠、钾的金属性强弱; c 2Na+2H2O=2Na++2OH¯+ H2↑检查装置气密性 Cu+2H2SO4(浓)ΔCuSO4+ 2H2O+ SO2↑除去CO2中混有的SO2盛有硅酸钠溶液的试管出现白色沉淀; SO2+ HCO3¯= CO2+ HSO3¯【解析】【分析】乙同学设计实验探究碳、硅元素的非金属性强弱。
先用浓硫酸和铜在加热条件下制备二氧化硫气体,通入D试管与饱和碳酸氢钠反应生成二氧化碳,混合气体通入试管E,除去混有的二氧化硫,剩余的二氧化碳通入试管F与硅酸钠溶液反应,会出现白色沉淀。
该实验需要改良的地方尾气处理装置,以及防干扰装置(防止空气中的二氧化碳进入装置F,干扰实验结构,可以加一个球星干燥管,内盛放碱石灰)。
【详解】(Ⅰ)①由某研究性学习小组设计实验验证元素周期律可得,甲同学设计的实验目的是:验证锂、钠、钾的金属性强弱;②金属性:K>Na>Li,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是c;’③b 烧杯里发生反应的离子方程式:2Na+2H2O=2Na++2OH¯+ H2↑;(Ⅱ)(2)实验步骤:有气体参与反应,先连接仪器、检查装置气密性、加药品(先加固体,后加液体)后,打开 a、然后滴入浓硫酸,加热。
高考化学压轴题专题硫及其化合物的经典综合题含详细答案

高考化学压轴题专题硫及其化合物的经典综合题含详细答案一、高中化学硫及其化合物1.物质的类别和核心元素的化合价是研究物质性质的两个基本视角。
(1)图中Y物质的化学式为______。
(2)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体.则治理烟道气反应的化学方程式为____________________________。
(3)实验室中X气体由不溶性的硫化亚铁(FeS)固体和稀硫酸混合反应制得,该反应的离子方程式为:_____________________________________________。
(4)Na2S2O3(硫代硫酸钠)是一种用途广泛的钠盐。
①下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是___。
a.Na2S+Sb.Z+Sc.Na2SO3+Yd.NaHS+NaHSO3②Na2S2O3具有较强还原性,能作为织锦物漂白后的脱氯剂,脱氯后S2O32-转变为SO42-。
现需处理含标准状况下Cl2 2.24L的织锦物,理论上需要0.00100mol/L Na2S2O3溶液的体积为_______L。
【答案】SO3 2CO+SO22CO2+S FeS+2H+=Fe2++H2S↑ bd 25【解析】【分析】依据元素化合价和物质分类分析,X为气态氢化物为H2S,Y为硫元素的+6价氧化物为SO3,Z为+4价的盐可以为Na2SO3。
(1)Y是S元素化合价为+6价;(2)根据反应物、生成物,结合反应中电子转移数目相等,可得反应方程式;(3)FeS与稀硫酸发生复分解反应产生H2S和FeSO4,根据离子方程式中物质拆分原则书写反应的离子方程式;(4)①Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2;②根据元素化合价升降总数相等,计算反应消耗的Na2S2O3的物质的量,再根据n=cV计算其物质的量。
【详解】根据上述推断可知X是H2S,Y是SO3,Z是Na2SO3。
高考化学硫及其化合物(大题培优)及答案解析

高考化学硫及其化合物(大题培优)及答案解析一、高中化学硫及其化合物1.我国农业因遭受酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH所得数据如下:测试时间/h01234雨水的pH 4.75 4.62 4.56 4.55 4.54分析数据,回答以下问题:①雨水样品呈酸性的原因是________________________________(用化学方程式表示)。
②如果将刚取样的上述雨水和自来水(含有氯气)混合,pH将________(填“变大”“变小”或“不变”)。
(2)测定雨水样品时,每隔一定时间测定一次pH,发现pH逐渐变小,其原因可能是_______(用化学方程式表示)。
(3)举一例说明这种雨水将给环境中的生物或非生物造成的影响________________。
【答案】SO 2+H2O H2SO3变小 2H2SO3+O2==2H2SO4酸雨可腐蚀金属、建筑物,破坏植物,污染湖泊导致大量鱼类及水生生物死亡(任选1例,其它合理答案均可)【解析】【分析】正常雨水中,CO2+H2O H2CO3,由于碳酸显酸性,所以正常雨水显酸性,且pH大约为5.6。
当雨水中溶入一定量SO2后,SO2与水反应生成亚硫酸,从而使雨水的酸性增强,pH 减小。
当pH<5.6,雨水这就成为酸雨。
在酸雨中,H2SO3易被空气中的氧气氧化为硫酸,导致酸性增强,pH减小。
【详解】(1)①雨水样品呈酸性,主要是SO2溶于水并与水反应,原因是SO2+H2O H2SO3。
答案为:SO2+H2O H2SO3;②如果将刚取样的上述雨水和自来水(含有氯气)混合,则会发生反应H2SO3+Cl2+H2O==H2SO4+2HCl,pH将变小。
答案为:变小;(2)测定雨水样品时,每隔一定时间测定一次pH,发现pH逐渐变小,主要是H2SO3被空气中O2氧化所致,其原因可能是2H2SO3+O2==2H2SO4。
高考化学与硫及其化合物有关的压轴题含答案解析

高考化学与硫及其化合物有关的压轴题含答案解析一、高中化学硫及其化合物1.某研究性学习小组的甲、乙同学分别设计了以下实验来验证元素周期律。
(Ⅰ)甲同学在 a、b、c 三只烧杯里分别加入 50 mL 水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象。
①甲同学设计实验的目的是______②反应最剧烈的烧杯是______(填字母);③写出 b 烧杯里发生反应的离子方程式______(Ⅱ)乙同学设计了下图装置来探究碳、硅元素的非金属性强弱,根据要求完成下列各小题(1)实验装置:(2)实验步骤:连接仪器、______、加药品后,打开 a、然后滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)①铜与浓硫酸反应的化学方程式是______,装置 E 中足量酸性 KMnO4溶液的作用是______。
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是______;③试管 D 中发生反应的离子方程式是______。
【答案】验证锂、钠、钾的金属性强弱; c 2Na+2H2O=2Na++2OH¯+ H2↑检查装置气密性 Cu+2H2SO4(浓)ΔCuSO4+ 2H2O+ SO2↑除去CO2中混有的SO2盛有硅酸钠溶液的试管出现白色沉淀; SO2+ HCO3¯= CO2+ HSO3¯【解析】【分析】乙同学设计实验探究碳、硅元素的非金属性强弱。
先用浓硫酸和铜在加热条件下制备二氧化硫气体,通入D试管与饱和碳酸氢钠反应生成二氧化碳,混合气体通入试管E,除去混有的二氧化硫,剩余的二氧化碳通入试管F与硅酸钠溶液反应,会出现白色沉淀。
该实验需要改良的地方尾气处理装置,以及防干扰装置(防止空气中的二氧化碳进入装置F,干扰实验结构,可以加一个球星干燥管,内盛放碱石灰)。
【详解】(Ⅰ)①由某研究性学习小组设计实验验证元素周期律可得,甲同学设计的实验目的是:验证锂、钠、钾的金属性强弱;②金属性:K>Na>Li,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是c;’③b 烧杯里发生反应的离子方程式:2Na+2H2O=2Na++2OH¯+ H2↑;(Ⅱ)(2)实验步骤:有气体参与反应,先连接仪器、检查装置气密性、加药品(先加固体,后加液体)后,打开 a、然后滴入浓硫酸,加热。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学与硫及其化合物有关的压轴题附答案解析一、高中化学硫及其化合物1.实验室用如图所示装置模拟石灰石燃煤烟气脱硫实验:(1)实验中为提高石灰石浆液脱硫效率可采取的一种措施是____,写出通入SO2和空气发生反应生成石膏(CaSO4·2H2O)的化学方程式____。
(2)将脱硫后的气体通入KMnO4溶液,可粗略判断烟气脱硫效率的现象是____。
(3)研究发现石灰石浆液的脱硫效率受pH和温度的影响。
烟气流速一定时,脱硫效率与石灰石浆液pH的关系如图所示,在pH为5.7时脱硫效果最佳,石灰石浆液5.7<pH<6.0时,烟气脱硫效果降低的可能原因是____,烟气通入石灰石浆液时的温度不宜过高,是因为____。
(4)石灰石烟气脱硫得到的物质中的主要成分是CaSO4和CaSO3,实验人员欲测定石灰石浆液脱硫后的物质中CaSO3的含量,以决定燃煤烟气脱硫时通入空气的量。
请补充完整测定CaSO3含量的实验方案:取一定量石灰石烟气脱硫后的物质,____。
[浆液中CaSO3能充分与硫酸反应。
实验中须使用的药品:75%的硫酸、标准浓度的(NH4)2Fe(SO4)2溶液,标准浓度的酸性KMnO4溶液]【答案】不断搅拌、制成浆液2CaCO3 + 2SO2 + O2 +4H2O=2 CaSO4·2H2O + 2CO2高锰酸钾溶液颜色褪去的快慢石灰石的溶解度减小,减慢了与SO2的反应温度升高SO2的溶解度小加入足量的75%的硫酸,加热,将生成的SO2气体通入一定体积过量的标准浓度的酸性KMnO4溶液,记录加入KMnO4溶液的体积,充分反应后,用标准浓度的(NH4)2Fe(SO4)2溶液滴定(过量酸性KMnO4溶液),记录达到滴定终点时消耗(NH4)2Fe(SO4)2溶液的体积,计算得出结果【解析】【分析】(1)根据加快反应速率的条件分析;利用电子守恒、原子守恒写出化学方程式;(2)用高锰酸钾溶液检测SO2的含量;(3)根据影响化学反应速率的因素分析;(4)利用氧化还原滴定的方法测定CaSO3含量。
【详解】(1)实验中为提高石灰石浆液脱硫效率采取的措施是不断搅拌、制成浆液;根据电子守恒和原子守恒,写出通入SO2和空气发生反应生成石膏(CaSO4·2H2O)的化学方程式2CaCO3 +2SO2 + O2 +4H2O=2 CaSO4·2H2O + 2CO2。
(2)脱硫后的气体含有少量SO2气体,通入KMnO4溶液能使高锰酸钾溶液颜色,因此根据颜色褪去的快慢,可粗略判断烟气脱硫效率,本题答案为:高锰酸钾溶液颜色褪去的快慢。
(3)由脱硫效率与石灰石浆液pH的关系图知,在为5.7时脱硫效果最佳,pH增大石灰石的溶解度减小,减慢了与SO2的反应;温度升高SO2的溶解度小,因此,本题正确答案为:石灰石的溶解度减小,减慢了与SO2的反应;温度升高SO2的溶解度小。
(4)欲测定CaSO3的含量,根据所给实验药品,先向样品中加入足量的75%的硫酸,加热,将生成的SO2气体通入一定体积过量的标准浓度的酸性KMnO4溶液,记录加入KMnO4溶液的体积,充分反应后,用标准浓度的(NH4)2Fe(SO4)2溶液滴定(过量酸性KMnO4溶液),记录达到滴定终点时消耗(NH4)2Fe(SO4)2溶液的体积,计算得出结果。
【点睛】本题考查影响化学反应速率的因素、反应条件的选择、定量测定实验的设计,难点是(4)小题中,实验步骤的设计,要注意实验原理的分析,根据实验原理设计实验步骤。
2.物质的类别和核心元素的化合价是研究物质性质的两个重要维度。
下图为硫及其部分化合物的“价类二维图”,根据图示回答下列问题:(1)类比CO2的性质,学习SO2的性质,写出下列反应的离子方程式。
①少量的SO2通入澄清石灰水中:__________________。
②SO2通入Na2SO3溶液中: ________________________。
(2)Y的分子式:___________________。
(3)Z的稀溶液与铁反应的离子方程式为______________________。
(4)检验CO2是否混有SO2,可以使混合气体通过盛有品红溶液的洗气瓶,这是利用了SO2的_____________性,也可以使混合气体通过盛有酸性高锰酸钾稀溶液的洗气瓶,这是利用了SO2的_____________性。
(5)大苏打(Na2S2O3)在照相、电影、纺织、化纤、造纸、皮革、农药等方面均有重要用途。
现欲在实验室制备大苏打,从氧化还原角度分析,合理的是__________(填字母选项)A.Na2S+S B.Na2SO3+S C.Na2SO3+ Na2SO4 D.SO2+Na2SO4(6)将X与SO2的水溶液混合后产生淡黄色沉淀,该反应的氧化产物与还原产物的质量之比为__________________【答案】Ca2++2OH-+SO2=CaCO3↓+H2O SO2+ SO32-+ H2O = 2HSO3- H2SO3 Fe+2H+=Fe2++2H2↑漂白还原 B 2:1【解析】【分析】根据二氧化硫的性质书写相关离子方程式;根据元素化合价及物质的种类分析判断物质的化学式;根据二氧化硫的漂白性和还原性分析解答;根据氧化还原反应中元素化合价升降规律分析解答。
【详解】(1)①SO2属于酸性氧化物,少量的SO2通入澄清石灰水中反应生成亚硫酸钙沉淀和水,离子方程式为:Ca2++2OH-+SO2=CaCO3↓+H2O;②SO2与Na2SO3反应生成亚硫酸氢钠,离子方程式为:SO2+ SO32-+ H2O = 2HSO3-;(2)如图所示Y中S元素化合价为+4,则对应的酸为亚硫酸,分子式为:H2SO3;(3)如图所示Z中S元素化合价为+6,则对应的酸为硫酸,硫酸与铁反应生成硫酸亚铁和氢气,离子方程式为Fe+2H+= Fe2++2H2↑;(4)二氧化硫具有漂白性,而二氧化碳没有,二氧化硫中S为+4价,能被高锰酸钾氧化,具有还原性,故答案为:漂白;还原;(5)大苏打(Na2S2O3)中S元素化合价为+2价,A.Na2S中S为-2价,S中化合价为0,不能都升高为+2价,故A不合理;B.Na2SO3中S为+4价,S中化合价为0,可以发生歧化反应得到+2的S,故B合理;C.Na2SO3中S为+4价,Na2SO4中S为+6价,不能都降低为+2价,故C不合理; D.SO2中S为+4价,Na2SO4中S为+6价,不能都降低为+2价,故D不合理;故答案为:B;(6)将X与SO2的水溶液混合后产生淡黄色沉淀,则X为H2S,淡黄色沉淀为S,反应为2H2S+SO2=3S↓+2H2O,生成的3molS中,2mol由H2S氧化得到,1mol由SO2还原得到,所以氧化产物与还原产物的物质的量之比为:2:1,则质量之比为:2:1,故答案为:2:1。
3.(1)古代锻造刀剑时,将炽热的刀剑快速投入水中“淬火”,反应为:3Fe+4H2O(g)ΔFe3O4+4H2。
该反应中H2O作__________(填“氧化剂”或“还原剂”);(2)检验某溶液中是否含有SO42-,先加盐酸,再加______(填“BaCl2”或“NaCl;(3)海水提镁的重要步骤之一是用沉淀剂将海水中的Mg2+沉淀。
该沉淀剂是__________(填“生石灰”或“盐酸”)。
(4)过氧化钠可用于呼吸面具中作为氧气的来源。
完成下列化学方程式:2Na2O2 + 2______ = 2Na2 CO3 +O2 ↑;(5)某同学炒菜时发现,汤汁溅到液化气的火焰上时,火焰呈黄色。
据此他判断汤汁中含有________(填“钠”或“钾”)元素;【答案】氧化剂 BaCl2生石灰 CO2钠【解析】【详解】(1)在3Fe+4H2O(g)ΔFe3O4+4H2中氢元素的化合价从+1价降为0价,则H2O作氧化剂;(2)检验某溶液中是否含有SO42-,先加稀盐酸,可以排除银离子与碳酸根离子等离子的干扰,再加入BaCl2溶液,产生的沉淀是硫酸钡;(3)海水中的Mg2+沉淀是生成Mg(OH)2,沉淀剂是利用生石灰与水反应生成氢氧化钙,从而将Mg2+沉淀;(4)过氧化钠可用于呼吸面具中作为氧气的来源,是利用Na2O2与CO2或水蒸气反应生成氧气,则2Na2O2 + 2CO2= 2Na2 CO3 +O2 ↑;(5)钠元素的焰色反应呈黄色,即可判断汤汁中含有钠元素。
4.A、B、D、E、G 是原子序数依次增大的五种短周期元素,A与E同主族,A、B和E的原子最外层电子数之和为19,B与G 的单质都能与 H2反应生成“HX”(X代表B或G)型氢化物,D 为同周期主族元素中原子半径最大的元素。
(1)B 在元素周期表中的位置是______。
(2)D 的两种常见氧化物中均含有____________(填“离子键”或“共价键”)。
(3)E的最高价氧化物对应水化物的浓溶液和木炭共热,反应的化学方程式为____________。
(4)D 的最高价氧化物对应水化物的溶液与G的单质反应,反应的离子方程式为___________。
(5)用原子结构解释“B、G 单质都能与H2反应生成HX型氢化物”的原因:________。
【答案】第2周期第VIIA族离子键 2H2SO4(浓)+C CO2↑+2SO2↑+2H2O Cl2+2OH﹣═ClO﹣+Cl﹣+H2O 氟和氯同在VIIA族,其原子最外层电子数均为7,均可与氢原子共用一对电子形成共价键【解析】【分析】A、B、D、E、G 是原子序数依次增大的五种短周期元素,其中B与G同主族,B 与G 的单质都能与H2反应生成“HX”(X代表B或G)型氢化物,则B为F元素,G为Cl元素.D为同周期主族元素中原子半径最大的元素,原子序数大于F而小于Cl,则D为Na元素.A与E 同主族,A、B和E的原子最外层电子数之和为19,可知A与E的最外层电子数都为6,则A为O元素,E为S元素,结合对应单质、化合物的性质以及元素周期律知识的解答。
【详解】A、B、D、E、G 是原子序数依次增大的五种短周期元素,其中B与G同主族,B 与G 的单质都能与H2反应生成“HX”(X代表B或G)型氢化物,则B为F元素,G为Cl元素.D为同周期主族元素中原子半径最大的元素,原子序数大于F而小于Cl,则D为Na元素.A与E 同主族,A、B和E的原子最外层电子数之和为19,可知A与E的最外层电子数都为6,则A为O元素,E为S元素;(1)B为F元素,位于周期表第2周期第VIIA族;(2)D为Na元素,其两种常见氧化物为氧化钠、过氧化钠,二者均含有离子键;(3)E的最高价氧化物对应水化物的浓溶液为浓硫酸,具有强氧化性,和木炭共热反应化学方程式为2H2SO4(浓)+C CO2↑+2SO2↑+2H2O;(4)氯气和氢氧化钠反应生成氯化钠和次氯酸钠,反应的离子方程式为Cl2+2OH-═ClO-+Cl-+H 2O ;(5)氟和氯同在VIIA 族,其原子最外层电子数均为7,均可与氢原子共用一对电子形成共价键,单质都能与H 2 反应生成HX 型氢化物。
