15-1 醋酸地塞米松
地塞米松的化学制备

地塞米松的化学制备地塞米松(dexamethasone),异名:德沙美松;氟甲强的松龙;氟甲去氢氢化可的松;氟美松;甲氟烯索,地塞米松,Acidocont, Deronil, Dexacortal, dexametona, Flumeprednisolon等。
又叫德沙美松、氟甲强的松龙是抗炎、抗过敏药物。
主要作为危重疾病的急救用药和各类炎症的治疗。
肾上腺皮质激素类药。
具有抗炎、抗过敏、抗风湿、免疫抑制作用,主要用于治疗严重细菌感染和严重过敏性疾病、各种血小板减少性紫癜、粒细胞减少症、严重皮肤病、器官移植的免疫排斥反应、肿瘤治疗及对糖皮质激素敏感的眼部炎症等。
1958年,Arth与Oliveto等分别合成了地塞米松,1960年Merck & Co.生产地塞米松磷酸钠,至今,上市的地塞米松衍生物已达12种以上。
地塞米松的化学结构为泼尼松龙的B环9α位引入氟原子,D环16α位引入甲基;9α氟及16α甲基均使其抗炎活性显著增强,而16α甲基则显著地降低了地塞米松的水钠潴留副作用。
地塞米松与泼尼松龙的临床生物等效剂量比为0.75:5,生物半衰期为36-54小时,列为长效糖皮质激素。
地塞米松与其他糖皮质激素一样,具有抗炎、抗内毒素、抑制免疫、抗休克及增强应激反应等药理作用,故广泛应用于各科治疗多种疾病,如自身免疫性疾病,过敏,炎症,哮喘及皮肤科、眼科疾病。
地塞米松磷酸钠注射剂更是抢救垂危病人不可缺少的急救药品,近十几年来,临床医师应用地塞米松磷酸钠治疗和预防各类中西药引起的药物过敏及治疗病毒性感冒引起的发烧等症,使地塞米松临床用药量逐年增加,至今我国已成为世界上最大的地塞米松市场。
地塞米松的化学结构为泼尼松龙的B环9α位引入氟原子,D环16α位引入甲基;9α氟及16α甲基均使其抗炎活性显著增强,而16α甲基则显著地降低了地塞米松的水钠潴留副作用。
地塞米松与泼尼松龙的临床生物等效剂量比为0.75:5,生物半衰期为36-54小时,列为长效糖皮质激素。
15甾体激素 药物化学

19
19:46
醋酸地塞米松的鉴别
• 其甲醇溶液与碱性酒石酸铜共热,生成氧化亚铜 的橙红色沉淀 • 本品与乙醇制氢氧化钾醇试液共热后,C21位上的 酯键可水解,与硫酸煮沸,即产生乙酸乙酯的香 味 • 氧瓶中燃烧后,显氟化物的鉴别反应
2013年7月15日7时56分
20
19:46
临床应用与副作用
• 本品的糖代谢作用和抗炎作用比氢化可的 松强30倍。主要用于抗炎抗过敏,如活动 性风湿病、类风湿性关节炎、全身性红班 狼疮等胶原性疾病,严重支气管哮喘、皮 炎等过敏性疾病,以及急性白血病等。 • 用量大易引起糖尿和类库欣氏综合症,长 期应用可引起精神症状的疾病。
2013年7月15日7时56分
雷洛昔芬对卵巢、 乳腺雌激素受体均 有拮抗作用,但对 骨骼受体产生激动 作用,用于骨质疏 松的预防和治疗。
40
19:46
第五节 孕激素类药物
• 孕酮类:黄体酮、已酸羟孕酮 醋酸甲羟孕酮、醋酸甲地孕酮 • 睾酮类:炔孕酮、炔诺酮 、异炔诺酮、 炔诺孕酮
2013年7月15日7时56分
41
19:46
2013年7月15日7时56分
13
19:46
糖皮质激素的结构修饰
O OH
OH
O
O OH OH OH OH OH CH3 O CH3 O O
O O
O O
OH OH OH
O O
OH OH OH OH OH O O
CH3 CH3
泼尼松 6α -甲基泼尼松龙 曲安奈德
O O O
F
F CH3
F 泼尼松龙 6α -氟泼尼松龙 氟轻松
31
甾体雌激素
O CH3 C H3 OH CH3 OH OH
醋酸地塞米松片的说明书

醋酸地塞米松片的说明书忙于工作的人最常见的疾病就是肠胃疾病,许多白领阶层都患有胃肠方面的疾病,工作忙起来往往就不注意自身的健康问题,这样是不利于健康的。
因此,我们一定要正确的饮食,养成合理的进食习惯。
目前推出了一种叫做醋酸地塞米松片的药物,对于胃肠疾病治疗很有帮助。
【药品名称】通用名称:醋酸地塞米松片商品名称:醋酸地塞米松片拼音全码:CuSuanDiSaiMiSongPian【主要成份】本品主要成分为醋酸地塞米松。
化学名:16α-甲基-11β,17α,21-三羟基-9α-氟孕甾-1,4-二烯-3,20-二酮-21-醋酸酯。
分子式:C24H31FO6分子量:434.50。
【性状】本品为白色片。
【适应症/功能主治】主要用于过敏性与自身免疫性炎症性疾病。
如结缔组织病,严重的支气管哮喘,皮炎等过敏性疾病,溃疡性结肠炎,急性白血病,恶性淋巴瘤等。
此外,本药还用于某些肾上腺皮质疾病的诊断——地塞米松抑制试验。
【规格型号】0.75mg*100s【用法用量】口服,成人开始剂量为一次0.75~3.00mg(1~4片),一日2~4次。
维持量约一日0.75mg(1片),视病情而定。
【不良反应】本品较大剂量易引起糖尿病、消化道溃疡和类柯兴综合征症状,对下丘脑-垂体-肾上腺轴抑制作用较强。
并发感染为主要的不良反应。
【禁忌】对本品及肾上腺皮质激素类药物有过敏史患者禁用。
高血压、血栓症、胃与十二指肠溃疡、精神病、电解质代谢异常、心肌梗塞、内脏手术、青光眼等患者一般不宜使用。
特殊情况下权衡利弊使用,但应注意病情恶化的可能。
【注意事项】1、结核病、急性细菌性或病毒性感染患者慎用,必要应用时,必须给予适当的抗感染治疗。
2、长期服药后,停药前应逐渐减量。
3、糖尿病、骨质疏松症、肝硬化、肾功能不良、甲状腺功能低下患者慎用。
肾上腺皮质激素类药物的用药护理

36
护用药理学
促肾上腺皮质素
1.是维持肾上腺正常形态和功能的重要激素。ACTH缺乏,将引起肾 上腺皮质萎缩、分泌功能减退。
2.临床上主要用于ACTH 兴奋试验以判断肾上腺皮质贮备功能,诊 断脑垂体前叶-肾上腺皮质功能状态及检测长期使用糖皮质激素的停药前 后的皮质功能水平,以防止因停药而3发7 `生皮质功能不全。
12
药理作用
护用药理学
现多采用局部应用的方法,因局部抗炎作用强,病变部位药物 浓度高,药物起效迅速,可减少全身不良反应。如布地奈德粉吸入 剂、丙酸氟替卡松吸入气雾剂等在哮喘治疗中的应用。
13
13
药理作用
护用药理学
3.抗免疫作用
对免疫过程的多个环节有抑制作用。
4.抗毒作用
提高机体对细菌内毒素的耐受能力,迅速缓解 中毒症状。但对细菌外毒素无效。
水和电解质代谢:潴钠排钾, 长期用药9造成骨质脱钙
9
药理作用
护用药理学
2.抗炎作用
糖皮质激素是目前最强的抗炎药物之 一,能抑制多种原因造成的炎症反应,包括 物理性,如烧伤,创伤等;化学性、如酸、 碱损伤等;免疫性,如各型变态反应,及无 菌性炎症,如缺血性组织损伤1等0 。
10
药理作用
护用药理学
2.抗炎作用
5
泼尼松龙 (prednisolone)
>200
5
曲安西龙 (triamcinolone)
>200
4
对氟米松 (paramethasone)
>200
2
地塞米松 (dexamethasone)
>300 6
0.6
强壮灵合剂的抗炎作用

胃内漂浮滞留型缓释片是依据流体动力学原理,此种剂型进入人体胃环境内,能够漂浮于胃液的上面,并且能够缓慢释放药物,该制剂被称之为“生物有效制剂”[15]。
组成此种剂型的几个因素为药物、亲水凝胶滞留材料以及其他的辅助材料。
在凝胶屏障的保护下,该种剂型的骨架材料的密度小于胃内容物,因此漂浮于胃液之上,并且不受胃排空的影响[15]。
崔京浩[16]等根据胃内滞留剂的释药原理,将葛根素制成胃内滞留剂。
首先将难溶物葛根素制成HP-β-CD 包合物,作为滞留剂的内容物。
以海藻酸钙做为滞留微丸的主要材料,通过考察其他辅料(甲基纤维素、硬脂酸镁、壳聚糖)对药物释放的影响。
实验结果表明,硬脂酸镁为2%时,滞留剂的漂浮效果最好。
与此同时,考察该剂型在人工胃液中的释放情况,其在8h 内的累积释放率为87%,未出现药物突释现象。
胃内滞留丸不仅表现了较好的漂浮效果,其缓释效果也很稳定。
7 小结目前已研究的葛根素缓控释制剂很多,但是从体内药动学的角度来看,关于葛根素制剂的体内研究还不完善,葛根素制剂的体内运行机理还未明确。
希望以上关于葛根素的剂型总结,为以后学者们对葛根素的深入研究提供一定的帮助。
参考文献[1] 夏华玲.葛根素药理作用研究进展[J].时珍国医国药,2006,17(3):434.[13]宋金春,陈佳丽,黄岭.葛根素环糊精包合物脂质体的制备及体外性质研究[J].中国药学杂志,2008,43(23):1792-1797.LIN H S,CHAN S Y,YANGLOW K S.Ki n eti c study of 2 -hydrox yprop y -β-c yc l ode xtr i n-based Formulation of all -tr ansre ti no i c ac i d in sprague -dawle rast after o r a l or i ntr avenousa dmini stra ti o n[J].J Pha r m Sc i,2000,89(2):260-267.Sheth P R,Tossun ia n J L.The hydr odyna mi ca ll y ba l anced system (HBSTM);A nove l dr ug de li ve ry system fo r o r a l use[J].Dr ug D e vInd Pha r m,1984,10(2):313-316.[14][15][16] 崔京浩,钱颖,缪文俊,等.含葛根素-羟丙基β-环糊精包合物胃滞留剂的制备与体外评价[J].中国中药杂志,2008,33(16):1960-1964.收稿日期:2013-08-26强壮灵合剂的抗炎作用李娜1李仁花2窦德强1*姜素云3*1.辽宁中医药大学(大连116000)2 .吉林省图们市人民医院(吉林132000)3.大连市食品药品检验所(大连 116021)[2]苑程鲲,沈文娟,吴效科.葛根素临床应用新进展[J].中医药信息,2011,28(6):125-127. 马家骅,杨明,曹世栋,等.葛根素的提取和含量测定[J].华西药学杂志,2006,21(2):206-207. 由立红,邹英华,景秋芳,等.葛根素缓释复合骨架片理化性质的研究[J].沈阳药科大学学报,2002,19(3):168-172. 景秋芳,任福正,沈永嘉,等.葛根素复合骨架缓释片的处方及制备工艺[J].华东理工大学学报,2003,29(2):173-180. 周珊珊,谭睿,谢彬,等.葛根素骨架缓释片的研制及体外释放评价[J].中国实验方剂学杂志,2013,19(3):23-26. 高秀蓉,许小红,张永模,胡霞.葛根素包衣缓释滴丸的制备及其体外释放度研究[J].时珍国医国药,2011,22(6):1417-1419. 刘伟星,李宁,高崇凯.葛根素自微乳化渗透泵控释胶囊的制备[J].中草药,2013,44(12):1568-1573.摘要目的研究强壮灵合剂对小鼠炎症的影响。
醋酸地塞米松及其制剂的分析

结构和理化性质
脂溶性
H HO
CH3
O CH3
H
F
H
O
O
CH3
OH
H
CH3
O
醋酸地塞米松分子结构中具有环 戊烷并多氢菲母核,虽然同时具 有羟基、α-醇酮基等极性取代基, 整体属于弱极性、脂溶性化合物 (在有机溶剂中溶解性较好,而在 水中溶解性较差)。 醋酸地塞米松在丙酮中易溶,在 甲醇或无水乙醇中溶解,在乙醇 或三氯甲烷中略溶,在乙醚中极 微溶解,在水中不溶。
醋酸地塞米松及其制剂的分析
目录
CONTENTS
01 结构和理化性质
02 鉴别试验
03 有关物质检查
04 含量测定
1
结构和理化性质
结构和理化性质
醋酸地塞米松(Dexamethasone Acetate)是临床广 泛应用的典型甾体激素类药物(steroid hormones)。
甾体激素类药物
肾上腺皮质激素 性激素
碱性酒石酸铜反应,生成氧化亚铜(Cu2O)红色沉淀
在强碱性溶液中与四氮唑试液反应显色
水解反应法
醋酸地塞米松17位取代基具有乙酯键。ChP2015中利用乙醇制KOH溶液中, 使醋酸酯水解,再在硫酸的催化下与乙醇反应生成乙酸乙酯,并利用其气 味进行鉴别。
H HO
CH3
O CH3
H
F
H
O
O
CH3
OH
H
CH3
结构和理化性质
旋光性
H HO
CH3
O CH3
H
F
H
O
O
CH3
OH
H
CH3
O
甾体激素类药物的环戊烷并多 氢菲母核的并环碳原子、和多 个取代位的骨架碳原子,均为 立体专属的手性碳,因此,甾 体激素类药物的立体构型均明 确、之一,且具有旋光性。
醋酸地塞米松乳膏与派瑞松对皮炎湿疹类皮肤病的效果分析

1562021年1月第7卷第1期*临床药物应用*醋酸地塞米松乳膏与派瑞松对皮炎湿疹类皮肤病的效果分析郑蕾六安市人民医院皮肤性病科,安徽六安237000摘要目的探析醋酸地塞米松乳膏与派瑞松对皮炎湿疹类皮肤病的效果。
方法选取该院门诊于2019年9月一2020年2月收治的60例皮炎湿疹类皮肤病患者作为研究对象,随机两组,对照组30例采用醋酸地塞米松乳膏治疗,观察组30例采用派瑞松治疗,观察两组患者的治疗效果。
结果观察组有效率93.33%高于对照组66.67%,观察组不良反应0.00%低于对照组20.00%,差异有统计学意义仪2二6.667、4.630,!<0.05)。
观察组皮损评分优于对照组,差异有统计学意义(!<0.05)。
结论采用派瑞松治疗皮炎湿疹类皮肤病可提高临床有效率,改善临床症状,安全性高$关键词醋酸地塞米松乳膏;派瑞松;皮炎湿疹类皮肤病中图分类号R687.3文献标志码A doil0.11966/j.issn.2095-994X.2021.07.01.50Analysis of the Effect of Dexamethasone Acetate Cream and Pevisone on Dermatitis and EczemaZHENG LeiDepartment of Dermatology,Liu'an People's Hospital,Liu'an,Anhui Province,237000ChinaAbstract Objective To explore the effect of dexamethasone acetate cream and parvisone on dermatitis and eczema.Methods A total of 60patients with dermatitis and eczema who were admitted to the outpatient clinic from September2019to February2020were selected as the research objects.Two groups were randomized.30cases in the control group were treated with dexamethasone acetate cream,and30in the observation group were treated with parvisone,and the treatment effect of the two groups of patients was observed.Results The effective rate of the observation group was93.33%higher than that of the control group66.67%,and the adverse reaction rate of the observation group was0.00%lower than that of the control group20.00%,and the difference was statistically sig-nificant(x2i6.667,4.630,!<0.05).The skin lesion score of the observation group was better than that of the control group,and the difference was statistically significant(!<0.05).Conclusion Pevisone treatment of dermatitis and eczema can improve clinical effectiveness,improve clinical symptoms,and has high safety.Key words Dexamethasone acetate cream;Parvisone;Dermatitis and eczema skin diseases临床上,皮炎湿疹类皮肤病为常见的一种疾病,以糜烂、渗液、丘疹等为主要症状,严重影响患者正常的工作和生活,生活质量更是显著降低叫所以,对该类患者实施针对性的治疗意义重大$临床上治疗该病的药物有很多,如醋酸地塞米松乳膏%派瑞松等,均有不错的效果&2'$有研 究指岀[3],针对皮炎湿疹类皮肤病患者采取派瑞松治疗可有效改善临床症状,效果确切,且不良反应较少,应用价值较高。
醋酸地塞米松片质量分析与思考

高限标准溶液:30mg/mlo低限标准溶液:21.25mg/mlo薄层板:硅胶GF254点样量:1*lo展开剂:氯仿-甲醇-浓氨溶液(15=10=3)o显色:紫外光灯(254nm)下观察;或喷碘试液显色观察斑点大小~强弱o3.4氯霉素片~胶囊~注射液(规格:0.25g~2ml= 0.25g)供试品溶液的制备:注射剂精密量取2ml加稀乙醇稀释10ml作供试品溶液;片剂取1片或胶囊剂取1粒的内容物研末精密加稀乙醇10ml 研磨2分钟静置上清液作为供试品溶液(25mg/ml)o 高限标准溶液:30mg/mlo低限标准溶液:21.25mg/mlo薄层板:硅胶GF254点样量:1*lo展开剂:氯仿-乙醇(9=1)o显色:紫外光灯(254nm)下检视斑点大小~强弱o3.5盐酸林可霉素注射液(规格:2ml=0.6g)供试品溶液的制备:精密量取本品1ml至25 ml容量瓶中加水稀释至刻度摇匀即得供试品溶液(12mg/ml)o高限标准溶液:14.4mg/mlo低限标准溶液制备:10.2mg/mlo薄层析:硅胶Go点样量:1*lo展开剂:氯仿-乙醇(9=1)o显色;置碘蒸气中显色;或喷碘试液显色观察斑点大小~强弱o4讨论1)当前医药市场假劣药品屡禁不止的问题仍较为严重尤其是对一些价格昂贵的药品有一些不法厂商存在少投料的现象这类药品在进药渠道较乱的农村基层医药单位占一定比例必须加大监督检验力度为此设计适用于农村基层医药单位药品快检分析的薄层半定量检测法该法操作简便迅速测定结果可靠o全部检测设施可放在小型快检箱内便于携带在农村基层药品销售点流动检查以及时发现不合格药品o2)为了提高薄层半定量检测的准确性必须注意操作过程的规范化o薄层板制备表面应均匀~平整~无麻点~无气泡~无破损及污染o供试品溶液与低限标准溶液~高限标准溶液的点样量必须相同点样直径必须控制一致以使供试品的斑点与对照品斑点在完全相同的条件下进行大小~深浅的比较得出正确的结论o3)由于薄层半定量检测法具有一定的误差不是法定检验标准仅是一种以发现不合格药品的快检分析手段故对于用此法检出的不合格药品还需抽验按药典方法进行检验后发出正式报告作出处理o参考文献1中华人民共和国卫生药典委员会编.中华人民共和国药典.二部.北京:化学工业出版社2000.31.2中华人民共和国卫生部编.卫生部药品标准(抗生素药品分册).北京:人民卫生出版社1989.40.3中国药品生物制品检定所编.关于九种药品的鉴别方法及起草说明.北京:科技出版社1996.(收稿日期:2001-05-08)醋酸地塞米松片质量分析与思考姚楠江阴市药品检验所(江阴214431)醋酸地塞米松片是临床上常用的肾上腺皮质激素类药品2000年版中国药典以有机氟化物的反应作为其唯一鉴别方法用紫外分光光度法测定其含量[1]o实验证明该法专属性不强目前市场上的伪劣品用该法测定结果为合格品o从三方面的检验数据来加以分析论证o-05 -1薄层色谱法(T LC)1.1仪器~试药硅胶GF254铝基高效薄层板5>20cm,天津药典标准仪器开发公司~园桶型展开缸~紫外分析仪~醋酸地塞米松片~天津药业有限公司生产,天津药检所提供1.2方法与结果1.2.1对照品溶液的制备取醋酸地塞松片2片,置研钵中研细,加甲醇5ml,继续研磨使主成分溶解,静置1.2.2样品溶液的制备取样品2片,置研钵中研细,加甲醇5ml,继续研磨,加甲醇5ml,继续研磨,使主成分溶解~静置1.2.3薄层色谱取定量毛细管吸取对照品~样品的上清液2#l,分别点于同一铝基薄层板上,以醋酸乙酯-无水乙醇-氨水(50=5=1)为展开剂展开,展距为8cm,取出晾干,在紫外检测仪(254nm)下检视1.2.4结果见表12药典鉴别~含量测定方法2.1鉴别有机氟化物按<中国药典>(2000年版)醋酸地塞米松片项下方法测定,即得2.2含量测定按<中国药典>(2000年版)醋酸地塞米松片项下方法测定仪器:岛津UV-1601型分光光度计2.3结果见表13~PLC鉴别及含量测定3.1仪器与试药Waters501~PLC泵,Waters2487紫外检测仪, 25#l进样器,JS3030色谱工作站,实验用醋酸地塞米松片均为本所近期抽验品种,甲醇等试剂为分析纯,醋酸地塞米松对照品~醋酸泼尼松对照品均为中国药品生物制品检验所提供3.2实验方法3.2.1色谱柱十八烷基硅烷键合硅胶(Waters),流动相:甲醇-水(70=30),流量:0.8ml/min,检测波长:240nm3.2.2对照品溶液的制备醋酸地塞米松对照液,精密称取醋酸地塞米松对照品13mg,置50ml量瓶中,加甲醇35ml振摇溶解,加水至刻度,摇匀~滤过精密吸取续滤液5ml,置25ml量瓶中,用流动相稀释至刻度,摇匀,即得醋酸泼尼松对照液精密称取得醋酸泼尼松对照品约13mg,同上法制备,即得3.2.3供试品溶液的制备取本品20片,精密称定研细,精密称取适量(约相当于醋酸地塞米松13mg),置50ml量瓶中,加甲醇35ml,振摇使溶解,加水至刻度,摇匀~滤过精密吸取续滤液5ml,置25ml量瓶中,加流动相稀释至刻度,摇匀,即得3.2.4~PLC鉴别按下述含量测定方法操作比较样品色谱图与对照品色谱图,看样品是否具有与醋酸地塞米松或醋酸泼尼松对照品相应的色谱峰3.2.5~PLC含量测定精密吸取对照品液与供试品溶液各10#l,分别注入高效液相色谱仪,记录色谱图,按外标法以峰面积计算含量即得3.3结果8批醋酸地塞米松片的鉴别与含量测定结果见表1表18批样品的鉴别与含量测定序号标示厂家批号鉴别醋酸地塞米松片含量(标示量%)T LC氟化物~PLC分光法~药典法~PLC 1天津药业有限公司000632+++98.3101.1 2天津药业有限公司000911+++99.299.8 3天津药业有限公司001025+++98.898.7 4浙江医药股份有限公司990804+++97.999.4 5浙江仙居药业有限公司000206+++99.1101.7 6陕西汉中第一制药厂20000308-未检-100.90 7广东河源康泰制药厂20000618-+-102.30 8广东河源康泰制药厂20000709-+-100.40注:T LC鉴别中+表示与对照品R f值一致,- 即R f值不一致氟化物鉴别中+表示呈正反应,- 表示呈负反应~PLC鉴别中+表示检出醋酸地塞米松色谱峰,- 表示未检出醋酸地塞米松色谱峰.15.4讨论1)由表1可见,1 5号样品三种方法鉴别结果均一致,分光光度法和~PLC法测定的含量均符合规定,为正品产品6号样品鉴别不符合规定,~PLC法含量为零,而分光光度法含量合格图示中看出是以醋酸泼尼松冒充醋酸地塞米松7 8号样品药典方法可视为合格品但T LC 及~PLC鉴别和含量测定均不符合规定图示既不是醋酸地塞米松也不是醋酸泼尼松,为未知物的色谱峰2)2OOO版药典方法专属性不强,不易区分假冒伪劣品,应尽快修订3)以上数据表明,T LC与~PLC鉴别结果完全一致,且T LC法快速简便,可操作性强,特别适合基层开展工作此法既可以作为对可疑药品的初筛,也可考虑修订标准时增加此法~PLC法的定性~定量则更科学~更合理4)针对当前市场假冒伪劣品的不断出现以及发展动态,制假手段不断升级,制订严密的分析方法刻不容缓,只有这样才能有效遏制造假势头的蔓延,让不法分子无机可乘参考文献1中华人民共和国卫生部药典委员会.中华人民共和国药典.二部.北京:化学工业出版社,2OOO:1O19.(收稿日期:2OO1-11-27)~PLC法测定氯雷酊中氯霉素的含量张林松周继勇镇江市药品检验所(镇江212OO3)氯雷酊是由氯霉素和间苯二酚组成,具有抗菌消炎作用,收载于镇江市医院制剂手册中,标准中只有间苯二酚的含量测定(滴定法),没有对氯霉素进行含量测定,为进一步完善该药品质量标准,对其中的氯霉素进行了含量测定文献报道的复方氯霉素制剂中氯霉素的含量测定方法有紫外分光光度法[1]和~PLC法[2],因氯霉素和间苯二酚的乙醇溶液紫外吸收峰严重重叠,故本实验利用了~PLC法对其中的氯霉素进行了含量测定,结果表明本法简便快速,精密度好1仪器与试剂1.1材料LC-6A高效液相色谱仪,C-R6A积分仪(日本岛津);氯霉素原料(东北制药厂,批号:2OOOO811,含量:99.8%),氯雷酊(镇江市皮防所制)其余试剂均为分析纯1.2色谱条件色谱柱:kromasil C18(15O.O>4.O mm,5Mm);流动相:甲醇-水(42=58);检测波长:28O nm;流量: 1ml/min;理论塔板数以氯霉素计应大于1OOO,氯霉素与间苯二酚两峰间的分离度应大于 1.22方法与结果2.1对照品溶液的制备取氯霉素原料(置以五氧化二磷为干燥剂的干燥器中干燥至恒重)约4O mg,精密称定,用乙醇溶解并稀释至1OO ml,摇匀,即得2.2供试品溶液的制备精密吸取样品2ml,用乙醇稀释至5O ml,摇匀精密吸取上述溶液3ml,用乙醇稀释至1O ml,摇匀,即得2.3阴性对照品溶液的制备取间苯二酚与乙醇按处方制成不含氯霉素的空白样品,并按2.2项下的操作条件制得阴性对照品溶液.25 .醋酸地塞米松片质量分析与思考作者:姚楠作者单位:江阴市药品检验所,江阴,214431刊名:江苏药学与临床研究英文刊名:JIANGSU PHARMACEUTICAL AND CLINICAL RESEARCH年,卷(期):2002,10(1)1.国家药典委员会中国药典(二部) 20001.徐建东.刘昌美醋酸地塞米松的含量测定[期刊论文]-中国药师2005,8(5)2.卜生高.何选林RP-HPLC法测定醋酸地塞米松片的含量[期刊论文]-中国药事2004,18(8)3.吕长淮.LU Chang-huai紫外分光光度法测定醋酸地塞米松片溶出度[期刊论文]-安徽医药2005,9(6)4.杨魁.李岩.邱方利.YANG Kui.LI Yan.QIU Fang-li止痛灵结构的表征及紫外分光光度法含量测定[期刊论文]-安徽化工2007,33(2)5.郑一玲.林秋英.黄颂.李枝端甲紫溶液的紫外分光光度法含量测定[期刊论文]-海峡药学2001(3)6.王世刚醋酸地塞米松片含量均匀度紫外测定波长偏离原因考察[期刊论文]-安徽医药2003,7(3)本文链接:/Periodical_jsyxylcyj200201024.aspx。
成都天台山制药有限公司药品品种一览表
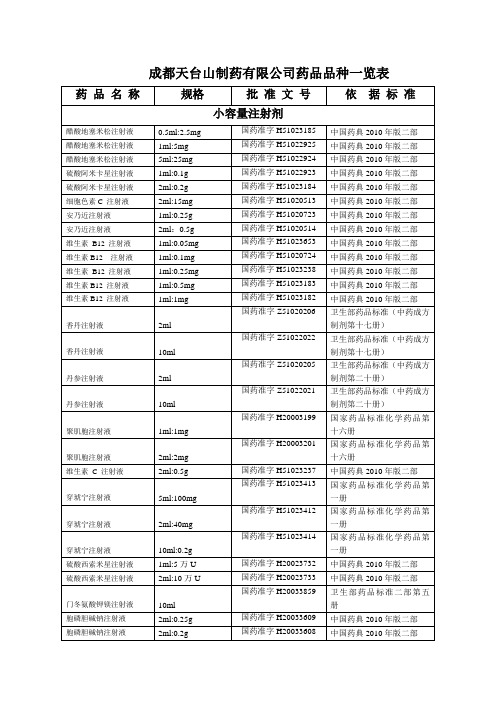
国药准字H20066227
《中国药典》2010年版二部
注射用甲磺酸加贝酯
0.1g
国药准字H20066191
国家药品标准YBH02452007
注射用甲硫氨酸维B1
甲硫氨酸40mg维生素B14mg
国药准字H20060966
国家药品标准YBH13292006
注射用丁溴东莨菪碱
20mg
国药准字H20080375
注射用辅酶A
50U
国药准字H51020693
卫生部药品标准二部第六册
注射用辅酶A
100U
国药准字H51020692
卫生部药品标准二部第六册
注射用辅酶A
200U
国药准字H51020713
卫生部药品标准二部第六册
注射用三磷酸腺苷二钠
10mg
国药准字H51020715
中国药典2010年版二部
注射用三磷酸腺苷二钠
注射用甲磺ห้องสมุดไป่ตู้培氟沙星
0.4g
国药准字H20054647
中国药典2010年版二部
注射用甘草酸二铵
0.15g
国药准字H20050891
国家药品标准YBH10912005
注射用奥美拉唑钠
40mg
国药准字H20055327
国家药品标准YBH12312005
注射用盐酸曲马多
0.1g
国药准字H20051229
国家药品标准YBH16962005
国家药品标准YBH01662010
注射用地塞米松磷酸钠
2mg
国药准字H20052125
国家药品标准YBH31202005
注射用地塞米松磷酸钠
10mg
国药准字H20052126
蛋白同化、肽类激素名单
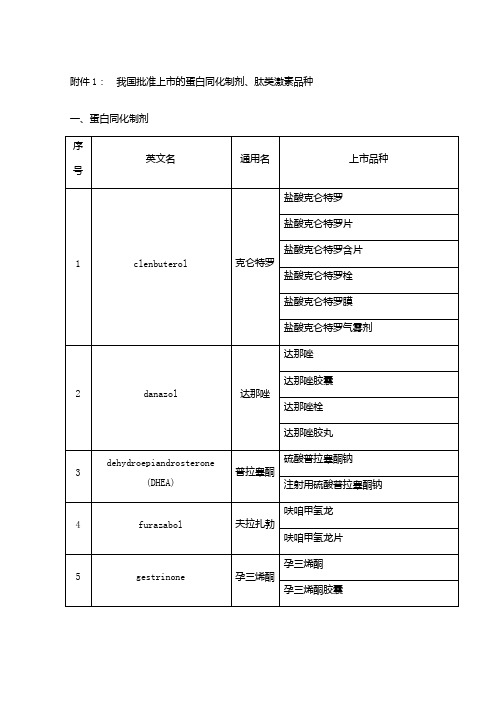
普拉睾酮
硫酸普拉睾酮钠
注射用硫酸普拉睾酮钠
4
furazabol
夫拉扎勃
呋咱甲氢龙
呋咱甲氢龙片
5
gestrinone
孕三烯酮
孕三烯酮
孕三烯酮胶囊
6
methandienone
美雄酮
美雄酮
美雄酮片
7
methyltestosterone
甲睾酮
甲睾酮
甲睾酮片
8
nandrolone
诺龙
癸酸诺龙
乙酰水杨酸孕烯诺龙
芬太尼及其衍生物
芬太尼
芬太尼贴片
芬太尼透皮贴剂
枸橼酸芬太尼
枸橼酸芬太尼注射液
枸橼酸舒芬太尼
瑞芬太尼
盐酸阿芬太尼
盐酸瑞芬太尼
注射用盐酸瑞芬太尼
枸橼酸舒芬太尼注射液
氢吗啡酮
氢吗啡酮
盐酸氢吗啡酮
盐酸氢吗啡酮缓释片
美沙酮
美沙酮
盐酸美沙酮
盐酸美沙酮口服溶液
盐酸美沙酮片
盐酸美沙酮注射液
吗啡
吗啡
阿桔片
阿片
阿片酊
阿片粉
贝敏伪麻片
苯酚伪麻片
苯海拉明伪麻黄碱胶囊
布洛伪麻分散片
布洛伪麻干混悬剂
布洛伪麻缓释胶囊
布洛伪麻缓释片
麻黄碱
布洛伪麻混悬液
布洛伪麻胶囊
布洛伪麻颗粒
布洛伪麻口腔崩解片
布洛伪麻那敏片
布洛伪麻泡腾颗粒
布洛伪麻片
布洛伪麻软胶囊
茶碱麻黄碱胶囊
茶碱麻黄碱片
非索伪麻缓释片
酚咖麻敏胶囊
酚氯伪麻缓释片
酚麻美敏咀嚼片
酚麻美敏口服溶液
醋酸地塞米松(欧典)

EUROPEAN PHARMACOPOEIA 7.0DexamethasoneacetateC.9-fluoro-11β,17,21-trihydroxy-16α-methylpregn-4-ene-3,20-dione,D.17,21-dihydroxy-16α-methyl-9β,11β-epoxypregna-1,4-diene-3,20-dione,E.17,21-dihydroxy-16α-methylpregna-1,4,9(11)-triene-3,20-dione,F.9-fluoro-11β,21-dihydroxy-16α-methylpregna-1,4-diene-3,20-dione,G.9-fluoro-11β,17-dihydroxy-16α-methyl-3,20-dioxopregna-1,4-dien-21-yl acetate (dexamethasoneacetate),H.17-hydroxy-16α-methyl-3,20-dioxopregna-1,4,9(11)-trien-21-ylacetate.04/2010:0548DEXAMETHASONE ACETATE DexamethasoniacetasC 24H 31FO 6M r 434.5[1177-87-3]DEFINITION9-Fluoro-11β,17-dihydroxy-16α-methyl-3,20-dioxopregna-1,4-dien-21-yl acetate.Content :97.0per cent to 103.0per cent (dried substance).CHARACTERSAppearance :white or almost white,crystalline powder.Solubility :practically insoluble in water,freely soluble in ethanol (96per cent),slightly soluble in methylene chloride.It shows polymorphism (5.9).IDENTIFICATIONFirst identification:B,C .Second identification:A,C,D,E,F .A.Dissolve 10.0mg in anhydrous ethanol R and dilute to 100.0mL with the same solvent.Place 2.0mL of this solution in a ground-glass-stoppered tube,add 10.0mL of phenylhydrazine-sulfuric acid solution R ,mix and heat in a water-bath at 60°C for 20min.Cool immediately.The absorbance (2.2.25)measured at the absorption maximum at 419nm is not less than 0.35.B.Infrared absorption spectrophotometry (2.2.24).Comparison :dexamethasone acetate CRS .If the spectra obtained in the solid state show differences,dissolve the substance to be examined and the reference substance separately in methylene chloride R ,evaporate to dryness and record new spectra using the residues.C.Thin-layer chromatography (2.2.27).Solvent mixture :methanol R ,methylene chloride R (1:9V/V ).Test solution .Dissolve 10mg of the substance to beexamined in the solvent mixture and dilute to 10mL with the solvent mixture.Reference solution (a).Dissolve 20mg of dexamethasoneacetate CRS in the solvent mixture and dilute to 20mL withthe solvent mixture.Reference solution (b).Dissolve 10mg of cortisone acetate R in reference solution (a)and dilute to 10mL with reference solution (a).Plate :TLC silica gel F 254plate R .Mobile phase :add a mixture of 1.2volumes of water R and 8volumes of methanol R to a mixture of 15volumes ofether R and 77volumes of methylene chloride R .Application :5μL.Development :over 3/4of the plate.Drying :in air.Detection A :examine in ultraviolet light at 254nm.Results A :the principal spot in the chromatogram obtained with the test solution is similar in position and size to the principal spot in the chromatogram obtained with reference solution (a).Detection B :spray with alcoholic solution of sulfuric acid R ,heat at 120°C for 10min or until the spots appear,and allow to cool;examine in daylight and in ultraviolet light at 365nm.Results B :the principal spot in the chromatogram obtainedwith the test solution is similar in position,colour in daylight,fluorescence in ultraviolet light at 365nm and size to theprincipal spot in the chromatogram obtained with reference solution (a).System suitability :reference solution (b):—the chromatogram shows 2clearly separated spots.D.Add about 2mg to 2mL of sulfuric acid R and shake to dissolve.Within 5min,a faint reddish-brown colour develops.Add this solution to 10mL of water R and mix.The colour is discharged and a clear solution remains.E.Mix about 5mg with 45mg of heavy magnesium oxide Rand ignite in a crucible until an almost white residue is obtained (usually less than 5min).Allow to cool,add 1mL of General Notices (1)apply to all monographs and other texts1809Dexamethasone acetate EUROPEAN PHARMACOPOEIA7.0water R,0.05mL of phenolphthalein solution R1and about 1mL of dilute hydrochloric acid R to render the solution colourless.Filter.To a freshly prepared mixture of0.1mL of alizarin S solution R and0.1mL of zirconyl nitratesolution R,add1.0mL of the filtrate.Mix,allow to stand for5min and compare the colour of the solution with that of a blank prepared in the same manner.The test solution is yellow and the blank is red.F.About10mg gives the reaction of acetyl(2.3.1).TESTSSpecific optical rotation(2.2.7):+94to+99(dried substance). Dissolve0.250g in anhydrous ethanol R and dilute to25.0mL with the same solvent.Related substances.Liquid chromatography(2.2.29).Carry out the test protected from light.Test solution.Dissolve25mg of the substance to be examined in about4mL of acetonitrile R and dilute to10.0mL with water R.Reference solution(a).Dissolve2mg of dexamethasone CRS (impurity A)and2mg of betamethasone acetate CRS (impurity D)in100.0mL of the mobile phase and sonicate for about10min(solution A).Mix6.0mL of the test solution and 1.0mL of solution A and dilute to10.0mL with the mobile phase.Reference solution(b).Dilute1.0mL of the test solution to 100.0mL with the mobile phase.Dilute1.0mL of this solution to10.0mL with the mobile phase.Reference solution(c).Dissolve the contents of a vial of dexamethasone acetate impurity E CRS in1.0mL of the mobile phase.Column:—size:l=0.25m,Ø=4.6mm;—stationary phase:octadecylsilyl silica gel forchromatography R(5μm).Mobile phase:mix380mL of acetonitrile R with550mL of water R and allow to equilibrate;dilute to1000.0mL with water R and mix again.Flow rate:1mL/min.Detection:spectrophotometer at254nm.Injection:20μL.Run time:2.5times the retention time of dexamethasone acetate.Identification of impurities:use the chromatogram obtained with reference solution(a)to identify the peaks due to impurities A and D;use the chromatogram obtained with reference solution(c)to identify the peak due to impurity E.Relative retention with reference to dexamethasone acetate (retention time=about22min):impurity A=about0.4; impurity D=about0.9;impurity E=about1.2.System suitability:reference solution(a):—resolution:minimum3.3between the peaks due to impurity D and dexamethasone acetate.Limits:—impurity D:not more than3times the area of the principal peak in the chromatogram obtained with referencesolution(b)(0.3per cent);—impurities A,E:for each impurity,not more than twice the area of the principal peak in the chromatogram obtainedwith reference solution(b)(0.2per cent);—unspecified impurities:for each impurity,not more than the area of the principal peak in the chromatogram obtainedwith reference solution(b)(0.10per cent);—total:not more than5times the area of the principal peak in the chromatogram obtained with reference solution(b)(0.5per cent);—disregard limit:0.5times the area of the principal peak in the chromatogram obtained with reference solution(b)(0.05per cent).Loss on drying(2.2.32):maximum0.5per cent,determined on 0.500g by drying in vacuo in an oven at105°C.ASSAYDissolve0.100g in ethanol(96per cent)R and dilute to 100.0mL with the same solvent.Dilute2.0mL of this solution to100.0mL with ethanol(96per cent)R.Measure the absorbance(2.2.25)at the absorption maximum at238.5nm. Calculate the content of C24H31FO6taking the specific absorbance to be357.STORAGEProtected from light.IMPURITIESSpecified impurities:A,D,E.Other detectable impurities(the following substances would, if present at a sufficient level,be detected by one or other of the tests in the monograph.They are limited by the general acceptance criterion for other/unspecified impurities and/or by the general monograph Substances for pharmaceutical use (2034).It is therefore not necessary to identify these impurities for demonstration of compliance.See also5.10.Control of impurities in substances for pharmaceutical use):B,C,F,G,H.A.9-fluoro-11β,17,21-trihydroxy-16α-methylpregna-1,4-diene-3,20-dione(dexamethasone),B.14-fluoro-11β,17-dihydroxy-16α-methyl-3,20-dioxopregna-1,4-dien-21-ylacetate,C.9-fluoro-11β,17β-dihydroxy-16α-methyl-3,20-dioxopregna-1,4-dien-21-ylacetate,D.9-fluoro-11β,17-dihydroxy-16β-methyl-3,20-dioxopregna-1,4-dien-21-yl acetate(betamethasone acetate),1810See the information section on general monographs(cover pages)EUROPEAN PHARMACOPOEIA 7.0DexamethasoneisonicotinateE.9-fluoro-11β,17-dihydroxy-16α-methyl-3,20-dioxopregn-4-en-21-ylacetate,F.17-hydroxy-16α-methyl-3,20-dioxo-9β,11β-epoxypregna-1,4-dien-21-ylacetate,G.9-fluoro-11β-hydroxy-16α-methyl-3,20-dioxopregna-1,4-dien-21-ylacetate,H.17-hydroxy-16α-methyl-3,20-dioxopregna-1,4,9(11)-trien-21-yl acetate.01/2008:2237DEXAMETHASONE ISONICOTINATE Dexamethasoniisonicotinas C 28H 32FNO 6M r 497.6[2265-64-7]DEFINITION9-Fluoro-11β,17-dihydroxy-16α-methyl-3,20-dioxopregna-1,4-dien-21-yl pyridine-4-carboxylate.Content :99.0per cent to 101.0per cent (dried substance).CHARACTERSAppearance :white or almost white crystalline powder.Solubility :practically insoluble in water,slightly soluble in anhydrous ethanol and in acetone.IDENTIFICATIONInfrared absorption spectrophotometry (2.2.24).Comparison :dexamethasone isonicotinate CRS .TESTSSpecific optical rotation (2.2.7):+142to +146(dried substance).Suspend 0.200g in 4.0mL of ethyl acetate R and dilute to 20.0mL with ethanol (96per cent)R .Treat in an ultrasonic bath until a clear solution is obtained.Related substances .Liquid chromatography (2.2.29).Prepare solutions immediately before use.Test solution .Suspend 50.0mg in 7mL of acetonitrile R and dilute to 10.0mL with water R .Treat in an ultrasonic bath until a clear solution is obtained.Reference solution (a).Suspend 5.0mg of dexamethasone CRS and 5.0mg of dexamethasone acetate CRS in 70mL of acetonitrile R ,add 1.0mL of the test solution and dilute to 100.0mL with water R .Treat in an ultrasonic bath until a clear solution is obtained.Reference solution (b).Dilute 1.0mL of reference solution (a)to 10.0mL with water R .Reference solution (c).Suspend 5mg of dexamethasone isonicotinate for impurity C identification CRS in 0.7mL of acetonitrile R and dilute to 1mL with water R .Treat in an ultrasonic bath until a clear solution is obtained.Column :—size :l =0.125m,Ø=4.0mm,—stationary phase :octadecylsilyl silica gel for chromatography R (5μm).Mobile phase :—mobile phase A :water R ,—mobile phase B :acetonitrile R ,Time (min)Mobile phase A (per cent V/V )Mobile phase B (per cent V/V )0-268322-2068→5032→5020-2550→6850→3225-356832Flow rate :1.2mL/min.Detection :spectrophotometer at 240nm.Injection :10μL.Identification of impurities :use the chromatogramsupplied with dexamethasone isonicotinate for impurity Cidentification CRS and the chromatogram obtained with reference solution (c)to identify the peak due to impurity C.Relative retention with reference to dexamethasone isonicotinate (retention time =about 12min):impurity A =about 0.4;impurity C =about 0.6;impurity B =about 0.8.System suitability :reference solution (a):—resolution :minimum 5.0between the peaks due toimpurity B and dexamethasone isonicotinate.Limits :—impurity A :not more than 5times the area of thecorresponding peak in the chromatogram obtained withreference solution (b)(0.5per cent),—impurity B :not more than 3times the area of thecorresponding peak in the chromatogram obtained withreference solution (b)(0.3per cent),—impurity C :not more than 3times the area of the peak due to dexamethasone isonicotinate in the chromatogram obtained with reference solution (b)(0.3per cent),—unspecified impurities :for each impurity,not more than the area of the peak due to dexamethasone isonicotinate in thechromatogram obtained with reference solution (b)(0.1percent),General Notices (1)apply to all monographs and other texts1811。
一种醋酸地塞米松的制备方法

一种醋酸地塞米松的制备方法醋酸地塞米松是一种合成的类固醇类激素,通常用于抗炎、免疫抑制及抗过敏等临床应用。
下面将介绍醋酸地塞米松的制备方法。
首先,醋酸地塞米松的制备需要以地塞米松为原料。
地塞米松是合成激素类化合物,具有抗炎、免疫抑制作用,是一种常见的肾上腺皮质激素。
地塞米松脱氧醋酸衍生物(dexmethasone-21-acetate)即为醋酸地塞米松。
醋酸地塞米松的制备方法如下:1. 地塞米松的还原:将地塞米松溶于无水乙醇中,并添加适量的氢氧化钠溶液,在10-15温度下进行还原反应。
还原反应时间一般在1小时左右,反应后去除无水乙醇,得到地塞米松的还原产物。
2. 酰化反应:将地塞米松的还原产物与醋酸溶液在碱性条件下进行酰化反应,一般在室温下进行。
酰化反应时间根据反应进展情况而定,一般在2-4小时左右。
反应后加入碳酸氢钠溶液中和反应液,然后用醚或氯仿等有机溶剂萃取出醋酸地塞米松。
3. 结晶:将有机溶剂中的醋酸地塞米松溶液过滤,得到醋酸地塞米松母液。
母液一般通过酒石酸盐结晶法进行结晶,首先加入酒石酸盐溶液搅拌,然后进行慢慢升温结晶。
随着温度的升高,醋酸地塞米松逐渐结晶出来。
结晶过程需要注意温度控制和搅拌均匀,以充分生成结晶。
4. 干燥和提纯:将结晶得到的醋酸地塞米松进行过滤、洗涤和干燥,得到粗品。
然后使用溶剂进行提纯。
一般使用醚、丙酮、碳酸氢钠溶液等进行溶解,然后过滤去除杂质,再用无水乙醇洗涤并干燥,得到纯净的醋酸地塞米松。
总之,醋酸地塞米松的制备主要经历了地塞米松的还原、酰化反应、结晶和干燥提纯等步骤。
这个方法能够高效地合成出纯净的醋酸地塞米松,为其进一步的临床应用提供了基础。
地塞米松的化学制备

地塞米松的化学制备地塞米松(dexamethasone),异名:德沙美松;氟甲强的松龙;氟甲去氢氢化可的松;氟美松;甲氟烯索,地塞米松,Acidocont, Deronil, Dexacortal, dexametona, Flumeprednisolon等。
又叫德沙美松、氟甲强的松龙是抗炎、抗过敏药物。
主要作为危重疾病的急救用药和各类炎症的治疗。
肾上腺皮质激素类药。
具有抗炎、抗过敏、抗风湿、免疫抑制作用,主要用于治疗严重细菌感染和严重过敏性疾病、各种血小板减少性紫癜、粒细胞减少症、严重皮肤病、器官移植的免疫排斥反应、肿瘤治疗及对糖皮质激素敏感的眼部炎症等。
1958年,Arth与Oliveto等分别合成了地塞米松,1960年Merck & Co.生产地塞米松磷酸钠,至今,上市的地塞米松衍生物已达12种以上。
地塞米松的化学结构为泼尼松龙的B环9α位引入氟原子,D环16α位引入甲基;9α氟及16α甲基均使其抗炎活性显著增强,而16α甲基则显著地降低了地塞米松的水钠潴留副作用。
地塞米松与泼尼松龙的临床生物等效剂量比为0.75:5,生物半衰期为36-54小时,列为长效糖皮质激素。
地塞米松与其他糖皮质激素一样,具有抗炎、抗内毒素、抑制免疫、抗休克及增强应激反应等药理作用,故广泛应用于各科治疗多种疾病,如自身免疫性疾病,过敏,炎症,哮喘及皮肤科、眼科疾病。
地塞米松磷酸钠注射剂更是抢救垂危病人不可缺少的急救药品,近十几年来,临床医师应用地塞米松磷酸钠治疗和预防各类中西药引起的药物过敏及治疗病毒性感冒引起的发烧等症,使地塞米松临床用药量逐年增加,至今我国已成为世界上最大的地塞米松市场。
地塞米松的化学结构为泼尼松龙的B环9α位引入氟原子,D环16α位引入甲基;9α氟及16α甲基均使其抗炎活性显著增强,而16α甲基则显著地降低了地塞米松的水钠潴留副作用。
地塞米松与泼尼松龙的临床生物等效剂量比为0.75:5,生物半衰期为36-54小时,列为长效糖皮质激素。
外用糖皮质激素分类、用法用量、注意事项与不良反应-综述

外用糖皮质激素目录外用糖皮质激素 (1)分类 (1)适应证 (2)药物和制剂的特点及其选择 (2)常用的糖皮质激素制剂 (3)含有抗菌药物的复方糖皮质激素制剂 (4)用法和用量 (5)注意事项 (5)禁忌证 (6)不良反应 (6)分类外用糖皮质激素具有抗炎、抗过敏、免疫抑制及抗增生等药理作用。
根据外用糖皮质激素的药理作用强度可大致可分为弱效、中效、强效和超强效四类,但其浓度和基质成分的不同也可改变其作用强度。
目前国内常用的外用糖皮质激素有:强度药物制剂浓度%强效醋酸氢化可的松 1.0中效醋酸地塞米松0.025~0.075丁酸氢化可的松0.1醋酸曲安缩松0.1强效糠酸莫米松0.1二丙酸倍氯米松0.025氟轻松氟西奈德0.025哈西奈德氯氟舒松0.025超强效卤米松0.05哈西奈德氯氟舒松0.1丙酸氯倍他索0.02* 制剂的剂型可以有软膏、乳膏、溶液或硬膏等。
适应证1.主要用于过敏性或与变态反应相关的非感染性炎症性皮肤病,包括皮炎和湿疹类如特应性皮炎、湿疹、接触性皮炎、光感性皮炎、虫咬皮炎等;2.其他免疫性或与免疫相关性皮肤病如盘状红斑狼疮、扁平苔藓、银屑病、白癜风等。
3.某些瘙痒性皮肤病如神经性皮炎、阴肛部瘙痒症等。
药物和制剂的特点及其选择外用糖皮质激素有消炎、止痒和抑制皮损发作的作用。
不少皮肤病病因不明,病程迁延,常反复发作,如手部湿疹,在皮损消退后仍应每周间歇使用1~2次,作维持治疗,以巩固疗效,防止复发,对银屑病的治疗详见银屑病节。
外用糖皮质激素的品种很多,它们作用的强弱和剂型不同,浓度也各异,要根据皮肤病的性质、皮损类型、部位、患者年龄等因素选择用药。
如面部、腹股沟、腋窝、外阴部等皮肤柔嫩及皱褶部位应使用弱效或中效制剂。
慢性革化肥厚性皮损或手掌足跖部皮损需使用强效或超强效激素制剂,必要时需作封包治疗。
婴儿或儿童皮肤薄嫩,易出现不良反应,通常用弱效或中效激素制剂且使用时间不宜过长。
对特应性皮炎严重、肥厚的皮损可短期使用中、强效激素制剂1~2周,当皮损好转后换用稍弱的制剂。
醋酸地塞米松贴片说明书

醋酸地塞米松贴片说明书醋酸地塞米松贴片(意可贴)用于非感染性口腔黏膜溃疡。
下面是店铺整理的醋酸地塞米松贴片说明书,欢迎阅读。
醋酸地塞米松贴片商品介绍通用名:醋酸地塞米松贴片生产厂家: 深圳太太药业有限公司批准文号:国药准字H19991372药品规格:0.3mg*5片药品价格:¥19.5元醋酸地塞米松贴片说明书【通用名称】醋酸地塞米松贴片【商品名称】醋酸地塞米松贴片(意可贴)【英文名称】DexamethasoneAcetateAdhesiveTablets【拼音全码】CuSuanDiSaiMiSongTiePian(YiKeTie)【主要成份】醋酸地塞米松贴片(意可贴)每片含醋酸地塞米松0.3毫克。
辅料:糊精、卡波姆、硬脂酸镁、维生素B2、二氧化钛、柠檬黄、聚丙烯酸树脂、邻苯二甲酸二乙酯。
【性状】醋酸地塞米松贴片(意可贴)为双层片,类白色层为含药层,黄色层为保护层。
【适应症/功能主治】用于非感染性口腔黏膜溃疡。
【规格型号】0.3mg*5s【用法用量】贴于患处。
一次1片,一日总量不超过3片,连用不得超过一周。
洗净手指后粘少许唾液粘起黄色面,将白色层贴于患处,并清压10-15秒,使其粘牢,不须取出,直至全部融化。
【不良反应】1.偶见皮疹等过敏反应;2.长期使用可见糖皮质激素类全身性不良反应。
【禁忌】严重高血压、糖尿病、胃和十二指肠溃疡、骨质疏松症,有神经病史,癫痫病史,青光眼等患者禁用。
【注意事项】1.醋酸地塞米松贴片(意可贴)仅限口腔使用;2.醋酸地塞米松贴片(意可贴)不宜长期使用,连用7日后症状未缓解,应停药就医;3.孕妇、哺乳期妇女及儿童慎用;4.醋酸地塞米松贴片(意可贴)在口腔内缓慢融化后可咽下;5.如使用过量或发生严重不良反应,应立即就医;6.对醋酸地塞米松贴片(意可贴)过敏者禁用,过敏体质者慎用;7.运动员慎用;8.醋酸地塞米松贴片(意可贴)性状发生改变时禁止使用;9.请将醋酸地塞米松贴片(意可贴)放在儿童不能接触的地方;10.儿童必须在成人监护下使用;11.如正在使用其他药品,使用醋酸地塞米松贴片(意可贴)前请咨询医师或药师。
9.7醋酸地塞米松

• 标示量的单位为mg/片。
Ø 对照品,精密称定 甲醇,溶解并定量稀释
30μg/ml对照 品溶液
制剂的分析
• 醋酸地塞米松片含量测定,采用HPLC法,与原料药条件相同;
Ø
取本品20片,精密称定,精密称取适量(约相当于
研细
醋酸地塞米松2.5mg)
置50ml量瓶中
加适量甲醇 超声使溶解 用甲醇稀释至刻度,摇匀 滤过
续滤液作为供试品溶液
l C11上有羟基,C10、C13有角甲基。
醋酸地塞米松鉴别实验
与斐 林试 剂的 反应
醋酸 酯的 反应
红外 光谱 法
有机 氟化 物的 反应
醋酸地塞米松的化学鉴别实验
1.与斐林试剂的反应 斐林试剂
• C17-α-醇酮基
碱性酒石酸铜试液
2.醋酸酯的反应
碱性条件下水解
硫酸
• 醋酸酯类药物
醋酸 乙醇
乙酸乙酯
检查项目
2.硒检查原理
Se4+ 2,3-二氨基萘 4,5-苯并苯硒二唑
环
pH2.0±0.2
己
烷
Se<0.005%
• 供试品制备方法
含硒物质 氧瓶燃烧 Se6+ 盐酸羟胺
Se4+
含量测定
• 《中国药典》测定醋酸地塞米松采用HPLC法。 填充剂:十八烷基硅烷键合硅胶 流动相:乙腈-水(40 60) 检测波长:240nm
醋酸地塞米松及其制剂的分析
甾体激素类药物概况
• 甾体激素类药物,一些为天然药物,一些为人工合成品, 它们均具有环戊烷并多氢菲母核,其基本骨架如下:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A
40~45′
感谢您的关注
浸渍15min,时时振摇,滤过,滤液置水浴
上蒸干,残渣显有机氟化物的鉴别反应。
二、检查
(一)原料药的检查
1.有关物质
• 来源:结构类似的其他甾体
• 方法:HPLC
• 2.硒(二氧化硒剧毒)
• 来源:合成过程中,二氧化硒脱氢引入的硒
• 方法:二氨基萘比色法 • 样品先经氧瓶燃烧法破坏。使硒游离并转变为 Se6+,在吸收液中加盐酸羟胺,使Se6+还原为 Se4+。然后在pH2.0的条件下,与2,3-二氨基萘 反应,生成4,5-苯并苯硒二唑,用环已烷提取后
,于378nm波长处测定吸光度。
(二)醋酸地塞米松片的检查
1.含量均匀度(HPLC)
2.溶出度(第二法)
• 溶出介质:含有表面活性剂十二烷基磺酸 钠的溶液
三、含量测定
(一)原料药(HPLC)
• 固定相:C18-ODS
• 流动:乙腈-水(40:60)
• 检测波长:240nm • 外标法
(二)制剂
酯类甾体激素药物 酸或碱 水解
例如:醋酸可的松鉴别:取本品约50mm,加乙醇制 氢氧化钾试液2mL,置水浴上加热1min,放冷,加硫 酸溶液(1→2)2mL,缓缓煮沸1 min,即发生醋酸 乙醋的香气。
3.IR • 具有羟基、羰基、酯氧基的红外吸收特征
4.有机氟化物的鉴别:取本品细粉适量(约
相当于醋酸地塞米松7mg),加乙醇25mL,
15.1 醋酸地塞米松及其制剂的分析
结构特点: ★具有21个C原子 ★ A环:具有△4-3-酮 基 ★ C17:具有α -醇酮基 与醋酸成酯 ★ C10、C13:具有角甲 基 ★ C11:具有羟基或酮 基
主要活性基团
性
质
△4
– 3 – 酮
UV、与羰基试剂反 应
还 原 性
C17 – α – 醇酮 基
一、鉴别
(一)物理常数的测定
1.比旋度(二氧六环为溶剂):
+82°~+88°
2.吸收系数:240nm,百分吸收系数为343~371
(二)鉴别 1.与菲林试液的反应 • C17-醇酮基的呈色反应(还原性) • 醋酸地塞米松与斐林试剂(碱性酒石酸铜
)反应生成橙红色氧化亚铜沉淀。
2.醋酸酯的反应(水解产物的反应)
1.醋酸地塞米松片(HPLC)
• 方法与原料药相同
2.醋酸地塞米松注射剂 四氮唑盐比色法
1.原理 C17 -α -醇酮基强还原性
四氮唑盐 有色甲瓒
OH - [还原]
C 醇酮基
2.测定方法
对照品法
供试液 对照液
暗
TTC
氢氧化四甲基铵 ℃
