典型金属的晶体结构资料
材料科学基础2.2金属的晶体结构

间隙原子与最近邻原子
间距离:
四面体边长:
a 3/4
a/ 2
112 1 4 4
8
fcc Octahedron 八面体间隙大小
r 2 1 0.414 R
2r
a 2 2R
体中心和棱的中间
Rr a 2
fcc
C
D
Tetrahedron 四面体间隙大小
rin
3 4
a
R
f cc ,
R fcc
2a 4
bcc 八面体间隙大小
4R 3a bcc
rin
a/4
Rbcc
a/2
1
23
r aR R R
2 in
bcc
3
bcc
bcc
rin 2 3 1 0.155
Rbcc
3
(3) A3: hcp
Octahedral sites:6个
a/ 2
C
hcp
Tetrahedral sites
2 6 2 1 2 3 12 3
2.2.2 晶体的原子堆垛方式和间隙
1.密排面和密排向 晶体晶格中原子密度最大的晶面、晶向
密排六方结构A3(hcp) 0001和 1120
C
C
中间层相对底层错动
110 1 0
3
面心立方结构A1 (ABCABC…)
111和 110
1
8
9
7
3
2
6
4
5
密排面的堆积:(ABCABC…)
1
7 2
8 3
4 第二层相对于第一层错动
FCC
BCC HCP
三种典型晶体中的间隙
八面体间隙
常见纯金属的晶格类型

常见纯金属的晶格类型
常见金属晶体的晶格类型有:(1)正方晶系;(2)单斜晶系,包括等轴晶系和面心立方晶系;
(3)四方晶系,即一组四个角为120°的平行四边形晶胞。
纯金属中,按照晶胞的大小分为大、中、小三种晶粒尺寸;按照晶体结构可以分为等轴晶系、面心立方晶系、六方晶系、四方晶系、八面体晶系等几种晶格类型。
在单斜晶系中,因为每条棱都是相互垂直的,所以一个晶胞中只能出现两个晶面。
而六方晶系里,由于每条棱都垂直,所以同样一个晶胞中会有6个晶面。
正方晶系中最主要的晶体结构是立方晶胞。
第一章-金属的晶体结构(共118张PPT)可修改全文

B面:
(1) 该面与z轴平行,因此x=1,y=2, z=∞; (2) 1/x=1,1/y=1/2,1/z=0; (3) 最小整数化1/x=2,1/y=1,1/z=0; (4) 〔2 1 0〕
C面:
(1) 该面过原点,必须沿y轴进行移动,因此x= ∞ ,y=-1,z=∞ (2) 1/x=0,1/y=-1,1/z=0; (3) 不需最小整数化;(4) 〔0 1 0〕
晶胞在三维空间的重复构成点阵
〔4〕晶格常数
在晶胞中建立三维坐标体系, 描述出晶胞的形状与大小
晶胞参数- 晶格常数:a、b、c 棱间夹角:α、β、γ
2 晶系与布拉菲点阵
依据点阵参数 的不同特点划分为七种晶系
(1) 三斜晶系
α≠β≠γ≠90° a≠ b≠ c
复杂单胞 底心单斜
(2) 单斜晶系
α=γ=90°≠β a≠ b≠ c
3 原子半径: r 2 a
4 配位数= 12
4
5 致密度= nv/V=(4×3πr3/4)/a3=0.74
γ-Fe(912~1394℃)、Cu、Ni、Al、Ag 等
——塑性较高
面心立方晶胞中原子半径与晶 格常数的关系
a
r 2a 4
(三)密排六方结构〔 h.c.p〕 〔 了解〕
金属:Zn、Mg、Be、α-Ti、α-Co等
具有光泽:吸收了能量从被激发态回到基态时所 产生的幅射;
良好的塑性:在固态金属中,电子云好似是 一种流动的万能胶,把所有的正离子都结合 在一起,所以金属键并不挑选结合对象,也 无方向性。当一块金属的两局部发生相对位 移时,金属正离子始终“浸泡〞在电子云中, 因而仍保持着金属键结合。这样金属便能经 受较大的变形而不断裂。
1-3-1 金属的晶体结构

2
一、典型金属的晶体结构
最常见的金属晶体结构有三种:面心立方结 构、体心立方结构和密排六方结构。 本节主要讨论原子的排列方式、晶胞内原子 数、点阵常数、原子半径、原子配位数、致密度 和原子间隙大小。 下面分别加以讨论:
3
1、原子排列方式
1) 球体的紧密堆积
① 单一质点的等大球体最紧密堆积,如纯金属晶体。 ② 几种质点的不等大球体的紧密堆积,如离子晶体。
16
2) 密排六方结构
属于六方紧密堆积,以ABABAB…的方式堆积, 从结构中可分析出六方晶胞。 具有这种结构的金属:Be、Mg、Zn、Cd、 -Ti和-Co。
3) 体心立方结构
属于体心立方紧密堆积,原子是以体心立方空间 点阵的形式排列,可分析出体心立方晶胞。
具有这种结构的金属:V、-Fe、Nb、Mo、 Cr和W。
3、晶胞中的原子数
1) 简单立方结构 (SC / Simple cubic)
1 8 1 8
20
2) 体心立方结构
(bcc / Body-centered cubic)
3) 面心立方结构
(fcc / Face-centered cubic)
1 8 1 2 8
1 1 8 6 4 8 2
第三层堆积的特征: 有两种完全不同的堆积方式。 a. 堆积在单层空隙位置 从垂直图面的方向观察,第三层球的位置正好与 第一层相重复。如果继续堆第四层,其又与第二 层重复,第五层与第三层重复,如此继续下去, 这种紧密堆积方式用ABABAB……的记号表示。
六方紧密堆积hcp (ABAB…)
对应ABAB……紧密堆积方式,其球体
r(Ag)=0.288nm, r(Al)=0.286nm,但都不能形成连续 (无限)固溶体,为什么? 3、(1)叙述形成固溶体的影响因素; (2)形成连续固溶体的充分必要条件是什么?
金属材料的晶体结构及其性质

金属材料的晶体结构及其性质金属材料是指由金属元素或合金元素组成的材料,具有优良的导电性能、塑性和韧性,常用于各种工业领域。
而这些特性和性质的背后,与金属材料的晶体结构密不可分。
一、晶体结构晶体结构是指原子在立方、六方、单斜、正交等几何形状中有序排列而形成的三维周期性结构,它决定了金属材料的物理、化学性质。
在实践应用中,常见的金属晶体有面心立方晶体、体心立方晶体、六方密堆晶体等。
1.面心立方晶体面心立方晶体是金属晶体中最常见的结构类型之一,其晶胞中堆积着许多等体积的球形离子,其排列成为面心立方体结构。
面心立方晶体结构中相邻的原子之间的键长为1.28A,原子之间有12个近邻,它的密度较大,但这种密堆积结构存在一定的缺陷,因为它的球形离子之间的间距较小,容易发生塌陷,从而导致材料失去稳定性。
2. 体心立方晶体体心立方晶体是一种另外一种常见的金属晶体结构,其晶胞中有一个球形原子居于体心,被八个等距的球形原子包围。
体心立方晶体结构中相邻原子间的键长为2.06A,与面心立方晶体相比,原子之间的距离较远,原子间的紧密程度相对较低,从而具有较好的稳定性。
由于其晶体结构封闭、稳定,使得体心立方晶体在许多工业领域得到广泛的应用。
3. 六方密堆晶体六方密堆结构,又称密堆六方晶体结构,指的是在轴向上紧密堆积的一种晶胞结构。
在这种结构中,每个原子有12个近邻,六个处于同一层,三个分别居于每个上下相邻层中。
其中除轴向STC键长为2.88A之外,其它键长相等且约为2.49A。
这种类型的晶体结构出现在一些金属中,如石墨和锆。
四、性质晶体结构对金属材料的物理、化学性质有着重要影响。
金属的结构特性决定了它们的多种性质,如导电性能、塑性、热膨胀系数等。
1.导电性金属材料的导电性是由其结晶中的自由电子导致的,而这些自由电子存在于金属晶体结构的价电子带或导带中。
当电场作用在金属晶体中时,导电性能表现为传导电流的能力。
一般地,面心立方晶体结构的金属材料具有更好的导电性能。
金属的晶体结构介绍

金属的晶体结构介绍
一基本概念
固体物质按原子排列的特征分为:
晶体: 原子排列有序,规则,固定熔点,各项异性。
非晶体:原子排列无序,不规则,无固定熔点,各项同性。
如: 金属、合金,金刚石—晶体玻璃,松香、沥青—非晶体
晶格: 原子看成一个点,把这些点用线连成空间格子。
结点: 晶格中每个点。
晶胞: 晶格中最小单元,能代表整个晶格特征。
晶面: 各个方位的原子平面。
晶格常数: 晶胞中各棱边的长度(及夹角), 以A(1A=10-8cm)度量
金属晶体结构的主要区别在于晶格类型,晶格常数。
二常见晶格类型
1 体心立方晶格:Cr 、W、α-Fe、Mo 、V等,特点:强度大,塑性较好,原子数:1/8 X8 +1=2,20多种
2 面心立方晶格: Cu、Ag、Au、Ni、Al、Pb、γ- Fe塑性好。
原子数:4,20多种
3 密排六方晶格:Mg、Zn、Be、β-Cr α-Ti Cd(镉),纯铁在室温高压(130x108N/M2)成ε-Fe,原子数=1/6 x12+1/2 x2+3=6 , 30多种三多晶结构
单晶体:晶体内部的晶格方位完全一致。
多晶体:许多晶粒组成的晶体结构,各项同性。
晶粒:外形不规则而内部晶各方位一致的小晶体。
晶界:晶粒之间的界面。
金属晶体的常见结构

金属晶体的常见结构
金属晶体的常见结构有以下几种:
1. 面心立方(FCC)结构:在这种结构中,金属原子分别位于正方形面的角点和中心,以及正方形面的中心。
每个原子都与12个邻近原子相接触,形成一个紧密堆积的结构。
典型的例子是铜、铝和金。
2. 体心立方(BCC)结构:在这种结构中,金属原子分别位于正方体的角点和正方体的中心。
每个原子都与8个邻近原子相接触,形成一个比较紧密的结构。
铁和钨是常见的具有BCC结构的金属。
3. 密排六方(HCP)结构:在这种结构中,金属原子以一定的方式排列,形成六边形的密排层,其中每个层的原子位于前一层原子的空隙上。
这些层之间存在垂直堆叠,形成一个紧密堆积的结构。
典型的例子是钛和锆。
除了以上三种常见的金属晶体结构外,还有其他特殊的结构,如体心立方密堆积(BCC HCP)和面心立方密堆积(FCC HCP)等。
这些不同的结构对于金属的性质和行为有着重要的影响。
1。
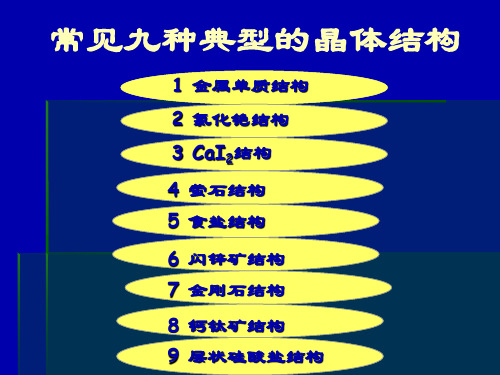
常见九种典型的晶体结构
反萤石型结构
球键图
阳离子四面体配位 阴离子立方体配位
反萤石型结构可看作:阴离子做立方最紧密堆积,阳离 子充填在全部的四面体空隙中。
结构类型 物质名称 萤石(CaF2)
萤石型结 氯化锶(SrCl2)
构
氯化钡(BaCl2)
氟化铅(PbF2)
氧化钾(K2O)
反萤石型 结构
氧化钠(Na2O)
氧化锂(Li2O)
闪锌矿的晶体结构:球键图(左)、配位多面体连接图(右)
结构中,S2- 和Zn2+配位数都是4,配位多面体都 是四面体。四面体共角顶相联。
从图可看出,[SZn4] 四面体([ZnS4] 四面体 也是一样)共角顶联成的 四面体基元层与[111]方 向垂直。
由于S2-和Zn2+都呈配位四面体,所以闪锌矿只用一种配位 多面体结构形式表达(S和Zn互换是一样的)。
(Fe3+(Fe2+Fe3+)2O4)。
当结构中四、八面体孔隙被A2+和B3+无序占据时, 叫混合尖晶石结构,代表晶相是镁铁矿(Fe, Mg)3O4。
具有尖晶石型结构的部分物质
Fe3O4 VMn2O4 NiAl2O4 NiGa2O4 Co3S4 TiZn2O4 γ-Fe2O3 LiTi2O4 CoAl2O4 MgGa2O4 NiCo2S4 VZn2O4 MnFe2O4 MnTi2O4 ZnAl2O4 MnGa2O4 Fe2SiO4 SnMg2O4 MgFe2O4 ZnCr2O4 Co3O4 ZnIn2S4 Ni2SiO4 TiMg2O4 Ti Fe2O4 CoCr2O4 GeCo2O4 MgIn2O4 Co2SiO4 WNa2O4 LiMn2O4 CuMn2O4 VCo2O4 CuV2S4 Mg2SiO4 CdIn2O4
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
rB / rA = 0.15
与面心立方结构相比,这 两种结构的八面体和四面 体的形状完全相似,但位 置不同
四面体间隙 rB /rA = 0.225 八面体间隙 rB / rA =
0.414
A A A A A A A A
Aห้องสมุดไป่ตู้A A A A
A A A A A
B
A
C
等径球体在平面上的最紧密堆积
面心立方最紧密堆积和六方最紧密堆积
球体在空间的堆积是按照 ABAB……的层序来堆积。
这样的堆积中可以取出一个六方晶胞,称为六方最紧密堆
积(A3型)。 另一种堆积方式是按照 ABCABC…… 的堆积方式。 这样的堆积中可以取出一个面心立方晶胞,称为面心立方 最紧密堆积。面心立方堆积中, ABCABC…… 重复层面
2. 晶胞中原子数
每个晶胞所含有的原子数(N)可用下式计算: N=Ni+Nf/2+Nr/m
Ni,Nf,Nr分别表示位于晶胞内部,面心和角顶上的原子数,
m为晶胞类型参数,立方晶系m=8,六方晶系m=6.
体心立方
面心立方
密排六方
1 n 8 1 2 8
1 1 1 1 n 8 6 4 n 12 2 3 6 8 2 6 2
等径球最紧密堆积时,在平面上每个球与6个球相接触, 形成第一层(球心位置标记为A。此时,每3个彼此相接
触的球体之间形成1个弧线三角形空隙,每个球周围有6
个弧线三角形空隙,其中3个空隙的尖角指向图的下方 (其中心位置标记为B),另外3个空隙的尖角指向图的 上方(其中心位置标记为C),这两种空隙相间分布。
3. 原子半径与点阵常数的关系
晶胞中棱边长度a,b,c称为点阵常数。如把原子看作半径为r的刚性球, 则可据几何关系求出点阵常数与r之间的关系。
体心立方
面心立方
密排六方
3a r 4
2a r 4
a r 2
4. 配位数与致密度
配位数和致密度定量地表示原子排列的紧密程度。 配位数(coordination number,CN):晶体结构中任一 原子周围最近且等距离的原子数。 致密度(K):晶胞中原子所占的体积分数,
平行于(111)晶面(A1型) 。
两种最紧密堆积中,每个球体周围同种球体的个数均 为12。
面心立方最紧密堆积
1 6 1 2 3 4 6 5 4
2
3
5
A
1 6
5 4 2
3
B C
面心立方最紧密堆积
A C B A C B A
ABCABC……, 即每三层重复一次
面心立方最紧密堆积
1 6 5
2 3 4
面心立方最紧密堆积
面心立方晶胞 ——面心立方最紧密堆积
C
B A
密排面
六方最紧密堆积
1 2
6 5 4
3
ABAB……的层序堆积
六方最紧密堆积
ABABAB……
每两层重复一次
A B A B A
六方晶胞——六方密堆积
A A 密 B
排 B 面
A A
6.晶体结构中的间隙
刚球模型四面体间隙
刚球模型八面体间隙
四面体间隙:位于由 一个顶角原子和三个
密排六方(A3)hexagonal close-packed lattice→hcp
面心立方点阵
体心立方点阵
密排六方点阵
面心立方(face-centered cubic,fcc)
体心立方(body-centered cubic,bcc)
密排六方(hexagonal close-packed,hcp)
原子半径 体心立方 面心立方
原子数 2
配位数 8 12
致密度 0.68
r
3 a 4
2 r a 4
1 r a 2
4
0.74
密排六方
6
12
0.74
5. 晶体中原子的堆垛方式
面心立方和密排六方结构的致密度均为0.74,是纯金属中 最密集的结构 面心立方与密排六方虽然晶体结构不同,但配位数与致密 度却相同,为搞清其原因,必须研究晶体中原子的堆垛方式 面心立方与密排六方的最密排面原子排列情况完全相同, 但堆垛方式不一样
典型金属的晶体结构
1. 三种典型金属晶体结构 2. 晶胞中原子数 3. 原子半径与点阵常数的关系 4. 配位数与致密度 5. 晶体中原子的堆垛方式 6. 晶体结构中的间隙
1. 三种典型金属晶体结构
面心立方(A1)face-centred cubic lattice→fcc
常见金属晶体 的结构
体心立方(A2)body-centred cubic lattice→bcc
nv K V
式中,n为晶胞原子数,v原子体积,V晶胞体积。
面心立方配位数为12
4 2 3 4 ( a) nv 3 4 K 0.74 3 V a
体心立方配位数为8
4 3 2 ( a)3 nv 3 4 K 0.68 3 V a
密排六方配位数为12
4 a 3 4 ( ) nv 3 2 0.74 K V 3 2a 3
面中心原连接成的正
四面体中心,数目为8。 rB / rA =0.225
八面体间隙:位置是 立方体的正中心和每 一个棱边中心,其数 目为4. rB / rA = 0.414
四面体间隙:位于
两个体心原子和两
个顶角原子所组成 的四面体中心,数 目为12。 rB / rA = 0.29
八面体间隙:位于 立方体每个面中心 和每根棱中间,数 目为6。
