酸碱中和反应PPT
合集下载
《酸和碱的中和反应》课件
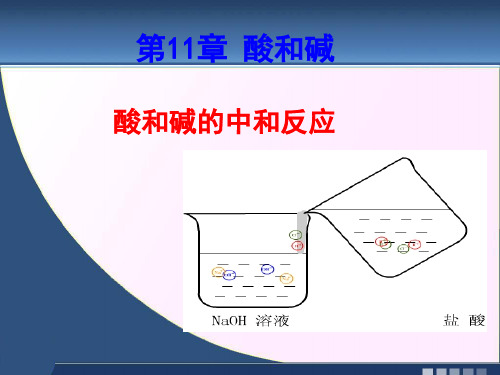
蜜蜂与马蜂
蜜蜂
被蜜蜂这蛰后,用肥 皂水或氨水清洗
马蜂
被马蜂蛰后,用食 醋止痛止痒
被同样属于蜂的两种蜂蜇,为什么一种 用碱液处理,一种用酸液处理?
• 蜜蜂毒液显酸性,马蜂毒液显碱性。 • 氨水是一种弱碱 ,肥皂水也是显碱性的 ;
食醋是一种酸溶液。 原因:
肥皂水或氨水与蜜蜂的酸性毒液发生中 和反应,食醋与马蜂的碱性毒液发生中和反 应。
结论与提升
1、氢氧化钠溶液与稀盐酸混合伴随:能量的 变化(放热);反应物减少了;生成了新物质。
2、反应实质:是盐酸中的H+与氢氧化钠溶 液中的OH-结合生成了水。
3、无明显现象反应证明方法: (1)证明有新物质生成【检验生成物】 (2)证明反应物减少
NaOH与稀盐酸反应后溶液中溶质的组成探究:
溶液中溶质 实验步骤 实验现象 结论
稀盐酸
氢 氧 化 钠
(1)你认为他得出的结论是否正确 不正确 , 理由是 如果盐酸滴加过量,滴入酚酞试液也不变色。
(2)请你另设计一个实验,探究上述烧杯中的溶 液是否恰好完全反应,填写下表:
实验方法
可能观察到 结 论 的现象
①取样,滴加紫色石蕊试液 试液变红 盐酸过量
②取样,滴加紫色石蕊试液 试液不变红 恰好中和
PH试纸等
变红
无色
【结论】稀盐酸与氢氧化钠溶液混合后氢氧化钠
被消耗了,说明反应。
【实验探究三】探究新物质的生成
【实验仪器】玻璃棒 、酒精灯 【实验药品】稀盐酸与氢氧化钠溶液的混合液 (探究二的反应液)
【结论】稀盐酸与氢氧化钠溶液混合后有新物 质生成,会反应。
反应前后溶液中离子发生了怎样的变化?
稀盐酸与氢氧化钠溶液反应的微观探究
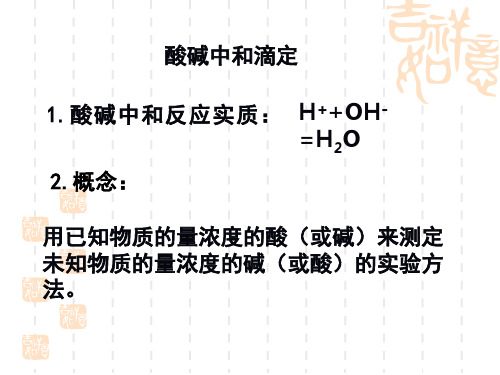
酸碱中和滴定ppt课件

作指示剂 B.溶液呈中性,只能选用石蕊作指示剂 C.溶液呈碱性,可选用 甲基橙或酚酞作指示剂 D.溶液呈碱性,只能选用酚酞作指示剂
四、实验步骤
1.滴定前准备
2.滴定操作 用左手控制滴定管活塞,逐滴放出溶液,右手摇动锥形瓶, 两眼注视锥形瓶内溶液颜色变化。
控制活塞
摇动锥形瓶
锥形瓶 内溶液颜色变化
3.终点判断 当滴入最后半滴×××标准溶液后,溶液由××色变成××色,
【课堂练习】
1.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,从下表中选出正确 选项( C )
序号
① ② ③ ④
锥形瓶中 滴定管中 选用指示 选用滴定
溶液
溶液
剂
管
碱
酸
石蕊
甲
酸
碱
酚酞
甲
碱
酸
甲基橙
甲
酸
碱
酚酞
乙
A.①② B.②③ C.③④ D.②④
2.用0.10mol/LNaOH溶液滴定未知浓度的CH3COOH溶液,恰好完全反应 时,下列叙述中正确的是( D ) A.溶液呈中性,可选用甲基橙或酚酞
带玻璃球 的橡胶管
注意: 酸式滴定管:酸性、强氧化性试剂 碱式滴定管:碱性试剂
【课堂练习】
1.下列所述仪器“0”刻度位置正确的是( B )
A.在量筒的上端
B.在滴定管上端
C.容量瓶上端
D.在托盘天平刻度尺的右边2.50ml的滴定管盛有
溶液,液面恰好在20.0处,若把滴定管中溶液全部
C 排出,则体积( )
液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;D.取标准KOH
溶液注入碱式滴定管至“0”刻度以上2~3 mL;E.调节液面至“0”或“0”以
四、实验步骤
1.滴定前准备
2.滴定操作 用左手控制滴定管活塞,逐滴放出溶液,右手摇动锥形瓶, 两眼注视锥形瓶内溶液颜色变化。
控制活塞
摇动锥形瓶
锥形瓶 内溶液颜色变化
3.终点判断 当滴入最后半滴×××标准溶液后,溶液由××色变成××色,
【课堂练习】
1.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,从下表中选出正确 选项( C )
序号
① ② ③ ④
锥形瓶中 滴定管中 选用指示 选用滴定
溶液
溶液
剂
管
碱
酸
石蕊
甲
酸
碱
酚酞
甲
碱
酸
甲基橙
甲
酸
碱
酚酞
乙
A.①② B.②③ C.③④ D.②④
2.用0.10mol/LNaOH溶液滴定未知浓度的CH3COOH溶液,恰好完全反应 时,下列叙述中正确的是( D ) A.溶液呈中性,可选用甲基橙或酚酞
带玻璃球 的橡胶管
注意: 酸式滴定管:酸性、强氧化性试剂 碱式滴定管:碱性试剂
【课堂练习】
1.下列所述仪器“0”刻度位置正确的是( B )
A.在量筒的上端
B.在滴定管上端
C.容量瓶上端
D.在托盘天平刻度尺的右边2.50ml的滴定管盛有
溶液,液面恰好在20.0处,若把滴定管中溶液全部
C 排出,则体积( )
液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;D.取标准KOH
溶液注入碱式滴定管至“0”刻度以上2~3 mL;E.调节液面至“0”或“0”以
酸碱中和滴定实验-PPT课件

22
(4)溶液变色因局部过量而实际未达终点,立即读数会造成 V(KMnO4)减小,故结果偏低。
答案:(1)把游码拨回零处 镊子 (2)酸式 滴入一滴酸 性 KMnO4 溶液,溶液由无色变为浅紫色,且半分钟不褪色
(3)26W7 mol·L-1 (4)偏低
23
•
感 谢 阅
读感 谢 阅
读
13
名师点拨:在滴定过程中,指示剂略多加了几滴,一般不 影响实验结果。NaOH 与 CH3COOH 恰好完全反应,生成的 CH3COONa 溶液呈碱性,而甲基橙的变色范围是在 pH 约为 3.1~4.4 中,当用甲基橙指示滴定终点时,还未完全反应,使 实验结果产生误差,应选用酚酞作指示剂。
答案:C
应用________拨动游码。
(2)若将 W g Na2C2O4 配成 100 mL 标准溶液,移取 20.00 mL 置于锥形瓶中,则酸性 KMnO4 溶液应装在 ________(填“酸式”或“碱式”)滴定管中。判断滴定达到终
点的现象是__________________________________________。
16
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程
式如下,请将相关物质的化学计量数及化学式填写在方框里。
□MnO
-
4
+
□H2O2
+
□H
+
□Mn2 + + □H2O +
□
(3) 滴定时,将高锰酸钾标准溶液注入________( 填“酸
式 ” 或 “ 碱 式 ”) 滴 定 管 中 。 滴 定 到 达 终 点 的 现 象 是 _____________________________________________________ _________________。
人教版九年级下册化学 《酸和碱的中和反应》PPT精品课件(第1课时)

稀硫酸与氢氧化钡溶液反应 生成白色沉淀
发生了反应
H2SO4+Ba(OH)BaSO4↓+2H2O
盐酸+氢氧化钠 无明显现象。
盐酸和氢氧化钠有没 有发生反应呢?怎样
验证?
实验10-8
在烧杯中加入5mL氢氧化钠溶液,滴入几滴酚酞溶液。再用滴管慢慢滴入稀盐酸, 并不断搅拌溶液,至溶液颜色恰好变成无色为止。
D.稀盐酸与氢氧化钠溶液发生的反应是放热反应
感谢各位的聆听
无色酚 酞溶液
振荡
NaOH 溶液
稀盐酸
现象:氢氧化钠溶液中滴加酚酞后溶液显红色,随着滴加盐酸,颜色逐渐消 失至无色。
讨论
1、酚酞在实验中起什么作用? 借以判断反应有无发生
2、什么时候酸和碱恰好完全反应? 溶液刚好由红色变为无色
反应前后溶液中离子发生了怎样的变化?
盐酸与氢氧化钠溶液混合后,氢离子(H+)和氢氧根离子(OH-)结合成了水分子, 导致溶液原有的酸、碱性相互“中和”。
HCl+KOH=KCl+H2O 2HCl+Ca(OH)2=CaCl2+2H2O
H2SO4+2KOH=K2SO4+2H2O H2SO4+2NaOH=Na2SO4+2H2O
金属离子
酸根离子
盐
我们化学上所说的“盐”,是否就是我们日常生活中所说的“盐”?
由金属离子(或铵根离子)和酸根离子构成的化合物
例如:NaCl、Na2CO3、CaCO3、KMnO4、CuSO4、Fe(NO3)3、NaHCO3、 NH4NO3
第十单元 酸和碱
酸和碱的中和反应(第1课
时
)
目录 CONTENTS
酸碱中和滴定实验ppt课件.ppt
C(酸)×V(酸) =化学计量数之比 C(碱)×V(碱)
讨论:运用这种方法的关键问题是什么?
4.关键: ①准确测出参加反应的两种溶液的体积。
②准确判断中和反应是否恰好进行完全。
思考:测定溶液体积的仪器有哪些? 量筒 滴定管:酸式滴定管和碱式滴定管
想一想:
1、如何判断酸式滴定管和碱式滴定管?
2、量筒和滴定管的“0”刻度位置是否一致?
思考:如果是强碱和弱酸中和滴定又该选择 什么指示剂?
结论:根据达到终点后溶液的酸碱性来选 变色范围尽可能与所生成盐的酸碱性范围一致 浅变深更好
练一练
1、酸碱恰好完全中和时,它们的( D)一定相等。
A、质量
B、物质的量
C、物质的量浓度
D、H+和OH-的物质的量
2、物质的量浓度相同、体积也相同的一元酸和一元
碱相互中时,溶液显什么性( D )
A、显酸性B、显碱性C Nhomakorabea显中性D、酸碱性无法判断
练一练
3.用已知物质的量浓度的NaOH溶液滴定未 知物质的量浓度的HCl溶液,一般选用(酚酞 ) 作指示剂,用已知物质的量溶液的HCl溶液滴 定未知物质的量浓度的NaOH溶液,一般选用 (甲基)橙作指示剂。
5、实验仪器
解: HCl 1mol
+
NaOH = NaCl+ H2O
1mol
c(HCl)•V[HCl(aq)] c(NaOH)•V[NaOH(aq)]
c(NaOH)= c(HCl ) •V[HCl (aq)] 1mol
V[NaOH (aq)] 1mol
= 0.1100mol / L 0.02900L
0.02300L
V[NaOH (aq)] 1mol
讨论:运用这种方法的关键问题是什么?
4.关键: ①准确测出参加反应的两种溶液的体积。
②准确判断中和反应是否恰好进行完全。
思考:测定溶液体积的仪器有哪些? 量筒 滴定管:酸式滴定管和碱式滴定管
想一想:
1、如何判断酸式滴定管和碱式滴定管?
2、量筒和滴定管的“0”刻度位置是否一致?
思考:如果是强碱和弱酸中和滴定又该选择 什么指示剂?
结论:根据达到终点后溶液的酸碱性来选 变色范围尽可能与所生成盐的酸碱性范围一致 浅变深更好
练一练
1、酸碱恰好完全中和时,它们的( D)一定相等。
A、质量
B、物质的量
C、物质的量浓度
D、H+和OH-的物质的量
2、物质的量浓度相同、体积也相同的一元酸和一元
碱相互中时,溶液显什么性( D )
A、显酸性B、显碱性C Nhomakorabea显中性D、酸碱性无法判断
练一练
3.用已知物质的量浓度的NaOH溶液滴定未 知物质的量浓度的HCl溶液,一般选用(酚酞 ) 作指示剂,用已知物质的量溶液的HCl溶液滴 定未知物质的量浓度的NaOH溶液,一般选用 (甲基)橙作指示剂。
5、实验仪器
解: HCl 1mol
+
NaOH = NaCl+ H2O
1mol
c(HCl)•V[HCl(aq)] c(NaOH)•V[NaOH(aq)]
c(NaOH)= c(HCl ) •V[HCl (aq)] 1mol
V[NaOH (aq)] 1mol
= 0.1100mol / L 0.02900L
0.02300L
V[NaOH (aq)] 1mol
(九年级化学)第十单元课题2酸和碱的中和反应课件

减少污染
中和反应可以减少酸性或碱性废 水的排放,降低对水体的污染。
节约资源
通过中和反应,可以回收和再利用 酸性或碱性物质,减少资源浪费。
生态平衡
中和反应有助于维持生态平衡,保 护生物多样性。
中和反应的未来发展
绿色化学
随着绿色化学的发展,中和反应 将更加注重环保和可持续发展,
减少对环境的负面影响。
新技术的应用
中和反应的实验结果
实验结果分析
根据实验数据,分析酸和 碱的浓度、中和反应过程 中溶液的pH值变化以及最 终溶液的酸碱性。
绘制曲线
将实验数据整理成曲线图, 展示酸碱滴定过程中pH值 的变化趋势。
结论总结
根据实验结果,总结酸和 碱的中和反应规律,理解 中和反应在实际中的应用。
中和反应的化学方程式
酸碱中和反应的化学方程式
制药行业
中和反应是制药行业中的重要步骤, 用于制备药物、药物中间体和原料药, 如通过中和反应控制药物的pH值和稳 定性。
化工行业
环保行业
中和反应可用于处理酸性或碱性废水, 调节废水的pH值,使其达到排放标准。
在化工行业中,中和反应广泛应用于 化学品的合成和生产,如塑料、染料、 涂料等。
中和反应对环境的影响
如氢氧化钠与盐酸反应生成氯化钠和水。
酸碱指示剂
酸碱指示剂是用来指示溶液的酸 碱性的一种物质,常用的有紫色
石蕊溶液和无色酚酞溶液。
酸能使紫色石蕊溶液变红,碱能 使紫色石蕊溶液变蓝,中性物质
不能使紫色石蕊溶液变色。
无色酚酞溶液遇酸不变色,遇碱 变红,中性物质不能使无色酚酞
溶液变色。
03
中和反应的过程与实验
04
酸能与碱反应生成盐和 水:如盐酸与氢氧化钠 反应生成氯化钠和水。
中和反应可以减少酸性或碱性废 水的排放,降低对水体的污染。
节约资源
通过中和反应,可以回收和再利用 酸性或碱性物质,减少资源浪费。
生态平衡
中和反应有助于维持生态平衡,保 护生物多样性。
中和反应的未来发展
绿色化学
随着绿色化学的发展,中和反应 将更加注重环保和可持续发展,
减少对环境的负面影响。
新技术的应用
中和反应的实验结果
实验结果分析
根据实验数据,分析酸和 碱的浓度、中和反应过程 中溶液的pH值变化以及最 终溶液的酸碱性。
绘制曲线
将实验数据整理成曲线图, 展示酸碱滴定过程中pH值 的变化趋势。
结论总结
根据实验结果,总结酸和 碱的中和反应规律,理解 中和反应在实际中的应用。
中和反应的化学方程式
酸碱中和反应的化学方程式
制药行业
中和反应是制药行业中的重要步骤, 用于制备药物、药物中间体和原料药, 如通过中和反应控制药物的pH值和稳 定性。
化工行业
环保行业
中和反应可用于处理酸性或碱性废水, 调节废水的pH值,使其达到排放标准。
在化工行业中,中和反应广泛应用于 化学品的合成和生产,如塑料、染料、 涂料等。
中和反应对环境的影响
如氢氧化钠与盐酸反应生成氯化钠和水。
酸碱指示剂
酸碱指示剂是用来指示溶液的酸 碱性的一种物质,常用的有紫色
石蕊溶液和无色酚酞溶液。
酸能使紫色石蕊溶液变红,碱能 使紫色石蕊溶液变蓝,中性物质
不能使紫色石蕊溶液变色。
无色酚酞溶液遇酸不变色,遇碱 变红,中性物质不能使无色酚酞
溶液变色。
03
中和反应的过程与实验
04
酸能与碱反应生成盐和 水:如盐酸与氢氧化钠 反应生成氯化钠和水。
酸碱中和反应(共13张PPT)

第十一页,共13页。
问题(wèntí)(二)
此药中含有(hán yǒu)氢氧化铝
试写出胃康—U治胃酸过多的原理(yuánlǐ)。
3HCl+Al(OH)3=AlCl3+3H2O
第十二页,共13页。
练习(liànxí):完成下列反应并指出哪种 是中和反应( )
A、CaCO3 + 2HCl —— B、Fe2O3 + 3H2SO4 —
CaCl2+H2O+CO2 Fe2(SO4)3 + 3H2O
C、H2SO4 + NaOH ——
2
D、CO2 + Ca(OH)2 ——
Na2SO4 + 2H2O CaCO3 ↓ + H2O
第十三页,共13页。
第六页,共13页。
反应(fǎnyìng)的现象
酚酞试液
稀盐酸
H溶液(róngyè) 现象1
现象2
无色(wú sè)
红色
无色
第七页,共13页。
3、中和反应中加酚酞试液的目 的(mùdì)是什么?
是指示中和反应(fǎnyìng)是否 进行
第八页,共13页。
中和反应(fǎnyìng)的实质
是酸中的氢离子(lízǐ)和碱中 的氢氧根离子(lízǐ)结合生成 水分子的过程
第 五 节 中 和 反 应 pH 常见的碱 碱的通性
第一页,共13页。
课题1: 和 之间 会发生(fāshēng)什 么反应
第二页,共13页。
酸和碱之间的反应
用什么方法可以证明酸和碱之 可以在酸或碱中加入(jiārù)指示剂以显示它的存在,然后加入(jiārù)碱或酸直到溶液变为另一种颜色或者褪色。
问题(wèntí)(二)
此药中含有(hán yǒu)氢氧化铝
试写出胃康—U治胃酸过多的原理(yuánlǐ)。
3HCl+Al(OH)3=AlCl3+3H2O
第十二页,共13页。
练习(liànxí):完成下列反应并指出哪种 是中和反应( )
A、CaCO3 + 2HCl —— B、Fe2O3 + 3H2SO4 —
CaCl2+H2O+CO2 Fe2(SO4)3 + 3H2O
C、H2SO4 + NaOH ——
2
D、CO2 + Ca(OH)2 ——
Na2SO4 + 2H2O CaCO3 ↓ + H2O
第十三页,共13页。
第六页,共13页。
反应(fǎnyìng)的现象
酚酞试液
稀盐酸
H溶液(róngyè) 现象1
现象2
无色(wú sè)
红色
无色
第七页,共13页。
3、中和反应中加酚酞试液的目 的(mùdì)是什么?
是指示中和反应(fǎnyìng)是否 进行
第八页,共13页。
中和反应(fǎnyìng)的实质
是酸中的氢离子(lízǐ)和碱中 的氢氧根离子(lízǐ)结合生成 水分子的过程
第 五 节 中 和 反 应 pH 常见的碱 碱的通性
第一页,共13页。
课题1: 和 之间 会发生(fāshēng)什 么反应
第二页,共13页。
酸和碱之间的反应
用什么方法可以证明酸和碱之 可以在酸或碱中加入(jiārù)指示剂以显示它的存在,然后加入(jiārù)碱或酸直到溶液变为另一种颜色或者褪色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.用于医药
⑴人的胃液里含有适量的盐酸,可以帮助消化。 胃酸过多,可以服用碱性物质的药物,以中和过多 的胃酸。
如胃药“胃舒平”中含有氢氧化铝 3HCl+Al(OH)3====AlCl3+3H2O 也可服小苏打(碳酸氢钠)——NaHCO3 HCl+NaHCO3====NaCl+H2O+CO2↑ ⑵蚊虫能分泌出蚁酸,从而使皮肤肿痛。 如果涂一些含有碱性物质(如肥皂水或NH3· 2O) H 等药水,就可以减轻痛庠。 讨论:举出生活中利用中和反应的实例。
变红色
留下白色固体
活动与探究
⑴如图10-13所示,在烧杯中加入10mL氢氧化钠溶液, 讨论:玻璃片上的物质是氢氧化钠吗? 滴入几滴酚酞溶液,测一下氢氧化钠溶液及稀盐酸的 温度。再用滴管慢慢滴入稀盐酸,并不断搅拌溶液, 为什么? 至溶液颜色恰好变成无色为止。 ⑵取2滴上述反应后的无色溶液滴在玻璃片上,使液 体蒸发,观察玻璃片上的现象。 不是氢氧化钠,是氯化钠。
实验方法
⑴取样,滴入紫色石蕊试液
可能观察到的现象 试液变红色
结 论
酸过量
复习巩固: 2NaOH+CO2===Na2CO3+H2O 8.实验室有部分变质的氢氧化钠固体。现取该固体 样品10g,加入100g稀盐酸中,恰好完全反应,反应 后溶液的质量为107.8g。求: ⑴生成气体的质量。⑵该样品中氢氧化钠的质量。
2KOH + H2SO4 == K2SO4 + 2H2O
Ca(OH)2 + 2HCl == CaCl2 +2 H2O
Cu(OH)2+H2SO4 == CuSO4 +2H2O
1 .盐:含有金属离子和酸根离子的化合物, 叫做盐。 盐→金属离子+酸根离子 如氯化钠、氯化钙、硫酸铜等,都属于盐。 注意:中和反应 NaCl==Na++Cl是放热反应。 CuSO4==Cu2++SO422++2ClCaCl2==Ca 2.中和反应:酸与碱作用生成盐和水的反应,叫做 中和反应。 2HCl+Ca(OH)2====CaCl2+2H2O H2SO4+2NaOH====Na2SO4+2H2O
谢谢各位同学的合作学习!
下水道若为金属管道,盐酸会使其腐蚀; 并污染水。应氢氧化铝 [Al(OH) 3 ],它在人的胃内起什么作用?试写出 反应的化学方程式。
Al(OH)3能中和胃中过量的盐酸
Al(OH)3+3HCl=AlCl3+3H2O
4.一些国家正在试用碳酸水浇灌某些植物,其作 用是 碳酸 并能分解放出CO2 (BC )
( B)
( B)
复习巩固:
7.如右图所示,小田同学在进行酸碱中和反 应的实验时,向烧杯中的氢氧化钠溶液滴加稀 盐酸一会儿后,发现忘记了滴加指示剂。为了 确定盐酸与氢氧化钠是否恰好完全反应,小田 从烧杯中取了少量反应后的溶液于一支试管中, 并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液 不变色。于是她得出“两种物质已恰好完全中和”的结论。 ⑴你认为她得出的结论是否正确_________,理由是 不正确 ___________________________ 如果盐酸过量,滴入酚酞试液也不会变色 ⑵请你另设计一个实验,探究上述烧杯中的溶液是否恰好完 全中和,填写下表。
A.调节土壤的pH,改良酸性土壤 B.调节土壤的pH,改良碱性土壤 C.促进植物的光合作用D.在植物上方形成温室
复习巩固: 5.下列反应中,肯定能生成水的是 A.化合反应 B.中和反应 C.分解反应 D.置换反应 6.下列关于物质的用途的叙述不正确的是 A.盐酸可用来除铁锈 B.稀硫酸在实验室里常用作干燥剂 × C.氢氧化钠可用作制肥皂和造纸工业 D.熟石灰可用来改良酸性土壤
二、中和反应在实际中的应用
1 .改变土壤的酸碱性
可以利用中和反应,在土壤中加入酸性或碱性物质, 以调节土壤的酸碱性。
人们将熟石灰加入土壤以中和酸性。 2.处理工厂的废水 例如,硫酸厂的污水中含有硫酸等杂质, 可以用熟石灰进行中和处理。 你能写出该反应的化学方程式吗? H2SO4+ Ca(OH)2====CaSO4+2H2O 因为熟石灰价格便宜,处理污水成本低。
学完本课题你应该知道
1、酸和碱能发生中和反应,生成盐和水。
2、酸碱中和反应在生活和生产中有广泛
的应用。 3、盐是在水溶液中能解离出金属离子和
酸根离子的化合物
复习巩固:1.用适量盐酸可以将热水瓶胆壁上的 水垢[主要成分是Mg(OH)2和CaCO3]除去。说明去 垢的原理,写出有关的化学方程式。 盐酸将不溶性的Mg(OH)2和CaCO3生成可 溶性的氯化镁和氯化钙而便于洗去。 Mg(OH)2+2HCl=MgCl2+2H2O CaCO3+2HCl=CaCl2+CO2↑+H2O 2.如果将实验室残留的盐酸直接倒入下水道,会 造成什么危害?应如何处理废盐酸?
因为它和盐酸发生了化学反应:
NaOH+HCl===NaCl+H2O
中和反应的微观示意图
酸 性 中和反应能改变溶液的酸碱性! 消失的粒子: H+、OH碱 性 反应前 中 性 恰好完全反应后 H+ + OH- —— H2O 生成的粒子: H2O分子
中和反应的微观实质:
练习:写出下列反应的化学方程式
1、氢氧化钾和 硫酸反应 2、氢氧化钙和 盐酸反应 3、氢氧化铜和 硫酸反应
解:生成CO2的质量为10g+100g-107.8g=2.2g 设样品中有碳酸钠的质量为x Na2CO3+2HCl==2NaCl+H2O+CO2↑ 106 44 x 2.2g 106 44 106×2.2g —— = —— X = ———— = 5.3g x 2.2g 44 氢氧化钠的质量为10g-5.3g = 4.7g 答:生成CO22.2g,样品中有NaOH4.7g。
