酸碱中和反应课件.
合集下载
10.2 酸和碱的中和反应课件-九年级化学人教版下册

5.“用微观的眼光看世界”是我们学习化学的重要思想方法,回答下列问题: (1)稀硫酸和氢氧化钠溶液发生反应的微观过程如图所示。从微观角度分析该反应 能 发 生 的 原 因 是 酸 中 的 ____氢__离_子_______ 和 碱 中 的 _____氢__氧_根__离_子________ 结 合 生 成 了 ____水_分__子______,反应的化学方程式是__H__2S_O__4_+__2_N_a_O__H_=_=_=_N__a_2_S_O_4_+__2_H_2_O__。 (2) 为了准确控制反应的进度,可先向氢氧化钠溶液中加入几滴无色酚酞溶液,当 二者恰好完全反应时,溶液的颜色变化是_____由_红__色_变__成_无__色___________,此时溶液中的 溶质是___氢__氧_根__离_子______。
• 被黄蜂蜇到,毒液呈碱性,可涂食醋
思考讨论
探究—洗发剂和护发剂的酸碱性
健康的头发
受损伤的头发
学完本课你应该知道
酸 和 碱 的 中 和 反应 应用
中和反应:酸+碱 盐+水
改良酸性或碱性土壤应用
1.下列应用与中和反应原理无关的是( B )
A.服用含Al(OH)3的药物,治疗胃酸过多症 B.用稀硫酸除去铁钉表面的铁锈 C.用NaOH溶液洗涤石油产品中的残余硫酸 D.用熟石灰改良酸性土壤
二 中和反应在实际中的应用
• 1.改变土壤的酸碱性
熟石灰
H2SO4+ Ca(OH)2 = CaSO4 + 2H2O 改良时能否用NaOH? 碱性太强,价格太贵
思考与练习
• 2.处理工厂的废水
用熟石灰处理
• 2.处理工厂的废水
方法1:可用熟石灰 进行中和处理。 方法2:在废硫酸中加入 废铁(硫酸亚铁可用来 做动物的食品添加剂。)
第19讲《中和反应》ppt课件(含答案)

应用
注意
酸碱性 ,却无法衡量酸、碱性的强弱程度。 酸碱指示剂只能测量溶液的___________ pH 表示,可以用_______ pH试纸 测量。 酸碱度表示溶液酸性或碱性强弱的程度,常用____ 1.溶液的酸碱度与pH的关系 强 ; pH____7 pH____7 < , 溶 液 显 酸 性 , pH 越 小 , 酸 性 越 ____ = ,溶液显中性; 强 。 pH____7 > ,溶液显碱性,pH越大,碱性越____ 2.测定溶液pH的方法 pH试纸 上,将试纸呈现的颜色与 ____________ 标准比色卡 用玻璃棒蘸取待测溶液点在 ________ 酸碱度 。 对照,就可以粗略地确定溶液的_________ 【注意】(1)用pH试纸测定溶液的酸碱度时,pH试纸不能用水润湿,否则会使 测定结果不准确。 (2)不能将pH试纸直接放入待测溶液中,否则会污染试剂。
pH变
化及反 应后的 溶质
(1)改良土壤的酸碱性。如用熟石灰中和酸性土壤。 (2)处理工厂的废水。如硫酸厂的污水可用熟石灰进行中和处理,化学方程式为H2SO4+ Ca(OH)2===CaSO4+2H2O (3)用于医疗。如用氢氧化铝中和人体内过多的胃酸,化学方程式为Al(OH)3+3HCl===AlCl3+ 3H2O,人们被蚊虫叮咬后(蚊虫能向人体内分泌蚁酸),可用一些碱性的物质进行涂抹(如肥皂、 纯碱溶液等) ①中和反应的产物是盐和水,但有盐和水生成的反应不一定是中和水反应,如CO2+ 2NaOH===Na2CO3+H2O就不是中和反应 ②中和反应属于复分解反应,不是基本反应类型 ③中和反应实验中指示剂的选择:一般选用无色酚酞溶液。指示剂如果选紫色石蕊溶液,紫色 石蕊溶液在碱溶液中呈蓝色,在中性溶液中呈紫色,蓝色与紫色间没有明显的界限
中和反应课件ppt

中和反应在生活中常被用于降低碱性食物的碱性,使其更适口并符合酸碱平 衡的饮食需求。例如,在烹饪过程中使用酸性食材如柠檬汁、醋等来中和面 食等食物中的碱性成分。
处理废碱液
在工业生产和实验室中会产生大量的废碱液,中和反应可以用来处理这些废 碱液以减少对环境的污染。例如,向废碱液中加入酸性物质如盐酸回收再利 用。
中和反应的速率方程可以用来描述中和反应的速率与反应物浓 度的关系。
中和反应的速率方程也可以用来预测一定条件下反应的速率, 帮助人们更好地理解和控制化学反应。
04
中和反应的平衡
中和反应的平衡概述
酸碱反应的平衡常数表达式:$K_{a}= \frac{c(H^{+}) \cdot c({OH}^{})}{c(HA)}$ 酸碱反应的平衡常数与温度有关
中和反应在化学实验中的应用
检测酸碱物质
中和反应可以用于检测酸或碱的存在。例如,用酚酞指示剂在中性溶液中显淡红 色,加入一滴酸溶液后颜色消失,而加入一滴碱性溶液时颜色变为粉红色。
分离提纯
中和反应在化学实验中常被用来分离提纯某些物质。例如,通过加入某种酸或碱 使杂质离子与该离子反应形成沉淀物,从而除去杂质离子。
中和反应的能量变化计算
酸碱反应平衡常数
酸碱反应平衡常数是衡量酸碱反应进行程度的物理量,可以通过实验测定,也可 以通过计算得出。
中和反应热效应计算
中和反应热效应是衡量中和反应能量变化的重要物理量,可以通过中和反应平衡 常数计算得出。
中和反应的能量变化图
中和反应能量变化曲线图
中和反应能量变化曲线图可以形象地展示中和反应过程中能 量的变化情况。
化学反应,从而确定被测物质的浓度和含量。
中和反应的速率常数
中和反应的速率常数是指反应速度与反应物浓度的比例 系数。
处理废碱液
在工业生产和实验室中会产生大量的废碱液,中和反应可以用来处理这些废 碱液以减少对环境的污染。例如,向废碱液中加入酸性物质如盐酸回收再利 用。
中和反应的速率方程可以用来描述中和反应的速率与反应物浓 度的关系。
中和反应的速率方程也可以用来预测一定条件下反应的速率, 帮助人们更好地理解和控制化学反应。
04
中和反应的平衡
中和反应的平衡概述
酸碱反应的平衡常数表达式:$K_{a}= \frac{c(H^{+}) \cdot c({OH}^{})}{c(HA)}$ 酸碱反应的平衡常数与温度有关
中和反应在化学实验中的应用
检测酸碱物质
中和反应可以用于检测酸或碱的存在。例如,用酚酞指示剂在中性溶液中显淡红 色,加入一滴酸溶液后颜色消失,而加入一滴碱性溶液时颜色变为粉红色。
分离提纯
中和反应在化学实验中常被用来分离提纯某些物质。例如,通过加入某种酸或碱 使杂质离子与该离子反应形成沉淀物,从而除去杂质离子。
中和反应的能量变化计算
酸碱反应平衡常数
酸碱反应平衡常数是衡量酸碱反应进行程度的物理量,可以通过实验测定,也可 以通过计算得出。
中和反应热效应计算
中和反应热效应是衡量中和反应能量变化的重要物理量,可以通过中和反应平衡 常数计算得出。
中和反应的能量变化图
中和反应能量变化曲线图
中和反应能量变化曲线图可以形象地展示中和反应过程中能 量的变化情况。
化学反应,从而确定被测物质的浓度和含量。
中和反应的速率常数
中和反应的速率常数是指反应速度与反应物浓度的比例 系数。
《酸和碱的中和反应》课件
蜜蜂与马蜂
蜜蜂
被蜜蜂这蛰后,用肥 皂水或氨水清洗
马蜂
被马蜂蛰后,用食 醋止痛止痒
被同样属于蜂的两种蜂蜇,为什么一种 用碱液处理,一种用酸液处理?
• 蜜蜂毒液显酸性,马蜂毒液显碱性。 • 氨水是一种弱碱 ,肥皂水也是显碱性的 ;
食醋是一种酸溶液。 原因:
肥皂水或氨水与蜜蜂的酸性毒液发生中 和反应,食醋与马蜂的碱性毒液发生中和反 应。
结论与提升
1、氢氧化钠溶液与稀盐酸混合伴随:能量的 变化(放热);反应物减少了;生成了新物质。
2、反应实质:是盐酸中的H+与氢氧化钠溶 液中的OH-结合生成了水。
3、无明显现象反应证明方法: (1)证明有新物质生成【检验生成物】 (2)证明反应物减少
NaOH与稀盐酸反应后溶液中溶质的组成探究:
溶液中溶质 实验步骤 实验现象 结论
稀盐酸
氢 氧 化 钠
(1)你认为他得出的结论是否正确 不正确 , 理由是 如果盐酸滴加过量,滴入酚酞试液也不变色。
(2)请你另设计一个实验,探究上述烧杯中的溶 液是否恰好完全反应,填写下表:
实验方法
可能观察到 结 论 的现象
①取样,滴加紫色石蕊试液 试液变红 盐酸过量
②取样,滴加紫色石蕊试液 试液不变红 恰好中和
PH试纸等
变红
无色
【结论】稀盐酸与氢氧化钠溶液混合后氢氧化钠
被消耗了,说明反应。
【实验探究三】探究新物质的生成
【实验仪器】玻璃棒 、酒精灯 【实验药品】稀盐酸与氢氧化钠溶液的混合液 (探究二的反应液)
【结论】稀盐酸与氢氧化钠溶液混合后有新物 质生成,会反应。
反应前后溶液中离子发生了怎样的变化?
稀盐酸与氢氧化钠溶液反应的微观探究
酸碱中和滴定ppt课件

作指示剂 B.溶液呈中性,只能选用石蕊作指示剂 C.溶液呈碱性,可选用 甲基橙或酚酞作指示剂 D.溶液呈碱性,只能选用酚酞作指示剂
四、实验步骤
1.滴定前准备
2.滴定操作 用左手控制滴定管活塞,逐滴放出溶液,右手摇动锥形瓶, 两眼注视锥形瓶内溶液颜色变化。
控制活塞
摇动锥形瓶
锥形瓶 内溶液颜色变化
3.终点判断 当滴入最后半滴×××标准溶液后,溶液由××色变成××色,
【课堂练习】
1.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,从下表中选出正确 选项( C )
序号
① ② ③ ④
锥形瓶中 滴定管中 选用指示 选用滴定
溶液
溶液
剂
管
碱
酸
石蕊
甲
酸
碱
酚酞
甲
碱
酸
甲基橙
甲
酸
碱
酚酞
乙
A.①② B.②③ C.③④ D.②④
2.用0.10mol/LNaOH溶液滴定未知浓度的CH3COOH溶液,恰好完全反应 时,下列叙述中正确的是( D ) A.溶液呈中性,可选用甲基橙或酚酞
带玻璃球 的橡胶管
注意: 酸式滴定管:酸性、强氧化性试剂 碱式滴定管:碱性试剂
【课堂练习】
1.下列所述仪器“0”刻度位置正确的是( B )
A.在量筒的上端
B.在滴定管上端
C.容量瓶上端
D.在托盘天平刻度尺的右边2.50ml的滴定管盛有
溶液,液面恰好在20.0处,若把滴定管中溶液全部
C 排出,则体积( )
液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;D.取标准KOH
溶液注入碱式滴定管至“0”刻度以上2~3 mL;E.调节液面至“0”或“0”以
四、实验步骤
1.滴定前准备
2.滴定操作 用左手控制滴定管活塞,逐滴放出溶液,右手摇动锥形瓶, 两眼注视锥形瓶内溶液颜色变化。
控制活塞
摇动锥形瓶
锥形瓶 内溶液颜色变化
3.终点判断 当滴入最后半滴×××标准溶液后,溶液由××色变成××色,
【课堂练习】
1.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,从下表中选出正确 选项( C )
序号
① ② ③ ④
锥形瓶中 滴定管中 选用指示 选用滴定
溶液
溶液
剂
管
碱
酸
石蕊
甲
酸
碱
酚酞
甲
碱
酸
甲基橙
甲
酸
碱
酚酞
乙
A.①② B.②③ C.③④ D.②④
2.用0.10mol/LNaOH溶液滴定未知浓度的CH3COOH溶液,恰好完全反应 时,下列叙述中正确的是( D ) A.溶液呈中性,可选用甲基橙或酚酞
带玻璃球 的橡胶管
注意: 酸式滴定管:酸性、强氧化性试剂 碱式滴定管:碱性试剂
【课堂练习】
1.下列所述仪器“0”刻度位置正确的是( B )
A.在量筒的上端
B.在滴定管上端
C.容量瓶上端
D.在托盘天平刻度尺的右边2.50ml的滴定管盛有
溶液,液面恰好在20.0处,若把滴定管中溶液全部
C 排出,则体积( )
液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;D.取标准KOH
溶液注入碱式滴定管至“0”刻度以上2~3 mL;E.调节液面至“0”或“0”以
酸碱中和滴定实验ppt课件.ppt
C(酸)×V(酸) =化学计量数之比 C(碱)×V(碱)
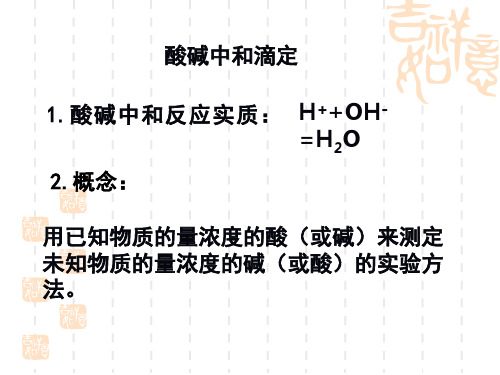
讨论:运用这种方法的关键问题是什么?
4.关键: ①准确测出参加反应的两种溶液的体积。
②准确判断中和反应是否恰好进行完全。
思考:测定溶液体积的仪器有哪些? 量筒 滴定管:酸式滴定管和碱式滴定管
想一想:
1、如何判断酸式滴定管和碱式滴定管?
2、量筒和滴定管的“0”刻度位置是否一致?
思考:如果是强碱和弱酸中和滴定又该选择 什么指示剂?
结论:根据达到终点后溶液的酸碱性来选 变色范围尽可能与所生成盐的酸碱性范围一致 浅变深更好
练一练
1、酸碱恰好完全中和时,它们的( D)一定相等。
A、质量
B、物质的量
C、物质的量浓度
D、H+和OH-的物质的量
2、物质的量浓度相同、体积也相同的一元酸和一元
碱相互中时,溶液显什么性( D )
A、显酸性B、显碱性C Nhomakorabea显中性D、酸碱性无法判断
练一练
3.用已知物质的量浓度的NaOH溶液滴定未 知物质的量浓度的HCl溶液,一般选用(酚酞 ) 作指示剂,用已知物质的量溶液的HCl溶液滴 定未知物质的量浓度的NaOH溶液,一般选用 (甲基)橙作指示剂。
5、实验仪器
解: HCl 1mol
+
NaOH = NaCl+ H2O
1mol
c(HCl)•V[HCl(aq)] c(NaOH)•V[NaOH(aq)]
c(NaOH)= c(HCl ) •V[HCl (aq)] 1mol
V[NaOH (aq)] 1mol
= 0.1100mol / L 0.02900L
0.02300L
V[NaOH (aq)] 1mol
讨论:运用这种方法的关键问题是什么?
4.关键: ①准确测出参加反应的两种溶液的体积。
②准确判断中和反应是否恰好进行完全。
思考:测定溶液体积的仪器有哪些? 量筒 滴定管:酸式滴定管和碱式滴定管
想一想:
1、如何判断酸式滴定管和碱式滴定管?
2、量筒和滴定管的“0”刻度位置是否一致?
思考:如果是强碱和弱酸中和滴定又该选择 什么指示剂?
结论:根据达到终点后溶液的酸碱性来选 变色范围尽可能与所生成盐的酸碱性范围一致 浅变深更好
练一练
1、酸碱恰好完全中和时,它们的( D)一定相等。
A、质量
B、物质的量
C、物质的量浓度
D、H+和OH-的物质的量
2、物质的量浓度相同、体积也相同的一元酸和一元
碱相互中时,溶液显什么性( D )
A、显酸性B、显碱性C Nhomakorabea显中性D、酸碱性无法判断
练一练
3.用已知物质的量浓度的NaOH溶液滴定未 知物质的量浓度的HCl溶液,一般选用(酚酞 ) 作指示剂,用已知物质的量溶液的HCl溶液滴 定未知物质的量浓度的NaOH溶液,一般选用 (甲基)橙作指示剂。
5、实验仪器
解: HCl 1mol
+
NaOH = NaCl+ H2O
1mol
c(HCl)•V[HCl(aq)] c(NaOH)•V[NaOH(aq)]
c(NaOH)= c(HCl ) •V[HCl (aq)] 1mol
V[NaOH (aq)] 1mol
= 0.1100mol / L 0.02900L
0.02300L
V[NaOH (aq)] 1mol
(九年级化学)第十单元课题2酸和碱的中和反应课件

减少污染
中和反应可以减少酸性或碱性废 水的排放,降低对水体的污染。
节约资源
通过中和反应,可以回收和再利用 酸性或碱性物质,减少资源浪费。
生态平衡
中和反应有助于维持生态平衡,保 护生物多样性。
中和反应的未来发展
绿色化学
随着绿色化学的发展,中和反应 将更加注重环保和可持续发展,
减少对环境的负面影响。
新技术的应用
中和反应的实验结果
实验结果分析
根据实验数据,分析酸和 碱的浓度、中和反应过程 中溶液的pH值变化以及最 终溶液的酸碱性。
绘制曲线
将实验数据整理成曲线图, 展示酸碱滴定过程中pH值 的变化趋势。
结论总结
根据实验结果,总结酸和 碱的中和反应规律,理解 中和反应在实际中的应用。
中和反应的化学方程式
酸碱中和反应的化学方程式
制药行业
中和反应是制药行业中的重要步骤, 用于制备药物、药物中间体和原料药, 如通过中和反应控制药物的pH值和稳 定性。
化工行业
环保行业
中和反应可用于处理酸性或碱性废水, 调节废水的pH值,使其达到排放标准。
在化工行业中,中和反应广泛应用于 化学品的合成和生产,如塑料、染料、 涂料等。
中和反应对环境的影响
如氢氧化钠与盐酸反应生成氯化钠和水。
酸碱指示剂
酸碱指示剂是用来指示溶液的酸 碱性的一种物质,常用的有紫色
石蕊溶液和无色酚酞溶液。
酸能使紫色石蕊溶液变红,碱能 使紫色石蕊溶液变蓝,中性物质
不能使紫色石蕊溶液变色。
无色酚酞溶液遇酸不变色,遇碱 变红,中性物质不能使无色酚酞
溶液变色。
03
中和反应的过程与实验
04
酸能与碱反应生成盐和 水:如盐酸与氢氧化钠 反应生成氯化钠和水。
中和反应可以减少酸性或碱性废 水的排放,降低对水体的污染。
节约资源
通过中和反应,可以回收和再利用 酸性或碱性物质,减少资源浪费。
生态平衡
中和反应有助于维持生态平衡,保 护生物多样性。
中和反应的未来发展
绿色化学
随着绿色化学的发展,中和反应 将更加注重环保和可持续发展,
减少对环境的负面影响。
新技术的应用
中和反应的实验结果
实验结果分析
根据实验数据,分析酸和 碱的浓度、中和反应过程 中溶液的pH值变化以及最 终溶液的酸碱性。
绘制曲线
将实验数据整理成曲线图, 展示酸碱滴定过程中pH值 的变化趋势。
结论总结
根据实验结果,总结酸和 碱的中和反应规律,理解 中和反应在实际中的应用。
中和反应的化学方程式
酸碱中和反应的化学方程式
制药行业
中和反应是制药行业中的重要步骤, 用于制备药物、药物中间体和原料药, 如通过中和反应控制药物的pH值和稳 定性。
化工行业
环保行业
中和反应可用于处理酸性或碱性废水, 调节废水的pH值,使其达到排放标准。
在化工行业中,中和反应广泛应用于 化学品的合成和生产,如塑料、染料、 涂料等。
中和反应对环境的影响
如氢氧化钠与盐酸反应生成氯化钠和水。
酸碱指示剂
酸碱指示剂是用来指示溶液的酸 碱性的一种物质,常用的有紫色
石蕊溶液和无色酚酞溶液。
酸能使紫色石蕊溶液变红,碱能 使紫色石蕊溶液变蓝,中性物质
不能使紫色石蕊溶液变色。
无色酚酞溶液遇酸不变色,遇碱 变红,中性物质不能使无色酚酞
溶液变色。
03
中和反应的过程与实验
04
酸能与碱反应生成盐和 水:如盐酸与氢氧化钠 反应生成氯化钠和水。
酸碱中和反应(共13张PPT)

第十一页,共13页。
问题(wèntí)(二)
此药中含有(hán yǒu)氢氧化铝
试写出胃康—U治胃酸过多的原理(yuánlǐ)。
3HCl+Al(OH)3=AlCl3+3H2O
第十二页,共13页。
练习(liànxí):完成下列反应并指出哪种 是中和反应( )
A、CaCO3 + 2HCl —— B、Fe2O3 + 3H2SO4 —
CaCl2+H2O+CO2 Fe2(SO4)3 + 3H2O
C、H2SO4 + NaOH ——
2
D、CO2 + Ca(OH)2 ——
Na2SO4 + 2H2O CaCO3 ↓ + H2O
第十三页,共13页。
第六页,共13页。
反应(fǎnyìng)的现象
酚酞试液
稀盐酸
H溶液(róngyè) 现象1
现象2
无色(wú sè)
红色
无色
第七页,共13页。
3、中和反应中加酚酞试液的目 的(mùdì)是什么?
是指示中和反应(fǎnyìng)是否 进行
第八页,共13页。
中和反应(fǎnyìng)的实质
是酸中的氢离子(lízǐ)和碱中 的氢氧根离子(lízǐ)结合生成 水分子的过程
第 五 节 中 和 反 应 pH 常见的碱 碱的通性
第一页,共13页。
课题1: 和 之间 会发生(fāshēng)什 么反应
第二页,共13页。
酸和碱之间的反应
用什么方法可以证明酸和碱之 可以在酸或碱中加入(jiārù)指示剂以显示它的存在,然后加入(jiārù)碱或酸直到溶液变为另一种颜色或者褪色。
问题(wèntí)(二)
此药中含有(hán yǒu)氢氧化铝
试写出胃康—U治胃酸过多的原理(yuánlǐ)。
3HCl+Al(OH)3=AlCl3+3H2O
第十二页,共13页。
练习(liànxí):完成下列反应并指出哪种 是中和反应( )
A、CaCO3 + 2HCl —— B、Fe2O3 + 3H2SO4 —
CaCl2+H2O+CO2 Fe2(SO4)3 + 3H2O
C、H2SO4 + NaOH ——
2
D、CO2 + Ca(OH)2 ——
Na2SO4 + 2H2O CaCO3 ↓ + H2O
第十三页,共13页。
第六页,共13页。
反应(fǎnyìng)的现象
酚酞试液
稀盐酸
H溶液(róngyè) 现象1
现象2
无色(wú sè)
红色
无色
第七页,共13页。
3、中和反应中加酚酞试液的目 的(mùdì)是什么?
是指示中和反应(fǎnyìng)是否 进行
第八页,共13页。
中和反应(fǎnyìng)的实质
是酸中的氢离子(lízǐ)和碱中 的氢氧根离子(lízǐ)结合生成 水分子的过程
第 五 节 中 和 反 应 pH 常见的碱 碱的通性
第一页,共13页。
课题1: 和 之间 会发生(fāshēng)什 么反应
第二页,共13页。
酸和碱之间的反应
用什么方法可以证明酸和碱之 可以在酸或碱中加入(jiārù)指示剂以显示它的存在,然后加入(jiārù)碱或酸直到溶液变为另一种颜色或者褪色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HCl和NaOH在水中电离出离子 HCl→H+ + Cl- NaOH→ OH-+ Na+
H2O
NaCl
化学方程式: NaOH + HCl == H2O + NaCl
结合刚才所学到的知识,你能写出H2SO4和 NaOH反应、HCl和Ca(OH)2、H2SO4和 Ca(OH)2的化学方程式吗?
化学方程式: H2SO4 + 2NaOH === 2H2O + Na2SO4 2HCl + Ca(OH)2 === 2H2O + CaCl2 H2SO4 + Ca(OH)2 === 2H2O + CaSO4
学 校:田庄二中 授课人:王圣军
据《东方早报》报道,2013年9月10日18时许, G15沈海高速近S32申嘉湖高速匝道处,一辆危险品 槽罐车仰天翻车,近30吨浓盐酸泄漏。造成该路段 封闭,后方道路极度拥堵,环保和消防到场监测, 并采取稀释、中和措施。
事故发生在隔离带的花坛旁,部分稀释后的盐 酸流入花坛内。松江区建交委运来石灰对事故点高 速立交桥下方废盐酸浓液进行中和处置。
这些反应有什么共同点吗?
NaOH + HCl === H2O + NaCl 2NaOH + H2SO4=== 2H2O + Na2SO4 Ca(OH)2 + 2HCl === 2H2O + CaCl2 Ca(OH)2 + H2SO4=== 2H2O + CaSO4
1.反应物是酸和碱
共
同
2. H+和OH- 结合生成了H2O
A. HNO3
B. Mg(OH)2
C. Na2CO3
D. FeO
教材66页第3、5题
无悔无愧于昨天,丰硕殷实 的今天,充满希望的明天。
2.盐:由金属离子和酸根离子组成的化合物
3.中和反应的实质
→ H+ + OH-
H2O
4.酸碱中和反应在生活和生产中有广泛的应用。
1、下列反应属于中和反应的是(C)
A.2HCl + CuO = CuCl2 + H2O B.2NaOH + CO2 = NaCO3 + H2O C.2HCl + Ca(OH)2 = CaCl2 + H2O D.CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
二、中和反应在实际中的应用
熟石灰
1、改变土壤的酸碱性
⑴酸性土壤中通常加碱性物质 如用熟石灰改良酸性土壤 H2SO4 + Ca(OH)2 = CaSO4 + 2H2O ⑵碱性土壤中通常加酸性物质
如用碳酸水浇树 改良土壤的碱性 促进植物的光合作用
2、处理工厂废水 ⑴酸性废水加碱性物质 H2SO4 + Ca(OH)2 === CaSO4 + 2H2O 因为熟石灰价格便宜, 处理污水成本低。 ⑵碱性废水加酸性物质 如造纸厂的废水
酚酞溶液
稀盐 酸
10mL氢氧化钠溶液
NaOH溶液 滴入(无色酚酞 )溶液 溶液为( 红 )色 再滴入( 稀盐酸 )溶液 溶液为( 无 )色
讨论:
试管内的物质是氢氧化钠吗?是盐酸吗? 为什么?
既不是氢氧化钠,也不是盐酸。因为他们 已经反应完了,剩下的是反应后的生成物。
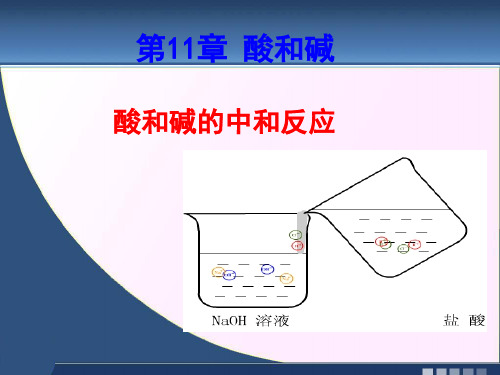
下面让我从微观角度给大家展示一下 NaOH和HCl的反应,看看大家会有什 么发现……
点 3.都生成了由酸根离子和金属
ห้องสมุดไป่ตู้
离子构成的化合物
盐:由金属离子和酸根离子构成的化合物。 如:NaCl和Na2SO4。此外由于NH4+的性
质接近金属离子,所以像NH4Cl、(NH4)2SO4 等化合物也是盐。
酸+碱 → 盐 + 水
中和反应:酸与碱作用生成盐和水的反应
中和反应 的实质
H+ + OH-
H2O
2.下列各组物质中,要借助指示剂才能判断反应
发生的是(C)
A. 碳酸钙和稀盐酸 B. 氢氧化钡和硫酸 C. 氢氧化钠和稀盐酸 D. 氢氧化铁和稀盐酸
3.鱼胆弄破后会使鱼肉沾上难溶于水的胆汁酸而变苦
,要减少这种苦味,用来洗涤的最佳物质是( B )
A.水
B.纯碱
C.食盐
D.食醋
4.下列属于盐的是( C )
被蜜蜂蛰后,用肥皂水或氨水清洗
蚊虫叮咬时,蚊虫会分泌出一种有机酸——蚁酸, 在家庭中可用浓肥皂(显碱性)涂抹可迅速止痒。
酸碱之间发生了怎样的变化呢?
一、中和反应
[实验10-8] 中和反应
[实验10-8] 中和反应
在烧杯中加入约10 mL氢氧化钠溶液,滴入几滴酚 酞溶液。再用滴管慢慢滴入稀盐酸,并不断搅拌溶 液,至溶液恰好变成无色为止。
含硫酸的工业废水
3.用于医药
(此药中含有氢氧化铝)
⑴胃酸过多的病人,可以服用氢氧化铝来治病。 3HCl+Al(OH)3====AlCl3+3H2O 中和胃酸
⑵处理蚊虫叮咬
蜜蜂与马蜂
蜜蜂
被蜜蜂蛰后,用肥 皂水或氨水清洗
马蜂
被马蜂蛰后,用食 醋止痛止痒
1.酸和碱能发生中和反应,生成盐和水。
酸+碱→盐+水
