硫化氢的实验室制法
氯化氢、硫化氢、二氧化硫、乙炔、乙酸乙酯de实验室制法

氯化氢的实验室制法实验室里制取氯化氢是利用食盐和浓硫酸在不加热或稍微加热的条件下进行反应。
化学方程式是:NaCl+H2SO4(浓)=NaHSO4+HCl↑这个反应是属于固体粉末与液体反应制取气体的类型,所用制气装臵与实验室制取氯气的一样(参看氯气的实验室制法)。
氯化氢极易溶于水,密度比空气大,只能用向上排空气法进行收集。
氯化氢有很强的刺激性气味,收集氯化氢后的剩余尾气,不能逸散在室内,可用水进行吸收。
硫化氢的实验室制法实验室里通常是用硫化亚铁跟稀盐酸或稀硫酸反应制取硫化氢,它们的化学方程式是:FeS+2HCl=FeCl2+H2S↑FeS+H2SO4(稀)=FeSO4+H2S↑制取硫化氢使用的是块状固体与液体反应制取气体的仪器装臵(参看《初中卷》使用固体和液体药品制备气体的仪器装臵)。
硫化氢易溶于水,密度比空气大,应使用向上排空气法收集。
检验集气瓶内是否已集满硫化氢,可将润湿的醋酸铅试纸放在集气瓶口,若试纸立即变黑,证明瓶内硫化氢气已集满。
二氧化硫的实验室制法在实验室里,常用亚硫酸钠跟浓硫酸起反应制取二氧化硫。
化学方程式是:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑制气装臵是用固体粉末与液体反应制取气体的仪器装臵(参看《初中卷》使用固体和液体药品制备气体的仪器装臵)。
二氧化硫易溶于水,密度比空气大,收集二氧化硫是用向上排空气集气法。
氨的实验室制法实验室里常用的是给铵盐和碱的混合物加热的方法制取氨气。
一般是用加热氯化铵和氢氧化钙的混合物,化学方程式是:2NH4Cl+Ca(OH)=2CaCl2+2H2O+2NH3↑制气装臵是用给固体药品加热制取气体的仪器装臵。
氨气极易溶于水,密度比空气小,要用向下排空气法收集。
检验集气瓶中是否已集满氨气,可把润湿的红色石蕊试纸放在瓶口;若试纸立即变蓝,证明集气瓶内已集满氨气。
铵根离子的检验检验铵根离子是利用铵盐能跟碱起反应放出氨气的性质。
检验方法是:把少量铵盐晶体放入试管里,然后用胶头滴管滴入少量较浓的氢氧化钠溶液,给试管加热。
硫化钠实验室制硫化氢方程式

硫化钠实验室制硫化氢方程式引言硫化氢(H₂S)是一种常见的无机气体,具有刺激性的恶臭味道。
它在实验室和工业中被广泛使用,用于合成其他化合物、分析试剂以及环境污染控制等领域。
本文将介绍在实验室中使用硫化钠制备硫化氢的方程式及其相关实验操作。
实验原理硫化钠(Na₂S)是一种白色晶体固体,可溶于水。
当硫化钠溶液与酸反应时,会产生硫化氢气体。
反应方程式如下:Na₂S + 2HCl → 2NaCl + H₂S↑该反应属于酸碱中和反应,其中硫化钠是碱性物质,盐酸(HCl)是酸性物质。
通过这个反应,我们可以方便地制备出大量的硫化氢气体。
实验材料和设备•硫化钠(Na₂S)•盐酸(HCl)•水•反应瓶•漏斗•橡胶塞或玻璃塞•导气管•水槽或水池实验步骤步骤一:准备实验设备和试剂1.准备一个干净的反应瓶,并用水清洗干净。
2.准备一定量的硫化钠固体和盐酸溶液。
硫化钠固体可以事先称取好,盐酸溶液可以事先配制好。
步骤二:装置实验装置1.将反应瓶放在水槽或水池中,使其底部浸入水中。
2.在反应瓶的塞子上安装一个漏斗,并将漏斗的口与导气管连接起来。
步骤三:进行实验1.将一定量的硫化钠固体加入反应瓶中。
2.慢慢地向漏斗中滴加盐酸溶液。
注意,滴加速度要适当,以控制生成硫化氢气体的速率。
3.观察反应瓶内产生的气泡,并闻其味道。
硫化氢气体具有刺激性恶臭味道,注意不要直接吸入。
结果与讨论在实验中,我们通过反应瓶中的漏斗滴加盐酸溶液,与硫化钠固体发生反应,产生了硫化氢气体。
根据实验原理中的方程式,该反应生成了氯化钠(NaCl)和硫化氢气体。
值得注意的是,硫化氢具有强烈的刺激性臭味,并且具有一定的毒性。
在进行实验时,要确保实验室通风良好,并避免直接吸入产生的气体。
实验应用制备硫化氢是一种常见且重要的实验操作。
硫化氢广泛应用于以下领域: 1. 合成其他化合物:硫化氢可以作为还原剂,在合成其他金属硫化物时起到重要作用。
2. 分析试剂:硫化氢可以用作分析试剂,例如用于检测金属离子。
高一化学知识小卡片·硫化氢的实验室制法(51)
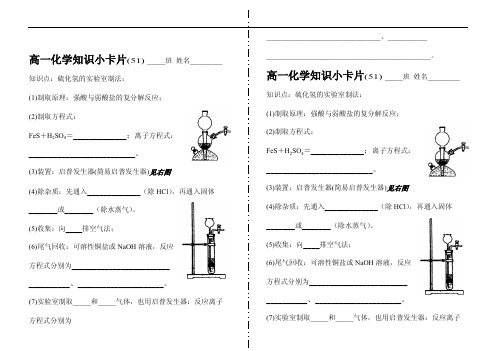
高一化学知识小卡片(51)_____班 姓名_________知识点:硫化氢的实验室制法:(1)制取原理:强酸与弱酸盐的复分解反应;(2)制取方程式:FeS +H 2SO 4=_____________;离子方程式:__________________________。
(3)装置:启普发生器(简易启普发生器)见右图(4)除杂质:先通入_____________(除HCl ),再通入固体_______或_______(除水蒸气)。
(5)收集:向____排空气法;(6)尾气回收:可溶性铜盐或NaOH 溶液,反应方程式分别为__________________________________、_____________________。
(7)实验室制取_____和_____气体,也用启普发生器:反应离子方程式分别为________________________________、_________________________________________________________。
高一化学知识小卡片(51) _____班 姓名_________知识点:硫化氢的实验室制法:(1)制取原理:强酸与弱酸盐的复分解反应;(2)制取方程式:FeS +H 2SO 4=_____________;离子方程式:__________________________。
(3)装置:启普发生器(简易启普发生器)见右图(4)除杂质:先通入_____________(除HCl ),再通入固体_______或_______(除水蒸气)。
(5)收集:向____排空气法;(6)尾气回收:可溶性铜盐或NaOH 溶液,反应方程式分别为__________________________________、_____________________。
(7)实验室制取_____和_____气体,也用启普发生器:反应离子方程式分别为________________________________、_________________________________________________________。
硫酸和铜的反应硫化氢的制备实验

硫酸和铜的反应硫化氢的制备实验硫酸和铜的反应是一个常见的化学实验,其中产生的硫化氢气体常用于实验室或工业中的各种化学反应和检测方法。
本文将探讨硫酸和铜反应制备硫化氢的实验方法以及反应机理。
在这个实验中,我们需要的材料有硫酸、铜粉、试管以及酒精灯等。
首先,我们将一小块铜粉放入试管中,然后倒入适量的硫酸。
这时我们会观察到试管内出现颜色变化,开始变黑。
这是由于铜与硫酸反应产生了黑色的硫化铜。
随着反应的进行,我们会看到试管内逐渐产生气泡,并有一股特殊气味弥漫开来。
这是因为反应生成了硫化氢气体。
硫化氢有着强烈的臭味,类似于腐烂的鸡蛋。
它具有毒性,因此在进行实验时应注意确保实验室通风良好,以防止气体积聚。
接下来,我们可以利用这个实验制备硫化氢气体。
硫化氢在实验室中有着重要的应用,可以用于检测金属离子的存在、还原反应以及催化剂的制备等。
硫化氢的制备还有其他方法,但这个实验是最常用的、简单而有效的方法之一。
我们可以简单了解一下硫酸和铜反应制备硫化氢的反应机理。
在这个反应中,硫酸是酸性溶液,铜则是金属。
硫酸分子中的氢离子(H+)与铜表面的金属离子结合,形成了硫酸铜离子(Cu2+)和水(H2O)。
同时,由于铜表面和硫酸发生反应的氢离子过多,会形成硫酸和铜的产物——硫化铜。
而硫化铜又会进一步分解,生成硫化氢气体。
这个过程可以表示为CuS → Cu + H2S。
其中的H2S就是我们需要的硫化氢气体。
通过这个实验,我们可以更加深入地理解化学反应的基本原理。
在实验过程中,我们可以观察到物质的变化,从而验证化学方程式中的反应机理。
这对于学习化学科学非常有帮助,同时也增强了我们对实验操作的理解和实际操作能力。
当然,在进行这个实验时,我们也需要注意安全。
硫化氢具有毒性,对人体有害,因此应该避免直接吸入。
实验室应该有良好的通风系统,同时戴上防护眼镜和手套,以防止化学品溅到皮肤或眼睛。
总而言之,硫酸和铜的反应制备硫化氢是常见的化学实验之一。
高一化学知识小卡片_硫化氢的实验室制法.doc
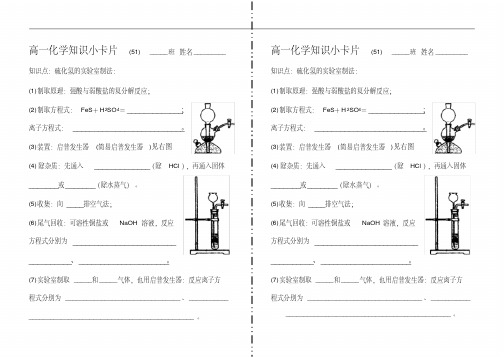
高一化学知识小卡片(51) _____班姓名_________ 知识点:硫化氢的实验室制法:(1)制取原理:强酸与弱酸盐的复分解反应;(2)制取方程式:FeS+H2SO4=_____________;离子方程式:__________________________。
(3)装置:启普发生器(简易启普发生器)见右图(4)除杂质:先通入_____________(除HCl),再通入固体_______或_______(除水蒸气)。
(5)收集:向____排空气法;(6)尾气回收:可溶性铜盐或NaOH溶液,反应方程式分别为__________________________________、_____________________。
(7)实验室制取_____和_____气体,也用启普发生器:反应离子方程式分别为________________________________、___________ ______________________________________________。
高一化学知识小卡片(51) _____班姓名_________ 知识点:硫化氢的实验室制法:(1)制取原理:强酸与弱酸盐的复分解反应;(2)制取方程式:FeS+H2SO4=_____________;离子方程式:__________________________。
(3)装置:启普发生器(简易启普发生器)见右图(4)除杂质:先通入_____________(除HCl),再通入固体_______或_______(除水蒸气)。
(5)收集:向____排空气法;(6)尾气回收:可溶性铜盐或NaOH溶液,反应方程式分别为__________________________________、_____________________。
(7)实验室制取_____和_____气体,也用启普发生器:反应离子方程式分别为________________________________、___________ ______________________________________________。
制取硫化氢的化学方程式

制取硫化氢的化学方程式
硫化氢的化学方程式为:H2S = 2H+ + S2- 。
在化学反应中生成硫化氢的方法有很多。
其中一种方法是利用酸
硫偶合反应(acid–sulfur coupling reaction)。
这个反应是将硫
酸与过氧化物发生反应,而这些过氧化物是由H2O2和其他酸例如硝酸
或磷酸催化剂而得到的。
典型的反应方程式如下:
H2SO4 + H2O2 → H2S + 2H2O
另外,通过热解硫酸盐也能够制取硫化氢。
在实验室中,将硫酸
溶于水中,然后加热它,就可以在高温下制取硫化氢。
高温使硫酸分
解成硫化氢和水的过程如下:
H2SO4 → H2S + O2
还有一种方法可以制取硫化氢,那就是利用燃烧硫钾,其反应方
程式为:
3K2S + 5O2 → K2SO4 + 4H2S
此外,通过矿物质的燃烧也可以制取硫化氢。
实验中常用植物繁
殖或沼气发生器的植物残渣来将矿物质燃烧以产生有机硫化物,可以
用来制备硫化氢。
比如可以将一些铁矿石或石墨,以及岩石中的其他
矿物质,燃烧到2000-2500摄氏度,从而转化成硫化氢。
燃烧矿物质
生成硫化氢的反应方程式为:
X 2S + O2 → X 2S + H2S
最后,硝酸盐也可以与溴酸或碳酸钠发生反应,从而生成硫化氢。
典型的反应方程式如下:
HNO3 + NaHCO3 → H2S + NaNO3 + H2O。
制备硫化氢的方法

制备硫化氢的方法
硫化氢(Hydrogen Sulfide)是一种有毒的可燃气体,广泛存在于工业生产中。
它的制备是工业生产中的必备步骤。
本文介绍几种常见的制备硫化氢的方法,为工业生产提供参考。
第一种方法是电解法制备硫化氢,这种方法是在高碱度的溶液中电解,将亚硫
酸氢钠溶液电解分解为硫化氢和氢气,产Be品纯度高,约在50%以上。
但电解法
对设备费用要求比较高,性价比不太高。
第二种制备硫化氢的方法是酸化制备,即将固体化学硫和固体化学氢(超高纯度)混入过量硫酸溶液中,温度从低温慢慢升高,利用氢温酸化作用,从而将混合物酸化分解为氢气和硫化氢,可以获得超质量的硫化氢,纯度约为90%以上。
然而,这种方法需要控制溶解度和反应温度,并且受其他物质的影响产Be量易变。
第三种制备硫化氢的方法是燃烧制备,即将镁、铝和硫或其他有机物在相对高
温(1000℃左右)下,利用燃烧反应将有机物的氧原子代替部分的氢原子来释放出硫化氢,纯度可以达到90%左右。
燃烧法是经济低廉的制备硫化氢方法,但受物料
可燃性影响,反应温度控制及精确度较一般方法要高。
以上就是制备硫化氢的三种常见方法,每种方法都有其特定优势与不足之处。
在实际工作中,应该根据需求,灵活选择不同的制备方法,以达到最佳的制备效果。
硫化氢的实验室制法

排水法( 因为氧 气不易 溶于水) 向上排气法(因为 氧气 的密度比空 气略大)
排水法(因为氢气难 溶于水)
向下排气法(因为氢 气的密度比空气小)
带火星的木条伸 检验方法 入集气瓶,木条
复燃,为氧气
点燃气体能燃烧, 生成物只有水,为 氢气
氧
氢
气
气
的
ቤተ መጻሕፍቲ ባይዱ
的
发
发
生
生
装
装
置
置
讨论:选择实验室制取气体装置的
思路与方法。
可供选药品:1 大理石, 2 锌粒,
A
3 MnO 2 , 4 浓H2SO4 , 5 稀H2SO4
6 FeS, 7 双氧水,8稀HCl,9浓HCl
B
可制备的气 A中盛放的 B中盛放的
体
药品
药品
O2
7
3
CO2
8
1
H2S
8或5
6
排水法 向上排气法 向下排气法
2、收集方法: 向上排气法( H2S的密度比空气大)
不能用排水法( H2S能溶于水)
收集仪器: 1、集气瓶 2、玻璃片
实验室制取硫化氢的装置 :
3、检验方法:
使湿润的醋 酸铅(PbAc2)试 H2S 纸变黑。
思考:
1。如何验证集气瓶内的气体已满?
2。尾气如何吸收?
Cl2的制备、提纯、吸收 Cl2中混有HCl和H2O(g)
三、实验室制取硫化氢气体的装置
1、发生装置(制取氢气的装置相似 )
发生仪器: 1、长颈漏斗
(或分液漏斗) 2、锥形瓶 3、双孔橡皮塞 4、导气管
2、在选择收集装置时应以什么为依据? 主要应以物理 (1)气体的密度与空气比较 性质两个方面:(2)气体在水中的溶解性
硫化氢的制取实验

硫化氢的制取实验
硫化亚铁稀酸逢,启普器中气体生。
橱中操作上排气,氧化性酸概不用。
解释:
1、硫化亚铁稀酸逢,启普器中气体生:"稀酸"在此指稀盐酸或稀硫酸。
这句的意思是说,在实验室中常用硫化亚铁(FeS)跟稀盐酸(HCI)或稀硫酸(H2SO4),在启普发生器中发生反应来制取硫化氢(H2S)[联想:"关闭活塞查密性"]。
2、橱中操作上排气:"橱中操作"的意思是说,该实验的操作过程必须在通风橱中进行[联想:因为H2S有剧毒,空气中如果含有微量的H2S,就会使人感到头痛、头晕恶心,吸入较多的H2S,会使人昏迷、甚至死亡。
]。
3、氧化性酸概不用:"氧化性酸"在此指浓硫酸(H2SO4)和硝酸(HNO3)。
这句的意思是说一概不用氧化性酸根硫化亚铁反应来制取硫化氢,因为硫化亚铁是强还原剂,易被氧化性酸氧化(H2S+ H2SO4浓=S↓+SO2↑+2H2O,H2S+ 8HNO3浓= H2SO4+8NO2+4H2O,3H2S+2HNO3=3S↓+ 2NO↑+4H2O)。
高一化学知识小卡片·硫化氢的实验室制法(51)
______________________________________________。
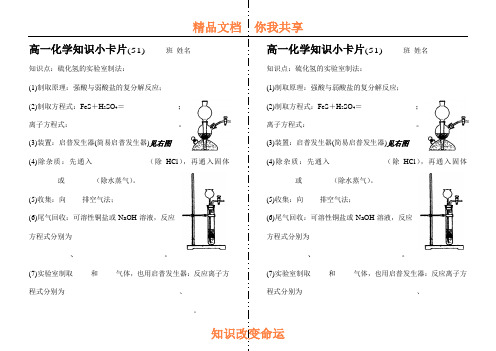
高一化学知识小卡片(51)_____班姓名_________
(4)除杂质:先通入_____________(除HCl),再通入固体_______或_______(除水蒸气)。
(5)收集:向____排空气法;
(6)尾气回收:可溶性铜盐或NaOH溶液,反应方程式分别为________________________
__________、_____________________。
知识点:硫化氢的实验室制法:
(1)制取原理:强酸与弱酸盐的复分解反应;
(2)制取方程式:FeS+H2SO4=_____________;离子方程式:__________________________。
(3)装置:启普发生器(简易启普发生器)见右图
(4)除杂质:先通入____________(除HCl),再通入固体_______或_______(除水蒸气)。
唐宗宋祖,稍逊风骚。
一代天骄,成吉思汗,
只识弯弓射大雕。
俱往矣,数风流人物,还看今朝。
______________________________________________。沁园春·雪<毛泽东>
北国风光,千里冰封,万里雪飘。
望长城内外,惟余莽莽;
大河上下,顿失滔滔。
山舞银蛇,原驰蜡象,
欲与天公试比高。
须晴日,看红装素裹,分外妖娆。
江山如此多娇,引无数英雄竞折腰。
硫化钠实验室制硫化氢方程式

硫化钠实验室制硫化氢方程式
硫化钠实验室制硫化氢方程式
硫化钠是一种常用的化学试剂,可以用于实验室制备硫化氢。
硫化氢
是一种无色、有毒、易燃的气体,具有刺激性气味。
它可以用于制备
其他化学试剂,如硫酸铵、硫酸钠等。
下面是硫化钠实验室制硫化氢
的方程式:
Na2S + 2HCl → 2NaCl + H2S
在这个反应中,硫化钠和盐酸反应生成氯化钠和硫化氢。
这个反应是
一种酸碱反应,硫化钠是碱性物质,而盐酸是酸性物质。
当它们混合
在一起时,会产生化学反应,生成硫化氢气体。
硫化氢是一种有毒气体,需要注意安全。
在实验室中制备硫化氢时,
需要采取一些措施来保护实验人员的安全。
首先,需要在通风良好的
实验室中进行实验,以便及时排除产生的硫化氢气体。
其次,需要佩
戴防护眼镜、手套和口罩等个人防护装备,以避免接触到硫化氢气体。
最后,需要使用专门的实验室设备来制备硫化氢,如硫化钠反应瓶、
气体收集瓶等。
总之,硫化钠实验室制硫化氢方程式是Na2S + 2HCl → 2NaCl + H2S。
在制备硫化氢时需要注意安全,采取必要的措施来保护实验人员的安全。
硫化钠实验室制硫化氢方程式

硫化钠实验室制硫化氢方程式硫化钠是一种常见的无机化合物,其化学式为Na2S。
在实验室中,可以通过硫化钠制备硫化氢气体。
硫化氢是一种无色、有刺激性气味的气体,具有强烈的还原性。
下面将详细介绍硫化钠实验室制备硫化氢的方程式,并解释其反应机理。
我们需要准备一定量的硫化钠固体和适量的酸溶液。
常用的酸溶液有盐酸(HCl)或者稀硫酸(H2SO4)。
方程式1:硫化钠与盐酸反应Na2S + 2HCl → 2NaCl + H2S↑方程式2:硫化钠与硫酸反应Na2S + H2SO4 → Na2SO4 + H2S↑以上两个方程式分别描述了硫化钠与盐酸、硫酸反应生成硫化氢气体的过程。
在实验室中,我们通常将硫化钠固体与酸溶液混合,观察到产生大量气泡并伴有刺激性气味的硫化氢气体的释放。
这是因为硫化钠与酸发生反应,产生了硫化氢气体。
在方程式1中,硫化钠与盐酸反应生成氯化钠和硫化氢。
硫化钠中的硫离子(S2-)与盐酸中的氢离子(H+)结合,形成硫化氢气体(H2S)。
同时,钠离子(Na+)与氯离子(Cl-)结合,形成氯化钠(NaCl)。
在方程式2中,硫化钠与硫酸反应生成硫酸钠和硫化氢。
硫化钠中的硫离子与硫酸中的氢离子结合,形成硫化氢气体。
同时,钠离子与硫酸中的硫酸根离子结合,形成硫酸钠。
这两个反应都是双替代反应,即硫化钠中的硫离子替代了酸中的氢离子,形成硫化氢气体和相应的盐类产物。
硫化氢是一种有毒气体,具有刺激性气味,能够与空气中的氧气发生剧烈反应,形成二氧化硫和水。
因此,在实验室中制备硫化氢时,要注意安全措施,确保操作在通风良好的环境下进行,并避免吸入过量的硫化氢气体。
总结起来,硫化钠实验室制备硫化氢的方程式可以分为硫化钠与盐酸反应和硫化钠与硫酸反应两种情况。
这两个方程式描述了硫化钠与酸反应生成硫化氢气体的过程。
硫化氢是一种有刺激性气味的气体,具有强烈的还原性。
在实验室中制备硫化氢时,要注意安全措施,确保操作在通风良好的环境下进行。
硫化钠实验室制硫化氢方程式

硫化钠实验室制硫化氢方程式
硫化钠实验室制备硫化氢的方程式如下:
Na2S + 2HCl → H2S + 2NaCl
在这个方程式中,硫化钠(Na2S)与盐酸(HCl)发生反应,生成硫化氢(H2S)和氯化钠(NaCl)。
这个反应是一个酸碱反应,也可以看作是一种氧化还原反应。
在这个反应中,硫化钠被氧化成硫化氢,而盐酸中的氢离子被还原成氢气。
值得注意的是,硫化氢是一种有毒气体,具有刺激性气味。
因此,在实验室中制备硫化氢时,需要采取相应的安全措施,如在通风良好的环境下操作,佩戴防护眼镜和手套等。
硫化氢在实验室中还常用于进行其他实验,如鉴别离子的实验、制备金属硫化物等。
由于硫化氢具有特殊的气味,可以通过其气味来鉴别不同的离子。
另外,硫化氢还可以与金属离子反应,形成相应的金属硫化物。
这些实验可以帮助我们进一步了解硫化氢的性质和应用。
总结一下,硫化钠实验室制备硫化氢的方程式为Na2S + 2HCl → H2S + 2NaCl。
这个方程式描述了硫化钠和盐酸反应产生硫化氢和氯化钠的过程。
硫化氢是一种有毒气体,在实验室中需要采取相应的安全
措施。
此外,硫化氢还可以用于鉴别离子和制备金属硫化物等实验。
硫代硫酸钠和硫化氢

硫代硫酸钠(Na2S2O3)和硫化氢(H2S)在化学领域具有重要的应用和研究价值。
本文将介绍它们的性质、制备方法、以及它们在工业和实验室中的应用。
一、硫代硫酸钠的性质和制备方法硫代硫酸钠是一种无色结晶体,具有较好的溶解性。
其化学式为Na2S2O3,相对分子质量为158.11。
硫代硫酸钠是一种还原剂和螯合剂,能与银盐反应生成可溶性的白色沉淀,因此在摄影行业被广泛使用。
硫代硫酸钠的制备方法主要有以下两种: 1. 硫酸铜与亚硫酸钠反应生成硫代硫酸钠的溶液,再用乙醇结晶得到硫代硫酸钠的固体。
2. 碱性条件下,通过亚硫酸钠和硫在硫酸钠存在下反应生成硫代硫酸钠。
二、硫化氢的性质和制备方法硫化氢是一种具有刺激性气味的无色气体,化学式为H2S,相对分子质量为34.08。
硫化氢是一种剧毒气体,易燃且可被氧气燃烧,生成二氧化硫和水。
硫化氢主要通过以下几种方法制备: 1. 在实验室中,可以通过酸和硫化物的反应来制备硫化氢,例如用而硫化钠和酸反应,产生硫化氢气体。
2. 工业上,常采用硫和氢气在一定温度和催化剂存在下反应来制备硫化氢。
三、硫代硫酸钠和硫化氢的应用硫代硫酸钠和硫化氢在工业和实验室中有广泛的应用。
在工业上,硫代硫酸钠被用作摄影工艺中的显影剂和固定剂。
具体来说,硫代硫酸钠能够还原暗影颗粒(AgBr)为银颗粒,在胶卷显影过程中起到还原和显影的作用。
同时,硫代硫酸钠还能够与游离银离子反应,形成可溶性的配合物,从而固定显影后产生的银颗粒。
在实验室中,硫代硫酸钠和硫化氢也有着重要的应用。
硫代硫酸钠常被用作还原剂,可以还原含氯物质,如漂白粉等。
而硫化氢则常被用于金属离子研究和分析实验中。
硫化氢能够与金属离子反应生成相应的金属硫化物沉淀,从而用于金属离子的检测和分离。
综上所述,硫代硫酸钠和硫化氢作为化学领域的重要物质,具有广泛的应用和研究价值。
它们在工业中用于摄影显影和固定,而在实验室中则可用于还原剂和金属离子研究等方面。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
发生仪器: 1、长颈漏斗
(或分液漏斗) 2、锥形瓶 3、双孔橡皮塞 4、导气管
2、在选择收集装置时应以什么为依据? 主要应以物理 (1)气体的密度与空气比较 性质两个方面:(2)气体在水中的溶解性
排水法 向上排气法 向下排气法
2、收集方法: 向上排气法( H2S的密度比空气大)
不能用排水法( H2S能溶于水)
收集仪器: 1、集气瓶 2、玻璃片
实验室制取硫化氢的装置 :
3、检验方法:
使湿润的醋 酸铅(PbAc2)试 H2S 纸变黑。
思考:
1。如何验证集气瓶内的气体已满?
2。尾气如何吸收?
小结:
1。固体+固体 加热 气体
2。固体+液体
气体
3。固体+液体 加热
气体
1、下列制取硫化氢的装置有哪些错误?
反应 原理
2KClO3 =M=n=O= 22KCl + 3O2 2KMnO4 == K2MnO4+MnO2+O2
Zn+H2SO4 =ZnSO4 +H2
装 置
发生装置 收集装置
氧 气 ( O2 )
氢 气( H2 )
收集方法
排水法( 因为氧 气不易 溶于水) 向上排气法(因为 氧气 的密度比空 气略大)
6 FeS, 7 双氧水,8稀HCl,9浓HCl
B
可制备的气 A中盛放的 B中盛放的
体
药品
药品
O2
7
3
CO2
8
1
H2S
8或5
6
A.长颈漏斗下端管口没有插 到液面以下。 B.导气管插到液面以下。 C.用向下排气法收集。 D.导管没有插到接近集气瓶 底部和收集气
体(洗气,干燥,尾气回收装置已略去)
可供选药品:1 大理石, 2 锌粒,
A
3 MnO 2 , 4 浓H2SO4 , 5 稀H2SO4
硫化氢的实验室制法
实验室制备气体的要素
1。药品: 2。反应原理: 3。发生装置: 4。除杂装置: 5。收集装置: 6。尾气吸收装置:
实验室制取硫化氢的方法:
一、药品: 硫化亚铁和稀硫酸(或稀盐 酸)
二、反应原理:
FeS+H2SO4==FeSO4+H2S
FeS+2HCl==FeCl2+H2S
氧 气 ( O2 ) 氢 气 ( H2 ) 药品 氯酸钾或高锰酸钾 锌和稀硫酸
从两个方面考虑: (1)反应的条件。 (2)药品的状态。
氧 气 的 发 生 装 置
此装置使用于什么样的反应
氢 气 的 发 生 装 置
此装置使用于什么样的反应
适用于反应物是固 体且需加热
适用于反应物有两种 (固体+液体)且不 需加热
Cl2的制备、提纯、吸收 Cl2中混有HCl和H2O(g)
三、实验室制取硫化氢气体的装置
排水法(因为氢气难 溶于水)
向下排气法(因为氢 气的密度比空气小)
带火星的木条伸 检验方法 入集气瓶,木条
复燃,为氧气
点燃气体能燃烧, 生成物只有水,为 氢气
氧
氢
气
气
的
的
发
发
生
生
装
装
置
置
讨论:选择实验室制取气体装置的
思路与方法。
1、制取氧气时能否用制取氢气的
装置?反之是否可行?
2、在选择发生装置时要考虑哪些 因素?
