最全浮游藻类的分类
海大浮游生物总结讲解

海洋浮游植物:硅藻门、甲藻门、绿藻门、蓝藻门、裸藻门、金藻门、黄藻门、隐藻门海洋浮游动物:原生动物、轮虫、桡足类、枝角类海洋浮游植物(Marine phytoplankton):海洋中营浮游生活,很弱或无游动能力的微小植物,能进行光合作用,是海洋的食物生产者(初级生产者)。
海洋初级生产力:单位面积浮游植物固定有机物的能力(300-400mg C/m2·d)。
海洋浮游生物(Marine plankton):海洋中很弱或无游动能力的微小生物,包括海洋浮游植物和海洋浮游动物,是海洋动物的食物基础。
海洋浮游藻类概述1、细胞壁藻类大多数种类都有细胞壁,少数种类没有细胞壁而有周质体。
有些具有囊壳。
硅藻门:由两个U形节片套合而成,主要由硅质组成,外层二氧化硅,内层为果胶质。
甲藻门:由许多小板片拼合组成。
2、细胞核3、色素:叶绿素(chlorophyll)、胡萝卜素(carotene)、叶黄素(lutein)和藻胆素(phycobelin)除蓝藻和原绿藻外,色素均位于色素体内。
4、蛋白核:是绿藻、隐藻等藻类中常有一种细胞器,通常由蛋白质核心和淀粉鞘(starch sheath)组成,有的则无鞘。
可以作为分类依据。
5、贮存物质绿藻:甲藻:淀粉硅藻:脂肪金藻:白糖素蓝藻:蓝藻淀粉裸藻:副淀粉6、与运动有关:鞭毛:除蓝藻和红藻外,各门藻生殖期动孢子、配子具鞭毛或营养细胞具鞭毛。
眼点:运动藻体上常有一个。
桔红色,球形、椭球形,多位于细胞前端侧面,具有感光作用。
伸缩泡:调节细胞中水分。
在细胞一端或两端。
7、周质体——周质体是藻体细胞质表层特化成的一层坚韧有弹性的构造,藻体形态较稳定。
8、囊壳:是某些藻类具有的特殊细胞壁状的构造,无纤维质,但常有钙或铁化合物的沉积,常呈黄色、棕色甚至棕红色。
9、繁殖:藻类繁殖方式基本上有以下三种:营养繁殖、无性生殖和有性生殖。
此外,还有绿藻门接合藻纲的接合生殖。
10、微微型浮游生物:0.2um~2.0um 需要荧光染色微型浮游生物: 2.0um~20um小型浮游生物:20um~200um大型浮游生物:200um以上11、藻类与人类的关系:饵料,药用与食用,水污染的指示生物一、硅藻门特征:主要特征(1-3)1、细胞壁:外层硅质,内层果胶质,壁上具有排列规则的花纹(点纹、线纹、孔纹、肋纹),无色透明。
最全浮游藻类的分类

采样频次
采样频率一般2~4次/年; 时间以夏秋两季为宜; 有些湖泊可按丰枯水期采样; 根据排污或藻类爆发(如蓝藻爆发状况,水交换频繁 的湖泊,可随时增加采样次数。)
采样层次
≤2m
0.5m左右深处采集亚表层水样 若透明度很小,下层加取,制成混合样
≤5m 水表面以下0.5、1、2、3和4m等五个水层采样,取定量水样,制混合样
浮游藻类的基本特征
基本定义:浮游藻类是指所有生活在水中营浮游生活方式 的微小植物。 基本特征:具有光合色素,能进行光合作用,营自养生活; 植物体没有真正的根、茎、叶分化;生殖器官是单细胞的,用 单细胞的孢子或合子进行生殖。
浮游藻类的细Βιβλιοθήκη 结构 细胞壁 色素和色素体 贮藏物质 液泡和鞭毛
溶液1ml、甘油2ml。为防止样品褪色,可在样品中加1、2滴 饱和硫酸铜溶液。
对于浮于水样表层的样品(如带气囊的微囊藻)可在 样品中加入适量皂液,以便沉降。
Lugols鲁哥氏液固定液:称取40g碘及60g碘化钾(分析纯),溶
于1000ml纯水中。
样品沉淀和浓缩
沉淀和浓缩可以在筒形分液漏斗或直接在采样瓶中进行, 因为一般浮游藻类的大小为几微米到几十微米,再经过碘液 固定后,下沉较快,所以静置沉淀时间一般需用24 ~ 48h。 然后用细小玻璃管加乳胶管或小橡皮管以虹吸方式缓慢 地吸去上层的清液,注意不能搅动或吸出浮在表面和沉淀的 藻类。 最后留下约20ml时,将沉淀物放入容积为50 ~100ml 的试剂瓶中,试剂瓶事先应精确的在30ml处做好标记,用吸 出的上层清液或蒸馏水冲洗分液漏斗或采样瓶2~3次,一起 放入试剂瓶中,在计数时定容到30ml(转移量大于30ml时可 多次虹吸。
海洋浮游动物的分类和区域分布

海洋浮游动物的分类和区域分布# 引言海洋浮游动物是指生活在海洋中,不能主动游动的微小生物体,包括浮游植物和浮游动物。
它们在海洋生态系统中发挥着重要的角色,参与了海洋食物链的运转、气候调节和能量转换等过程。
本文将介绍海洋浮游动物的分类和区域分布。
## 分类海洋浮游动物根据其特征和分类方法的不同,可以被分为多个类群。
1. 浮游植物- 藻类:包括硅藻、针状藻、隐藻等,它们通过光合作用吸收阳光能量并转化为有机物质。
- 绿潮藻:是一种大型浮游植物,容易形成海洋绿潮现象,对海洋生态系统和渔业资源造成负面影响。
2. 浮游动物- 原生动物:包括放射虫、纤毛虫等,以吞噬细菌和其他浮游生物为食。
- 桡足类动物:包括水蚤、溞簿虫等,是浮游动物中数量最多的类群。
- 幼体阶段:很多底栖动物的幼体是浮游动物,如虾蛄、海鞘等。
## 区域分布海洋浮游动物的区域分布受到多种因素的影响,包括温度、盐度、营养物质、光照等。
1. 赤道附近- 热带海洋区域的海水温度较高,光照充足,适宜浮游生物的生长繁殖。
因此,赤道附近是浮游动物种类和数量最为丰富的地区之一。
2. 极地海域- 极地海域的水温较低,但由于受到季节性的浮游生物大规模繁殖的影响,使得该地区浮游动物密度很高。
- 北极地区的浮游动物以硅藻为主,而南极地区则以甲藻为主。
3. 冷水流和暖水流交汇处- 冷水流和暖水流交汇处是浮游动物聚集的重要地点之一。
由于水文环境的差异,这些区域的营养盐含量高,适宜浮游动物的生长。
- 这里往往是鱼类和鸟类聚集的地方,它们以浮游动物为食,形成了复杂的食物链关系。
4. 内陆海域- 内陆海域通常水域浅,光照较为充足,容易形成浮游植物的大规模生长。
这些浮游植物为浮游动物提供了丰富的食物资源。
- 部分内陆海域如波罗的海,由于缺乏淡水补给和水交换,导致浮游生物种类相对较少。
# 结论海洋浮游动物的分类和区域分布对于我们了解海洋生态系统的运行和变化具有重要意义。
通过对这些微小生物的研究,我们可以更好地理解海洋生态系统的结构和功能,并为保护海洋生物多样性和生态平衡提供科学依据。
部分藻类分类

绿藻门
石莼(Ulva lactuca L)
绿藻门,丝藻目,石莼科,石莼属
片状,近似卵形的叶片体由两层细胞构成,高10—40厘米,鲜绿色,基部以固着器固着于岩石上,生活于海岸潮间带,可供食用。生长在海湾内中、低潮带的岩石上,东海、南海分布多、黄海、渤海稀少,冬春采收,鲜食或漂洗晒干。
褐藻门酸藻科酸藻属
为中国唯一的酸藻属植物。藻体淡褐色,分枝繁密,数回近羽状分枝,向上分枝渐细成细毛状,各分枝有中轴,分枝亚圆柱形,主轴扁压,固着器盘状。
青岛、烟台有分布。生中、低潮带岩石上。
鼠尾藻(Sargassum thunbergii)
褐藻门,圆子纲,墨角藻目,马尾藻科,马尾藻属
藻体黑褐色,形似鼠尾,高3~50厘米,可达120厘米。主干短粗,上长数条主枝。主枝圆柱形,数条纵走浅沟。轮生短小分枝,叶丝状,短小,全缘或有粗锯齿。气囊小,纺锤形,顶尖,有细柄。固着器盘状至圆锥状。生殖托圆柱形,雌托长度大多在3-5mm,雄托长度在10-15mm。生长在中潮带岩石上或石沼中。全年可见,生长盛期3~7月。鼠尾藻雌雄异株,其自然繁殖方式有两种:有性繁殖和营养繁殖。
暖温带性海藻。主要分布潮间带,为优势种,北起辽东半岛南至雷州半岛均有分布。
点叶藻(Dunctariaceae)
褐藻门、褐藻纲、网管藻目、点叶藻科
藻体薄叶状,具暗褐色斑点,宽3—7cm
产于黄、渤海沿岸,东海和南海
红藻门
多管藻(Polysiphonia Grev.)
仙菜目,多管藻属
植物体直立或部分匍匐,匍匐枝上具1或2个细胞组成的假根,上生直立枝,自其上辐射分枝。多管藻,新鲜时呈红色,干燥时茶褐色或黑色,丛生,高约20厘米。分枝上有节,每隔3~4节有互生弯曲的小分枝,无毛丝体,节部透明,无皮层。每一孢子囊枝上产生数十个四分孢子囊。精子囊枝顶端延长成无色毛。囊果瓮状,上部突出成宽颈,顶端有一开口,具短柄,生于小分枝的中部或下部。
水生生态系统中浮游植物的种类与分布

水生生态系统中浮游植物的种类与分布水生生态系统中浮游植物是生态系统中的一个重要组成部分,它们在水体中的生态角色非常重要,可以用来作为水体污染指数的监测指标,也是水体养分的主要来源。
因此,了解水生生态系统中浮游植物的种类与分布非常有意义。
本文将对水生生态系统中浮游植物的种类与分布进行探讨。
一、浮游植物的种类浮游植物属于植物界,是一类不具根茎叶的微型水生植物,主要通过悬浮在水体中的芽孢或配子形成新个体,繁衍生息。
在水生生态系统中,常见的浮游植物有浮游藻类、浮游硅藻类、浮游甲藻类等。
此外,还有一些不同于植物的生物,如动物浮游生物、细菌等,它们虽然也是在水体中漂动,但它们不具有光合作用的能力,因此不能被归为浮游植物。
浮游藻类:浮游藻类也称绿藻,它们是一类单细胞或多细胞生物。
通常它们以异养为生,需要从外部摄取有机物才能生存,但它们也有一些根据环境条件自己合成有机物质的能力。
浮游藻种类非常多,有高等浮游藻类、低等浮游藻类、蓝藻等。
浮游硅藻类:浮游硅藻类主要以硅质为壳,在水体中经常可以看到石蕊(一种常见的硅质壳)形态各异的硅藻种类。
它们是一类非常重要的浮游生物,也是水生生态环境中的重要指标生物。
浮游甲藻类:浮游甲藻类的主要特点是它们具有外壳,并且这个外壳是非常复杂的形态结构。
浮游甲藻类也是一类重要的浮游植物,是水生生态系统中的重要指标生物之一。
二、浮游植物的分布浮游植物的分布主要取决于水体中的环境条件,如水温、光照、养分等因素。
不同种类的浮游植物有不同的生长环境要求,因此它们的分布也有所不同。
在水体中,最主要的浮游植物分布区分为多层分布和表层分布。
多层分布主要指的是深度较深的水层中的浮游植物,比较常见的有硅藻、黄绿藻等;表层分布主要指的是水体表面的浮游植物,比较常见的有绿藻、蓝藻等。
此外,还有一些浮游植物主要分布于湖沼中,如水生菌藻、石蕊藻等。
总体来说,浮游植物的分布比较广泛,既可以存在于富含养分的水体中,也可以存在于养分较为缺乏的水体中,还可以存在于一些深渊水体中。
浮游植物—黄藻的分类

绿胞藻纲
植物体为单细胞的鞭毛藻类。 无真正的细胞壁,外层只有 柔嫩的周质,因此能变形。
细胞常为背腹侧扁,背侧隆 起,腹侧平直,具1条纵沟。
鞭毛2条,游泳鞭毛向前, 拖曳鞭毛向后。
无眼点。
细胞前端具1个大的储蓄泡, 储蓄泡前端与胞咽相连,胞 咽开口于细胞顶端凹入处。
伸缩泡1~2个,位于储蓄泡 侧边。
中。
扁形膝口藻在我国较常见,常在温暖季节出现于肥水鱼池中。 大量繁殖时,形成云彩状水华,水色呈黄绿色,为鲢鳙的良
好饵料。
赤潮异弯藻
• 藻体单细胞 藻体单细胞,细胞裸露,易 变形,略呈椭圆形,长 8~25μm,宽6~15μm。 细胞腹部略凹,从此处伸出 2条不等长鞭毛,长者约为 细胞长的1.3倍,短者为细 胞长的0.7~0.8倍。
三、常见黄藻门植物
1.拟气球藻属
• 单细胞、球形、细胞壁薄,无“∪”形节片构造。
• 个体大小相差很大,大的细胞中央具1大而明显的液 泡。
• 幼细胞具1~2色素体,成熟后色素体为多数,椭圆 形、多角形或盘状,周生。
• 拟气球藻:浮游生活或潮湿土壤表面,动孢子具2条 不等长鞭毛。
2.海球藻属
• 细胞球形、个体大,直径大于500µm • 细胞壁由相等的两瓣组成,以边缘相连 • 色素体多个,侧生。 • 细胞的叶绿体常由原生质线连成网状 • 本种为暖水种,有时可大量分布于我国近海
我国南海、黄海、渤 海等有分布。
01 认识浮游植物
一、藻类的概述 二、认识蓝藻 三、认识硅藻 四、认识金藻 五、认识甲藻 六、认识裸藻 七、认识绿藻 八、认识黄藻 九、认识隐藻
02 认识浮游动物 03 认识底栖动物 04 认识大型水生植物
黄藻门的分类
一、分类Байду номын сангаас
提醒珍藏!史上最全高清藻类图谱讲解
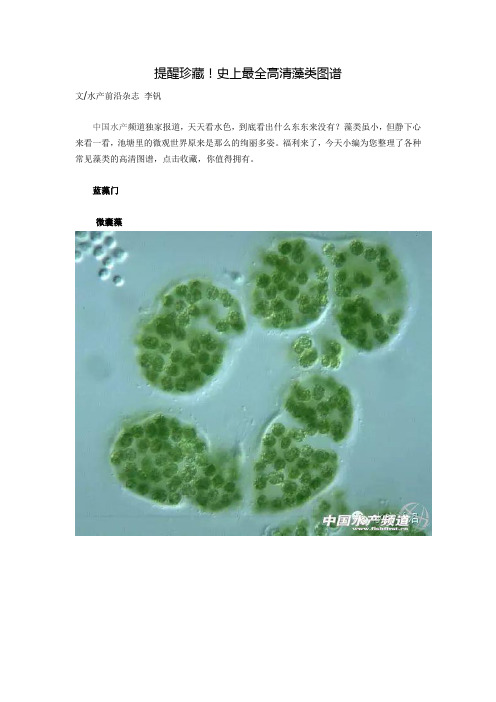
提醒珍藏!史上最全高清藻类图谱文/水产前沿杂志李钒中国水产频道独家报道,天天看水色,到底看出什么东东来没有?藻类虽小,但静下心来看一看,池塘里的微观世界原来是那么的绚丽多姿。
福利来了,今天小编为您整理了各种常见藻类的高清图谱,点击收藏,你值得拥有。
蓝藻门微囊藻(学名:Microcystis,来自拉丁文的mikros(小)与kystis(囊状物))是淡水中常见的一个蓝菌的属,其中包含会造成有害藻华的铜绿微囊藻(Microcystis aeruginosa),其毒素会导致肝脏、胆囊病变。
如命名所显示,微囊藻的特征是小型的细胞且没有鞘的包覆。
细胞常聚集成大至肉眼可见的群落,本为圆形,但随细胞数增多会逐渐出现孔洞并变不规则。
其原生质体的颜色为浅蓝绿色,但充满气体的囊泡常会呈暗色,这是在光学显微镜下用来鉴别微囊藻的特征之一。
色球藻色球藻(Chroococcus)藻体多数为2、4、6或更多一些细胞组成的群体,少数为单细胞。
单细胞时细胞球形,群体中的细胞为半球形或四分之一圆形。
细胞均具明显胶被,群体者既具群体胶被,其内的细胞也各具胶被,有的种类胶被还明显分层。
细胞仅具原核。
细胞蓝绿色、淡蓝绿色或灰色或黄色等。
色球藻为淡水常见种类,常见于有机质丰富的水体或潮湿的土壤和花盆壁上。
螺旋藻螺旋藻(学名:Spirulina),亦称“节旋藻”,是一类低等生物,原核生物,由单细胞或多细胞组成的丝状体,体长200-500μm,宽5-10μm,圆柱形,呈疏松或紧密的有规则的螺旋旋形弯曲,形如钟表发条,故而得名。
胶质鞘无或只有极薄的鞘,并有规则螺旋状,以形成藻殖段繁殖。
无异形胞和后壁孢子。
约38种,多数生长在碱性盐湖。
目前国内外均有大规模人工培育,主要为钝顶螺旋藻、极大螺旋藻和印度螺旋藻三种。
可食用,营养丰富,蛋白质含量高达60%-70%。
在自然水域,其大量繁殖会形成水华。
颤藻颤藻(Oscillatoria)属于颤藻科,最原始的绿色植物之一,是丝状的蓝线菌,属于原核生物。
史上最全的藻类图谱都在这里了,快看...

史上最全的藻类图谱都在这里了,快看...众所周知,在水产养殖过程中,养鱼就是养水。
养水就是培养良好的藻类,对养殖动物起到供氧或者作为生物饵料的作用。
在这里我们将水产养殖过程中的常见藻类做了一个统计,并且将其在显微镜下的特点整理出来,方便大家对藻类的学习(部分图片来自网络)。
蓝藻门蓝藻门的藻类多数属于害藻。
蓝藻是一种浮游生物,有单细胞的,也有多细胞的。
容易在富营养化的水中大量爆发。
池塘中出现蓝藻时就应该提高警觉,可以通过在早期换掉上层水除去蓝藻。
如果使用了杀死蓝藻的药物,切记使用解毒药!蓝藻死后是有毒的,产生的毒素将会对养殖动物构成威胁。
蓝藻门由蓝藻纲组成,这里为大家介绍的常见藻类包括色球藻目的蓝纤维藻(指杆藻)、色球藻(蓝球藻)、平裂藻和微囊藻;颤藻目的颤藻、螺旋藻、席藻(胶鞘藻)和鞘丝藻;念球藻目的拟鱼腥藻、鱼腥藻和念珠藻。
色球藻目1、蓝纤维藻(指杆藻)群体胶被无色透明;淡蓝绿色至亮蓝绿色。
2、色球藻(蓝球藻)群体胶被厚,且单独都有衣鞘,背靠背的两个小球。
与平裂藻相比,排列较为散乱。
3、平裂藻每两个细胞两两成对,2对为一组,4组成一小群;个体胶被不明显。
颤藻目1、颤藻没有胶质鞘或有极薄胶质鞘;以段殖体进行繁殖。
2、螺旋藻呈螺旋弹簧状3、席藻(胶鞘藻)群体分布。
与颤藻对比,有胶质衣鞘。
4、鞘丝藻有一段空的胶鞘念珠藻目1、拟鱼腥藻异形胞两端各一个2、鱼腥藻异形胞间生单个穿插3、念珠藻异形胞间生,长成串。
硅藻门硅藻门中的常见藻类比较多,而且多为益藻。
包括中心硅藻纲(中心纲)和羽纹硅藻纲(羽纹纲)。
一、中心硅藻纲(中心纲)圆筛藻目1、直链藻两细胞间有假环沟,两边具棘2、圆筛藻孔纹4、漂流藻圆盘形,壳环面四周有薄而透明的翼状突,翼上有许多射出肋。
5、海链藻以一条胶质线相连成串,有的壳缘有刺。
6、骨条藻胞间以细刺连接7、冠盖藻胞间管状短链相连,胞壁有明显的六角形孔纹。
根管藻目1、根管藻末端具刺像针盒形藻目1、角毛藻从细胞的四角生出的角毛比细胞长。
淡水浮游生物的组成及意义

8.2 淡水浮游生物的组成一、浮游植物(Phytoplankton )淡水浮游植物主要由藻类、细菌和藻状菌植物中的一些种类组成。
本节只介绍与淡水渔业有关的浮游植物,其类群主要有蓝藻门、绿藻门、裸藻门、金藻门、黄藻门、硅藻门和甲藻门等七类。
1. 概论(1) 体型。
浮游植物一般都是小型,肉眼难以看到,需借助显微镜方能观察其细微结构。
它们有的是单细胞体,有的是群体,有的则是丝状体,丝状体种类大多不分枝。
浮游植物的细胞主要有球形、椭圆形、卵形、圆柱形、纺锤形、纤维形等各种形状;另外,有些种类的细胞扁平、阔展成四方形、三角形、圆盘形、板片形等,这样的形状具有较大的相对面积,更容易悬浮于水中。
(2) 细胞结构。
在细胞结构方面,浮游植物通常都有细胞壁,但裸藻类无细胞壁,仅有一层由原生质特化的表膜。
细胞内部,除蓝藻类以外,都具有真核。
在细胞质中,因种类不同而含有不同的色素。
主要色素有叶绿素、黄色素、胡萝卜素和藻色素。
各种浮游植物的色素由多种色素配合而成,由于色素的种类以及配合比例的不同,使得各种浮游植物具有不同的体色。
除蓝藻类以外,浮游植物的色素均集结成色素体。
(3) 运动。
有些浮游植物具有鞭毛,可以自由游泳;有些则不具鞭毛,不能游动,只能随水漂浮。
具有鞭毛的浮游植物,其鞭毛的数目、长短及着生部位,因种类而不同。
(4) 繁殖。
浮游植物的繁殖能力很强,繁殖方式有三种类型,即营养繁殖、无性繁殖和有性繁殖。
营养繁殖和无性繁殖比较普遍,有性繁殖仅绿藻类具有。
2. 蓝藻门(Cyanophyta )蓝藻门约有150 属1500 种。
植物体通常呈蓝色或蓝绿色,有单细胞体、群体和丝状体等不同体型。
构成植物体的细胞均为原核细胞。
(1) 分布。
本门植物分布广泛,但大多数都生活于淡水中,成为淡水浮游植物的重要组成部分。
生活在淡水中的浮游蓝藻,在温暖季节里常大量繁殖、集聚水面形成“水华”。
形成水华的蓝藻主要有:微孢藻(Microcystis )、项圈藻(Anabaena )、螺旋藻(Spirulina )、节旋藻(Artrospira )、拟项圈藻(Anaba-enopsis )、腔球藻(Goelosphaerium )、尖头藻(Raphidio-psis )、颤藻(Oscillatoria )、片藻(Merismopedia )、席藻(Phormidium )等10 多个属。
浮游植物分类

浮游植物分类
浮游植物是指生活在海水中,靠浮力维持自己在水中位置的植物。
它们通常是光合生物,依靠光合作用获取能量,并且为海洋食物链的底层提供了重要的营养物质。
浮游植物在海洋中数量极多,大部分在海水中是不可见的,只有通过放大显微镜才能观察到。
浮游植物有多种分类方法,以下是其中的几种主要分类方法。
一、按细胞结构分类
1.原核生物类
原核生物是浮游植物最原始的类型,包括青藻、绿藻等。
这类浮游植物的细胞没有细胞核以及复杂的细胞器,体积较小,形态单一,很少被用作食品。
2.真核生物类
真核生物是指细胞有明显的细胞核和其他复杂器官的浮游植物,包括硅藻、钙藻、甲藻、裸藻等。
这类浮游植物的形态多样化、结构丰富,营养价值较高,有些是重要的海洋食品资源。
二、按生境分类
1.表层浮游植物
表层浮游植物生活在海洋的最上层,属于光合生物,能够通过光合作用获取营养,并且为海洋食物链的底层提供了营养物质。
2.深层浮游植物
深层浮游植物生活在深海或水体深处,这类浮游植物数量较少,种类较单一,通常是一些特殊的硅藻或甲藻。
三、按类群分类
1.硅藻
硅藻是一种大型浮游植物类群,体型多样、形态复杂,主要通过化石记录进行研究。
2.甲藻
甲藻是一种绝大多数为单细胞的微型浮游植物,有些种类具有球形、卵圆形、梨形等不规则形态。
3.裸藻
裸藻是一类细胞缺乏细胞壁的浮游植物,形态多样化、结构简单,可在海洋中大量繁殖。
4.鞭毛虫藻属
鞭毛虫藻属是一类有鞭毛或纤毛的藻类浮游植物,属于原生生物,形态比较单一,数量较少。
(完整版)浮游藻类监测及分类

定性样品一般采样量为20ml(指管容积),加福尔马林溶液1ml、甘油2ml。为防止样品褪色,可在样品中加1、2滴饱和硫酸铜溶液(分别加入的溶液的作用)
对于浮于水样表层的样品(如带气囊的微囊藻)可在样品中加入适量皂液,以便沉降
样品的沉淀及浓缩
1、沉淀和浓缩可以在筒形分液漏斗或直接在采样瓶中进行,因为一般浮游藻类的大小为几微米到几十微米,再经过碘液固定后,下沉较快,所以静置沉淀时间一般需用24~48h。
2、然后用细小玻璃管加乳胶管或小橡皮管以虹吸方式缓慢地吸去上层的清液,注意不能搅动或吸出浮在表面和沉淀的藻类。
3、最后留下约20ml时,将沉淀物放入容积为50~100ml的试剂瓶中,试剂瓶事先应精确的在30ml处做好标记,用吸出的上层清液或蒸馏水冲洗分液漏斗或采样瓶2~3次,一起放入试剂瓶中,在计数时定容到30ml(转移量大于30ml时可多次虹吸)。
另外,藻类的种群结构和污染指示种是湖泊营养型评价的重要参数,尤其是那些在某种特定的环境(营养)条件下能大量生存的藻类,即污染指示藻类的种类和数量,在一定程度上可直接反映出环境条件的改变和水体的营养状况。
优势种:是指群落中占优势的种类,它包括群落每层中在数量、体积上最大、对生境影响最大的种类。藻类学家在“指示种类”方法的基础上,提出了用整个藻类群落的种类组成和优势种群的变化来评价污染的方法。Fjerdingstad(1964)年用群落中的优势种来划分污染带,在污水生物系统的基础上,根据受生活污水污染的水体中优势生物种类的不同,划分为9个污水带。
定性样品
用25#浮游生物网在表层至0.5m深处以20~30cm/s的速度作∞形循回拖动约1~3min
样品固定
定量样品
测定藻类用的水样采样后应立即加以固定以免时间延长样品变质。固定剂用鲁哥氏液,一般用量为1L水样中加15ml鲁哥氏液,使水样摇匀即可(加鲁哥氏液的作用)
【备考总结】浮游生物学总

一、各大类藻的形态结构区分1、硅藻门:具硅质细胞壁,由上、下两壳套合而成,硅质壁上具有排列规则的花纹,没有鞭毛,细胞表面有多种多样的突出物,运动种类具有壳缝。
2、甲藻门:细胞有背腹之分,前后端具有角状突起,具2条顶生或腰生鞭毛,纵裂类细胞壁由左右两片组成,横裂类细胞壁由许多小板片组成,大多数具有一条横沟和一条纵沟,具有2条等长或不等长的鞭毛,具有特殊的换甲藻素、新甲藻素和甲藻黄素,贮存物质为淀粉或油滴。
3、蓝藻门:原核生物,无真正的细胞核。
细胞无鞭毛,具有假空胞,除颤藻目外其它的蓝藻都有异形胞,具有藻胆素,贮存物质为蓝藻淀粉。
多数能分泌胶质,包于藻体外。
4、金藻门:多数种类为裸露的运动个体,有些种类在表质上具有硅质化的鳞片、小刺或囊壳,大多具有2条鞭毛,色素含有金藻素,藻体成金黄色或棕色,同化产物为白糖素和脂肪。
5、黄藻门:细胞壁由“U”形或“H”形的两节片套合而成,运动细胞具两条不等长的鞭毛,长鞭毛为短鞭毛的4~6倍。
藻体成黄绿色或黄褐色,有1个至多个色素体,贮藏物质为油滴和白糖素。
6、绿藻门:色素体是绿藻细胞中最显著的细胞器,一般具有1或多个蛋白核,细胞内有液泡,大多具有2条顶生、等长的鞭毛,在鞭毛着生基部一般都有2个生毛体和伸缩泡。
大多具1个细胞核,少数多核。
7、隐藻门:大部分种类没有纤维素细胞壁,细胞长椭圆形或卵形,前部较宽,钝圆或斜向平截,有背腹之分,前端偏于一侧具有向后延伸的纵沟,有的种类具有1条口沟,纵沟或口沟两侧具有多个棒状的刺丝泡,2条鞭毛,略等长,具有藻胆素,贮存物质为淀粉,有蛋白核。
8、裸藻门:细胞裸露,无细胞壁,细胞质外层特化为表膜,有色素种细胞前端一侧有一眼点,少数种类具有特殊的裸藻红素,大多数种类具1条鞭毛,有贮存物质为副淀粉粒。
二、主要藻类的分类1、硅藻:中心硅藻纲Centricae:壳面花纹呈同心的放射状对称,不具壳缝或假壳缝。
羽纹硅藻纲Pennatae:壳面花纹左右对称,呈羽纹排列,具壳缝或假壳缝。
我国常见水华藻类图鉴

我国常见水华藻类图鉴作者:防灾科技学院1750232班科技小组水华是淡水体中藻类大量繁殖的一种自然生态现象,造成水华的原因是水体富营养化。
引起水华的有藻类、原核生物以及浮游动物,其中藻类是一个非常大的原因。
淡水中富营养化后,"水华"频繁出现,面积逐年扩散,持续时间逐年延长。
太湖、滇池、巢湖、洪泽湖都有"水华",就连流动的河流,如长江最大支流——汉江下游汉口江段中也出现"水华"。
淡水中"水华"造成的较大危害是:饮用水源受到威胁,藻毒素通过食物链影响人类的健康,蓝藻"水华"的次生代谢产物MCRST能损害肝脏,具有促癌效应,直接威胁人类的健康和生存。
引起我国水华的藻类种类繁多,下面是我国的引起水华的常见藻类。
1.隐藻水华:这是我国池塘养鱼常见的一种水华,其出现频率在各地肥水中可达到80%--100%,次优势种常称为小环藻、蓝隐藻和绿球藻的一些种类。
水色褐、红褐、褐绿和褐青。
全年都可出现。
优劣势:隐藻在海洋浮游生物群落中占有一定地位。
隐藻喜生于有机物和氮丰富的水体,是我国传统高产肥水鱼池中极为常见的鞭毛藻类,有隐藻水华的鱼池,白鲢生长好,快,产量高,隐藻是水肥、水活、好水的标志。
2.膝口藻水华这是无锡鱼池夏季肥水最常见的水华,在生长期中出现的频率近60%。
优势种为扁型膝口藻,次优势种为隐藻和裸甲藻,有时绿球藻类也较多,水色褐青或褐绿。
优劣势:膝口藻大量繁殖时形成云彩状水华,水色呈黄绿色,为鲢鳙鱼的良好饵料。
池塘膝口藻的大量繁殖造成泛池死鱼事件频繁发生,使养殖户蒙受重大经济损失,主要发生在每年的七八月份。
3.裸甲藻水华这是由蓝绿甲藻大量繁殖引起的,在江浙和广东肥水中较常见,夏秋季出现较多。
夏季长与扁型膝口藻共存。
水色褐绿,褐青或铁灰,水面长有云雾状蓝绿色斑团,鱼农称为“转水”。
优劣势:裸、甲藻繁殖造成pH值偏高,影响对虾脱壳,造成脱壳后软壳;抑制水体有益藻生长,影响对虾成活率,脱壳期更为严重;藻毒素会造成对虾肝胰腺病变,摄食下降,影响对虾生长,严重时出现空肠空胃、偷死等现象。
藻类生物知识点总结

藻类生物知识点总结一、藻类的分类藻类是指一类原核生物和真核生物中,寄生生活或自由生活在水体中的单细胞或多细胞植物、浮游植物体。
藻类包括原始的蓝藻、藻类、金藻、渤海藻、绿藻、裸藻、红藻、棕藻等,根据细胞结构和生活方式的不同,可以将藻类分为浮游藻和沉积藻两大类。
浮游藻是一类悬浮在水中的藻类,如原藻、绿藻、蓝藻等,它们通常以光合作用为生,是水体中重要的生态因子。
而沉积藻是一类寄生或附着在底栖物上的藻类,如硅藻、甲藻、红藻等,它们在海洋底部和淡水中扮演着重要的角色。
二、藻类的生活史藻类的生活史通常包括有性生殖和无性生殖两种方式。
有性生殖是藻类通过配子体或孢子形成的生殖细胞相互结合,产生新个体的生殖方式,如藻类的卵子和精子相结合形成双生子,再长成新的藻体。
无性生殖是藻类通过分裂或孢子发育等方式产生新个体的生殖方式,如藻类通过细胞分裂产生子细胞,每个子细胞又可以长成独立的藻体。
藻类的生物多样性和繁殖能力十分丰富,通过交配、分裂等方式保持着其种群的生态平衡。
三、藻类的生态学特征藻类是地球上最古老的生物之一,它们具有重要的生态学意义。
藻类是水域生态系统的重要组成部分,通过光合作用为生态系统提供能量和氧气,是海洋和淡水中食物链的基础。
藻类对水质和营养物质的循环具有重要的影响,如硅藻可以吸收水中的营养物质,促进水质的净化。
此外,藻类对海洋和淡水生态环境的稳定性和平衡性起着至关重要的作用,它们还能够抵抗水域中的污染物,起到净化水域的作用。
四、藻类的生物学意义藻类在生物学上有着重要的意义,它们不仅是生态系统中的重要组成部分,还具有多种生物学功效。
首先,藻类是许多水生动物的重要食物来源,如海藻是海洋中贝类、鱼类等的主要食物之一,对维持水域生态系统平衡具有重要作用。
其次,藻类还具有一定的药用价值,如褐藻富含藻蓝蛋白,具有抗氧化、抗炎、调节免疫等生物活性,可以用于药物及保健品的开发。
此外,藻类还具有环境修复和资源利用的潜力,如利用藻类清除水质中的富营养化物质,生产生物柴油等。
几种浮游藻类简介

%%%%%%%%%%%%%%%%%%%%8888!!封面)封底照片说明几种浮游藻类简介!!布氏双尾藻!C +*.1&%L $+3"*J #11++"!封面"!硅藻门$呈短三棱柱状#少数呈圆柱状或方柱状#壳面中央有一条粗直中空的长刺$细胞壁薄而透明#常单个浮游生活#以环面观出现在显微镜下$壳面边缘有一列小刺与细胞贯壳轴平行伸出为刺冠$适温范围广#近海分布$中华盒形藻!U +66&1<"+('+4#4'+'"!封底%"!硅藻门$藻体大多单独生活#偶有形成短链$细胞宽0$,"5$-C #高%%$,50$-C $壳面椭圆形#中央平或稍凹$细胞的四角伸出细长的棒状突起#平行于壳环轴或稍弯向细胞内侧$为偏暖形近岸种类#分布极广$我国东海%黄海和渤海均有分布$活动盒形藻!U +66&1<"+(%2L +1+#4'+'"!封底5"!硅藻门$壳面椭圆形#扁平#顶轴长/$A #&-C #顶轴两端各生一较长的角#角直#上下壳的角呈对角线伸出#角的内侧另生长刺$分布广$我国东海%黄海有分布$星脐圆筛藻!52',+426+',&'('*#$2%<"(1&'"!封底""!硅藻门$细胞大型#细胞壁硅质化程度较强$壳面圆形#有大而明显的玫瑰纹#正中央常有一圈无纹区$除盐度很低的内海外#各外海和近岸区都有$在我国渤海%黄海%东海和南海均有#为最常见的种类之一$中肋骨条藻!>:#1#*24#%(,2'*(*&%"!封底#"!硅藻门$呈透镜形或短圆柱形#壁薄#以长链状群体!有时可达#$个细胞以上"浮游生活$壳面圆#凸如冠状#直径0-C 左右$壳面边缘生一圈管状长突起#以之与邻细胞的长突起相接而连成长链#连接结明显$色素体%或5个#肾形$为世界广布种#在近岸低盐水及河口海域尤为繁茂#是沿岸流的良好指示生物$本种夏%秋季在长江口海域可占现场浮游植物总个数的F$@以上$能生长于富营养化水域#是沿岸水中常见的赤潮生物#曾多次引发赤潮$海洋原甲藻!?$2$2,#4*$&%%+,(4'"!封底/"!甲藻门$细胞侧扁#呈瓜子状#体长/5,?$-C #宽55,#$-C $细胞前端圆#后端尖#藻体中部最宽$广泛分布于沿海%河口和大洋海域$在我国沿岸#本种是牡蛎%幼鱼的饵料#大量繁殖可形成赤潮#是太平洋东岸形成赤潮的重要种类#大量生殖时有发光现象$叉状角藻!5#$(*+&%7&$,("!封底0"!甲藻门$藻体长#前后延伸#上体部长#向前端延伸逐渐变细#形成开孔的顶角$横沟部位最宽#呈环状#平直#细胞腹面中央为斜方形$下体部短#两侧平直或略弯#底缘由右向左倾斜#5个后角呈叉状向体后直伸出#左%右角近乎平行#末端尖而封闭#左后角比右后角长而稍粗壮$典型的沿岸表层性种#广泛分布#是渤海%东海和南海习见种$可形成赤潮$梭角藻!5#$(*+&%7&'&'"!封底?"!甲藻门$藻体细长#前后延伸#直或轻微弯曲$横沟部位最宽#几乎位于细胞的中部#上体向前端逐渐变细#延长成狭长的顶角$下体向底端渐渐变细成瘦长的左后角#右后角极短小或退化$世界性分布种$该种在内湾常形成赤潮$!浙江宁波海洋研究院!邵倩文"9999999999999999999999999999999999999999999999"楂#十月的板栗笑哈哈$5=#!植物遗传和繁殖相关俗语!例如)好树结好桃#好葫芦开好瓢(向阳好种茶#背阴好插柳(樱桃好吃树难栽(种牡丹者得花#种蒺藜者得刺(三年桃#四年杏(种瓜得瓜#种豆得豆$5=0!植物资源利用相关俗语!例如)麦收短秆#豆打长秸(宁吃仙桃一口#不吃烂杏一筐(去家千里#勿食萝藦%枸杞(上床萝卜下床姜(桃养人#杏伤人#李子树下埋死人(天上有蟠桃#不如手里有核桃(新手烧大菜#多放葱姜蒜(萝卜青菜,,,各有所爱$$"小结在生物学课堂教学中#教师若能适时地引用与动%植物相关的俗语#不仅能活跃课堂气氛#提高学生的学习兴趣#同时有利于学生对相关知识点的掌握$-基金项目$5$%?年江苏省高等教育教改项目#7:=5$%?K 6K H %F&&南京师范大学!5$%0%5$%?"重中之重教改课题.!3电子资源主要参考文献&%'温端政=俗语大词典&D '=北京)商务印书馆#5$%#=&5'张光富=汉语成语中的植物学现象浅析&K '=生物学教学#5$%/#"F !%5")#F 0%=&"'张光富=我国县市地名中的植物名称综述&K '=生物学教学#5$%0#/%!F ")5/=&/'李海霞=方言词典动植物名称的收录和解释&K'=辞书研究#5$$5#5"!#")"#/%="-F ?-生物学教学5$%F 年!第//卷"第%期。
浮游植物—隐藻的分类

2、与渔业的Байду номын сангаас系
• 有机物、氮丰富的水体,传统高产肥水鱼池中极为常见的鞭毛藻 类。
• 有隐藻水华的鱼池,白鲢生长好,快,产量高。 • 隐藻是水肥、水活、好水的标志。
小结:隐藻门的主要特征
• 1、多为单细胞运动个体,有2条鞭毛,顶生或侧生。少数形成不定形群体。 • 2、细胞有背(隆)腹(平)之分,前端钝圆或斜截形。 • 3、大部分种类细胞不具有纤维素的细胞壁,细胞外有一层周质体,柔软或坚固。 • 4、除了叶绿素a、c,β-胡箩卜素,还具有藻胆素,色素体1-2个,叶状或盘状,贮存物质
,边缘常具( ),周生,呈蓝色到蓝绿色 。 • 细胞核1个 ,位细胞下半部。
常见是尖尾蓝隐藻,细胞长7~10μm,宽4.5~ 5.5μm。
细胞后端渐尖,向腹侧弯曲
三、分布、与渔业的关系
• 1、分布
• 隐藻门植物种类不多,但分布很广,淡水、海水均有分布。 • 隐藻对温度、光照适应性极强,无论夏季和冬季冰下水体均可形成优势种群
二、分类概述
• 此门仅1纲,隐藻纲,分5科。 • 我国仅发现1科(隐鞭藻科)。 • 隐鞭藻科Cryptomonadaceae:单细胞,细胞不对称,有背腹之分,具2条鞭毛,多数
种类具色素体,少数无。具纵沟和口沟,刺丝泡位口沟处或细胞周边。
1、隐藻属 Cryptomonas
• 细胞椭圆形、豆形、卵形、圆锥形、S形等。 • 背腹扁平,背侧明显隆起,腹侧平直或略凹入,前端钝圆
为淀粉和脂肪(油滴); • 5、繁殖:游动的种类主要为纵分裂,群体或不具鞭毛种类产生游动孢子。
优势种
红褐 显著 蓝绿色云彩状水华 蓝绿裸甲藻 色 显著 草绿色云彩状水华 膝口藻
显著 棕黄色云彩状水华 光甲藻
03各门藻类11

假空泡(gas vacuoles):蓝藻细胞内的气泡,在光 学显微镜下呈黑色、红色或紫色,可使植物体漂浮。
异形胞(hete rocysts) :丝状体上较光亮的特殊细 胞。包被加厚。与固氮和生殖有关。
返回
2、生殖方式
没有有性生殖,也没有具鞭毛的生殖细胞。 通常以营养细胞分裂为主,此外尚有 段殖体 (hormogonia):藻殖段、藻殖胞 厚壁孢子(akinete) 内生孢子(endospore) 外生孢子(exospore)等。
段殖体是蓝藻藻
丝上两个营养细胞间生 出的胶质隔片(凹面体) 或由间生异形胞断开后 形成的若干短的藻丝分 段,又称藻殖段或连锁
体。
厚壁孢子:由普
通营养细胞增大体积, 积累营养,然后细胞壁 增厚而成。厚壁孢子有 极强的生命活力,能在 不利环境条件下长期休 眠。
3、分类概述
蓝藻门分一纲:蓝藻纲,主要根据生殖方式分三 目:见P13分目检索表
➢ 复大孢子:体型大,使产生的藻体恢复原来的大小。
➢ 小孢子:细胞核多次分裂,形成多个小孢子。
溢出→新个体
➢ 休眠孢子:细胞内原生质收缩于中央,分泌两瓣厚 壳。抗逆。
分类:
▪ 中心硅藻纲:圆筛藻目:骨条藻科p52,海链藻科p52,
藻殖段目:植物体为单列丝状体,无异形胞和厚壁孢子
段殖体的形成及丝状体的裂断是颤藻类的主要繁殖方法。 颤藻科(P20),螺旋藻属、束毛藻属(p21) 念珠藻科(P21),念珠藻属——发菜,鱼腥藻属(P23-24)
色球藻目:细胞卵形、圆柱形、纤维形等,多形成球状、
团块状群体。有共同的胶质衣鞘。繁殖以细胞分裂、群体 碎裂增殖为主。是淡水中重要的浮游藻类。如微囊藻水华
常见藻类图谱(史上最全版本)
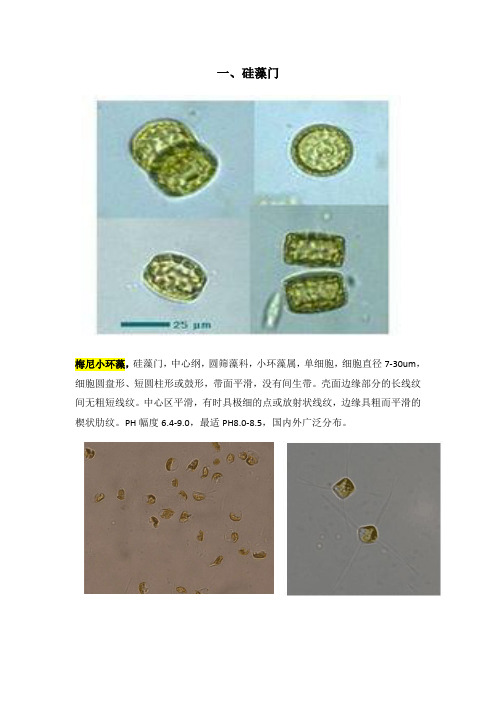
一、硅藻门梅尼小环藻,硅藻门,中心纲,圆筛藻科,小环藻属,单细胞,细胞直径7-30um,细胞圆盘形、短圆柱形或鼓形,带面平滑,没有间生带。
壳面边缘部分的长线纹间无粗短线纹。
中心区平滑,有时具极细的点或放射状线纹,边缘具粗而平滑的楔状肋纹。
PH幅度6.4-9.0,最适PH8.0-8.5,国内外广泛分布。
角毛藻,硅藻门,中心纲,盒形藻目,盒形藻科,是一种小型的海洋浮游硅藻,细胞长35-110um,宽11.5-42um,刺长12.5-100um,细胞小,壁薄,多数单个生活。
邻近细胞的角毛相连,使群体成链状。
角毛的长度,常几倍于细胞体本身。
链端角毛的形态,常和其他角毛不同,短而粗。
细胞行多次间接分裂后,链内出现相异的角毛,于是就分成两条链。
色素体两个或多个,有的种类角毛里也有色素体,是分种特征之一。
生殖方法有:形成复大孢子、体眠孢子和有性繁殖。
角毛藻在海洋浮游生物中占重要的位置,是鱼类的良好食料。
偏心圆筛藻,硅藻门,中心纲,圆筛藻目,圆筛藻科,细胞直径58-100um,细胞单独生活,少数两两相连。
细胞圆盒形。
壳面平,或略有凹凸。
壳面有六角形,多角形或圆形的孔纹,像个筛子,也像昆虫的复眼,有集光作用。
孔纹的排列方式和大小是分种的根据。
壳周在有的种类上有小刺,有的有小突起。
壳环狭而无纹,或有环状纹。
色素体小而多,紧靠在细胞壁,核常在中央。
草食性水生动物的主要食物之一。
长刺根管藻,硅藻门,中心纲,根管藻目,管形藻科,根管藻属,细胞长70-200um,直径4-10um,刺长80-200um,细胞长棒形,侧扁,有背腹之分;带面具发达的半环形的间生带;壳面椭圆形,具弯圆锥形的帽状体,末端具1条细长的刚硬的棘刺,刺长接近或明显超过细胞长度;色素体小圆盘状,2-4个。
生长在池塘、水库、湖泊、河流中。
扎卡四棘藻,硅藻门,中心纲,盒形藻目,盒形藻科,四棘藻属,单细胞或2~3个细胞互相连接成暂时性的短链状群体,细胞长35~110μm,宽11.5~42μm,刺长12.5~100μm,细胞扁椭圆形,细胞壁极薄,带面具多数环状间生待,末端楔形,无隔片;壳面扁椭圆形,中部凹入,由每个角状凸起延长成1条粗而坚硬的长刺;色素体盘状,4个;生长在湖泊、池塘、河流中,多为富营养水体,浮游,分布广泛。
浮游藻类三个常见属(颤藻属、直链硅藻属和针杆藻属)学名变更的解释

浮游藻类三个常见属(颤藻属、直链硅藻属和针杆藻属)学名变更的解释陈宇炜;李朋富;MartinDOKULIL【期刊名称】《湖泊科学》【年(卷),期】2003(015)001【摘要】根据近年来国外文献所涉及的藻类分类学研究进展,着重解释了蓝藻门的颤藻属和硅藻门的直链硅藻属和针杆藻属的一些浮游种类的学名变更情况,同时介绍了国际上最新的蓝藻门颤藻目和硅藻门的分类概况. 根据Anagnostidis和Komárek 的分类,原颤藻属的大部分浮游种类进入了新属[浮游蓝丝藻属](Planktothrix),其他种类则分别属于[湖生蓝丝藻属](Limnothrix)、胶鞘藻属(Phormidium)和现在的颤藻属(Oscillatoria)等多个颤藻目的类别. 根据Krammer 和Lange-Bertalot的分类,原直链硅藻属的浮游种类进入了新属[浮生直链藻属](Aulacoseira),另外的种类归属于Orthoseira、Ellerbeckia和现在的直链硅藻属(Melosira)等硅藻类别中;原针杆藻属的浮游种类并入脆杆藻属(Fragilaria),其他种类进入菱形藻属(Nitzschia)、双尖菱板藻属(Hantzschia)和现在的针杆藻属(Synedra)中.【总页数】10页(P85-94)【作者】陈宇炜;李朋富;MartinDOKULIL【作者单位】中国科学院南京地理与湖泊研究所,南京210008;南京大学生命科学院生物科学与技术学系,南京210093;Institute for Limnology,Austrian Academy of Sciences,A-5310 Mondsee,Austria【正文语种】中文【中图分类】Q949.22【相关文献】1.青海省异极藻属和桥弯藻属(硅藻门)的新变种 [J], 李艳玲;施之新;谢平;戎克文2.新疆菱形藻属和细齿藻属(硅藻门)中国新记录植物 [J], 尤庆敏;王全喜3.我国微型硅藻类的新记录属——微壳藻属 [J], 李扬;高亚辉;吕颂辉4.中国沿海甲藻两个新记录属——艉杆藻属和易碎藻属 [J], 顾海峰;王艳5.硅藻细胞壁亚显微结构研究:Ⅱ.针杆藻属,圆蕊藻属,斜斑藻属,槌棒藻… [J], 刘师成因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
样品计数(显微镜)
显微镜的校准
将目(测微)尺放入10倍目镜内,应使用刻度清晰成像 (一般刻度面应朝下),将台(测微)尺当作显微玻片标本, 用20倍物镜进行观察,使台尺刻度清晰成像。台尺的刻度代 表标尺上的实际长度,一般每小格0.01mm。转动目镜并移 动载物台,使目尺与台尺平行,并且目尺的边沿刻度与台尺 的0点刻度重合,然后数出目尺10格相当于台尺多少格,用 这个格数去乘0.01mm,其积表示目尺10格代表标本上的长 度多少。用台尺测出视野的直径,按πr2计算视野面积。
多样性指数
Goodnight修订指数(GBI) Shannon-wiener多样性指数(H’) 生物学污染指数(BPI) 硅藻指数 Margelef指数
群落结构演替
演替是一个群落为另一个群落所取代的过程,它是群落 动态的一个最重要的特征。主要是由于藻类之间和藻类与环 境之间的相互作用,以及这种相互作用的不断变化而引起的 自然演替过程。主要包括季节动态和年变化。
样品计数(显微镜)
计数方法
计数单位:一个单细胞生物,一个自然群体,都看作一个 单位。藻类个体数亦有以细胞数计。 视野计数法:在显微镜(400 ~ 600倍)下观察100个或 200个视野,一般计数两片。 长条计数法:选取两相邻刻度从计数框的左边一直计数到 计数框的右边成为一个长条。一般计数三条,即第2、5、8条。
另外,藻类的种群结构和污染指示种是湖泊营养型评价 的重要参数,尤其是那些在某种特定的环境(营养)条件下能 大量生存的藻类,即污染指示藻类的种类和数量,在一定程 度上可直接反映出环境条件的改变和水体的营养状况。
优势种
优势种,是指群落中占优势的种类,它包括群落每层中在数量、体 积上最大、对生境影响最大的种类。藻类学家在“指示种类”方法的基 础上,提出了用整个藻类群落的种类组成和优势种群的变化来评价污染 的方法。 Fjerdingstad(1964)年用群落中的优势种来划分污染带,在 污水生物系统的基础上,根据受生活污水污染的水体中优势生物种类的 不同,划分为9个污水带。
浮游藻类的基本特征
基本定义:浮游藻类是指所有生活在水中营浮游生活方式 的微小植物。 基本特征:具有光合色素,能进行光合作用,营自养生活; 植物体没有真正的根、茎、叶分化;生殖器官是单细胞的,用 单细胞的孢子或合子进行生殖。
浮游藻类的细胞结构
细胞壁 色素和色素体 贮藏物质 液泡和鞭毛
植物
多污带
α-中污带
β-中污带
无硅藻、绿藻、 藻类大量出现, 硅藻、绿藻、结
结合藻以及高 有蓝藻、绿藻、 合藻的许多种类
等植物
结合藻和硅藻 出现;此带为鼓
藻类主要分布区
寡污带
水中藻类少, 着生藻类多
指示种
狭义的“指示生物”即以某些种类的存在或消失作为监 测指标。公认的“指示种类”应用的鼻祖是Kolkwitz 和 Marrson ,他们不仅提出河流有机污染的污水生物系统,还 为各个不同污染带举出了不同的指示生物,而后被许多研究 者(Patrick 1949; Liebmann 2019; Fjerdingstad 1964; Sladecek 1973)不断的修改和补充提出各种污染带中更为 详细的指示生物名录。1969年Palmer对许多忍受有机污染 的藻类作了综合分析,并对这些藻类的指示作用作了评分。
黄藻门
硅藻门
隐藻门
金藻门 蓝藻门
甲藻门绿藻门ຫໍສະໝຸດ 裸藻门浮游藻类的分门
藻类的分类有不同的看法,主要在分类地位, 分类依据等方面。
目前国内大多学者把常见淡水藻类分成11-13个 门(即蓝藻门、隐藻门、甲藻门、金藻门、黄藻门、 硅藻门、裸藻门、绿藻门、红藻门、褐藻门、轮藻 门)。
注: 红藻门、褐藻门不常见,轮藻门多为着生藻类(现 已归并成绿藻门的一个纲),本课件不展开讨论。
分类计数必须在200个藻体以上,否则需全片或浓缩计数。 硅藻破壳不计数,藻类计数用画“正”的方式进行。 两片的数值与其平均值之差大于±15%,需进行第三片计数。
样品计数(显微镜)
结果换算
计算公式:N=[(A/Ac)×(Vw/V)]n 式中: N—每升原水样中浮游植物的数量(个/L); A—计数框面积(mm2); Ac—计数面积(mm2); Vw—原样定容的体积(ml); V—计数框体积(ml); n—计数所得的藻类的个数或细胞数。
采样频次
采样频率一般2~4次/年; 时间以夏秋两季为宜; 有些湖泊可按丰枯水期采样; 根据排污或藻类爆发(如蓝藻爆发状况,水交换频繁 的湖泊,可随时增加采样次数。)
采样层次
≤2m
0.5m左右深处采集亚表层水样 若透明度很小,下层加取,制成混合样
≤5m 水表面以下0.5、1、2、3和4m等五个水层采样,取定量水样,制混合样
粪生带:无藻类优势群落,基本无藻类。 甲型多污带:无藻类优势群落,基本无藻类。 乙型多污带:裸藻群落,优势种为绿裸藻和静裸藻。 丙型多污带:绿色颤藻群落。 甲型中污带:环丝藻群落或底生颤藻群落或小毛枝群落。 乙型中污带:脆弱刚毛藻或席藻群落(包括蜂巢席藻、韧氏席藻)。 丙型中污带:红藻群落,优势种群为串珠藻;或者绿藻群落,优势 种团刚毛藻或环丝藻。 寡污带:绿藻群落,优势种为簇生竹枝藻;或环状扇形藻等。 清水带:绿藻群落,优势种为羽状竹枝藻,或蓝藻群落眉藻属。
定性样品
用25#浮游生物网在表层至0.5m深处以20~30cm/s的速 度作∞形循回拖动约1~3min。
样品固定
定量样品 测定藻类用的水样采样后应立即加以固定以免时间延长样
品变质。固定剂用鲁哥氏液,一般用量为1L水样中加15ml鲁 哥氏液,使水样摇匀即可。
定性样品 定性样品一般采样量为20ml(指管容积),加福尔马林
细胞壁
大多数藻类细胞都有细胞壁(除裸藻、部分甲藻、金藻及生 殖细胞[即动孢子、配子等不具细胞壁)。 细胞壁一般分内外两层、内层较坚硬,外层较柔软,成分为 纤维素、果胶质、二氧化硅、碳酸等。 藻类细胞壁大多平滑,也有具有各种花纹、刺、棘或突起等。
色素和色素体
藻类含有的色素组成极为复杂,大致可分为叶绿素(a、b、 c、d、e)、胡萝卜素(α,β,r,ε)、藻胆素(藻蓝素、别藻蓝 素、藻红素)、叶黄素(二十来种)四大类。 不同的色素组成标志着进化的不同方向,是分门的主要依据。 藻类细胞中的色素载体叫色素体,其形状有盘状、板状、杯 状、带状、螺旋状等;位于细胞中心或中轴的称轴生,位于细胞 周围、靠近细胞壁的称周生。 色素体在藻类细胞中的数量、形状和不同位置都是分类鉴定 时的重要依据。
浮游藻类监测与分类
翁建中
提纲
一 浮游藻类监测 二 浮游藻类分类
一、浮游藻类的监测
浮游藻类 监测
监测 方法
评价 方法
断面布设原则
断面布设的代表性
污染源附近;排污口下游;敏感区域(水源地等)
与水化学监测断面布设的一致性
同步采样;数据对比;全面评价
断面布设要考虑水体环境的整体性
对照断面;污染断面;观察断面
样品计数(仪器法)
目前有多种藻类监测仪器可对水样进 行藻类细胞数量的测定,一般计数单位为 细胞数/升。
评价方法
污水生物系统 指示种 优势种 群落结构演替 多样性指数 生物密度
污水生物系统
污水生物系统:水体受污染后形成的特有生物群落,可以用来进行水污染 生物学评价。污水生物系统是德国学者Kolkwitz 和Marrson于20世纪初提出的。 其理论基础是河流受到有机物污染后,在污染源下游的一段流程里,会产生自 净过程,即随河水污染程度的逐渐减轻,生物种类也发生变化,在不同的河段 出现不同的生物种。据此,可将河流依次划为4个带:多污带、 α-中污带、β- 中污带(即甲型、乙型中污带)和寡污带,每个带都有自己的物理、化学和生 物学特征。50年代以后,一些学者经过深入研究,补充了污染带的种类名录, 增加了指示种的生理学和生态学描述。1964年日本学者津田松苗编制了污水生 物系统各带的化学和生物特征表。
断面布设的经济性
优化验证;样品及时运输
断面布设的连续性
长期、连续、可比性数据
断面布设方法
河流
平原水网地区一般不布设浮游藻类断面,建议采集着生藻类。
湖泊水库
入湖(库)口区 湖(库)中心区 湖(库)出口区 湖(库)特殊水区 沿湖(库)边排污口区 湖(库)相对清洁区
若水体是圆形或接近圆形,两岸设置两个相互垂直的采样;狭长 的水域则设置三个相互平行,间隔均匀的断面。
以太湖群落演替为例: 浮游藻类:近50年来,浮游藻类种类减少,生物量上升。 50-60年代优势种群以硅藻为主,80年代绿藻、硅藻和蓝藻 为优势种群,90年代优势种群以蓝藻为主。 有研究表明水草对藻类有明显的抑制作用,然而,由于 大量滤食性鱼类的放养,增加了对大型藻类的摄食压力,使 得小型藻类大量繁殖,呈现藻类小型化(陈立侨等,2019)。
>5m
深水水体可按3~6m间距设置采样层次,变温层以下的水层可适当少采样; 对透明度较大的深水水体,可按表层、透明度0.5倍处、1倍处、1.5倍处、 2.5倍处、3倍处取样,制混合样
水华期间 表层0.2m、亚表层层0.5m和底层各采一定量水样,制混合样
备注 若需了解浮游植物垂直分布状况,可分层次分别采样,不需混合
生物密度
藻类个体数 划分标准: 贫营养型:<30万个/升 中营养型:30~100万个/升 富营养型:>100万个/升
藻类湿重 浮游藻类的比重近于1,其湿重相当于其体积。 划分标准: 贫营养型:<3mg/L 中营养型:3~5mg/L 富营养型:5~10mg/L 超富营养型:>10mg/L
二、浮游藻类的分类
用作测量和计数的其他镜头的每一种搭配,也都应作同 样的校准和记录。
样品计数(显微镜)
