病毒遗传分析方法
第五章病毒的遗传分析

第五章病毒的遗传分析(3h)教学目的:掌握噬菌体的突变类型以及λ噬菌体的基因组;明确噬菌体的噬菌体的重组;了解噬菌体的互补测验。
教学重点:噬菌体的重组。
教学难点:噬菌体的互补测验。
第一节噬菌体的繁殖和突变型一、噬菌体的繁殖二、噬菌体突变型第二节噬菌体突变型的互补测验一、φX174条件致死突变型的互补测验二、T4突变型的互补测验第三节噬菌体突变的重组实验一、T2突变型的两点测交二、T4突变型的三点测交第四节λ噬菌体基因组与λ原噬菌体一、λ噬菌体的基因组二、原噬菌体的插入与切除第五节环状排列与末端重复(自学)一、线状DNA具有环状遗传图二、环状排列与末端重复的形成第五章病毒的遗传分析(3h)第一节噬菌体的繁殖和突变型一、噬菌体的繁殖感染周期:是指噬菌体从吸附细菌到子代噬菌体从宿主细菌细胞中放出来的过程。
1、烈性噬菌体的感染周期:烈性噬菌体T4,其宿主是大肠杆菌,故称之为大肠杆菌T4-噬菌体。
T4-噬菌体对大肠杆菌的侵染过程,就是我们在前面讲过的噬菌体感染周期。
大肠杆菌T4-噬菌体:头、尾两部分组成,外为蛋白质外壳+内部DNA分子。
侵染过程:侵染时T4噬菌体的尾部吸附在大肠杆菌的细胞壁上,放出溶菌酶将细胞壁溶成一小孔,借助于尾鞘的收缩,将自己的DNA(T4-DNA)通过小孔注入大肠杆菌细胞内,T4-噬菌体的基因e立即有顺序地进行表达。
T4-噬菌体DNA上约有160个基因,已定位的有70多个基因,装配成完整的噬菌体的全部信息也都在此DNA上。
T4-噬菌体的基因的表达:早前期基因表达—多为调节基因。
其作用是启动自身基因表达。
而抑制宿主大肠杆菌细胞的DNA合成。
晚前期基因表达—是与DNA复制有关的基因。
其产物是:核酸酶:降解大肠杆菌的DNA,为自己DNA 合成提供游离的核苷酸;DNA复制有关的酶:大量合成新T4-DNA。
晚期基因表达—是控制形态发生过程的基因;编码噬菌体结构蛋白的基因。
其产物是大部分直接参与外壳的建成和少数具有酶的作用。
10细菌和病毒的遗传-性导、转导

如果研究三因子转导(three-factor transduction),只需分析一个实 验的结果就可以推出三个基因的次序。
普遍性转导
例如:供体基因型a+b+c+,受体的基因型为a- b- c- 。 供体用P1噬菌体感染,P1的后代再用来感染受体细胞,
然后把受体细胞接种在选择培养基上。
如果通过中断杂交已知三个基因中的一个如a不在中 间,就可对a+进行选择,即在对a+进行选择的选择培 养基上,把可以生长的a+细胞选出来。然后,再把被 选择的受体细胞重复接种在其他对b+或c+进行选择的 选择培养基上,检查a+细胞是否同时具有b+和c+。
突变子和重组子都是一个核苷酸对或者碱基对(bp)。所
以基因内每个碱基均可能发生突变,任意两个碱基间均能 发生交换重组
噬菌体突变型的互补试验
属于同一基因(功能单位)还是两个基因突变产生的呢
p59
对于两个独立起源的、表型相似的隐性突变,如何判定是 在二倍体生物中,可以建立双突变杂合体。双突变体杂合 体有两种形式:顺式(cis)和反式(trans)
普遍性转导
最少的一类转导体应当代表最难于转导的情况,
这种转导体是同时发生交换次数最多的一类。
这种转导子的基因排列应为两边是供体基因,而
中间为受体基因。
假定由实验得到的最少的转导体类别为a+b+c- ,
那么就可以确定,这三个基因的正确次序应当是 acb或bca,而不是abc。
普遍性转导
如λ的DNA,既可以以自主的状态存在,也可以整合在细菌染色 体中。这种有两种状态的遗传因子叫做附加体(episome)。
细菌和病毒的遗传学分析

用不同的Hfr菌株进行中断杂交实验所作出的大肠杆菌基因连锁图,其基因向F-细胞转移的顺序大不相同。
重组作图
01
当转移时间间隔在两分钟之内, 如已知lac与ade紧密连锁,距离约为1分钟,中断杂交作图就不可靠,须用传统的重组作图(recombination mapping)
01
不用亲本类型 两对基因间的交换频率,必须在形成部分二倍体的条件下,计算重组率。 部分二倍体如果不发生重组,无法鉴别。 接合重组不产生相反的重组类型
低频重组与高频重组
高频重组(High frequence recombination, Hfr)
F因子整合到了细菌染色体上,与F-细胞接合后将供体染色体的一部分或全部传递给F-受体,当供体和受体的等位基因带有不同的遗传标记时,可观察到它们之间发生重组,频率可达到10-2以上,称为高频重组品系(菌株)
杂合DNA复制后,形成一个亲代类型的DNA和一个重组类型的DNA并导致转化细胞的形成与表达。
转化的进程
4 共转化与遗传图谱绘制
共转化:供体的一条DNA片段上的两个基因同时转换的现象。 利用共同转化绘制细菌连锁遗传图谱的基本原理: 相邻基因发生共同转化的概率与两者的距离间成正向关系,基因间距离越近,发生共同转化的频率越高,反之越低。 因此可能通过测定两基因共同转化的频率来指示基因间的相对距离。
数理与生物工程学院
单击添加副标题
遗 传 学
单击添加副标题
第七章细菌和病毒的遗传学分析
目录
1
2
二 细菌的接合与染色体作图
1.接合现象的发现
细菌的接合首先是莱德伯格( Lederberg )和塔特姆( Tatum )在1946大肠杆菌杂交试验中发现的。
医学-第四章病毒遗传分析

终止 5`UAG 3` 3`AUC 5` 酪氨酸
(2)噬菌体的抑制因子敏感突变型类型及表现 琥珀型(amber)UAG 赭石型(ocher)UAA 乳白型(opal) UGA
表5-2携带不同专一性抑制基因宿主中sus突变噬菌体的表现
(四)无义突变与无义抑制突变
无义突变:指一个为氨基酸编码的密码变为终止密码 的突变。
• Benzer所用 T4的 r II突变就是遗传学研究 中所用的第一个条件致死突变型。
• T4噬菌体有多个迅速裂解突变型,分别称为 rl, r II,rIII等,它们位于 T4染色体 DNA的不同区 段,这 3组突变型由于在大肠杆菌不同菌株上的 反应不同可以相互区别。
• T4 r II突变使所侵染细胞迅速裂解形成大噬菌 斑,所以称为 r II突变型。
(1)抑制因子敏感突变的概念: 例如:噬菌体mRNA基因 细菌tRNA基因反密码子
正常 突变
突变
正常
基因:5`TAC 3`5`TAG 3` 3`ATC 5`3`ATG 5`
mRNA 5`UAC 3` 5`UAG 3` 3`AUC 5` 3`AUG 5`
酪氨酸 酪氨酸
表型:酪氨酸
噬菌体生长的测定——一步生长曲线
一步生长曲线:定量描述一群菌体内毒性噬菌体生 长规律的实验曲线。
感染后培养过程
被噬菌体侵染的
菌群培养过程
定时取培养 液与敏
感菌混合平 板培养
不同取样时间培养液与敏感菌混合 平板培养产生的噬菌斑数量的动态
• 四、基本术语 • 1.涂布效率(e.o.p)=噬菌斑/感染噬菌体颗
2.1 互补测验原理和方法 基础遗传学研究首先须有突变型,然后
细菌及病毒的遗传分析h

trp2+ his2+ tyr1+转化trp2- his2- tyr1- 实验 trp2 34 his2 13 tyr1
Hfr菌株在切除F因子时发生错误切除,分离出一个携带F因子和部分宿主染色体基因的遗传因子,这种带有宿主染色体基因的F因子称为F΄因子。
T2噬菌体的基因重组
将两种不同的T2突变体进行杂交,对其杂交子代进行重组分析 杂交方法: 将Ttor和Ttos两种大肠杆菌细胞混合 同时接种高浓度的T2噬菌体的h-r+和h+r-两种突变体,保证绝大多数细菌都被一个以上噬菌体感染 两种不同的噬菌体DNA可能在宿主细胞内进行重组,从而产生非亲本型子代h+r+和h-r-。 亲本型 重组型
F因子在杂交中的行为——接合过程
(三)中断杂交实验作图
中断杂交实验作图
1分钟≈20%的重组值
二、转化
转化(transformation):指某些细菌(或其它生物)能通过其细胞膜摄取周围介质中的DNA片段,并将此外源DNA片段整合到自己染色体组中的过程。 (一)转化的过程 非感受态细胞 外源DNA被洗掉了 转化因子 感受态细胞 外源DNA仍与细胞结合 整合 吸收 整合 供体单链DNA进入受体细胞后与受体染色体的某一部分联会,并进一步置换受体的对应染色体区段的过程。
第十章 细菌及病毒的遗传分析(2h)
1
第一节 细菌和病毒遗传研究的意义
2
第二节 噬菌体的基因重组
3
第三节 细菌基因重组
4
本章要求
5
思考题
繁殖世代所需时间短;
易于管理和进行化学分析;
便于研究基因的作用;
便于研究基因的突变;
遗传物质较简单,便于用作研究基因结构、功能及调控机制的材料。
遗传学_ 细菌和病毒的遗传分析_
1180 + 418 + 685 +107 +11940 +3660
100% = 2390 100% =13% 17990
trp2
tyr
34
his2
13 tyr1
his
40
trp
八、转导(transduction)
⚫ 普遍性转导(Generalized transduction)
转导是以噬菌 体为媒介,将 外源基因携带 入细菌,使受 体细胞发生遗 传重组的方式。
a、b间发生交换
单性状的转化子
a、b间不发生交换
双性状的转化子
七、转化作图的原理
细菌两连锁基因的交换率
=
单性状转化子的数 单性状转化子数+共转化的转化子数
100%
表7-1 枯草芽孢杆菌trp2+ his2+ tyr1+(供体)× trp2- his2- tyr1-(受体)的转化实验 座位转化子类型
噬菌体的遗传分析
一、细菌和病毒的遗传分析
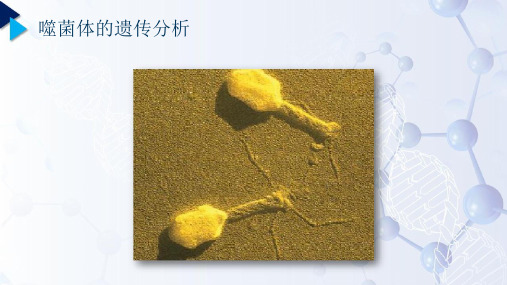
7-1 T4噬菌体的电镜照片
二、病毒对遗传学研究的贡献
1952年 Hershey & Chase的同位素示踪试验
证明T4病毒的遗传物质 是脱氧核糖核酸(DNA) 【1969年诺贝尔奖】
二、病毒对遗传学研究的贡献
1956年Fraemkel Conrat的烟草花叶病毒的重建试验
滑,可致病)
粗糙型R菌株 (无荚膜,菌落粗
糙,不致病)
三、转化现象的发现——Griffth的肺炎双球菌实验
IIR菌株不致病 IIIS菌株致病
灭活的IIIS菌株不致病 灭活的IIIS菌株的某种物 质使IIR菌株发生性状改 变,变成致病的IIIS菌株
高通量测序及其应用于细菌和病毒的遗传学研究

高通量测序及其应用于细菌和病毒的遗传学研究随着高通量测序技术的不断发展,科学家们可以更加深入地研究微生物的遗传学。
在细菌和病毒研究领域,高通量测序技术已经成为必备的工具。
本文将介绍高通量测序技术的原理、应用范围及其对细菌和病毒遗传学研究的意义。
一、高通量测序技术原理高通量测序技术是对DNA或RNA序列进行快速、准确、高效的测序分析技术,通过高速测序平台、实时数据分析和大数据的存储,能够同时对众多生物样本进行测序分析。
测序分析主要包括以下步骤:1. 文库制备DNA或RNA样本需要先进行文库制备。
文库制备的方法包括PCR扩增文库和文库构建(例如用转录酶逆转录RNA并将其转换为cDNA)。
2. 测序平台高通量测序平台的种类有很多。
其中Illumina、Ion Torrent、PacBio和Oxford Nanopore等平台是应用较为广泛的。
3. 数据分析数据分析包括质量控制、比对、分析和注释等步骤,其目的是解释原始序列并从中提取有用的生物信息。
二、高通量测序技术的应用高通量测序技术在基因组学、转录组学、表观遗传学和染色体构象等领域的应用已经得到了广泛的认可。
在微生物学领域,高通量测序技术可应用于:1. 细菌基因组研究高通量测序技术可用于细菌基因组测序,从而深入研究细菌的基因组结构和本质特征。
细菌基因组测序可以帮助科学家们比较发现新的多样性、理解细菌的进化过程、挖掘和注释基因、发现新的生物学功能等。
此外,高通量测序技术也可以为细菌群落的DNA比对提供便利,从而更加全面地评估其进化和多样性。
2. 细菌转录组研究高通量测序技术可用于分析细菌的转录组,并帮助科学家们了解细菌在不同生活状态下基因表达的变化。
通过分析转录组数据,科学家们可以发现新的生物学过程并理解细菌的代谢途径等。
3. 病毒遗传学研究高通量测序技术也在病毒学研究中得到了广泛的应用,包括分析病毒基因组、检测病毒变异等。
病毒测序主要涉及到两个方面,即病毒本身的基因组信息和宿主对病毒的响应。
病毒进化和生态遗传学特征分析

病毒进化和生态遗传学特征分析在当前的全球环境中,病毒的进化和变异是一个备受关注的话题。
随着科技的不断进步,我们越来越了解到病毒的生态遗传学特征,这对于我们预测和控制病毒传播具有重要的意义。
一、病毒生态系统及其进化病毒生态系统包括病毒、寄主和环境因素等。
病毒的进化和演化是受到这些因素的共同影响的。
寄主的免疫力不断发展,病毒需要不断的适应和进化才能在寄主中存活下来。
此外,环境因素如气候、地理位置等也会对病毒的演化和分布产生影响。
病毒的进化是非常快速和复杂的过程,它可能产生新的病毒毒株,这可能对大众的健康和医疗产生很大的危害。
正确的预测和有效的控制是相当重要的。
二、生态遗传学特征的分析生态遗传学的研究重点是遗传变异和环境适应性之间的关系,这对于理解病毒的进化规律和遗传策略有着重要的启示。
1. 基因突变病毒的存在依赖于基因组的完整性和准确性,任何基因的突变都可能影响病毒的功能。
这种突变可能是病毒DNA或RNA序列改变、插入、删除等,导致了在病毒毒株中的遗传变异。
2. 基因重组基因重组是指两种不同病毒的基因互相组合形成新的毒株。
这个过程通常发生在两种病毒感染同一个寄主的情况下,遗传物质之间的交互会产生新的遗传特征。
3. 病毒适应性进化随着寄主的进化和免疫系统的演化,病毒也在不断地调整自己的适应性属性以避免被免疫系统攻击。
病毒分成两种:一种是利用旧的特征来适应新的环境;另一种则是在新的环境中产生新的变化,以适应当前的情况。
三、对于病毒进化和生态遗传学特征的控制策略基因突变和重组是病毒演化的关键,控制的策略有以下几个方面:1. 加强公共卫生意识对于病毒的早期检测和隔离是非常重要的,通过大力宣传公共卫生意识,增加大众的疫情认知度和疫情预防意识,是真正有效遏制病毒的传播和进化。
2. 病毒监测和追踪对于不同地区不同时期的病毒状况进行监测和追踪,并及时报告疫情情况,可以获得及时的消息,为疫情预测和控制提供更有意义的信息。
猫冠状病毒的全基因测序与遗传进化分析

Chinese Journal of Animal Infectious Diseases中国动物传染病学报收稿日期:2021-08-31基金项目:兽医病理生物学与疫病防控安徽省重点实验室自主课题(SYZZ2017003);科技部国家重点研发计划(2018YFD0500100)作者简介:张淼,男,硕士,主要从事动物疾病的研究通信作者:王桂军,E-mail:************.cn 2023,31(6):108-115·研究论文·摘 要:为了解猫传染性腹膜炎病毒(FIPV )的基因组特征和遗传变异情况。
本试验利用RT-PCR 方法从患病猫组织中鉴定出1株Ⅰ型FIPV 病毒,通过RT-PCR 扩增18个片段的目的基因,连接到pCE-TA 克隆载体后测序,对测序结果进行拼接获得FIPV NJ-20-a 株的全基因序列,对获得的全基因序列和编码区序列以往毒株进行同源性分析,并构建S 基因系统进化树。
结果显示NJ-20-a 株与以往毒株同源性较低,新分离毒株基因组变异较大,通过编码区序列同源性分析发现S 基因和3a 、3b 、3c 基因是变异的主要区域,S 基因系统进化树发现NJ-20-a 株处于Ⅰ型FIPV 分支内的单独分支,与以往毒株进化差异较大,表明猫冠状病毒在不同地域遗传进化过程中差异较大。
本研究通过对 FIPV NJ-20-a 毒株进行全基因测序和分析,为猫冠状病毒的分子生物学研究和流行性学的调查提供了一定基础。
关键词:FIPV ;NJ-20-a 株;全基因测序;遗传进化分析中图分类号:S852.65文献标志码:A文章编号:1674-6422(2023)06-0108-08猫冠状病毒的全基因测序与遗传进化分析张 淼,吕 炫,毕庄莉,朱英奇,张 冲,李佳明,张瑞辰,吴 琼,王桂军(安徽农业大学动物科技学院,合肥230036)Abstract: To understand the genomic characteristics and genetic variation of Feline infectious peritonitis virus (FIPV), the type I FIPV strain NJ-20-a was isolated from diseased feline tissues by RT-PCR in the present study. The target genes of 18 fragments were amplifi ed by RT-PCR and then the amplifi ed products were cloned into pCE-TA vector. After sequencing, the whole genomic sequence of FIPV NJ-20-a strain was obtained by splicing. The whole genomic and coding region sequences were compared with previous strains for analyzing their homology and constructing the S gene phylogenetic tree. The results showed that the homology of NJ-20-a strain and previous strains was lower, indicating this novel FIPV strain NJ-20-a experienced significantly variation. Analysis of coding region sequences also showed that the S gene and 3a , 3b and 3c genes were the main regions of variation. Thep hylogenetic analysis of the S gene showed that FIPV NJ-20-a strain belonged to a separate branch of type I FIPV branch, which was quite different from previous strains. In conclusion, these results indicated that there were great differences in the genetic evolution of feline coronavirus in different regions. This study provided a basis for molecular biology and epidemic investigation of feline coronavirus by sequencing and analyzing the whole genome of FIPV NJ-20-a strain.Key words: Feline coronavirus; NJ-20-a strain; genome sequencing; phylogenetic analysisThe Whole Genomic Sequencing and Genetic Evolution Analysis of A FelineCoronavirus StrainZHANG Miao, LYU Xuan, BI Zhuangli, ZHU Yingqi, ZHANG Chong, LI Jiaming, ZHANG Ruicheng,WU Qiong, WANG Guijun(College of Animal Science and Technology, Anhui Agricultural University, Hefei 230036, China)· 109 ·张 淼等:猫冠状病毒的全基因测序与遗传进化分析第31卷第6期猫传染性腹膜炎(feline infectious peritonitis, FIP)是一种猫的慢性型、进行性、致死性的传染病,其病原为猫传染性腹膜炎病毒(Feline infectious peritonitis virus, FIPV),由猫冠状病毒(Feline coronavirus, FCoV)突变而来[1]。
病毒学研究的方法和技术

病毒学研究的方法和技术病毒学是研究病毒的学科,主要关注病毒的生物学特性、分类、传播和致病机制。
病毒学的研究方法和技术种类繁多,本文将按照其研究方向和用途进行介绍。
一、病毒分类和鉴定方法病毒分类是研究病毒的基础,也是为寻找针对特定病毒的治疗手段提供重要依据。
常用的病毒分类方法包括形态学分类、生物物理化学分类、分子生物学分类等。
其中最具代表性的是分子生物学分类方法。
该方法通过对病毒遗传物质的DNA或RNA序列进行分析,建立起了病毒系统发育树,依依分类病毒,如爱滋病病毒(HIV)、流感病毒等。
利用PCR扩增技术可以快速鉴定出病毒特异性DNA/RNA序列,为病毒的快速检测和鉴定提供了重要的技术支持。
二、病毒核酸和蛋白质的分离与分析方法分离和分析病毒核酸和蛋白质是研究病毒基因组和蛋白质组成为了进一步探究病毒的生物学特性和致病机制。
常用的方法包括电泳分离、质谱分析、荧光定量PCR等。
其中,电泳分离技术被广泛应用。
根据不同的电泳方式,电泳分离技术可以分为凝胶电泳、毛细管电泳和微流管电泳等。
凝胶电泳主要用于分离病毒核酸和蛋白质;毛细管电泳主要用于分析病毒核酸序列;微流管电泳则可在微量样品中分离和分析病毒核酸和蛋白质。
质谱分析技术主要用于检测病毒蛋白质的质量、结构、组成,提供理论支持和新的治疗靶标;荧光定量PCR则是目前病毒检测中最常用的一种快速检测技术,尤其适用于新型冠状病毒检测。
三、病毒培养和检测方法病毒培养技术是研究病毒生长和复制规律的基础。
通过极端条件下的体外培养,可以从体外获得大量相同的病毒实验体,实现对病毒生物学特性的深入分析以及寻找针对特定病毒的治疗手段的研发。
病毒的检测技术主要分为传统检测和分子检测两大类。
传统检测方法包括免疫荧光技术(IFA)、酶联免疫吸附试验(ELISA)等,主要基于病毒特异性蛋白质或其他病毒成分的检测;分子检测技术则主要利用PCR方法,检测病毒特异性DNA或RNA序列,如RT-PCR、LAMP等。
1株欧亚类禽猪流感病毒的分离鉴定及遗传进化分析

中国畜牧兽医 2024,51(4):1642-1650C h i n aA n i m a lH u s b a n d r y &V e t e r i n a r y Me d i c i n e 1株欧亚类禽猪流感病毒的分离鉴定及遗传进化分析韩 慧1,郭亚晶1,颜广智2,陈盛楠2,刘明杰2,莫美连2,黄良宗1(1.佛山科学技术学院生命科学与工程学院,佛山528000;2.广东方道基因生物科技有限公司,佛山528000)摘 要:ʌ目的ɔ了解广东地区猪流感病毒(S w i n e i n f l u e n z a v i r u s ,S I V )的流行情况并探究其分子生物学特征㊂ʌ方法ɔ采集广东某猪场疑似猪流感病毒感染猪的鼻拭子和肺脏组织样品进行病毒分离鉴定㊁遗传进化和关键氨基酸位点分析㊂ʌ结果ɔ样品经实时荧光定量R T -P C R 检测为猪流感病毒核酸阳性;在红细胞凝集试验中,该病毒对鸡红细胞有凝集作用,血凝效价为1ʒ128;8个基因片段序列结果经B L A S T 比对和进化树分析显示,HA ㊁N A 基因属于欧亚类禽猪流感病毒(H 1N 1)分支,P A ㊁P B 1㊁P B 2㊁N P 和M 基因属p d m /09分支,N S 基因属于北美三源重组分支,因此,本试验分离株属于G 4基因型欧亚类禽猪流感病毒,将其命名为A /s w i n e /G u a n g d o n g/C J M 2/2022(H 1N 1)㊂关键氨基酸位点分析显示,分离株HA 蛋白裂解位点序列为P S I Q S R /G L ,具有典型低致病性流感病毒的分子特征㊂HA 基因在受体结合位点处的190㊁225㊁226位氨基酸分别为D ㊁E ㊁Q ,表明其既具有结合人型唾液酸受体的潜能又具有结合禽型唾液酸受体的潜能㊂N A 基因关键氨基酸残基均未发生突变,提示分离株对奥司他韦和扎那米韦等神经氨酸酶抑制剂的敏感性较高,而M 基因3处氨基酸位点突变为V 27A ㊁A 30T ㊁D 44A ,提示对金刚烷胺类药物耐药性增加㊂ʌ结论ɔ本研究分离鉴定的毒株为G 4基因型欧亚类禽猪流感病毒,关键氨基酸位点分析提示该毒株具有适应在哺乳动物中复制和毒力增强的特征㊂本研究结果为广东地区猪流感的防控提供了参考数据㊂关键词:欧亚类禽猪流感病毒;分离鉴定;序列分析;H 1N 1亚型中图分类号:S 852.65+1文献标识码:AD o i :10.16431/j .c n k i .1671-7236.2024.04.032 开放科学(资源服务)标识码(O S I D ):收稿日期:2023-11-17基金项目:广东省自然科学基金项目(2017A 030310612)联系方式:韩慧,E -m a i l :1570387219@q q .c o m ㊂通信作者黄良宗,E -m a i l :l i a n g z o n g h u a n g@f o s u .e d u .c n I s o l a t i o n ,I d e n t i f i c a t i o na n dG e n e t i cE v o l u t i o nA n a l ys i s o f a E u r a s i a nA v i a n -l i k e S w i n e I n f l u e n z aV i r u sH A N H u i 1,G U O Y a j i n g 1,Y A N G u a n g z h i 2,C H E NS h e n gn a n 2,L I U M i n g j i e 2,MO M e i l i a n 2,HU A N GL i a n g z o n g1(1.S c h o o l o f L i f eS c i e n c e a n dE n g i n e e r i n g ,F o s h a nU n i v e r s i t y ,Fo s h a n 528000,C h i n a ;2.G u a n g d o n g F i n d e r g e n eB i o t e c h n o l o g y C o .,L t d .,F o s h a n 528000,C h i n a )A b s t r a c t :ʌO b j e c t i v e ɔT h e e x pe r i m e n tw a s a i m e d t ou n d e r s t a n d t h e p r e v a l e n c e of S w i n e i n f l u e n z a v i r u s (S I V )i n G u a ng d o n g a n de x p l o r e i t sm o l e c u l a rb i o l o g i c a l ch a r a c t e ri s t i c s .ʌM e t h o d ɔN a s a l s w a ba n dl u n g t i s s u es a m p l e so f p i g ss u s pe c t e dt ob e i nf e c t e d w i t hS w i n e i n f l u e n z av i r u sw e r e c o l l e c t e d f r o ma p ig f a r m i nG u a n g d o n g f o r v i r u s i s o l a t i o n a n d i d e n t i f i c a t i o n ,g e n e t i c e v o l u t i o n a n d k e y a m i n o a c i d s i t e a n a l y s i s .ʌR e s u l t ɔTh e s a m pl e sw e r e t e s t e d p o s i t i v e f o rS w i n e i n f l u e n z av i r u s n u c l e i c a c i db y R e a l -t i m e q u a n t i t a t i v eR T -P C R.I n t h e r e db l o o dc e l l a g gl u t i n a t i o n t e s t ,t h ev i r u s e x h i b i t e d a g g l u t i n a t i o nw i t h c h i c k e n r e db l o o d c e l l s ,w i t hah e m a g gl u t i n a t i o n t i t e r o f 1ʒ128.T h e r e s u l t s o f s e q u e n c i n g a n a l y s i so f e i g h t g e n es e g m e n t sw e r ea n a l y z e db y B L A S Tc o m pa r i s o na n d4期韩慧等:1株欧亚类禽猪流感病毒的分离鉴定及遗传进化分析c o n s t r u c t i o no fe v o l u t i o n a r y t r e e s,a nd HA a n d N A ge n e sb e l o n g e dt ot h eE u r a s i a na v i a n-l i k e S w i n e i nf l u e n z av i r u s(H1N1)b r a n c h,P A,P B1,P B2,N P a n d Mg e n e sb e l o n g e d t o th e p d m/09 b r a n c h,a n d N S g e n eb e l o n g e dt ot h e N o r t h A m e ri c a nt r i p l er e a s s o r t a n tb r a n c h,t h e r e f o r e,t h e i s o l a t e i n t h i s s t u d y b e l o n g e dt o t h eG4g e n o t y p eE u r a s i a na v i a n-l i k eS w i n e i n f l u e n z av i r u s,a n d w a s n a m e dA/s w i n e/G u a n g d o n g/C J M2/2022(H1N1).K e y a m i n oa c i ds i t e a n a l y s i s s h o w e d t h a t t h e c l e a v a g e s i t e s e q u e n c e o fH A p r o t e i no f t h e i s o l a t ew a sP S I Q S R/G L,w h i c hh a d t h em o l e c u l a r c h a r a c t e r i s t i c s o f a t y p i c a l l o w p a t h o g e n i c i t y i n f l u e n z a v i r u s.T h e a m i n o a c i d s a t p o s i t i o n190,225 a n d226o f t h e r e c e p t o rb i n d i n g s i t eo f HA g e n ew e r eD,Ea n dQ,r e s p e c t i v e l y,w h i c hs u g g e s t e d t h a t i t h a dt h e p o t e n t i a l a b i l i t y t ob i n dt ot h eh u m a ns a l i v a r y a c i dr e c e p t o ra n d i ta l s oh a dt h e p o t e n t i a l t ob i n da v i a ns i a l i ca c i dr e c e p t o r s.N o n eo f t h ea m i n oa c i dr e s i d u e so f N A g e n ew e r e m u t a t e d,s u g g e s t i n g t h a t t h e i s o l a t ew a s s e n s i t i v e t on e u r a m i n i d a s e i n h i b i t o r s s u c ha s o s e l t a m i v i r a n d z a n a m i v i r.H o w e v e r,t h em u t a t i o n s a t t h r e e a m i n o a c i d s i t e s i n M g e n ew e r eV27A,A30Ta n d D44A,s u g g e s t i n g a ni n c r e a s e dr e s i s t a n c et oa m a n t a d i n e-b a s e dd r u g s.ʌC o n c l u s i o nɔT h es t r a i n i s o l a t e da n di d e n t i f i e di nt h i ss t u d y w a sa G4E u r a s i a na v i a n-l i k eS w i n ei n f l u e n z av i r u s.T h e a n a l y s i s o f k e y a m i n oa c i ds i t e ss u g g e s t e dt h a t t h i ss t r a i nh a dt h ec h a r a c t e r i s t i c so f a d a p t i n g t o r e p l i c a t i o na n d e n h a n c i n g v i r u l e n c e i nm a m m a l s.T h e r e s u l t s o f t h i s s t u d yp r o v i d e d r e f e r e n c e d a t a f o r t h e p r e v e n t i o na n d c o n t r o l o f s w i n e i n f l u e n z a i nG u a n g d o n g.K e y w o r d s:E u r a s i a n a v i a n-l i k e S w i n ei n f l u e n z a v i r u s;i s o l a t i o n a n di d e n t i f i c a t i o n;s e q u e n c e a n a l y s i s;H1N1s u b t y p e猪流感是由猪流感病毒(S w i n ei n f l u e n z a v i r u s,S I V)引起的猪的一种急性呼吸道传染病,临床症状以咳嗽㊁流鼻涕㊁发热㊁食欲减退为主[1]㊂猪的呼吸道上皮细胞同时具有α-2,3和α-2,6两种唾液酸(s i a l i c a c i d,S A)受体,能感染人流感病毒和禽流感病毒,不同流感病毒同时感染猪时极易发生基因重排而产生新的流行毒株,所以猪被认为是流感病毒发生基因重排的 混合器 [2-3]㊂流感病毒的重排是产生具有新抗原性和生物学特性的子代病毒的主要机制,可导致流感灾难性的大流行㊂不同亚型S I V在世界范围内猪群中呈地区性流行,其中以H1N1亚型S I V最为常见㊂H1N1亚型S I V又可分为经典H1N1亚型(C l a s s i c a l s w i n e i n f l u e n z a v i r u s,C S H1N1S I V)和欧亚类禽H1N1亚型(E u r a s i a na v i a n-l i k e H1N1S w i n ei n f l u e n z a v i r u s,E A H1N1S I V)等㊂E A H1N1亚型S I V于1979年在欧洲猪群中首次被报道,之后欧洲H1N1亚型S I V主体变成了E A H1N1亚型S I V[4]㊂中国E A H1N1分支于2001年首先报道于香港,随后在各地猪群中传播开来,分离率不断上升,目前已成为中国猪群中流行的优势毒株[5]㊂2009年,墨西哥暴发了席卷全球人群的甲型H1N1(P a n d e m i cH1N1 i n2009,p d m/09H1N1)流感病毒,成为21世纪第1次流感大流行,在全球范围内造成18000多人死亡[6]㊂大流行之后p d m/09H1N1毒株在人群中持续传播并传入猪群,p d m/09H1N1毒株在猪群中与E A H1N1亚型S I V等多种流行病毒发生基因重排,极大地危害了人类的公共健康[7]㊂2018年,猪群中E A H1N1亚型S I V与p d m/09H1N1亚型S I V等重排形成了多种基因型,其中G4基因型的重排方式是:HA和N A基因来自于E A H1N1亚型S I V,N S基因来自北美三源重排S I V,其余内部基因来自p d m/09H1N1亚型S I V[8-10],因此,这种G4基因型病毒对公共卫生构成更严重的威胁㊂目前,E A H1N1亚型S I V在中国南方的猪群中广泛传播,给人类健康带来严重威胁[11-12],因此,监测该地区S I V的流行和变异情况具有重要意义㊂2022年12月,在广东某猪场采集一批猪鼻拭子和肺脏组织样品,进行病毒分离鉴定,并对分离病毒进行全基因组基因测序和遗传进化分析,以了解分离病毒的起源及遗传进化特征,为广东省猪流感综合防控提供参考依据㊂1材料与方法1.1病料、S P F鸡胚病料为采集于广东省某猪场的猪肺脏组织和鼻拭子;9~10日龄S P F鸡胚购自北京梅里亚维通实验动物技术有限公司㊂3461中国畜牧兽医51卷1.2主要试剂2ˑP h a n t aM a x M a s t e rM i x(D y eP l u s)㊁R N A 提取试剂盒(R N AI s o l a t e rT o t a lR N A E x t r a c t i o n R e a g e n t)㊁反转录试剂盒(H i S c r i p tⅡ1s tS t r a n d c D N AS y n t h e s i sK i t)㊁胶回收试剂盒(F a s t P u r eG e l D N A E x t r a c t i o n M i n iK i t)均购自南京诺唯赞生物科技有限公司;D L2000D N A M a r k e r购自天根生化科技(北京)有限公司㊂1.3病毒分离、鉴定及纯化将肺脏组织研磨液和鼻拭子液8000r/m i n离心5m i n,取上清过0.22μm滤膜除菌,接种于9~ 10日龄S P F鸡胚尿囊腔中,于37ħ恒温培养箱培养,去除24h内死亡鸡胚,72h后收集鸡胚尿囊液㊂按照上述方法将尿囊液再次接种鸡胚盲传2代,收集第3代尿囊液,通过S I V实时荧光定量R T-P C R 检测方法[13]和鸡红细胞凝集试验鉴定获得的病毒液,于-80ħ保存备用㊂鸡红细胞凝集试验是在V 形孔微量血凝板上将1%鸡红细胞与不同倍比稀释度的病毒反应,将血凝板倾斜70ʎ,观察沉淀于孔底的红细胞是否向下呈线状流动,以出现全部凝集(红细胞无流动)的最大稀释度为本分离株的血凝效价㊂1.4病毒全基因组扩增按照R N A提取试剂盒说明书提取病毒R N A,使用反转录通用引物(U n i12:5'-A G C A A A A G C A-G G-3')按照反转录试剂盒使用说明书进行反转录,合成c D N A㊂P C R引物参照H o f f m a n n等[14]建立的流感病毒全基因扩增方法合成,引物信息见表1㊂引物均由金唯智生物科技有限公司合成㊂根据高保真酶2ˑP h a n t aM a xM a s t e rM i x(D y e P l u s)说明书分别扩增分离株的8个基因(P B1㊁P B2㊁P A㊁H A㊁N A㊁N P㊁M和N S基因)节段㊂P C R反应体系50μL:2ˑP h a n t aM a xM a s t e rM i x(D y e p l u s)25μL,上㊁下游引物(10μm o l/L)各2μL,c D N A模板3μL,d d H2O补至50μL㊂P C R反应条件:95ħ预变性3m i n;95ħ变性15s,58ħ退火15s,72ħ延伸2m i n,共35个循环;72ħ延伸5m i n㊂P C R产物经1.0%琼脂糖凝胶电泳进行鉴定㊂扩增产物用胶回收试剂盒回收并送金唯智生物科技有限公司进行测序㊂表1引物信息T a b l e1P r i m e r i n f o r m a t i o n基因G e n e s引物序列P r i m e r s e q u e n c e s(5'ң3')产物大小P r o d u c t s i z e/b pP B2F:T A T T G G T C T C A G G G A G C G A A A G C A G G T C R:A T A T G G T C T C G T A T T A G T A G A A A C A A G G T C G T T T2341 P B1F:T A T T C G T C T C A G G G A G C G A A A G C A G G C A R:A T A T C G T C T C G T A T T A G T A G A A A C A A G G C A T T T2341 P A F:T A T T C G T C T C A G G G A G C G A A A G C A G G T C A R:A T A T C G T C T C G T A T T A G T A G A A A C A A G G T A C T T2233 H A F:T A T T C G T C T C A G G G A G C A A A A G C A G G G G R:A T A T C G T C T C G T A T T A G T A G A A A C A A G G G T G T T T T1778 N A F:T A T T G G T C T C A G G G A G C A A A A G C A G G A G T R:A T A T G G T C T C G T A T T A G T A G A A A C A A G G A G T T T T T T1565 N P F:T A T T C G T C T C A G G G A G C A A A A G C A G G G T A R:A T A T C G T C T C G T A T T A G T A G A A A C A A G G G T A T T T T T1413 M F:T A T T C G T C T C A G G G A G C A A A A G C A G G T A G R:A T A T C G T C T C G T A T T A G T A G A A A C A A G G T A G T T T T T1027 N S F:T A T T C G T C T C A G G G A G C A A A A G C A G G G T G R:A T A T C G T C T C G T A T T A G T A G A A A C A A G G G T G T T T T8901.5病毒遗传进化分析测序结果通过S e q M a n软件拼接,N C B I网站在线B L A S T进行序列比对㊁相似性分析,通过N e t N G l y c1.0软件(h t t p s:ʊs e r v i c e s.h e a l t h t e c h.d t u.d k/se r v i c e s/N e t N G l y c-1.0/)分析预测潜在糖基化位点,在G e n B a n k中下载参考序列,使用M e g a7.0基于N e i g h b o r-J o i n i n g方法构建遗传进化树,B o o t s t r a p值为1000㊂2结果2.1病毒分离鉴定经S I V实时荧光定量R T-P C R检测,鸡胚尿囊液样品C t值为20.88,判定为S I V核酸阳性(图1)㊂将收获的鸡胚尿囊液进行红细胞凝集试验,结果显示,有血凝性,血凝效价为1ʒ128㊂将分离得到的毒株命名为A/s w i n e/G u a n g d o n g/C J M2/2022㊂2.2分离株全基因组测序通过R T-P C R对病毒的8个基因片段进行扩增,得到P B1㊁P B2㊁P A㊁HA㊁N A㊁N P㊁M和N S8个基因片段,大小分别为2341㊁2341㊁2233㊁1778㊁1565㊁1413㊁1027和890b p(图2),与预期目的条带大小相符㊂44614期韩 慧等:1株欧亚类禽猪流感病毒的分离鉴定及遗传进化分析1,鸡胚尿囊液;2,阴性对照1,C h i c k e ne m b r y o a l l a n t o i c f l u i d ;2,N e g a t i v e c o n t r o l 图1 实时荧光定量R T -P C R 检测结果F i g.1 R e s u l t s o fR e a l -t i m e q u a n t i t a t i v eR T -P CR M ,D L 2000D N A M a r k e r ;1~8,P B 1㊁P B 2㊁P A ㊁HA ㊁N A ㊁N P ㊁M 和N S 基因M ,D L 2000D N A M a r k e r ;1-8,P B 1,P B 2,P A ,HA ,N A ,N P ,M a n d N S g e n e s ,r e s p e c t i v e l y图2 分离株各基因片段P C R 扩增结果电泳图F i g .2 E l e c t r o p h o r e s i so fP C Ra m p l i f i c a t i o nr e s u l t so fe a c h g e n e f r a gm e n t o f t h e i s o l a t e 2.3 遗传进化分析2.3.1 病毒全基因组相似性分析 分离株A/s w i n e /G u a n g d o n g/C J M 2/2022的8个基因片段与G e n B a n k 登录的基因序列比对结果显示,HA ㊁N A ㊁P B 2㊁N P 和M 基因均与2018年在北京出现的A/s w i n e /B e i j i n g/0301/2018(H 1N 1)相似性最高,核苷酸相似性分别为97.94%㊁97.60%㊁97.27%㊁98.31%和98.83%,因此,进一步判定分离毒株属于H 1N 1亚型毒株,并将其命名为A /s w i n e/G u a n g d o n g/C J M 2/2022(H 1N 1);P A 基因与A /s w i n e /S h a n d o n g /L Y 142/2017(H 1N 1)的核苷酸相似性最高,为97.65%;N S 基因与A /s w i n e /L i a o n i n g /C Y 1833/2020(H 1N 1)的核苷酸相似性最高,为98.86%;P B 1基因与A /s w i n e /A n h u i /H D 21/2020(H 1N 1))核苷酸相似性最高,为96.92%㊂2.3.2 H A 氨基酸序列分析 分离毒株A/s w i n e /G u a n g d o n g /C J M 2/2022(H 1N 1)HA 基因裂解位点氨基酸序列为P S I Q S R /G L ,与近年来E AH 1N 1亚型S I V H A 裂解位点氨基酸组成相同,裂解位点仅含有1个碱性氨基酸(R ),具有低致病性流感病毒的特征㊂利用N e t N G l y c 1.0软件预测H A 蛋白潜在糖基化位点,结果显示,H A 蛋白具有5个潜在的糖基化位点,分别为26N S T D ㊁38N V T V ㊁288N C T T ㊁493N G T Y 和552N G S L ㊂2.3.3 N A 氨基酸序列分析 分离毒株A /s w i n e /G u a n g d o n g/C J M 2/2022(H 1N 1)N A 基因含有7个潜在糖基化位点,分别为44N Q S E ㊁58N N T W ㊁63N Q T Y ㊁68N V S N ㊁88N S S L ㊁146N G T V 和235N G S C,在58位多出1个潜在糖基化位点N N TW ㊂N A 蛋白氨基酸序列对神经氨酸酶抑制剂类药物如扎那米韦和奥司他韦的敏感位点119(E )㊁152(R )㊁275(H )㊁293(R )㊁295(N )的氨基酸残基均未发生突变㊂2.3.4 病毒表面基因遗传进化分析 在N C B I 下载相关序列,通过M e g a 7.0分析软件,将分离株的HA 基因与G e n B a n k 中的C S H 1N 1㊁E AH 1N 1㊁类人型H 1N 1和p d m /09分支代表毒株进行比对分析并构建遗传进化树㊂结果显示,分离株的HA 基因位于E A H 1N 1进化分支(图3);由N A 基因进化树可看出,分离株的N A 基因也位于E A H 1N 1进化分支(图4)㊂5461中 国 畜 牧 兽 医51卷图3 H A 基因进化树F i g .3 P h y l o ge n e t i c t r e e of H Ag e ne 图4 N A 基因进化树F i g .4 P h y l o ge n e t i c t r e e of N Ag e n e 64614期韩慧等:1株欧亚类禽猪流感病毒的分离鉴定及遗传进化分析2.3.5内部片段基因序列位点分析将分离株的内部片段基因(P B2㊁P B1㊁P A㊁N P㊁M和N S基因)序列进行关键氨基酸位点比对分析㊂P B2蛋白氨基酸位点进行比对发现,T271A㊁A590S和A591R的组合发生了突变㊂P B2蛋白中第431位氨基酸发生了T431M突变,第588位氨基酸发生了T588I突变㊂P B1蛋白的氨基酸位点H436Y发生替换㊂P A蛋白的P224S㊁L295P㊁A515T位点发生替换㊂N P蛋白中K319N㊁Q357K位点发生替换㊂M蛋白的V27A㊁A30T㊁D44A位点发生替换㊂N S蛋白关键氨基酸位点没有发生突变㊂2.3.6内部片段基因遗传进化分析将分离株的内部片段基因(P B2㊁P B1㊁P A㊁N P㊁M和N S基因)进行遗传进化分析,绘制进化树㊂分离株的P B2㊁P B1㊁P A㊁N P和M基因遗传进化分析结果显示,均来位于p d m/09H1N1分支㊂而N S基因处于北美三源重组分支(图5)㊂通过对分离毒株A/ s w i n e/G u a n g d o n g/C J M2/2022(H1N1)的8个基因节段的序列分析发现,该毒株的HA和N A基因来源于E A H1N1分支,P B1㊁P B2㊁P A㊁N P和M基因来源于p d m09H1N1分支,N S基因来源于t r H1N2(N o r t hA m e r i c a n t r i p l e r e a s s o r t a n tH1N2)分支,这属于近几年流行的G4基因型E A H I N1 S I V㊂3讨论S I V可引起猪的高度传染性呼吸系统疾病,发病率高,传播速度快,使患病猪生产性能下降㊂此外,其对人类也有一定的感染性[15]㊂S I V的一个显著特性是通过不断的变异和进化来逃避宿主的免疫保护,从而引发新的流感暴发和流行㊂S I V的持续进化不仅改变了其毒力,还引发了更广泛的猪流感流行,严重威胁了公共卫生安全[16-17]㊂流感病毒H A蛋白受体结合区的特殊氨基酸位点是决定其宿主范围的关键因素,H1亚型流感病毒唾液酸受体结合能力一般取决于第190和225位氨基酸,分离株A/s w i n e/G u a n g d o n g/C J M2/ 2022(H1N1)中HA基因第190和225位氨基酸分别为D㊁E,第226位氨基酸为Q,表明其既具备结合S Aα-2,6-G a l型人流感病毒S A受体的特点,也有结合S Aα-2,3-G a l型禽流感病毒S A受体的可能[18]㊂A型流感病毒P B2蛋白上的627和701位点是影响病毒致病性的关键位点,如发生E627K或D701N突变会显著提高病毒毒力[19],本试验分离毒株未发现这两个位点的突变㊂本试验中,S I V P B2蛋白的T271A㊁A590S和A591R的组合发生突变,有研究表明,这有利于S I V在哺乳动物宿主中的复制效率和毒力[20]㊂P B2蛋白中单个氨基酸T431M 发生突变,该氨基酸的突变对于E A H1N1亚型S I V在小鼠体内的毒力中起着关键作用,会显著增强E A H1N1亚型S I V在小鼠中的毒力[21]㊂分离株的P B1蛋白氨基酸位点H436Y和P A蛋白P224S位点发生相同的突变,这2个位点的突变有助于增强病毒在小鼠身上的毒力[22]㊂N P蛋白中K319N㊁Q357K位点突变,同样表明增强了对小鼠的致病性[23]㊂M基因的V27A㊁A30T㊁D44A位点发生突变,提示分离株可能对金刚烷胺类药物耐药性增加[24]㊂G4基因型S I V自2016年以来在中国逐渐形成流行趋势,主要在猪群中传播[25]㊂该基因型毒株是来源于3种谱系的重排方式,包括E A H1N1㊁p d m/09H1N1病毒,以及综合了禽类㊁人类和猪的流感病毒基因的北美三源重组t r H1N2病毒,中国南方地区生态㊁地理和气候环境独特,猪场㊁鸡场密集及人和畜禽的频繁接触,有利于S I V的变异和流行[26]㊂分离毒株基因片段HA㊁N A与来自E A H1N1亚型S I V相似性较高,部分基因片段与p d m/09H1N1相似性较高,与北京㊁安徽㊁辽宁等省份的片段高度同源,提示分离株可能是在人流感病毒感染猪及生猪跨区域流动过程中重排产生㊂随着S I V的变异和与其他亚型病毒的重组,其跨种间传播的能力和感染人的风险也逐步增强㊂因此,加强对华南地区S I V的监测对公共卫生具有重要意义㊂对于养猪业来说,要采取有效的预防和控制措施,如定期消毒㊁加强饲养管理㊁提高猪群的免疫力等,以减少猪流感的发生和传播㊂74618461中国畜牧兽医51卷A~F,分别为P B1㊁P B2㊁P A㊁N P㊁M和N S基因A-F,P B1,P B2,P A,N P,M a n d N S g e n e s,r e s p e c t i v e l y图5内部片段基因进化树F i g.5P h y l o g e n e t i c t r e e o f i n t e r n a l f r a g m e n t s4期韩慧等:1株欧亚类禽猪流感病毒的分离鉴定及遗传进化分析4结论本研究分离到1株G4型欧亚类禽猪流感病毒(H1N1),将其命名为A/s w i n e/G u a n g d o n g/C J M2/ 2022(H1N1)㊂HA基因裂解位点氨基酸序列为P S I Q S R/G L具有低致病性流感病毒的分子特征,但在不同基因片段的关键氨基酸位点上发生了突变,这可能增强毒力和对哺乳动物的致病性㊂参考文献(R e f e r e n c e s):[1]黄良宗,颜广智,邓汝森,等.猪流感病毒广东株分离鉴定及遗传进化分析[J].中国畜牧兽医,2020,47(8):2625-2633.HU A N GLZ,Y A N GZ,D E N G RS,e t a l.I s o l a t i o n,i d e n t i f i c a t i o na n d g e n e t i ce v o l u t i o na n a l y s i so fS w i n ei n f l u e n z av i r u sf r o m G u a n g d o n g p r o v i n c e[J].C h i n aA n i m a l H u s b a n d r y&V e t e r i n a r y M e d i c i n e,2020,47(8):2625-2633.(i nC h i n e s e)[2]I T O T,C O U C E I R O J N,K E l M S,e t a l.M o l e c u l a rb a s i s f o r t h e g e n e r a t i o n i n p i g s o f I n f l u e n z aAv i r u s e sw i t h p a n d e m i c p o t e n t i a l[J].J o u r n a lo f V i r o l o g y,1998,72(9):7367-7373.[3] MA W,K A HNRE,R I C H TJA.T h e p i g a s am i x i n gv e s s e l f o rI n f l u e n z av i r u s e s:H u m a n a n d v e t e r i n a r yi m p l i c a t i o n s[J].J o u r n a lo f M o l e c u l a r a n d G e n e t i cM e d i c i n e,2008,3(1):158-166.[4] P E N S A E R T M,O T T I S K,V A N D E P U T T J,e t a l.E v i d e n c e f o r t h en a t u r a l t r a n s m i s s i o no f I n f l u e n z a Av i r u sf r o m w i l d d u c t s t o s w i n e a n d i t s p o t e n t i a li m p o r t a n c e f o rm a n[J].B u l l e t i n o f t h eW o r l d H e a l t hO r g a n i z a t i o n,1981,59(1):75-78.[5] L IH,L E N G H,T A N G S,e t a l.P r e v a l e n c e,g e n e t i c sa n d e v o l u t i o n a r y p r o p e r t i e s o f E u r a s i a n a v i a n-l i k eH1N1S w i n e i n f l u e n z a v i r u s e s i n L i a o n i n g[J].V i r u s e s,2022,14(3):643.[6] C E N T E R S F O R D I S E A S E C O N T R O L A N DP R E V E N T I O N(C D C).U p d a t e:S w i n ei n f l u e n z a A(H1N1)i n f e c t i o n s C a l i f o r n i a a n d T e x a s,A p r i l2009[J].M o r b i d i t y a n d M o r t a l i t y W e e k l y R e p o r t,2009,58(16):435-437.[7] V I J A Y K R I S HN A D,P O O N L L,Z HU H C,e t a l.R e a s s o r t m e n to f p a n d e m i c H1N1/2009I n f l u e n z a Av i r u s i n s w i n e[J].S c i e n c e,2010,328(5985):1529.[8] S U N H,X I A O Y,L I U J,e t a l.P r e v a l e n t E u r a s i a na v i a n-l i k e H1N1S w i n ei n f l u e n z a v i r u s w i t h2009p a n d e m i cv i r a l g e n e s f a c i l i t a t i n g h u m a n i n f e c t i o n[J].P r o c e e d i n g s o f t h eN a t i o n a lA c a d e m y o f S c i e n c e s o ft h eU n i t e dS t a t e s o f A m e r i c a,2022,117(29):17204-17210.[9]李梓,赵晓南,黄维娟,等.云南省首例人感染G4基因型欧亚类禽H1N1猪流感病毒病原学特征分析[J].病毒学报,2022,38(2):290-297.L IZ,Z HA O X N,HU A N G W J,e t a l.E t i o l o g i c a lc h a r a c t e r i s t i c so ft h ef i r s th u m a ni n f e c t i o n w i t ht h eG4g e n o t y p e E u r a s i a n a v i a n-l i k e H1N1S w i n ei n f l u e n z a v i r u s i nY u n n a n p r o v i n c e,C h i n a[J].C h i n e s eJ o u r n a lo f V i r o l o g y,2022,38(2):290-297.(i nC h i n e s e)[10] M E N G F,C H E N Y,S O N G Z,e t a l.C o n t i n u e de v o l u t i o n o ft h e E u r a s i a n a v i a n-l i k e H1N1S w i n ei n f l u e n z a v i r u s e si n C h i n a[J].S c i e n c e C h i n a L i f eS c i e n c e,2023,66(2):269-282.[11] Y A N G H,C H E N Y,Q I A O C,e t a l.P r e v a l e n c e,g e n e t i c s,a n dt r a n s m i s s i b i l i t y i nf e r r e t so f E u r a s i a na v i a n-l i k e H1N1S w i n e i n f l u e n z a v i r u s e s[J].P r o c e e d i n g s o f t h eN a t i o n a lA c a d e m y o f S c i e n c e s o ft h e U n i t e dS t a t e s o f A m e r i c a,2016,113(2):392-397.[12]黄书,曾智勇,梁海英,等.1株H1N1亚型猪流感病毒的进化分析及分子特征研究[J].中国畜牧兽医,2023,50(12):5084-5093.HU A N G S,Z E N G Z Y,L I A N G H Y,e t a l.E v o l u t i o n a r y a n a l y s i s a n dm o l e c u l a r c h a r a c t e r i s t i c so fa H1N1s ub t y p e S w i n ei n f l u e n z a v i r u s[J].C h i n aA n i m a l H u s b a n d r y&V e t e r i n a r y M e d i c i n e,2023,50(12):5084-5093.(i nC h i n e s e)[13]张春明,乔传玲,陈艳,等.猪流感病毒M基因实时荧光定量P C R诊断方法的建立[J].中国预防兽医学报,2008,30(10):805-810.Z HA N G C M,Q I A O C L,C H E N Y,e t a l.D e v e l o p m e n t o f R e a l-t i m e f l u o r e s c e n t q u a n t i t a t i v eP C R f o r d e t e c t i o n o f M g e n e o f S w i n ei n f l u e n z av i r u s e s[J].C h i n e s e J o u r n a l o f P r e v e n t i v eV e t e r i n a r yM e d i c i n e,2008,30(10):805-810.(i nC h i n e s e) [14] H O F F MA N N E,S T E C H J,G U A N Y,e t a l.U n i v e r s a l p r i m e rs e t f o r t h e f u l l-l e n g t ha m p l i f i c a t i o no f a l l I n f l u e n z aAv i r u s e s[J].A r c h i v e s o f V i r o l o g y,2001,146(12):2275-2289.[15] M C K I MM-B R E S C H K I NJ,T R I V E D IT,H A M P S O N A,e t a l.N e u r a m i n i d a s e s e q u e n c e a n a l y s i s a n ds u s c e p t i b i l i t i e so fI n f l u e n z av i r u sc l i n i c a l i s o l a t e st oz a n a m i v i ra n d o s e l t a m i v i r[J].A n t i m i c r o b i a l A g e n t sa n dC h e m o t h e r a p y,2003,47(7):2264-2272.[16] Z HU W,Z HA N G H,X I A N G X,e t a l.R e a s s o r t a n tE u r a s i a na v i a n-l i k e I n f l u e n z aA(H1N1)v i r u s f r o mas e v e r e l y i l l c h i l d,H u n a n p r o v i n c e,C h i n a,2015[J].E m e r g i n g I n f e c t i o u sD i s e a s e s,2016,22(11):1930-1936.9461中国畜牧兽医51卷[17] Q IX,C U IL,J I A O Y,e t a l.A n t i g e n i ca n d g e n e t i cc h a r a c t e r i z a t i o no f aE u r o p e a n a v i a n-l i k eH1N1S w i n ei n f l u e n z av i r u sf r o m a b o y i n C h i n ai n2011[J].A r c h i v e s o f V i r o l o g y,2013,158(1):39-53.[18] WA N GZ,Y A N G H,C H E N Y,e t a l.As i n g l e-a m i n o-a c i d s ub s t i t u t i o n a t p o s i t i o n225i n h e m a g g l u t i n i na l t e r s t h et r a n s m i s s ib i l i t y o fa v i a n-l i k e H1N1S w i n ei n f l u e n z a v i r u s i n g u i n e a p i g s[J].J o u r n a l o fV i r o l o g y,2017,91(21):e00800-17.[19] G A B R I E LG,D A U B E RB,WO L F FT,e t a l.T h e v i r a lp o l y m e r a s em e d i a t e s a d a p t a t i o no f a nA v i a n i n f l u e n z av i r u st oa m a m m a l i a n h o s t[J].P r o c e e d i n g so f t h eN a t i o n a lA c a d e m y o f S c i e n c e so f t h eU n i t e dS t a t e so f A m e r i c a,2005,102(51):18590-18595. [20] B U S S E Y K A,B O U S S E T L,D E S M E T E A,e t a l.P B2r e s i d u e271p l a y s a k e y r o l e i n e n h a n c e dp o l y m e r a s e a c t i v i t y o f I n f l u e n z a A v i r u s e s i nm a m m a l i a nh o s t c e l l s[J].J o u r n a l o f V i r o l o g y,2010,84(9):4395-4406.[21] X U C,X U B,WU Y,e t a l.A s i n g l ea m i n oa c i da tp o s i t i o n431o f t h eP B2p r o t e i n d e t e r m i n e s t h e v i r u l e n c eo fH1N1S w i n e i n f l u e n z a v i r u s e s i nm i c e[J].J o u r n a l o fV i r o l o g y,2020,94(8):e01930-19.[22] S U N Y,X U Q,S H E N Y,e t a l.N a t u r a l l y o c c u r r i n gm u t a t i o n si nt h e P A g e n ea r e k e y c o n t r i b u t o r st oi n c r e a s e dv i r u l e n c eo f p a n d e m i c H1N1/09I n f l u e n z av i r u s i nm i c e[J].J o u r n a l o f V i r o l o g y,2014,88(8):4600-4604.[23] Z HU W,F E N G Z,C H E N Y,e t a l.M a m m a l i a n-a d a p t i v e m u t a t i o n N P-Q357K i n E u r a s i a n H1N1S w i n e i n f l u e n z a v i r u s e s d e t e r m i n e s t h e v i r u l e n c ep h e n o t y p e i n m i c e[J].E m e r g i n g M i c r o b e s&I n f e c t i o n s,2019,8(1):989-999.[24] F U R U S E Y,S U Z U K I A,O S H I A N I H.L a r g e-s c a l es e q u e n c ea n a l y s i so f M g e n eo fI n f l u e n z a A v i r u s e sf r o md i f f e r e n t s p e c i e s:M e c h a n i s m s f o r e m e rg e n c e a n ds p r e a d o f a m a n t a d i n e r e s i s t a n c e[J].A n t i m i c r o b i a lA g e n t s a n dC h e m o t h e r a p y,2009,53(10):4457-4463.[25] Z HU H,Z H O U B,F A N X,e t a l.N o v e l r e a s s o r t m e n to fE u r a s i a na v i a n-l i k ea n d p a n d e m i c/2009I n f l u e n z av i r u s e s i ns w i n e:I n f e c t i o u s p o t e n t i a l f o rh u m a n s[J].J o u r n a l o f V i r o l o g y,2011,85(20):10432-10439.[26]郑运,马俊,罗永峰,等.广东省猪流感病毒的分离鉴定及遗传进化分析[J].中国兽医学报,2017,37(2):266-271.Z H E N G Y,MA J,L U O Y F,e t a l.I s o l a t i o n a n dg e n e t i ce v o l u t i o na n a l y s i so fS w i n e i n f l u e n z av i r u s i nG u a n g d o n gp r o v i n c e[J].C h i n e s e J o u r n a l o f V e t e r i n a r yS c i e n c e,2017,37(2):266-271.(i nC h i n e s e)(责任编辑董晓云)0561。
济南市犬瘟热病毒H基因遗传进化分析

动物医学进展,2021,2(1):6-12ProgressinVeterinary Medicine济南市犬瘟热病毒H基因遗传进化分析王召阳,蒋亚君,刘雪婷,侯绍华,郭晓宇,鑫婷,朱鸿飞,贾红(中国农业科学院北京畜牧兽医研究所,北京100193)摘要:为了解济南市犬瘟热病毒(CDV)的流行情况,通过随机采集7份济南市2019年1月一6月份宠物医院疑似感染CDV的临床样品,提取病毒RNA,扩增CDV H基因全长序列,连接至载体,测序后进行H基因序列的氨基酸及核苷酸同源性分析、进化树分析、主要氨基酸位点突变分析以及H基因抗原表位预测分析。
结果显示,7个野毒株均为Asia-I型,H基因核苷酸同源性为9&7%〜99.9%,氨基酸同源性为9&7%〜100%,与疫苗株相比差异较大,核苷酸、氨基酸同源性分别为90.0%〜90.9%和8&8%〜91.4%。
主要氨基酸位点突变分析表明,除SD-07为8个潜在天冬酰胺糖基化位点,其余6株均为9个潜在天冬酰胺糖基化位点。
H基因抗原性预测分析表明,7个野毒株与疫苗株相比存在明显的差异。
研究结果表明,济南市犬瘟热病毒株以Asia-I型为主,野毒株同源性与疫苗株相比差异较大,不同毒株间存在遗传多样性。
关键词:犬瘟热;犬瘟热病毒;H基因;序列分析中图分类号:S852.659.5;S85&292文献标识码:A文章编号:1007-5038(2021)01-0006-07犬瘟热(Canine distemper,CD)是由犬瘟热病毒(Canine distemper virus,CDV)引起的一种急性、高度接触性传染病[1]o CDV可引起多种食肉动物感染,发病率高,致死率高达50%2,严重威胁犬只健康。
犬瘟热也对其他野生动物,包括东北虎⑶、大熊猫、狮子、猕猴口5等造成严重威胁。
临床症状主要包括眼鼻分泌物增多、双相热、腹泻、呕吐、足垫增厚和抽搐等[1'6],且CDV常与其他病原(犬细小病毒、犬冠状病毒虫和滴虫等)共同感染卩8。
第7章 病毒的遗传分析

L(M)
O L
14.1 kb
5.4 kb 3.0 kb
L: 线状、O: 环状、M: 基因组含几个片断、1=单链、2=双链
病毒 (virus) 类别 核酸类型 形状 核酸长度 2.植物病毒:创伤肿瘤病毒(WTV) 2-RNA L 21.0kb 雀麦花叶病毒(BMV) 1-RNA L(M) 9.0kb 马铃薯 X 病毒(PVX) 1-RNA L 8.67kb 花椰菜花叶病毒(CaMV) 2-DNA O 8.1kb 烟草花叶病毒(TMV) 1-RNA L 6.3kb 芜菁黄色花叶病毒(TYMV) 1-RNA L 6.0kb 3.动物病毒:鸟痘病毒 2-DNA L? 300.0kb 牛痘苗病毒 2-DNA L 240.0kb 疱疹病毒 2-DNA L 15.9kb 呼肠孤病毒(reovirus) 2-RNA L 3.4kb 口蹄疫病毒(FMDV) 1-RNA L 10.3kb 脊髓灰质炎病毒(polio) 1-RNA L(M) 7.8kb 多瘤病毒(polyoma) 2-DNA O 4.5kb L: 线状、O: 环状、M: 基因组含几个片断、1=单链、2=双链 核酸分子长度与碱基数的关系:3 kb = 1㎛
禽流感病毒
二、噬菌体的繁殖
1、
2、温和噬菌体的侵染周期 温和性噬菌体中λ和P1噬菌体各代表了一种略有不 同的溶源性类型 温和性噬菌体的生活周期有两个: 一个是溶源性周期,即在噬菌体侵入后并不裂解 细菌,而是将其DNA分子整合到细菌基因组DNA上, 这样的噬菌体叫原噬菌体。带有原噬菌体的细菌叫 溶源性细菌。
attP 的序列结构特征也是一样,记为POP`序 列。 整合酶和 IHF 在 att 上都有特定的结合 位点。每一次整合的重组过程需要20-40个 整合酶分子和约70个IHF分子。说明这两种 蛋白不仅仅是酶(起催化作用),而且在形 成某种复合物结构中起着重要作用。
病毒的遗传分析ppt课件

哈工大-遗传学
第五章 病毒的遗传分析
突变位点 在同一顺
反子内
突变位点 不在同一 顺反子内
顺式测验
反式测验
+− ++
当顺式有功能,而反式没有功能时,突变位点突变位点在同一 顺反子内;当顺式有功能,而反式也有功能时,突变位点突变位点在 不同顺反子内。
哈工大-遗传学
第五章 病毒的遗传分析
第五章 病毒的遗传分析
(二)、φX174噬菌体
(1)基因组的结构特点 DNA含有5386个核苷酸,编码总分子量
为25万的11个蛋白质分子。Sanger发现存 在着重叠基因。
哈工大-遗传学
第五章 病毒的遗传分析
(2)φX174噬菌体突变型在遗传学中的应用
互补实验: 两点测交: 三点测交:
哈工大-遗传学
第五章 病毒的遗传分析
3.0% 2.0% 1.5%
(1). a、b、c 三个基因在连锁图上的次序如何?为什么它们 之间的距离不是累加的?
(2). 假定三因子杂交,ab+c × a+bc+, 预期哪两种类型的重 组子频率最低? (3). 计算(2)所假定的三因子杂交中,各重组类型的频率?
哈工大-遗传学
第五章 病毒的遗传分析
野生型重组体。
哈工大-遗传学
第五章 病毒的遗传分析
λ噬菌体基因分为两类:
❖ 噬菌斑形成所必需的基因,在基因组中以大 写字母表示
❖ 噬菌体斑形成非必需的基因,用小写字母或 希腊字母表示
哈工大-遗传学
第五章 病毒的遗传分析
噬菌斑形成所必需的基因
1)A、W、B、C、D、E、F基因是头部形成必需基因 2)Z、U、V、G、T、H、M、L、K、I、J是尾部形成必需基 因 3)O、P是噬菌体复制的必需基因 4)S、R是细菌细胞裂解及子代噬菌体释放的必需基因 5)N、Q是正调节基因,可促进噬菌斑的形成
遗传学第六章病毒的遗传分析

在反式测验中,如两个突变之间能互补,则表明两个突变是位于两个基因(顺反子)内的突变。如两个突变之间不能互补,则表明两个突变是位于同一个基因内的突变。
顺反子:一个不同突变之间没有互补的
功能区称为顺反子(cistron)。
基因内互补
例外情况。如:沙门氏杆菌甘油磷酸脱氢酶基因;大肠杆菌和脉孢菌色氨酸合成酶
第六章 病毒的遗传分析
一、病毒的形态结构与基因组 P184 二、噬菌体的增殖与突变型 (一)噬菌体的增殖 P186 (二)噬菌体的突变型 1、条件致死突变 在某些条件下,导致某些突变型致死,而另 外一些条件下仍能增殖 。致死条件为限制条件(restrictive condition)。 增殖条件为许可条件 (permissive condition)。
λ噬菌体的基因组
位点专一性重组的分子机制
参与整合,切离主要的酶:
整合酶(Int);
整合宿主因子(IHF);
切离酶(Xis)。
环状排列与末端重复 基因组串联体
斑点测试法(spot test) P196 用一种rⅡ突变型以0.1的感染比(噬菌体1:细菌10)感染大肠杆菌K(λ),噬菌体和细菌在温热的琼脂中混合,涂布在营养平板上,琼脂凝固后,在平板上划出一定位置,再在上面滴加含另一种rⅡ突变型的培养基。在这一滴培养基范围内,一些菌被两种噬菌体感染,如这范围内形成噬菌斑,就证明这两种突变型互补,相反则不互补。 在一个培养基上可做6—8个斑点试验。
点突变(point mutation):一个顺反子内单个核苷酸发生的改变。
缺失作图的原理
利用重叠缺失定位未知的rⅡ突变:
01
根据是否产生野生型噬菌体,系列Ⅰ将rⅡ突变定于A5片段;系列Ⅱ将rⅡ突变定于A5c区;系列Ⅲ将其定于A5c3区 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
病毒遗传分析方法
(三) 条件致死突变型
1 温度敏感突变型
2 抑制因子敏感突变(sus)
噬菌体
细菌
正常基因
sus+
su-
突变基因
sus
suamber+opal+
表5-6 174突变型之间杂交观察到的双因子重组率
病毒遗传分析方法
X174的三点测交
1 确定三个基因的顺序的前提条件 只有两种可能顺序的条件下进行;
例如:要确定amA、amB、tsC三基因的顺序 已知:amA与amB较近,amA和amB离tsC都较远;
表5-5 T4的 m r tu x + + + 三点试验结果
亲本类型 单交换型 单交换型 双交换型
合计
类 型 噬菌斑数 %
重组频率%
m-r r-tu m-tu
m r tu +++
3467 3279
69.6%
m++ + r tu
520 474
9.6%
∨
∨
mr+ + + tu
853 965
17.5%
∨∨
amA+ amB+ amA- amB-
A+B+ X 2
amA-amB间重组值:
X 100%
su+:amA、amB总数
病毒遗传分析方法
两个不同抑制因子敏感突变型间的杂交 sus amber x sus opal
su+amber;su+opal
10-6
10-2
限制条件:su+amber、opal
基因型:amb-opal+ amb+opalamb+opal+ amb-opal-
3`AUC 5` 酪氨酸
病毒遗传分析方法
(2)噬菌体的抑制因子敏感突变型类型及表现 琥珀型(amber)UAG 赭石型(ocher)UAA 乳白型(opal) UGA
表5-2携带不同专一性抑制基因宿主中sus突变噬菌体的表现
宿主菌基因型 噬菌体基因型 su- su+amb su+och su+op
↓释放 子噬菌体。
病毒遗传分析方法
图8-2 T4噬菌体的生病活毒遗周传分期析方法
图8-3 λ 噬菌体的生活病毒周遗传期分析方法
二 噬菌体的突变型
(一)快速溶菌突变型(r) 由于基因突变能快速复制,并裂解细菌的噬菌体类型。
r+—野生型,r—突变型。 r+—小噬菌斑,r—大噬菌斑且边缘清晰。 (二)宿主范围突变型(h) h能感染野生型细菌和突变型细菌。野生型噬菌体用h+表 示,只能侵染野生型菌株。 例如: T2噬菌体
病毒的遗传分析
病毒遗传分析方法
病毒的形态结构与基因组
病毒的形态结构
病毒没有细胞结构,既不属于原核生 物,也不属于真核生物。
病毒结构十分简单,仅含DNA或RNA
和一个蛋白质外壳,没有合成蛋白质
外壳所必须的核糖体。所以,病毒必
须感染活细胞,改变和利用活细胞的
代谢合成机器,才能合成新的病毒后
代。
病毒遗传分析方法
m + tu +r+
162 172
3.3%
∨
∨
10342
12.9 20.8 27.1
作图:
m 12.9 r 20.8 tu
病毒遗传分析方法
X174突变型的两点和三点测交
(一) X174的两点测交 ——两个琥珀突变型间杂交
amA x amB
su+
su+: amA、amB
su-
基因型:amA- amB+ amA+ amB- amA+ amB+
+
- 半透明
+
+ 透明
病毒遗传分析方法
双重感染(混合感染、复感染):是指用两种噬 菌体同时感染某一菌株。 例如:噬菌体Ⅰ:hr+即能感染B和B/2菌株产生噬 菌斑小而边缘模糊,即透明、小噬菌斑。 噬菌体Ⅱ:h+r能感染B株,产生约大两倍 的边缘清楚的噬菌斑,即为半透明、大的噬菌斑。 用hr+和h+r两种噬菌体同时感染B株,进行双重 感染。 在双重感染(相当hr+ ×h+r)的过程中,hr+ 和h+r相互作用(即基因可以发生交换),所以 在其子代中可以得到hr和h+r+的重组体和hr+及 h+r4种噬菌体。
su+
病毒遗传分析方法
(1)抑制因子敏感突变的概念:
例如:噬菌体mRNA基因 细菌tRNA基因反密码子
正常 突变
突变
正常
基因:5`TAC 3`5`TAG 3` 3`ATC 5`3`ATG 5`
mRNA 5`UAC 3` 5`UAG 3` 3`AUC 5` 3`AUG 5`
酪氨酸 酪氨酸
表型:酪氨酸 终止 5`UAG 3`
5种琥珀抑制基因的性质
插入的 氨基酸
合成的蛋白质 占野生型%
丝氨酸
28
谷氨酰胺
14
酪氨酸
55
酪氨酸
16
赖氨酸
5
赭石型抑 制基因
+
T2突变型及特性
快速溶菌突变型:r 野生型:r+
T2宿主范围野生型: h T2宿主范围突变型: h-
细菌
B
B/2
大噬菌斑;
小噬菌斑;
野生型
+
+
+
+
sus amber -
+
+
-
sus ochre -
-
+
-
sus opal
-
-
-
+
病毒遗传分析方法
(二)无义突变与无义抑制突变 无义突变:指一个为氨基酸编码的密码变为终止密码的突变。 无义抑制突变:指能抑制无义突变表现的突变。
表5-3
琥珀型抑 制基因
su1+ su2+ su3+ su4+ su5+
总噬菌斑数
病毒遗传分析方法
图8-7 T2的h+r-与h- r+ 之间杂交重组后的4种噬菌斑形态
病毒遗传分析方法
表8-5 h+ rx- × h- rx+ 噬菌斑数目及重组值( rx- 代表不同 的r- 基因)
病毒遗传分析方法
病毒遗传分析方法
病毒遗传分析方法
病毒遗传分析方法
T4突变型的三点试验
结构简单: 蛋白质外壳、核酸、某些碳水化合物、
脂肪等。 多样性的原因:外壳的蛋白质种类、染
色体类型和结构。
病毒遗传分析方法
病毒遗传分析方法
表8-1 病毒的基因病组毒遗结传分构析方法
噬菌体的繁殖
(一)烈性噬菌体的感染周期 (二)温和性噬菌体的感染周期 1 溶源周期:
原噬菌体: 溶源性细菌: 溶源性细菌的特点: 2 裂解周期: 溶源性细菌自发或经诱发裂解细菌
病毒遗传分析方法
T2突变型的两点试验
(一) 噬菌体杂交
h-r+ X h+r-
Ecoli B
表现型 透明,小 半透明,大 透明,大 半透明,小
基因型 h-r+ 亲组合 h+r- 亲组合 h-r- 重组合 h+r+ 重组合
(二) 噬菌体重组值的计算
重组噬菌斑数
重组值 =
X100%
Ecoli:B + B/2
