强氧化剂
过氧化氢

111过氧化氢过氧化氢溶液,化学式为H2O2,其水溶液俗称双氧水,外观为无色透明液体,是一种强氧化剂,适用于伤口消毒及环境、食品消毒。
中文名:过氧化氢外文名:Hydrogen peroxide别名:双氧水化学式:H2O2相对分子质量:34.01化学品类别:无机物--过氧化物管制类型:过氧化氢(*)(易制爆)储存:用瓶口有微孔的塑料瓶装阴凉保存管制信息过氧化氢属于易制爆物品,根据《危险化学品安全管理条例》受公安部门管制。
低浓度医用过氧化氢溶液不受管制。
[1]编码信息CAS号 7722-84-1[1]EINECS号 231-765-0InChI编码 InChI=1/H2O2/c1-2/h1-2H [2]物理性质EINECS登录号:231-765-0英文名称:Hydrogen peroxide分子结构:O原子以sp3杂化轨道成键、分子为共价极性分子。
其立体结构像一本半展开的书一样,两个氧原子在书缝上,两个氢原子各占据书的两页纸。
过氧化氢立体结构H-O-O键角96度52分外观与性状:水溶液为无色透明液体,有微弱的特殊气味。
纯过氧化氢是几乎无色(非常浅的蓝色)的液体。
主要成分:工业级分为27.5%、35%两种。
试剂级常分为30%、40%两种。
分子量:34.02熔点(℃):-0.89℃(无水)沸点(℃):152.1℃(无水)折射率:1.4067(25℃)相对密度(水=1):1.46(无水)饱和蒸气压(kPa):0.13(15.3℃)溶解性:能与水、乙醇或乙醚以任何比¨例混合。
不溶于苯、石油醚。
结构:H-O-O-H 既有极性共价键又有非极性共价键毒性LD50(mg/kg):大鼠皮下700mg/Kg[4]化学性质酸碱H2O2是二元弱酸,具有酸性。
氧化性具有较强的氧化性H2O2 + 2KI + 2HCl = 2KCl + I2+ 2H2O2Fe2+ + H2O2+ 2H+ = 2Fe3+ + 2H2OH2O2 + H2S = S↓+ 2H2OH2O2 + SO2 = H2SO4Cu + H2O2 + 2HCl = CuCl2+2H2O注:在酸性条件下H2O2的还原产物为H2O,在中性或碱性条件其还原产物为氢氧化物。
常见氧化剂还原剂和催化剂的应用
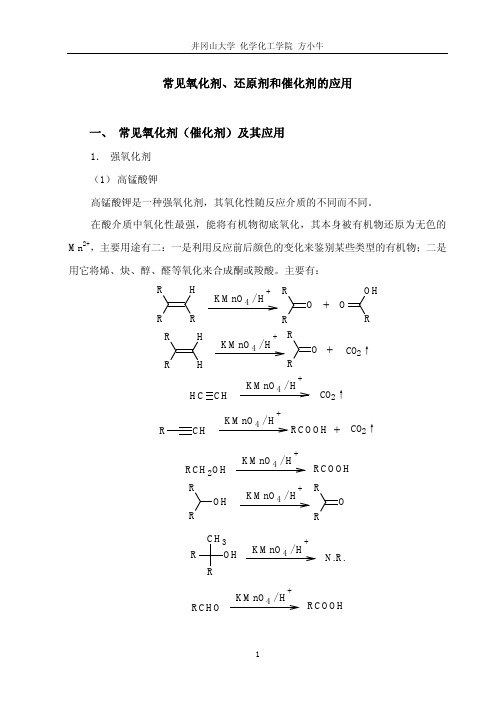
常见氧化剂、还原剂和催化剂的应用一、 常见氧化剂(催化剂)及其应用1. 强氧化剂 (1) 高锰酸钾高锰酸钾是一种强氧化剂,其氧化性随反应介质的不同而不同。
在酸介质中氧化性最强,能将有机物彻底氧化,其本身被有机物还原为无色的Mn 2+,主要用途有二:一是利用反应前后颜色的变化来鉴别某些类型的有机物;二是用它将烯、炔、醇、醛等氧化来合成酮或羧酸。
主要有:R H KMnO 4 / H+OROR OH+ R RHH KMnO 4 / H++O RRCO 2↑KMnO 4 / H+C H CH CO 2↑KMnO 4 / H++CHRCO 2↑RCOOHKMnO 4 / H+RCOOHRCH 2OHOH RRKMnO 4 / H+O RROHRR CH 3KMnO 4 / H+N.R.KMnO 4 / H+RCOOH RCHOKMnO 4 / H +N.R.RCOR' KMnO 4 / H+CO 2↑COOH COOH高锰酸钾在中性或碱性介质中的氧化性稍弱,在控制条件下可以将 π 键氧化而不断裂 σ 键,主要用于从烯烃制备邻二醇(反应的立体化学特征是顺式加成)。
四氧化锇的作用与此类似。
OO MnO(2) 重铬酸钾K 2Cr 2O 7 / H 2SO 4溶液的氧化性能与KMnO 4 / H +相似,用途也相似。
除用以氧化醇、醛等含氧衍生物外,主要用于将芳环氧化成醌。
如:O OCrO 3-H 2SO 4CrO 3-H 2SO 4OOK 2Cr 2O 7 / H 2SO 4RCH 2OHRCHO 边氧化边蒸馏(3) 稀硝酸稀硝酸具有强氧化性,它可以将芳环的侧链氧化和将醇氧化,如:Ar-CH 3Ar-COOH 稀HNO 3稀HNO 3OHO△HO 2C-(CH 2)4-CO 2H2. 温和氧化剂 (1) 二氧化锰MnO 2-H 2SO 4是一种中强氧化剂,可将甲苯氧化成苯甲醛:C 6H 5-CH 3C 6H 5-CHOMnO 2-H 2SO 4活性MnO 2则是一种温和的氧化剂,能将烯丙式醇氧化成醛而不影响C=C 双键:CH 3CH 3CH 3CHOMnO 2石油醚(2) 三氧化铬-吡啶络合物三氧化铬-吡啶络合物(CrO 3-C 5H 5N )又称为Sarett 试剂,是一种温和的氧化剂,能将醇(尤其是烯丙式的)氧化成为醛,而不影响其它基团。
高锰酸钾说明

高锰酸钾高锰酸钾晶体高锰酸钾(potassium permanganate)亦名“灰锰氧”、“PP粉”,是一种常见的强氧化剂,常温下为紫黑色片状晶体,易见光分解:2KMnO₄(s)—hv→K2MnO₄(s)+MnO₂(s)+O₂(g),故需避光存于阴凉处,严禁与易燃物及金属粉末同放。
高锰酸钾以二氧化锰为原料制取,有广泛的应用,在工业上用作消毒剂、漂白剂等,在实验室,高锰酸钾因其强氧化性和溶液颜色鲜艳而被用于物质的鉴定,酸性高锰酸钾溶液是氧化还原滴定的重要试剂。
在医学上,高锰酸钾可用于消毒、洗胃。
高锰酸钾(易制毒-3)(易制爆)本品根据《易制毒化学品管理条例》受公安部门管制。
性状深紫色或古铜色结晶。
无臭。
味甜而涩。
在空气中稳定,热至约240℃分解有氧气逸出,遇乙醇及其他有机溶剂分解。
也能从浓酸中游离氧,遇盐酸游离氯,能被多数还原物质分解,如亚铁盐、碘化物和草酸盐等,特别是在含有酸时更易氧化。
溶于14.2份冷水、3.5份沸水。
相对密度2.703。
有强氧化性,与有机物(如甘油、蔗糖、樟脑等)混合能引起燃烧或爆炸。
低毒,半数致死量(大鼠,经口) 1.09g/kg。
有腐蚀性。
保存密封阴凉保存用途氧化剂。
消毒剂。
有机合成。
净水。
容量分析氧化还原法测定用试剂。
色谱分析用试剂。
用于发射光谱分析。
点滴分析钡、银、硫酸盐、铁、钒及锡,临床脱落细胞检验等。
安全措施远离火种、热源、贮于阴凉干燥处。
切忌与易(可)燃物、金属粉末、还原剂、硫、磷共储。
误食,用水漱口,饮牛奶或蛋清。
灭火方法燃烧性:不燃灭火剂:水、雾状水、砂土。
紧急处理吸入:迅速脱离现场至新鲜空气处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
误食:误服者用水漱口,给饮牛奶或蛋清。
就医。
<BR>皮肤接触:立即脱去被污染衣着,用大量流动清水冲洗,至少15分钟。
就医。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗,至少15分钟。
双氧水——过氧化氢

过氧化氢,化学式为H2O2,其水溶液俗称双氧水,外观为无色透明液体,是一种强氧化剂,适用于伤口消毒及环境、食品消毒。
中文名称:二氧化氢,双氧水英文别名:Hydrogen peroxide,30% solution,Hydrogen dioxide 30% solution,Albone,Perhydrol 30% solution,Hioxyl,Lensan A化学式:H2O2相对分子质量:34.01储存:用瓶口有微孔的塑料瓶装阴凉保存。
用途:氧化剂。
漂白剂。
点滴分析测定钙、钴、铜、锰、钛、钒、铵及铬酸。
有机合成。
安全措施泄漏:迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。
建议应急处理人员戴自给正压式呼吸器,穿防酸碱工作服。
尽可能切断泄漏源,防止进入下水道、排洪沟等限制性空间。
小量泄露:用砂土、蛭石或其它惰性材料吸收。
也可用大量水冲洗,洗水稀释后放入废水系统。
大量泄露:构筑围堤或挖坑收容;喷雾状水冷却和稀释蒸气、保护现场人员、把泄漏物稀释成不燃物。
用泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。
灭火方法燃烧性:不燃爆炸下限(%):12爆炸上限(%):19引燃温度(℃):615最大爆炸压力(MPa):0.490灭火剂:水、雾状水、干粉、砂土。
灭火注意事项:消防人员必须穿戴全身防火防毒服。
尽可能将容器从火场移至空旷处。
喷水保持容器冷却,直至灭火结束。
处在火场中的容器若已变色或从安全泄压装置中产生声音,须马上撤离。
紧急处理吸入:迅速脱离现场至新鲜空气处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
误食:饮足量温水,催吐,就医。
皮肤接触:脱去被污染衣着,用大量流动清水冲洗。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。
就医。
物理性质本品助燃,具强刺激性。
与重金属等混合易爆炸。
分子结构过氧化氢是含有极性键和非极性键的极性分子,其结构式为H—O—O—H,电子式为:H:O:O:H 2、过氧化氢的物理性质过氧化氢是一种无色黏稠的液体,它的水溶液俗称双氧水。
谁是最强的氧化剂?

谁是最强的氧化剂?关于氧化剂中学化学⾥有介绍,氧化还原化学反应中得到电⼦的物质称为氧化剂,这种得电⼦的性质称为氧化性,氧化性的决定因素是该物质中⾼价态元素的得电⼦倾向,另外氧化性还可能受PH值和分⼦稳定性影响,在这⾥不⼀⼀赘述。
根据物质的得电⼦能⼒强弱,可将氧化剂分为强氧化剂、中等强度氧化剂与弱氧化剂,⼀般以氧⽓和铁离⼦为界,氧化性超过氧⽓的物质为强氧化剂,弱于铁离⼦的为弱氧化剂,两者之间的为中等强度氧化剂。
常见的氧化剂有①⾮⾦属单质如F2、O3、Cl2、O2、Br2、I2、S、P、Si等(其氧化性强弱与⾮⾦属活动性基本⼀致);②含有变价元素的⾼价化合物,如KMnO4、KClO3、浓 H2SO4 、HNO3、MnO2 、FeCl3等;③⾦属阳离⼦如:Fe3+、Cu2+,Ag+等。
其中氟⽓的氧化性最强,是已知的最强的氧化剂之⼀,究其原因是因为氟是已知元素中⾮⾦属性最强的元素,这使得其没有正氧化态。
氟的基态原⼦价电⼦层结构为2s2 2p5,且氟具有极⼩的原⼦半径,因此具有强烈的得电⼦倾向。
氟⽓可以与除氮氧氦氖氩氪元素以外所有的单质直接化合,且条件⽐氧容易的多,反应也更加剧烈,氟⽓和氢⽓在冷暗处相遇即爆炸化合,常温下⽊炭和铁丝通⼊氟⽓便会剧烈燃烧,甚⾄黄⾦在受热后也会在氟⽓中燃烧。
最近化学界发现的强氧化剂,⼤于或者和氟⽓相当的有:⼆氟化氪,⼆氟化⼆氧,⼆氟化氧,六氟化氙,四氧化氙,三氧化氙,六氟化铂,三氟化氯,三氟化氯等,氧化性综合排名:⼆氟化氪≥⼆氟化⼆氧>四氧化氙>三氧化氙≥六氟化氙>⼆氟化氧>四氟化氙≥六氟化铂(六氟化铑)>氟⽓≥三氟化氯>⼆氟化氙>⾼铁酸(盐)>臭氧>过硫酸(盐),1. 下⾯介绍其中⼏种较为典型的氧化剂:⼆氟化氪:分⼦式KrF2,由氟和氪低温混合放电得到。
⼆氟化氪在常温下不能存在,当环境温度超过零下30度就会开始分解,已知的两个反应:①⼆氟化氪将黄⾦氧化,黄⾦从零价升⾼到+5价,这也是⾦的最⾼价。
常见氧化剂及氧化性排序

氧化剂(一)概述英文名:strong oxidant具有强烈氧化性的物质。
在电位顺序中的位置越靠后,电位值越正,在化学反应中越易获得电子,则这类物质(如分子、原子或离子)就是越强的氧化剂。
如三价钴盐、过硫酸盐、过氧化物、重铬酸钾、高锰酸钾、氧酸盐、浓硫酸等,都是强氧化剂。
常见的氧化剂是在化学反应中易得电子被还原的物质。
(1)典型的非金属单质如F₂、O₂、Cl₂、Br₂、I₂、S等(其氧化性强弱与非金属活动性基本一致)。
(2)含有变价元素的高价化合物,如KMnO4 KClO₃ H2SO₄ HNO₃MnO₂等。
(3)金属阳离子如:Fe₃+、Cu₂+、(H+)(在金属与酸、盐溶液的置换反应,如反应Fe+CuSO₄=FeSO₄+Cu中,实质上是Cu₂+离子氧化Fe原子,Cu₂+作氧化剂,Fe是还原剂)常见氧化剂:1.氟气氟气(F₂)是淡黄色的气体,强氧化性,有特殊难闻的臭味,剧毒。
-188℃以下,凝成黄色的液体。
在-223℃变成黄色结晶体。
在常温下,氟几乎能和所有的元素化合:大多数金属都会被氟腐蚀,碱金属在氟气中会燃烧,甚至连黄金在受热后,也能在氟气中燃烧。
许多非金属,如硅、磷、硫等同样也会在氟气中燃烧。
2.臭氧臭氧(分子式O₃)是氧的同素异形体,有强氧化性。
在常温下,它是一种有特殊臭味的蓝色气体。
臭氧主要存在于距地球表面20公里的同温层下部的臭氧层中。
它吸收对人体有害的短波紫外线,防止其到达地球。
气态臭氧厚层带蓝色,有特殊臭味,浓度高时与氯气气味相像;液态臭氧深蓝色,固态臭氧紫黑色。
3.氯气氯单质为黄绿色气体,有窒息性臭味;熔点-100.98°C,沸点-34.6°C,气体密度3.214克/升,20°C时1体积水可溶解2.15体积氯气。
氯相当活泼,湿的氯气比干的还活泼,具有强氧化性。
除了氟、氧、氮、碳和惰性气体外,氯能与所有元素直接化合生成氯化物;氯还能与许多化合物反应,例如与许多有机化合物进行取代反应或加成反应。
高锰酸钾

皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗至少15分钟,就医。 眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟,就医。 吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。 食入:用水漱口,给饮牛奶或蛋清。就医。[4]
操作处置与储存
操作注意事项:密闭操作,加强通风。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴头罩型电动送风过滤式防尘呼吸器,穿胶布防毒衣,戴氯丁橡胶手套。远离火种、热源,工作场所严禁吸烟。避免产生粉尘。避免与还原剂、活性金属粉末接触。搬运时要轻装轻卸,防止包装及容器损坏。配备相应品种和数量的消防器材及泄漏应急处理设备。倒空的容器可能残留有害物。 储存注意事项:储存于阴凉、通风的库房。远离火种、热源。库温不超过32℃,相对湿度不超过80%。包装密封。应与还原剂、活性金属粉末等分开存放,切忌混储。储区应备有合适的材料收容泄漏物。[4]
高锰酸钾,也叫灰锰氧、PP粉,是一种常见的强氧化剂,常温下为紫黑色片状晶体,易见光分解:2KMnO4(s)—hv→K2MnO4(s)+MnO2(s)+O2(g),故需避光存于阴凉处,严禁与易燃物及金属粉末同放。高锰酸钾以二氧化锰为原料制取,有广泛的应用,在工业上用作消毒剂、漂白剂等,在实验室,高锰酸钾因其强氧化性和溶液颜色鲜艳而被用于物质的鉴定,酸性高锰酸钾溶液是氧化还原滴定的重要试剂。在医学上,高锰酸钾可用于消毒、洗胃。
化学性质
化学式:KMnO4,高锰酸钾常温下即可与甘油等有机物反应甚至燃烧(但有时与甘油混合后反应极为缓慢,甚至感受不到温度的升高,其原因尚不明确);在酸性环境下氧化性更强,能氧化负价态的氯、溴、碘、硫等离子及二氧化硫等。与皮肤接触可腐蚀皮肤产生棕色染色,数日不褪;粉末散布于空气中有强烈刺激性,可使人连打喷嚏。尿液、二氧化硫等可使其褪色。与较活泼金属粉末混合后有强烈燃烧性,危险。该物质在加热时分解: 2KMnO4=△=K2MnO4+MnO2+O2↑ ·高锰酸钾在酸性溶液中还原产物为二价锰离子 ·高锰酸钾在碱性溶液中还原产物一般为墨绿色的锰酸钾(K2MnO4)。 ·高锰酸钾在中性环境下还原产物为二氧化锰。 维生素C的水溶液能使高锰酸钾溶液褪色,并且维生素C溶液越浓,水溶液用量就越少。根据这一特性,就能够用高锰酸钾测定蔬菜或水果中的维生素含量。高锰酸钾造成的污渍可用还原性的草酸、维生素C等去除。强氧化剂,在酸性条件下氧化性更强,可以用做消毒剂和漂白剂,和强还原性物质反应会褪色,如SO2、不饱和烃。[5]
十大最强氧化剂

十大最强氧化剂强氧化剂是指具有强烈氧化性的物质。
氧化剂具有的得电子的性质称为氧化性,氧化性的决定因素是该物质中高价态元素的得电子倾向。
在溶液中,根据双电层理论,氧化性的大小反映为氧化剂的标准氢电极电势:电势越高,则氧化性越强;电势越低,则氧化性越弱,相对应的,其还原态的还原性则越强。
强氧化剂就是具有高电势的氧化物质。
在标准电位顺序中的位置越靠后,标准电位值越正,在化学反应中越易获得电子,则这类物质(如分子、原子或离子)就是越强的氧化剂。
如三价钴盐、过硫酸盐、过氧化物、重铬酸钾、高锰酸钾、氯酸盐、发烟硫酸等,都是强氧化剂。
01天然虾青素天然虾青素是迄今为止发现的最强的抗氧化剂,其抗氧化活性远远超过现有的抗氧化剂,具有远远超过维生素E的抗氧化能力,清除二氧化氮、硫化物、二硫化物等,还能抗衰老和抗疲劳。
02氯酸氯酸是十大最强氧化剂之一,具有较强的氧化性能。
03氢溴酸氢溴酸是十大最强氧化剂之一,其酸性得益于其电子结构。
氢溴酸中的氢原子与溴原子形成氢溴酸,并且溴原子能够提供电子空位给氢原子,从而使得氢溴酸具有较强的氧化性。
04硝酸硝酸是四大氧化剂之一,具有强氧化性。
它可以与一些还原剂发生反应,产生二氧化氮和硝酸盐。
硝酸的酸性是由于其中含有氯原子的原因。
硝酸可以用于消毒、化学实验和工业生产中。
例如,硝酸可以用于制备硝酸钠,用于化肥的生产。
硝酸的酸性还可以增强酸的腐蚀性,因此在一些特殊环境中,硝酸还是一种重要的消毒剂和防腐剂。
总之,硝酸是一种强氧化剂,具有广泛的应用领域和重要的化学作用。
05白藜芦醇白藜芦醇是一种多酚化合物,能够清除或抑制自由基的产生,从而抑制脂质过氧化,并调节抗氧化相关酶的活性。
06盐酸盐酸是十大最强氧化剂之一,具有酸性。
它是根据化学式HClO4来命名的,其中氯原子具有较强的还原性。
盐酸可以与高氯酸发生反应,生成氯离子的盐。
07氢碘酸氢碘酸是十大最强氧化剂之一,它的酸性比高氯酸还要高。
氢碘酸的酸性是由于其电子结构特殊,在光照条件下很容易分解成碘和氢气,并且容易与空气中的氧气反应,生成碘沉淀。
氯酸的威力从消剂到炸药

氯酸的威力从消剂到炸药氯酸的威力:从消毒剂到炸药氯酸是一种强氧化剂,具有广泛的应用领域。
从消毒剂到炸药,氯酸的威力在不同的场合中得到了充分的展示。
本文将介绍氯酸的性质、用途以及在不同领域中的应用。
一、氯酸的性质和特点氯酸(HClO3)是一种无机化合物,呈无色晶体或液体,具有较强的氧化性。
它在水中呈强酸性溶液,能与许多物质发生反应。
氯酸具有低毒性,但在高浓度下可以对人体造成伤害,使用时需注意安全。
二、氯酸的消毒剂作用作为一种强氧化剂,氯酸具有很强的消毒能力。
在水处理中,可以将氯酸加入水中,能有效地杀灭细菌、病毒和其他微生物,保证水的卫生安全。
此外,氯酸还常用于食品加工、医疗卫生等行业中的消毒操作,起到预防传染病的作用。
三、氯酸的氧化剂作用由于氯酸是一种强氧化剂,因此在化学反应中具有重要的应用价值。
氯酸可以与许多有机物和无机物发生反应,将其氧化为更高价态的元素。
比如,在某些有机合成反应中,氯酸可以将醇氧化为酮、醛,起到催化剂的作用。
四、氯酸在炸药中的应用氯酸在炸药制备中作为重要的组成部分,发挥着重要的作用。
混合氯酸和有机物,如甘油和糖类,可以制备出氯酸炸药。
这种炸药威力巨大,能够产生剧烈的爆炸,因此在军事和爆破领域得到广泛应用。
五、氯酸的环境问题尽管氯酸在消毒和炸药制备中具有重要作用,但它也存在一定的环境问题。
炸药爆炸后会释放出大量有害气体,污染空气和水源。
此外,在未经处理的情况下,氯酸也可能对环境产生负面影响。
因此,在使用氯酸时需采取适当的安全措施,以减少对环境的影响。
结论氯酸是一种具有强氧化性的化合物,广泛应用于消毒剂和炸药制备中。
它在消毒过程中能够有效杀灭病菌,保证水的卫生安全。
同时,氯酸也能用作有机合成反应的催化剂,发挥其强氧化剂的作用。
然而,使用氯酸需谨慎,需注意安全和环境保护的问题。
以上是对氯酸的威力从消毒剂到炸药的综合介绍,希望对您有所帮助。
铸造中使用的强氧化剂1

铸造生产中使用的强氧化剂一. 选择原则 安全、无毒、便宜。
要选择运输、保存、使用中安全性强的,使用中不产生有毒气体和毒性副产物的和价格稍便宜的氧化剂。
二.可供选的强氧化剂的种类强氧化剂种类有很多,但可供有以下几种: 硝酸盐类、氯酸盐类、高锰酸盐、高氯酸盐重铬酸盐、氧化锰可供选的强氧化剂有:硝酸钾KNO 3,硝酸钠NaNO 3,硝酸钙 Ca (NO 3 )2;氯酸钾KCl +5O 3,高氯酸钾KCl +7O 4 ,重铬酸钾K 2Cr +62O 7,高锰酸钾KMn +7O 4,二氧化锰MnO 2,、三氧化二铁Fe 2O 3 。
1. 硝酸盐 所有的硝酸盐性质都不稳定,加热时易分解,放出氧气,高温时是强氧化剂。
1). 常见的金属活动顺序表(K ,Ca ,Na , Mg, Al, Zn , F e , Sn , Pb ,(H )Cu, Hg ,Ag ,Pt ,Au )。
位于Mg 之前金属K ,Ca ,Na ,的硝酸盐,在加热时生成金属的亚硝酸盐KNO 2 ,NaNO 2, Ca(NO 2)2和氧气O 2 。
① 硝酸钾KNO 3 加热至400℃时,放出氧气并生成亚硝酸钾KNO 2。
硝酸钾为强氧化剂。
硝酸钾与有机物接触时能引起燃烧和爆炸。
KNO 3−−→−℃400KNO 2 + O 2↑ ② 硝酸钠NaNO 3 加热至380℃时开始分解,400-600℃放出氧气。
为强氧化剂。
与C 、S 、P 和有机物混合或受到撞击,容易引起燃烧和爆炸。
NaNO 3 −−→−℃380NaNO 2 + O 2↑ 400-600℃放出氮气和氧气。
③硝酸钙Ca (NO 3)2 ·4H 2O 无水硝酸钙Ca (NO 3)2Ca(NO 3)2 −−→−℃500Ca(NO 2)2 + O 2↑加热分解温度:加热到500℃分解放出氧气。
2) 在金属活动顺序表里,位于Mg 至Cu 的金属(Mg, Al, Zn, Fe, Sn, Pb, Cu )的硝酸盐,在加热时生成金属单质、二氧化氮和氧气。
强氧化剂

强氧化剂编辑重铬酸钾、过氧化物、如三价钴盐、过硫酸盐、强氧化剂就是具有强烈氧化性的物质。
高锰酸钾、氯酸盐、发烟硫酸、硝酸、氯气、氟气等。
这些物质对人体有很大伤害,使用需要小心中文强氧化英文oxidantstrong危险性描强氧化剂一般具有强腐蚀性,具有一定的危险氧化的物具有强目概1.强弱标2.几种类3.还原4.概编strong oxidant英文名的物质具有强氧化中越易获得电子,化学反在标电顺序中的位置越靠后,标准电位值越正,或离子)就是越强的氧化剂这类物质(如分子原[1等硫过氧化重铬酸、高锰酸钾、氧酸盐发如三钴、过硫酸盐都是强氧化剂常见的氧化剂是在化学反应中易得电子被还原的物质非金属等(其氧化性强弱I金属单FOClBr)典型的基本一致)动等)含有变价元素的高价化合物,KMnO4 KClO4 H2SO4 HNO3)(在金属与酸、盐溶液的置换反应,如、HFe3阳离如Cu2)金FCu2是氧化剂原子中,实质上Fe+CuSO4=FeSO4+CCu2离子氧F还原 . . .. . . . F1氟℃以下,凝是淡黄色的气体,强氧化性,有特殊难闻的臭味,剧毒。
18氟(F2大多数几乎能和所有的元素化合常下黄色的液体。
-22℃变成黄结晶许属都会被氟腐蚀,碱金属在氟气中会燃烧,甚至连黄金在受热后也能在氟气中燃烧、磷、硫等同样也会在氟气中燃烧非金属,臭O2它是一种有特殊臭味的蓝色气体在常温下同素异形有强氧化性臭氧是氧气中。
它吸收对人体有害的短波臭氧公里同温下部臭氧主要存在于距地球表2气味相像;氯外线,防止其到达地球。
气态臭氧厚层带蓝色,有特殊臭味,浓度高时态臭氧深蓝色,固态臭氧紫黑色氯Cl33.21,气体密-34.6氯单质为黄绿色气体,有窒息性臭味;熔-100.98,沸体积氯气。
氯相当活泼,湿的氯气比干的还活泼,2.1体积水可溶升20有强氧化性。
除了氟、氧、氮、碳和惰性气体外,氯能与所有元素直接化合生成氯化物;加成反还能与许多化合物反应,例如与许有机化合进取代反HNO4硝五氧化酸硝酸nitric aci)分子式,是一种有强氧化性、强腐蚀性的无机酸),易溶于水,在水中完全电离,常温下其。
次氯酸在工业上的应用案例

次氯酸在工业上的应用案例次氯酸(HClO)是一种强氧化剂,在工业上有多种应用案例。
以下是符合要求的10个应用案例。
1. 次氯酸消毒剂次氯酸具有很强的杀菌能力,因此被广泛应用于消毒剂的制造。
次氯酸消毒剂可以用于食品加工厂、医疗机构、酒店等场所的卫生消毒,能有效杀灭细菌、病毒和真菌。
2. 次氯酸漂白剂次氯酸可用作漂白剂,可以用于纺织、造纸、食品加工等行业。
次氯酸漂白剂对有机染料有很强的漂白作用,能有效去除污渍,提高产品的质量。
3. 次氯酸污水处理剂次氯酸在污水处理中可以用作氧化剂,能有效降解有机物和去除污染物。
次氯酸污水处理剂可以用于工业废水、生活污水和农业废水的处理,能改善水质,减少对环境的污染。
4. 次氯酸饮用水处理剂次氯酸可用于饮用水的消毒处理,能有效杀灭水中的细菌和病毒,保证饮用水的安全性。
次氯酸饮用水处理剂具有操作简便、安全可靠的特点,被广泛应用于城市供水系统和户外活动中的饮水设备。
5. 次氯酸洗涤剂次氯酸洗涤剂可以用于清洗食品加工设备、医疗器械和实验室用具等。
次氯酸具有强氧化性和杀菌作用,能有效去除污渍和细菌,保持设备的清洁和卫生。
6. 次氯酸金属表面处理剂次氯酸可用于金属表面的处理,能去除金属表面的氧化层、锈蚀和污渍,提高金属的表面质量。
次氯酸金属表面处理剂广泛应用于金属制品的生产和维修领域。
7. 次氯酸橡胶漂白剂次氯酸可以用于橡胶的漂白,能去除橡胶中的杂质和污渍,提高橡胶的外观和质量。
次氯酸橡胶漂白剂被广泛应用于橡胶制品的生产和加工过程中。
8. 次氯酸脱臭剂次氯酸具有很强的氧化性,可以用于去除污水、废气和垃圾等产生的恶臭。
次氯酸脱臭剂可以用于污水处理厂、垃圾处理场和化工厂等场所,能改善环境空气质量。
9. 次氯酸石油开采助剂次氯酸可以用作石油开采的助剂,能有效降低油井的黏度和表面张力,提高采油效率。
次氯酸石油开采助剂被广泛应用于油田开发和石油生产过程中。
10. 次氯酸纸浆漂白剂次氯酸可用于纸浆的漂白,能有效去除纸浆中的杂质和色素,提高纸张的白度和质量。
最强氧化剂最强酸和最强氧化性酸

1最强氧化剂最强酸和最强氧化性酸1.1先看看最强的酸是什么?1.最强的单酸是高氯酸,它也是最强的无机单酸,它的酸性是硫酸的10倍,其次是哪个,不好说,我手里没有相关数据,有人说是高溴酸,有人说是偏高碘酸,有人说是有人说是氢碘酸,有人说是氢砹酸。
(等我查到数据再补上谁是第二谁是第三单酸)最强的有机酸是三氟甲磺酸,它属于超强酸,酸性比高氯酸还强。
严格来说他也属于混合酸。
常见的最强有机酸是草酸,它的酸性和亚硫酸基本相当,比亚硫酸略强,强于磷酸最强的酸,包括单酸和混合酸,那就是氟锑酸,其次是魔酸。
至于“王水”,王水也属于混合酸,它酸性未必比盐酸强多少,但是氧化性却比较强,距离最强酸的标准还差得远,等提到氧化性酸再说它。
你能将强酸拍拍顺序吗?酸太多了,许多都没有数据,现将中学出现的酸排排吧。
第一个,毫无疑问是高氯酸,我们假设高氯酸的酸性为100吧(各个酸对应高氯酸的强度可以计算)第二个氢碘酸,氢碘酸的酸性大概是高氯酸的0.8,80,至于什么高溴酸,偏高碘酸,氢砹酸,不是中学需要掌握的,氢砹酸理论上是仅次于高氯酸的强酸,可它是放射性元素,没有人去研究使用。
要注意的是氢碘酸很不稳定,光照,受热都会分解成碘和氢气,并且露于空气中的时候很快就会被空气中的氧气所氧化,变成碘沉淀下来,所以实际用处不大。
尽管你很强,可是总不能只装在瓶子里看吧.....。
第三个,是氢溴酸,酸性是高氯酸的0.4,40第四个,是硫酸,酸性是高氯酸的十分之一,10第五个,是盐酸,酸性,约是高氯酸的1/25,近似于4第六个,是氯酸,酸性和高氯酸相差较多,大约在2--3之间第七个,高锰酸,大约在2----2.5之间第八个,硝酸,酸性是高氯酸的六十分之一第九个,重铬酸,酸性约是高氯酸的百分之一另外还有个硒酸,酸性基本和硫酸相当,也可放在硫酸的位置。
其中:氢溴酸,氢碘酸,高氯酸,盐酸,硫酸,硝酸被称为六大无机强酸;其中高氯酸,酸性最强,氧化性最强,活泼金属和盐酸反应最快,其次是硫酸;不活泼金属和硝酸反应最快。
高锰酸钾

高锰酸钾高锰酸钾,也叫灰锰氧、PP粉,是一种常见的强氧化剂,常温下为紫黑色片状晶体,易见光分解:2KMnO4(s)—hv→K2MnO4(s)+MnO2(s)+O2(g),故需避光存于阴凉处,严禁与易燃物及金属粉末同放。
高锰酸钾以二氧化锰为原料制取,有广泛的应用,在工业上用作消毒剂、漂白剂等,在实验室,高锰酸钾因其强氧化性和溶液颜色鲜艳而被用于物质的鉴定,酸性高锰酸钾溶液是氧化还原滴定的重要试剂。
在医学上,高锰酸钾可用于消毒、洗胃。
化学性质化学式:KMnO4,高锰酸钾常温下即可与甘油等有机物反应甚至燃烧(但有时与甘油混合后反应极为缓慢,甚至感受不到温度的升高,其原因尚不明确);在酸性环境下氧化性更强,能氧化负价态的氯、溴、碘、硫等离子及二氧化硫等。
与皮肤接触可腐蚀皮肤产生棕色染色,数日不褪;粉末散布于空气中有强烈刺激性,可使人连打喷嚏。
尿液、二氧化硫等可使其褪色。
与较活泼金属粉末混合后有强烈燃烧性,危险。
该物质在加热时分解:2KMnO4=△=K2MnO4+MnO2+O2↑·高锰酸钾在酸性溶液中还原产物为二价锰离子·高锰酸钾在碱性溶液中还原产物一般为墨绿色的锰酸钾(K2MnO4)。
·高锰酸钾在中性环境下还原产物为二氧化锰。
维生素C的水溶液能使高锰酸钾溶液褪色,并且维生素C溶液越浓,水溶液用量就越少。
根据这一特性,就能够用高锰酸钾测定蔬菜或水果中的维生素含量。
高锰酸钾造成的污渍可用还原性的草酸、维生素C等去除。
强氧化剂,在酸性条件下氧化性更强,可以用做消毒剂和漂白剂,和强还原性物质反应会褪色,如SO2、不饱和烃。
[5]编辑本段作用与用途实验室1.用来自行加热分解或与过氧化氢反应制取氧气。
(1)高锰酸钾加热分解制取氧气的化学方程式:2KMnO4===△===K2MnO4+MnO2+O2↑KMnO4===△===KMnO2+O2↑K2MnO4 的高温分解可能是:2K2MnO4====2K2O+2MnO2+O2↑注意:若高锰酸钾用量较大,要在试管里的导管口堵一团棉花,否则氧气将高锰酸钾粉末带起堵住导管,引发危险并造成试剂浪费。
常见氧化剂及氧化性排序

氧化剂概述换反应,如反应Fe+CuSO₄=FeSO₄+Cu中,实质上是Cu₂+离子氧化Fe原子,Cu₂+作氧化剂,Fe是还原剂)常见氧化剂:1.氟气氟气(F₂)是淡黄色的气体,强氧化性,有特殊难闻的臭味,剧毒。
-188℃以下,凝成黄色的液体。
在-223℃变成黄色结晶体。
在常温下,氟几乎能和所有的元素化合:大多数金属都会被氟腐蚀,碱金属在氟气中会燃烧,甚至连黄金在受热后,也能在氟气中燃烧。
许多非金属,如硅、磷、硫等同样也会在氟气中燃烧。
2.臭氧臭氧(分子式O₃)是氧的同素异形体,有强氧化性。
在常温下,它是一种有特殊臭味的蓝色气体。
臭氧主要存在于距地球表面20公里的同温层下部的臭氧层中。
它吸收对人体有害的短波紫外线,防止其到达地球。
气态臭氧厚层带蓝色,有特殊臭味,浓度高时与氯气气味相像;液态臭氧深蓝色,固态臭氧紫黑色。
3.氯气氯单质为黄绿色气体,有窒息性臭味;熔点-100.98°C,沸点-34.6°C,气体密度3.214克/升,20°C时1体积水可溶解2.15体积氯气。
氯相当活泼,湿的氯气比干的还活泼,具有强氧化性。
除了氟、氧、氮、碳和惰性气体外,氯能与所有元素直接化合生成氯化物;氯还能与许多化合物反应,例如与许多有机化合物进行取代反应或加成反应。
4.硝酸硝酸(nitric acid)分子式HNO₃,是一种有强氧化性、强腐蚀性的无机酸,酸酐为五氧化二氮。
硝酸的酸性较硫酸和盐酸小(PKa=-1.3),易溶于水,在水中完全电离,常温下其稀溶液无色透明,浓溶液显棕色。
硝酸不稳定,易见光分解,应在棕色瓶中于阴暗处避光保存,严禁与还原剂接触。
硝酸在工业上主要以氨氧化法生产,用以制造化肥、炸药、硝酸盐等,在有机化学中,浓硝酸与浓硫酸的混合液是重要的硝化试剂。
5.浓硫酸浓硫酸是指浓度(这里的浓度是指硫酸溶液里硫酸的质量百分比)大于或等于70%的硫酸溶液。
浓硫酸在浓度高时具有强氧化性,这是它与普通硫酸或普通浓硫酸最大的区别之一。
最强氧化剂最强酸和最强氧化性酸

1最强氧化剂最强酸和最强氧化性酸1.1先看看最强的酸是什么?1.最强的单酸是高氯酸,它也是最强的无机单酸,它的酸性是硫酸的10倍,其次是哪个,不好说,我手里没有相关数据,有人说是高溴酸,有人说是偏高碘酸,有人说是有人说是氢碘酸,有人说是氢砹酸。
(等我查到数据再补上谁是第二谁是第三单酸)最强的有机酸是三氟甲磺酸,它属于超强酸,酸性比高氯酸还强。
严格来说他也属于混合酸。
常见的最强有机酸是草酸,它的酸性和亚硫酸基本相当,比亚硫酸略强,强于磷酸最强的酸,包括单酸和混合酸,那就是氟锑酸,其次是魔酸。
至于“王水”,王水也属于混合酸,它酸性未必比盐酸强多少,但是氧化性却比较强,距离最强酸的标准还差得远,等提到氧化性酸再说它。
你能将强酸拍拍顺序吗?酸太多了,许多都没有数据,现将中学出现的酸排排吧。
第一个,毫无疑问是高氯酸,我们假设高氯酸的酸性为100吧(各个酸对应高氯酸的强度可以计算)第二个氢碘酸,氢碘酸的酸性大概是高氯酸的0.8,80,至于什么高溴酸,偏高碘酸,氢砹酸,不是中学需要掌握的,氢砹酸理论上是仅次于高氯酸的强酸,可它是放射性元素,没有人去研究使用。
要注意的是氢碘酸很不稳定,光照,受热都会分解成碘和氢气,并且露于空气中的时候很快就会被空气中的氧气所氧化,变成碘沉淀下来,所以实际用处不大。
尽管你很强,可是总不能只装在瓶子里看吧.....。
第三个,是氢溴酸,酸性是高氯酸的0.4,40第四个,是硫酸,酸性是高氯酸的十分之一,10第五个,是盐酸,酸性,约是高氯酸的1/25,近似于4第六个,是氯酸,酸性和高氯酸相差较多,大约在2--3之间第七个,高锰酸,大约在2----2.5之间第八个,硝酸,酸性是高氯酸的六十分之一第九个,重铬酸,酸性约是高氯酸的百分之一另外还有个硒酸,酸性基本和硫酸相当,也可放在硫酸的位置。
其中:氢溴酸,氢碘酸,高氯酸,盐酸,硫酸,硝酸被称为六大无机强酸;其中高氯酸,酸性最强,氧化性最强,活泼金属和盐酸反应最快,其次是硫酸;不活泼金属和硝酸反应最快。
水处理剂之强氧化剂的分类(三)

水处理剂之强氧化剂的分类(三)
浓硫酸
浓硫酸是指浓度(这里的浓度是指硫酸溶液里硫酸的质量百分比)大于或等于70%的硫酸溶液。
浓硫酸在浓度高时具有强氧化性,这是它与普通硫酸或普通浓硫酸最大的区别之一。
常用的浓硫酸中H2SO4的质量分数为98.3%,其密度为
1.84g·cm-3,其物质的量浓度为18.4mol·L-1。
硫酸是一种高沸点难挥发的强酸,易溶于水,能以任意比与水混溶。
高锰酸钾
高锰酸钾亦名“灰锰氧”、“PP粉”,是一种常见的强氧化剂,常温下为紫黑色片状晶体,易见光或受热分解:2KMnO4=K2MnO4+MnO2+O2↑,故需避光存于阴凉处,严禁与易燃物及金属粉末同放。
高锰酸钾以二氧化锰为原料制取,有广泛的应用,在工业上用作消毒剂、漂白剂等,在实验室,高锰酸钾因其强氧化性和溶液颜色鲜艳而被用于物质的鉴定,酸性高锰酸钾溶液是氧化还原滴定的重要试剂。
oxone氧化剂

oxone氧化剂oxone氧化剂是一种有机无机混合氧化剂,也称为过氧化脲(PAN),是一种强氧化剂。
oxone氧化剂是由六氟乙醚(醚)、钠和氧气组成的混合物。
它是国际上最常用的氧化剂,也是最安全、最有效的氧化剂之一。
oxone氧化剂的性能优异,具有高活性、高氧化效率、强氧化性、低毒性、低腐蚀性、低环境污染等特点。
在实际应用中,oxone氧化剂可以帮助人们实现以下功能:1、工业废水处理:oxone氧化剂可以有效的改善水质,降低污染物的浓度,减少致病原因,提升水质,从而解决废水处理问题。
2、食品加工中的消毒:oxone氧化剂是食品加工企业最常用的消毒剂,用于消毒食品加工设备、各种餐具、饮料及储藏室,有效的消除有害微生物的可能性,以达到安全卫生的要求。
3、水处理:oxone氧化剂可以快速和有效的分解一氧化碳、氨氮等有毒物质,有效的抑制水体营养物质积聚,保护水体生态环境,实现水质净化。
4、空气清洁:oxone氧化剂可以快速有效的降解空气中的各种污染物,包括硫化氢、一氧化碳、臭氧、甲烷、氨等,有效净化空气,改善大气环境。
此外,oxone氧化剂还可以用于解决其他的环境问题,有效的控制污染物的排放,减少污染物的排放,减少污染物对环境的影响,保护环境资源,有利于维护地球的生态系统。
oxone氧化剂在控制污染方面有着卓越的表现,不仅有效净化水体、空气和食物,还有助于减少工业污染物的排放,保护环境资源。
它的安全性、高效率的氧化性和较低的费用,使它成为国际上最常用的氧化剂之一。
然而,oxone氧化剂仍有一定的毒性,如果使用时不注意安全操作,可能会对人体健康带来危害。
因此,在使用oxone氧化剂时,我们应根据特殊情况控制剂量,并注意安全操作,以确保安全。
总之,oxone氧化剂在解决环境污染问题方面表现出色,除了它有一定毒性需要注意外,它被广泛用于工业废水处理、食品加工消毒、水处理和空气清洁等方面,以及其他环境保护方面,深受人们的认可。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
强氧化剂
概述
英文名:strong oxidant
具有强烈氧化性的物质。
在标准电位顺序中的位置越靠后,标准电位值越正,在化学反应中越易获得电子,则这类物质(如分子、原子或离子)就是越强的氧化剂。
如三价钴盐、过硫酸盐、过氧化物、重铬酸钾、高锰酸钾、氧酸盐、浓硫酸等,都是强氧化剂。
常见的氧化剂是在化学反应中易得电子被还原的物质。
(1)典型的非金属单质如F₂、O₂、Cl₂、Br₂、I₂、S等(其氧化性强弱与非金属活动性基本一致)。
(2)含有变价元素的高价化合物,如KMnO4 KClO₃ H2SO₄ HNO₃ MnO₂等。
(3)金属阳离子如:Fe₃+、Cu₂+、(H+)(在金属与酸、盐溶液的置换反应,如反应Fe+CuSO₄=FeSO₄+Cu中,实质上是Cu₂+离子氧化Fe原子,Cu₂+作氧化剂,Fe 是还原剂)
强氧化剂
1.氟气
氟气(F₂)是淡黄色的气体,强氧化性,有特殊难闻的臭味,剧毒。
-188℃以下,凝成黄色的液体。
在-223℃变成黄色结晶体。
在常温下,氟几乎能和所有的元素化合:大多数金属都会被氟腐蚀,碱金属在氟气中会燃烧,甚至连黄金在受热后,也能在氟气中燃烧。
许多非金属,如硅、磷、硫等同样也会在氟气中燃烧。
2.臭氧
臭氧(分子式O₃)是氧的同素异形体,有强氧化性。
在常温下,它是一种有特殊臭味的蓝色气体。
臭氧主要存在于距地球表面20公里的同温层下部的臭氧层中。
它吸收对人体有害的短波紫外线,防止其到达地球。
气态臭氧厚层带蓝色,有特殊臭味,浓度高时与氯气气味相像;液态臭氧深蓝色,固态臭氧紫黑色。
3.氯气
氯单质为黄绿色气体,有窒息性臭味;熔点-100.98°C,沸点-34.6°C,气体密度3.214克/升,20°C时1体积水可溶解2.15体积氯气。
氯相当活泼,湿的氯气比干的还活泼,具有强氧化性。
除了氟、氧、氮、碳和惰性气体外,氯能与所有元素直接化合生成氯化物;氯还能与许多化合物反应,例如与许多有机化合物进行取代反应或加成反应。
4.硝酸
硝酸(nitric acid)分子式HNO₃,是一种有强氧化性、强腐蚀性的无机酸,酸酐为五氧化二氮。
硝酸的酸性较硫酸和盐酸小(PKa=-1.3),易溶于水,在水中完全电离,常温下其稀溶液无色透明,浓溶液显棕色。
硝酸不稳定,易见光分解,应在棕色瓶中于阴暗处避光保存,严禁与还原剂接触。
硝酸在工业上主要以氨氧化法生产,用以制造化肥、炸药、硝酸盐等,在有机化学中,浓硝酸与浓硫酸的混合液是重要的硝化试剂。
5.浓硫酸
浓硫酸是指浓度(这里的浓度是指硫酸溶液里硫酸的质量百分比)大于或等于70%的硫酸溶液。
浓硫酸在浓度高时具有强氧化性,这是它与普通硫酸或普通浓硫酸最大的区别之一。
常用的浓硫酸中H₂SO₄的质量分数为98.3%,其密度为1.84g·cm-3,其物质的量浓度为18.4mol·L-1。
硫酸是一种高沸点难挥发的强酸,易溶于水,能以任意比与水混溶。
6.高锰酸钾
高锰酸钾亦名“灰锰氧”、“PP粉”,是一种常见的强氧化剂,常温下为紫黑色片状晶体,易见光或受热分解:2KMnO₄=K₂MnO₄+MnO₂+O₂↑,故需避光存于阴凉处,严禁与易燃物及金属粉末同放。
高锰酸钾以二氧化锰为原料制取,有广泛的应用,在工业上用作消毒剂、漂白剂等,在实验室,高锰酸钾因其强氧化性和溶液颜色鲜艳而被用于物质的鉴定,酸性高锰酸钾溶液是氧化还原滴定的重要试剂。
7.重铬酸钾
重铬酸钾呈橙红色板状结晶,有强氧化性,与可燃物接触可能着火。
比重2.676。
熔点398℃。
本品为用途极广的铬化合物,用于铬酸混合液和重铬酸滴定等实验室应用,工业上的铬酸盐、重铬酸盐制造、有机合成,电镀、防腐剂、颜料、媒染剂,照相、印刷、电池、安全火柴、化学研磨剂等。
六价铬毒性大于三价铬。
铬还是一种致敏源,六价铬有刺激性和腐蚀性,是一种致癌物。
8.次氯酸钠
白色粉末,有潮解性。
在空气中不稳定,受热后分解。
工业品则是浅黄色透明液体。
俗称漂白水,是不稳定化合物。
能逐渐释放出氧气。
碱性次氯酸钠溶液比较稳定,俗称安替福明。
能溶于冷水,受热到35℃以上或遇酸则分解,有氧化性。
作为氧化剂使用时主要在
强碱介质使用。
9.双氧水
水溶液为无色透明液体,有微弱的特殊气味。
纯过氧化氢是淡蓝色的油状液体。
存在于空气和水中,光照、闪电和微生物均可产生过氧化氢。
化学性质极不稳定,是一种强氧化剂,具有较强的漂白和防腐功能,可以掩盖食品本身的腐败变质。
10.其它强氧化剂
其他较常见的强氧化剂还有二氧化铅、铋酸钠、高碘酸、三氟化钴、高铁酸钠等,但较前面列举的强氧化剂应用得少一些。
还原剂
常见的还原剂是在化学反应中易失电子被氧化的物质。
(1)典型的金属单质如:K、Ca、Na、Mg等(其还原性强弱与金属活动性基本一致)
(2)某些非金属单质及其化合物如:H₂、C、CO。
(3)有变价元素的最低价态化合物如:H₂S、HI、HBr、HCl
(4)非金属阴离子如:S₂-、I-、Br-、Cl-
活泼的金属单质,如Na,Al,Zn,Fe等.某些非金属单质,如H₂,C,Si等.元素(如C,S 等)处于低化合价时的氧化物,如CO,SO₂等.元素(如Cl,S等)处于低化合价时的酸,如HCl,H₂S等.元素(如Fe,S等)处于低化合价时的盐,如Na₂SO₃,FeSO₄等。
常见的还原剂还有:氢气(H₂)、一氧化碳(CO)、铁屑(Fe)、锌粉(Zn)等。
强弱标准。
