13有机合成基础
第二十一章 有机合成基础

第二十一章有机合成基础简单有机化合物的制备及复杂化合物的合成是有机化学研究过程中的主要任务。
有机合成是有机化学中的重要分支。
出于基础理论和实际应用研究的需要,人们在从事新化合物的合成的同时,也在不断的优化已知化合物的合成工艺路线,开发出了许多新的更经济、更环保的合成反应。
有机合成的中心任务主要包括:1)以具有特殊用途或目的的分子为目标,设计合成路线并进行实施;2)以特定的价廉易得的天然原料为起始物,经过合成转化成价值高的产品;3)以特定的反应,特别是新反应为对象,研究它们在有意义的化合物的合成中的潜在应用。
有机合成设计的主要内容包括有机分子骨架的形成和官能团的引入及转化两个方面。
分子骨架的形成主要包括碳碳单键、不饱和键以及碳环与杂环的形成方法,它是有机合成的核心内容。
本章将主要介绍碳基本骨架的形成途径、常见官能团的合成方法、以及反合成分析的基础知识。
21.1 碳氢分子骨架的形成复杂有机化合物可以看成是以烃类分子为基本骨架,在特定位置上引入各种不同的杂原子或官能团后形成的。
构建分子骨架的具体内容主要包括C-H键、C-C键、C=C键、C≡C 键及碳环的形成方法。
21.1.1 C-H键的形成方法在有机合成中,为了构建特定的碳链结构,常需要借助特定的官能团作为辅助基团。
在碳链结构构建成功后,这些官能团需要转化成C-H键。
形成C-H键的一般方法包括:1)利用碳负离子夺取一个质子;2)利用催化加氢和氢解反应;3)利用负氢试剂的亲核取代反应(表观上的还原反应);4)碳自由基的攫氢反应。
一、碳负离子法一般而言,碳负离子主要是通过还原试剂还原特定官能团化合物而生成的中间体。
下面对各种形成方式作简单介绍。
1)卤代烃与碱(土)金属的反应除氟代烃外,卤代烃可以与金属镁反应,形成相应的格氏试剂。
格氏试剂与含酸性氢原子的化合物反应,则可以得到卤素被氢原子取代的产物。
例如:OCH3Br ClOCH3 Br OCH3MgBrClH O+OCH3ClOH HBr Br Mg, THF3+2)碱金属还原不饱和键的反应在低温下,含苯环的化合物可以被锂(钠)在液氨中还原成1,4-环己二烯化合物,该过程称为Birch 还原反应。
(统考版)2023高考化学二轮专题复习 题型分组训练13 有机化学基础(选考题)

题型分组训练13 有机化学基础(选考题)(A 组)1.某研究小组以芳香族化合物A 为起始原料,按下列路线合成高血压药物阿替洛尔。
已知:有机物H 中除了苯环还有其他环;RCOOR ――→NH 3 RCONH 2。
请回答:(1)下列说法正确的是________。
A .有机物D 能发生加成、取代、氧化反应,不发生还原反应B .有机物E 能与FeCl 3溶液发生显色反应C .有机物Ⅰ具有弱碱性D .阿替洛尔的分子式是C 14H 20N 2O 3(2)写出有机物E 的结构简式_______________________________________________。
(3)写出F +G ―→H 的化学方程式___________________________________________ ________________________________________________________________________ _______________________________________________________________________。
(4)设计从A 到B 的合成路线(用流程图表示,无机试剂任选)。
(5)写出有机物C 同时符合下列条件的同分异构体的结构简式________________________________________________________________________。
①1H —NMR 谱和IR 谱检测表明:分子中共有4种氢原子,无氮氧键和碳氮双键; ②除了苯环外无其他环。
2.沙利度胺是一种重要的合成药物,具有镇静、抗炎症等作用。
有机物H是合成它的一种中间体,合成路线如图(部分反应条件和产物未列出)。
回答下列问题:(1)A的化学名称为________,E→F的反应类型为________,H中官能团的名称为____________________。
大学有机化学有机合成全面总结

OH
α -氰 醇
α -羟 基 酸
应用范围:醛、甲基脂肪酮 、C8以下环酮
2. 增加二个碳原子的反应
R MgX + CH2 CH2 O
R CH2CH2 H3O+ RCH2CH2OH OMgX
3. 增加多个碳原子的反应
① R-C CH NaNH2 R-C CNa R/X R-C C-R/
其中:R/ 为伯卤代烃 X 为Cl、Br、I
H2O / OH- PX3 Mg
NH3 R-NH2
R-MgX
R-X
① ②
CO2 H3O+
R-COOH
H3O+
NaCN
R-CN
R-NH2 R-NHR
[H]
R-CH2NH2
R-X
R-NR2
2. 羧酸及其衍生物的转换
R-COCl
NH3
R-CONH2
R/OH
R-COOH
NH3
R-COOR/
R/OH
(RCO)2O
H2SO4 H2O
① (BH3)2 ② H2O2 /
OH-
R-CH-CH3(符合马氏规则) OH
R-CH2CH2OH(反马氏规则)
[H]
② R-C=O H(R/) [ O ]
R-CH-OH H(R/)
[ H ] = LiAiH4 、NaBH4 、 H2 / Ni、Pt、Pd等
③ R-COOR/ [ H ] R-CH2OH + R/OH [ H ] = LiAiH4 、C2H5OH + Na 、 H2 / Ni、Pt、Pd等
R-NH2
● 碳环的合成
① 双烯合成(D-A反应)
X△
-X
有机合成 第三章 有机合成路线基础

a
CO2Et
a b 路线b原料相同,节约成本
TM19
王鹏
3.2 双官能团的切断思路
四、1,5-二羰基化合物的切断设计:
活泼α-H化合物与α, β-不饱和醛酮的加成
Michael反应: 活泼亚甲基化合物和α, β-不饱和
羰基化合物碱催化加成
活泼亚甲基化合物: 丙二酸酯、氰乙酸酯、乙酰乙 酸酯、乙酰丙酮、硝基烷类 α, β-不饱和羰基化合物:α, β-烯(炔)醛或酮、 α, β-烯(炔)酯、 α, β-烯腈、 α, β-烯酰胺、 α, β-不饱 和硝基化合物、对醌类、杂环和α, β-不饱和烃类
四、羧酸的切断设计:
①与羧基相邻的C-C键可切断为卤代烃
②取代乙酸类羧酸化合物的α与β位间可切断为
卤代烃和EM
+ CN-或CO2
+ R-X
王鹏
3.1 单官能团的切断思路
练习:
H2C
COOEt
-
COOH
COOEt
CO2H
+
Br
OH
TM9
COOEt
COOEt
王鹏
3.1 单官能团的切断思路
Base CH2
CO2Et CH CO2Et
王鹏
基本术语和概念
FGA:Functional
Group Addition,官能团添 加,通过添加不存在的官能团实现合成 FGA的例子: FGI O
CCH2CH2CH3
O Cl CCH2CH2CH3
AlCl3
O
好处:避免重排副反应
3.1 单官能团的切断思路
Mannich碱
+
CH3COCl
王鹏
有机合成基础

HY +δ C+ 4=C3−C2=Oδ 1- 碱
重排
[ Y−C-C=C-OH ]
Y−C-C-C=O
H
反应物: 有活性亚甲基化合物
反
α、β-不饱和醛酮、酯、腈等
应
催化剂: 强碱
特
点 产 物: 1,5—二羰基化合物
过 程:1,4-加成(表面上若3.4-加成)
Chapter 17
(3)偶联反应
CH3CH2CH2MgBr + CH3CCH CH3CCCH2CH=CH2
R '
亲核取代反应
C 2 H 5 O N a C H 2 ( C O O C 2 H 5 ) 2
B r - C H 2 - C H 2 - C H 2 - B r
① O H /H 2 O ② H +
Chapter 17
C O O H
2.形成四元环 亲核取代: 二卤代物脱卤环化: [2+2]反应: 1,3 – 二烯电环化反应
➢从反应类型分:亲核取代、亲核加成、亲电取代、亲电加成等
Chapter 17
1.烃基化反应
(1)通过亲核取代反应引入烃基 亲核试剂---碳负离子或潜在的碳负离子
➢活泼亚甲基烃化:丙二酸酯、β-酮酸酯、 β-二酮等.
Chapter 17
➢烯胺在有机合成中的应用
O X
R
RX
N
+
O XR
O R
Chapter 17
Chapter 17
(2)有机合成是改造世界的工具 人工合成自然界中存在或不存在的人类需要的化合物。
➢尿素的合成 (1828年,德国化学家 Wohler)
O
N H 4O C N
第十三章有机合成基础_有机化学及实验
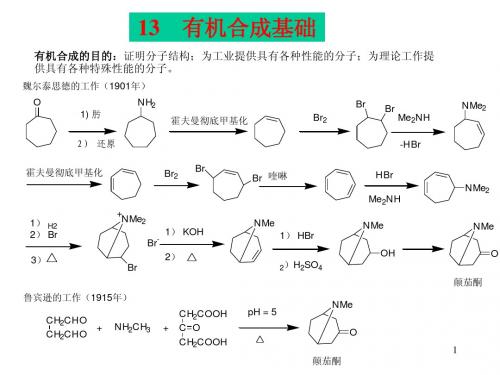
NH2 霍夫曼彻底甲基化 Br2
Br
Br
NMe2 Me2NH -HBr
NMe OH
NMe O 颠茄酮
鲁宾逊的工作(1915年) CH2CHO + CH2CHO NH2CH3 + CH2COOH C O CH2COOH pH = 5
NMe O
1
颠茄酮
13 有机合成基础
魏尔泰思德的工作(1911年) O NMe 假石榴碱 NMe2 1)MeI 2)Ag2O 3) Br2 Br 1)Me2NH 2)MeI 3)Ag2O 4) H2 NMe OH -H2O NMe 1)MeI 2)Ag2O
+
CHCH 2CH2Br CH3
合成:
Br CH3CHCH 3
1) Mg,Et2O 2)
O
CH3
CHCH 2CH2OH CH3 CH3
PBr3
CH3
1) Mg,Et2O 2)CH3CO2Et
CH3
CHCH 2CH2CCH 2CH2CHCH 3 CH3 OH CH3
6
13.1 逆向合成分析
13.1.1切断的选择方法
13.1 逆向合成分析
13.1.2 芳环上取代基切断顺序
1、考察取代基间的相互关系,寻找能实现正确定位的途径。 例如:
O a b b Br O Cl
O + a
Br
b法切断是错误: 异丙基是邻对位定位基, 乙酰基是间位定位基,异 丙基与乙酰基处于对位。
+ Cl
O
合成
+ Br CH3CHCH 3 AlCl3
H2N OH CO2H O2N OH CO2H OH H2N CO2H O2N O2N H2N OH CO2H OH CO2H OH CO2H
高中《化学》有机合成思路与方法
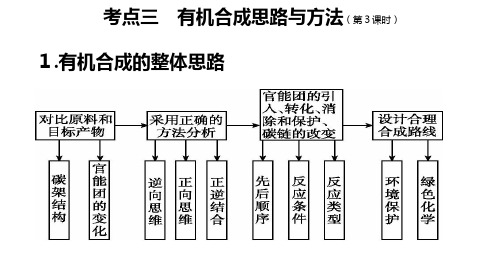
(2).官能团的消除 (1)消除双键:加成反应。 (2)消除羟基:消去、氧化、酯化反应。 (3)消除醛基:还原和氧化反应。 (3).官能团的保护 在引入一个新官能团或将某一官能团加以转换时,若反应会影响分子中原有的官能 团,则应对这一官能团进行保护。例如在含有碳碳双键的分子中,欲将羟基氧化时, 应先把碳碳双键保护起来,以防被破坏。为了保护其他官能团而人为引入的基团, 称为保护基。保护基的选择应满足以下条件:①易于引入且不影响分子中其他部位 结构;②形成的保护基在后续反应中保持稳定;③在保持分子其他部位结构不被破 坏的情况下易于除去。试题中出现的大多是对(酚)羟基、醛基、氨基、碳碳双键 等易于被氧化的官能团进行保护。
(3)成环的方法
①二元醇脱水成环醚; ②二元醇与二元羧酸成环酯; ③羟基酸分子间成环酯; ④氨基酸分子间成环等。 ⑤ 双烯合成[狄(弟)尔斯-阿尔德反应]
4. 有机合成路线的设计
能力要求:能利用不同类型有机化合物之间的转化关系及能
够从题给合成路线中选用必要的合成方法,设计合理路线
合成目标化合物。 综合能力要求高,是考查的难点! 一般是3分,也是拉开差距的部分!!!
和
为原料制备
的路线(无机试剂任选)。
(1)合成路线为:
(1)
(2)已知 :
。设计以
的路线(无机试剂任选)。
和
为原料制备
理解信息中给出的成环反应, 虚线左边来自于二烯烃,虚线右边来自于单烯烃,结合原
料中有含醛基物质,可推出
可由
与氢气加成反应得到,而
可
由 CH2=CHCH=CH2 和 CH2=CHCHO 加成得到。而 CH2=CHCH=CH2 可由 CH3CH=CHCH3 与溴发生加成反应,然后再发生卤代烃的消去反应得到,进而得到合成路线图。
有机化学基础知识点

有机化学基础知识点有机化学基础知识点有机化学又称为碳化合物的化学,是研究有机化合物的组成、结构、性质、制备方法与应用的科学,是化学中极重要的一个分支。
以下是店铺为大家收集的有机化学基础知识点,欢迎大家借鉴与参考,希望对大家有所帮助。
有机化学基础知识点11、熟记下列烃的分子式、结构简式和物理性质、化学性质:甲烷、乙烷、乙烯、丙烯、乙炔、丁二烯、苯、C7H8、C10H8、金刚烷C10H162、熟记下列烃的衍生物的分子式、结构简式和物理性质、化学性质:溴乙烷、乙醇、乙二醇、丙三醇、乙醚、乙醛、丙酮、乙酸、乙酸乙酯、甲醇、甲醛、甲酸、甲酸甲酯、苯酚、苯甲酸3、油脂、糖类、蛋白质:葡萄糖、麦牙糖、淀粉、纤维素(水解)、甘氨酸(两性)、油脂的水解和氢化、蛋白质(水解、盐析、变性)4、多官能团化合物:乳酸、水杨酸、肉桂醛5、有机反应类型:取代、加成、消去、加聚、缩聚、氧化、还原、成肽反应、水解反应6、检验有机物的试剂:银氨溶液、新制Cu(OH)2、FeCl3、KMnO4溶液、溴水、水、NaOH、碘水、灼烧7、同系物、同分异构体、顺反异构、手性分子(会举例)8、有机物的分离与提纯:蒸馏、重结晶、萃取9、有机物的测定:元素分析法、质谱法、红外光谱法、核磁共振法10、有机物的制法:乙烯、乙炔、乙醛、乙酸、乙酸乙酯、合成草酸二乙酯、11、合成高分子化合物:聚氯乙烯、聚已二酸乙二醇酯、酚醛树脂、聚对苯二甲酸二乙酯、顺丁橡胶12、有机物中的氢键、有机物的熔沸点与分子间作用力。
有机化学基础知识点21、常温常压下为气态的有机物:1~4个碳原子的烃,一氯甲烷、新戊烷、甲醛。
2、碳原子较少的醛、醇、羧酸(如甘油、乙醇、乙醛、乙酸)易溶于水;液态烃(如苯、汽油)、卤代烃(溴苯)、硝基化合物(硝基苯)、醚、酯(乙酸乙酯)都难溶于水;苯酚在常温微溶与水,但高于65℃任意比互溶。
3、所有烃、酯、一氯烷烃的密度都小于水;一溴烷烃、多卤代烃、硝基化合物的密度都大于水。
有机合成基础

2、氯甲基化反应:通过苯与甲醛、氯化氢在无水 氯化锌作用下反应生成氯化苄,转化基团可生成 多种化合物
ZnCl2 60 C
0
HCHO
HCl
CH2Cl
3、金属有机化合物反应
在格式试剂中,镁原子以共价键同碳原子相连,碳原子电负性大于 镁,因此成建电子向碳原子转移,使得C-Mg键高度极化,故羟基 是一种活性很高的亲核试剂,能够发生加成、取代、偶合反应。见 课本P8
α—呋喃丙胺
α—呋喃丙胺是治疗血吸虫的药物
c、克诺文盖尔(Knoevenagel)反应。
定义:在弱碱的催化作用下,醛、酮与含有双重
致活的活泼亚甲基化合物发生的缩合反应叫克诺
文盖尔(Knoevenagel)反应。
R' C=O + R Z' H2 C Z 弱碱 R' C=C R Z' + H2O Z
主要有机物之间转化关系图 烷
烯 炔
卤代烃
水解
醇
氧化
还原
醛
氧化
羧酸
酯 化
水 解
酯
2、正向合成分析法
此法采用正向思维方法,从已知原料入手, 找出合成所需要的直接可间接的中间产物,逐步 推向目标合成有机物。
基础原料
中间体
中间体
目标化合物
正向合成分析法示意图
3、逆向合成分析法
是将目标化合物倒退一步寻找上一步反应的 中间体,该中间体同辅助原料反应可以得到目标 化合物。 所确定的合成路线的各步反应,其反应条件 必须比较温和,并具有较高的产率,所使用物基 础原料和辅助原料应该是低毒性、低污染、易得 和廉价的。
O O NaOC2 H5 CH3 C CH2 C OC2H5
2020-2021高中化学5课时作业13有机合成含解析

2020-2021学年高中化学人教版选修5课时作业13有机合成含解析课时作业13有机合成[练基础]1.能在有机物分子中引入羟基的反应类型有:①酯化、②取代、③消去、④加成、⑤水解、⑥还原,其中正确的组合为()A.①②③⑥B.②④⑤C.②④⑤⑥D.②④⑥2.下列反应中,不可能在有机物中引入羧基的是()A.卤代烃的水解B.有机物RCN在酸性条件下水解C.醛的氧化D.烯烃的氧化3.某有机物结构简式为,该有机物不可能发生的反应是()①氧化②取代③加成④消去⑤还原⑥酯化⑦水解⑧加聚A.②B.④C.⑥D.⑧4.对氨基苯甲酸可用甲苯为原料合成,已知苯环上的硝基可被还原为氨基,,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是()A.甲苯――→,硝化X错误!Y错误!对氨基苯甲酸B.甲苯错误!X错误!Y错误!对氨基苯甲酸C.甲苯错误!X错误!Y错误!对氨基苯甲酸D.甲苯错误!X错误!Y错误!对氨基苯甲酸5.以氯乙烷为原料制取乙二酸(HOOC-COOH)的过程中,要依次经过下列步骤中的()①与NaOH的水溶液共热②与NaOH的醇溶液共热③与浓硫酸共热到170℃④在催化剂存在情况下与氯气反应⑤在Cu或Ag存在的情况下与氧气共热⑥与新制的Cu(OH)2悬浊液共热,再酸化A.①③④②⑥B.①③④②⑤C.②④①⑤⑥D.②④①⑥⑤6.1,4。
二氧六环()是一种常见的溶剂,它可以通过下列方法制得:A.1。
丁烯B.1,3-丁二烯C.乙炔D.乙烯7.以乙醇为原料,用下述6种类型的反应来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是()①氧化反应;②消去反应;③加成反应;④酯化反应;⑤水解反应;⑥加聚反应A.①⑤②③④B.①②③④⑤C.②③⑤①④D.②③⑤①⑥8.分子式为C9H18O2的有机物A能在酸性条件下进行下列转化,同温同压下,相同质量的B和C的蒸气所占体积相同,则下列说法不正确的是(A、B、C、D、E均为有机物)() A.E酸化后的有机物与C一定为同系物B.符合上述转化关系的有机物A的结构有9种C.1 mol B完全转化为D转移2 mol电子D.D到E发生氧化反应9.Diels.Alder反应为共轭双烯与含有双键或三键的化合物相互作用生成六元环状化合物的反应,最简单的反应是.如果要合成,所用的原始原料是()A.2-甲基-1,3。
专题十三有机化学基础第十二课时有机合成

专题十三有机化学基础第十二课时有机合成【课堂目标】1.了解加成、取代、消去、加聚和缩聚等有机反应的特点,能判断典型有机反应的类型。
2.掌握烃(烷烃、烯烃、炔烃和芳香烃)及其衍生物(卤代烃、醇、酚、醛、羧酸、酯)的组成、结构特点和主要性质。
能利用不同类型有机化合物之间的转化关系设计合理路线合成简单有机化合物。
3.知道简单合成高分子的单体、链节和聚合度,了解合成高分子化合物的性能及其在高新技术领域中的应用。
【基础梳理】活动一:基础知识回顾1.有机物的类别:(按官能团分类)2.基本有机反应与特征反应(1)取代反应:饱和烃取代(反应条件为光照);卤代烃水解(反应条件为NaOH水溶液并加热);醇分子间脱水(生成醚);酯化反应(反应条件为浓H2SO4并加热);酯或淀粉的水解(反应条件为稀酸并加热)等。
(2)加成反应:当反应条件为催化剂存在下的加氢反应时,通常为碳碳双键、碳碳叁键、苯环或醛基的加成反应(其中“-CHO”和“苯环”只能与H2发生加成反应。
“—CHO”与溴水反应是被溴水氧化)。
(3)消去反应:能够发生消去反应有机物为醇或卤代烃。
(4)氧化反应①燃烧氧化②弱氧化剂氧化能发生银镜反应或能与新制的Cu(OH)2悬浊液反应的有机物必含有“-CHO”。
1mol -CHO 完全反应时生成2molAg↓或1molCu 2O 。
③催化氧化当反应条件为催化剂并有氧气时,通常是醇氧化为醛或醛氧化为酸。
能发生连续氧化的有机物A→B→C,则A 应是具有“-CH 2OH”的醇,B 就是醛,C 应是酸。
(5)聚合反应①加聚反应:单体的结构特点:含有不饱和键,如:“-C =C -”、“-C≡C-”、“>CO ”②缩聚反应:酚醛缩聚 聚酯 聚酰胺 聚醚(6)有机显色反应:遇FeCl 3溶液显紫色的有机物必含有酚羟基。
3.有机物结构鉴定的常用方法:化学方法:利用特征反应鉴定出官能团。
物理方法:红外光谱、核磁共振谱等。
高中化学 有机合成基础知识(基础)知识讲解学案 新人教版选修5

有机合成基础知识【学习目标】1、掌握有机化学反应的主要类型:取代反应、加成反应、消去反应的概念,反应原理及其应用;2、了解有机化学反应中的氧化还原反应,能根据碳原子的氧化数法判断有机化学反应是氧化反应还是还原反应;3、了解加成聚合反应和缩合聚合反应的特点,能写出简单的聚合反应的化学方程式;4、了解官能团与有机化学反应类型之间的关系,能判断有机反应类型,能正确书写有机化学反应的方程式。
【要点梳理】要点一、有机化学反应的主要类型 1.取代反应。
(1)取代反应指的是有机物分子中的某些原子或原子团被其他原子或原子团所代替的反应。
(2)有机物与极性试剂发生取代反应的结果可以用下面的通式来表示。
888811221221A B A B A B A B +-+--+-→-+-(3)烃的卤代、芳香烃的硝化或磺化、卤代烃的水解、醇分子间的脱水反应、醇与氢卤酸的反应、酚的卤代、酯化反应、酯的水解和醇解,以及即将学到的蛋白质的水解等都属于取代反应。
①卤代。
CH 4+X 2−−→光CH 3X+HX②硝化。
③磺化。
④α—H 的取代。
Cl 2+CH 2=CH —CH 3500600C︒−−−−−→:CH 2=CH —CH 2Cl+HCl ⑤脱水。
CH 3CH 2OH+HOCH 2CH 3140C ︒垐垐垎噲垐垐浓硫酸CH 3CH 2OCH 2CH 3+H 2O ⑥酯化。
CH 3COOH+HO —CH 3∆垐垐垎噲垐垐浓硫酸CH 3COOCH 3+H 2O ⑦水解。
R —X+H 2O NaOH∆−−−−→R —OH+HX R —COOR '+H 2O H +垐垎噲垐RCOOH+R 'OH(4)取代反应发生时,被代替的原子或原子团应与有机物分子中的碳原子直接相连,否则就不属于取代反应。
(5)在有机合成中,利用卤代烷的取代反应,将卤原子转化为羟基、氨基等官能团,从而制得用途广泛的醇、胺等有机物;也可通过取代反应增长碳链或制得新物质。
有机化学基础知识点总复习

有机化学基础知识点总复习一、协议关键信息1、有机化学的基本概念有机化合物的定义与特点:____________________________官能团的概念与常见官能团:____________________________同系物、同分异构体的定义与判断:____________________________2、烃类化合物烷烃的结构、性质与命名:____________________________烯烃的结构、性质与加成反应:____________________________炔烃的结构、性质与化学性质:____________________________芳香烃的结构、性质与苯的同系物:____________________________3、烃的衍生物卤代烃的性质与卤代烃的取代反应:____________________________醇的结构、性质与醇的氧化反应:____________________________酚的结构、性质与酚的酸性:____________________________醛的结构、性质与醛的氧化还原反应:____________________________羧酸的结构、性质与羧酸的酯化反应:____________________________酯的结构、性质与酯的水解反应:____________________________4、有机化学反应类型取代反应的特点与常见实例:____________________________加成反应的特点与常见实例:____________________________消去反应的条件与常见实例:____________________________氧化反应与还原反应的判断与常见反应:____________________________聚合反应的分类与常见聚合反应:____________________________5、有机化合物的合成合成路线的设计原则:____________________________官能团的引入与转化方法:____________________________有机合成中的保护与去保护策略:____________________________6、有机化合物的结构鉴定红外光谱、核磁共振氢谱的原理与应用:____________________________有机化合物结构推断的方法与思路:____________________________二、协议内容11 有机化学的基本概念111 有机化合物是指含碳的化合物,但一些简单的含碳化合物如一氧化碳、二氧化碳、碳酸盐等通常被归类为无机化合物。
有机化学基础知识点

有机化学基础知识点有机化学是研究有机化合物的结构、性质、合成和反应机理的科学。
它是化学的一个重要分支领域,广泛应用于药物、农药、染料、塑料等化学工业领域。
以下是有机化学的基础知识点:1.有机化合物的命名:有机化合物的命名是有机化学的基础。
根据基团、取代基、碳原子数等特征,可以使用功能组命名法、规则命名法等将有机化合物命名为有机化学家可以理解和使用的名称。
2.有机反应的机理:有机化合物的反应可以分为加成反应、消除反应、置换反应等。
了解反应机理对于预测反应产物和控制化学反应有重要意义。
3.有机功能团的性质:有机化合物中的功能团如羟基、氨基、醛基等具有不同的性质和反应性。
了解它们的性质对于有机化合物的设计和合成具有重要意义。
4.手性有机化合物:手性有机化合物是指具有不对称碳原子的有机化合物。
它们具有不对称的空间结构,因此可以存在两种或多种不同的立体异构体。
手性化合物在药物研究和合成中具有重要应用价值。
5.有机合成反应:有机合成反应是有机化学的核心内容。
通过合成反应,可以按照需要合成目标化合物。
了解不同的有机合成方法和反应条件对于合成有机化合物具有重要意义。
6.氧化还原反应:氧化还原反应是有机化学中常见的反应类型之一。
氧化还原反应涉及电子转移过程,通常涉及到氧化剂和还原剂的使用。
7.催化剂:催化剂在有机化学中起着重要的作用。
它们可以加速化学反应的速率,降低反应的活化能。
了解催化剂的性质和使用对于提高有机化学反应的效率具有重要意义。
8.有机多步合成:有机多步合成是有机化学中常见的合成方法之一。
通过多步反应的组合,可以实现对复杂有机化合物的合成。
9.芳香化合物:芳香化合物是一类具有特殊结构的有机化合物。
它们通常具有香味并且具有稳定的化学性质。
芳香化合物的合成和反应机理对于药物和染料的研究具有重要意义。
10.碳骨架的转换:碳骨架的转换是有机化学研究中的一个重要方向。
通过对碳骨架的改变,可以合成出具有不同性质和功能的有机化合物。
有机合成基础知识

有机合成的发展历程
有机合成起源于19世纪初期,随着人们对天然产物和有机 化合物的认识逐渐加深,开始尝试通过化学反应来合成一 些天然产物。
20世纪初,随着立体化学和量子力学的出现和发展,有机 合成的方法和技术得到了极大的提升和改进。
如今,随着计算机辅助设计和预测反应结果等新技术的应 用,有机合成已经进入了一个全新的发展阶段,为人类社 会的进步和发展做出了巨大的贡献。
有机合成基础知识
• 有机合成的定义与重要性 • 有机合成的化学键与反应类型 • 有机合成的原料与试剂 • 有机合成的合成策略与路线设计 • 有机合成的实验操作与技巧 • 有机合成在生活与工业中的应用
01
有机合成的定义与重要性
有机合成的定义
有机合成是有机化学的一个重要分支 ,主要研究如何通过化学反应将简单 易得的原料转化为复杂有机分子。
功能性材料
通过有机合成技术可以制备具有特殊 功能的材料,如光电材料、磁性材料 、传感器材料等,这些材料在电子、 通信、能源等领域有重要应用。
THANKS
感谢观看
废弃物处理
有机合成实验中产生的废弃物应按照 相关规定进行妥善处理,避免对环境 和人体造成危害。
06
有机合成在生活与工业中的应用
有机合成在医药领域的应用
药物研发
有机合成在药物研发过程中发挥 着关键作用,通过合成新的化合 物或对现有化合物进行结构改造, 以寻找具有治疗作用的候选药物。
合成生物活性物质
清理实验现场,确保实验室安全卫生,妥 善处理废弃物。
有机合成实验中的分离与提纯技术
萃取技术
利用不同物质在两种不相溶溶剂中的溶解度差异, 实现分离和提纯。
结晶技术
通过控制温度、浓度等条件,使物质从溶液中析 出晶体,实现分离和提纯。
有机合成基础知识点总结

有机合成基础知识点总结一、有机合成的概念。
有机合成是指利用简单、易得的原料,通过有机化学反应,生成具有特定结构和功能的有机化合物的过程。
其目的包括合成天然产物、制备具有特殊性能的有机材料等。
二、有机合成的任务。
1. 构建碳骨架。
- 增长碳链的反应。
- 卤代烃与氰化钠(NaCN)反应:R - X+NaCN→R - CN + NaX,然后R - CN水解可得到羧酸R - COOH,实现了碳链的增长。
- 醛、酮与格氏试剂(RMgX)反应:R - CHO+R'MgX→R - CH(OH)R'(产物为醇,增长了碳链);R - CO - R'+R''MgX→R - C(OH)(R'')R'。
- 羟醛缩合反应:在稀碱作用下,含有α - H的醛发生自身加成反应。
例如2CH_3CHO→(稀碱)CH_3CH(OH)CH_2CHO,产物加热失水可得到CH_3CH = CHCHO,实现碳链增长。
- 缩短碳链的反应。
- 烷烃的裂化反应:如C_16H_34→(高温)C_8H_18+C_8H_16。
- 烯烃、炔烃的氧化反应:例如R - CH = CH - R'→(KM nO_4/H^+)R - COOH+R' - COOH,碳碳双键断裂,碳链缩短。
- 脱羧反应:R - COOH→(碱石灰)R - H+CO_2↑,常用于制备少一个碳原子的烃类。
2. 引入官能团。
- 引入卤素原子(-X)- 烷烃的卤代反应:CH_4+Cl_2→(光照)CH_3Cl+HCl,反应逐步进行,可得到多卤代物。
- 烯烃、炔烃与卤素单质或卤化氢的加成反应:CH_2 =CH_2+Br_2→CH_2Br - CH_2Br;CH≡ CH+HCl→CH_2 = C HCl。
- 芳香烃的卤代反应:在催化剂作用下,苯与液溴反应C_6H_6+Br_2→(FeBr_3)C_6H_5Br+HBr。
2020版高考化学题型层级练13 有机化学基础(含解析)

题型层级练13 有机化学基础(A 级)1.有机物F ()为一种高分子树脂,其合成路线如下:已知:①A 为苯甲醛的同系物,分子中无甲基,其相对分子质量为134;② H CHO+C H CHO |−−− |NaOH /−−−−−−−−→稀溶液2CH C CHO H O |−=−+ 请回答下列问题:(1)X 的化学名称是________。
(2)B 生成C 的反应类型为________.(3)E 的结构简式为________。
(4)由C 生成D 的化学方程式为________________________________________________________________________。
(5)芳香族化合物Y 是D 的同系物,Y 的同分异构体能与饱和Na 2CO 3溶液反应放出气体,分子中只有1个侧链,核磁共振氢谱显示有5种不同化学环境的氢,峰面积比为6:2:2:1:1.写出两种符合要求的Y的结构简式:________、________.(6)写出以乙醛和乙二醇为主要原料合成高分子化合物的合成路线(无机试剂自选):______________________________________________________ __________________。
答案:(1)甲醛(2)加成反应(3)(4)(5)(6)2.蜂胶是蜜蜂从植物芽孢或树干上采集的树脂。
在蜂胶众多的功效成分中,咖啡酸苯乙酯(CAPE)已经被鉴定为蜂胶中的主要活性组分之一。
已知:①A的核磁共振氢谱有三个波峰,红外光谱显示咖啡酸分子中存在碳碳双键。
合成咖啡酸苯乙酯的路线设计如下:请回答下列问题:(1)物质A的名称为________。
(2)由B生成C和C生成D的反应类型分别是________、________。
(3)E的结构简式为________。
(4)咖啡酸生成咖啡酸苯乙酯的化学方程式为______________________________________________________ ________________________________________________________________________ __________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
13 有机合成基础内容提要讲述了有机合成中的几个概念,如逆向合成份析、合成子、合成树,把握有机合成中的大体思路和策略,学会对多官能团目标化合物的逆向合成份析及其合成技术。
有机化学的进展慢慢形成了三个相互联系和依存的领域。
一是具有生理活性天然产物的分离、鉴定、结构测定及其应用研究;二是以研究反映机理为重点的物理有机化学;第三确实是有机合成。
有机合成是一个富有制造性的领域,不仅能合成那些自然界供给不足的有效化合物,而且能合成自然界不存在的、新的成心义的化合物。
有机合成的基点是各类各类的合成反映和组合这些合成反映来合成目标化合物的合成设计和策略。
近十来年是有机合成的一个新高涨时期。
这一个时期的特点是:1)1)合成反映的选择性,包括化学选择性、区域选择性和立体选择性;2)2)设计并发觉了许多高度选择性的合成反映,尤其是立体选择中的对映选择反映,取得了十年前所无法预料的结果,而且这方面仍在进展;3)3)有机合成设计方式的进步,使此刻的合成线路加倍合理、加倍巧妙。
有机合成既是艺术、又更是科学。
运算机辅助有机合成设计也已开始尝试。
如此一些合成上的进展,使有机化学适应各类复杂分子深切研究的需求,尤其是能更好地参与到与生命进程有关的各类复杂分子研究工作中去。
有机合成是一件超级有趣、超级艰巨的工作,它需要有正确的合成线路和熟练的实验技术。
在合成有机化合物时,所利用的反映都是一些基础反映,只要设计合理,巧妙构建分子骨架,正确引入官能团,适当解决分子的立体化学,有机合成绩迎刃而解了。
逆向合成份析考虑一个特定目标分子(Target Molecule)的合成,第一步是对整个分子的结构特点和已知的理化性质进行搜集、考察,如此能够简化合成的问题和幸免没必要要的弯路;第二步是以上述分析为基础,一步一步倒推出合成此目标化合物的各类线路和可能的起始原料,成立合成树,这也称为逆向合成(Retrosynthesis);第三步是在上述两步的基础上从合成方向进行检查,增加试剂和反映条件,对合成树进行剪裁、取舍,选择最好的线路进行合成。
合成子原料逆向合成份析(Retrosynthetic Analysis),也称反合成份析,是有机合成的逆向思维法,为有机合成提供简捷合理的合成线路。
逆向合成份析经常使用官能团彼此转化(Function Group Interconversion)和切断(Disconnection)方式。
逆向合成份析中经常使用的几个术语或符号如下:目标分子:欲待合成的分子,常以TM表示。
官能团彼此转换(FGI):借助于取代、加成、消去、氧化或还原等反映,和分析中所用的逆推法操作,将一种官能团转换成另一种官能团的进程。
切断:将分子中的一个键切断(用切断符号“┆”穿过被切断的键表示),使分子转变成一种以上的可能的原料。
:逆向合成份析中切断或FGI进程的符号。
合成子(synthon):通过切断而产生的一种概念性的分子碎片,一样为正离子或负离子,也可能是相应反映中的一个中间体。
试剂(Reagent):实际利用的代表合成子的化合物。
例如CH3CH2MgBr是合成子CH3CH2-的试剂。
下面介绍几种逆向合成份析策略。
切断的选择方式关于一个有机分子,专门是较为复杂的有机分子,可切断的键不只一个,因此切断的技术很重要。
在逆向合成份析中,将分子切断成简单易患的原料为佳。
为此,可采纳以下叁种方式:(1)在接近分子的中央处进行切断,使其断裂成合理的两部份,这两部份一样为比较易患的原料或较易合成的中间产物,而不是从端部切断一或二个碳原子。
例如:O+试剂为BrMg试剂为O合成:CH3CH CH2NBSBrCH2CH CH2MgBrMgCH2CH CH2CH23OCuI 2CH2CHCH2CH2CH2COCH3(2)在支化点处进行切断。
如此更有可能切断为直链碎片,而这些直链碎片更有可能是易患的化合物。
例如:O+BrMg合成:CH 3CH 2CH 2CH 2Br CH 3CH 2CH 2CH 2MgBrCH 3CCH 32CH 3CCH 2CH 2CH 2CH 3OOHCH 31)一个环和一条链之间的连接处常常是个支化点,一般是切断处。
例如:O +BrMg合成:CH 3CH CH 2NBSMgBrMgCH 2CH CH 2, CuIH 2OOOCH 2CH CH 21)2)(3)利用目标分子的对称性进行切断,使之切断为简单易患的原料。
例如,对称炔烃可用此法切断。
Br+NaC CNa合成:HCNaNH 2NaCCNaCH 3CH 2CH 2CH 2BrCH 3CH 2CH 2CH 2C CCH 2CH 2CH 2CH 3具有对称性的醇也可用此法切断。
例如:CH 3CO 2Et +MgBrMgBr+O合成:CH 3CHCH 3Br Mg,Et 2O OCH 3CHCH 2CH 2OH CH 3PBr 3CH 3CHCH 2CH 2Br CH 3Mg,Et 2O32CH 3CHCH 2CH 2CCH 2CH 2CHCH 3CH 3CH 3OHCH 31)1)2)环状对称醚可切断为对称二醇,对称二醇可切断为对称酯。
例如:PhMgBrEtO 2CCO 2Et +合成:Br2 FeBr3BrMgMgBrEtO2CCH2CH2CO2EtH2OHPhPhPhPhOH HOPhPhPhPh O1)芳环上取代基切断顺序要合成多取代芳环化合物,必需考虑各取代基的定位作用、立体效应及对芳环的电子效应。
在逆向合成份析时,要注意以下几点:1法切断是错误的,而按a法是正确的。
其合成方式为:CH3CHCH3Br AlCl3CH(CH3)2CH3COClAlClCH(CH3)2COCH3+2、在定位规那么许可下,最先切断最具吸电子性基团(即那个基团最后引入)。
因为吸电子基团钝化芳环,无益于亲电取代反映。
例如:23O23OCH3Cl+合成:CH3OH(CH3)3CCl HNO3CH3OCH3CH3OCH3NO2C(CH3)3O2NC(CH3)3333、在合成中进行一些官能团的转化,可能会改变基团的定位效应,因此另一个取代基应在FGI前或以后导入。
官能团转化前官能团转化后邻、对位定位基-CH3间位定位基-CO2H邻、对位定位基-CH3间位定位基-CCl3/-CF3间位定位基-NO2邻、对位定位基-NH2邻、对位定位基-NH2间位定位基-NH3+HSO4-例如:CH 3对氯苯甲酸中 -Cl 与 -CO 2H 为对位关系,而-CH 3是邻对位定位基,-CO 2H 是间位定位基,因此,甲苯先氯化取得对氯甲苯,后氧化对氯甲苯取得对氯苯甲酸。
合成:CH 3Cl 2FeCl 3KMnO 4,HCH 3ClCO 2HCl2CO 2HCH 3间硝基苯甲酸中-NO 2 与 -CO 2H 为间位关系,故甲苯先氧化,后硝化。
合成:CH 3KMnO 4,HCO 2H HNO 3H 2SO 4CO 2HNO 24、许多基团,专门是一样方式难导入的基团(如-CN ,-F ,-I 等)可通过重氮盐导入。
例如:CO HCNCl NH 2FGI目标分子2-位 -Cl 与4-位苯基(邻对位定位基)为间位关系,与 -COOH (间位定位基)为邻位关系。
因此,需要在-Cl 导入之前引入4-位苯基,-COOH 由比苯环定位能力更强的邻对位定位基替代,那么可将-Cl 导入正确位置上。
假设 -NH 2代替-COOH ,待-Cl 导入后,-NH 2重氮化后导入 -CN ,后者水解为 -COOH ,如此可顺利合成目标化合物。
NH 2Cl3NaNO 2,HCl CNClCO 2HClH 3O1)5、有些合成中,可在芳环上引入 -NO 2(或-NH 2),在 -NO 2(或-NH 2)定位作用下或占据某一名置后,导入其它基团,然后通过重氮盐将-NO 2(或-NH 2)除去。
例如:OH H 2NCO 2HOH O 2NCO 2H O 22H H 2OHCO 2HH 2N2HO 2OH CO 2H目标化合物不可能由水杨酸硝化还原取得,但通过一个 -NH 2的定位作用,然后通过重氮化反映将此氨基除去可取得目标化合物。
OH CO 2HHNO 3OH 2HO 2NFe,HCl (CH CO)OCH 3CONHOHCO 2HOH O 2N CO 2HH 2NNaNO 2,HCl EtOH,△OHO 2NCO 2HOH O 2N2HFe,HCl68%68%1)2)2)1)6、找出难导入的取代基(如 -OH ,-OR 等),不切断这些基团,而是利用含有这些基的起始原料。
例如:OHOCH 3OH CO 2HNH 2CO 2HO OO 苯酚苯甲醚水杨酸邻氨基苯甲酸苯酐3邻,间,对甲苯酚联苯邻,间,对苯二酚切断实例R'MgX ( )R'Li +R''X (R''OTs)R'CH CHCH R'CH CHCH 2X +R''MgX ( )R''LiR'2R'2C O Ph 3P CHR''+R'CH CHR''R'X R''X NaC CNa++CH RX +NaCCHCH2OHCH CNa OC +R RHC 2CHR OHCHCNa +H 2COCHRC R''R'OHR'''MgX +R'COR''OH R'MgX R''CO 2Et+2CHR''OHR'MgX +H 2O2CR''OR'XCH 3CR''O+2CH 2CR''OR'2CuLi +CH 2CHCR''OO R'2Cd+R''COCl2CCH 3ORXCH 3CCH 2CO 2Et+OR'CCH 2O R'CCH 3OOH +O CR''2R'CCH 2CH 2CR''O OR'CCH 3O+CH 2CHCR''OR'CH CHCR''O2CR''O OH CH 3CR''O R'CHO +2CO 2H RX CH 2(CO 2Et)2+2HRXR'R''2EtR'CR''OEtO 2CCH 2CO 2Et+以上介绍了一些逆向合成份析方式,但一样有机化合物的合成要复杂得多。
