最新版gmp规范
质量控制实验室gmp指南(2023版)

质量控制实验室gmp指南(2023版) 下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by the editor. I hope that after you download them, they can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, our shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!质量控制实验室是药品生产过程中至关重要的环节,质量控制实验室GMP指南(2023版)为规范实验室管理和操作提供了重要参考。
新版gmp检查标准

新版gmp检查标准随着医药行业的不断发展,对药品质量和生产管理的要求也越来越高。
为了规范药品生产企业的生产管理,保障药品的质量安全,各国纷纷制定了一系列的GMP(Good Manufacturing Practice)生产管理规范。
其中,新版gmp检查标准更是对药品生产企业提出了更高的要求。
首先,新版gmp检查标准对生产设施和设备提出了更加严格的要求。
生产设施和设备是药品生产的基础,直接关系到药品的质量和安全。
新版gmp检查标准要求企业必须拥有先进的生产设施和设备,并且要进行定期的维护和检修,确保其正常运转和生产过程的稳定性。
其次,新版gmp检查标准对生产过程中的人员管理提出了更为严格的要求。
药品生产过程中的操作人员是直接参与药品生产的重要环节,其素质和管理水平直接关系到药品的质量和安全。
新版gmp检查标准要求企业必须对生产人员进行全面的培训和考核,确保其具备良好的职业素养和操作技能,同时要求企业建立健全的人员管理制度,确保生产过程中的人员行为符合规范要求。
此外,新版gmp检查标准对原材料的采购和管理提出了更加严格的要求。
原材料是药品生产的基础,其质量直接关系到药品的最终质量。
新版gmp检查标准要求企业必须建立完善的原材料采购管理制度,对原材料的供应商进行全面的评估和审核,确保其具备良好的质量管理体系和供货能力,同时要求企业对进货的原材料进行全面的检验和记录,确保其符合规范要求。
最后,新版gmp检查标准对药品生产过程中的质量控制和记录管理提出了更为严格的要求。
质量控制和记录管理是药品生产的关键环节,直接关系到药品的质量和安全。
新版gmp检查标准要求企业必须建立完善的质量控制体系和记录管理制度,对生产过程中的各个环节进行全面的监控和记录,确保药品的生产过程符合规范要求,同时要求企业对生产过程中的关键环节进行全面的验证和验证,确保其稳定可靠。
综上所述,新版gmp检查标准对药品生产企业提出了更加严格的要求,要求企业在生产设施和设备、人员管理、原材料管理、质量控制和记录管理等方面都要符合规范要求,以确保药品的质量和安全。
新版GMP中要求的操作规程

新版GMP中要求的操作规程新版GMP(Good Manufacturing Practice)的操作规程要求作为一种质量管理体系,为制药企业设立了一套操作规范,以确保产品的质量和安全。
以下是新版GMP中要求的操作规程的一些重要方面:1.质量保证体系:新版GMP要求制药企业建立一套完整的质量保证体系,包括质量管理体系、质量控制体系和质量评估体系。
这些体系需要详细规定各种质量保证活动的操作规程。
2.设备管理规程:新版GMP要求制药企业建立适当的设备管理规程,确保设备的科学运行和维护。
规程需要包括设备的选择、采购、安装和维护等方面的要求,同时需要确保设备的清洁和消毒以及记录和报告设备故障或异常情况。
3.原材料管理规程:新版GMP对制药原材料的管理要求更加严格。
操作规程需要包括原材料的验收、储存、保护、使用和出库等方面的要求,同时需要建立符合质量标准的原材料的供应商评估和审核机制。
4.生产流程规程:新版GMP要求制药企业建立详细的生产流程规程,确保各个生产环节的合规性和产品质量的稳定性。
规程需要包括生产工艺、操作步骤、环境要求和记录和报告要求等方面的内容。
5.检验和分析规程:新版GMP要求制药企业建立有效的检验和分析规程,确保产品的质量控制。
规程需要包括检验和分析的方法和程序、仪器设备的校准和验证、操作人员的培训和记录和报告的要求。
6.记录和报告规程:新版GMP要求制药企业建立完整的记录和报告规程,确保质量活动的可追溯性和透明性。
规程需要包括记录和报告的要求、记录的保存和归档、记录的查阅和审核等方面的内容。
7.员工培训和管理规程:新版GMP要求制药企业建立合适的员工培训和管理规程,确保员工具备必要的知识和技能,以提高生产质量。
规程需要包括培训计划和培训课程、培训记录和考核、员工绩效评估和任务分配等方面的内容。
8.不良事件和投诉管理规程:新版GMP要求制药企业建立有效的不良事件和投诉管理规程,及时采取措施纠正不良事件并预防再次发生。
最新版GMP(药品生产质量管理规范)

第一章总则第一条为规范药品生产质量管理,根据《中华人民共和国药品管理法》和《中华人民共和国药品管理法实施条例》的规定,制定本规范。
第二条企业应建立药品质量管理体系。
该体系包括影响药品质量的所有因素,是确保药品质量符合预定用途所需的有组织、有计划的全部活动总和。
第三条本规范作为质量管理体系的一部分,是药品生产管理和质量控制的基本要求,以确保持续稳定地生产出适用于预定用途、符合注册批准或规定要求和质量标准的药品,并最大限度减少药品生产过程中污染、交叉污染以及混淆、差错的风险。
第四条本规范为药品生产质量管理的基本要求。
附录为药品生产质量管理的特殊要求,适用于相关的药品或生产质量管理活动,可根据情况适时修订。
第五条本规范不包括有关环境保护、劳动安全等管理要求。
第六条企业应诚实守信地遵守本规范。
第七条企业可以采用经过验证的替代方法,达到本规范的要求。
第二章质量管理第一节原则第八条企业应建立并实施符合质量管理体系要求的质量目标,将药品注册中有关安全、有效和质量可控的所有要求,系统地贯彻到药品生产、控制及产品放行、发运的全过程中,确保所生产的药品适用于预定的用途,符合注册批准或规定要求和质量标准。
第九条企业高层管理人员应确保实现既定的质量目标,各部门不同层次的人员以及供应商、经销商应共同参与并承担各自的责任。
第十条企业应配备足够的、符合要求的人员、厂房、设施和设备,为实现质量目标提供必要的条件。
第二节质量保证第十一条质量保证是质量管理体系的一部分。
企业必须建立质量保证系统,应以完整的文件形式明确规定,并监控其有效性。
第十二条质量保证应确保符合下列要求:1.药品的设计与研发应考虑本规范的要求;2.明确规定生产管理和质量控制活动,保证本规范的实施;3.明确管理职责;4.保证生产以及采购和使用的原辅料和包装材料正确无误;5.确保中间产品所需的控制以及其它中间控制得到实施;6.确保验证的实施;7.严格按各种书面规程进行生产、检查、检验和复核;8.只有经质量受权人批准,每批产品符合注册批准以及药品生产、控制和放行的其它法规要求后,方可发运销售。
新版gmp指南解读

新版gmp指南解读
【原创版】
目录
1.新版 GMP 指南的概述
2.新版 GMP 指南的主要内容
3.新版 GMP 指南的实施及影响
正文
一、新版 GMP 指南的概述
新版 GMP 指南,全称为《药品生产质量管理规范》,是我国药品生产领域的一项重要法规。
GMP 指南旨在规范药品生产过程中的质量管理,确保生产出的药品安全、有效、质量可控。
新版 GMP 指南在原版的基础上进行了全面修订,对于药品生产企业具有重要的指导意义。
二、新版 GMP 指南的主要内容
1.强化了药品生产企业的质量管理体系,明确企业应建立完善的质量管理体系,并确保其在整个生产过程中的有效运行。
2.增加了药品生产企业的风险管理要求,要求企业对生产过程中的风险进行全面评估,并采取有效的控制措施。
3.对药品生产企业的生产设施和设备提出了更高的要求,要求企业确保其生产设施和设备符合生产要求,并能够持续稳定地运行。
4.提高了药品生产企业的人员素质要求,要求企业对从事药品生产的人员进行培训,确保他们具备必要的专业知识和技能。
三、新版 GMP 指南的实施及影响
新版 GMP 指南的实施,对于提高我国药品生产企业的质量管理水平,保障药品的安全、有效、质量可控具有重要的推动作用。
新GMP标准规范-中药制剂

新GMP标准规范-中药制剂新GMP 标准规范-中药制剂第一章第一章范围范围第一条第一条本附录适用于中药材前处理、中药提取和中药制剂的生产、质量控制、储存和运输。
第二章第二章原则原则第二条第二条中药制剂的质量与中药材的质量、中药材前处理和中药提取工艺密切相关,应对中药材的质量以及中药材前处理、中药提取工艺严格控制,防止在中药材前处理、中药提取和储存过程中的微生物污染和变质。
第三条第三条厂房应根据生产工艺要求采取密闭、通风、排风、除尘、除湿、空气净化等措施。
第四条第四条中药材来源应相对稳定。
中药注射剂生产所用中药材的产地应与注册申报资料中的产地一致,并符合中药材GAP 要求。
第五条第五条中药制剂质量标准在法定标准的基础上可适当增加新的检验项目,以确保产品质量的控制。
第三章第三章机构与人员机构与人员第六条企业的质量管理部门应有专人负责中药材的质第六条量管理。
第七条专职负责中药材质量管理的人员应至少具备以第七条下条件:1)具有中药学、生药学或相关专业大专以上学历,并至少有三年从事中药生产、质量管理的实际工作经验,或专职从事中药材鉴别工作八年以上的实际工作经验;2)具备鉴别中药材真伪优劣的能力;3)具备中药材质量控制的实际能力;4)根据所生产品种的需要,熟悉相关毒性中药材的管理与处理要求。
八条专职负责中药材质量管理的人员主要从事以下第八条工作:1)中药材的取样;2)中药材的鉴别、质量评价,提出中药材是否放行的意见; 3)培训中药材处理操作人员,包括毒性中药材处理操作人员;4)中药材标本的收集、制作和管理;5)监督投料。
第四章第四章厂房设施厂房设施第九条第九条中药材的取样、筛选、称重、粉碎、混合等易产生粉尘的操作,应采取有效措施以控制粉尘扩散,避免污染和交叉污染,如安装捕尘设备、排风设施或设置专用厂房(操作间)等。
第十条第十条中药材前处理的厂房内应设拣选工作台,工作台表面应平整、易清洁,不产生脱落物。
第十一条第十一条中药材的提取、浓缩等厂房应与其生产工艺要求相适应,有良好的排风、水蒸汽控制及防止污染和交叉污染等设施。
新版GMP中要求的操作规程

新版GMP中要求的操作规程一、应当制定操作规程确保质量受权人独立履行职责,不受企业负责人和其他人员的干扰。
(第20条) 质量受权人独立履行职责SOP 二、企业应当建立人员卫生操作规程,包括与健康、卫生习惯及人员着装相关的内容;应当采取措施,避免体表有伤口、患有传染病或其他可能污染药品疾病的人员从事直接接触药品的生产。
(第29、30、32条)人员卫生SOP三、应当对厂房进行适当维修,并确保维修活动不影响药品的质量。
应当按照详细的书面操作规程对厂房进行清洁或必要的消毒。
(第41条)厂房清洁及消毒SOP四、应建立设备使用、清洁、维护和维修的操作规程,并保存相应的操作记录。
(第72条)设备使用、清洁、维护和维修的SOP 五、生产用模具的采购、验收、保管、维护、发放及报废应当制定相应操作规程,设专人专柜保管,并有相应记录。
(第78条)生产用模具的采购、验收、保管、维护、发放及报废SOP六、应当制定设备的预防性维护计划和操作规程,设备的维护和维修应当有对应的记录。
(第80条)其中设备编码很重要,可看出在哪个房间的哪个设备,工艺规程、批生产记录中都应体现。
设备的预防性维护计划和SOP七、主要生产和检验设备都应当有操作规程、生产设备还要有清洁规程。
(第82条、84条)用于生产或检验的设备和仪器,应当有使用日志,内容包括使用、清洁、维护和维修情况以及日期、时间、所生产及检验的药品名称、规格和批号。
(第86条)主要生产和检验设备SOP/使用日志、生产设备清洁SOP八、应当按照操作规程和校准计划定期对生产和检验用衡器、量具、仪表、记录和控制设备以及仪器进行校准和检查,并保存记录。
(第90条)衡器、量具、仪表、记录和控制设备以及仪器校准和检查的SOP九、应当按照操作规程对纯化水、注射用水管道进行清洗消毒,并有相关记录。
(第101条)纯化水、注射用水管道清洗消毒SOP 十、应当建立物料和产品的操作规程,确保物料和产品的正确接收、贮存、发放、使用和发运。
最新版GMP(药品生产质量管理规范)下载

第一章总则第一条为规范药品生产质量管理,根据《中华人民共和国药品管理法》和《中华人民共和国药品管理法实施条例》的规定,制定本规范。
第二条企业应建立药品质量管理体系。
该体系包括影响药品质量的所有因素,是确保药品质量符合预定用途所需的有组织、有计划的全部活动总和。
第三条本规范作为质量管理体系的一部分,是药品生产管理和质量控制的基本要求,以确保持续稳定地生产出适用于预定用途、符合注册批准或规定要求和质量标准的药品,并最大限度减少药品生产过程中污染、交叉污染以及混淆、差错的风险。
第四条本规范为药品生产质量管理的基本要求。
附录为药品生产质量管理的特殊要求,适用于相关的药品或生产质量管理活动,可根据情况适时修订。
第五条本规范不包括有关环境保护、劳动安全等管理要求。
第六条企业应诚实守信地遵守本规范。
第七条企业可以采用经过验证的替代方法,达到本规范的要求。
第二章质量管理第一节原则第八条企业应建立并实施符合质量管理体系要求的质量目标,将药品注册中有关安全、有效和质量可控的所有要求,系统地贯彻到药品生产、控制及产品放行、发运的全过程中,确保所生产的药品适用于预定的用途,符合注册批准或规定要求和质量标准。
第九条企业高层管理人员应确保实现既定的质量目标,各部门不同层次的人员以及供应商、经销商应共同参与并承担各自的责任。
第十条企业应配备足够的、符合要求的人员、厂房、设施和设备,为实现质量目标提供必要的条件。
第二节质量保证第十一条质量保证是质量管理体系的一部分。
企业必须建立质量保证系统,应以完整的文件形式明确规定,并监控其有效性。
第十二条质量保证应确保符合下列要求:1. 药品的设计与研发应考虑本规范的要求;2. 明确规定生产管理和质量控制活动,保证本规范的实施;3. 明确管理职责;4. 保证生产以及采购和使用的原辅料和包装材料正确无误;5. 确保中间产品所需的控制以及其它中间控制得到实施;6. 确保验证的实施;7. 严格按各种书面规程进行生产、检查、检验和复核;8. 只有经质量受权人批准,每批产品符合注册批准以及药品生产、控制和放行的其它法规要求后,方可发运销售。
药品生产质量管理规范(2021年修订)》GMP

药品生产质量管理规范(2021年修订)》GMP药品生产质量管理规范(2021年修订)》是根据《中华人民共和国药品管理法》和《中华人民共和国药品管理法实施条例》制定的,旨在规范药品生产质量管理。
企业应当建立药品质量管理体系,覆盖所有影响药品质量的因素,并确保所有活动有组织、有计划。
本规范是质量管理体系的一部分,旨在降低药品生产过程中的污染、交叉污染、混淆和差错等风险,确保持续稳定地生产出符合预定用途和注册要求的药品。
企业应当严格执行本规范,坚持诚实守信,禁止任何虚假、欺骗行为。
企业应当建立符合药品质量管理要求的质量目标,并将药品注册的有关安全、有效和质量可控的所有要求系统地贯彻到药品生产、控制及产品放行、贮存、发运的全过程中,确保所生产的药品符合预定用途和注册要求。
企业高层管理人员应当确保实现既定的质量目标,不同层次的人员以及供应商、经销商应当共同参与并承担各自的责任。
企业应当配备足够的、符合要求的人员、厂房、设施和设备,为实现质量目标提供必要的条件。
质量保证是质量管理体系的一部分。
企业必须建立质量保证系统,同时建立完整的文件体系,以保证系统有效运行。
质量保证系统应当确保药品的设计与研发体现本规范的要求,生产管理和质量控制活动符合本规范的要求,管理职责明确,采购和使用的原辅料和包装材料正确无误,中间产品得到有效控制,确认、验证的实施,严格按照规程进行生产、检查、检验和复核,每批产品经质量受权人批准后方可放行,在贮存、发运和随后的各种操作过程中有保证药品质量的适当措施,并按照自检操作规程,定期检查评估质量保证系统的有效性和适用性。
总之,药品生产质量管理的基本要求是建立质量管理体系,确保药品质量符合预定用途和注册要求。
企业应当严格执行本规范,建立质量保证系统,配备足够的、符合要求的人员、厂房、设施和设备,为实现质量目标提供必要的条件。
同时,不同层次的人员以及供应商、经销商应当共同参与并承担各自的责任,确保质量保证系统有效运行。
中国新版gmp标准

中国新版gmp标准中国新版GMP标准。
中国新版GMP标准(Good Manufacturing Practice,良好生产规范)是指在药品生产过程中,制定并实施的一系列规范和标准,旨在确保药品的质量、安全和有效性。
新版GMP标准的出台,对于提升中国药品生产质量,加强监管,保障患者用药安全具有重要意义。
首先,新版GMP标准对药品生产企业的要求更加严格。
标准明确了生产车间的设计要求、设备的选用和维护、生产工艺的控制等方面的要求,要求企业建立健全的质量管理体系,确保生产过程的每一个环节都符合标准要求。
这将有效提高药品生产的质量和可靠性,为患者提供更加安全有效的药品。
其次,新版GMP标准对药品监管部门的监督要求更加严格。
标准明确了监管部门对药品生产企业的审批、检查和监督管理的要求,要求监管部门加强对企业的监督检查力度,确保企业严格按照标准生产,对违规企业采取严厉的处罚措施,有效遏制药品生产中存在的违法违规行为,保障患者用药安全。
再次,新版GMP标准对药品生产技术的要求更加严格。
标准要求企业采用先进的生产技术和设备,加强生产工艺的控制和管理,确保药品生产过程中的每一个环节都符合最新的技术标准,提高药品的质量和稳定性,降低药品生产过程中的风险和安全隐患。
最后,新版GMP标准对药品生产企业的自我管理要求更加严格。
标准要求企业建立健全的质量管理体系和风险管理体系,加强对生产过程的自我监督和自我管理,确保企业能够自觉遵守标准要求,提高企业的自律性和责任感,保障药品生产的质量和安全。
总之,中国新版GMP标准的出台,将对提升中国药品生产质量,加强监管,保障患者用药安全产生积极的影响。
各药品生产企业应当严格按照新版GMP标准要求,加强自我管理,不断提高生产质量和管理水平,为患者提供更加安全有效的药品。
监管部门也应当加强对企业的监督检查,确保企业严格遵守标准要求,对违规企业采取严厉的处罚措施,有效维护患者用药安全。
相信在新版GMP标准的指导下,中国药品生产质量将迎来新的提升,患者用药安全得到更好的保障。
《药品生产质量管理规范实施指南》最新版本

《药品生产质量管理规范实施指南》最新版本下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!《药品生产质量管理规范实施指南》最新版解析随着医药行业的不断发展和进步,药品生产质量管理规范(Good Manufacturing Practice,简称GMP)的重要性日益凸显。
最新新版GMP及附录完整版

《药品生产质量管理规范(2010年修订)》1发布232011年02月12日发布456历经5年修订、两次公开征求意见的《药品生产质7量管理规范(2010年修订)》(以下简称新版药品GMP)今8天对外发布,将于2011年3月1日起施行。
9《药品生产质量管理规范》(以下简称药品GMP)是药10品生产和质量管理的基本准则。
我国自1988年第一次颁布11药品GMP至今已有20多年,其间经历1992年和1998年两12次修订,截至2004年6月30日,实现了所有原料药和制13剂均在符合药品GMP的条件下生产的目标。
新版药品GMP14共14章、313条,相对于1998年修订的药品GMP,篇幅大15量增加。
新版药品GMP吸收国际先进经验,结合我国国情,16按照“软件硬件并重”的原则,贯彻质量风险管理和药品17生产全过程管理的理念,更加注重科学性,强调指导性和18可操作性,达到了与世界卫生组织药品GMP的一致性。
19药品GMP的修订是药监部门贯彻落实科学发展观和医疗卫生体制改革要求,进一步关注民生、全力保障公众2021用药安全的又一重大举措,它的实施将进一步有利于从源22头上把好药品质量安全关。
1998年修订的药品GMP的实施,23在提升我国药品质量、确保公众用药安全方面发挥了重要24的作用,取得了良好的社会效益和经济效益。
随着经济的25发展和社会的进步,世界卫生组织及欧美等国家和地区药26品GMP的技术标准得到很大的提升,新的理念和要求不断27更新和涌现,我国现行药品GMP需要与时俱进,以适应国28际药品GMP发展趋势,也是药品安全自身的要求。
29我国现有药品生产企业在整体上呈现多、小、散、低的格局,生产集中度较低,自主创新能力不足。
实施新3031版药品GMP,是顺应国家战略性新兴产业发展和转变经济发32展方式的要求。
有利于促进医药行业资源向优势企业集中,33淘汰落后生产力;有利于调整医药经济结构,以促进产业34升级;有利于培育具有国际竞争力的企业,加快医药产品35进入国际市场。
最新版GMP(药品生产质量管理规范)

第一章总则第一条为规范药品生产质量管理,根据《中华人民共和国药品管理法》和《中华人民共和国药品管理法实施条例》的规定,制定本规范。
第二条企业应建立药品质量管理体系。
该体系包括影响药品质量的所有因素,是确保药品质量符合预定用途所需的有组织、有计划的全部活动总和。
第三条本规范作为质量管理体系的一部分,是药品生产管理和质量控制的基本要求,以确保持续稳定地生产出适用于预定用途、符合注册批准或规定要求和质量标准的药品,并最大限度减少药品生产过程中污染、交叉污染以及混淆、差错的风险。
第四条本规范为药品生产质量管理的基本要求。
附录为药品生产质量管理的特殊要求,适用于相关的药品或生产质量管理活动,可根据情况适时修订。
第五条本规范不包括有关环境保护、劳动安全等管理要求。
第六条企业应诚实守信地遵守本规范。
第七条企业可以采用经过验证的替代方法,达到本规范的要求。
第二章质量管理第一节原则第八条企业应建立并实施符合质量管理体系要求的质量目标,将药品注册中有关安全、有效和质量可控的所有要求,系统地贯彻到药品生产、控制及产品放行、发运的全过程中,确保所生产的药品适用于预定的用途,符合注册批准或规定要求和质量标准。
第九条企业高层管理人员应确保实现既定的质量目标,各部门不同层次的人员以及供应商、经销商应共同参与并承担各自的责任。
第十条企业应配备足够的、符合要求的人员、厂房、设施和设备,为实现质量目标提供必要的条件。
第二节质量保证第十一条质量保证是质量管理体系的一部分。
企业必须建立质量保证系统,应以完整的文件形式明确规定,并监控其有效性。
第十二条质量保证应确保符合下列要求:1. 药品的设计与研发应考虑本规范的要求;2. 明确规定生产管理和质量控制活动,保证本规范的实施;3. 明确管理职责;4. 保证生产以及采购和使用的原辅料和包装材料正确无误;5. 确保中间产品所需的控制以及其它中间控制得到实施;6. 确保验证的实施;7. 严格按各种书面规程进行生产、检查、检验和复核;8. 只有经质量受权人批准,每批产品符合注册批准以及药品生产、控制和放行的其它法规要求后,方可发运销售。
最新版GMP(药品生产质量管理规范)下载

Electricity lines, equipment inspections, found hidden in time for rectification, maintenance, and security. 9, do not use an open flame in the classroom, prohibit burning stove, lit candles, mosquito repellent, no smoking, and banning messy wiring. Without using any household appliances is not allowed. 10, live on campus faculty members, must lead by example, and educate families and children ready to fire. 11, household use of gas in schools, to master proper usage, pay attention to the leak-proof, explosion-proof, fireproof, closing valve after use to ensure security. 12, dining room must be qualified, and annual testing of pressure vessels, to regularly check, the canteen workers must be certified, strictly by operation operation, gas tank and stove safety distance of 1.5 meters, to prevent accidents. 13, the adverse consequences caused by ignoring fire safety regulations, will be punished, until investigated for legal responsibility. Song Lin Xiang Liu Jia ping elementary school March 2016 Xiang Liu Jia ping elementary school, pine slopes surrounding safety management system 1 teachers and students, the surrounding area of the school governance covers personal and food hygiene, cultural events and other aspects, integrated governance shall obtain wide support and full cooperation of the community. On the surrounding environment in schools should be closely monitored. 2, school work at the same time, should pay attention to the safety management of school environment, should take the initiative to contact the district police station, the village Committee, Correctional Centre, Township government, business management and other departments to do a good job management. 3, teacher on duty with the exception of inspections in schools, should also pay attention to environmental inspections near the campus, found that the jobless migrants from rural areas, for example, harassment of students and a variety of accidents, according to different situations reported school officials or the police station in a timely manner, to protect the safety of students. 4, every day before school, teachers remind students, pay attention to traffic safety. 5, should educate students to respect social ethics, and various regulations, maintaining public order, and fight the bad guys, and grasp the correct ways and means of maintaining and improving students ' self-care ability. 6, the establishment of emergency rescue teams of teachers in schools, on high alert and deployed. Song Lin Xiang Liu Jia ping elementary school March 2016 song Lin Xiang Liu Jia ping primary school teachers and students organizations out of safety management system organization activities between teachers and students, to draw up a precise plan and security measures must be signed by the school officials to review the programme of activities agreed upon Correctional Center agreed to implement. Organization to the field relatively far or activities require approval by the Deputy Director of the Education Bureau in charge of security. 2, each activity should have a specific responsibility, pay attention to the persons age, physical match. Route 3, activities, location, field surveys should be carried out in advance. 4, activities for the means of transport should explain the situation to the school to comply with vehicle, safety requirements, before the line for repairs. 5, each activity must have security, emergency response plan for accidents. 6, picnics, hiking, picnic to pay attention to fire prevention, food poisoning, prevention of fall accidents 7, the activities near the rivers, reservoirs, no measures or do not meet the security requirements of the Organization and not let students into the water第一章 总则第一条 为规范药品生产质量管理,根据《中华人民共和国药品管理法》和《中华人民共和国药品管理法实施条例》的规定,制定本规范。
GMP-4-新版GMP药品生产质量管理规范及其认证管理

(1)药品生产洁净室(区)空气洁净度 洁净室区空气洁净度划分为4个级别,即 100级;10000级;100000级;300000级。空气 洁净级别不同的相邻房间之间静压差,应大于5 帕,洁净度要求高的房间对相邻的洁净度要求 低的房间呈相对正压 (2)洁净室区要求规定 进入洁净室区的空气必须净化。应定期消 毒,消毒剂品种应定期更换 。温度应控制在 18℃~26℃ ,相对湿度应控制在45%~65%。 安装的地漏、水池不得对药品产生污染;100级 洁净室区内不得设地漏。10000级洁净室区使用 的传输设备不得穿越较低级别区域
3.对工作服的规定 工作服选材、式样及穿戴方式应 与生产操作和洁净级别要求相适应,并 不得混用 无菌工作服必须包盖全部头发、 胡须及腰部,并能阻留人体脱落物 不同洁净级别使用的工作服应分 别清洗、整理,必要时消毒或灭菌。 100 000级以上区域的洁净工作服应在 洁净室区内洗涤、干燥、整理
(七)验证 证明任何程序、生产过程、设备、 物料、活动或系统确实能达到预期结果 的有文件证明的一系列活动 1.范围 药品生产验证;产品的生产工艺及 关键设施、设备验证;当影响产品质量 的主要因素发生改变,及生产一定周期 后,应进行再验证。 2.程序
物料应按规定使用期储存,无规定 使用期限的,其储存一般不超过3年,期 满后复验 4.药品的标签、说明书管理 标笺说明书的内容、式样、文字必 须与国家食品药品监督管理局批准的一致 标笺、说明书应有专人保管,按品种规格 专柜存放,凭批包装指令发放 标笺要计数发放。发放、使用、销 毁应有记录
(六)卫生 1.制定制度规程 药品生产企业应有防止污染的卫生措施, 制定各项卫生制度,并由专人负责。车间、工 序、岗位应制定清洁规程。药品生产人员应有 健康档案,直接接触药品的生产人员每年至少 体检一次 2.生产区卫生规定 生产区不得存放非生产物品及个人杂物。 生产中的废弃物应及时处理 更衣室、浴室厕所的设置不得对清洁室区 产生不良影响。清洁室区应定期消毒。
最新版GMP(药品生产质量管理规范)

第一章总则第一条为规范药品生产质量管理,根据《中华人民共和国药品管理法》和《中华人民共和国药品管理法实施条例》的规定,制定本规范。
第二条企业应建立药品质量管理体系。
该体系包括影响药品质量的所有因素,是确保药品质量符合预定用途所需的有组织、有计划的全部活动总和。
第三条本规范作为质量管理体系的一部分,是药品生产管理和质量控制的基本要求,以确保持续稳定地生产出适用于预定用途、符合注册批准或规定要求和质量标准的药品,并最大限度减少药品生产过程中污染、交叉污染以及混淆、差错的风险。
第四条本规范为药品生产质量管理的基本要求。
附录为药品生产质量管理的特殊要求,适用于相关的药品或生产质量管理活动,可根据情况适时修订。
第五条本规范不包括有关环境保护、劳动安全等管理要求。
第六条企业应诚实守信地遵守本规范。
第七条企业可以采用经过验证的替代方法,达到本规范的要求。
第二章质量管理第一节原则第八条企业应建立并实施符合质量管理体系要求的质量目标,将药品注册中有关安全、有效和质量可控的所有要求,系统地贯彻到药品生产、控制及产品放行、发运的全过程中,确保所生产的药品适用于预定的用途,符合注册批准或规定要求和质量标准。
第九条企业高层管理人员应确保实现既定的质量目标,各部门不同层次的人员以及供应商、经销商应共同参与并承担各自的责任。
第十条企业应配备足够的、符合要求的人员、厂房、设施和设备,为实现质量目标提供必要的条件。
第二节质量保证第十一条质量保证是质量管理体系的一部分。
企业必须建立质量保证系统,应以完整的文件形式明确规定,并监控其有效性。
第十二条质量保证应确保符合下列要求:1. 药品的设计与研发应考虑本规范的要求;2. 明确规定生产管理和质量控制活动,保证本规范的实施;3. 明确管理职责;4. 保证生产以及采购和使用的原辅料和包装材料正确无误;5. 确保中间产品所需的控制以及其它中间控制得到实施;6. 确保验证的实施;7. 严格按各种书面规程进行生产、检查、检验和复核;8. 只有经质量受权人批准,每批产品符合注册批准以及药品生产、控制和放行的其它法规要求后,方可发运销售。
GMP规范新版2020版与2002版区别
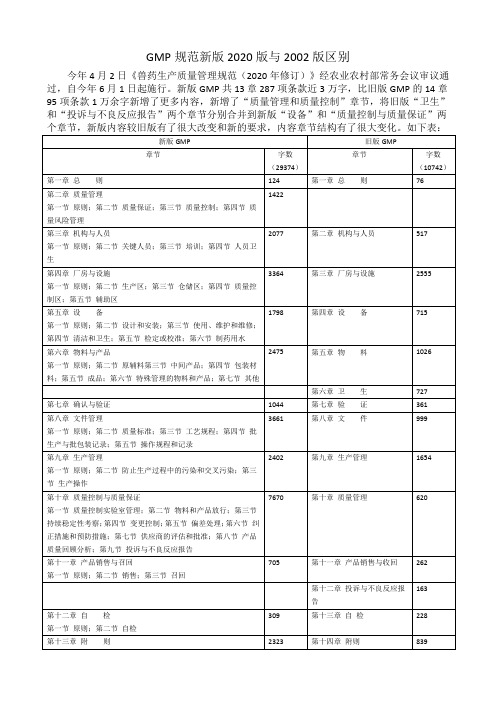
GMP规范新版2020版与2002版区别今年4月2日《兽药生产质量管理规范(2020年修订)》经农业农村部常务会议审议通过,自今年6月1日起施行。
新版GMP共13章287项条款近3万字,比旧版GMP的14章95项条款1万余字新增了更多内容,新增了“质量管理和质量控制”章节,将旧版“卫生”和“投诉与不良反应报告”两个章节分别合并到新版“设备”和“质量控制与质量保证”两从表中可以看出,国家对于兽药的监管更注重于质量的管控,从字数内容来看质量管控占据了整篇规范的三分之一,管控内容增加,指导性也更详细,新增的第十章质量控制和质量保证内容是一大特色和亮点,参照了国际GMP和人药GMP的新进的管理方式和理念,结合国内药企的经营和旧版的GMP执行情况,制定了相应标准。
新版GMP对于兽药的管控范围也较旧版有了很大改变,对产品整个生命周期的各个环节均有管控,第一产品研发要有前瞻性的评估;第二产品要有持续稳定性考察;第三产品要进行质量回顾分析;第四产品进入市场后有措施保证;第五全过程进行环节管控。
2002年农业部第11号令的第一版规范实行,到2020年农业农村部的第3号令,历经18年时间中国兽药生产管理从无到有、从粗到细、从国内到国际的发展阶段,这18年是一座桥梁,连接着过去和未来,过去的粗放式管理和生产模式,关注的只是产品的有效性,仅处于国内局限性的兽药市场和国内养殖现状及思维模式。
从有兽药GMP规范的18中,国内兽药发展更注重了规范生产,保障了畜禽和人民群众的健康。
中国的兽药伴随中国国家快速发展的浪潮,也搭载着国家发展、开放、包容、共荣的巨轮向远方的梦想前行。
发展的浪潮起伏向前,一刻不停,药品安全、生物安全、食品安全时时刻刻在影响着畜禽健康和百姓的健康,人们和社会物质和精神文明的进步,对于安全和健康有了更大的需求。
兽药从最根本上影响着的肉蛋奶安全,影响着百姓“菜篮子”的绿色和安全。
18年中生物安全、食品安全事件也促使行业者和人们去思考、去寻找更规范的产品质量管控方法。
gmp标准物质管理指南最新版本

gmp标准物质管理指南最新版本下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!GMP标准物质管理指南最新版解析全球药品生产质量管理规范(Good Manufacturing Practice,简称GMP)是药品生产和质量管理的基本准则,其中对于标准物质的管理是至关重要的环节。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
最新版gmp规范
最新版GMP规范
GMP(Good Manufacturing Practice)是“良好生产规范”的缩写,是制药行业中的质量管理体系。
GMP规范以药品的安全性、有效
性为中心,要求制药企业在药品生产、质量控制、人员培训、设备
和环境条件等各方面都要遵守规范。
最新版GMP规范于2019年8月1日正式实施,更新了之前版
本的规定,以更好地适应发展变化和药品安全保障的需要。
该规范分为十章,主要包括以下内容:
1. 总则:提出GMP规范的基本要求和适用范围。
2. 质量管理体系:要求企业建立科学的质量管理体系,并进行
有效运用和持续改进。
3. 人员:要求企业建立合理的人员结构和培训计划,确保人员
能够胜任本职工作。
4. 原料药和辅料:要求企业对原料药和辅料进行全面管理,建
立标准化管理体系。
5. 制剂:要求企业建立切实可行的制剂质量控制和检测方法,
确保制剂品质符合要求。
6. 生产设备:要求企业对生产设备进行管理和维护,确保生产
环节顺利进行。
7. 质量控制:要求企业建立合理的质量控制体系,对实施的产
品进行全面监督和检测。
8. 产品质量评价:要求对产品进行全面评价,确保产品符合要求。
9. 安全性评价:要求企业对产品的安全性进行评价,确保药品
对人体没有不良影响。
10.文档管理:要求企业建立全面的文档管理体系,以确保质量的可追溯性。
随着行业的发展和监管的不断加强,GMP规范也在不断演进,为保障药品的质量和安全发挥了重要作用。
