文件分发、回收记录表
ISO文件表格

xxxxx公司文件汇总表KRT /QR- 1编制: 日期:XXXXX公司文件分发、回收记录表KRT /QR- 2KRT /QR- 03编制: 审批: 日期:文件名称更改日期更改人XXXXX公司文件更改单文件编号生效日期更改章节号更后实施日期审核人批准人备注XXXXX公司文件补发申请单KRT /QR- 04文件销毁申请单KRT /QR- 05外来文件清单KRT /QR- 06制表: 日期:XXXXX公司质量记录清单KRT /QR - 08制表:审核:日期:质量记录一览表KRT /QR - 09质量记录查阅登记表KRT /QR -10审核:XXXXX公司评审时间评审内容:管理评审计划KRT/QR-11地点主持人记录人参加部门及人员评审资料准备要求:审核: 批准: 日期:评审时间主持人参加评审人员: 评审内容摘要:评审结论:纠正和预防措施:xxxxx公司管理评审报告KRT/QR-12记录人编制: 审核: 批准: 日期:KRT /QR- 13XXXXX公司签到表xxxxx公司年度培训计划KRT /QR- 14培训记录KRT /QR- 15岗位技能要求KRT/QR-16页共页xxxxx公司岗位技能考评表KRT/QR-17XXXXX公司设备保养记录KRT/QR-18XXXXX公司设备管理台帐KRT /QR- 19制表: 审核: 年月曰设备名称维修部位维修内容:备忘录:XXXXX公司设备检修记录编号维修时间维修人:产品部:KRT /QR- 20使用车间年月曰年月曰xxxxx公司设备加工能力确认表KRT /QR- 21设备维护保养计划KRT /QR- 22XXXXX公司合同评审表签名: 年月曰KRT /QR- 23合同要求:综合部评审意见:评审人/日期:XXXXX公司合同变更表KRT /QR- 24顾客信息处理报告KRT /QR- 25客户名称日 期联系人电话修改校对审批 年 月曰xxxxx 公司信息反馈内容:经办人: 年月曰综合部: 产品部: 营销部管理者代表:XXXXX公司设计开发方案KRT-QR-26依据的标准、法律法规及技术协议的主要内容:设计内容(包括产品主要功能、性能、技术指标、主要结构等)XXXXX公司设计开发计划KRT-QR-27xxxxx公司设计开发任务KRT-QR-28KRT -QR- 29依据的标准、法律法规及技术协议的主要内容:设计内容(包括产品主要功能、性能、技术指标、主要结构等)设计部门及项目负责人:备注:技术开发部主任签名: XXXXX 公司设计评审报告项目名称 型号规格 下达日期要求完成日期日期:提供评审的主要文件:评审总结意见:改进措施:XXXXX 公司设计验证记录产品名称规格型号评审组长负责人:年 月曰 评审人XXXXX公司顾客证实意见:年 月曰年 月曰年 月曰年 月曰米购部单位盖章:签名: 年 月曰 研发部产品部营销部签名:签名:签名:签名:设计开发确认表KRT -QR- 31产品检验结果:检验员:年 月曰产品名称 规格型号 出厂编号XXXXX公司设计更改申请单KRT -QR- 32 产品名称型号规格更改文件名称更改的理由:更改的内容:更改日期实施日期更改申请人审核批准年月曰XXXXX公司供方评审报告KRT /QR- 38企业名称联系人提供产品电话供方基本情况调查:报告人: 日期:职能部门评审意见综合部:负责人: 年月曰产品部:负责人: 年月曰XXXXX公司合格供方名单KRT /QR- 39编制/日期: 批准/日期:XXXXX公司采购计划表KRT /QR- 4014.15.审核目的16.17.XXXXX公司内部审核计划制单: 批准: 日期:xxxxx公司KRT /QR- 34内部审核检查表XXXXX 公司受审部门 审核员编制人 编制日期审核时间 审核组长 过程 检查内容检查记录KRT /QR- 35不合格事实描述不合格项报告部门负责人审核日期受审核部门 年 月曰不符合IS09001中不合格类型: 重口 轻微□ 条的要求;不符合 文件中 条的要求审核员 受审部门负责人 年 月曰不合格原因分析: 受审部门负责人年 月曰纠正/预防措施计划: 完成日期:年 月曰前完成负责人 年 月 日纠正/预防措施验证: 结论 再次验证 验证人审核员 I有效 □ 部分有效口 效果不明显口 无效 □需要口不需要□需要时验证时间:管理者代表内部审核报告KRT /QR- 36年度内部审核计戈【」KRT /QR- 37KRT /QR- 42XXXX)公司不合格品处理报告机型图号零件名称分类数量日期编号不合格品情况原因分析:责任部门:处理意见:责任部门:跟踪验证情况:检验员:年月日综合部车间采购员审批年月曰纠正/预防措施序号实施项目完成日期负责人验证人检验员: 年月曰纠正和预防措施处理报告KRT /QR- 43机型图号名称事由责任部门报告编号原因分析:责任部门:采取措施:完成时间负责人年月曰责任部门综合部批准年月曰实施效果验证:综合部:计量器具台帐KRT /QR- 44制表: 日期:KRT /QR- 45XXXX )公司顾客满意度调查表尊敬的客户:感谢使用XXXXX 公司生产的产品,为了更好地了解 您对公司产品和服务还有什么意见和建议特发放顾客丄_ 意调查表3请将您的意见和建议添在此表中。
质量体系认证用表格模板

序号:
编号:
任务来源 任务内容( 产品名称、 规格、 数量、 定货日期、 交货日期、 包装要求等) :
本任务单为常规产品, 请于
年 月 日前完成生产任务。
接受部门·日期 分管领导·日期
销售公司
年月日
42
设计编号:
资料内容仅供参考,如有不当或者侵权,请联系本人改正或者删除。
设计计划书
编号: 日期:
随机附件及数量:
随机文件:
设施安装调试情况:
验收依据:
27
验收结论:
资料内容仅供参考,如有不当或者侵权,请联系本人改正或者删除。
参加验收部门/人意见( 签名) :
28
资料内容仅供参考,如有不当或者侵权,请联系本人改正或者删除。
设施管理台帐
编号:
序号
设备名 称/型号
数量
生产厂家
购入日期
验收/使 用日期
《设计更改申请单》
《外来图审查记录》
主管部门
保存期限
备注
9
资料内容仅供参考,如有不当或者侵权,请联系本人改正或者删除。
序号: 文件名称 销毁原因:
归口部门意见:
管理者代表意见:
记录销毁申请
编号: 编号
版本 份数
申请人: 签 名:
日期: 日期:
签 名:
日期:
10
资料内容仅供参考,如有不当或者侵权,请联系本人改正或者删除。
文件名称
编号: 文件编号 发文部门 版本号 备注
6
资料内容仅供参考,如有不当或者侵权,请联系本人改正或者删除。
编写:
日期:
审批: 外来文件登记表
日期:
序号
分发 号
ISO9001质量记录清单样本
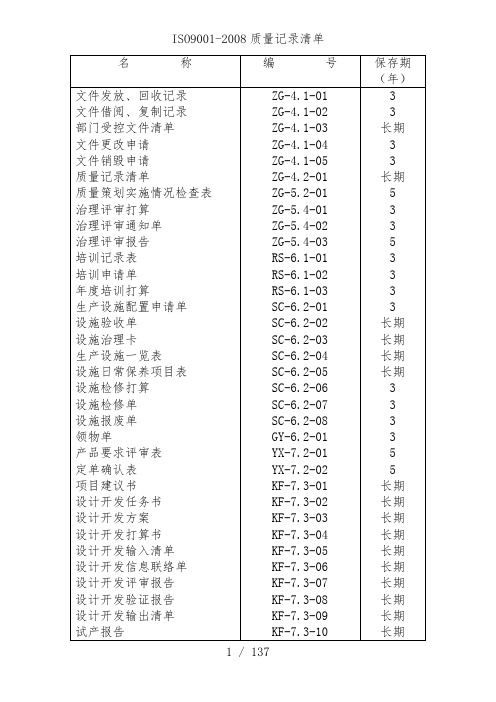
ISO9001-2008质量记录清单文件发放、回收记录编号:ZG-4.1-01文件借阅、复制记录编号:ZG-4.1-02部门受控文件清单部门:编号:ZG-4.1-03文件更改申请编号:ZG-4.1-04 序号:文件销毁申请编号:ZG-4.1-05 序号:质量记录清单编号:ZG-4.2-01质量策划实施情况检查表编号:ZG-5.2-01 序号:治理评审打算编号:ZG-5.4-01治理评审通知单编号:ZG-5.4-02 序号:治理评审报告编号:ZG-5.4-03 序号:培训记录表编号:RS-6.1-01 序号:培训申请单编号:RS-6.1-02年度培训打算编号:RS-6.1-03生产设施配置申请单编号:SC-6.2-01 序号:设施验收单编号:SC-6.2-02 序号:生产设施一览表编号:SC-6.2-04编制:日期:设施日常保养项目表编号:SC-6.2-05设施名称:设施编号:使用部门:保养人:月:异常情况记录备注注:保养后,用“V”表示日保,“”为周保、“”为月保,“X”表示有异常情况,应在“异常情况记录”栏予以记录。
设施检修打算编号:SC-6.2-06执行部门:序号:编制:日期:批准:日期:设施检修单编号:SC-6.2-07设施使用部门:序号:设施报废单编号:SC-6.2-08使用部门:序号:领物单编号:GY-6.2-01 序号:领物单编号:GY-6.2-01 序号:生产要求评审表编号:YX-7.2-01()初次评审()修订(原评审表号:)序号:定单确认表编号:YX-7.2-02 序号:项目建议书编号:KF-7.3-01 序号:(所列各项,可另加页叙述)设计开发任务书编号:KF-7.3-02 序号:总工程师签名:年月日设计开发方案编号:KF-7.3-03 序号:设计开发打算书编号:KF-7.3-04 序号:。
三类医疗器械质量管理记录系列表格

医疗器械质量管理记录1、文件修订申请表 (3)2、文件发放记录表 (4)3、文件回收记录表 (5)4、文件销毁申请表 (6)5、文件销毁记录表 (7)6、质量管理体系问题改进和措施跟踪记录 (8)7、医疗器械群体不良事件基本信息表 (9)8、医疗器械不良反应/事件报告表 (10)9、质量查询、投诉、服务记录 (11)10、质量事故调查、处理表 (12)11、医疗器械质量投诉处理记录 (13)12、质量事故处理跟踪记录 (14)13、员工健康档案表 (15)14、员工健康检查汇总表 (16)15、年度质量培训计划表 (17)16、培训签到表 (18)17、培训实施记录表 (19)18、员工个人培训教育档案 (20)19、设施设备台帐 (21)20、设施设备运行维护使用记录 (22)21、计量器具检定记录 (23)22、医疗器械养护质量情况分析季度报表 (24)23、医疗器械质量信息反馈表 (25)24、医疗器械质量信息传递处理单 (26)25、医疗器械召回记录 (27)26、医疗器械追回记录 (28)27、不合格医疗器械台帐 (29)28、不合格医疗器械报损审批表 (30)29、不合格医疗器械报损销毁审批表 (31)30、质量管理制度执行情况自查及整改记录表 (32)31、质量管理制度执行情况检查和考核记录表 (33)32、医疗器械采购记录 .......................................................................................................................................... .3433、医疗器械收货记录 (35)34、医疗器械验收记录 (33)35、医疗器械出库记录 (37)36、温湿度记录表 (33)37、计算机系统权限授权审批记录表 (33)38、车辆日常保养及卫生检查表 (40)39、月卫生检查记录表 (41)40、设施设备检修维护记录 (42)41、医疗器械质量监控检查记录 (33)42、医疗器械质量复查报告单 (33)43、医疗器械停售通知单 (33)44、医疗器械解除停售通知单 (33)45、医疗器械拒收通知单 (33)46、合格供货方档案表 (33)47、储存作业区来访人员登记表 (33)48、首营企业审批表 (50)49、首营品种审批表 (33)50、全体人员情况表 (33)51、供货企业质量体系评定表 (33)52、质量保证体系调查表 (33)53、医疗器械质量档案表 (33)54、医疗器械质量信息汇总表 (56)1、文件修订申请表编号:JYBN-QXJL-001-012、文件发放记录表编号:JYBN-QXJL-002-013、文件回收记录表4、文件销毁申请表5、文件销毁记录表编号:JYBN-QXJL-005-016、质量管理体系问题改进和措施跟踪记录编号:JYBN-QXJL-006-01编号:JYBN-QXJL-007-01报告日期:年月日编号:JYBN-QXJL-008-01首次报告□跟踪报告□报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□9、质量查询、投诉、售后服务记录编号:JYBN-QXJL-009-0110、质量事故调查、处理表11、医疗器械质量投诉处理记录编号:JYBN-QXJL-011-0112、质量事故处理跟踪记录编号:JYBN-QXJL-012-0113、员工健康档案表编号: JYBN-QXJL-013-01注:应将历次体检结果证明文件存入档案14、员工健康检查汇总表编号: JYBN-QXJL-014-01年度培训计划表编号:JYBN-QXJL-015-01质管部:行政部:审批人:培训签到表编号:JYBN-QXJL-016-0117、培训实施记录表编号:JYBN-QXJL-017-0118、员工个人培训教育档案编号:JYBN-QXJL-018-01记录人:19、设施设备台帐编号:JYBN-QXJL-019-0120、设施设备运行维护使用记录编号:JYBN-QXJL-020-0121、计量器具检定记录编号:JYBN-QXJL-021-0122、医疗器械养护情况汇总分析季度报表编号:JYBN-QXJL-022-01养护员:汇总日期:年月日23、医疗器械质量信息反馈表编号:JYBN-QXJL-023-0124、医疗器械质量信息传递处理单编号:JYBN-QXJL-024-0125、医疗器械召回记录编号:JYBN-QXJL-025-0126、医疗器械追回记录编号:JYBN-QXJL-026-0127、不合格医疗器械台帐编号:JYBN-QXJL-027-0128、不合格医疗器械报损审批表编号:JYBN-QXJL-028-0129、不合格医疗器械报损销毁审批表编号:JYBN-QXJL-030-01部门:年月日编号:JYBN-QXJL-031-0132、医疗器械采购记录编号:JYBN-QXJL-032-0133、医疗器械收货记录编号:JYBN-QXJL-033-0134、医疗器械验收记录编号:JYBN-QXJL-034-0135、医疗器械出库记录36、温湿度记录表编号:JYBN-QXJL-036-01年月37、计算机系统权限授权审批记录表编号:JYBN-QXJL-037-0138、车辆日常保养及卫生检查表编号: JYBN-QXJL-038-0139、月卫生检查记录表编号:JYBN-QXJL-039-01的符合或不符合的□内打√。
公司管理记录清单工程公司

公司管理记录清单工程公司一、公司程序文件中所列记录清单1、文件发放、回收登记表2、文件修订履历表3、文件更改申请表4、受控文件清单5、管理体系文件管理和分发职能表6、职业健康安全管理方案7、环境管理方案8、职业健康安全/环境管理方案实施细则9、职业健康安全/环境管理方案评审报告10、管理活动检查记录11、管理评审计划管理评审报告12、管理评审会议记录13、职工培训目标管理考核表14、职工培训记录表15、职工培训卡16、职工培训办班统计台帐17、机械设备大修理申报表18、机械设备大修理竣工验收单19、施工机械设备实有、完好、利用情况统计季报表20、主要施工机械维保反馈表21、申请报废鉴定表22、危险因素(源)调查表23、危险因素(源)汇总评估表24、重大危险因素(源)表25、环境因素识别一览表26、环境因素汇总评价表27、重要环境因素清单28、应急计划29、应急准备与相应演练活动表30、劳动保护用品发放台帐31、有毒有害作业人员体检档案32、口头定单主要内容记录33、招(议)标文件(口头定单)评审记录34、投标文件评审记录35、与产品有关的要求的评审36、合同评审第()次会议记录37、补充(修订)合同评定会签记录38、合同台帐39、工程质量回访单40、工程质量回访计划41、顾客意见处理单42、供方考察报告43、供方年度评价表44、合格供方名录45、紧急放行物资申请记录表46、材料质量证明书(合格证)登记表47、试验委托申请表48、物资材料采购台帐49、物资到货记录50、不合格物资记录、处置情况记录51、供方登记表52、工程和劳务合格供主名册53、特殊工种上岗证登记表54、特殊过程能力预先鉴定表55、特殊过程主要技术参数连续监控记录56、质量隐患/通病通知单57、重要物资标识和转移记录表58、计量检测设备配备计划59、测量设备购置审批表60、测量设备验收单61、计量器具登记表62、测量设备停用申请单63、测量设备启用申请单64、顾客满意度调查表65、工程质量监督卡66、内部审核计划67、内部审核检查表内部审核不合格项报告68、内部审核报告69、不合格项分布表70、例外转序申请表71、不合格品情况记录、评审表72、不合格品处置报告73、让步使用批准书74、信息联络处理单75、不合格/潜在不合格信息汇总表76、纠正措施/预防措施记录单二、日常管理记录1、会议记录2、日常监督检查记录3、工作日志4、学习记录三、交工资料1、交工记录(规范、标准及业主所要求的记录)2、体系运行记录(程序文件中要求的记录,项目部在给公司档案室返回的竣工记录中应包含此记录)。
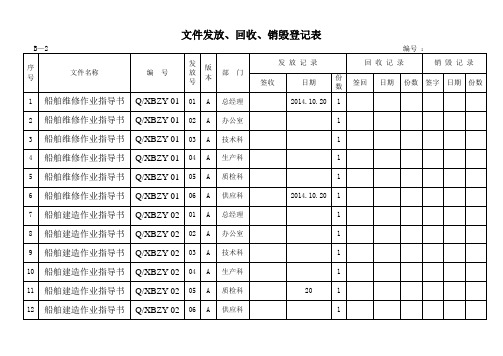
文件发放、回收、销毁登记表
受控/外来文件清单文件更改申请单文件评审表记录清单环境因素调查表环境因素清单环境因素评价表重要环境因素清单危险源辨识清单职业健康安全危险源登记表职业健康安全风险评价表重大职业健康安全风险及其控制措施一览表编制:审批:法律法规与其他要求清单管理方案信息交流表培训申请表年度培训计划表人力资源/专业技术人员能力确定台帐培训有效性评价表培训档案B—21 编号:机械设备台帐B—22 编号:重要设备履历表施工设备维修保养记录设备/设施购置申请表审核:批准:设施验收表设备/设施报废申请表招标书/标书/合同评审记录工程要求更改/评审表合同交底记录表交底部门:接收部门:日期:日期:合格供方名录供方业绩评定表供方调查表物资采购计划表编制/日期:审批/日安全检查记录安全检查隐患整改通知单顾客意见处理报告B—59 编号:应急计划演练记录施工工程顾客/相关方满意度调查表B—75 编号:调查人:日期:竣工工程顾客/相关方满意度调查表B—76 编号:调查人/日期重点施加影响相关方一览表年度内审计划内部审核实施计划日期:年月日日期:年月日内审检查记录表B—81 编号:不符合项报告B—82 编号:不符合项分布表B—83 编号:不符合项分布表B—83 续篇编号:内部审核首(末)次会议签到联合管理体系内部审核报告联合管理体系内部审核报告B—84续编号:纠正和预防措施处置单B—87 编号:联合管理体系持续改进记录表B—88 编号:。
三类医疗器械质量管理记录系列表格

医疗器械质量管理记录1、文件修订申请表 (3)2、文件发放记录表 (4)3、文件回收记录表 (5)4、文件销毁申请表 (6)5、文件销毁记录表 (7)6、质量管理体系问题改进和措施跟踪记录 (8)7、医疗器械群体不良事件基本信息表 (9)8、医疗器械不良反应/事件报告表 (10)9、质量查询、投诉、服务记录 (12)10、质量事故调查、处理表 (13)11、医疗器械质量投诉处理记录 (14)12、质量事故处理跟踪记录 (15)13、员工健康档案表 (17)14、员工健康检查汇总表 (18)15、年度质量培训计划表 (19)16、培训签到表 (20)17、培训实施记录表 (21)18、员工个人培训教育档案 (22)19、设施设备台帐 (23)20、设施设备运行维护使用记录 (24)21、计量器具检定记录 (25)22、医疗器械养护质量情况分析季度报表 (26)23、医疗器械质量信息反馈表 (27)24、医疗器械质量信息传递处理单 (28)25、医疗器械召回记录 (29)26、医疗器械追回记录 (30)27、不合格医疗器械台帐 (32)28、不合格医疗器械报损审批表 (33)29、不合格医疗器械报损销毁审批表 (34)30、质量管理制度执行情况自查及整改记录表 (35)31、质量管理制度执行情况检查和考核记录表 (36)32、医疗器械采购记录 .......................................................................................................................................... .3433、医疗器械收货记录 (35)34、医疗器械验收记录 (36)35、医疗器械出库记录 (37)36、温湿度记录表 (36)37、计算机系统权限授权审批记录表 (36)38、车辆日常保养及卫生检查表 (40)39、月卫生检查记录表 (41)40、设施设备检修维护记录 (42)41、医疗器械质量监控检查记录 (36)42、医疗器械质量复查报告单 (36)43、医疗器械停售通知单 (36)44、医疗器械解除停售通知单 (36)45、医疗器械拒收通知单 (36)46、合格供货方档案表 (36)47、储存作业区来访人员登记表 (36)48、首营企业审批表 (50)49、首营品种审批表 (36)50、全体人员情况表 (36)51、供货企业质量体系评定表 (36)52、质量保证体系调查表 (36)53、医疗器械质量档案表 (36)54、医疗器械质量信息汇总表 (56)1、文件修订申请表编号:JYBN-QXJL-001-012、文件发放记录表编号:JYBN-QXJL-002-013、文件回收记录表编号:JYBN-QXJL-003-014、文件销毁申请表编号:JYBN-QXJL-004-015、文件销毁记录表编号:JYBN-QXJL-005-016、质量管理体系问题改进和措施跟踪记录编号:JYBN-QXJL-006-017、医疗器械群体不良事件基本信息表编号:JYBN-QXJL-007-01报告日期:年月日8、医疗器械不良反应/事件报告表编号:JYBN-QXJL-008-01首次报告□跟踪报告□报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□9、质量查询、投诉、售后服务记录编号:JYBN-QXJL-009-0110、质量事故调查、处理表11、医疗器械质量投诉处理记录编号:JYBN-QXJL-011-0112、质量事故处理跟踪记录编号:JYBN-QXJL-012-0113、员工健康档案表编号: JYBN-QXJL-013-01注:应将历次体检结果证明文件存入档案14、员工健康检查汇总表编号: JYBN-QXJL-014-01'.年度培训计划表编号:JYBN-QXJL-015-01质管部:行政部:审批人:'...培训签到表编号:JYBN-QXJL-016-0117、培训实施记录表编号:JYBN-QXJL-017-01'.18、员工个人培训教育档案编号:JYBN-QXJL-018-01记录人:'.19、设施设备台帐编号:JYBN-QXJL-019-0120、设施设备运行维护使用记录编号:JYBN-QXJL-020-0121、计量器具检定记录编号:JYBN-QXJL-021-0122、医疗器械养护情况汇总分析季度报表编号:JYBN-QXJL-022-01养护员:汇总日期:年月日23、医疗器械质量信息反馈表编号:JYBN-QXJL-023-0124、医疗器械质量信息传递处理单编号:JYBN-QXJL-024-0125、医疗器械召回记录编号:JYBN-QXJL-025-01'.26、医疗器械追回记录编号:JYBN-QXJL-026-01'.'.27、不合格医疗器械台帐编号:JYBN-QXJL-027-01'.28、不合格医疗器械报损审批表编号:JYBN-QXJL-028-0129、不合格医疗器械报损销毁审批表30、质量管理制度执行情况自查及整改记录表编号:JYBN-QXJL-030-01部门:年月日31、质量管理制度执行情况检查和考核记录表编号:JYBN-QXJL-031-0132、医疗器械采购记录编号:JYBN-QXJL-032-0133、医疗器械收货记录编号:JYBN-QXJL-033-01编号:JYBN-QXJL-034-01..36、温湿度记录表编号:JYBN-QXJL-036-01年月37、计算机系统权限授权审批记录表编号:JYBN-QXJL-037-0138、车辆日常保养及卫生检查表编号: JYBN-QXJL-038-0139、月卫生检查记录表编号:JYBN-QXJL-039-01 检查日期:年月日的符合或不符合的□内打√。
质量管理体系全套表格
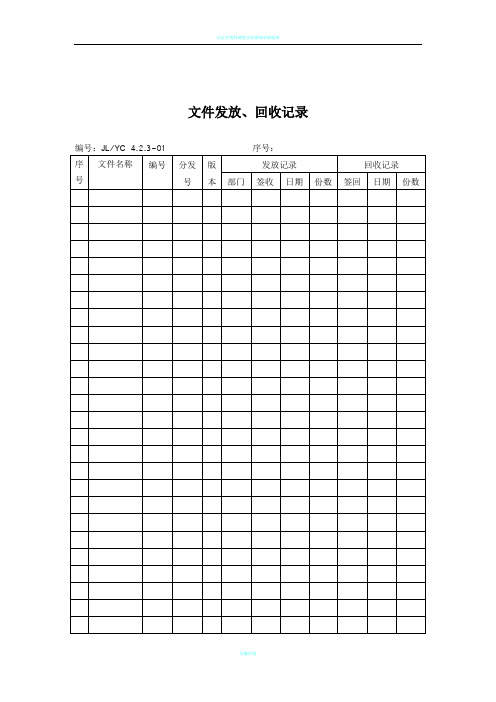
文件发放、回收记录编号:JL/YC 4.2.3-01序号:文件借阅、复制记录表部门受控文件清单编号:JL/YC 4.2.3-03序号:文件更改申请编号:JL/YC 4.2.3-04序号:文件销毁申请编号:JL/YC 4.2.3-05序号:外来文件清单文件发放审批表质量记录清单认证有效性调查企业现场审核提纲质量目标分解表编号:JL/YC 5.4.1-01序号:页脚内容认证有效性调查企业现场审核提纲页脚内容管理评审计划编号:JL/YC 5.6-01序号:管理评审通知单管理评审报告_____年度培训计划编号:JL/YC 6.2-01序号:培训记录表培训申请单岗位技能、业绩考评表编号:JL/YC 6.2-04序号:员工培训档案编号:JL/YC 6.2-05序号:设施配置申请单设施一览表设施日常保养项目表编号:JL/YC 6.3-04序号:注:保养后,用“V”表示日保,“∆”为周保、“X”表示有异常情况,应在“异常情况记录”栏予以记录。
设施检修计划执行部门:编号:JL/YC 6.3-05设施检修单编号: JL/YC 6.3-06设施使用部门: 序号:设施报废单编号: JL/YC 6.3-07使用部门: 序号:工作环境检查记录表风险分析—预期用途/目的的特征表编号:JL/YC 6.4-01序号:公司名称:产品名称:风险分析——已知或可预见的危害表产品要求评审表编号JL/YC 7.2-01□初次评审□修订(原评审号: ) 序号:顾客电话记录编号:JL/YC 7.2-02序号:定单确认表编号:JL/YC 7.2-03序号:编号:JL/YC 7.2-04序号:销售合同样本(编号:JL/YC 7.2-05)医疗器械销售合同合同编号:签订地点:签订时间:采购人(甲方):供应商(乙方):根据《中华人民共和国政府采购法》、《中华人民共和国合同法》及项目(项目编号:SCTC-2012-007的《招标文件》、乙方的《投标文件》及第4包《中标通知书》),甲、乙双方同意签订本合同。
