标准溶液的配制与标定ppt课件
标准溶液的配制与标定

• 配制0.1mol/LHCl标准溶液,先用一定量的浓HCl 加水稀释,配制成浓度约为0.1mol/L的稀溶液,然后 用该溶液滴定经准确称量的无水Na2CO3 基准物质, 直至两者定量反应完全,再根据滴定中消耗HCl溶液 的体积和无水Na2CO3 的质量,计算出HCl溶液的准确 浓度。大多数无法通过直接配制的标准溶液的准确浓 度是通过标定的方法确定的。
• (7) 对不稳定的标准溶液,久置后,在使用前还 需重新标定其浓度。
感谢您 聆听
• ⑶ 配制和标定溶液时使用的量器,如滴定管,容量瓶 和移液管等,在必要时应校正其体积,并考虑温度的 影响。
• ⑷ 标定好的标准溶液应该妥善保存,避免因水 分蒸发而使溶液浓度发生变化。
• (5) 有些不够稳定,如见光易分解的AgNO3和 K暗M处n保O4存等。标准溶液应贮存于棕色瓶中,并置于
• (6) 能吸收空气中二氧化碳并对玻璃有腐蚀作用 的强碱溶液,最好装在塑料瓶中,并在瓶口处 装一碱石灰管,以吸收空气中的二氧化碳和水。
• 8.碘量法的反应温度在15-20℃之间。
• 二、配制标准溶液的方法
• 1.直接配制法
• 用分析天平准确地称取一定量的物质,溶于适量水后定量转 入容量瓶中,稀释至标线,定容并摇匀。根据溶质的质量和容 量瓶的体积计算该溶液的准确浓度。
• 例如:氯化钠、葡萄糖、K2Cr2O7、KBrO3等。
•
很多仪器分析中用到的标准物质配制的标准溶液,如三
聚氰胺、苯甲酸、维生素类,这些都是通过直接配制法进行制
备相应的标准溶液。
配制步骤:溶解--转移--洗涤--定容--摇匀
• 2.间接配制法(标定法)
• 需要用来配制标准溶液的许多试剂不能完全符合上 述基准物质必备的条件。
NaOH标准溶液的配制与标定

三、实验步骤
1、0.1molL-1NaOH溶液的标定 用差减法准确称取0.4~0.6g已烘干的邻苯 二甲酸氢钾三份,分别放入三个已编号的 250mL锥形瓶中,加20~30mL水溶解(可稍加 热以促进溶解)——2~3d酚酞——NaOH溶液 滴定——微红色(30S内不褪)——记录 VNaOH,计算C NaOH和标定结果的相对偏差。
化学试剂规格
IUPAC分五级:A B 我国: 试剂级别 一级试剂 二级试剂 三级试剂 生化试剂 C D E
中文名称 英文名称 标签颜色 优级纯 分析纯 化学纯 GR AR CR BR 深绿色 红色 蓝色 咖啡色
用途 精密分析实验 一般分析实验 一般化学实验 生化实验
特殊用途的化学试剂:光谱纯试剂、色谱纯试剂
滴定管的使用
酸式:装酸、中性、氧化性物质 HCI,AgNO3,KMnO4,K2Cr2O7 碱式:装碱、非氧化性物质 NaOH,Na2S2O3 1、检查 酸式:活塞转动是否灵活?漏水? 涂凡士林 碱式:胶管老化?漏水? 更换胶管、玻璃珠 2、洗涤 自来水-洗涤液-自来水-蒸馏水 3、装滴定剂 摇匀溶液-润洗滴定管 ~3次(10~15ml/次)-装液(零刻度以上) 润洗滴定管2~ 次 润洗滴定管 4、排气泡,调零并记录初始读数 5、滴定 酸式:勿顶活塞,防漏液 用手腕摇动锥形瓶 碱式:挤压玻璃珠偏上部位,防气泡。 近终点时,要“半滴”操作-冲洗 观察颜色变化和读数 滴定管垂直,视线与刻度平行,读至小数点后两位 排液、洗涤 酸式滴定管长期放置-夹纸片
(2)草酸 H2C204﹒2H2O: 草酸在相对湿度为5%~95%时稳定。(能否放置在干 燥器中保存?)用不含CO2的水配制草酸溶液,且暗处保 存。注意:光和Mn2+能加快空气氧化草酸,草酸溶液本身 也能自动分解。 化学计量点时,溶液呈弱碱性(pH≈8.4),可选用酚酞作 指示剂。 滴定反应为: H2C204 + 2NaOH = Na2C204 + 2H2O 结果计算:
(方案)标准溶液的配制与标定.ppt

..........
1
一.标准溶液及基准物质定义
标准溶液是指已知准确浓度的 溶液,它是滴定分析中进行定量 计算的依据之一。
能用于直接配制标准溶液的物 质,称为基准物质或基准试剂, 它是用来确定某一溶液准确浓度 的标准物质。
..........
2
• 作为基准物质必须符合下列要求:
..........
8
• 2.间接配制法(标定法)
• 需要用来配制标准溶液的许多试剂不能完全符合上述 基准物质必备的条件。
• 例如:NaOH极易吸收空气中的二氧化碳和水分,纯 度不高;市售盐酸中HCl的准确含量难以确定,且易挥发; KMnO4和Na2S2O3等均不易提纯,且见光分解,在空气 中不稳定等。
• ⑴ 标定单人应平行测定,至少重复4次,并要求测定结果的相对偏差 不大于0.2% ,双人8平行测定。
• ⑵ 为了减少测量误差 ,称取基准物质的量不应太少,最少应称取 0.15g以上;同样滴定到终点时消耗标准溶液的体积也不能太小,最 好在30-40mL之间。
• ⑶ 配制和标定溶液时使用的量器,如滴定管,容量瓶和移液管等, 在必要时应校正其体积,并考虑温度的影响。
..........
13
• ⑷ 标定好的标准溶液应该妥善保存,避免因水分蒸发而使溶液浓度发 生变化。
• (5) 有些不够稳定,如见光易分解的AgNO3和 KMnO4等标准溶液应 贮存于棕色瓶中,并置于暗处保存。
• (6) 能吸收空气中二氧化碳并对玻璃有腐蚀作用的强碱溶液,最好装在 塑料瓶中,并在瓶口处装一碱石灰管,以吸收空气中的二氧化碳和水。
..........4 Nhomakorabea• 标准溶液的配制与标定的一般规定:
溶液制备ppt课件

标准溶液的制备
5、要熟练掌握一些常用溶剂的配制方法。如碘液配制 时,要将碘溶于较浓的碘化钾水溶液中,才可稀释;配制易 水解盐类的水溶液时,应先加酸溶解后,再以一定浓度的稀 酸稀释。如配制SnC12溶液时,如果操作不当已发生水解,加 相当多的酸仍难溶解沉淀。
6、加热溶完溶质后所得的浓溶液,必须冷至室温后才 可于容量瓶中定容。
8
标准溶液的制备
7、不能用手接触腐蚀性及有剧毒的溶液,剧毒废液应 作解毒处理,才能直接倒入下水道。
8、计算及称量数据,应记在专用记录本上,以备出现 错误时查对。
9、标定好的溶液应妥善保存。每瓶试剂溶液必须标有 名称、规格、浓度、配制日期的标签。
9
标准溶液的制备
10、贮存标准溶液的容器,其材料应不与溶液起理化作 用,壁厚最薄处不小于0.5mm。溶液应用带塞试剂瓶盛装; 见光易分解变质的溶液要装于棕色瓶中,挥发性试剂,例如 用有机溶剂配制的溶液,其瓶塞要严密;遇空气易变质及放 出腐蚀性气体的溶液也要盖紧瓶盖,长期存放时要用蜡封住; 浓碱液要用塑料瓶盛装,若装在玻璃瓶中,则要用橡皮塞塞 紧,不能使用玻璃磨口塞。
标准溶液的制备
五 基准物质的条件
1、基准物质的组成必须与化学式完全符合,含有结晶 水的物质,其结晶水的含量也应与其化学式相符。
2、基准物质应具有一定的稳定性,在空气中不吸收水 份及二氧化碳,不被空气氧化,能长久保持,基准物含有结 晶水时,每次使用1月前必须进行重结晶。
3、基准物质必须易溶于水且易于精制和干燥。 4、基准物质与被滴定溶液的反应必须快速,并且遵守 等物质的量的反应规则。
6
标准溶液的制备
3、配制H2SO4、H3PO4、HNO3、HCl等溶液时,都应将酸倒 入水中;对于溶解时放热较多的试剂,不可在试剂瓶中配制, 以免炸裂容器;配制H2SO4溶液时,应将H2SO4分为小份慢慢倒 入水中,边加边搅拌,必要时以冷水冷却烧杯外壁。
盐酸标准溶液的配制与标定资料课件

盐酸标准溶液的配制与标定资料课件一、实验目的1. 掌握盐酸标准溶液的配制方法;2. 掌握盐酸标准溶液的浓度计算方法;3. 掌握盐酸标准溶液的标定方法。
二、实验原理盐酸为无色液体,是一种强酸,可与水快速反应,放出大量的热。
盐酸溶液的浓度可以通过酸碱滴定法进行测定。
三、实验仪器酸碱分析仪、容量瓶、滴定管、移液管、烧杯、称量器等。
四、实验步骤1. 盐酸标准溶液的配制(1) 取适量的质量分数为36%的盐酸加入到容量瓶中;(2) 加入适量的去离子水,摇匀后加入至刻度线,混合均匀;(3) 最后用去离子水对瓶口擦拭干净,盖妥瓶塞,轻轻摇均,标记后存放。
2. 盐酸标准溶液的浓度计算盐酸标准溶液的浓度计算方法:C1V1=C2V2其中C1为盐酸标准溶液的浓度,V1为盐酸标准溶液的体积,C2为待测溶液的浓度,V2为待测溶液的体积。
根据浓度计算公式,可以算出盐酸标准溶液的浓度,以及待测溶液的浓度。
3. 盐酸标准溶液的标定(1) 取适量的盐酸标准溶液,加入烧杯中,并用甲基橙指示剂进行溶液颜色变化的观察;(2) 开始滴加待测溶液,直到溶液由黄色变成橙色,立即记录所滴加的待测溶液体积,此时盐酸标准溶液和待测溶液已达到化学计量反应;(3) 重复上述实验三次,求出平均值。
根据计算,可以得出盐酸标准溶液的浓度。
五、实验注意事项1. 制备盐酸标准溶液时要精确称量和计量;2. 滴定时要逐滴加入待测溶液,并搅动溶液,使反应均匀;3. 滴定过程中要注意读数的准确性;4. 实验完成后要注意清洗实验器材,保持实验室卫生。
六、实验数据处理根据实验数据,可以计算出盐酸标准溶液的浓度,如C1=0.1mol/L,此时可以根据需求来计算配制盐酸溶液的体积和质量。
七、实验结果分析本实验主要完成了盐酸标准溶液的配制和标定实验,进一步提高了我们在实验操作方面的技巧。
通过实验学习,我们可以掌握更多的化学实验技能,并且在实验数据分析中,更加了解了实验结果。
标准溶液配制和标定
标准溶液的配制和标定标准溶液是用于滴定分析法测定化学试剂、化工产品纯度及杂质含量的已知准确浓度的溶液。
国家标准(GB 601-88)对滴定分析用标准溶液的配制和标定方法做了详细、严格的规定,配制和标定标准溶液时,必须严格执行。
实验室中最常用的是是物质的量浓度标准溶液,也有用滴定度标准溶液和质量体积表示的标准溶液,这里只介绍物质的量浓度标准溶液的配制和标定。
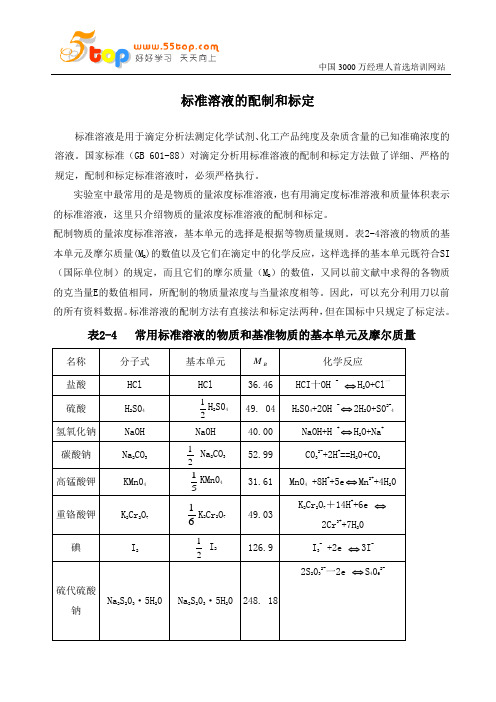
配制物质的量浓度标准溶液,基本单元的选择是根据等物质量规则。
表2-4溶液的物质的基)的数值以及它们在滴定中的化学反应,这样选择的基本单元既符合SI 本单元及摩尔质量(MB(国际单位制)的规定,而且它们的摩尔质量(M)的数值,又同以前文献中求得的各物质B的克当量E的数值相同,所配制的物质量浓度与当量浓度相等。
因此,可以充分利用刀以前的所有资料数据。
标准溶液的配制方法有直接法和标定法两种,但在国标中只规定了标定法。
表2-4 常用标准溶液的物质和基准物质的基本单元及摩尔质量一、标准溶液的配制方法1.直接法准确称取一定量基准化学试剂溶解后,移入一定体积的量瓶中,加水至刻度,摇匀即可。
然后由试剂质量和体积计算出所配标准溶液的准确浓度。
直接法配制标准溶液,必须使用基准试剂,它必须具备4个条件:(1)纯度高,要求杂质含量在万分之一以下;(2)组成与化学式相符,若含有结晶水,其含量也应与化学式相符。
如:Na2B47·1OH20,结晶水应恒定为10个;(3)性质稳定,干燥时不分解,称量时不吸潮,不吸收二氧化碳、不被空气氧化、放置时不变质;(4)容易溶解,最好具有较大的摩尔质量。
基准试剂由于在贮存过程中会吸潮、吸二氧化碳,因此,在使用前必须经过烘干或灼烧处理。
德信诚精品培训课程(部分)内审员系列培训课程查看详情TS16949五大工具与QC/QA/QE品质管理类查看详情 JIT>>>德信诚深圳培训中心 E-mail:55top@ 报名表下载>>> 公开课计划表2.标定法标定法是首先配制成接近于所需浓度的溶液,然后再用基准物质标定其准确浓度,或用另一种标准溶液对所配制标准溶液进行滴定,并计算出其准确浓度为比较法。
盐酸标准溶液的配制与标定-1.ppt

7. 关机 ①按住 键不放直到显示屏出现“OFF”字样, 再松开键盘。
②按一下
8. 取下称量物和容器。检查天平上下是否清洁,若 有脏物,用毛刷清扫干净。填写天平使用登记簿 后方可离开天平室。
注意事项
1. 不得用天平称量热的或超载的物品。 2. 不准称带磁性的物质。 3. 天平要经常关门,特别是在称量过程中。 4. 天平机前要预热0.5-1.0h。 5. 天平在使用前都应进行较准。 6. 称量时,被称物质入在秤盘的中央。药品不得直接放在
3. 查看水平仪。
若不水平,需调整水平调节螺丝,直到气泡 位于水平仪上圆圈的中央。
4.开机
或
水平仪调节示意图:
5. 称量
5.1 简单称量(直接法) ①开机等待,直到稳定状态探测符“。”消失(屏 幕左边)。 ②将空容器放到天平上,显示该重量,后点击 <O/T>键 或Tare键 ,启动天平的去皮功能。 ③把样品放入天平上的容器里进行称量,显示净重。 注:如果将容器从天平上拿走,则皮重以负值显示。 皮重一直保留到再次按<O/T>键、Tare键或天平关 机为止。
食品分析检验技术
0.1mol/L盐酸溶液的配制与标定
盐酸溶液的配制与标定
一、技能目标 二、实验原理 三、仪器和试剂 四、实验步骤 五、数据处理 六、注意问题
一、技能目标
学习盐酸标准溶液的配制和标定方法。 正确使用酸式滴定管、天平等仪器。 如实记录数据,计算准确。
二、实验原理
由于浓盐酸容易挥发,不能用它们来直接 配制具有准确浓度的标准溶液,因此,配制 HCl标准溶液时,只能先配制成近似浓度的 溶液,然后用基准物质标定它们的准确浓度, 或者用另一已知准确浓度的标准溶液滴定该 溶液,再根据它们的体积比计算该溶液的准 确浓度。
标准溶液的配制与标定

–
•
T: 是指1 ml标准溶液相当于被测物质的质量, 单位:g/ml。
• T= C*M /1000 • 式中 C——EDTA的摩尔浓度 mol/L ; • M——Ni的相对分子量 58.69 • 例1、称4.0000 g硫酸镍,溶于250 ml容量 瓶中,分取10ml于400ml,消耗上述EDTA 标准溶液21.0ml,求硫酸镍中镍的百分含 量。
• 液,加热溶解,用(1+1)H2 SO4酸化后, 再过量10 ml,移入1000 ml容量瓶中,用 水稀释至刻度。MV=50.94 CV=0.001g/ml • N—苯基邻氨基苯甲酸溶液(0.2%): 称取0.2gN—苯基邻氨基苯甲酸溶解于100 ml 0.2%碳酸钠溶液中。
• 分取10 ml钒标准于300 ml锥形瓶中,加入25 ml (1+1)H2 SO4,加热溶解。滴加HNO3至钛的 紫色消失,并加热赶尽氮的氧化物,取下冷却, 用水稀释约100ml,滴加高锰酸钾(0.5%)溶液, 至溶液呈稳定的红色后,放置3分钟,加入10 ml 尿素(10%)溶液,再滴加(1%)亚硝酸钠溶液 至红色消失,放置2分钟,加入5滴N—苯基邻氨 基苯甲酸溶液(0.2%),用硫酸亚铁铵标准溶液 滴定至溶液由桃红色变为黄绿色为终点。假设消 耗硫酸亚铁铵标准溶液9.8ml
• • • •
• 标定方法 • 称取下述规定量的于105——110 。C烘至质量恒定的 基准邻苯二甲酸氢钾,称准至0.0001g,溶于下述规定体 积的无CO2水中,加2滴酚酞指示液(10g/L),用配制好 的NaOH溶液,滴定至溶液呈粉红色,同时作空白试验。 计算NaOH溶液的浓度。 • CNaOH mol/L m基准邻苯二甲酸氢钾 g 无CO2水 ml • 1 6 80 • 0.5 3 80 • 0.1 0.6 50
溶液配制PPT课件

❖ 2.质量摩尔浓度
❖ 是指溶液中溶质B的物质的量(mol)除以溶剂 的质量(g),即bB=nB/mK
❖ 式中 bB——质量摩尔浓度, mol/Kg ❖ nB——物质B的物质的量,mol ❖ mK——溶剂K的质量,Kg
❖ 用质量摩尔浓度来表示的溶液组成,其优点 是其量值不受温度影响,缺点是使用不方便。因 此,在化学中应用很少,与此相应的浓度表示方 法有已被废弃的重量摩尔浓度,重量克分子浓度。
❖
V ——溶液的体积,L。
❖ 如:c(H2SO4)=1mol/L,表示1L溶液中含有 H2SO4为1mol,即每升溶液中含有H2SO498.08。
❖ c(1/2H2SO4)=1mol/L,表示1L溶液中含有 (1/2H2SO4)为1mol,即每升溶液中含有 H2SO449.04。
❖ 7.滴定度
❖ 是指单位体积的标准滴定溶液A,相当于被测物 质的质量,常以TB/A符号表示。
❖ wB=mB/nB=mB/(cB*V)
例题:将质量为1.5803g的高锰酸钾配制成体 积为2000ml的溶液,求该溶液浓度 c(1/3KMnO4)。
❖ 解 根据公式cB=mB/(MBV)
❖ W(Zn)=98.3*10-6代替过去常用的 98.3ppm
❖ W(Au)=2.6*10-9代替过去常用的2.6ppb
❖ 用质量分数表示溶液浓度的优点是浓度不 受温度的影响。它常用于溶质为固体的溶 液。
❖ 如w(NaCl)=5%,表示5gNaCl溶于95g水中。 ❖ 市售的浓酸的含量,就是以质量分数表示
❖ 例如,1.00mL K2Cr2O7标准溶液恰好能与 0.005682g Fe完全反应,则此K2Cr2O7溶液对 Fe的滴定度TFe/K2Cr2O7 = 0.005682g/mL-1。
高锰酸钾标准溶液配制和标定PPT(精)

消毒剂
高锰酸钾具有杀菌消毒能 力,常用作消毒剂和漂白 剂,可用于水处理、医疗 卫生、化妆品等领域。
药学领域
高锰酸钾还可用于治疗某 些皮肤病和口腔炎症等。
标准溶液在化学实验室的重要性
精确浓度
标准溶液具有准确已知的 浓度,可作为基准物质, 用于其他溶液的标定和浓 度的准确测量。
质量控制
标准溶液可用于质量控制 和质量保证,确保实验结 果的准确性和可重复性。
实验目的和任务
实验目的:掌握高锰酸钾标准溶液的配 制方法和标定原理,了解其在化学实验 中的应用。
3. 分析实验过程中可能产生的误差,并 讨论提高实验结果准确性的方法。
2. 通过合适的标定方法,确定高锰酸钾 标准溶液的浓度。
实验任务 1. 配制一定浓度的高锰酸钾标准溶液。
02
高锰酸钾标准溶液的配制
。
在数据分析过程中,我们还需要考虑实 验误差的来源,并对数据进行适当的处 理和修正,以提高结果的准确性和可靠
性。
结论总结
通过精确的数据记录和分析,我们成功地配制了特定浓度的高锰酸钾标准溶液,并 进行了准确的标定。
标定结果表明,我们配制的高锰酸钾溶液浓度与预期值相符,且误差在可接受范围 内。这说明我们的配制和标定方法是有效的。
根据高锰酸钾标准溶液的浓度 ,可以进一步计算待测溶液中 还原性物质的浓度。
注意:以上步骤和计算仅为一 种常用的标定方法,实际操作 中可能根据具体情况有所调整 。
04
实验数据分析与结论
数据记录
在进行高锰酸钾标准溶液的配制过程中,我们记录了精确的称量数据,包括高锰酸钾的质量以及溶剂 的体积。这些数据是后续分析和标定的基础。
使用的滴定管、容量瓶等仪器未经准 确校准,导致结果偏差。
标准溶液的配制与标定

标准溶液的配制与标定(总6页)-CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除一、氢氧化钠标准滴定溶液1、配制:称取110g氢氧化钠,溶于100ml无二氧化碳的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
按下表用量,用塑料管量取上层清液,用无二氧化碳的水稀释至1000mL,摇匀。
氢氧化钠标准滴定溶液的浓度C(NAOH)/(mol/L)氢氧化钠溶液的体积V/mL1540.5270.1 5.42、标定:按下表的规定量,称取于105℃~110℃电烘箱中干燥至恒量的工作基准试剂邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示液(10g/L),用配制的氢氧化钠滴定至溶液呈粉红色,并保持30s。
同时做空白试验。
氢氧化钠标准滴定溶液的浓度C(NAOH)/(mol/L)工作基准试剂邻苯二甲酸氢钾的质量m/g无二氧化碳水的体积V/mL17.5800.5 3.6800.10.7550氢氧化钠标准滴定溶液的浓度[c(NaOH)],按式(1)计算:c(NaOH)= (1)式中:m—邻苯二甲酸氢钾质量,单位为克(g);V1—氢氧化钠溶液体积,单位为毫升(mL);V2—空白试验消耗氢氧化钠溶液体积,单位为毫升(mL);M—邻苯二甲酸氢钾的摩尔质量,单位为克每摩尔(g/mol)[M(KHC8H4O4)=204.22]二、盐酸标准滴定溶液1、配制:按下表规定量,量取盐酸,注入1000mL水中,摇匀。
盐酸标准滴定溶液的浓度c(HCl)/(mol/L)盐酸的体积V/mL1900.5450.192、标定按下表规定量,称取于270℃~300℃高温炉中灼烧至恒量的工作基准试剂无水碳酸钠,溶于50mL水中,加10滴溴甲酚绿-甲基红指示液,用配制的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,加盖具钠石灰管的橡胶塞,冷却,继续滴定至溶液再呈暗红色。
同时做空白试验。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
THANK YOU
SUCCESS
2019/5/7
可编辑
3、装滴定剂 摇匀溶液-润洗滴定管2~3次(10~15ml/
次)-装液(零刻度以上)
4、排气泡,调零并记录初始读数 5、滴定 酸式:勿顶活塞,防漏液
用手腕摇动锥形瓶
碱式:挤压玻璃珠偏上部位,防气泡。 近终点时,要“半滴”操作-冲洗 观察颜色变化和读数 滴定管垂直,视线与刻度平行,读至小数
NaOH标准溶液的配制与标定
NaOH标准溶液的配制与标定
一、实验目的 1、掌握NaOH标准溶液的配制、保存方法 2、进一步学习天平、容量器皿(滴定管、移液
管、容量瓶等)的使用. 3、掌握酚酞指示剂确定终点的方法。 4、学习 NaOH标准溶液的标定方法 5、了解邻苯二甲酸氢钾 的性质与应用
25毫升 吸量管 碱式滴定管 式滴定管
读数必须读到小数点后第二位,第二 位数字为估读数字,从0到9估读的概 率应该相同,避免经常估读为5或0;
每次固定在0.00 mL处或稍低一点的 位置,减少体积测量误差。
碱式滴定管操作要点: 滴定管操作:左手拇指
在前,食指在后,其余 三指夹住管口; 指尖捏挤玻璃珠周围右 侧乳胶管,使乳胶管与 玻璃珠之间形成细缝, 溶液即可流出。
常用滴定分析仪器
量筒
25 0 毫 升 容
量
瓶
移液管
烧杯 2个
锥形瓶 4个
二、实验原理
由于NaOH固体易吸收空气中的 CO2和水分,故只能选用标定法(间 接法)来配制,即先配成近似浓度的 溶液, 再用基准物质或已知准确浓 度的标准溶液标定其准确浓度。通 常配制0.1mol·L-1的溶液。
实验原理
标定:用基准物质准确标定出NaOH溶液的浓 度
点后两位
排液、洗涤 酸式滴定管长期放置-夹纸
酸碱滴定管 操作练习—重点训练
(1) 滴定管的准 备 试漏:演示! 涂油或选择合适的玻璃珠和乳胶管: 演示! 洗涤滴定管:10 mL洗液自来水 蒸馏水洗三遍,每次10 mL;
标准溶液的装入: 润洗:510mL标准溶液洗23次,
标准溶液直接装入滴定管,不得 借用任何别的器皿。(润洗的目 的是什么?) 赶气泡:酸式滴定管和碱式滴定 管操作不同; 演示! 调节液面:在0.00mL处或稍下一 点位置,读取初体积。
常用基准物质:邻苯二甲酸氢钾 (1) 邻苯二甲酸氢钾: 优点:易制得纯品,在空气中不吸水,易保
存,摩尔质量大,与NaOH反应的计量比为1: 1。在100~125℃下干燥1~2h后使用。
滴定反应为:
COOH + NaOH COOK
COONa COOK + H2O
化学计量点时,溶液呈弱碱性(pH≈9.20),可选用酚酞作指示剂。
特殊用途的化学试剂:光谱纯试剂、色谱纯试剂
滴定管的使用
酸式:装酸、中性、氧化性物质 HCI,AgNO3,KMnO4,K2Cr2O7
碱式:装碱、非氧化性物质 NaOH,Na2S2O3 1、检查 酸式:活塞转动是否灵活?漏水? 涂凡士林 碱式:胶管老化?漏水? 更换胶管、玻璃珠 2、洗涤 自来水-洗涤液-自来水-蒸馏水
半滴滴法:将旋塞稍稍转动,使有 半滴溶液悬于管口,将锥形瓶与管 口接触,使液滴流出,并用洗瓶以 蒸馏水冲下。演示!
滴定管读数—重点训练
从滴定管架上取下滴定管; 保持竖直; 无色或浅色溶液:读取视线与弯月面
下缘实线最低点相切处的刻度;有色 溶液:读取视线与液面两侧最高点呈 水平处的刻度;
滴定管读数—重点训练
2、配制好的溶液如何保存? 实验课本p158
化学试剂规格
IUPAC分五级:A B C D E 我国:
试剂级别
一级试剂 二级试剂 三级试剂 生化试剂
中文名称 英文名称 标签颜色
优级纯 GR 分析纯 AR 化学纯 CR
BR
深绿色 红色 蓝色 咖啡色
用途
精密分析实验 一般分析实验 一般化学实验 生化实验
酸式滴定管操作要点---重点训练
酸式滴定管的操作:左手控制旋塞, 拇指在前,食指和中指在后,手指向 内扣住旋塞,勿使手心顶住旋塞造成 渗液;演示!
锥形的操作:右手握住锥形瓶,滴定 管管尖伸进瓶口为宜,手腕摇动使溶 液作同一方向的圆周运动;演示!
溶液滴入速度不能成流水状放出;
酸式滴定管操作要点---重点训练
结果计算:
C NaOH
(
m M
)
邻苯二甲酸氢钾
1000
mol.L1
VNaOH
式中m邻苯二甲酸氢钾—单位g, VNaOH—单位ml。
三、实验步骤
1、0.1mol·L-1NaOH溶液的标定 用差减法准确称取0.75g已烘干的邻苯二
甲酸氢钾三份,分别放入三个已编号的250mL 锥形瓶中,加50mL水溶解——2~3d酚酞—— NaOH溶液滴定——微红色(30S内不褪)—— 记录VNaOH,计算C NaOH和标定结果
方法(1).用小烧杯于台秤上称取较理论计算量稍多的 NaOH,用不含CO2蒸馏水迅速冲洗两次,溶解并定溶。
(2).制备饱和NaOH(50%, Na2CO3基本不溶)待Na2CO3 下沉后,取上层清液用不含CO2的蒸馏水稀释.
(3).于NaOH溶液中,加少量Ba(OH)2或BaCI2,取上层清液 用不含CO2的蒸馏水稀释.
3
空白组
项目
m(邻苯二甲酸氢 钾)g 0.75 g
VNaOH(ml)
CNaOH (mol·L-1)
CNa(OmHol·L-1)
五、问题讨论:
1、NaOH 因吸收CO2而混有少量的Na2CO3,以致在实
验中导致误差,必须设法除去CO32-离子,如何配制不 含CO32-的NaOH溶液?
注意: 不要用力捏玻璃珠、 不要使玻璃珠上下移动、不要捏挤玻璃珠下端胶 管,以免空气进入形成气泡。
1、配制0.1mol/L的氢氧化钠溶液250毫升放 到容量瓶中备用。 2、润洗碱式滴定管 3、将称量瓶盛满邻苯二甲酸氢钾 每组2个 4、差量法称取邻苯二甲酸氢钾0.75g到3个锥 形瓶中,记录准确数值小数点后3位 5、向4个锥形瓶中加入50毫升水溶解摇匀 (3个平行试验,一个空白试验) 6、向锥形瓶加2-3滴酚酞 7、滴定,记录消耗的氢氧化钠体积,小数点 后2位
