热力学课后习题02答案
(完整版)哈工大工程热力学习题答案——杨玉顺版

(完整版)哈⼯⼤⼯程热⼒学习题答案——杨⽟顺版第⼆章热⼒学第⼀定律思考题1. 热量和热⼒学能有什么区别?有什么联系?答:热量和热⼒学能是有明显区别的两个概念:热量指的是热⼒系通过界⾯与外界进⾏的热能交换量,是与热⼒过程有关的过程量。
热⼒系经历不同的过程与外界交换的热量是不同的;⽽热⼒学能指的是热⼒系内部⼤量微观粒⼦本⾝所具有的能量的总合,是与热⼒过程⽆关⽽与热⼒系所处的热⼒状态有关的状态量。
简⾔之,热量是热能的传输量,热⼒学能是能量?的储存量。
⼆者的联系可由热⼒学第⼀定律表达式 d d q u p v δ=+ 看出;热量的传输除了可能引起做功或者消耗功外还会引起热⼒学能的变化。
2. 如果将能量⽅程写为d d q u p v δ=+或d d q h v p δ=-那么它们的适⽤范围如何?答:⼆式均适⽤于任意⼯质组成的闭⼝系所进⾏的⽆摩擦的内部平衡过程。
因为 u h pv =-,()du d h pv dh pdv vdp =-=-- 对闭⼝系将 du 代⼊第⼀式得q dh pdv vdp pdv δ=--+ 即 q dh vdp δ=-。
3. 能量⽅程δq u p v =+d d (变⼤)与焓的微分式 ()d d d h u pv =+(变⼤)很相像,为什么热量 q 不是状态参数,⽽焓 h 是状态参数?答:尽管能量⽅程 q du pdv δ=+与焓的微分式 ()d d d h u pv =+(变⼤)似乎相象,但两者的数学本质不同,前者不是全微分的形式,⽽后者是全微分的形式。
是否状态参数的数学检验就是,看该参数的循环积分是否为零。
对焓的微分式来说,其循环积分:()dh du d pv =+蜒? 因为0du =??,()0d pv =??所以0dh =??,因此焓是状态参数。
⽽对于能量⽅程来说,其循环积分:q du pdv δ=+蜒?虽然: 0du =?? 但是: 0pdv ≠?? 所以: 0q δ≠?? 因此热量q 不是状态参数。
工程热力学第三版曾丹苓第二章习题及答案

⼯程热⼒学第三版曾丹苓第⼆章习题及答案热⼒学第⼆章习题及答案⼀、是⾮题1、任意过程只要知道其始末状态即可确定过程与外界的热交换(x)、功交换(x)及系统热⼒学能的变化(√)。
2、简单可压缩系统任意过程中对外所作膨胀功均可⽤计算(√)。
pdV计算(x),⽤?dWpsurr3、流动功Δ(pdV)只有在开⼝系统中研究⽓体流动时才需要考虑(√)。
4、q和w是状态参数(x)⼆、选择题1、表达式δQ=dU+δW c 。
(a)适⽤于任意热⼒过程;(b)仅适⽤于准静态过程;(c)仅适⽤于闭⼝系统中的热⼒过程。
2、表达式δQ=dU+pdV适⽤ a1中的 a2。
(a1)闭⼝系;(b1)开⼝系;(c1)闭⼝及开⼝系;(a2)准静过程;(b2)任意热⼒过程;(c2)⾮准静过程。
3、任意准静或⾮准静过程中⽓体的膨胀功均可⽤ b 计算。
(a)pdV;(b)p surr dV;(c)d(pv)。
4、在正循环中?Qδa零,同时?Wδa零。
在逆循环中?Qδ c 零,且?Wδ c 零(a)⼤于;(b)等于;(c)⼩于。
三、习题2-1 0.5kg 的⽓体,在汽缸活塞机构中由初态p 1=0.7MPa 、V 1=0.02m 3,准静膨胀到V 2=0.04m 3。
试确定在下列各过程中⽓体完成的功量及⽐功量;(1)定压过程;(2) pV 2=常数。
解:(1)由准平衡过程体积变化功的表达式,当为定压过程时:W=p △V=0.7×106×0.02=14000 J=14 kJ ⽐功量 w= p △v=W/m=14000/0.5=28000 J=28 kJ(2)pV 2=0.7×106×0.022=280 J 〃m 3由准平衡过程体积变化功的表达式W=dV V pdv v v ??=04.002.0228021=7000 J=7 kJ⽐功量 w= p △v=W/m=7000/0.5=14000 J=14 kJ 2-2为了确定⾼压下稠密⽓体的性质,取2kg ⽓体在25MPa 下从350K 定压加热到370K ,⽓体初终状态下的容器分别为0.03 m3及0.035 m 3,加⼊⽓体的热量为700kJ ,试确定初终状态下的热⼒学能之差。
西工大(冯青) 工程热力学作业答案 第二章

0 = ( mu ′ − m0 u0 ) + 0( h + − ( m − m0 )( h +
1 2 cf + gz ) out 2
1 2 cf + gz ) in + 0 2
习题 2-13 储气罐充气
忽略宏观动能和位能后,整理得
( mu ′ − m0 u0 ) = h( m − m0 ) ,即开口系能量的增加等于
则由闭口系热力学第一定律表达式得
Q12 = ΔU 12 + W12 = 1.5( p2V2 − p1V1 ) +
1 ( p2 − p1 )(V2 + V1 ) + ( p1V2 − p2V1 ) 2
= 60 + 0.5 × ( 200 − 1000)(1.2 + 0.2) + (1000 × 1.2 − 200 × 0.2) = 660 kJ
PA2V A2 PA1V A1
× T A1 =
V2
2 × 0.00645 TA1 = 3T A1 = 900 K 1 × 0.043
(2)取 B 内气体为热力系, WB =
∫
V2
V1
pdV = ∫
RgTB1
V
V1
dV = RgTB1 ln
V2 V1
kJ
= 0.287 × 300 × ln
则 QB = ΔU B + WB = 0 − 59.68 = −59.68
cf 3′ = 2( h3 − h3′ ) =
2γRg
γ −1
(T3 − T3′ ) =
2 × 1.40 × 0.287 (600 − 370) = 21.50 m/s 1.40 − 1
大学物理化学1-热力学第一定律课后习题及答案

热力学第一定律课后习题一、是非题下列各题中的叙述是否正确?正确的在题后括号内画“√”,错误的画“⨯”。
1.在定温定压下,CO2由饱和液体转变为饱和蒸气,因温度不变,CO2的热力学能和焓也不变。
( )2. d U = nC V,m d T这个公式对一定量的理想气体的任何pVT过程均适用。
( )3. 一个系统从始态到终态,只有进行可逆过程才有熵变。
( )4. 25℃时H2(g)的标准摩尔燃烧焓等于25℃时H2O(g)的标准摩尔生成焓。
( )5. 稳定态单质的∆f H(800 K) = 0。
( )二、选择题选择正确答案的编号,填在各题后的括号内:1. 理想气体定温自由膨胀过程为:()。
(A)Q > 0;(B)∆U < 0;(C)W <0;(D)∆H = 0。
2. 对封闭系统来说,当过程的始态和终态确定后,下列各项中没有确定的值的是:( )。
( A ) Q;( B ) Q+W;(C ) W( Q = 0 );( D ) Q( W = 0 )。
3. pVγ = 常数(γ = C p,m/C V,m)适用的条件是:( )(A)绝热过程;( B)理想气体绝热过程;( C )理想气体绝热可逆过程;(D)绝热可逆过程。
4. 在隔离系统内:( )。
( A ) 热力学能守恒,焓守恒;( B ) 热力学能不一定守恒,焓守恒;(C ) 热力学能守恒,焓不一定守恒;( D) 热力学能、焓均不一定守恒。
5. 从同一始态出发,理想气体经可逆与不可逆两种绝热过程:( )。
( A )可以到达同一终态;( B )不可能到达同一终态;( C )可以到达同一终态,但给环境留下不同影响。
6. 当理想气体反抗一定的压力作绝热膨胀时,则:( )。
( A )焓总是不变;(B )热力学能总是增加;( C )焓总是增加;(D )热力学能总是减少。
7. 已知反应H2(g) +12O2(g) ==== H2O(g)的标准摩尔反应焓为∆r H(T),下列说法中不正确的是:()。
大学物理化学 第二章 热力学第二定律学习指导及习题解答

3.熵可以合理地指定
Sm$
(0K)
0
,热力学能是否也可以指定
U
$ m
(0K)
0
呢?
答:按能斯特热定理,当温度趋于0K,即绝对零度时,凝聚系统中等温变化过
程的熵变趋于零,即
, 只要满足此式,我们就可以任意
选取物质在0K时的任意摩尔熵值作为参考值,显然 Sm$ (0K) 0 是一种最方便的
选择。但0K时反应的热力学能变化并不等于零,
(2)变温过程
A.等压变温过程 始态 A(p1,V1,T1) 终态 B(p 1,V2,T2)
S
T2
δQ R
T T1
T2 Cp d T T T1
Cp
ln
T2 T1
B.等容变温过程 始态 A(p1,V1,T1) 终态 B(p2,V1,T2)
S
T2
δQ R
T T1
C.绝热过程
T2 CV d T T T1
,所以不
能指定
U
$ m
(0K)
0
。
4.孤立系统从始态不可逆进行至终态S>0,若从同一始态可逆进行至同
一终态时,则S=0。这一说法是否正确?
答:不正确。熵是状态函数与变化的途径无关,故只要始态与终态一定S
必有定值,孤立系统中的不可逆过程S>0,而可逆过程S=0 是毋庸置疑的,
问题是孤立系统的可逆过程与不可逆过程若从同一始态出发是不可能达到相同
4.熵 (1)熵的定义式
dS δ QR T
或
S SB SA
B δ QR AT
注意,上述过程的热不是任意过程发生时,系统与环境交换的热量,而必须是在
可逆过程中系统与环境交换的热。
物理化学 课后答案-热力学第二定律

第三章热力学第二定律【复习题】【1】指出下列公式的适用范围。
(1)min ln BB BS Rnx ∆=-∑;(2)12222111lnln ln ln P v p T V T S nR C nR C p T V T ∆=+=+; (3)dU TdS pdV =-; (4)G Vdp ∆=⎰(5),,S A G ∆∆∆作为判据时必须满足的条件。
【解】(1)封闭体系平衡态,理想气体的等温混合,混合前后每种气体单独存在时的压力都相等,且等于混合后气体的总压力。
(2)非等温过程中熵的变化过程,对一定量的理想气体由状态A (P 1、V 1、T 1)改变到状态A (P 2、V 2、T 2)时,可由两种可逆过程的加和而求得。
(3)均相单组分(或组成一定的多组分)封闭体系,非体积功为0的任何过程;或组成可变的多相多组分封闭体系,非体积功为0的可逆过程。
(4)非体积功为0,组成不变的均相封闭体系的等温过程。
(5)S ∆:封闭体系的绝热过程,可判定过程的可逆与否; 隔离体系,可判定过程的自发与平衡。
A ∆:封闭体系非体积功为0的等温等容过程,可判断过程的平衡与否;G ∆:封闭体系非体积功为0的等温等压过程,可判断过程的平衡与否;【2】判断下列说法是否正确,并说明原因。
(1)不可逆过程一定是自发的,而自发过程一定是不可逆的; (2)凡熵增加过程都是自发过程; (3)不可逆过程的熵永不减少;(4)系统达平衡时,熵值最大,Gibbs 自由能最小;(5)当某系统的热力学能和体积恒定时,S ∆<0的过程不可能发生;(6)某系统从始态经过一个绝热不可逆过程到达终态,先在要在相同的始、终态之间设计一个绝热可逆过程;(7)在一个绝热系统中,发生了一个不可逆过程,系统从状态1变到了状态2,不论用什么方法,系统再也回不到原来状态了;(8)理想气体的等温膨胀过程,0U ∆=,系统所吸的热全部变成了功,这与Kelvin 的说法不符;(9)冷冻机可以从低温热源吸热放给高温热源,这与Clausius 的说法不符; (10)p C 恒大于V C 。
工程热力学第三版_热力学第二定律课后题答案

B T1 1 lim lim 1 T T T T T T2 A 1 2 1
lim
1 1 1
T1
[3-7]用可逆热机驱动可逆制冷机,热机从热源 TH,向热源 T0 放热,而制冷 机从冷藏库 TL 取热向热源 T0 放热, 如图 3-20 所示, 试证明当 TH 大大高于 T0 时,制冷机从冷藏库吸取 的热量 QL 与热源 TH 供给的热量 QH 之比趋近于 TL TO TL 。 解:可逆热机热效率 T C 1 O TH 吸热 QH,作功量为 TO W C QH 1 T QH H 可逆制冷机制冷系数 TL c TO TL 输入功量
5 333 5 4.1868 t 0 25 4.1868 50 t 解得 t 28.41C 301.41K
混合后系统的熵增 S 系=S 冰+S 水
S系=
m1rl dT dT m1rl T T m1c m2 c m1c ln m2 c ln T1 T1 T T2 T T1 T1 T2
第二章-热力学第二定律习题解答

第二章 热力学第二定律 一、基本公式和基本概念 (一)基本公式1. 热力学第二定律的数学表达式——克劳修斯不等式 (0A B A B QS Tδ→→∆−≥∑2. 熵函数的定义 (R QdS Tδ=,ln S k =Ω3. 熵变的计算理想气体单纯,,p V T 变化22,1122,1122,,11ln ln ln ln lnln V m p m p m V m T V S C R T V T p S C R T p V p S C C V p ∆=+∆=−∆=+理想气体定温定压混合过程ln i i iS R n x ∆=−∑封闭系统的定压过程21, T p m T C S n dT T∆=∫封闭系统定容过程 21, T V m T C S n dT T∆=∫可逆相变 m n H S T∆∆=标准状态下的化学反应 ,()r m Bm B BS S T θθν∆=∑定压下由1T 温度下的化学反应熵变求2T 温度下的熵变 21,21 ()()T p m r m r m T C S T S T dT T∆∆=∆+∫4. 亥姆霍兹函数 A U TS ≡−5. 吉布斯函数 G H TS ≡−6. G ∆和A ∆的计算(A ∆的计算原则与G ∆相同,做相应的变换即可)定温过程G H T S ∆=∆−∆组成不变的均相封闭系统的定温过程 21p p G Vdp ∆=∫理想气体定温过程 21ln p G nRT p ∆= 7. 热力学判据熵判据:,()0U V dS ≥亥姆霍兹函数判据:,,'0()0T V W dA =≤ 吉布斯函数判据:,,'0()0T p W dG =≤8. 热力学函数之间的关系组成不变,不做非体积功的封闭系统的基本方程dU TdS pdV dH TdS Vdp dA SdT pdV dG SdT Vdp=−=+=−−=−+麦克斯韦关系S VpS T Vp TT p V S T V p S S p V T S V p T ∂∂⎛⎞⎛⎞=−⎜⎟⎜⎟∂∂⎝⎠⎝⎠⎛⎞∂∂⎛⎞=⎜⎟⎜⎟∂∂⎝⎠⎝⎠∂∂⎛⎞⎛⎞=⎜⎟⎜⎟∂∂⎝⎠⎝⎠⎛⎞∂∂⎛⎞=−⎜⎟⎜⎟∂∂⎝⎠⎝⎠ 9. 吉布斯-亥姆霍兹方程2()pG H T T T ∆⎡⎤∂∆⎢⎥=−∂⎢⎥⎣⎦ 基本概念1. 热力学第二定律在研究化学或物理变化驱动力来源的过程中,人们注意到了热功交换的规律,抓住了事物的共性,提出了具有普遍意义的熵函数。
(完整版)第二章习题解答
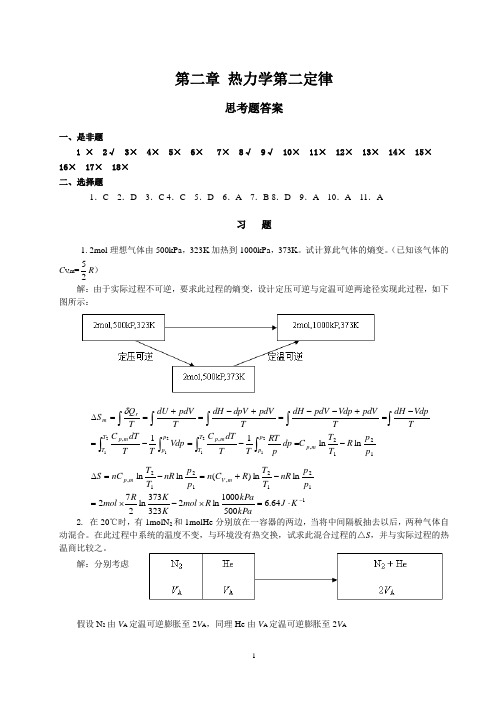
第二章 热力学第二定律思考题答案一、是非题1 × 2√ 3× 4× 5× 6× 7× 8√ 9√ 10× 11× 12× 13× 14× 15× 16× 17× 18× 二、选择题1.C 2.D 3.C 4.C 5.D 6.A 7.B 8.D 9.A 10.A 11.A习 题1. 2mol 理想气体由500kPa ,323K 加热到1000kPa ,373K 。
试计算此气体的熵变。
(已知该气体的C V ,m =25R ) 解:由于实际过程不可逆,要求此过程的熵变,设计定压可逆与定温可逆两途径实现此过程,如下图所示:1212,,,ln ln 1121212121p pR T T C dp p RT T T dT C Vdp TTdT C TVdpdH T pdV Vdp pdV dH T pdV dpV dH TpdVdU T Q S m p p p T T m p p p T T m p rm -=-=-=-=+--=+-=+==∆⎰⎰⎰⎰⎰⎰⎰⎰⎰δ11212,1212,64.65001000ln 2323373ln 272ln ln )(ln ln -⋅=⨯-⨯=-+=-=∆K J kPakPa R mol K K R mol p pnR T T R C n p p nR T T nC S m V m p2. 在20℃时,有1molN 2和1molHe 分别放在一容器的两边,当将中间隔板抽去以后,两种气体自动混合。
在此过程中系统的温度不变,与环境没有热交换,试求此混合过程的△S ,并与实际过程的热温商比较之。
解:分别考虑假设N 2由V A 定温可逆膨胀至2V A ,同理He 由V A 定温可逆膨胀至2V A△S 1 = n (N 2)R ln2 △S 2 = n (He)R ln2所以系统的 △S = △S 1+△S 2 = n (N 2) R ln2 + n (He) R ln2= 2×1mol×8.314 J ·mol -1·K -1×ln2 = 11.52J.K -1而实际过程系统没有与环境交换热和功,则 TQ= 0 即 △S >TQ 3. 1 mol 双原子理想气体,温度为298.15 K ,压强为p θ,分别进行:(1)绝热可逆膨胀至体积增加1倍;(2)绝热自由膨胀至体积增加1倍。
第二章 热力学第二定律 答案

第二章热力学第二定律练习题答案一、判断题答案:1.对。
自然界发生的过程是以一定速率进行的,都是不可逆的,但不一定都是自发的,例如人们用电解水法制备氢气。
2.错。
例如,理想气体绝热不可逆压缩,就不是自发的。
3.错。
只有在孤立体系才成立。
非孤立体系不成立,例如电解水熵增加,但不自发的。
4.第1,2个结论正确,第3个结论错。
绝热不可逆压缩过程。
∆S > 0。
5.错。
系统由同一始态出发,经绝热可逆和绝热不可逆过程不可能到达相同的终态。
经绝热可逆,∆S = 0;绝热不可逆过程,∆S > 0。
6.错。
系统经循环过程后回到始态,状态函数都不改变,但不能依此来判断过程的性质,可逆循环与不循环都可以回到始态。
7.错。
正确说法是隔离系统平衡态的熵最大。
8.错。
正确的是绝热可逆过程中∆S = 0,绝热不可逆过程中∆S > 09.不矛盾。
理想气体经等温膨胀后,是的,吸的热全部转化为功,因气体的状态变化了,体积增大了,发生了其他变化。
10.错。
例如过冷水结冰,自发过程,但熵减少。
只有孤立体系或绝热体系,自发变化过程,∆S > 0。
11.错。
必须可逆相变才能用此公式。
12.错。
系统的熵除热熵外,还有构型熵。
例如NaOH固体溶于水,或C在氧气中燃烧,都是放热,但熵都是增加。
13.对。
固体、液体变成气体,熵是增加的。
14.错。
冰在0℃,pө下转变为液态水,不能认为是自发方程;同样在0℃,pө下液态水也可以变成冰,只能说是可逆过程(或平衡状态)。
15.错。
只有孤立体系才成立,非孤立体系不成立,例如过冷水结冰,ΔS< 0,混乱度减小,自发过程的方向就不是混乱度增加的方向。
16.错,必须在等温、等压的条件下才有此结论。
17.错。
若有非体积功存在,则可能进行,如电解水,吉布斯函数变化大于零。
18.错。
此说法的条件不完善,如在等温条件下,做的功(绝对值)才最多。
19.错。
基本方程对不可逆相变不适用。
20.错。
热力学答案 第二章

28 第二章 均匀物质的热力学性质2.1 已知在体积保持不变时,一气体的压强正比于其热力学温度. 试证明在温度保质不变时,该气体的熵随体积而增加.解:根据题设,气体的压强可表为 (),p f V T = (1)式中()f V 是体积V的函数. 由自由能的全微分dF SdT pdV=--得麦氏关系.T VS p V T ∂∂⎛⎫⎛⎫= ⎪ ⎪∂∂⎝⎭⎝⎭ (2) 将式(1)代入,有 ().T VS p p f V V T T ∂∂⎛⎫⎛⎫===⎪ ⎪∂∂⎝⎭⎝⎭ (3) 由于0,0p T >>,故有0TS V ∂⎛⎫> ⎪∂⎝⎭. 这意味着,在温度保持不变时,该气体的熵随体积而增加.2.2 设一物质的物态方程具有以下形式:(),p f V T =试证明其内能与体积无关.解:根据题设,物质的物态方程具有以下形式: (),p f V T = (1)故有().Vp f V T ∂⎛⎫= ⎪∂⎝⎭ (2) 但根据式(2.2.7),有,T VU p T p V T ∂∂⎛⎫⎛⎫=- ⎪ ⎪∂∂⎝⎭⎝⎭(3)所以()0.TU Tf V p V ∂⎛⎫=-= ⎪∂⎝⎭ (4)这就是说,如果物质具有形式为(1)的物态方程,则物质的内能与体积无关,只是温度T 的函数.2.3 求证:()0;HS a p ⎛⎫∂< ⎪∂⎝⎭()0.US b V ∂⎛⎫> ⎪∂⎝⎭ 解:焓的全微分为 .dH TdS Vdp =+ (1) 令0dH=,得0.HS Vp T ⎛⎫∂=-< ⎪∂⎝⎭ (2) 内能的全微分为 .dU TdS pdV =- (3) 令0dU=,得0.US p V T ∂⎛⎫=> ⎪∂⎝⎭ (4)2.4 已知0T U V ∂⎛⎫=⎪∂⎝⎭,求证0.TU p ⎛⎫∂= ⎪∂⎝⎭解:对复合函数(,)(,(,))U T P U T V T p =(1)求偏导数,有.T T T U U V p V p ⎛⎫⎛⎫∂∂∂⎛⎫= ⎪⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭ (2)如果0TU V ∂⎛⎫=⎪∂⎝⎭,即有0.TU p ⎛⎫∂= ⎪∂⎝⎭ (3) 式(2)也可以用雅可比行列式证明:(,)(,)(,)(,)(,)(,)T U U T p p T U T V T V T p T ⎛⎫∂∂= ⎪∂∂⎝⎭∂∂=∂∂.T TU V V p ⎛⎫∂∂⎛⎫=⎪ ⎪∂∂⎝⎭⎝⎭ (2)292.5 试证明一个均匀物体的在准静态等压过程中熵随体积的增减取决于等压下温度随体积的增减.解:热力学用偏导数pS V ∂⎛⎫⎪∂⎝⎭描述等压过程中的熵随体积的变化率,用pT V ∂⎛⎫⎪∂⎝⎭描述等压下温度随体积的变化率. 为求出这两个偏导数的关系,对复合函数(,)(,(,))S S p V S p T p V ==(1)求偏导数,有.p p p p pC S S T T V T V T V ∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫== ⎪ ⎪ ⎪ ⎪∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭(2) 因为0,0p C T >>,所以p S V ∂⎛⎫ ⎪∂⎝⎭的正负取决于pT V ∂⎛⎫⎪∂⎝⎭的正负.式(2)也可以用雅可经行列式证明:(,)(,)(,)(,)(,)(,)∂∂∂∂⎛⎫== ⎪∂∂∂∂⎝⎭P S S p S p T p V V p T p V p P PS T T V ∂∂⎛⎫⎛⎫= ⎪ ⎪∂∂⎝⎭⎝⎭(2)2.6 试证明在相同的压强降落下,气体在准静态绝热膨胀中的温度降落大于在节流过程中的温度降落.解:气体在准静态绝热膨胀过程和节流过程中的温度降落分别由偏导数S T p ⎛⎫∂ ⎪∂⎝⎭和HT p ⎛⎫∂ ⎪∂⎝⎭描述. 熵函数(,)S T p 的全微分为.P TS S dS dT dp T p ⎛⎫∂∂⎛⎫=+ ⎪ ⎪∂∂⎝⎭⎝⎭ 在可逆绝热过程中0dS=,故有.TP p SPS V T p T T S p C T ⎛⎫∂∂⎛⎫ ⎪ ⎪∂⎛⎫∂∂⎝⎭⎝⎭=-=⎪∂∂⎛⎫⎝⎭ ⎪∂⎝⎭ (1) 最后一步用了麦氏关系式(2.2.4)和式(2.2.8).焓(,)H T p 的全微分为.P TH H dH dT dp T p ⎛⎫∂∂⎛⎫=+ ⎪ ⎪∂∂⎝⎭⎝⎭ 在节流过程中0dH=,故有.T Pp HPH V T V p T T H p C T ⎛⎫∂∂⎛⎫- ⎪ ⎪∂⎛⎫∂∂⎝⎭⎝⎭=-= ⎪∂∂⎛⎫⎝⎭ ⎪∂⎝⎭ (2)最后一步用了式(2.2.10)和式(1.6.6).将式(1)和式(2)相减,得 0.pS H T T V p p C ⎛⎫⎛⎫∂∂-=> ⎪ ⎪∂∂⎝⎭⎝⎭ (3) 所以在相同的压强降落下,气体在绝热膨胀中的温度降落大于节流过程中的温度降落. 这两个过程都被用来冷却和液化气体.由于绝热膨胀过程中使用的膨胀机有移动的部分,低温下移动部分的润滑技术是十分困难的问题,实际上节流过程更为常用. 但是用节流过程降温,气体的初温必须低于反转温度. 卡皮查(1934年)将绝热膨胀和节流过程结合起来,先用绝热膨胀过程使氦降温到反转温度以下,再用节流过程将氦液化.2.7 实验发现,一气体的压强p 与体积V 的乘积以及内能U 都只是温度的函数,即(),().pV f T U U T ==试根据热力学理论,讨论该气体的物态方程可能具有什么形式.解:根据题设,气体具有下述特性:(),pV f T = (1)().U U T = (2)由式(2.2.7)和式(2),有0.T VU p T p V T ∂∂⎛⎫⎛⎫=-= ⎪ ⎪∂∂⎝⎭⎝⎭(3)而由式(1)可得30 .Vp T df T T V dT ∂⎛⎫= ⎪∂⎝⎭ (4) 将式(4)代入式(3),有,dfTf dT= 或.df dT f T= (5) 积分得ln ln ln ,f T C =+或,pV CT = (6)式中C 是常量. 因此,如果气体具有式(1),(2)所表达的特性,由热力学理论知其物态方程必具有式(6)的形式. 确定常量C 需要进一步的实验结果.2.8 证明2222,,p V T Vp TC C p V T T V T p T ∂⎛⎫⎛⎫⎛⎫∂∂∂⎛⎫==- ⎪ ⎪ ⎪ ⎪∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭并由此导出00220022,.⎛⎫⎛⎫∂∂=+=- ⎪ ⎪∂∂⎝⎭⎝⎭⎰⎰VpV V p p V p V pp p C C T dV C C T dp T T根据以上两式证明,理想气体的定容热容量和定压热容呈只是温度T 的函数.解:式(2.2.5)给出.V VS C T T ∂⎛⎫= ⎪∂⎝⎭ (1)以T ,V 为状态参量,将上式求对V 的偏导数,有2222,V T VC S S S T T T V V T T V T ⎛⎫⎛⎫⎛⎫∂∂∂∂⎛⎫===⎪ ⎪ ⎪ ⎪∂∂∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭ (2)其中第二步交换了偏导数的求导次序,第三步应用了麦氏关系(2.2.3). 由理想气体的物态方程 pV nRT =知,在V 不变时,p 是T 的线性函数,即220.Vp T ⎛⎫∂= ⎪∂⎝⎭ 所以 0.V TC V ∂⎛⎫=⎪∂⎝⎭ 这意味着,理想气体的定容热容量只是温度T 的函数. 在恒定温度下将式(2)积分,得0202.VV VV Vp C C T dV T ⎛⎫∂=+ ⎪∂⎝⎭⎰ (3)式(3)表明,只要测得系统在体积为0V 时的定容热容量,任意体积下的定容热容量都可根据物态方程计算出来.同理,式(2.2.8)给出.p pS C T T ∂⎛⎫= ⎪∂⎝⎭ (4)以,T p 为状态参量,将上式再求对p 的偏导数,有2222.p p TC S S S T T T p p T T p T ∂⎛⎫⎛⎫⎛⎫⎛⎫∂∂∂===- ⎪ ⎪ ⎪ ⎪∂∂∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭(5)其中第二步交换了求偏导数的次序,第三步应用了麦氏关系(2.2.4). 由理想气体的物态方程pV nRT =知,在p 不变时V是T 的线性函数,即220.pV T ⎛⎫∂= ⎪∂⎝⎭ 所以0.p TC p ∂⎛⎫= ⎪∂⎝⎭ 这意味着理想气体的定压热容量也只是温度T 的函数. 在恒定温度下将式(5)积分,得 0202.pp pp pV C C T dp T ⎛⎫∂=+ ⎪∂⎝⎭⎰式(6)表明,只要测得系统在压强为0p 时的定压热容量,任意31压强下的定压热容量都可根据物态方程计算出来.2.9 证明范氏气体的定容热容量只是温度T 的函数,与比体积无关.解:根据习题2.8式(2)22,V T VC p T V T ⎛⎫∂∂⎛⎫= ⎪ ⎪∂∂⎝⎭⎝⎭ (1) 范氏方程(式(1.3.12))可以表为22.nRT n a p V nb V=-- (2)由于在V 不变时范氏方程的p 是T 的线性函数,所以范氏气体的定容热容量只是T 的函数,与比体积无关.不仅如此,根据2.8题式(3)0202(,)(,),VV V V Vp C T V C T V T dV T ⎛⎫∂=+ ⎪∂⎝⎭⎰(3)我们知道,V →∞时范氏气体趋于理想气体. 令上式的0V →∞,式中的0(,)V C T V 就是理想气体的热容量. 由此可知,范氏气体和理想气体的定容热容量是相同的.顺便提及,在压强不变时范氏方程的体积V 与温度T 不呈线性关系. 根据2.8题式(5)22,V T VC p V T ⎛⎫∂∂⎛⎫= ⎪ ⎪∂∂⎝⎭⎝⎭ (2) 这意味着范氏气体的定压热容量是,T p 的函数.2.10 证明理想气体的摩尔自由能可以表为,,00,002ln ln =⎰+-⎰--=-⎰⎰+--V m m V m m m m V m m m mC dTF C dT U T dT RT V TS T C dT U TS RT V TT解:式(2.4.13)和(2.4.14)给出了理想气体的摩尔吉布斯函数作为其自然变量,T p 的函数的积分表达式. 本题要求出理想气体的摩尔自由能作为其自然变量,m T V 的函数的积分表达式. 根据自由能的定义(式(1.18.3)),摩尔自由能为,m m m F U TS =- (1)其中m U 和mS 是摩尔内能和摩尔熵. 根据式(1.7.4)和(1.15.2),理想气体的摩尔内能和摩尔熵为,0,m V m m U C dT U =+⎰ (2),0ln ,V m mm m C S dT R V S T=++⎰ (3)所以,,00ln .V m m V m m m m C F C dT T dT RT V U TS T=--+-⎰⎰(4)利用分部积分公式,xdy xy ydx =-⎰⎰令,1,,==⎰V m x y C dT T可将式(4)右方头两项合并而将式(4)改写为,002ln .m V mm m m dTF T C dT RT V U TS T=--+-⎰⎰ (5)2.11 求范氏气体的特性函数m F ,并导出其他的热力学函数.解:考虑1mol 的范氏气体. 根据自由能全微分的表达式(2.1.3),摩尔自由能的全微分为 ,m m m dF S dT pdV =-- (1)故2,m m m m TF RT ap V V b V ⎛⎫∂=-=-+ ⎪∂-⎝⎭ (2) 积分得()(),ln ().m m m maF T V RT V b f T V =---+ (3)由于式(2)左方是偏导数,其积分可以含有温度的任意函数()f T . 我们利用V →∞时范氏气体趋于理想气体的极限条件定出函数()f T . 根据习题2.11式(4),理想气体的摩尔自32 由能为,,00ln .V m m V m m m m C F C dT dT RT V U TS T=--+-⎰⎰(4)将式(3)在m V →∞时的极限与式(4)加以比较,知,,00().V m V m m m C f T C dT T dT U TS T=-+-⎰⎰(5)所以范氏气体的摩尔自由能为()(),,00,ln .V m m m V m m m m m C a F T V C dT T dT RT V b U TS TV =----+-⎰⎰(6)式(6)的(),mm F T V 是特性函数范氏气体的摩尔熵为(),0ln .V m m m m m C F S dT R V b S T T ∂=-=+-+∂⎰(7)摩尔内能为,0.m m m V m m maU F TS C dT U V =+=-+⎰(8)2.15 计算热辐射在等温过程中体积由1V 变到2V 时所吸收的热量.解:根据式(1.14.3),在可逆等温过程中系统吸收的热量为.Q T S =∆ (1)式(2.6.4)给出了热辐射的熵函数表达式34.3S aT V =(2) 所以热辐射在可逆等温过程中体积由1V 变到2V 时所吸收的热量为 ()4214.3Q aT V V =- (3)2.16 试讨论以平衡辐射为工作物质的卡诺循环,计算其效率. 解:根据式(2.6.1)和(2.6.3),平衡辐射的压强可表为41,3p aT = (1)因此对于平衡辐射等温过程也是等压过程. 式(2.6.5)给出了平衡辐射在可逆绝热过程(等熵过程)中温度T 与体积V 的关系3().T V C =常量(2)将式(1)与式(2)联立,消去温度T ,可得平衡辐射在可逆绝热过程中压强p 与体积V的关系43pV C '=(常量). (3)下图是平衡辐射可逆卡诺循环的p V-图,其中等温线和绝热线的方程分别为式(1)和式(3).下图是相应的TS -图. 计算效率时应用T S -图更为方便.在由状态A 等温(温度为1T )膨胀至状态B 的过程中,平衡辐射吸收的热量为()1121.Q T S S =- (4)在由状态C 等温(温度为2T )压缩为状态D 的过程中,平衡辐射放出的热量为()2221.Q T S S =-循环过程的效率为()()2212211211111.T S S Q T Q T S S T η-=-=-=-- (6)2.18 试证明磁介质H C 与M C 之差等于3320H M M TH M C C T T H μ∂∂⎛⎫⎛⎫-= ⎪ ⎪∂∂⎝⎭⎝⎭解:当磁介质的磁化强度有dM 的改变时,外界所做的功是0đ,W V HdM μ=(1)式中H 是电场强度,V 是介质的体积.不考虑介质体积的改变,V 可看作常量. 与简单系统đW pdV =-比较,在变换0p H,V VM μ→-→(2)下,简单系统的热力学关系同样适用于磁介质. 式(2.2.11)给出.p V V pp V C C T T T ∂∂⎛⎫⎛⎫-= ⎪ ⎪∂∂⎝⎭⎝⎭ (3)在代换(2)下,有0H M M HH M C C T T T μ∂∂⎛⎫⎛⎫-=- ⎪ ⎪∂∂⎝⎭⎝⎭(4)式中H C 是磁场强度不变时介质的热容量,M C 是磁化强度不变时介质的热容量. 考虑到1H M TM T H T H M ∂∂∂⎛⎫⎛⎫⎛⎫=- ⎪ ⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭ (5)(5)式解出HM T ∂⎛⎫⎪∂⎝⎭,代入(4)式,得 20H M M TH M C C T T H μ∂∂⎛⎫⎛⎫-= ⎪ ⎪∂∂⎝⎭⎝⎭2.19 已知顺磁物质遵从居里定律:().CM H T=居里定律 若维物质的温度不变,使磁场由0增至H ,求磁化热.解:式(1.14.3)给出,系统在可逆等温过程中吸收的热量Q 与其在过程中的熵增加值∆S 满足.Q T S =∆ (1)在可逆等温过程中磁介质的熵随磁场的变化率为(式(2.7.7))0.T HS m H T μ∂∂⎛⎫⎛⎫= ⎪ ⎪∂∂⎝⎭⎝⎭ (2)如果磁介质遵从居里定律(),CVm H C T=是常量 (3) 易知2Hm CV H T T ∂⎛⎫=- ⎪∂⎝⎭, (4) 所以0.TCV H S H T μ∂⎛⎫=- ⎪∂⎝⎭2(5) 在可逆等温过程中磁场由0增至H 时,磁介质的熵变为202.2HTCV H S S dH H T μ∂⎛⎫∆==- ⎪∂⎝⎭⎰(6)吸收的热量为20.2CV H Q T S Tμ=∆=- (7)补充题1 温度维持为25C,压强在0至1000n p 之间,测得水的实验数据如下:()363114.510 1.410cm mol K .pV p T ----∂⎛⎫=⨯+⨯⋅⋅ ⎪∂⎝⎭ 若在25C的恒温下将水从1n p 加压至1000n p ,求水的熵增加值和从外界吸收的热量.解:将题给的pV T ∂⎛⎫⎪∂⎝⎭记为.pV a bp T ∂⎛⎫=+ ⎪∂⎝⎭ (1) 由吉布斯函数的全微分dG SdT Vdp =-+得麦氏关系34.p TV S T p ⎛⎫∂∂⎛⎫=- ⎪ ⎪∂∂⎝⎭⎝⎭ (2) 因此水在过程中的熵增加值为()222111∂∂⎛⎫⎛⎫∆==-=-+ ⎪ ⎪∂∂⎝⎭⎝⎭⎰⎰⎰p p p P p p Tp S V S dp dp a bp dp P T ()()222121.2b a p p p p ⎡⎤=--+-⎢⎥⎣⎦(3)将11,1000n n n p p p p ==代入,得110.527J mol K .S --∆=-⋅⋅根据式(1.14.4),在等温过程中水从外界吸收的热量Q 为 ()112980.527J mol 157J mol .Q T S--=∆=⨯-⋅=-⋅补充题2 试证明范氏气体的摩尔定压热容量与摩尔定容热容量之差为(),,23.21p m V m m m R C C a V b V RT-=--解:根据式(2.2.11),有,,.m m p m V m V pV p C C T T T ∂∂⎛⎫⎛⎫-= ⎪ ⎪∂∂⎝⎭⎝⎭ (1)由范氏方程2m mRT ap V b V =--易得()232,.⎛⎫∂∂⎛⎫==-+ ⎪ ⎪∂-∂⎝⎭-⎝⎭m V m m mT m p R p RT a T V b V V V b(2)但1,m m V m Tp V p T T V p ⎛⎫⎛⎫∂∂∂⎛⎫=-⎪ ⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭ 所以()()323,2∂⎛⎫⎪∂-⎝⎭∂⎛⎫=-= ⎪∂⎛⎫∂⎝⎭-- ⎪∂⎝⎭m V m m m p m m m Tp T RV V b V T p RTV a V b V(3)代入式(1),得 (),,23.21p mV m m mR C C a V b RTV -=--(4)补充题3 承前1.6和第一章补充题3,试求将理想弹性体等温可逆地由0L 拉长至02L 时所吸收的热量和内能的变化.解:式(2.4.4)给出,以,T V 为自变量的简单系统,熵的全微分为.V VC p dS dT dV T T ∂⎛⎫=+ ⎪∂⎝⎭ (1) 对于本题的情形,作代换 ,,V L p →→-J (2)即有.L LJ TdS C dT T dL T ∂⎛⎫=- ⎪∂⎝⎭ (3)将理想弹性体等温可逆地由0L 拉长至02L 时所吸收的热量Q 为2.L L LQ TdS T dL T ∂⎛⎫==- ⎪∂⎝⎭⎰⎰J (4) 由2020L L J bT L L ⎛⎫=- ⎪⎝⎭可得220002200021,L L L dL J L L b bT T L L L L L dT ⎛⎫⎛⎫∂⎛⎫=--+ ⎪ ⎪ ⎪∂⎝⎭⎝⎭⎝⎭(5)代入式(4)可得0002222200022002L L L L L L L L Q bT dL bT a dL L L L L ⎛⎫⎛⎫=--++ ⎪ ⎪⎝⎭⎝⎭⎰⎰350051,2bTL a T ⎛⎫=-- ⎪⎝⎭(6) 其中001.dL L dTα=过程中外界所做的功为2220020,L L L L L L W JdL bT dL bTL L L ⎛⎫==-= ⎪⎝⎭⎰⎰(7) 故弹性体内能的改变为2005.2U W Q bT L α∆=+= (8)补充题4 承上题. 试求该弹性体在可逆绝热过程中温度随长度的变化率.解:上题式(3)已给出.L LJ TdS C dT T dL T ∂⎛⎫=- ⎪∂⎝⎭ (1)在可逆绝热过程中0dS =,故有.S L L T T J L C T ∂∂⎛⎫⎛⎫= ⎪ ⎪∂∂⎝⎭⎝⎭(2)将习题2.15式(5)求得的LJ T ∂⎛⎫⎪∂⎝⎭代入,可得2200022002.S L L L T bT L L T L C L L L L α⎡⎤⎛⎫⎛⎫∂⎛⎫=--+⎢⎥ ⎪ ⎪ ⎪∂⎝⎭⎝⎭⎝⎭⎣⎦(3)补充题5 实验测得顺磁介质的磁化率()T χ. 如果忽略其体积变化,试求特性函数(,)f M T ,并导出内能和熵.解:在磁介质的体积变化可以忽略时,单位体积磁介质的磁化功为(式(2.7.2))0đ.W HdM μ= (1)其自由能的全微分为0.df SdT MdM μ=-+将()χ=T M H代入,可将上式表为.Mdf SdT dM μχ=-+ (2)在固定温度下将上式对M 积分,得20(,)(,0).2()M f T M f T T μχ=+ (3)(,)f T M 是特性函数. 单位体积磁介质的熵为(),MS f T M T ∂⎡⎤=-⎢⎥∂⎣⎦2021(,0).2d M S T dTμχχ=+ (4)单位体积的内能为220002.22M d U f TS M T U dTμμχχχ=+=++ (5)。
热力学第二版习题答案(全)

PD
F-
XC
h a n g e Vi e
w
F-
XC
h a n g e Vi e
w
er
er
!
O W
N
y
bu
to
m
w
.d o
c u -tr
. ack
c
w
o
.d o
c u -tr a c k
.c
习题: 2-1.为什么要研究流体的 pVT 关系? 答:在化工过程的分析、研究与设计中,流体的压力 p、体积 V 和温度 T 是流体最基本的性 质之一,并且是可以通过实验直接测量的。而许多其它的热力学性质如内能 U、熵 S、Gibbs 自由能 G 等都不方便直接测量, 它们需要利用流体的 p –V –T 数据和热力学基本关系式进行 推算;此外,还有一些概念如逸度等也通过 p –V –T 数据和热力学基本关系式进行计算。因 此,流体的 p –V –T 关系的研究是一项重要的基础工作。 2-2.理想气体的特征是什么? 答:假定分子的大小如同几何点一样,分子间不存在相互作用力,由这样的分子组成的气体 叫做理想气体。严格地说,理想气体是不存在的,在极低的压力下,真实气体是非常接近理 想气体的,可以当作理想气体处理,以便简化问题。 理想气体状态方程是最简单的状态方程:
pV RT
2-3.偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗? 答:纯物质的偏心因子 是根据物质的蒸气压来定义的。实验发现,纯态流体对比饱和蒸 气压的对数与对比温度的倒数呈近似直线关系,即符合:
1 log p 1 T r
s r
ps 其中, p pc
迭代结果为: V 3.39m 3 kmol 1 (2) 压缩功 W pdV
工程热力学 课后习题答案 可打印 第三版 第二章

第二章 热力学第一定律
2-1 一辆汽车 1 小时消耗汽油 34.1 升,已知汽油发热量为 44000kJ/kg ,汽油密度 0.75g/cm3 。
测得该车通过车轮出的功率为 64kW,试求汽车通过排气,水箱散热等各种途径所放出的热量。
解: 汽油总发热量 Q = 34.1×10 −3m3 × 750kg/m3 × 44000kJ/kg = 1125300kJ
汽车散发热量 Qout = Q −W × 3600 = (1125300 − 64× 3600)kJ/h = 894900kJ/h
2-2 1kg 氧气置于图 2-13 所示气缸内,缸壁能充分导热,且活塞与缸壁无磨擦。初始时氧气压
力为 0.5MPa,温度为 27℃,若气缸长度 2 l ,活塞质量为 10kg。试计算拔除钉后,活塞可能
即每生产 1 公斤压缩空气所需技术功为 252kJ。
(3)压气机每分钟生产压缩空气 10kg,即1/ 6kg/s ,故带动压气机的电机功率为
N
=
q m wt
=
1 6
kg/s × 252kJ/kg
=
42kW
9
第二章 热力学第二定律
2-10 某蒸汽动力厂中锅炉以 40T/h 的蒸汽供入蒸汽轮机。进口处压力表上读数是 9MPa ,蒸 汽的焓是 3441kJ/kg 。蒸汽轮机出口处真空表上的读数是 0.0974MPa ,出口蒸汽的焓是
的室内空气每小时温度的升高值,已知空气的热力学能与温度关系为 ∆u = 0.72∆TkJ/kg 。
解 室内空气总质量 m = pV = 0.1×106 Pa ×15m2 × 3.0m = 52.06kg RgT 287J/(kg ⋅ K) × (28 + 273.15)K
热力学统计物理 课后习题 答案

则顶点在球心的立体角d,在太阳表面所张的面积为R2SUN d。
假设太阳是黑体,则根据斯特藩-玻耳兹曼定律,得到单位时间内在立
体角内辐射的太阳辐射能量为 T4 R2SUN d
第二步:题设给出单位时间内,投射到地球大气层外单位面积上的太阳
辐射能量为JSE=1.35103Jm-2s-1(该值称为太阳常数),
式子中的f(V)是体积V的函数.
故有 (2)
根据(2.2.7)式,在温度保持不变时,内能随体积的变化率与物态方程
的关系
(3)
得 (4)
说明:如果物质具有形式为P=f(V)T 的物态方程,则物质的内能与体积
无关,只是温度T的函数。
2.4 求证:1 2
解:1焓的全微分为 (1-1)
令=0,得 (1-2)
第二章 均匀物质的热力学性质
2.1温度维持为250C,压强在0至1000Pn之间,测得的水的实验数据如
下:
若在250C的恒温下,将水从1 Pn加压至1000Pn,求水的熵增和从外界
吸收的热量。
解:将题设定为=A+BP (1)
由吉布斯函数G的全微分dG= SdT+VdP
得麦氏关系
(2)
因此
(3)
将P1=1 Pn,P2=1000 Pn,代入得 S= 0.527Jmol1K1
和 描述。
熵函数的全微分为
在可逆绝热过程中=0有
焓H(T,P)的全微分为
节流过程中=0有 (2)
式(1)和式(2)相减,得
2.9证明,,并由此推出
和。
根据以上两式证明,理想气体的定容热容量和定压热容量只是温度T的
函数。
解:式
(1)
以T,V 状态参量,将上式求对V的偏导数,
物理化学 第五版 答案02 热力学第一定律习题解答

湖北民院化环院——天大教材——热力学第一定律课外练习解答
ο 查表得 Δ f H m (H 2 O,g) -241.818kJ mol 1 ο ο H1 =Δ r H m Δf H m (H 2 O,g) 1mol -241.818kJ
子气体
Cv,m 2.5R , Cv, p 3.5R , C p ,m / Cv,m 1.4 ,
1
碳 ( CO2,
g ) 的 标 准 摩 尔 生 成 焓
o f Hm
分 别 为
1molH2 O
(2)
424.72kJ mol1、 285.83kJ mol1、 309.509kJ mol1 。应用这些数据求 25℃时下列
0.25 molO 2 2.8214 molN 2 25 ο C,100kPa
根据热力学第一定律
氮气: n ( N 2 ) 0.79 3.5714mol 2.8214mol 剩余氧气: n (O 2 ) (0.21 3.5714 0.5)mol 0.25mol
1molH 2 0.75molO 2 2.8214 molN 2 25 C,100kPa (1)
W , Q , H , U 。
3
HCOOH(l )+2O2 (g)=2H 2O(l )+2CO 2 (g)
o o o o c Hm (HCOOCH3 , l ) 2 f H m (CO 2 , g ) 2 f H m (H 2 O, l ) f H m (HCOOCH 3 , l )
T2
T3
由于 p1V1 p2V2 ,则 T3 T1 ,对有理想气体ΔH 和ΔU 只是温度的函数 ΔH=ΔU=0 该途径只涉及恒容和恒压过程,因此计算功是方便的
02习题及答案

第二章热力学第一定律思考题1设有一电炉丝浸于水中,接上电源,通过电流一段时间。
如果按下列几种情况作为系统,试问ΔU,Q,W为正为负还是为零?(1)以电炉丝为系统;(2)以电炉丝和水为系统;(3)以电炉丝、水、电源及其它一切有影响的部分为系统。
2设有一装置如图所示,(1)将隔板抽去以后,以空气为系统时,ΔU,Q,W为正为负还是为零?(2)如右方小室亦有空气,不过压力较左方小,将隔板抽去以后,以所有空气为系统时,ΔU,Q,W为正为负还是为零?作业题1 (1)如果一系统从环境接受了160J的功,内能增加了200J,试问系统将吸收或是放出多少热?(2)一系统在膨胀过程中,对环境做了10 540J的功,同时吸收了27 110J的热,试问系统的内能变化为若干?[答案:(1) 吸收40J;(2) 16 570J] 2在一礼堂中有950人在开会,每个人平均每小时向周围散发出4.2xl05J的热量,如果以礼堂中的空气和椅子等为系统,则在开会时的开始20分钟内系统内能增加了多少?如果以礼堂中的空气、人和其它所有的东西为系统,则其ΔU=?[答案:1.3×l08J;0] 3一蓄电池其端电压为12V,在输出电流为10A下工作2小时,这时蓄电池的内能减少了1 265 000J,试求算此过程中蓄电池将吸收还是放出多少热?[答案:放热401000J]4 体积为4.10dm3的理想气体作定温膨胀,其压力从106Pa降低到105Pa,计算此过程所能作出的最大功为若干?[答案:9441J]5 在25℃下,将50gN2作定温可逆压缩,从105Pa压级到2×106Pa,试计算此过程的功。
如果被压缩了的气体反抗恒定外压105Pa作定温膨胀到原来的状态,问此膨胀过程的功又为若干?[答案:–1.33×104J;4.20×103J]6 计算1mol理想气体在下列四个过程中所作的体积功。
已知始态体积为25dm3终态体积为100dm3;始态及终态温度均为100℃。
大学物理化学2-热力学第二定律课后习题及答案

热力学第二定律课后习题答案习题1在300 K ,100 kPa 压力下,2 mol A 和2 mol B 的理想气体定温、定压混合后,再定容加热到600 K 。
求整个过程的∆S 为若干?已知C V ,m ,A = 1.5 R ,C V ,m ,B = 2.5 R[题解]⎪⎩⎪⎨⎧B(g)2mol A(g)2mol ,,纯态 3001001K kPa,()−→−−−−混合态,,2mol A 2mol B100kPa 300K 1+==⎧⎨⎪⎪⎩⎪⎪p T 定容()−→−−2混合态,,2mol A 2mol B 600K 2+=⎧⎨⎪⎩⎪T ∆S = ∆S 1 + ∆S 2,n = 2 mol∆S 1 = 2nR ln ( 2V / V ) = 2nR ln2 ∆S 2 = ( 1.5nR + 2.5nR ) ln (T 2 / T 1)= 4nR ln2 所以∆S = 6nR ln2= ( 6 ⨯ 2 mol ⨯ 8.314 J ·K -1·mol -1 ) ln2 = 69.15 J ·K -1 [导引]本题第一步为理想气体定温定压下的混合熵,相当于发生混合的气体分别在定温条件下的降压过程,第二步可视为两种理想气体分别进行定容降温过程,计算本题的关键是掌握理想气体各种变化过程熵变的计算公式。
习题22 mol 某理想气体,其定容摩尔热容C v ,m =1.5R ,由500 K ,405.2 kPa 的始态,依次经历下列过程:(1)恒外压202.6 kPa 下,绝热膨胀至平衡态; (2)再可逆绝热膨胀至101.3 kPa ; (3)最后定容加热至500 K 的终态。
试求整个过程的Q ,W ,∆U ,∆H 及∆S 。
[题解] (1)Q 1 = 0,∆U 1 = W 1, nC V ,m (T 2-T 1))(1122su p nRT p nRT p --=, K400546.2022.405)(5.11221211212====-=-T T kPa p kPa p T p T p T T ,得,代入,(2)Q 2 = 0,T T p p 3223111535325=-=-=--()γγγγ,, T T 320.42303==-()K(3)∆V = 0,W 3 = 0,Q U nC T T V 3343232831450030314491==-=⨯⨯⨯-=∆,()[.(.)].m J kJp p T T 434350030310131671==⨯=(.).kPa kPa 整个过程:Q = Q 1 + Q 2+ Q 3 =4.91kJ ,∆U = 0,∆H = 0,Q + W = ∆U ,故W =-Q =-4.91 kJ∆S nR p p ==⨯=--ln (.ln ..).141128314405616711475J K J K ··[导引]本题的变化过程为单纯pVT 变化,其中U 、H 和S 是状态函数,而理想气体的U 和H 都只是温度的函数,始终态温度未变,故∆U = 0,∆H = 0。
工程热力学课后答案--华自强张忠进(第三版)pdf下载H02

第二章 热力学第一定律2-1 一辆汽车在1.1 h 内消耗汽油37.5 L ,已知通过车轮输出的功率为64 kW ,汽油的发热量为44 000 kJ/kg ,汽油的密度为0.75 g/cm 3,试求汽车通过排气、水箱散热及机件的散热所放出的热量。
解 37.5 L=33cm 105.37×消耗汽油量kg 13.281075.01037.533=×××=−m 汽油燃烧发出的热量kJ 10238.10044013.2861×=×=Q1.1小时内汽车发出功kJ/h 1053.203606450×=×=W所以通过排气、机件散热所发出的热量kJ 1084.91053.210238.15562×=×−×=Q2-2 一台工业用蒸汽动力装置,每小时能生产11 600 kg 蒸汽,而蒸汽在汽轮机中膨胀作功输出的功率为3 800 kW 。
如果该装置每小时耗煤1 450 kg ,煤的发热量为30 000 kJ/kg ,而在锅炉中水蒸气吸收的热量为2 550 kJ/kg 。
试求:(1)锅炉排出废烟气带走的能量;(2)汽轮机排出乏汽带走的能量。
解(1) 每小时该装置煤的发热量kJ/h 1043500300014551×=×=Q每小时锅炉中水蒸汽吸热kJ/h 108.29502550011652×=×=Q·14· 热力学第一定律 所以废气带走的热量5521g 108.29510435×−×=−=Q Q QkJ/h 10392.17×=(2)每小时汽轮机输出功kJ/h 108.1363600380050×=×=W所以乏汽带走的能量5502w 108.136108.295×−×=−=W Q WkJ/h 1059.17×=2-3 夏日室内使用电扇纳凉,电扇的功率为0.5 kW ,太阳照射传入的热量为0.5 kW 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第2章 热力学第一定律
2-1 定量工质,经历了下表所列的4个过程组成的循环,根据热力学第一定律和状态参数的特性填充表中空缺的数据。
过程 Q/ kJ W/ kJ
△U/ kJ
1-2 0 100 -100
2-3
-110
80 -190
3-4 300 90 210 4-1 20 -60
80
2-2 一闭口系统从状态1沿过程123到状态3,对外放出47.5 kJ 的热量,对外作功为
30 kJ ,如图2-11所示。
(1) 若沿途径143变化时,系统对外作功为6 kJ ,求过程中系统与外界交换的热量; (2) 若系统由状态3沿351途径到达状态1,外界对系统作功为15 kJ ,求该过程与外界
交换的热量;
(3) 若U 2=175 kJ ,U 3=87.5 kJ ,求过程2-3传递的热量,及状态1的热力学能U 1。
图2-11 习题2-2
解:(1)根据闭口系能量方程,从状态1沿途径123变化到状态3时,12313123Q U W −=∆+,
得1347.5kJ 30kJ 77.5kJ U −∆=−−=−
从状态1沿途径143变化到状态3时,热力学能变化量13U −∆保持不变,由闭口系能量方程14313143Q U W −=∆+,得14377.5kJ 6kJ 71.5kJ Q =−+=−,即过程中系统向外界放热71.5kJ
(2)从状态3变化到状态1时,()31133113U U U U U U −−∆=−=−−=−∆,由闭口系能量方程35131351Q U W −=∆+,得35177.5kJ 15kJ 62.5kJ Q =−=,即过程中系统从外界吸热92.5kJ
(3)从状态2变化到状态3体积不变,3
23232323232
Q U W U pdV U −−−=∆+=∆+=∆∫
,
因此23233287.5kJ 175kJ 87.5kJ Q U U U −=∆=−=−=−
由1331187.577.5kJ U U U U −∆=−=−=−,得1165kJ U =
2-3 某电站锅炉省煤器每小时把670t 水从230℃加热到330℃,每小时流过省煤器的烟气的量为710t ,烟气流经省煤器后的温度为310℃,已知水的质量定压热容为 4.1868 kJ/(kg ·K),烟气的质量定压热容为1.034 kJ/(kg ·K),求烟气流经省煤器前的温度。
解:设烟气流经省煤器前的温度为t ℃,对省煤器列能量平衡方程:
c m t c m t ∆=∆水水水烟烟烟,4.1868670(330230) 1.034710(310)t ××−=××−
m
2-7 某实验室用如图2-12的电加热装置来测量空气的质量流量。
已知加热前后空气的温度分别为t 1=20℃,t 2=25.5℃,电加热器的功率为800W 。
假设空气的平均定压质量比热容为c pm =1.005kJ/(kg ·K ),试求每分钟空气的质量流量。
图2-12 习题2-7
解:列能量平衡方程,()3
1.0051025.52080060
m
q ××
×−=
2-9 某发电厂一台发电机的功率为25 000kW ,燃用发热量为27 800kJ/kg 的煤,该发电
机组的效率32%。
求:(1)该机组每昼夜消耗多少吨煤?(2)每发一度电要消耗多少千克煤(1度电=1kW •h=3 600kJ )? 解:(1)煤消耗量为
25000kW
2.81kg/s 242.8t/d 27800kJ/kg 32%
==×,即每昼夜消耗煤242.8吨
(2)每发一度电消耗煤为
3600kJ
0.4047kg
27800kJ/kg32%
=
×
,即发一度电要消耗发热量
为27800kJ/kg的煤404.7克
2-10 某机组汽轮机高压缸进口蒸汽的焓值为3461kJ/kg,出口焓为3073kJ/kg,蒸汽流量为380t/h,求该汽轮机高压缸产生的功率。
解:汽轮机高压缸产生的功率为:
67
空气的质量定压热容分别为5.204 kJ/(kg·K)、4.1868 kJ/(kg·K)和1.004 kJ/(kg·K)。
