实验二醋酸解离常数的测定
醋酸解离常数的测定

pH值测定:按由稀到浓,测各溶液pH值。
1
2
3
4
5
pH计的使用
1
2
3
4
5
打开 预热
功能 档指
用 pH=6.86
用 pH=4.00
测待测 液pH。
pH,
标准
标准缓
温度
缓冲
冲
补
溶液
溶液调
10~20min。 偿至待 测液
调定 位钮
节 斜率使
顺序 1,2,3,4,5。
注意:调节好后定位温及度斜,率钮在整个使测显定示过程中不动显;示电极洗净擦干放入待测液。 斜率
一、实验目的
1 掌握测定醋酸解离度和解离常数的方法。 2 了解酸度计的工作原理,学习使用pH计。
二、实验原理
醋酸(HAc)是弱电解质,在水溶液中存在以 下电离平衡: HAc+H2O H3O+ +Ac
c c Kaθ
=
[H3O+ ][Ac [HAc]
]0
[H ]2
c0
[H eq
]
c0
0[H+ ]
0
100
VHAc /mL VNaOH(终)/mL VNaOH(初)/mL VNaOH/mL
cHAc/mol L-1 cHAc/mol L-1
di
d /% r
Ⅰ 25.00
Ⅱ 25.00
dr 0.3
Ⅲ 25.00
2、不同浓度HAc溶液的配制和pH值测定
体H积A 在小烧杯(洁
c
浓度醋酸溶液。
配制:按下表中加入HAc和H2O的 净、干燥)中配制不同
100%。
pH=6.86。
pH=4.00。
醋酸解离常数的测定实验报告

醋酸解离常数的测定实验报告醋酸解离常数的测定实验报告引言:醋酸是一种常见的有机酸,广泛应用于食品、医药、化妆品等领域。
醋酸的解离常数是衡量其酸性强弱的重要指标,也是研究其化学性质的基础。
本实验旨在通过测定醋酸的电导率,计算出其解离常数,从而探究醋酸的酸性特性。
实验步骤:1. 实验前准备:准备所需的实验器材和试剂,包括电导仪、电导池、醋酸溶液、去离子水等。
2. 样品制备:取适量的醋酸溶液,用去离子水稀释至一定浓度,以保证实验的准确性和可重复性。
3. 测定电导率:将电导池浸入稀释后的醋酸溶液中,打开电导仪,记录电导率的数值。
为了提高实验的准确性,需重复测量多次,取平均值。
4. 数据处理:根据电导率的测定结果,利用电导率与浓度之间的关系,计算出醋酸的解离度。
实验结果与分析:根据实验测得的电导率数据,我们可以计算出醋酸的解离度。
解离度是指溶液中解离物的浓度与总浓度之比,可以用来表示酸性的强弱。
根据测定的电导率和浓度数据,我们可以得到醋酸溶液的电导率与浓度之间的线性关系,进而推算出醋酸的解离度。
通过计算,我们得到了醋酸的解离常数。
解离常数是描述酸或碱在溶液中解离程度的指标,它越大表示酸性或碱性越强。
醋酸的解离常数可以用来评价其酸性的强弱,也可以作为比较不同酸的酸性强弱的依据。
实验误差与改进:在实验过程中,可能会存在一些误差,如仪器误差、操作误差等。
为了减小误差,可以采取以下改进措施:1. 保持实验环境的稳定,避免温度和湿度的变化对实验结果的影响。
2. 严格控制实验操作的步骤和时间,避免操作不当导致误差的产生。
3. 增加重复实验次数,取平均值,提高实验结果的可靠性。
结论:通过本实验测定,我们成功得到了醋酸的解离常数。
该实验结果可为研究醋酸的酸性特性提供重要依据。
同时,本实验还展示了电导率测定方法在化学实验中的应用,为进一步研究酸碱性质提供了思路和方法。
总结:本实验通过测定醋酸的电导率,计算出其解离度,进而得到醋酸的解离常数。
醋酸解离常数的测定实验报告数据
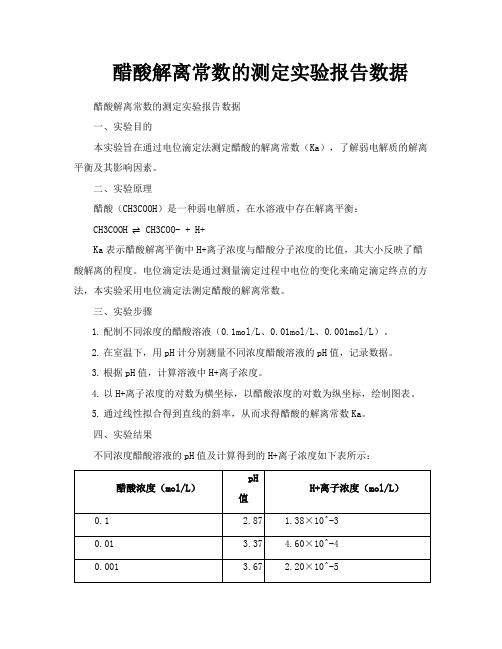
醋酸解离常数的测定实验报告数据醋酸解离常数的测定实验报告数据
一、实验目的
本实验旨在通过电位滴定法测定醋酸的解离常数(Ka),了解弱电解质的解离平衡及其影响因素。
二、实验原理
醋酸(CH3COOH)是一种弱电解质,在水溶液中存在解离平衡:
CH3COOH ⇌ CH3COO- + H+
Ka表示醋酸解离平衡中H+离子浓度与醋酸分子浓度的比值,其大小反映了醋酸解离的程度。
电位滴定法是通过测量滴定过程中电位的变化来确定滴定终点的方法,本实验采用电位滴定法测定醋酸的解离常数。
三、实验步骤
1.配制不同浓度的醋酸溶液(0.1mol/L、0.01mol/L、0.001mol/L)。
2.在室温下,用pH计分别测量不同浓度醋酸溶液的pH值,记录数据。
3.根据pH值,计算溶液中H+离子浓度。
4.以H+离子浓度的对数为横坐标,以醋酸浓度的对数为纵坐标,绘制图表。
5.通过线性拟合得到直线的斜率,从而求得醋酸的解离常数Ka。
四、实验结果
不同浓度醋酸溶液的pH值及计算得到的H+离子浓度如下表所示:
以H+离子浓度的对数为横坐标,以醋酸浓度的对数为纵坐标,绘制图表如下:
(请在此处插入图表)
通过线性拟合得到直线的斜率为-1.76,从而求得醋酸的解离常数Ka为
1.76×10^-5。
五、实验结论
本实验通过电位滴定法测定了醋酸的解离常数Ka为1.76×10^-5。
实验结果表明,醋酸在水溶液中存在解离平衡,其解离程度受到溶液浓度的影响。
通过本实验,我们加深了对弱电解质解离平衡的理解,并掌握了电位滴定法在化学分析中的应用。
实验二醋酸解离度和解离常数的测定

实验二 醋酸解离度和解离常数的测定一、实验目的1、了解电导率法测定醋酸解离度和解离常数的原理和方式;2、加深对弱电解质解离平稳的明白得;3、学习电导率仪的利用方式,进一步学习移液管的大体操作。
二、提 要醋酸CH 3COOH 即HA C ,在水中是弱电解质,存在着以下解离平稳:)1(O H )q (HAc 2+α )q (Ac )q (O H 3α+α-+或简写为)q (HAc α )aq (Ac )aq (H -++其解离常数为{}{}{}θθ-θ+=αc)c HA (c c )c A (c c )H (c)c HA (K eq eq eq(3.1) 若是HAc 的起始溶度为c o ,其解离度为α,由于,)()(0a c Ac c H c eq eq ==-+代入式(3.1)得:θθαα-α=α-α=c )1(c c )c c ()c ()HAc (K 200020 (3.2)某一弱电解质的解离常数K a 仅与温度有关,而与该弱电解质溶液的浓度无关;其解离度α那么随溶液浓度的降低而增大 。
能够有多种方式用来测定弱电解质的α和K a ,本实验采纳的方式是用电导率测定HAc 的α和K a 。
电解质溶液是离子电导体,在必然温度时,电解质溶液的电导(电阻的倒数)λ为l kA =λ (3.3)式中,k 为电导率...(电阻率的倒数),表示长度l 为1m 、截面积A 为1m 2导体的电导;单位为S·m -1。
电导的单位为S [西(门子)]。
在必然温度下,电解质溶液的电导λ与溶质的性质及其溶度c 有关。
为了便于比较不同溶质的溶液的电导,常采纳摩尔电导m λ。
它表示在相距1cm 的两平行电极间,放置含有1单位物质的量电解质的电导,其数值等于电导率k 乘以此溶液的全数体积。
假设溶液的浓度为)dm ·mol (c 3-,于是溶液的摩尔电导为c k 10kV 3m -==λ (3.4)m λ的单位为12mol ·m ·S -。
实验二醋酸解离度的测定与缓冲溶液
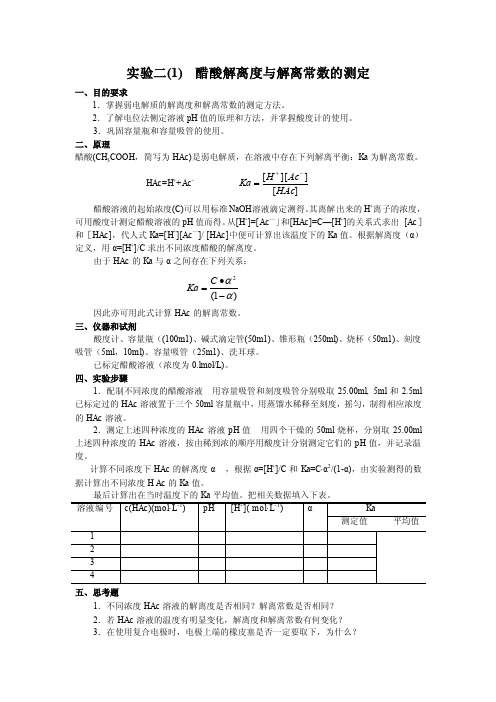
实验二(1) 醋酸解离度与解离常数的测定一、目的耍求1.掌握弱电解质的解离度和解离常数的测定方法。
2.了解电位法侧定溶液pH 值的原理和方法,并掌握酸度计的使用。
3.巩固容量瓶和容量吸管的使用。
二、原理醋酸(CH 3COOH ,简写为HAc)是弱电解质,在溶液中存在下列解离平衡:Ka 为解离常数。
HAc=H ++Ac-][]][[HAc Ac H Ka -+=醋酸溶液的起始浓度(C)可以用标准NaOH 溶液滴定测得。
其离解出来的H +离子的浓度,可用酸度计测定醋酸溶液的pH 值而得。
从[H +]=[Ac —」和[HAc]=C —[H +]的关系式求出 [Ac ]和[HAc],代人式Ka=[H +][Ac —]/ [HAc]中便可计算出该温度下的Ka 值。
根据解离度(α)定义,用α=[H +]/C 求出不同浓度醋酸的解离度。
由于HAc 的Ka 与α之间存在下列关系:)1(2αα-∙=C Ka 因此亦可用此式计算HAc 的解离常数。
三、仪器和试剂酸度计、容量瓶((100m1)、碱式滴定管(50m1)、锥形瓶(250ml)、烧杯(50m1)、刻度吸管(5ml ,10ml)、容量吸管(25m1)、洗耳球。
已标定醋酸溶液(浓度为0.lmol/L)。
四、实验步骤1.配制不同浓度的醋酸溶液 用容量吸管和刻度吸管分别吸取25.00ml, 5ml 和2.5ml 已标定过的HAc 溶液置于三个50ml 容量瓶中,用蒸馏水稀释至刻度,摇匀,制得相应浓度的HAc 溶液。
2.测定上述四种浓度的HAc 溶液pH 值 用四个干燥的50ml 烧杯,分别取25.00ml 上述四种浓度的HAc 溶液,按由稀到浓的顺序用酸度计分别测定它们的pH 值,并记录温度。
计算不同浓度下HAc 的解离度α ,根据α=[H +]/C 和Ka=C·α2/(1-α),由实验测得的数据计算出不同浓度H Ac 的Ka 值。
最后计算出在当时温度下的Ka 平均值。
醋酸解离常数的测定实验报告

醋酸解离常数的测定实验报告实验目的:本实验旨在利用电导率法测定醋酸在不同浓度下的电导率,从而计算出醋酸在水中的解离常数。
实验原理:醋酸(CH3COOH)在水中可以解离成乙酸根离子(CH3COO-)和氢离子(H+),其解离平衡反应可表示为:CH3COOH ⇌ CH3COO+ H+。
醋酸的解离常数(Ka)可以通过以下公式计算得出:Ka = [CH3COO-][H+]/[CH3COOH]其中,[]表示浓度。
在本实验中,我们将通过测定醋酸在不同浓度下的电导率,从而得出解离常数Ka的数值。
实验步骤:1. 准备工作,将所需的实验器材和试剂准备齐全,包括电导率计、醋酸、蒸馏水等。
2. 实验操作,分别取不同浓度的醋酸溶液,将其倒入电导率计测量池中,记录下相应的电导率值。
3. 数据处理,根据实验测得的电导率值,计算出各浓度下醋酸的解离常数Ka。
实验结果:我们通过实验测得了醋酸在不同浓度下的电导率值,并利用上述公式计算出了相应的解离常数Ka。
实验结果显示,随着醋酸浓度的增加,其解离常数Ka也呈现出增加的趋势。
实验讨论:根据实验结果,我们可以得出结论,醋酸在水中的解离常数Ka随着浓度的增加而增加。
这与化学理论预测的结果相符合。
同时,我们也可以进一步探讨醋酸解离常数与温度、离子强度等因素的关系,以及其在化学反应中的应用等方面的内容。
结论:通过本次实验,我们成功利用电导率法测定了醋酸在不同浓度下的解离常数Ka,并得出了相应的实验结果。
这不仅加深了我们对醋酸解离平衡反应的理解,也为今后相关研究提供了重要的实验数据和参考依据。
附录:实验数据表格、数据处理计算过程等。
以上为本次实验的全部内容,谢谢阅读。
醋酸解离常数的测定实验报告

醋酸解离常数的测定实验报告篇一:实验四醋酸解离常数的测定实验四醋酸解离常数的测定pH法一. 实验目的1. 学习溶液的配制方法及有关仪器的使用2. 学习醋酸解离常数的测定方法3. 学习酸度计的使用方法二. 实验原理醋酸是一元弱酸,在水溶液中存在如下解离平衡:HAc + H2O ? H3O+ + Ac-其解离常数的表达式为[c /cθ][c/ cθ] Kθa HAc = —————————————c/ cθ若弱酸HAc的初始浓度为C0 mol?L-1,并且忽略水的解离,则平衡时:c = (C0 – x)mol?L-1c = c= x mol?L-1xKθa HAc = ———— C0– x在一定温度下,用pH计测定一系列已知浓度的弱酸溶液的pH。
根据PH = -㏒[c /cθ],求出c ,即x,代入上式,可求出一系列的Kθa HAc,取其平均值,即为该温度下醋酸的解离常数。
实验所测的4个p Kθa,由于实验误差可能不完全相同,可用下列方式处理,求p Kθa平均和标准偏差s:n∑ Kθai HAc i=1θKa HAc = ————————nS =三.实验内溶(步骤)1.不同浓度醋酸溶液的配制2.不同浓度醋酸溶液pH的测定四.数据记录与处理温度_18_℃pH计编号____标准醋酸溶液浓度__mol?L-1实验所测的4个p Kθa,由于实验误差可能不完全相同,可用下列方式处理,求p Kθa平均和标准偏差s:n∑ Kθai HAc i=1Kθa HAc = ————————nS =Kθai = ×10-5S = ×10-5五.思考题;1.实验所用烧杯、移液管各用哪种HAc溶液润冲?容量瓶是否要用HAc溶液润冲?为什么?答:实验所用移液管用标准醋酸溶液润洗;所用烧杯用不同浓度醋酸溶液润洗;容量瓶用蒸馏水润洗。
2.用pH计测量溶液的pH时,各用什么标准溶液定位?答:用与待测液pH值接近的标准溶液定位3.测定HAc溶液的pH时,为什么要按HAc浓度由小到大的顺序测定?答:以减小测量误差。
醋酸解离常数的测定的原理

醋酸解离常数的测定的原理测定醋酸解离常数的原理可以概括为以下几点:
一、醋酸的解离反应
醋酸在水溶液中发生解离反应:
CH3COOH CH3COO- + H+
解离常数表达式为:
Ka=[H+][CH3COO-]/[CH3COOH]
二、测定原理
1. 准备一系列不同浓度的醋酸溶液。
2. 测量每种溶液的pH值。
3. 根据酸的pH值与浓度关系计算出[H+]。
4. 据酸的浓度计算出[CH3COOH]和[CH3COO-]。
5. 将值代入Ka表达式,计算得到Ka值。
三、实验步骤
1. 使用分析天平准确称取不同量的醋酸,配置成不同浓度溶液。
2. 用pH计分别测定各溶液的pH值。
3. 按公式计算出每种溶液中[H+]、[CH3COOH]和[CH3COO-]。
4. 将上述值代入Ka表达式,计算得到多个Ka值。
5. 求出Ka的平均值即为醋酸的解离常数。
四、注意事项
1. 各溶液配制要精确,浓度采用较宽范围。
2. pH计要校准,每种溶液重复测量pH值取平均值。
3. 浓度计算中要考虑溶解度和体积稀释效应。
4. 采用较多溶液浓度情况计算Ka,可以提高准确度。
通过上述方法和步骤,可以测定出醋酸的解离常数数值,但需要控制好变量和准确读数,才能保证结果的准确可靠。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
百度文库-让每个人平等地提升自我
醋酸解离常数的测定
目的要求
(1)了解对消法测电动势的基本原理,熟悉EM-3C电子电位差计的使用方法;
(2)学习电极及盐桥的使用方法,学会电池的装配方法;
(3)掌握可逆电池电动势测定的应用。
基本原理
利用各种氢离子指示电极与参比电极组成电池,即可从测得的电池电动势算出溶液的pH值,常用指示电极有:氢电极、醌氢醌电极和玻璃电极。
今讨论醌氢醌(QH2Q)电极。
QHQ为醌(Q)与氢醌(H2Q)的等分子化合物,在水溶液中部分分解。
O........ H O O 0H
(Q H2Q) (Q) (H2Q)
醌氢醌在水中溶解度很小。
将待测pH溶液用Q-H2Q饱和后,再插入一只光
亮Pt电极就构成了Q-H2Q电极,可用它构成如下电池:
Hg(l) | Hg2Cl2(s) |饱和KCl溶液II由QHQ饱和的待测pH溶液(H+) | Pt(s)
Q-H2Q电极反应为:
\ Q + 2H++ 2e-—H2Q /
因为在稀溶液中a H+ c H+,所以:
\ - 2.303 RT H
PH
QH2Q QH Q Q
百度文库-让每个人平等地提升自我
可见,Q-H 2Q 电极的作用相当于一个氢电极,电池的电动势为:
2.303 RT H
—F — pH
饱和甘汞
在HAc 和NaAc 组成的缓冲溶液中,由于同离子效应,当达到解离平衡时,
c o, NaAc 。
根据酸性缓冲溶液pH 的计算公式为
pH pK ^(HAc)
本实验中,量取两份相同体积、相同浓度的HAc 溶液,在其中一份中滴加NaOH 溶液至恰好中和(以酚酞为指示剂),然后加入另一份
HAc 溶液,即得到等浓度
的HAc-NaAc 缓冲溶液,测其pH 即可得到pK a (HAc )及K ?(HA C )。
一、 仪器
EM-3C 电子电位差计1套;Pt 电极1支;饱和甘汞电极1只;烧杯;移液管。
二、 试剂
盐桥;KCl 饱和溶液;醌氢醌(固体);未知浓度醋酸溶液;氢氧化钠溶液 L -; 2g/L 酚酞乙醇溶液。
三、 实验步骤
PH ( gw
X 10- (t -25),
饱和甘汞 饱和甘汞
)2.303 RT
=—6.61 (t ^25) - X 0- (t^5)2。
pH
pK 拿(HAc) lg 捡
c Ac
pK ? (HAc) ©虫竺
c o, NaAc
c HAc
c 0, HAc
,
c
Ac
对于由相同浓度 HAc 和NaAc 组成的缓冲溶液,则有
其中QH 2
Q 二
百度文库-让每个人平等地提升自我
1•按EM-3C电子电位差计的操作步骤进行测定,并记录其结果;
百度文库-让每个人平等地提升自我
2 •分别装配下列五个电池,测定其电动势
制备五种等浓度的HAc和NaAc混合溶液,测定pH:
用移液管从醋酸样品中依次分别取、、、、ml HAc溶液于1-5号烧杯中,各
加入25ml蒸馏水和产1滴酚酞溶液后,分别用滴管滴加L-NaOH溶液至酚酞变色,
半分钟内不退色为止,再依次用移液管取、、、、ml HAc样品溶液分别加入到
1-5号烧杯中,混合均匀,得到五种等浓度的HAc和NaAc混合溶液。
再分别于其中加入少量醌氢醌粉末,摇动使之溶解,但仍保持溶液中含少量固体,然后插入铂电极,架上盐桥与甘汞电极组成电池,测定以下电池的电动势
Hg(l) | Hg2Cl2(s) |饱和KCI溶液II由QHQ饱和的待测pH溶液| Pt(s)
四、数据处理
上述所测得5个数据,由于实验误差可能不完全相同,可用下列方法处理,
求pK拿(HAc)平均和标准偏差s:
n
pK ai (HAc)实验
a - d
pK;(HAc) 平均二―
n
误差△ i: i=pK 了(HAc)平均pK计(HAc)实验
'\ 厂
标准偏差s:s 一/
\ n 1
数据记录与结果处理
百度文库-让每个人平等地提升自我。
