第九章 热力学基础
大学物理-热力学基础必考知识点

第九章 热力学基础主要内容一.准静态过程(理想过程,在P-V 图中代表一条线) 系统从一个平衡态到另一个平衡态,中间经历的每一状态都可以近似看成平衡态(平衡态在P-V 图中代表一个点)过程。
二.理想气体状态方程:112212PV PV PV C T T T =→=; m PV RT M'=; P nkT = 8.31J R k mol =;231.3810J k k -=⨯;2316.02210A N mol -=⨯;A R N k =三.热力学第一定律Q E W =∆+;dQ dE dW =+…1.气体做功 21V V W Pdv =⎰ (规定气体对外做功>0 )2.Q (规定气体从外界吸收热量>0,过程量,只有在某个过程中才有意义)3.2121()V m V m m m dE C dT E E C T T M M ''=-=- 或 (状态量,理想气体内能只取决于温度,内能变化公式适用于任意的过程。
),2V m i C R =,=,P +22m i C R (i 为自由度,单原子分子自由度为3,双原子分子为5,多原子分子为6), =+,P ,m V m C C R ,气体比热容比:γ=>,,1P m V m C C四.热力学第一定律在理想气体的等值过程和绝热过程中的应用1. 等体过程-2(V m T 2. 等压过程⎧=⋅-=-⎪⎪⎪=∆+=-=⋅∆⎨⎪⎪∆=-∆⎪⎩21212121()()+2()2()=2p m V m m W P V V R TT M m i Q E W C T T P VM mi E C T T P V M;3.等温过程212211T T E E m V m p Q W RTln RTlnM V M p -=⎧⎪''⎨===⎪⎩1. 绝热过程210()V m Q W E C T T ν=⎧⎪⎨=-∆=--⎪⎩绝热方程1PV C γ=, -12V T C γ= ,13P T C γγ--= 。
统计热力学基础第九章2
l l al e 3 h
e
N Z1
Z1 V (
2m 3 / 2 ) 2 h
al
V
dxdydzdp x dpy dpz h
1
3
e
l
N 2m 3 / 2 V( 2 ) h
2 2 ( p2 1 x p y pz ) 3/ 2 N( ) e 2 mkT dpx dpy dpz 2mkT
配分函数的分离
根据配分函数的定义,将 i 和 i 的表达式代入,得:
q i exp(
i
i
kBT
)
i ,ti ,ri ,vi ,ei ,n exp(
i
i ,t i ,r i ,v i,e i,n
kBT
)
从数学上可以证明,几个独立变数乘积之和等于
f (v) m 3/ 2 [4 N ( ) e v v 2 kT [e v
mv 2 2 kT
mv2 2 kT
v2 ] 0
v2] 0
e
mv m 2 2 kT
mvm 2 [( )vm 2v m ] 0 kT
2kT m 2 RT M
vm
用分布函数计算与速率有关的物理量 在速率 0 ~ 区间内的平均值
SV Nk B ln qV Nk BT
d ln qV dT
d ln qe Se Nk B ln qe Nk BT dT d ln qn Sn Nk B ln qn Nk BT dT
的不可分辨性是与平动相联 系的。
§9.4 平动配分函数
1. 一维平动子:
0
2
第9章-热力学1xue

大爆炸后的宇宙温度 实验室能够达到的最高温度 太阳中心的温度 太阳表面的温度 地球中心的温度 水的三相点温度 微波背景辐射温度 实验室能够达到的最低温度 激光致冷) (激光致冷)
9-1-2 平衡态 准静态过程
平衡态:一个孤立系统, 平衡态:一个孤立系统,其宏观性质在经过 充分长的时间后保持不变( 充分长的时间后保持不变(即其状态参量不 再随时间改变)的状态。 再随时间改变)的状态。
两热力学系统相互接触,而与外界没有热量交 两热力学系统相互接触, 当经过了足够长的时间后, 换,当经过了足够长的时间后,它们的冷热程度不 再发生变化,则我们称两系统达到了热平衡。 再发生变化,则我们称两系统达到了热平衡。 热平衡 热力学第零定律: 热力学第零定律: 如果两个系统分别与第三个系统 达到热平衡,则这两个系统彼此也处于热平衡。 达到热平衡,则这两个系统彼此也处于热平衡。
当代科学实验里能产生的最高温度是10 ,最低温度是2× 当代科学实验里能产生的最高温度是 8K,最低温度是 ×10-8K, 上下跨越了16个数量级 个数量级。 上下跨越了 个数量级。
热学的研究方法: 热学的研究方法:
1.宏观法 宏观法 最基本的实验规律→逻辑推理(运用数学 运用数学) 称为热力学。 最基本的实验规律→逻辑推理 运用数学 ------称为热力学。 称为热力学 优点:可靠、普遍。 缺点:未揭示微观本质。 缺点:未揭示微观本质。 优点:可靠、普遍。 2.微观法 微观法. 微观法 物质的微观结构 + 统计方法 ------称为统计力学 称为统计力学 其初级理论称为气体分子运动论(气体动理论 气体动理论) 其初级理论称为气体分子运动论 气体动理论 优点:揭示了热现象的微观本质。 缺点:可靠性、 遍性差。 优点:揭示了热现象的微观本质。 缺点:可靠性、普 遍性差。 在热学研究中宏观法与微观法相辅相成。 在热学研究中宏观法与微观法相辅相成。
大学物理热力学基础-准静态过程-功-热量内能

如果其中有一个状态为非平衡态,则此过程不是准静 态过程。如果系统进行的速度过快,系统状态发生变 化后,还未来得及恢复新的平衡态,系统又发生了变 化,则该过程也不是准静态过程。
例如:气缸活塞压缩的速
度过快,气体的状态发生
变化,还来不及恢复,P、
F
V、T 无确定关系,则此过
程为不是准静态过程。
3
PA
量为0。 dT 0 2.过程方程 PV C
恒 温 源 T
P 1
P1
3.过程曲线
4.功 A V2 PdV V1
P2 o V1
T
2 V2 V
17
由理想气体状态方程
P m RT
V
RT
V
A V2 RT dV RT V2 dV
V1
V
V V1
等温过程的功
A RT ln V2 m RT ln V2
m RT ln P1
P2
19
三、等压过程
1.过程特点
系统的压强不变 dP 0
P
2.过程曲线
3.内能增量
E m i RT
2
1
2
P
4.功 压强不变
o
V1
V2 V
A
V2 V1
PdV
P
V2
V1
dV
P (V2 V1 )
PV
20
5.热量
QP E A
m
14
热力学第一定 律在等值过程
中的应用
15
一、等容过程
1.过程特点
V
系统的体积不变 dV = 0
系统对外做功为0 dA = 0 2.过程曲线
大学物理第九章热力学基础试题

大学物理第九章热力学基础试题第9章热力学基础一、选择题1.对于准静态过程和可逆过程,有以下说法.其中正确的是[](A)准静态过程一定是可逆过程(B)可逆过程一定是准静态过程(C)二者都是理想化的过程(D)二者实质上是热力学中的同一个概念2.对于物体的热力学过程,下列说法中正确的是[](A)内能的改变只决定于初、末两个状态,与所经历的过程无关(B)摩尔热容量的大小与所经历的过程无关(C)在物体内,若单位体积内所含热量越多,则其温度越高(D)以上说法都不对3.有关热量,下列说法中正确的是[](A)热是一种物质(B)热能是物质系统的状态参量(C)热量是表征物质系统固有属性的物理量(D)热传递是改变物质系统内能的一种形式4.关于功的下列各说法中,错误的是[](A)功是能量变化的一种量度(B)功是描写系统与外界相互作用的物理量(C)气体从一个状态到另一个状态,经历的过程不同,则对外作的功也不一样(D)系统具有的能量等于系统对外作的功5.理想气体状态方程在不同的过程中有不同的微分表达式,式pdV示[](A)等温过程(B)等压过程(C)等体过程(D)绝热过程MRdT表6.理想气体状态方程在不同的过程中可以有不同的微分表达式,式VdpMRdT表示[](A)等温过程(B)等压过程(C)等体过程(D)绝热过程7.理想气体状态方程在不同的过程中可以有不同的微分表达式,式VdppdV0表示[](A)等温过程(B)等压过程(C)等体过程(D)绝热过程8.理想气体状态方程在不同的过程中可以有不同的微分表达式,则式VdppdVMRdT表示[](A)等温过程(B)等压过程(C)等体过程(D)任意过程9.热力学第一定律表明:[](A)系统对外作的功不可能大于系统从外界吸收的热量(B)系统内能的增量等于系统从外界吸收的热量(C)不可能存在这样的循环过程,在此过程中,外界对系统所作的功不等于系统传给外界的热量(D)热机的效率不可能等于110.对于微小变化的过程,热力学第一定律为dQ=dEdA.在以下过程中,这三者同时为正的过程是[](A)等温膨胀(B)等容膨胀(C)等压膨胀(D)绝热膨胀11.对理想气体的等压压缩过程,下列表述正确的是[](A)dA>0,dE>0,dQ>0(B)dA<0,dE<0,dQ<0(C)dA<0,dE>0,dQ<0(D)dA=0,dE=0,dQ=012.功的计算式AVpdV适用于V).一次是等温压缩到2[](A)理想气体(B)等压过程(C)准静态过程(D)任何过程13.一定量的理想气体从状态(p,V)出发,到达另一状态(p,VV,外界作功A;另一次为绝热压缩到,外界作功W.比较这两个功值的大小是22[](A)A>W(B)A=W(C)A<W(D)条件不够,不能比较14.1mol理想气体从初态(T1、p1、V1)等温压缩到体积V2,外界对气体所作的功为[](A)RT1lnV2V(B)RT1ln1V1V22(C)p1(V2V1)(D)p2V2p1V115.如果W表示气体等温压缩至给定体积所作的功,Q表示在此过程中气体吸收的热量,A表示气体绝热膨胀回到它原有体积所作的功,则整个过程中气体内能的变化为[](A)W+Q-A(B)Q-W-A(C)A-W-Q(D)Q+A-W16.理想气体内能增量的表示式ECVT适用于[](A)等体过程(B)等压过程(C)绝热过程(D)任何过程17.刚性双原子分子气体的定压比热与定体比热之比在高温时为[](A)1.0(B)1.2(C)1.3(D)1.418.公式CpCVR在什么条件下成立[](A)气体的质量为1kg(B)气体的压强不太高(C)气体的温度不太低(D)理想气体19.同一种气体的定压摩尔热容大于定体摩尔热容,其原因是[](A)膨胀系数不同(B)温度不同(C)气体膨胀需要作功(D)分子引力不同20.摩尔数相同的两种理想气体,一种是单原子分子气体,另一种是双原子分子气体,从同一状态开始经等体升压到原来压强的两倍.在此过程中,两气体[](A)从外界吸热和内能的增量均相同(B)从外界吸热和内能的增量均不相同(C)从外界吸热相同,内能的增量不相同(D)从外界吸热不同,内能的增量相同21.两气缸装有同样的理想气体,初态相同.经等体过程后,其中一缸气体的压强变为原来的两倍,另一缸气体的温度也变为原来的两倍.在此过程中,两气体从外界吸热[](A)相同(B)不相同,前一种情况吸热多(C)不相同,后一种情况吸热较多(D)吸热多少无法判断22.摩尔数相同的理想气体H2和He,从同一初态开始经等压膨胀到体积增大一倍时[](A)H2对外作的功大于He对外作的功(B)H2对外作的功小于He对外作的功(C)H2的吸热大于He的吸热(D)H2的吸热小于He的吸热23.摩尔数相同的两种理想气体,一种是单原子分子,另一种是双原子分子,从同一状态开始经等压膨胀到原体积的两倍.在此过程中,两气体3[](A)对外作功和从外界吸热均相同(B)对外作功和从外界吸热均不相同(C)对外作功相同,从外界吸热不同(D)对外作功不同,从外界吸热相同24.摩尔数相同但分子自由度不同的两种理想气体从同一初态开始作等温膨胀,若膨胀后体积相同,则两气体在此过程中[](A)对外作功相同,吸热不同(B)对外作功不同,吸热相同(C)对外作功和吸热均相同(D)对外作功和吸热均不相同25.两气缸装有同样的理想气体,初始状态相同.等温膨胀后,其中一气缸的体积膨胀为原来的两倍,另一气缸内气体的压强减小到原来的一半.在其变化过程中,两气体对外作功[](A)相同(B)不相同,前一种情况作功较大(C)不相同,后一种情况作功较大(D)作功大小无法判断26.理想气体由初状态(p1、V1、T1)绝热膨胀到末状态(p2、V2、T2),对外作的功为[](A)MCV(T2T1)(B)MCp(T2T1)(C)MCV(T2T1)(D)MCp(T2T1)27.在273K和一个1atm下的单原子分子理想气体占有体积22.4升.将此气体绝热压缩至体积为16.8升,需要作多少功[](A)330J(B)680J(C)719J(D)223J28.一定量的理想气体分别经历了等压、等体和绝热过程后其内能均由E1变化到E2.在上述三过程中,气体的[](A)温度变化相同,吸热相同(B)温度变化相同,吸热不同(C)温度变化不同,吸热相同(D)温度变化不同,吸热也不同29.如果使系统从初态变到位于同一绝热线上的另一终态则[](A)系统的总内能不变(B)联结这两态有许多绝热路径(C)联结这两态只可能有一个绝热路径(D)由于没有热量的传递,所以没有作功30.一定量的理想气体,从同一状态出发,经绝热压缩和等温压缩达到相同体积时,绝热压缩比等温压缩的终态压强[](A)较高(B)较低(C)相等(D)无法比较431.一定质量的理想气体从某一状态经过压缩后,体积减小为原来的一半,这个过程可以是绝热、等温或等压过程.如果要使外界所作的机械功为最大,这个过程应是[](A)绝热过程(B)等温过程(C)等压过程(D)绝热过程或等温过程均可32.视为理想气体的0.04kg的氦气(原子量为4),温度由290K升为300K.若在升温过程中对外膨胀作功831J,则此过程是[](A)等体过程(B)等压过程(C)绝热过程(D)等体过程和等压过程均可能33.一定质量的理想气体经历了下列哪一个变化过程后,它的内能是增大的[](A)等温压缩(B)等体降压(C)等压压缩(D)等压膨胀34.一定量的理想气体从初态(V,T)开始,先绝热膨胀到体积为2V,然后经等容过程使温度恢复到T,最后经等温压缩到体积V.在这个循环中,气体必然[](A)内能增加(B)内能减少(C)向外界放热(D)对外界作功pOV2VVT9-1-34图35.提高实际热机的效率,下面几种设想中不可行的是[](A)采用摩尔热容量较大的气体作工作物质(B)提高高温热源的温度(C)使循环尽量接近卡诺循环(D)力求减少热损失、摩擦等不可逆因素36.在下面节约与开拓能源的几个设想中,理论上可行的是[](A)在现有循环热机中进行技术改进,使热机的循环效率达100%(B)利用海面与海面下的海水温差进行热机循环作功(C)从一个热源吸热,不断作等温膨胀,对外作功(D)从一个热源吸热,不断作绝热膨胀,对外作功37.下列说法中唯一正确的是[](A)任何热机的效率均可表示为AQ吸(B)任何可逆热机的效率均可表示为1T低T高(C)一条等温线与一条绝热线可以相交两次(D)两条绝热线与一条等温线可以构成一个循环538.卡诺循环的特点是[](A)卡诺循环由两个等压过程和两个绝热过程组成(B)完成一次卡诺循环必须有高温和低温两个热源(C)卡诺循环的效率只与高温和低温热源的温度有关(D)完成一次卡诺循环系统对外界作的净功一定大于039.在功与热的转变过程中,下面说法中正确的是[](A)可逆卡诺机的效率最高,但恒小于1(B)可逆卡诺机的效率最高,可达到1(C)功可以全部变为热量,而热量不能全部变为功(D)绝热过程对外作功,系统的内能必增加40.两个恒温热源的温度分别为T和t,如果T>t,则在这两个热源之间进行的卡诺循环热机的效率为[](A)TTtTtTt(B)(C)(D)TttTT41.对于热传递,下列叙述中正确的是[](A)热量不能从低温物体向高温物体传递(B)热量从高温物体向低温物体传递是不可逆的(C)热传递的不可逆性不同于热功转换的不可逆性(D)理想气体等温膨胀时本身内能不变,所以该过程也不会传热42.根据热力学第二定律可知,下列说法中唯一正确的是[](A)功可以全部转换为热,但热不能全部转换为功(B)热量可以从高温物体传到低温物体,但不能从低温物体传到高温物体(C)不可逆过程就是不能沿相反方向进行的过程(D)一切自发过程都是不可逆过程43.根据热力学第二定律判断,下列哪种说法是正确的[](A)热量能从高温物体传到低温物体,但不能从低温物体传到高温物体(B)功可以全部变为热,但热不能全部变为功(C)气体能够自由膨胀,但不能自由压缩(D)有规则运动的能量能够变为无规则运动的能量,但无规则运动的能量不能变为有规则运动的能量44.热力学第二定律表明:[](A)不可能从单一热源吸收热量使之全部变为有用功(B)在一个可逆过程中,工作物质净吸热等于对外作的功(C)摩擦生热的过程是不可逆的(D)热量不可能从温度低的物体传到温度高的物体45.“理想气体和单一热源接触作等温膨胀时,吸收的热量全部用来对外作功.”对此6说法,有以下几种评论,哪一种是正确的[](A)不违反热力学第一定律,但违反热力学第二定律(B)不违反热力学第二定律,但违反热力学第一定律(C)不违反热力学第一定律,也不违反热力学第二定律(D)违反热力学第一定律,也违反热力学第二定律46.有人设计了一台卡诺热机(可逆的).每循环一次可从400K的高温热源吸收1800J的热量,向300K的低温热源放热800J,同时对外作功1000J.这样的设计是[](A)可以的,符合热力学第一定律(B)可以的,符合热力学第二定律(C)不行的,卡诺循环所作的功不能大于向低温热源放出的热量(D)不行的,这个热机的效率超过了理论值47.1mol的单原子分子理想气体从状态A变为状态B,如果变化过程不知道,但A、B两态的压强、温度、体积都知道,则可求出[](A)气体所作的功(B)气体内能的变化(C)气体传给外界的热量(D)气体的质量48.如果卡诺热机的循环曲线所包围的面积从图中的abcda增大为abcda,那么循环abcda与abcda所作的功和热机效率变化情况是:[](A)净功增大,效率提高(B)净功增大,效率降低(C)净功和效率都不变(D)净功增大,效率不变pabdT2cbOT1c49.用两种方法:使高温热源的温度T1升高△T;使低温热源的温度T2降低同样的△T值;分别可使卡诺循环的效率升高1和2,两者相比:[](A)1>2(B)2>1(C)1=2(D)无法确定哪个大50.下面所列四图分别表示某人设想的理想气体的四个循环过程,请选出其中一个在理论上可能实现的循环过程的图的符号.[]pppp等温等压绝热绝热等绝热绝热容等容绝热绝热等温等温OVOVOVVO(A)(B)(C)(D)7T9-1-48图Vp51.在T9-1-51图中,IcII为理想气体绝热过程,IaII和IbII是任意过程.此两任意过程中气体作功与吸收热量的情况是:IIbc[](A)IaII过程放热,作负功;IbII过程放热,作负功a(B)IaII过程吸热,作负功;IbII过程放热,作负功I(C)IaII过程吸热,作正功;IbII过程吸热,作负功(D)IaII过程放热,作正功;IbII过程吸热,作正功O52.给定理想气体,从标准状态(p0,V0,T0)开始作绝热膨胀,体积增大到3倍.膨胀后温度T、压强p与标准状态时T0、p0之关系为(为比热比)[](A)T() T9-1-51图V11111T0,p()p0(B)T()T0,p()1p03333111111(C)T()T0,p()p0(D)T()T 0,p()p0333353.甲说:“由热力学第一定律可证明任何热机的效率不可能等于1.”乙说:“热力学第二定律可表述为效率等于100%的热机不可能制造成功.”丙说:“由热力学第一定律可T2”丁说:“由热力学第一定律可证明理想气体卡).T1T诺热机(可逆的)循环的效率等于(12).”对以上说法,有如下几种评论,哪种是正确的T1证明任何卡诺循环的效率都等于(1[](A)甲、乙、丙、丁全对(B)甲、乙、丙、丁全错(C)甲、乙、丁对,丙错(D)乙、丁对,甲、丙错paabbII的效率为,每次循环在高温热源处吸的热量为Q,则d[](A),QQ(B),QQcdc(C),QQ(D),QQOV54.某理想气体分别进行了如T9-1-54图所示的两个卡诺循环:I(abcda)和II(a'b'c'd'a'),且两个循环曲线所围面积相等.设循环I的效率为,每次循环在高温热源处吸的热量为Q,循环55.两个完全相同的气缸内盛有同种气体,设其初始状态相同.今使它们分别作绝热压缩至相同的体积,其中气缸1内的压缩过程是非准静态过程,而气缸2内的压缩过程则是准静态过程.比较这两种情况的温度变化:[](A)气缸1和气缸2内气体的温度变化相同(B)气缸1内的气体较气缸2内的气体的温度变化大(C)气缸1内的气体较气缸2内的气体的温度变化小(D)气缸1和气缸2内的气体的温度无变化二、填空题1.不等量的氢气和氦气从相同的初态作等压膨胀,体积变为原来的两倍.在这过程中,氢气和氦气对外作的功之比为.8T9-1-54图2.1mol的单原子分子理想气体,在1atm的恒定压力下从273K加热到373K,气体的内能改变了.3.各为1摩尔的氢气和氦气,从同一状态(p,V)开始作等温膨胀.若氢气膨胀后体积变为2V,氦气膨胀后压强变为p,则氢气和氦气从外界吸收的热量之比为.24.两个相同的容器,一个装氢气,一个装氦气(均视为刚性分子理想气体),开始时它们的压强和温度都相等.现将6J热量传给氦气,使之温度升高.若使氢气也升高同样的温度,则应向氢气传递的热量为.5.1摩尔的单原子分子理想气体,在1个大气压的恒定压力作用下从273K加热到373K,此过程中气体作的功为.6.273K和一个1atm下的单原子分子理想气体占有体积22.4升.此气体等温压缩至体积为16.8升的过程中需作的功为.7.一定量气体作卡诺循环,在一个循环中,从热源吸热1000J,对外作功300J.若冷凝器的温度为7C,则热源的温度为.8.理想气体卡诺循环过程的两条绝热线下的面积大小(图中阴影部分)分别为S1和S2,则二者的大小关系是.9.一卡诺机(可逆的),低温热源的温度为27C,热机效率为OpS1S2VT9-2-8图40%,其高温热源温度为K.今欲将该热机效率提高到50%,若低温热源保持不变,则高温热源的温度应增加K.10.一个作可逆卡诺循环的热机,其效率为,它的逆过程的致冷系数w则与w的关系为.T2,T1T211.1mol理想气体(设CPCV为已知)的循环过程如T-V图所示,其中CA为绝热过程,A点状态参量(T1,V1),和B点的状态参量(T1,V2)为已知.则C点的状态参量为:TABVC,T1TC,TC2OV1V2VpC.T9-2-11图912.一定量的理想气体,从A状态(2p1,V1)经历如T9-2-12图所示的直线过程变到B状态(p1,V1),则AB过程中系统作功___________,内能改变△E=_________________.13.质量为M、温度为T0的氦气装在绝热的容积为V的封2p1p1OpABV12V1VT9-2-12图闭容器中,容器一速率v作匀速直线运动.当容器突然停止后,定向运动的动能全部转化为分子热运动的动能,平衡后氦气的温度增大量为.14.有摩尔理想气体,作如T9-2-14图所示的循环过程abca,其中acb为半圆弧,b-a为等压过程,pc2pa,在此循环过程中气体净吸热量为QCp(TbTa)(填入:>,15.一定量的理想气体经历acb过程时吸热550J.则经历acbea过程时,吸热为.16.一定量理想气体,从同一状态开始使其体积由V1膨胀到2V1,分别经历以下三种过程:等压过程;等体内能增加最多;__________过程气体吸收的热量最多.ppcpaaOVap105PacbVbVT9-2-14图4aceb433V10mO11dT9-2-15图温过程;绝热过程.其中:__________过程气体对外作功最多;____________过程气17.一定量的理想气体,从状态a出发,分别经历等压、等温、绝热三种过程由体积V1膨胀到体积V2,试在T9-2-17图中示意地画出这三种过程的p-V图曲线.在上述三种过程中:pa(1)气体的内能增加的是__________过程;(2)气体的内能减少的是__________过程.OV1V2VT9-2-17图18.如T9-2-18图所示,已知图中两部分的面积分别为S1和S2.如果气体的膨胀过程为a1b,则气体对外做功W=________;如果气体进行a1b2a的循环过程,则它对外做功W=_______________.paOS11S22bVT9-2-18图1019.如T9-2-19图所示,一定量的理想气体经历abc过程,在此过程中气体从外界吸收热量Q,系统内能变化E.则Q和E>0或<0或=0的情况是:Q_________,E__________.20.将热量Q传给一定量的理想气体,pbcOaVT9-2-19图(1)若气体的体积不变,则其热量转化为;(2)若气体的温度不变,则其热量转化为;(3)若气体的压强不变,则其热量转化为.21.一能量为1012eV的宇宙射线粒子,射入一氖管中,氖管内充有0.1mol的氖气,若宇宙射线粒子的能量全部被氖气分子所吸收,则氖气温度升高了_________________K.(1eV=1.60某1019J,普适气体常量R=8.31J/(molK))22.有一卡诺热机,用29kg空气作为工作物质,工作在27℃的高温热源与-73℃的低温热源之间,此热机的效率=______________.若在等温膨胀的过程中气缸体积增大到2.718倍,则此热机每一循环所作的功为_________________.(空气的摩尔质量为29某10-3kgmol-1,普适气体常量R=8.31JmolK)23.一气体分子的质量可以根据该气体的定体比热来计算.氩气的定体比热cV=0.314kJ·kg1·K1,则氩原子的质量m=__________.三、计算题1.1mol刚性双原子分子的理想气体,开始时处于p11.0110Pa、V110m的状态,然后经图示直线过程I变到p24.0410Pa、后又经过方程为pV2C (常量)V22103m3的状态.5的过程II变到压强p3p11.0110Pa的状态.求:(1)在过程I中气体吸的热量;(2)整个过程气体吸的热量.1115335p(p2,V2)(p1,V1)Op3p1VT9-3-1图2.1mol的理想气体,完成了由两个等容过程和两个等压过程构成的循环过程(如T9-3-2图),已知状态1的温度为T1,状态3的温度为T3,且状态2和4在同一等温线上.试求气体在这一循环过程中作的功.Op21T9-3-2图34V113.一卡诺热机(可逆的),当高温热源的温度为127C、低温热源温度为27C时,其每次循环对外作净功8000J.今维持低温热源的温度不变,提高高温热源的温度,使其每次循环对外作净功10000J.若两个卡诺循环都工作在相同的两条绝热线之间,试求:(1)第二个循环热机的效率;(2)第二个循环的高温热源的温度.4.某种单原子分子的理想气体作卡诺循环,已知循环效率20%,试问气体在绝热膨胀时,气体体积增大到原来的几倍5.1mol双原子分子理想气体作如T9-3-5图所示的可逆循环过程,其中1-2为直线,2-3为绝热线,3-1为等温线.已知T22T1,V38V1,试求:(1)各过程的功,内能增量和传递的热量;(用T1和已知常数表示)(2)此循环的效率.(注:循环效率AQ1,A为每一循环过程气体对外所作的功,Q1为每一循环过程气体吸收的热量)pp21p1OV12V2T9-3-5图3V3V6.如T9-3-6图所示,一金属圆筒中盛有1mol刚性双原子分子的理想气体,用可动活塞封住,圆筒浸在冰水混合物中.迅速推动活塞,使气体从标准状态(活塞位置I)压缩到体积为原来一半的状态I(活塞位置II),然后维持活塞不动,待气体温度下降至0℃,再让活塞缓慢上升到位置I,完成一次循环.II(1)试在p-V图上画出相应的理想循环曲线;(2)若作100次循环放出的总热量全部用来熔解冰,则有多少冰被熔化冰水混合物5-T9-3-6图(已知冰的熔解热3.35某10J·kg1,普适气体常量R=--8.31J·mol1·K1)p(102Pa)7.比热容比1.40的理想气体,进行如T9-3-7图所示a4的abca循环,状态a的温度为300K.3(1)求状态b、c的温度;21(2)计算各过程中气体所吸收的热量、气体所作的功和c气体内能的增量;O(3)求循环效率.b46V(m3)2T9-3-7图8.一台冰箱工作时,其冷冻室中的温度为-10℃,室温为15℃.若按理想卡诺致冷循环计算,则此致冷机每消耗102J的功,可以从冷冻室中吸出多少热量129.一可逆卡诺热机低温热源的温度为7.0℃,效率为40%;若要将其效率提高50%,则高温热源温度需提高几度10.绝热容器中有一定量的气体,初始压强和体积分别为p0和V0.用一根通有电流的电阻丝对它加热(设电阻不随温度改变).在加热的电流和时间都相同的条件下,第一次保持体积V0不变,压强变为p1;第二次保持压强p0不变,而体积变为V1.不计电阻丝的热容量,求该气体的比热容比.11.空气中的声速的表达式为u系式p,其中是气体密度,是体弹性模量,满足关V.就下列两种情况计算其声速:V(1)假定声波传播时空气的压缩和膨胀过程是一个等温过程(即等温声速模型,亦称为牛顿模型);(2)假定声波传播时空气的压缩和膨胀过程是一个绝热过程(即绝热声速模型);比较这两个结果你得出什么结论(设空气中只有氮气)12.某热机循环从高温热源获得热量QH,并把热量QL排给低温热源.设高、低温热源的温度分别为TH=2000K和TL=300K,试确定在下列条件下热机是可逆、不可逆或不可能存在的.(1)QH=1000J,A=900J;(2)QH=2000J,QL=300J;(3)A=1500J,QL=500J.13.研究动力循环和制冷循环是热力学的重要应用之一.内燃机以气缸内燃烧的气体为工质.对于四冲程火花塞点燃式汽油发动机来说,它的理想循环是定体加热循环,称为奥托循环(Ottocycle).而对于四冲程压燃式柴油机来说,它的理想循环是定压加热循环,称为狄塞耳循环(Dieelcycle).如T9-3-13图所示,往复式内燃机的奥托循环经历了以下四个冲程:(1)吸气冲程(0→1):当活塞由上止点T向下止点B运时,进气阀打开,在大气压力下吸入汽油蒸气和空气的混合气体.(2)压缩冲程:进气阀关闭,活塞向左运行,混合气体被绝热压缩(1→2);活塞移动T点时,混合气体被电火花点燃迅速燃烧,可以认为是定体加热过程(2→3),吸收热量(3)动力冲程:燃烧气体绝热膨胀,推动活Q1.塞对外作功(3→4);然后,气体在定体条件下降压(4→1),放出热量Q2.(4)排气冲程:活塞向左运行,残余气体从排气阀排出.假定内燃机中的工质是理想气体并保持定量,试求上述奥托循环1→2→3→4→1的效率.VT9-3-13图1314.绝热壁包围的气缸被一绝热的活塞分成A,B两室,活塞在气缸内可无摩擦自由滑动,每室内部有1摩尔的理想气体,定容热容量cV5R.开始时,气体都处在平衡态2(p0,V0,T0).现在对A室加热,直到A中压强变为2p0为止.(1)加热结束后,B室中气体的温度和体积(2)求加热之后,A、B室中气体的体积和温度;(3)在这过程中A室中的气体作了多少功(4)加热器传给A室的热量多少15.如T9-3-15图所示,器壁与活塞均绝热的容器中间被一隔板等分为两部分,其中右边贮有1摩尔处于标准状态的氦气(可视为理想气体),左边为真空.现先把隔板拉开,待气体平衡后,再缓慢向右推动活塞,把气体压缩到原来的体积.求氦气的温度改变量.真空T9-3-15图16.如T9-3-15图所示,一固定绝热隔板将某种理想气体分成A、B两部分,B的外侧是可动活塞.开始时A、B两部分的温度T、体积V、压强p均相同,并与大气压强相平衡.现对A、B两部分气体缓慢地加热,当对A和B给予相等的热量Q以后,A室中气体的温度升高度数与B室中气体的温度升高度数之A比为7:5.(1)求该气体的定体摩尔热容CV和定压摩尔热容Cp;(2)B室中气体吸收的热量有百分之几用于对外作功?T9-3-17图17.有两个全同的物体,其内能为uCT(C为常数),初始时两物体的温度分别为T1、T2.现以两物体分别为高、低温热源驱动一卡诺热机运行,最后两物体达到一共同温度Tf.求(1)Tf;(2)求卡诺热机所作的功.18.温度为25℃、压强为1atm的1mol刚性双原子分子理想气体,经等温过程体积膨胀至原来的3倍.(普适气体常量R=8.31JmolK,ln3=1.0986)(1)计算这个过程中气体对外所作的功;(2)假若气体经绝热过程体积膨胀为原来的3倍,那么气体对外作的功又是多少19.图T9-3-19为一循环过程的T-V曲线.该循环的工质为mol的理想气体,其中CV和均已知且为常量.已知a点的温度为T1,体积为V1,b点的体积为V2,ca为绝热过程.求:(1)c点的温度;(2)循环的效率.。
大学物理C(2)知识点 全面

大学物理C(2)知识点第九章热力学基础1. 平衡态、态参量、热力学第零定律2.理想气体状态方程3.准静态过程、热量和内能4.热力学第一定律、典型的热力学过程(等容、等压、等温、绝热)教材:P42 9-2,P43 9-3、9-4,P43 9-14;指导:P175 1、2。
5.循环过程、卡诺循环、热机效率教材:P44 9-16,P45 9-17、9-18、9-19;指导:P175 3,P176 4、7。
6.热力学第二定律选择题:P173 1、2、3,P174 4、6、8、10;填空题:P174 1、2、P174 4、5、6。
第十章气体动理论1. 麦克斯韦速率分布律、三种统计速率教材:P92 10-14;指导:P194 2,P194 7。
2.统计规律、理想气体的压强和温度3.理想气体的内能、能量按自由度均分定理教材:P9210-17;指导:P195 3、4。
4.气体分子的平均碰撞频率和平均自由程教材:P9210-18。
5. 熵和熵增加原理选择题:P192 1、3、5,P193 6、7、9,填空题:P193 2,P1936、7、9。
第十一章振动学基础1.简谐运动的基本特征和表述、振动的相位、旋转矢量法教材:P128 11-3、11-4、11-5;指导:P211 3、6。
2.简谐运动的动力学方程教材:P129 11-12;指导:P211 7,P215 1。
3.简谐运动的能量教材:P129 11-14;指导:P215 2。
4.一维简谐运动的合成、拍现象教材:P130 11-16、11-18;指导:P215 3。
选择题:P208 1、3,P209 6、10,P211 1,P212 4,P213 6;填空题:P210 3、4,P213 1、P215 8、9。
第十二章波动学基础1.机械波的基本特征、平面简谐波波函数教材:P178 12-4、12-5、12-6,P179 12-9;指导:P236 3、4、6。
2.波的能量、能流密度3.惠更斯原理、波的衍射4.波的叠加、驻波、相位突变教材:P180 12-13,P181 12-15、12-19;指导:P236 7,P239 2、3。
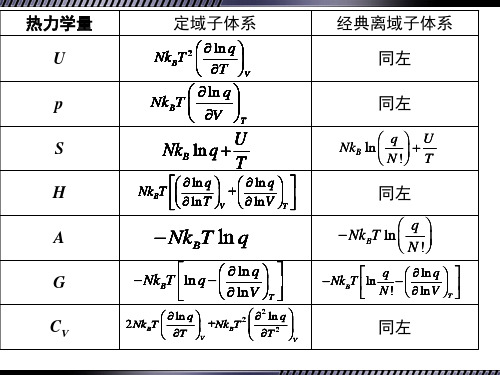
第9章_统计热力学初步-wfz-1

§9.2 能级分布的微观状态数及系统的总微态数
1. 能级分布
平衡系统中, 粒子各能级的能量值只与粒子的性质及 V有关,所 以平衡系统中各能级的能量也完全确定
任何一种能级分布均应服从 粒子数及能量守恒关系:
ì U = ï ï ï í ï N = ni
å
i
由于粒子的不停运动并彼此交换 能量 , 使 N 、 U 、 V 确定的系统并非 只有一种能级分布。
h2 et = 8m
2 骣 2 2 ny nx nz 琪 琪 + + 琪 2 2 琪 a b c2 桫
(n x , n y , n z
势箱边长
= 1, 2, L
量子数
)
m 为分子质量 a、b、c 为容器边长 h 为Planck常数
yn
x ,n y ,n z
对应于量子数
n x , n y , n z的量子态
3
量子态: 系统中粒子所处的各种不同的微观状态. 能级: 粒子能量相同的一组量子态组成一个能级.不同能级的 能量 i值是不连续的, 即量子化的. 在一定宏观状态的独立子系统中, 系统的总粒子数N 和总能量U 是不变的, 若处于能级i的粒子数目为 ni ,必然有 N ni U ni i
11.622
10-
40
J
e t, 1 - e t, 0 = (11.622 - 5.811 )? 10-
40
J
5.811
10-
40
J
由以上计算知:平动子相邻能级的能量差Δ 非常小,所以平动子 很容易受激发而处于各能级。在常温下,平动子的量子化效应不突出, 可近似用经典力学方法处理。
10
2. 分子转动 双原子分子可近似看作原子间距 d 保持不变的刚性转子 . 转子的转动惯量 I :
大学物理同步训练第09章热力学基础

第九章 热力学基础一、选择题1. 如图1所示,一定量的理想气体,由平衡状态A 变到平衡状态B (p A =p B ),则无论经过的是什么过程,系统必然(A )对外做正功(B )内能增加 (C )从外界吸热(D )向外界放热答案:B分析:功和热量为过程量,其大小、正负与过程有关,故A 、C 、D 选项错误;内能(温度)为状态量,与过程无关。
由图可知,B 点内能高于A 点(由内能公式E =ipV 2⁄可得,式中i 为气体分子自由度,见《气体动理论》选择题1)。
2. 对于室温下的单原子分子理想气体,在等压膨胀的情况下,系统对外所做的功与从外界吸收的热量之比W Q ⁄等于(A )23⁄(B )12⁄ (C )25⁄ (D )27⁄ 答案:C分析:由等压过程公式∆Q:∆E:∆W =(i +2):i:2可得W Q ⁄=2(3+2)=25⁄⁄。
3. 压强、体积、温度都相等的常温下的氧气和氦气,分别在等压过程中吸收了相等的热量,它们对外做的功之比为(A )1:1(B )5:9 (C )5:7 (D )9:5 答案:C分析:(参考选择题2)可得∆W =2i +2∆Q → ∆W O 2∆W He =2∆Q (i O 2+2)⁄2∆Q (i He +2)⁄=3+25+2=57 关于自由度i 可参考《气体动理论》选择题1。
4. 在下列理想气体过程中,哪些过程可能发生?(A )等体积加热时,内能减少,同时压强升高(B )等温压缩时,压强升高,同时吸热(C )等压压缩时,内能增加,同时吸热(D )绝热压缩时,压强升高,同时内能增加答案:D分析:热力学第一定律∆Q =∆E +∆W (其中∆Q 为系统吸收的热量,∆E 为系统内能的增量,∆W 为系统对外所做的功)。
等体过程,∆W =0,吸收热量∆Q >0,则∆E >0,系统内能增加,故A 错误;等温压缩,∆W <0,温度不变即∆E =0,故∆Q <0,系统放热,故B 错误;等压压缩,∆W <0,由等压过程公式(见选择题2)可知∆E <0,∆Q <0,系统内能减小,且系统放热,故C 错误;绝热压缩时,∆Q =0,∆W <0,故∆E >0,系统内能增加,由绝热过程曲线可知压强升高,故D 正确。
熵的原理

A
B
A
B 1 4 1/16 4/16
6
6/16
4 共 16 种微观态 5 种宏观态 1
4/16 1/16
10
2 10 23
有人计算过,概率这样小的事件 自宇宙存在以来都不会出现。
§9.4 熵
熵增加原理
第九章热力学基础
气体自由膨胀的不可逆性,从统计观点解释就是一个不 受外界影响的理想气体系统,其内部所发生的过程总是向着 大(或 大)的方向进行的。
显然孤立系统中不可逆过程熵是增加的 .
§9.4 熵
熵增加原理
第九章热力学基础
补充例 求热传导中的熵变 设在微小时间 t 内, 从 A 传到 B 的热量为 Q.
Q
S A
Q TA
TA
TA TB
Q TA
TB
绝热壁
S B
Q TB
S S A S B
不可逆过程 非平衡态 平衡态(熵增加) 自发过程 熵增加原理成立的条件: 孤立系统或绝热过程.
§9.4 熵
熵增加原理
第九章热力学基础
熵增加原理的应用 :给出自发过程进行方向
的判椐 . 9.4.4 热力学第二定律的熵表述
热力学第二定律亦可表述为 : 一切自发过程
总是向着熵增加的方向进行 .
§9.4 熵
T 314 K
'
T1 363 K
各部分热水的熵变
S1
dQ T
m1c p T
T
1
'
dT T
'
m1c p ln
T
'
T1
182 J K
'
第九章 统计热力学

一、统计热力学在物理化学中的地位
大量微观粒子构成的宏观系统
宏观性质 →宏观性质
微观结构和运动 →宏观性质
宏观现象是微观运动的结果
宏观现象与微观现象有差别
研究 对象
以由大量微观粒子构成的宏观系统
研究方法
从物质的微观结构和微观运动形态出发,利用统计 平均的方法来获得物质的各种宏观性质
研究作用
统计热力学是联系物质宏观特性与微观性质的桥梁,它 弥补了热力学的不足,两者彼此联系,互相补充。 利用统计热力学方法不需要低温下的量热实验,就能求 得熵函数,其结果甚至比热力学第三定律所得的熵值更准确。
宏观系统是由大量微观粒子构成的。 对于总粒子数为N,总能量为U,体积为V的独 立子系统,每个粒子的能量是不完全相同的,并
且随着粒子之间的能量交换,每个粒子能量也是
变化的。但系统中总粒子数不变和系统总能量是 不变的,应遵循下面的关系式
一、独立子系统中粒子数和能量守衡关系式
N nj
状态分布
j
三、粒子各运动形式的能级及简并度
1. 三维平动子
能级公式:
讨论:
2 n 2 n 2 nz h x y t 2 2 8m a 2 b c 2
(9.1.1a)
1)式中:h 6.626 10
34
J s ,称为普郎克常数
2)式中(nx,ny,nz)是表示三维平动子每个量子状态的一组平动 量子数,分别说明三个互相垂直方向平动能的分量,其值只能
0 1
g0
2
g2
… … … · · ·
j
gj
· · ·
能级简并度 粒子分布数
g1
· · ·
热工与流体力学基础第二版知识点

热工与流体力学基础第二版知识点热工与流体力学是工程中的重要学科,涉及热力学、传热学和流体力学等内容。
下面将介绍《热工与流体力学基础第二版》中一些重要的知识点。
第一章:热力学基础本章介绍了热力学的基本概念和基本定律。
热力学是研究热和功之间相互转化关系的学科。
其中包括热力学系统、状态方程、热力学过程等内容。
第二章:气体的热力学性质本章主要介绍了理想气体和真实气体的性质。
理想气体的状态方程为PV=RT,其中P为气体压强,V为气体体积,R为气体常数,T为气体温度。
真实气体的性质受到压力、温度和物质的影响。
第三章:热力学第一定律热力学第一定律是能量守恒定律,它表明能量可以从一种形式转化为另一种形式,但总能量保持不变。
热力学第一定律还可以用来分析各种热力学过程中的能量转化和能量平衡。
第四章:理想气体的热力学过程本章介绍了理想气体在不同热力学过程中的性质和特点。
其中包括等温过程、等容过程、等压过程和绝热过程。
这些过程在工程中具有重要的应用价值。
第五章:气体混合与湿空气本章介绍了气体混合和湿空气的热力学性质。
气体混合是指两种或多种气体按一定的比例混合在一起的过程。
湿空气是指空气中含有一定的水蒸气。
湿空气的热力学性质对于气候和环境工程有着重要的影响。
第六章:热力学第二定律热力学第二定律是热力学的基本定律之一,它规定了一个孤立系统的熵永远不会减少。
熵是一个表示系统无序程度的物理量,它可以用来描述热力学过程的方向性。
第七章:传热学基础传热学是研究热量从一个物体传递到另一个物体的学科。
本章介绍了传热的基本概念和热传导、对流传热、辐射传热的基本原理。
第八章:传热过程与换热器本章介绍了传热过程和换热器的基本原理和应用。
传热过程包括散热、传热和吸热。
换热器是一种用于实现热能转移的设备,广泛应用于工业生产和能源利用。
第九章:流体力学基础流体力学是研究流体运动规律的学科。
本章介绍了流体的基本性质和运动方程。
流体的性质包括密度、压力、粘度和表面张力等。
物理化学第九章 统计热力学初步

统计热力学的基本任务
根据对物质结构的某些基本假定,以及实 验所得的光谱数据,求得物质结构的一些基本常 数,如核间距、键角、振动频率等,从而计算分 子配分函数。再根据配分函数求出物质的热力学 性质,这就是统计热力学的基本任务。
定域子系统和离域子系统
粒子(子)(particles) ——聚集在气体、液体、固 体中的分子、原子、离子等。
t r v e n
同时,其简并度等于各独立运动形式的简并度之 积:
g gt gr gv ge gn
运动自由度
对于一个具有n个原子的分子,通常有3n个自 由度,分别为: 3个平动自由度(xyz轴方向的平动) 3个转动自由度(围绕三个轴的旋转) 3n-6个振动自由度 对于线型分子,转动自由度为2(围绕线轴的 旋转可忽略),振动自由度为3n-5
系统的可能的能级分布方式有:
能级分布数
能级分布 n0
n1
n2 n3
Σni
Σniεi =9hν/2
Ⅰ 0 3 0 0 3 3×3 hν/2=9hν/2
Ⅱ 2 0 0 1 3 2×hν/2+1×7hν/2=9hν/2
Ⅲ 1 1 1 0 3 1×hν/2+1×3hν/2 +1×5hν/2=9hν/2
2.状态分布
1.分子的平动
t
h2 8m
(
nx2 a2
n2y b2
nz2 c2
)
对立方容器a=b=c,V=a3
t
h2 8mV 3 / 2
( nx2
n2y
nz2
)
量子力学中把能级可能有的微观状态数称为该 能级的简并度(degeneration),用符号g表示。 简并度亦称为退化度或统计权重。
工程热力学知识点笔记总结

工程热力学知识点笔记总结第一章热力学基本概念1.1 热力学的基本概念热力学是研究能量与物质的转化关系的科学,它关注热与功的转化、能量的传递和系统的状态变化。
热力学中最基本的概念包括系统、热力学量、状态量、过程、功和热等。
1.2 热力学量热力学量是描述系统的性质和状态的物理量,包括内能、焓、熵、自由能等。
内能是系统的总能量,焓是系统在恒压条件下的能量,熵是系统的无序程度,自由能是系统进行非体积恒定的过程中能够做功的能量。
1.3 热力学第一定律热力学第一定律是能量守恒的表达形式,在闭合定容系统中,系统的内能变化等于系统所接受的热量减去系统所做的功。
1.4 热力学第二定律热力学第二定律是描述系统不可逆性的定律,它包括开尔文表述和克劳修斯表述。
开尔文表述指出不可能将热量完全转化为功而不引起其他变化,克劳修斯表述指出热量自然只能从高温物体传递到低温物体。
根据第二定律,引入了熵增大原理和卡诺循环。
1.5 热力学第三定律热力学第三定律是指当温度趋于绝对零度时,系统的熵趋于零。
这一定律揭示了绝对零度对热力学过程的重要意义。
第二章热力学系统2.1 定态与非定态定态系统是指系统的性质在长时间内不发生变化,非定态系统是指系统的性质在长时间内发生变化。
2.2 开放系统与闭合系统开放系统是指与外界交换物质和能量的系统,闭合系统是指与外界不交换物质但可以交换能量的系统。
2.3 热力学平衡热力学平衡是指系统内各部分之间的温度、压力、化学势等性质达到一致的状态。
系统处于热力学平衡时,不会产生宏观的变化。
第三章热力学过程3.1 等温过程在等温过程中,系统的温度保持不变,内能的变化全部转化为热量输给外界。
3.2 绝热过程在绝热过程中,系统不与外界交换热量,内能的变化全部转化为对外界所做的功。
3.3 等容过程在等容过程中,系统的体积保持不变,内能的变化全部转化为热量。
3.4 等压过程在等压过程中,系统的压强保持不变,内能的变化转化为对外界所做的功和系统所吸收的热量。
热学 (7 第九章 相变)

四、气液两相图
汽化曲线, 是液态和气态的分界线
饱和蒸汽压与温度的关系 沸点与外界压强的关系
汽化曲线终点就是临界点K 汽化曲线始点O是三相点
§9.3 克拉珀龙方程
一、方程的推导
两相平衡时的温度T和压强p有函数关系,相平衡曲线
气液二相图 汽化曲线
固液二相图 熔化曲线
Q1 ml
A m(2 1) p
在凹(凸)液面情况下,分 子由气相进入液相的概率比 平页面情况的概率大(小)
3、过饱和蒸气、凝结核、云室
若没有足够的凝结核,或凝结核过小,即使蒸气压强超过 该温度下的饱和蒸气压,液滴仍不能形成并长大,因而出现 过饱和现象,这样的蒸气称为过饱和蒸气压,或过冷蒸气。
4、云及人工降雨
暖云:大小水滴共存 冷云:由冰晶组成 混合云:由冰晶和水滴组成
pk
Vmk
Tk
pk
a
V2 2 mk
Vmk
b
R Tk
a 27b2
a
2 9b2
3b
b
R
8a 27bR
对比物态方程
3
2
3
1
8
对应态定理: 一切物质在相同的对比压强和对比温度下, 就有相
同的对比体积了.
8a Tk 27bR Vmk 3b
a pk 27b2
临界比容:液态的最大比容 临界压强:液态的最大饱和蒸汽压 临界温度:等温压缩使气体液化的最高温度
pk, k Tk之间的关系
临界系数
大学物理2-1第九章(热力学基础)习题答案

大学物理2-1第九章(热力学基础)习题答案习 题 九9-1 一系统由图示的状态a 经acd 到达状态b ,系统吸收了320J 热量,系统对外作功126J 。
(1)若adb 过程系统对外作功 42J ,问有多少热量传入系统? (2)当系统由b 沿曲线ba 返回状态a ,外界对系统作功84 J ,试问系统是吸热还是放热? 热量是多少?[解] 由热力学第一定律A E Q +∆= 得AQ E -=∆在a <b 过程中,E E E a b∆=-JA Q 19412632011=-=-= 在adb 过程中 JA E Q 236421942=+=+∆=在ba 过程中 JA E A E E Q b a 27884194333-=--=+∆-=+-=本过程中系统放热。
9-2 2mol 氮气由温度为 300K ,压强为510013.1⨯Pa(1atm)的初态等温地压缩到 510026.2⨯Pa(2atm)。
求气体放出的热量。
[解] 在等温过程中气体吸收的热量等于气体对外做的功,所以J P P RT M m A Q mol T 3211046.321ln 30031.82ln ⨯-=⨯⨯⨯===即气体放热为J 31046.3⨯。
9-3 一定质量的理想气体的内能E 随体积的变化关系为E - V 图上的一条过原点的直线,如图所示。
试证此直线表示等压过程。
[证明] 设此直线斜率为k ,则此直线方程为kvE =又E 随温度的关系变化式为Tk T C M M E v mol'=⋅=所以T k kV '=因此C kk T V ='=(C 为恒量) 又由理想气体的状态方程知,C TpV '= (C '为恒量)所以 p 为恒量 即此过程为等压过程。
9-4 2mol 氧气由状态1变化到状态2所经历的过程如图所示:(1)沿l →m →2路径。
(2)1→2直线。
试分别求出两过程中氧气对外作的功、吸收的热量及内能的变化。
《工程热力学》第九章 气体动力循环

9-4 活塞式内燃机各种理想循环的热力学比较
一、压缩比相同、吸热量相同时的比较 压缩比相同,1-2重合
吸热量相同,q1v q1m q1p
q2v q2m q2 p
tv tm tp
或
T 2v T 2m T 2 p
T 1v T 1m T 1p
tv
tm
tp
二、循环最高压力和最高温度相同时的比较
放热量相同:
又称萨巴德循环 12 等熵压缩;23 等容吸热; 34 定压吸热;45 等熵膨胀; 51 定容放热
特性参数:
压缩比(compression ratio) v1
v2 定容增压比(pressure ratio) p3
p2
定压预胀比 (cutoff ratio) v4
v3
反映气缸容积 反映供油规律
热效率
t
wnet q1
t
1
1
1
1
1
(9 7)
讨论:
v1 p3
v2
p2
v4
v3
a)循环1-2’-3’-4’-5-1
压缩比
Tm1 t
b)循环1-2-3”-4”-5-1
定容增压比
Tm1 t
c)循环1-2-3’”-4’”-5-1
定压预胀比
Tm1 t
二、定压加热理想循环(狄塞尔循环) 柴油机定压加热过程
3-4 等熵膨胀(燃气轮机内) 4-1 定压放热(排气,假想换热器)
热效率ηt
q1 h3 h2
cpm
t3 t2
T3 T2
cp
T3 T2
q2
h4
h1
c pm
t4 t1
T4 T1
cp T4 T1
第9章 热力学基础习题解答

第9章 热力学基础习题解答9-1 1mol 单原子分子理想气体,在4 atm 、27℃时体积1V =6L ,终态体积2V =12L 。
若过程是:(1)等温;(2)等压;求两种情况下的功、热量及内能的变化。
解:(1)等温过程:0=∆E12/ln 2121V V RT dV VRTpdV A Q V V V V T T νν====⎰⎰17282ln 30031.8=⨯=(J )(2)等压过程:36472/)(32/12=-=∆=∆V V p T iR E ν(J ) 2431)(12=-=V V p A (J ) 6078=+∆=A E Q P (J )9-2 1mol 单原子分子理想气体从300 K 加热到350 K 。
(1)体积保持不变;(2)压强保持不变;在这两过程中系统各吸收了多少热量?增加了多少内能?气体对外做了多少功?解:(1)等体过程:0=V A3.6232/5031.832/=⨯⨯=∆=∆=T iR E Q V ν(J )(2)等压过程:5.4155031.8)(12=⨯=∆=-=T R V V p A (J ) 10395.4153.623=+=+∆=A E Q P (J ) 9-3 将400 J 的热量传给标准状态下的2mol 氢气。
(1)若温度不变,氢气的压强、体积各变为多少?(2)若压强不变,氢气的温度、体积各变为多少?(3)若体积不变,氢气的温度、压强各变为多少?哪一过程中它做功最多?为什么?哪一过程中内能增加最多?为什么?解:(1)8.4410013.127331.82500=⨯⨯⨯==p RT V ν(L)等温过程:01/ln V V RT Q T ν= 9.4827331.82400exp8.44exp01=⨯⨯==RTQV V ν(L)916.09.48/8.44/1001===V V p p (atm )=9.27×104(Pa ) (2)等压过程:)(02T T C Q P P -=ν 9.2792732/31.87240002=+⨯⨯=+=T C QT Pν(K )9.45273/8.449.279/0022=⨯==T V T V (L) (3)等体过程:)(03T T C Q V V -=ν 6.2822732/31.85240003=+⨯⨯=+=T C QT Vν(K )55003310049.1273/10013.16.282/⨯=⨯⨯==T p T p (Pa )等温过程做功最多,因为热量全部转化为功。
《热工基础》第九章

13
温度对热导率的影响:
一般地说, 所有物质的热 导率都是温度的函数,不同 物质的热导率随温度的变化 规律不同。
纯金属的热导率随温度的 升高而减小。
等温面上任何一条线都是 等温线。如果用一个平面和一组 等温面相交, 就会得到一组等温 线。温度场可以用一组等温面或 等温线表示。
等温面与等温线的特征:
同一时刻,物体中温度不同的等温面或等温线不能 相交;在连续介质的假设条件下,等温面(或等温线) 或者在物体中构成封闭的曲面(或曲线),或者终止于 物体的边界,不可能在物体中中断。
常见的边界条件分为以下三类:
(a) 第一类边界条件 Dirichlet boundary 给出边界上的温度分布及其随时间的变化规律:
tw f , x, y, z
(b) 第二类边界条件 Neumann boundary
给出边界上的热流密度分布及
其随时间的变化规律:
t
qw
qw
t n
w
t n w
qw
定律和牛顿冷却公式可得
t n
w
h tw
tf
h, tf
第三类边界条件建立了物体内部温度在边界处的变
化率与边界处对流换热之间的关系,也称为对流换热边
界条件。 28
上式描述的第三类边界条件是线性的, 所以也称为 线性边界条件,反映了导热问题的大部分实际情况。
其数值与物质的种类有关。
15
多孔材料的热导率
绝大多数建筑材料和保温材料(或称绝热材料)都 具有多孔或纤维结构(如砖、混凝土、石棉、炉渣等), 不是均匀介质,统称多孔材料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
运动之间的能量转化。
3、 热量 Q:
系统之间由于热相互作用而传递的能量。
热量传递的本质:
功和热量都是过程量,而内能是状态
无 规 则 的 分 子 热 量,通过做功或传递热量的过程使系统的
运 动 之 间 的 能 量 转 化。状态(内能)发生变化。
热量的单位:
功与热的等效性:
国际单位:焦耳(J)
作功或传递热量都可以改变热力学系
Q
p p0e RT0
1.013
105
e
500
Pa 28.31273
0.912105 Pa
(3) p不变,热量变为什么?氢的T、V各 为多少?
V
p0V0 p
1.013
105 44.8 0.912 105
103
m3
解:(1)V不变, Q = E,热量转变为内能。 4.98102 m3
E
QV
m M
物体A、B达到热平衡,
则物体A和B也必相互
A
A
热平衡。
BC
BC
二、平衡态
在不受外界影响
(即系统与外界没有物
质和能量的交换)的条
件下,无论初始状态如
——热动平衡
何,系统的宏观性质在
经充分长时间后不再发
热力学过程 :热力学系统的状态随
生变化的状态。
时间发生变化的过程。——实际过程的中
间态为非平衡态。
三、准静态过程
摩尔热容:1摩尔物质的热容量。 i 表示不同的过程
3、摩尔热容:
Ci,m
d Qmol dT
i
(1)定体摩尔热容: 定体摩尔热容:
CV ,m
dQmol dT V
1mol理想气体在体积不变的状态下, 温度升高一度所需要吸收的热量。
(2)定压摩尔热容: 定压摩尔热容:
C p,m
dQmol dT
W V2 pdV dW pdV V1
E=(E1-E2 ): 表示系统内能的增量。
四、热力学第一定律的 根据热力学第一定律
应用 1、等体过程 特征:dV = 0,dA = 0
dQV
dE
m M
CV ,mdT
m i RdT M2
热源 Q V
理想气体的内能:
E
m M
i 2
R(T2
T1)
QV E
p
1mol理想气体在压强不变的状态下, 温度升高一度所需要吸收的热量。
(3)CV,m和Cp,m的关系
实验证明:
C p,m CV ,m R
——迈耶公式
令 C p,m 摩尔热容比(绝热系数)
CV ,m
i CV ,m 2 R
C p,m
i
2 2
R
i为自由度数:
CV,m
单原子 He, Ar 5/3=1.67 3R/2
热力学(开氏)温标: 水三相点(气态、液态、固态的共存 状 国际单位:开尔文(K) 态)273.16 K
摄氏温标和开氏温标的关系
4. 热力学第零定律——
t = T-273.15
测温原理
热平衡 :
在不受外界影响的
两个物体互相热接触,经过一段时
条件下,如果处于确定 间后它们的宏观性质不再变化,即达到了
状态下的物体C分别与 热平衡状态。
V1
m M
RT1 p1
28103 8.31 300 28103 1.013105
V2=V1
根据理想气体状态方程得
T2
p2 p1
T1
900K
p/(1.013×105Pa)
3
2
1
V/m3 O
V1 V4 V3
又 T3 T2 900K 则,
V3
p2V2 p3
7.38103 m3
又
V4
1 2 V3
QT
W
V2 V1
pdV
p
p m RT MV
O
QT
W
V2 V1
m M
RT dV V
V1
V2 V
P-V 图
m RTln V2 m RTln p1
M
V1 M
p2
p1V1ln
p1 p2
p2V2ln
V2 V1
例9-1 将500J的热量传给标准状态下的 2mol氢。 (1) V不变,热量变为什么?氢的温度为 多少? (2) T不变,热量变为什么?氢的p、V各 为多少?
8.31 (J mol 1 K1)
令 R 8.31 J mol 1 K1
——称为“摩尔气体常量 ”
从而,可得质量为m、摩尔质量为M 的理想气体状态方程。
专题讲座1 包括教材P9-27
热力学第一定律及 其应用
一、基本物理量 1、内能 E
内能:包括了分子热运动的平动、转 动、振动能量、化学能、原子能、核能...
工程单位:卡
统的内能。
热功当量:
1卡 = 4.186 焦耳
选择题
1. 单原子分子组成的理想气体自平衡态A变化到平衡态B,变化过 程不知道,但A、B两点的压强、体积和温度都已确定,则可求出 ( )。 (A)气体膨胀所做的功; (B)气体内能变化; (C)气体传递的热量; (D)气体分子的质量。
2. 一定量某种理想气体若按pV 3=恒量的规律被压缩,则压缩后该 理想气体的温度将( )。
m M
CV ,m (T2
T1)
W 0
在等体过程中,系统吸收的热量完全
用来增加自身的内能:
m
QV E2 E1 M CV ,m (T2 T1) p
(理想气体)
m M
i 2 R(T2
T1)
气体的内能仅为温度的
函数,所以,
O
E
m M
CV ,m (T2
T1)
V0
V
P-V 图
2、等压过程 特征: p C
气体在状态变化过程中压强保持不变。
p p
m Qp M C p,m (T2 T1)
m E M CV ,m (T2 T1) W p(V2 V1)
m M R(T2 T1) Q E
热源 Q
O
P
根据热力学第一定律
V1
V2 V
P-V 图
dQp dE pdV
Qp E p(V2 V1)
Qp
强降至1.013×105Pa , 然后又在等压
过程中将体积压缩一半。试求氮气 1
V/m3
在全部过程中的内能变化,所作的 O
功以及吸收的热量,并画出p-V图。
V1 V4 V3
解:已知: m= 2810-3kg
2.46103 (m3)
p1=1.013×105Pa
又 p2=3.039×105Pa
T1=273+27=300(K) 根据理想气体状态方程得
一、 准静态绝热过程 有热量的交换。
特征: dQ 0
p
绝热过程内能增量:
E
m M
CV ,m (T2
T!)
绝热过程的功:
W
m M
CV ,m (T2
T!)
O
V1
V2 V
P-V 图
绝热过程的热力学第一定律:
0 dW dE
dW dE
绝热过程方程:(绝 热方程或帕松方程)
*绝热方程的推导: m
2、功 W
V2
W pdV
V1
热力学系统作功的 装置——活塞
dW F d l pS d l
F
S
p,V
dV
pdV
p (pA,VA,TA)
dl
p-V 图
(pB,VB,TB)
O V1 dV
V2 V
结论:系统所做的功在数值上等于p-
V 图上过程曲线以下的面积。
热力学系统作功的本质:
无规则的分子热运动与有规则的机械
m M
C p,m (T2
T1)
E
m M
CV ,m (T2
T1)
3、等温过程 特征: T = 恒量,dE =0
QT W
m RTln V2
M
V1
m RTln p1
M
p2
p1V1ln
p1 p2
p2V2ln
V2 V1
E 0
气体在状态变化过程中温度保持不变。
过程曲线(双曲线) pV C
根据热力学第一定律 系统吸热全部用作对外做功:
3.69103 m3
p4=p1=1.013×105Pa
则
T4Biblioteka V4 V3T3450K
等体过程: W1 0
Q1
E1
m M
5 2 R(T2
T1)
1248 J
等温过程: E2 0
Q2
W2
m M
RT2ln
V3 V2
823 J
等压过程:
W3 p3(V4 V3) 374 J
E3
m M
5 2 R(T4
2
7 2
R(T
T0 )
T
Qp 7R
T0
281.6K
V V0T 0.046m3 T0
例 9-2: 质 量 为 2810-3kg、 压 强 为 1.013 ×105Pa、温度为27℃的氮气,
p/(1.013×105Pa)
先在体积不变的情况下使其压强增 3
至3.039×105Pa, 再经等温膨胀使压 2
CV ,mVdp Cp,m pdV 0
绝热过程方程:(绝 热方程或帕松方程)
pV C1 TV 1 C2 p 1T C3
Cp,m
CV ,m
dp dV 0
pV
两边积分得:ln p ln V C
ln pV C pV C1
