蔗糖酶的提取纯化及蛋白质含量测定研究
蔗糖酶蛋白含量的测定Folin酚法

四、实验操作方法和步骤 1、制备Folin-酚法蛋白质标准曲线
取6支试管,编号1-6,按表1顺序依次加入各种试剂,并在分光光度计于 500nm处测定光吸收值( A500nm值)。
试管号
0.5g/L标准蛋白质溶液(ml)
蒸馏水
(ml)
Folin-酚试剂甲 (ml)
Folin-酚试剂乙 (ml)
A500nm
蔗糖酶提取分离纯化的样品Ⅰ、Ⅱ、Ⅲ、 Ⅳ稀释溶液的光吸收值 ( A500nm),查蛋白质标准曲线得蔗糖酶蛋白含量,再进行样品Ⅰ、 Ⅱ、Ⅲ、 Ⅳ溶液的最终蔗糖酶蛋白含量的计算。
五、实验结果与分析
六、注意事项 加入Folin-酚乙试剂后,要迅速混匀(加一管混匀一管),使还原反应产生在磷钼
酸-磷钨酸试剂被破坏之前。
202X 蔗糖酶蛋白含量的测定
——Folin-酚法
单击此处添加副标题
实验三 汇报日期
一、实验目的和要求 1、学习Folin-酚法测定蛋白质含量的原理和方法; 2、掌握分光光度法制作标准曲线,准确测定未知样品的蛋白质含量; 3、掌握分光光度计的使用方法。 二、实验基本原理
Folin-酚测定法是在双缩脲反应的基础上发展起来的,Folin-酚试剂是由甲、乙两种 试剂组成的。甲试剂由碳酸钠、氢氧化钠、硫酸铜和酒石酸钾钠组成,在碱性条件下蛋 白质中的肽键与酒石酸钾钠铜盐起作用,生成紫红色络合物;乙试剂是由磷钼酸和磷钨 酸、硫酸、溴等组成,在碱性条件下,铜-蛋白质络合物以及蛋白质中的酪氨酸残基(酚 基)和色氨酸还原磷钼酸-磷钨酸试剂(乙试剂)产生深蓝色(钼蓝和钨蓝的混合物), 其色泽深浅与蛋白质含量成正比。可用500nm波长比色测定,适于测定蛋白质含量 0.05~0.5g/L. 优点: 简单、迅速、灵敏度高;反应较稳定。 缺点: 该反应受多种因素的干扰。
酵母蔗糖酶的提取分离纯化及其蛋白质浓和酶活力测定

蛋白总量 = 蛋白浓度×总体积 总酶活 = 酶活×校正体积 比活力(Unit/mg)=总酶活力/总蛋白 纯化倍数 = 比活力之比 回收率 = 总酶活之比
分实验四:离子交换柱层析纯化蔗糖酶
一、实验目的 学习掌握离子交换柱层析的原理与操作
二 、实验原理
离子交换是指液相中的离子与固相交换 基团中的离子可逆反应。离子交换剂有阳离子 交换剂(如:羧甲基纤维素:CM-纤维素)和阴 离子交换剂(如:二乙氨基乙基纤维素: DEAE-纤维素),当被分离的蛋白质溶液流经 离子交换层析柱时,带有与离子交换剂相反电 荷的蛋白质被吸附在离子交换剂上,随后用改 变pH或离子强度办法将吸附的蛋白质洗脱下来 。
➢在酸性条件下,蔗糖酶催化蔗糖水解,生成葡萄糖和果糖。 ➢葡萄糖、果糖和碱性铜试剂混合加热后被其氧化,二价铜
被还原成棕红色氧化亚铜沉淀。 ➢氧化亚铜与磷钼酸作用生成蓝色溶液,其蓝色深度与还原
糖的量成正比,于650nm测定光吸收值。
三、试剂
碱性铜试剂 磷钼酸试剂 葡萄糖标准溶液 0.2mol/L蔗糖溶液 0.2mol/L乙酸缓冲液,pH4.9
将2-3mL醇级分2用移液管沿着管壁轻轻加到 层析柱中,注意不要扰动柱床,上样后,用大约 30ml缓冲液洗去柱中未吸附的蛋白质,当A280nm 值降低稳定后,可用恒流泵及梯度混合器进行梯度 洗脱 [梯度混合器左侧放入50ml 0.02 mol/L pH值 为7.3的Tris-HCl缓冲液(含1 mol/L NaCl), 右侧放入等量0.02 mol/LpH值为7.3的Tris-HCl 缓冲液]。
10 ──反应10min
B ──每管加入酶液mL数 原始酶液的酶活力 E = (E′/2)×稀释倍数
分实验三:蔗糖酶各级分的蛋白含量测定 (G-250法)
啤酒酵母的蔗糖酶的提取、提纯及测定解读

浙江工业大学药学院生物化学实验论文2013 年12 月13日啤酒酵母蔗糖酶的提取、提纯及测定研究论文摘要:为了了解蔗糖酶的性质,我们用啤酒酵母做了一系列的实验,它们主要是以下内容:(1),蔗糖酶的提取与初提纯:a、先将酵母自溶,再两次离心得初提液A;b、接着调PH并加热、离心得热提取液B;c、用乙醇沉淀离心得提取液C。
(2),蔗糖酶的纯化—Q Sepharose 柱沉析法:先装柱,再安装盐度梯度发生器与柱的平衡,接着加样并洗脱,最后处理结果与交换剂的再生并得到提取液D。
(3),蔗糖酶活力的测定:第一人做葡萄糖标曲,第二人测定各提取液反应后的值,得各提取液的酶活力与回收率。
(4),蔗糖酶蛋白质含量的测定及活力OD540计算:遇上一个实验相反,第二人做标曲,第一个人测与各提取液相对应的OD660值,再对比得到各提取液的总蛋白、比活力、蛋白回收率、酶活回收率与纯化倍数。
(5),微量凯氏定氮法(以B为样品):先将样品B消化得消化液,洗涤定氮仪,再将消化液蒸馏,用HCl滴定馏出液,计算蛋白质含量。
(6),SDS-PAGE测定蛋白质的相对分子质量:首先制备分离胶并使之凝固,再制备浓缩胶使之在分离胶之上凝固,加处理后的样品和标准液,接着电泳,最后染色和脱色,确定样品相对分子质量。
关键词:蔗糖酶;蛋白质;提取;纯化;酶活力测定;Folin-酚试剂;微量凯式定氮;SDS-聚丙烯胺凝胶;标曲;电泳;正文:文献综述蔗糖酶(Sucrase,EC 3.2.1.26)又称转化酶(Invertase),可作用于β21,2糖苷键,将蔗糖水解为D2葡萄糖和D2果糖,广泛存在于动植物和微生物中,主要从酵母中得到。
蔗糖酶的最适温度为45℃-50℃,最适ph为4.0-4.5.实验原理、试剂与器材、操作方法、结果与分析、注意事项、认识与体会1 蔗糖酶的提取及初步提纯1.1实验原理酵母中含有蔗糖酶,而蔗糖酶属于胞内酶,所以常将细胞壁破碎后进行提取。
酵母蔗糖酶的提取分离纯化及其蛋白质浓和酶活力测定

分实验一:蔗糖酶的提取与初步纯化
一、实验目的
➢ 学习蔗糖酶分离提取的原理
➢ 学习掌握细胞破壁、有机溶剂沉淀蛋白质的原理 与操作
二、实验原理 细胞破碎的方法
高压匀浆破碎法(homogenization)
பைடு நூலகம்
机械法
振荡珠击破碎法 (Skaking Bead) 高速搅拌珠研磨破碎法(fine grinding)
蔗糖酶催化底物蔗糖分解成葡萄糖和果糖 蔗糖酶在酵母细胞中存在着两种形式 :
存在于细胞膜外细胞壁中的高度糖基化的外蔗糖酶,其活 力占蔗糖酶活力的大部分,是含有50%(质量分数)糖成 分的糖蛋白,该酶是蔗糖酶的主要形式
存在于细胞膜内侧细胞质中的低糖基化的内蔗糖酶。
本实验提取纯化的主要是外蔗糖酶
酵母细胞结构图
(4)平衡,4℃、10000rpm离心10min
(5)将上清液倒入量筒,量出体积并记录,转入清洁烧杯中。
(6)用pH试纸检查上清pH值,用1mol/L 乙酸将pH值调至5.0。
(7)将其置于50℃的水浴,经常缓慢搅拌,30min。
(8)于冰浴中迅速冷却,倒入100ml的离心管中,4℃,离心 10分钟。
酶是生物体内具有催化活性的物质,可据酶蛋 白的结构和性质来选择分离提纯方法和含量测 定。
酶的分离提纯是为了提高纯度(或比活力)及 收率;依据其性质(分子大小、溶解度、电荷、 吸附等)进行分离; 同时用测定酶活力的方法了 解酶的去向、衡量酶提纯的程度和得率。
本实验由四个分实验组成:
✓蔗糖酶的提取与初步纯化 ✓蔗糖酶各级分酶蛋白质浓度的测定 ✓蔗糖酶各级分酶活力的测定 ✓离子交换柱层析纯化蔗糖酶
超声波破碎法(ultrasonication) 渗透压冲击破碎法(osmotic shock)
实验四蔗糖酶各级分活性及蛋白质含量的测定

实验八蔗糖酶各级分活性及蛋白质含量的测定一、实验目的掌握蔗糖酶活性的测定方法,进一步熟悉蛋白质含量测定的操作。
二、实验原理为了评价分离纯化出的蔗糖酶,必须测定各极分酶活性和比活。
酸性条件下,蔗糖酶催化蔗糖水解生成一分子葡萄糖和一分子果糖。
用测定生成还原糖(葡萄糖和果糖)的量来测定蔗糖水解的速度。
蔗糖酶的活力单位指在一定条件下反应5min,每产生1毫克葡萄糖所需酶量。
蔗糖酶是一种蛋白质,在蛋白质浓度一定时,酶活力是随纯度的提高而升高。
比活力为每毫克蛋白质的活力单位数(活力单位/mg蛋白)。
三、实验器材与试剂1.试剂3,5-二硝基水杨酸试剂、标准葡萄糖溶液、0.2mol/L蔗糖、0.2mol/L,pH4.9乙酸溶液、标准牛血清蛋白溶液、考马斯亮兰G-250试剂。
2.器材分光光度计、水浴锅、试管、保鲜膜、秒表。
四、操作步骤1.各级分Ⅰ、Ⅱ、Ⅲ蔗糖酶活性测定A酶液的稀释用0.2mol/L ,pH4.9乙酸缓冲液稀释各级分酶液,测定酶活合适的稀释倍数:Ⅰ:1000-10000倍Ⅱ:1000-10000倍Ⅲ:100-1000倍以上倍数仅供参考。
B葡萄糖标准曲线的制作:以A520nm为纵坐标,以葡萄糖浓度为横坐标,绘制葡萄糖浓度的标准曲线。
C酶活力的测定将10%的蔗糖溶液稀释成pH4.5的6.5%(0.2mol/L)的溶液,取此溶液5ml置试管中(两支),将其放入25℃水浴保温5min,然后在一试管内加蔗糖酶液1.0ml,立即混匀,记时,反应5min,在加入0.1mol/LNaOH溶液终止反应;另一管先加入终止液再加入酶液,作为对照管。
取三支试管,在1,2管中分别加入上述反应液0.5ml二硝基水杨酸溶液,保鲜膜封口,沸水浴煮10min,取出后自来水冷却3min,加蒸馏水4ml,混匀,以第三管调零,于520nm处测定消光值(A520nm),以测定管的消光值减去对照管的消光值,以此值从标准曲线上求得相应的葡萄糖浓度,并乘以11,即为每ml酶溶液的活力。
【精品】蔗糖酶的提取纯化及蛋白质含量测定研究

论文论文题目:蔗糖酶的提取纯化及蛋白质含量测定研究作者姓名周柱林指导教师钟莉学科专业食品科学与工程1102所在学院生物与环境工程学院提交日期2013年12月蔗糖酶的提取纯化及蛋白质含量测定研究周柱林生物与环境工程学院食品科学与工程1102班摘要:对啤酒酵母蔗糖酶的相关性质进行研究讨论,实验采用酵母自溶法初步得到粗蔗糖酶,离心除杂质法得到初提取液A,接着制备热提取液B,接着制备乙醇沉淀提取液C,接着采用QSepharose-柱层析法得到纯度较高的D液,然后用DNS法、标准曲线法和分光光度法测定蔗糖酶的活力,用Folin-酚法测定蔗糖酶蛋白质含量及计算比活力,用微量凯氏定氮法测定总蛋白含量,最后用SDS-PAGE 法测定蛋白质的相对分子质量,并对其基本性质进行了研究。
实验测定结果A、B、C提取液的酶回收率(%)分别为100、128.5、56.6,蛋白回收率(%)分别为100、98.15、4.29,比活力分别为17.4、22.8、230.1,纯化倍数分别为1、1.31、13.22,SDS-PAGE测定酵母蔗糖酶相对分子质量为A:99150、45000;B:10140;C:92200、65660.关键词:蔗糖酶、提取、纯化、酶活力、蛋白质含量、比活力、相对分子质量1.前言(文献综述):啤酒酵母也叫营养酵母,可以从其中提取蔗糖酶,蔗糖酶又称为转化酶,属于水解酶类,蔗糖在蔗糖酶的催化下,水解为两种还原糖D一葡萄糖和D一果糖。
蔗糖酶在植物的运输贮藏、碳水化合物代谢中发挥主要作用,并在渗透调节、抗逆性生长繁殖、以及信号传导方面也发挥着重要的作用。
按水解蔗糖的方式,蔗糖酶可分为从果糖末端切开蔗糖的β-D-呋喃果糖苷酶(β-D-frutofuranosidases,EC 3.2.1.26)和从葡萄糖末端切开蔗糖的α-D-葡萄糖苷酶(α-D-glucosidases,EC 3.2.1.20)。
前者存在于酵母中,后者存在于霉菌中。
实验操作指导书:蔗糖酶的提取与部分纯化

(一)蔗糖酶的提取与部分纯化一、实验目的:学习酶的纯化方法,并为动力学实验提供一定量的蔗糖酶。
二、试剂:1. 啤酒酵母2. 二氧化硅3. 甲苯(使用前预冷到0℃以下)4. 去离子水(使用前冷至4℃左右)5. 冰块、食盐6. 1N乙酸7. 95%乙醇三、仪器:1. 研钵1个2. 离心管3个3. 滴管3个4. 量筒50ml 1个5. 水浴锅1个6. 恒温水浴7. 烧杯100ml 2个8. 广泛pH试纸9. 高速冷冻离心机四、操作步骤:1. 提取(1)准备一个冰浴,将研钵稳妥放入冰浴中。
(2)称取5g干啤酒酵母和20g湿啤酒酵母,称20mg蜗牛酶及适量(约10g)二氧化硅,放入研钵中。
二氧化硅要予先研细。
(3)量取预冷的甲苯30ml缓慢加入酵母中,边加边研磨成糊状,约需60分钟。
研磨时用显微镜检查研磨的效果,至酵母细胞大部分研碎。
(4)缓慢加入预冷的40ml去离子水,每次加2ml左右,边加边研磨,至少用30分钟。
以便将蔗糖酶充分转入水相。
(5)将混合物转入两个离心管中,平衡后,用高速冷离心机离心,4℃,10000rpm,10min。
如果中间白色的脂肪层厚,说明研磨效果良好。
用滴管吸出上层有机相。
(6)用滴管小心地取出脂肪层下面的水相,转入另一个清洁的离心管中,4℃,10000rpm,离心10min。
(7)将清液转入量筒,量出体积,留出1.5ml测定酶活力及蛋白含量。
剩余部分转入清洁离心管中。
(8)用广泛pH试纸检查清液pH,用1N乙酸将pH调至5.0,称为“粗级分I”。
2. 热处理(1)予先将恒温水浴调到50℃,将盛有粗级分I的离心管稳妥地放入水浴中,50℃下保温30分钟,在保温过程中不断轻摇离心管。
(2)取出离心管,于冰浴中迅速冷却,用4℃,10000rpm,离心10min。
(3)将上清液转入量筒,量出体积,留出1.5ml测定酶活力及蛋白质含量(称为“热级分II”)。
3. 乙醇沉淀将热级分II转入小烧杯中,放入冰盐浴(没有水的碎冰撒入少量食盐),逐滴加入等体积预冷至-20℃的95%乙醇,同时轻轻搅拌,共需30分钟,再在冰盐浴中放置10分钟,以沉淀完全。
蔗糖酶分离纯化产物的SDS-PAGE检测分析及蛋白质相对分子质量测定(精)

五、操作步骤 1、准备电泳装置:电泳槽、电泳仪。 2、配胶及凝胶的制备 (1)配制凝胶:
不连续体系SDS-聚丙烯酰胺凝胶配制
12%分离胶所需试剂量(ml) 5%浓缩胶所需试剂量(ml)
30.8%凝胶贮液
3
0.85
1.5mol/LTris-HCL pH8.9 分离胶缓冲液
1.9
0.5mol/L Tris-HCL pH6.7 浓缩胶缓冲液
四、实验器材 1、电泳仪、垂直电泳槽及配件(长短玻璃板各1块、封胶条2条、梳子1个) ;2、 微量移液器:1000μl、200μl、10μl; 3、烧杯、长滴管; 4、微量注射器50μl; 5、恒温水浴100℃; 6、高速台式离心机; 7、离心管(1.5ml、0.5ml)及离心管架; 8、¢15cm培养皿(染色、脱色用); 9、摇床(染色、脱色用) 。
3、样品处理与加样 ⑴样品处理
取蔗糖酶样品(样品Ⅰ、Ⅱ、Ⅲ、Ⅳ)各20ul(样品浓度约2~5mg/ml) , 分别放入1.5ml离心管中,并分别按等体积加入“2×蛋白质样品溶解液”, 100℃保温3分钟,取出冷却后,10000r/min离心1min,备用。 ⑵加样 ① 用微量注射器取样品处理液(取上清)10~20μl,向凝胶加样槽内注入样 品处理液(每孔蛋白质上样量在20~50μg) 。如样品浓度较低,可适当增加上 样量。 ②蛋白质分子量标准溶液加10μl/孔。
所带的电荷和分子质量的差异性进行分离;在电泳过程中仍保持蛋白质的天然 构象、亚基之间的相互作用及其生物活性。
6、聚丙烯酰胺凝胶电泳可分为: ⑴连续系统 凝胶缓冲液的pH值及凝胶浓度不变。该电泳系统具有电荷效应、 分子筛效应; ⑵不连续系统 凝胶缓冲离子成分、pH值、凝胶浓度、电位梯度不连续,由 浓缩胶和分离胶组成。由于浓缩胶的堆积(浓缩)作用,可使样品(即使是稀 释样品)在浓缩胶和分离胶的界面上先浓缩成一窄带,然后在一定浓度(或一 定浓度梯度)的凝胶上进行分离。该电泳系统具有浓缩效应、电荷效应、分子 筛效应。
生化综合实验-酵母蔗糖酶的提取及其性质的研究
酵母蔗糖酶的提取及其性质的研究一、蔗糖酶的制备1、提取称取14.997g干酵母粉于250ml小烧杯中,少量多次地加入50ml蒸馏水,搅拌均匀。
成糊状后加入1.499g乙酸钠、25ml乙酸乙酯,搅匀。
再于35℃恒温水浴中搅拌30min,然后补加30ml蒸馏水,搅匀,盖好,于35℃恒温过夜。
之后,1000r/min离心10min,抽取酯层后再次离心,得到无细胞提取液。
用1M HCl将其PH调至5.0,即可得到级分Ⅰ。
(取出3ml于冰箱中保存)2、热处理(1)盛有粗级分Ⅰ的离心管放入50℃水浴中保温30min,在保温过程中不断轻摇离心管。
(2)取出离心管,于冰浴中迅速冷却,用4℃,1000r/min离心10min。
(3)上清液即为热级分Ⅱ。
(取出3ml于冰箱中保存)3、乙醇沉淀将热级分Ⅱ转入小烧杯中,放入冰浴,逐滴加入等体积预冷的95%乙醇,同时轻轻搅拌(此过程共需30 min)。
然后在冰浴中静置10 min,以沉淀完全。
然后4℃,1000r/min离心10min。
倾去上清,并滴干。
将沉淀保存于离心管中,冷冻保存,此即级分Ⅲ。
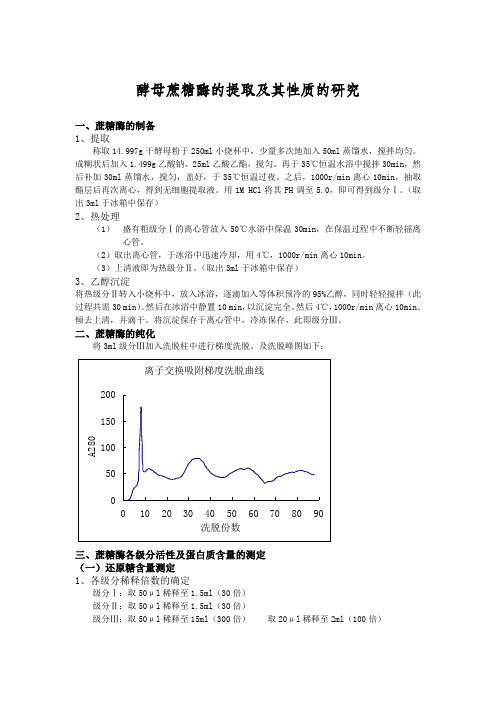
二、蔗糖酶的纯化将3ml级分Ⅲ加入洗脱柱中进行梯度洗脱。
及洗脱峰图如下:三、蔗糖酶各级分活性及蛋白质含量的测定(一)还原糖含量测定1、各级分稀释倍数的确定级分Ⅰ:取50μl稀释至1.5ml(30倍)级分Ⅱ:取50μl稀释至1.5ml(30倍)级分Ⅲ:取50μl稀释至15ml(300倍)取20μl稀释至2ml(100倍)释100倍。
在上述表格中,Glu含量是由标准曲线求得的,E'=Glu含量*稀释倍数/(10 min*0.6 ml)Units=0.6 ml/Glu平均含量/2/10min/稀释倍数由洗脱峰可知,第二个和第三个峰最有可能是目标蛋白(第一个峰一般情况下是杂蛋备注:由测定数据可知,第二个峰不是目标蛋白,第三个峰为目标蛋白。
(二)蛋白质含量测定1、各级分稀释倍数的确定由以上数据可知,级分Ⅰ和级分Ⅱ不需稀释,级分Ⅲ需稀释5倍。
啤酒酵母的蔗糖酶的提取、提纯及测定

啤酒酵母的蔗糖酶的提取、提纯及测定浙江工业大学药学院生物化学实验论文2021 年12 月 13日啤酒酵母蔗糖酶的提取、提纯及测定研究论文摘要:为了了解蔗糖酶的性质,我们用啤酒酵母做了一系列的实验,它们主要是以下内容:(1),蔗糖酶的提取与初提纯:a、先将酵母自溶,再两次离心得初提液A;b、接着调PH并加热、离心得热提取液B;c、用乙醇沉淀离心得提取液C。
(2),蔗糖酶的纯化—Q Sepharose 柱沉析法:先装柱,再安装盐度梯度发生器与柱的平衡,接着加样并洗脱,最后处理结果与交换剂的再生并得到提取液D。
(3),蔗糖酶活力的测定:第一人做葡萄糖标曲,第二人测定各提取液反应后的OD540值,得各提取液的酶活力与回收率。
(4),蔗糖酶蛋白质含量的测定及活力计算:遇上一个实验相反,第二人做标曲,第一个人测与各提取液相对应的OD660值,再对比得到各提取液的总蛋白、比活力、蛋白回收率、酶活回收率与纯化倍数。
(5),微量凯氏定氮法(以B为样品):先将样品B消化得消化液,洗涤定氮仪,再将消化液蒸馏,用HCl滴定馏出液,计算蛋白质含量。
(6),SDS-PAGE测定蛋白质的相对分子质量:首先制备分离胶并使之凝固,再制备浓缩胶使之在分离胶之上凝固,加处理后的样品和标准液,接着电泳,最后染色和脱色,确定样品相对分子质量。
关键词:蔗糖酶;蛋白质;提取;纯化;酶活力测定;Folin-酚试剂;微量凯式定氮;SDS-聚丙烯胺凝胶;标曲;电泳;正文:文献综述蔗糖酶(Sucrase,EC 3.2.1.26)又称转化酶(Invertase),可作用于β21,2糖苷键,将蔗糖水解为D2葡萄糖和D2果糖,广泛存在于动植物和微生物中,主要从酵母中得到。
蔗糖酶的最适温度为45℃-50℃,最适ph为4.0-4.5.实验原理、试剂与器材、操作方法、结果与分析、注意事项、认识与体会 1 蔗糖酶的提取及初步提纯1.1实验原理酵母中含有蔗糖酶,而蔗糖酶属于胞内酶,所以常将细胞壁破碎后进行提取。
啤酒酵母蔗糖酶提取、 分离纯化、性质鉴定及反应动力学实验

3,5-二硝基水杨酸比色定糖法工作曲线的制作Folin-酚法测定蛋白质含量工作曲线的制作米氏常数正交实验结果分析:啤酒酵母蔗糖酶提取、分离纯化、性质鉴定及反应动力学实验一、实验目的1、熟悉工作曲线的制作方法及注意事项;2、掌握3, 5-二硝基水杨酸(DNS)比色定糖的原理和方法;3、掌握Folin-酚法测定蛋白质含量的原理和方法;4、掌握酶蛋白分离提纯的原理;5、掌握酶的比活力测定及其计算方法;6、掌握酶促反应动力学中用双倒数法测定Km的方法;7、运用正交试验法确定温度、pH值、离子浓度的最适条件。
二、实验原理1、蔗糖酶的提取细胞破壁:就酶在生物体内的分布,可分为胞内酶和胞外酶,蔗糖酶系胞内酶。
提取胞内酶时,要破碎组织和细胞,然后用一定的溶液提取,得到的材料称为无细胞抽提液。
材料不同,破壁的方法也不同。
我们用的酵母菌细胞破壁方法有机械(匀浆)法、超声波处理法、反复冻融法、化学处理法、溶胞作用(酶溶解法)、自溶法,本实验采用自溶法。
自溶法即将新鲜的生物材料存放于一定的pH和适当的温度下,细胞结构在自身所具有的各种水解酶(如蛋白酶和酯酶等)的作用下发生溶解,使细胞内含物释放出来。
2、蔗糖酶的纯化(1)酶的蛋白属性①两性电离:蛋白质分子除两端的氨基和羧基可解离外,氨基酸残基侧链中某些基团,在一定的溶液pH条件下都可解离成带负电荷或正电荷的基团。
②等电点(isoelectric point, pI) :当蛋白质溶液处于某一pH时,蛋白质解离成正、负离子的趋势相等,即成为兼性离子,净电荷为零,此时溶液的pH 称为蛋白质的等电点。
③大分子(胶体) : 分子量可自1 万至100 万之巨,其分子的直径可达1~100nm,为胶粒范围之内。
④稳定的因素: 颗粒表面电荷、水化膜(2)调节酶溶解度的方法;①改变离子强度;盐析、硫酸铵分级沉淀(反抽提法)反抽提法(Back Extraction)例:E.coli RNA聚合酶42% - 50% 硫酸铵饱和度时沉淀通常方法:先33%-------再50%反抽提法:再42%将包含待分离酶在内的多种蛋白一起先沉淀出来,然后再选择适当的递减浓度的硫酸铵溶液来抽提沉淀物。
生物化学实验示范报告-蔗糖酶的提取与纯化(正确)

生物化学实验示范报告:实验名称:蔗糖酶的分离提取与纯化实验目的:1.掌握蔗糖酶分离提纯的原理与实验操作方法;2.掌握有机溶剂分级纯化蔗糖酶的原理和操作方法,了解蔗糖酶的离子交换层析法纯化原理;3.掌握酶活、酶比活等基本概念及测定原理、计算和操作方法;4.巩固并熟练掌握Folin法测定牛血清蛋白和3、5 -二硝基水杨酸法测定葡萄糖标准曲线制作方法,并能通过回归方程测定还原糖及蛋白质的含量。
实验原理:蔗糖酶分离提纯原理:酵母中的蔗糖酶含量很丰富,实验以安琪酵母粉为原料,首先采用自溶法破碎细胞壁、再用乙醇分级和DEAE—纤维素柱层析两步分离提纯,制备纯度较高的蔗糖酶制剂。
酶分离提纯的原理与蛋白质的相同。
但酶是有催化活性的蛋白质,在分离提纯过程中必须注意:防止酶变性失活;随时测定酶的比活力,并跟踪酶的去向、衡量酶提纯的程度及得率。
有机溶剂分级纯化蔗糖酶原理:利用不同蛋白质在不同浓度的有机溶剂—乙醇中溶解度的差异将蔗糖酶蛋白与其它蛋白质杂质进行有机溶剂分级沉淀,而使提取的蔗糖酶得以纯化(32%的乙醇饱和度沉淀分离杂蛋白,47.5%的乙醇饱和度沉淀分离酶蛋白)。
操作必须在低温下进行且避免有机溶剂局部过浓;分离后应立刻除去有机溶剂并用水或缓冲溶液溶解沉淀的酶蛋白(复溶),确保酶的活性;pH多选在酶蛋白的等电点附近;有机溶剂在中性盐存在时能增加蛋白质的溶解度减少变性,提高分离效果。
蔗糖酶的离子交换层析法纯化原理:本实验采用DEAE-纤维素(DEAE-C11)微粒状的、弱碱性的阴离子纤维素为柱料,进行蔗糖酶的进一步纯化。
它具有分辨率高、化学性质稳定、有开放性的长链结构、有较大的表面积、对蛋白质的吸附容量大等优点;纤维素上离子基团的数量不多,排列疏散,对蛋白质的吸附不是太牢固,用缓和的洗脱条件即可达到分离的目的,不致引起蛋白质的变性。
蔗糖酶活力与比活的测定:在蔗糖酶的纯化过程中,通过3、5-二硝基水杨酸法测定蔗糖酶催化蔗糖生成还原糖的量,测定酶活力大小,跟踪酶的活力。
实验六 酵母蔗糖酶的提取及纯化——生化实验文档资料文档

实验六 酵母蔗糖酶的提取及纯化原理蔗糖酶(invertase )(β—D —呋喃果糖苷果糖水解酶)(fructofuranoside fructohydrolase )(EC.3.2.1.26)特异地催化非还原糖中的α—呋喃果糖苷键水解,具有相对专一性。
不仅能催化蔗糖水解生成葡萄糖和果糖,也能催化棉子糖水解,生成密二糖和果糖。
每水解1mol 蔗糖,就生成2mol 还原糖。
还原糖的测定有多种方法,本实验采用Nelson 比色法测定还原糖量,由此可得知蔗糖水解的速度。
在研究酶的性质、作用、反应动力学等问题时都需要使用高度纯化的酶制剂以避免干扰。
酶的提纯工作往往要求多种分离方法交替应用,才能得到较为满足的效果。
常用的提纯方法有盐析、有机溶剂沉淀、选择性变性、离子交换层析、凝胶过滤、亲和层析等。
酶蛋白在分离提纯过程中易变性失活,为能获得尽可能高的产率和纯度,在提纯操作中要始终注意保持酶的活性如在低温下操作等,这样才能收到较好的分离效果。
啤酒酵母中,蔗糖酶含量丰富。
本实验用新鲜啤酒酵母为原料,通过破碎细胞,热处理,乙醇沉淀,柱层析等步骤提取蔗糖酶,并对其性质进行测定。
一、蔗糖酶的提取与部分纯化(一)实验目的学习酶的提取和纯化方法,掌握各步骤的实验原理,并为后续实验提供一定量的蔗糖酶。
(二)实验原理(略) (三)实验仪器、材料及试剂 仪器1. 高速冷冻离心机、恒温水浴箱、-20℃冰箱2. 电子天平、研钵(>200ml )、制冰机、50ml 烧杯3. 离心管(2ml ,10ml ,30ml 或50ml )、移液器(1000ul )或滴管、量筒 材料及试剂1. 市售鲜啤酒酵母(低温保存)2. 石英砂(海沙)、甲苯(使用前预冷到0℃以下)3. 95%乙醇(预冷-20℃)、去离子水(使用前冷至4℃左右)4. Tris-HCl (pH7.3)缓冲液 (四)操作步骤 1. 提取+ H 2O 蔗糖酶O HH O(1)将市售鲜啤酒酵母2000 rpm,离心10 min,除去大量水分。
蔗糖酶的提取及活力

蔗糖酶的提取及活力、含量和相对分子质量测定摘要:本学期共做了六次生化实验。
.第一次是提取及纯化蔗糖酶,以为后续实验提供样品。
实验主要目的是要求学生掌握高速离心机的使用。
实验共得到不同纯化度的三种提取液,标记为A、B、C。
将三种提取液分别放入冰箱保存,做为后续实验样品。
也因此做此实验时必须保证各个操作无误,及准确,以免影响后续实验的结果。
第二次是有关蔗糖酶的柱层析法,主要目的是要求同学掌握离子交换层析的原理及柱层析的操作技术及紫外吸收的分析方法。
此次实验通过柱层析及紫外吸收法得到2~3管的活力最大的分离液合并为分离液D,放入冰箱作为后续实验样品。
第三次实验为蔗糖酶的活力测定,目的为掌握酶的活力测定方法,了解各个酶的纯化情况。
利用分光度计测出各个样品的OD值,再对照葡萄糖的标准曲线来得出剩余葡萄糖的含量,从而获得各个酶的活力大小,了解各个酶的纯化情况。
并得出结论酶的纯化度越高,活力越小。
第四次实验为蔗糖酶蛋白质的含量测定,目的为掌握学习Folin-酚测定蛋白质含量的原理及方法,制备标准曲线测定未知样品中蛋白质含量。
同样利用与标准曲线对照来得到试样的蛋白质含量,并测出酶的比活力。
测量蛋白质的方法有多种,我们必须根据所做实验的具体选择合适的方法来测定蛋白质。
第五次的实验是微量凯氏定氮测总蛋白。
目的是要求同学掌握凯氏定氮法测定蛋白质含量的原理及方法。
本实验除利用了凯氏定氮法外还加上了酸式滴定法最后得出了毫克级别的总蛋白含量。
其结果与上一实验所测得的总蛋白质含量有所不同,正证明了不同的方法测量蛋白质造成的误差不同,致所得结果不同。
最后一次实验为SDS-PAGE测定蛋白质分子质量,目的为掌握SDS-聚丙烯酰胺凝胶电泳和测定蛋白质分子量技术。
此实验操作复杂,需先制作凝胶再结果染色脱色,最后还要制作标准蛋白分子质量曲线图来进行试样对照。
最后得到蔗糖酶的分子量在5万左右及9万左右。
关键字:实验;提取液;比活;蛋白质;SDS-PAGE;OD正文:1,蔗糖酶的提取及提纯1.1,文献综述:蔗糖酶的分离利用的是细胞破壁法。
“蔗糖酶的分离纯化及鉴定”实验目标及PBL问题

实验一、蔗糖酶的提取及粗分离一、实验目标1. 选择含蔗糖酶丰富的、价廉物美的材料,采用提取得率比较高的方法进行蔗糖酶的提取,得到初提取液。
2. 对初提取液进行初步分离,为后续的纯化提供样品。
二、导学问题1.蔗糖酶的用途,研究蔗糖酶的意义?蔗糖酶(Sucrase,EC 3.2.1.26)叉称转化酶(Invertase)。
可作用于B-1,2糖苷键,将蔗糖水解为n葡萄糖和n果糖。
由于果糖甜度高,约为蔗糖的1.36~1.60倍,在工业上具有较高的经济价值‘“。
可用以转化蔗糖,增加甜味,制造人造蜂蜜,防止高浓度糖浆中的蔗糖析出,制造含果糖和巧克力的软心糖,还可为果葡糖浆的工业化生产提供新的方法。
10分2.蔗糖酶有哪些性质?包括酶的适用pH和温度、等电点等。
蔗糖酶的最适温度为45℃~50℃,最适ph为4.0~4.5。
CuCl:对蔗糖酶有激活作用,而AgC]对蔗糖酶则其抑制作用,NaCI,KCl,FeSO。
对蔗糖酶活性无明显作用,但相对活力都保持在70%以上。
等电点5.610分3.蔗糖酶存在于什么材料中?你选择哪种材料来提取?为什么? 10分4.蔗糖酶属于胞内酶,提取前需要破壁,破壁方法有哪些? 15分5.蔗糖酶提取溶剂如何选择?为什么? 10分7.蛋白质的粗分离方法有哪些?各有什么优缺点?如何选择? 25分实验二、蔗糖酶的层析分离(一)一、实验目标根据初步纯化以后的样品性质选择一种柱层析方法进行纯化,目标是纯化效果好,回收率高。
二、导学问题1.蛋白质层析分离方法有哪些? 10分2.各层析分离方法的原理?适用范围? 15分3.准备用哪种层析方法进行纯化? 5分4.针对本实验的层析方法,选择实验条件有哪些?如何选择? 10分5.如何评价纯化方法的优劣? 10分6.如何快速测定纯化过程中样品的酶活力?5分7.什么是穿透峰?穿透峰中包含哪些物质? 10分8.穿透峰如果有酶活需要保存作为下个实验的样品吗?为什么? 10分9.什么是柱子的平衡?平衡的目的是什么? 5分10. 梯度洗脱方法有哪几种?各有什么优点? 10分11. 洗脱液的 pH如何选择? 5分12. 实验过程中要注意的事项? 5分实验三、蔗糖酶的层析分离(二)一、实验目标根据上个实验纯化以后的样品性质选择另一种层析方法进行纯化,目标是纯化效果好,回收率高。
啤酒酵母蔗糖酶的提取、纯化及测定研究

浙江工业大学海洋学院生物化学实验论文专业:食品科学与工程班级:食品1201姓名:徐素媛啤酒酵母蔗糖酶的提纯及相关性质测定研究作者:徐素媛单位:浙江工业大学海洋学院食工1201班摘要:为了了解酶的提取及及初提纯方法,并在此基础上掌握Q Sepharose-柱层析法提纯酶、DNS法测定酶活力、Folin-酚法和微量凯式定氮法测定蛋白含量以及SDS-PAGE测定蛋白质分子量的原理和方法,需要进行一系列的实验,主要实验过程如下:啤酒酵母自溶后经多次分别离心得到初提液A、热提取液B和乙醇提取液C。
利用Q Sepharose-柱层析法洗脱乙醇提取液C得到洗脱液,通过测定洗脱液的吸光值及酶活力的定性测定,选取活力最高的洗脱液得到柱分离液D。
接着进行定量酶活力测定,根据葡萄糖标准曲线的方程计算4个样品的总活力单位数和酶回收率,并得出随着蔗糖酶的不断提纯,酶的总活力单位数和酶回收率都逐渐减小。
随后用Folin-酚试剂法测样品中蛋白质的含量,与用微量凯氏定氮法测定的结果进行比较,后者测出的总蛋白含量比前者大,并得出A、B、C、D4个样品的比活力在一步步的纯化中逐渐升高,纯化倍数也明显增大,而总酶活、总蛋白和蛋白回收率却在下降。
最后用SDS-聚丙烯酰胺凝胶电泳法通过凝胶对样品的筛选分离、染色、洗脱等步骤测量蛋白质分子和染料的迁移距离来间接测定蔗糖酶的相对分子质量。
关键词:蔗糖酶提纯酶活力Folin-酚法微量凯式定氮法SDS-聚丙烯酰胺凝胶电泳法正文:1、文献综述1.1 总述啤酒酵母也叫营养酵母,为酵母科、酿酒酵母属,可作食用、药用和饲料酵母,还可以从其中提取核酸、谷胱甘肽、蔗糖酶、细胞色素c等营养物质[1]从啤酒酵母中提取蔗糖酶的一般工艺过程包括提取和分离纯化以及相关性质测定[2]。
1.2 蔗糖酶的提取蔗糖酶(Sucrase,EC 3.2.1.26)又称转化酶(Invertase),可作用于β-1,2糖苷键,并将蔗糖水解为D-葡萄糖和D-果糖。
大实验 酵母蔗糖酶的提取及其性质的研究
大实验酵母蔗糖酶的提取及其性质的研究本实验为学生提供一个较全面的实践机会,学习如何提取纯化、分析鉴定一种酶,并对这种酶的性质作初步的研究。
一.实验原理及相关知识(1)蔗糖酶的介绍自1860年Bertholet从酒酵母Sacchacomyces Cerevisiae中发现了蔗糖酶以来,它已被广泛地进行了研究。
蔗糖酶(invertase)(fructofuranoside fructohydrolase)(EC.3.2.1.26)特异地催化非还原糖中的 —呋喃果糖苷键水解,具有相对专一性。
不仅能催化蔗糖水解生成葡萄糖和果糖,也能催化棉子糖水解,生成蜜二糖和果糖。
(2)。
实验原理:本实验提取面包酵母中的蔗糖酶。
该酶以两种形式存在于酵母细胞膜的外侧和内侧,在细胞膜外细胞壁中的称之为外蔗糖酶(external yeast invertase), 其活力占蔗糖酶活力的大部分,是含有50% 糖成分的糖蛋白。
在细胞膜内侧细胞质中的称之为内蔗糖酶(internal yeast invertase),含有少量的糖。
两种酶的蛋白质部分均为双亚基,二聚体,两种形式的酶的氨基酸组成不同,外酶每个亚基比内酶多两个氨基酸,Ser和Met,它们的分子量也不同,外酶约为27万(或22万,与酵母的来源有关),内酶约为13.5万。
尽管这两种酶在组成上有较大的差别,但其底物专一性和动力学性质仍十分相似,因此,本实验未区分内酶与外酶,而且由于内酶含量很少,极难提取,本实验提取纯化的主要是外酶。
两种酶的性质对照表如下:实验中,用测定生成还原糖(葡萄糖)的量或旋光法来测定蔗糖水解的速度,在给定的实验条件下,每分钟水解底物的量定为蔗糖酶的活力单位。
比活力为每毫克蛋白质的活力单位数。
本实验共有以下分实验:一、蔗糖酶的提取与部分纯化二、离子交换柱层析纯化蔗糖酶三、蔗糖酶各级分活性及蛋白质含量的测定四、反应时间对产物形成的影响(一)蔗糖酶的提取与部分纯化:一、实验目的:学习酶的纯化方法。
蔗糖酶分离纯化与活力测定

考马斯亮兰法测定蛋白质含量的原理
考马斯亮兰G 250在酸性溶液时呈茶棕色,最大吸收峰在465nm。 考马斯亮兰G-250在酸性溶液时呈茶棕色,最大吸收峰在465nm。 在酸性溶液时呈茶棕色 465nm 当与蛋白质结合后变成深蓝色,最大吸收峰转至595nm,在10当与蛋白质结合后变成深蓝色,最大吸收峰转至595nm, 10595nm 100μg/mL蛋白质浓度范围内成正比 蛋白质浓度范围内成正比; 100μg/mL蛋白质浓度范围内成正比; 测定各级分蛋白质含量时应稀释适当倍数,使其测定值在标准曲 测定各级分蛋白质含量时应稀释适当倍数, 线的直线范围内 根据所测定的A595nm值 在标准曲线上查出相当于标准蛋白的量, 根据所测定的A595nm值,在标准曲线上查出相当于标准蛋白的量, A595nm 从而计算出未知样品的蛋白质浓度(mg/mL) 从而计算出未知样品的蛋白质浓度(mg/mL)
热处理和乙醇沉淀
预先将恒温水浴调到50℃ 将盛有粗级分I 50℃, (1) 预先将恒温水浴调到50℃,将盛有粗级分I的离心管稳妥 下保温30分钟, 地放入水浴中,50℃下保温30分钟 地放入水浴中,50℃下保温30分钟,在保温过程中不断轻 摇离心管。 摇离心管。 取出离心管, 冰浴中迅速冷却, 4℃,10000rpm, (2) 取出离心管,于冰浴中迅速冷却,用4℃,10000rpm,离 10min。 心10min。 将上清液转入小烧杯中,放入冰盐浴( (3) 将上清液转入小烧杯中,放入冰盐浴(没有水的碎冰撒 入少量食盐),逐滴加入等体积预冷至-20℃的95%乙醇 ),逐滴加入等体积预冷至 乙醇, 入少量食盐),逐滴加入等体积预冷至-20℃的95%乙醇, 同时轻轻搅拌,共需30分钟,再在冰盐浴中放置10分钟, 30分钟 10分钟 同时轻轻搅拌,共需30分钟,再在冰盐浴中放置10分钟, 以沉淀完全。 4℃,10000rpm,离心10min 倾去上清, 10min, 以沉淀完全。于4℃,10000rpm,离心10min,倾去上清, 并滴干,沉淀保存于离心管中,盖上盖子或薄膜封口, 并滴干,沉淀保存于离心管中,盖上盖子或薄膜封口,然 后将其放入冰箱中冷冻保存(称为“级分Ⅱ )。 后将其放入冰箱中冷冻保存(称为“级分Ⅱ”)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
论文论文题目:蔗糖酶的提取纯化及蛋白质含量测定研究作者姓名周柱林指导教师钟莉学科专业食品科学与工程1102所在学院生物与环境工程学院提交日期2013年12月蔗糖酶的提取纯化及蛋白质含量测定研究周柱林生物与环境工程学院食品科学与工程1102班摘要:对啤酒酵母蔗糖酶的相关性质进行研究讨论,实验采用酵母自溶法初步得到粗蔗糖酶,离心除杂质法得到初提取液A,接着制备热提取液B,接着制备乙醇沉淀提取液C,接着采用Q Sepharose-柱层析法得到纯度较高的D液,然后用DNS法、标准曲线法和分光光度法测定蔗糖酶的活力,用Folin-酚法测定蔗糖酶蛋白质含量及计算比活力,用微量凯氏定氮法测定总蛋白含量,最后用SDS-PAGE法测定蛋白质的相对分子质量,并对其基本性质进行了研究。
实验测定结果A、B、C提取液的酶回收率(%)分别为100、128.5、56.6,蛋白回收率(%)分别为100、98.15、4.29,比活力分别为17.4、22.8、230.1,纯化倍数分别为1、1.31、13.22,SDS-PAGE测定酵母蔗糖酶相对分子质量为A:99150、45000;B:10140;C:92200、65660.关键词:蔗糖酶、提取、纯化、酶活力、蛋白质含量、比活力、相对分子质量1.前言(文献综述):啤酒酵母也叫营养酵母,可以从其中提取蔗糖酶,蔗糖酶又称为转化酶,属于水解酶类,蔗糖在蔗糖酶的催化下,水解为两种还原糖D一葡萄糖和D一果糖。
蔗糖酶在植物的运输贮藏、碳水化合物代谢中发挥主要作用,并在渗透调节、抗逆性生长繁殖、以及信号传导方面也发挥着重要的作用。
按水解蔗糖的方式,蔗糖酶可分为从果糖末端切开蔗糖的β-D-呋喃果糖苷酶(β-D-frutofuranosidases,EC 3.2.1.26)和从葡萄糖末端切开蔗糖的α-D-葡萄糖苷酶(α-D-glucosidases,EC 3.2.1.20)。
前者存在于酵母中,后者存在于霉菌中。
工业上多从酵母中提取。
目前关于酵母中蔗糖酶提取纯化方面的研究较多 , 有SDS抽提法,正交法等等,其中以甲苯自溶法最为常见。
本实验采用此自溶法从啤酒酵母中提取蔗糖酶,利用有机溶剂将胞内蔗糖酶释放,经过初提取的离心去杂和等电位沉淀,制得的粗酶经醇沉后,采用Q Sepharose-柱层析法纯化,利用DNS法测定其酶活力,利用Folin-酚法测定蛋白质的含量及比活力,利用微量凯氏定氮法测总蛋白氮,以及用SDS-PAGE测定蛋白质的相对分子质量,并对其基本性质进行了研究,也为酵母蔗糖酶在食品工业中的应用和蔗糖酶基因工程产品的技术开发提供了实验依据。
本实验目的在于用自溶法提取酵母蔗糖酶的过程中,测定各步的总蛋白、总活力,并据此计算比活、回收率和纯化倍数。
2.材料与方法2.1 材料:啤酒酵母2.2 试剂与仪器2.2.1 试剂:醋酸钠;甲苯;95%乙醇;0.5mol/L Tris-HCl pH7.3缓冲液;4mol/L 醋酸;0.05mol/L Tris-HCl pH7.3缓冲液;1mol/L NaCl 的0.05mol/L Tris-HCl pH7.3缓冲液;0.5mol/L NaOH; Q-Sepharose;DNS;葡萄糖标准溶液;0.2mol/L pH4.6 醋酸缓冲液;2mol/L NaOH; 5% 蔗糖;试剂A(碱性铜试剂);试剂B(酚试剂);标准浓度牛血清白蛋白溶液;浓硫酸;硫酸钾3份与硫酸铜1份(质量分数)混合粉末;30%NaOH; 2%硼酸溶液;混合指示剂; 0.01mol/L HCl标准溶液;30%丙烯酰胺贮液;10%过硫酸铵溶液;分离胶缓冲液贮液;浓缩胶缓冲液贮液; 2*SDS-样品缓冲液;SDS-电极缓冲液贮存液;染色液;脱色液。
2.2.2 仪器:恒温水浴锅,恒温培养箱,高速冷冻离心机、磁力搅拌器或梯度混合器,搅拌子层析柱、梯度发生器及搅拌子、紫外分光光度计、点滴板,电炉,恒温水浴锅,分光光度计721分光光度计,刻度吸管0.5ml(*1),2ml*2, 5ml*1,试管1.5cm*15cm( *8),恒温水浴槽,改良式凯氏定氮仪,DYY-60型电泳仪。
2.3实验过程及方法2.3.1 蔗糖酶提取及初提纯a.酵母的自溶在250ml锥形瓶中加入鲜酵母20g、醋酸钠1.6g,加入1.5ml 甲苯用滤布加牛皮纸将瓶口塞住,摇匀10min,放入37℃培养箱保温60h,使酵母自溶。
b.制备初提液A 在培养箱中取出装有已自通酵母的锥形瓶,加入10ml蒸馏水,摇匀,倒入塑料离心管中,平衡后用高速冷冻离心机4℃、15000r/min离心10min。
小心取出离心后中间层的液体,重新倒入离心管中,4℃、15000r/min,取出3ml保存。
离心10min。
仔细倒出上层清液,测出体积为VAc.制备热提取液B 预先将水浴加热到50℃,将初提液A倒入50ml的锥形瓶中,加4mol/L醋酸3.2ml左右,摇匀,水浴保温20min,在保温过程中不断摇动锥形瓶,取出后迅速在冰浴中冷却,冷却液于4℃、15000r/min离心10min。
测出上层清液,取出3ml保存。
的体积记为VBd. 制备乙醇沉淀提取液C将热提取液B倒入100ml烧杯中,把烧杯放入冰浴中,轻轻搅拌并慢慢加入95%乙醇溶液,体积与热提取液B 相同。
整个过程不少于20min,再继续搅拌5min,将烧杯内的液体全部移入离心管中,杯底白色固体保留待用,4℃、15000r/min离心10min。
仔细地倒掉上层清液,用5ml0.05mol/LTris-HClpH7.3缓冲液把烧杯中的白色固体溶解,倒入离心管搅拌使离心管内的白色固体溶解,4℃、15000r/min离心10min。
测量上层清液体积V,全部保存。
C2.3.2 蔗糖酶的纯化Q Sepharose -柱层析法A 离子交换柱的填充B 缓冲液盐度梯度发生器的安装C 柱的平衡:交换剂成为相应的交换型①在小烧杯中加入15毫升Tris HCl②恒流泵进口插入烧杯液面下③恒流泵出水管一端连接柱子④放松夹子⑤打开恒流泵⑥用Tris HCl冲洗⑦直到缓冲液面与交换剂相切D 加样及洗穿透峰①夹紧下端夹子, 在烧杯加入15毫升Tris HCl②从上部缓慢加入0.5ml提取液C,放松夹子③样品全部刚好进入交换剂内,相切,夹紧夹子⑤先打开恒流泵,再放开夹子,⑥用量筒收集全部流出液体,每管收集3ml⑦直到液面相切E 洗脱①将梯度发生器出口与恒流泵相连②恒流泵与柱相连③打开搅拌器,打开连通器旋钮,打开恒流泵④用20 毫升Tris HCl 缓冲液配制的1摩尔/升 NaCl20 毫升溶液开始梯度洗脱打开夹子⑤用量筒收集3 毫升/管,直到全部缓冲液流出F 离子交换剂的再生烧杯加入15 毫升 NaCl洗脱→不用收集→凝胶冲到小烧杯→全部凝胶回收G 测吸光度,酶活力测试,取酶活力最高的2管为柱分离液D。
2.3.3 蔗糖酶活力的测定2.3.3.1葡萄糖标准曲线制作:烧水,不要太多,进行DNS反应:注意振荡混匀,移液管对应,要及时清洗2.3.3.2 酶活力测定A,稀释样品,浓度从低到高,即C→B→A,防止污染。
2.3.4 蔗糖酶蛋白质含量测定及比活力计算2.3.4.1蛋白质含量标准曲线绘制 :Folin-酚反应试管号0 1 2 3 4 5标准牛血清蛋白液0 0.2 0.4 0.6 0.8 1.0 /ml蒸馏水/ml 4.5 4.3 4.1 3.9 3.7 3.5 试剂A/ml 1.0 1.0 1.0 1.0 1.0 1.00.3 0.3 0.3 0.3 0.3 0.3 试剂B/ml 第一次0.2 0.2 0.2 0.2 0.2 0.2第二次总体积/ml 6.0 6.0 6.0 6.0 6.0 6.0 A660 0 0.181 0.323 0.457 0.576 0.703 2.3.4.2 未知蛋白质浓度测定A 样品稀释2.3.5 微量凯氏定氮法测总蛋白氮将0.04ml B样液与3ml浓硫酸、20mg硫酸钾-硫酸铜混合物加热消化。
洗涤微量凯氏定氮仪时,用装有10ml 2%硼酸溶液和4滴混合指示剂的锥形瓶检测,变绿则重新洗涤。
将消化液定容至50ml,取5ml于反应室,同时加入10ml30% NaOH,用少量水洗涤漏斗后水封。
等到颜色变绿后计时3min,再蒸馏1min,滴定。
六次滴定消耗HCl的体积(ml)分别为:0.48、0.55、0.52、0.45、0.50、0.50 。
2.3.6 SDS-聚丙烯酰胺凝胶电泳测定蛋白质的相对分子质量2.3.6.1 分离胶制备①配分离胶成分:12%分离胶②各成分加入小烧杯,加入每一种应立即用塑料吸管抽吸慢慢混匀,不要有过多气泡③TEMED最后加入,马上灌胶④用塑料吸管从一边加入玻璃板之间,防止气泡,不要全部挤入(2/3高度,梳子下端距分离胶上边缘 1.5cm ⑤加水覆盖,加满水,出现界面,再次出现界面聚合完成,⑥倒出水,用滤纸条吸出表面的水⑦聚合30~60 min2.3.6.2 浓缩胶制备①用滤纸吸干水层②配制5%浓缩胶:5% ③各成分加入小烧杯,加入每一种应立即用塑料吸管抽吸慢慢混匀,不要有过多气泡④ TEMED最后加入,马上灌胶⑤用塑料吸管从一边加入玻璃板之间,混匀加入在分离胶上层⑥插入梳子,不要插反⑦聚合⑧取出梳子(注意用力平衡,不要左右摇摆)⑨用滤纸条除去样品槽内的水分。
⑩撕去胶条,玻璃板方向:凹槽向内,不要用力压2.3.6.3 加样品:加入样品和marker,进行电泳。
电泳结束后,染色4h,然后用脱色液脱色三次。
以maker中标准蛋白质相对分子量的对数(lgMW)为纵坐标,相对迁移距离为横坐标作图,得到标准曲线。
然后根据样品蛋白质分子的相对迁移距离,从标准曲线上查出其相对分子质量。
3.结果与分析3.1 蔗糖酶的提取及初提纯,蔗糖酶的纯化——Q Sepharose-柱层析法3.1.1 实验结果V A=18.8ml V B=18.5ml V c=5.8ml V D=5.8mlV A总= V A =18.8mlV B总=V B·[V A/(V A-3)]= 18.5·[18.8/(18.8-3)]=22.01mlV c总=V c·[V A/(V A-3)]·[V B/(V B-3)]=V C·[V B总/(V B-3)] = 5.8·[22.01/(18.5-3)]=8.34mlV D总=V D·V C总/V样=5.8*8.8/0.5=96.75ml3.1.2 结果分析A. VB较大是因为在离心前平衡时加入了较多的蒸馏水是V B增大。
B、在同一温度下,溶液中各物质的量不同,所以溶解度不同,对蔗糖酶进行纯化。
