感染性疾病相关个体化医学分子检测技术指引
分子生物学技术在医学检验中的有效应用

分子生物学技术在医学检验中的有效应用分子生物学技术是一种通过分析和操作生物分子来研究生物学问题的技术手段。
在医学检验中,分子生物学技术的应用已经取得了显著的成就,并且为诊断和治疗疾病提供了有效的手段。
本文将详细介绍分子生物学技术在医学检验中的应用,主要包括基因检测、肿瘤标记物检测和传染病检测。
第一,基因检测是分子生物学技术在医学检验中的重要应用之一。
通过基因检测,可以检测个体的基因组,了解其潜在的遗传病风险以及疾病的易感性。
遗传性疾病,如先天性心脏病、血友病和遗传性癌症等,都可以通过基因检测进行早期诊断和风险评估。
基因检测还可以用于预测个体对药物的反应,从而指导个体化的药物治疗。
基因检测还可用于检测个体的人体衰老进程、准确预测肿瘤的分子亚型等。
第二,肿瘤标记物检测是分子生物学技术在肿瘤诊断和治疗中的应用之一。
肿瘤标记物是指能够在肿瘤发生和发展过程中产生的特定分子,如肿瘤相关基因、蛋白质和代谢产物等。
通过检测肿瘤标记物的水平,可以进行早期肿瘤的筛查、病情的监测以及治疗的评估。
前列腺特异性抗原(PSA)是前列腺癌常用的标志物,可以用于前列腺癌的早期筛查和复发监测。
血液中的循环肿瘤DNA(ctDNA)检测可以用于肿瘤的早期诊断、分子亚型鉴定、治疗效果评估和预后预测。
传染病检测是分子生物学技术在医学检验中的又一重要应用。
传染病是由微生物(如细菌、病毒、真菌和寄生虫)引起的疾病,传染病检测的目的是快速、准确地检测病原体的存在并确定其类型。
分子生物学技术在传染病检测中已经取得了显著的进展。
PCR技术可以通过扩增病原体特异性基因片段来检测病原体的存在,具有高度敏感性和特异性。
分子生物学技术还可以用于检测病原体的耐药性基因,指导临床合理使用抗生素等。
感染性疾病相关个体化医学分子检测技术指南

感染性疾病相关个体化医学分子检测技术指南前言感染性疾病是当今世界严重威胁人类健康的重大疾病,快速、准确的诊断是有效治疗、病情监测和控制疾病蔓延的重要前提。
随着分子检测技术的不断发展和完善,分子检测在病原微生物感染诊断及治疗监测上的临床应用日益广泛,已成为一些重要的感染性疾病的诊断和疗效评价中不可缺少的重要工具。
为使我国的感染性疾病分子检测临床应用健康有序发展,更好的为医患提供高质量的服务,有必要制订感染性疾病相关的分子检测技术指南,规范临床实验室相关分子检测操作程序,指导从事感染性疾病分子诊断的医务人员正确开展工作。
本指南以大量、丰富的临床实践为基础,同时消化吸取了大量国内外文献的精华,广泛征求相关学科专家的意见,遵循科学性、实用性、可行性的原则,反复修改而成。
我们衷心希望《感染性疾病相关个体化医学分子检测技术指南》能够对广大检验人员起到很好的帮助和指导作用,从而为提高感染性疾病临床诊治水平发挥积极的作用本指南起草单位:中国医科大学附属第一医院、国家卫生计生委临床检验中心本指南起草人:尚红、李金明、郭晓临、代娣、程仕彤目录1. 本指南适用范围 (3)2. 标准术语 (3)3. 感染性疾病相关的个体化医学分子检测概述 (9)4. 感染性疾病相关的个体化医学分子检测分析前质量控制 (12)4.1 标本采集 (13)4.2 标本的转运 (16)4.3 标本的接收 (17)4.4 标本的保存 (18)4.5 检验项目的选择 (19)5. 感染性疾病相关的个体化医学分子检测分析中质量控制 (20)5.1 实验室的设计要求 (20)5.2常用的分子检测方法 (21)5.3 试剂和方法的选择 (29)5.4 设备维护和校准 (36)5.5 人员培训 (36)5.6 试剂性能验证 (37)6. 感染性疾病相关的个体化医学分子检测分析后质量控制 (40)6.1 结果报告 (40)6.2 结果的解释及医患的沟通 (41)6.3 检测后标本的保存及处理 (42)7. 质量保证 (42)7.1 标准操作程序 (42)7.2 质控品 (42)7.3 室内质量控制 (43)7.4 室间质量评价 (47)8. 感染性疾病相关的个体化医学分子检测应用 (48)8.1 乙型肝炎病毒感染诊疗的个体化分子检测 (48)8.2 丙型肝炎病毒感染诊疗的个体化分子检测 (52)8.3 结核分枝杆菌感染诊疗的个体化分子检测 (56)8.4 人获得性免疫缺陷病毒感染诊疗的个体化分子检测 (57)附录 (65)参考文献 (66)1.本指南适用范围本指南由国家卫生计生委个体化医学检测技术专家委员会编订,是国家卫生计生委个体化医学检测技术系列指南之一,旨为临床实验室进行感染性疾病相关的个体化医学分子检测提供参考和指导。
标准操作规程(SOP)——分子鉴别诊断技术

标准操作规程(SOP)——一、目的在以监测禽流感病毒为主要目标的同时,对其他重要常见呼吸道感染病毒的确诊提供重要的参考依据。
国家流感中心实验室按照规定方法对不明原因呼吸道感染病例的标本进行处理和检测,使病例标本的处理和检测得到有效的控制。
保证检测结果的快速性和可靠性,同时确保样本不被污染和污染环境。
二、范围适用于中国国家流感中心操作人员进行不明原因呼吸道感染病例标本的检测。
三、定义(一)分子鉴别诊断技术(Molecular Differential Diagnosis, MDD):利用急性呼吸道感染的多重分析系统,将靶序列富集多重PCR(Target enriched multiplex PCR,Tem-PCR)和Multiple Analysis Profiling(xMAP)技术有机结合,能鉴别诊断禽流感及流感等重要呼吸道病毒,包括呼吸道合胞病毒、流感甲型、流感乙型、副流感Ⅰ、Ⅱ、Ⅲ型、腺病毒Ⅳ、Ⅶ型,同时对感染病毒的亚型等信息进行汇报,包括人群中常见的H1, H3型和近来备受关注的H5,H7和H9型。
(二)平均荧光强度值(Mean fluorescence intensity,MFI):杂交反应过程分子在颜色编码的微球表面进行反应,对于每一种病原体,靶序列特异的捕获探针与一组颜色编码的微球之间形成特异的共价结合。
在杂交悬浮体系中,标记的PCR 产物被结合有微球的探针捕获。
Luminex 200分析样品时,经过一套微流体系统检测装置,红色激光识别病原体,绿色激光检测杂交信号,即MFI值,根据MFI 值的强弱从而显示特定病原体的有无。
四、程序(一)生物安全要求H5、H7亚型高致病性禽流感病毒,H2N2亚型流感病毒的操作需要在BSL-3级实验室中进行,并遵守BSL-3级实验室生物安全操作规程,参见“生物安全个人防护SOP”。
其余流感病毒的操作需要在BSL-2级实验室中进行,并遵守BSL-2级实验室生物安全操作规程,参见“生物安全个人防护SOP”。
感染性疾病的分子诊断
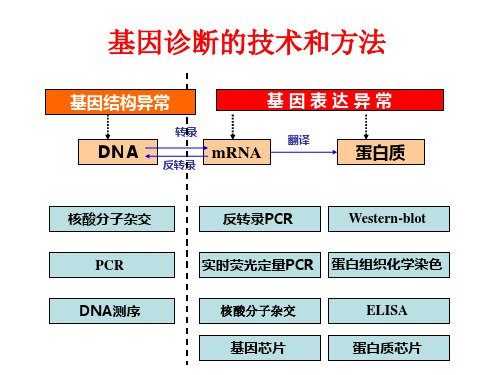
四、结果解释
1.阴性结果
注意:灵敏度,核酸提取及扩增效率.
2.阳性结果
注意:特异性,可能的污染.
3.定性检测结果
注意:病情缓解患者.
4.疾病状况的判断
五、应用及评价
1.弥补血清学诊断缺陷
注意:窗口期,灵敏度,部分特殊病例.
2.不能培养或生长缓慢微生物
3.监测疾病状态 4.耐药性及分型检测
第二节 病毒基因检测
杂交捕获系统
二、分子诊断方法
2.靶分子扩增技术(PCR/TAS/LCR)
转录依赖的扩增系统(TAS)
特点: 简单、快速、 灵敏度高
连接酶链反应(LCR)
三、标本处理
1.标本选择
选择原则:符合疾病的发病机制,反映病程 标本类型:血浆、血清、全血或白细胞 核酸类型:DNA\RNA\miRNA
2.标本量、抗凝剂 3.标本保存、传送 4.标本预处理
5’-NCR C E1 NS1/E2 NS2 NS3 NS4 NS5B 3’-NCR 高变异区(编码衣壳和包膜蛋白) (NCR: 非编码区)
5’-NCR为保守的区域,将引物设计在该区域, 进行RT-PCR, 可特异性的扩增HCV。
分子检测方法:
1.HCV的RNA定性及定量检测
RT-PCR, 巢式PCR,定量PCR,转录依赖的
1、感染性疾病:
病原生物的侵入如流感、肝炎、艾滋病
பைடு நூலகம்
2、遗传性疾病:
如苯丙酮尿症、血友病等
3、复杂性疾病,如肿瘤、原发性高血压
严永敏
基础医学与医学技术学院
第一节
诊断策略及诊断方法 标本处理 病毒的基因检测 病原菌的基因检测
一、分子诊断策略
一般性检出策略和方法
分子诊断技术在感染性疾病诊断中的应用前沿

分子诊断技术在感染性疾病诊断中的应用前沿随着科技的不断进步,分子诊断技术在感染性疾病的诊断中扮演着越来越重要的角色。
分子诊断技术通过检测人体内的特定基因、蛋白质以及其他分子标志物,能够准确、快速地诊断出感染性疾病,为临床治疗提供及时有效的指导。
本文将介绍分子诊断技术在感染性疾病诊断中的应用前沿。
一、分子诊断技术简介分子诊断技术是一种利用分子生物学和生物化学的方法进行疾病检测和诊断的新兴技术。
它利用了人体内微量的分子标志物,如DNA、RNA、蛋白质等,通过特定的实验方法进行检测,从而准确地诊断出感染性疾病。
在感染性疾病的诊断中,传统的方法往往需要培养和鉴定病原微生物,操作繁琐、耗时且存在很大误差。
而分子诊断技术则能够通过直接检测病原微生物的核酸或蛋白质等标志物,极大地提高了诊断的准确性和快速性。
二、PCR技术的应用聚合酶链反应(Polymerase Chain Reaction,PCR)是目前应用最广泛的分子诊断技术之一。
PCR技术通过扩增病原微生物的DNA片段,能够在非常短的时间内获得大量特定的基因组DNA。
在感染性疾病的诊断中,PCR技术被广泛应用于包括呼吸道感染、血液感染、泌尿道感染等在内的多个领域。
例如,在呼吸道感染的诊断中,通过采集患者的呼吸道标本,利用PCR技术快速检测出病原微生物的核酸,可以准确地确定感染性病原体,从而指导治疗方案的选择。
PCR技术的快速性和准确性为感染性疾病的早期诊断提供了重要的手段。
然而,PCR技术在一定程度上存在着对特殊设备和操作技术的依赖,同时也容易受到样品质量和操作误差的影响。
三、下一代测序技术的发展随着生物技术的不断发展,下一代测序技术(Next Generation Sequencing,NGS)逐渐兴起并广泛应用于感染性疾病的诊断中。
NGS 技术能够快速、准确地测序全基因组的DNA或RNA,不受研究对象的限制。
在感染性疾病的诊断中,NGS技术能够对患者样本中的全部基因组进行测序,并通过比对分析找出病原微生物的基因组序列,从而实现全面的病原微生物检测和鉴定。
分子诊断在感染性疾病中的应用

• FQ-PCR进行HBV DNA的定量检测,检测范围为 2.5×102~2.5×109 copies/ml
• 检测样本中5×102 copies/ml≤HBV DNA≤5×107 copies/ml, 测定结果有效,可直接报告相应的拷贝数
• 检测样本中HBV DNA>5×107 copies/ml,既可直接报告为 >5×107copies/ml,也可用正常人血清按10倍剃度做相应稀 释,使其拷贝数落在1×105-5×107 copies/ml范围内,再重 新测定,测定结果应以稀释倍数进行校正
-靶扩增技术如定量PCR方法 -信号扩增技术如支链DNA法
HCV RNA定量(real-time RT-PCR)
• 质控标准
– 阴性对照的检测结果为阴性 – 强阳性对照的Ct值应小于等于30.0 – 临界阳性对照的Ct值应大于强阳性对照的Ct值 – 否则此次实验视为无效
• 结果判断
– Ct值无数值的样本为阴性样本 – Ct值≤36.0的样本为阳性 – Ct值大于36.0的样本建议重做,重做结果无数值者为阴
• 检测样本HBV DNA<5×10²copies/ml时,拷贝数仅供参考, 报告为小于最低检出限
• Ct值无数值时, 报告为0.0 copies/ml
支链DNA(bDNA)技术
一种核酸探针杂交标志信号放大技术 。 优点:稳定性和重复性较好,结果准确,操作简单,
将待测病毒裂解释放核酸后变性为单链,即 可进行检测 。 缺点:敏感性较低、检测范围窄而不适用于低水平病 毒的检测 。
HIV在宿主细胞中的复制
靶细胞:CD4+ T 细胞
Step 1: Binding Step 2: Reverse Transcription Step 3: Integration Step 4: Replication Step 5: Translation Step 6: Viral Assembly
2 个体化医疗的分子诊断技术(珠江医院)

个体化医疗的分子诊断技术一、肿瘤个体化医疗与分子诊断二、个体化用药的基因检测三、个体化医疗的常见分子诊断技术四、临床实践一、肿瘤个体化医疗与分子检测肿瘤个体化治疗后基因组时代临床科学的必然走向病人群体传统治疗个性化治疗少多少个体化治疗=个体化诊断+ 靶点药物低毒、高效, 提高患者生活品质; 将恶性病转变成慢性病的医疗革命肿瘤个体化治疗药物非小细胞肺癌超过20%逐年增长。
目前靶向药物治疗的病种肺癌NSCLC驱动突变信号传导蛋白蛋白激酶驱动突变GTP结合蛋白)NSCLC中的基因驱动突变518905634NSCLC靶向治疗药物ErlotinibGefitinib易瑞沙J Pathol 2011;223:230-240与NSCLC靶向治疗相关的常见基因突变以EGFR突变分子为靶点的NSCLC药物及机理(ATP-binding cleft)Gefitinib, Erlotinib对基因突变的NSCLC有疗效下游基因突变上游药物无效AngiogenesisEGFR基因的突变与药效外显子耐药突变药物敏感突变Shama SV,et al. Nat Cancer 2007;7:169-81.易瑞沙、特罗凯对含EGFR突变的NSCLC疗效显著药敏型耐药型•对不含EGFR突变的患者不仅无效,反而更糟。
Rosell et al, N Engl J Med 2009,361:958-67Mok TS et al, N Engl J Med 2009,361:947-57Linda EC et al, Lancet 2009 ,10: 1001-10101. Schiller JH, et al. N Engl J Med 2002; 346:92-98.2. Scagliotti GV, et al. J Clin Oncol 2008; 26:3543-3551.3. Yang CH, et al. Presented at 2010 ESMO.4. Inoue A, et al. 2011 ASCO Abstract 7519.5. Mitsudomi T, et al. Lancet Oncol 2009ECOG1594含铂两药化疗(N=1207)1JMDB顺铂/培美曲塞(N=618)2IPASS卡铂/紫杉醇(N=608)3NEJ002易瑞沙EGFR基因敏感突变患者(N=114)4WJTOG3405易瑞沙EGFR基因敏感突变患者(N=86)5中位生存期(月)8.011.817.427.730.95101520253035未经选择人群选择性人群突变人群非鳞癌患者腺癌、不吸烟患者EGFR突变检测意义K-ras常见热点突变Winder et al,ONCOLOGY REPORTS,2009,21: 1283-1287突变名称碱基变化%GGT>AGT GGT>CGT GGT>TGT GGT>GAT GGT>GCT GGT>GTT GGC>GAC克唑替尼(Crizotinib)从发现关键驱动基因到美国上市仅4年推动药物研发的关键事件患者200520062007200820092010 2011EML4-ALK及其它融合突变体Eur J Cancer. 2010,46(10):1773-80.(81%)(19%)ALK 重排Cancer Treat Rev.2010,36 Suppl 3:S21-9123分子检测指导NSCLC治疗的时代2014NCCN指南(NSCLC)二、个体化用药的基因检测临床用药需考虑的因素临床症状基因多态性与个体化用药基因多态性药物靶标相关基因药物转运体药物代谢动力学个体药物效应的差异药物代谢酶药物效应动力学不同基因型个体的用药临床表现FDA批准的部分个体化用药基因型检测产品产品名称临床用途时间厂家方法P450(2D6,2C19)基因型检测试剂盒30种药物的剂量确定2005年1月Roche基因芯片UGT1A1基因型检测试剂盒“伊立替康”的适合人群2005年8月Third Wave Invader 细胞因子F2、F5及MTHFR基因型检测试剂盒指导个体化抗凝治疗2007年9月Nanosphere基因芯片CYP2C9、VKORC1基因型检测试剂盒指导抗凝药物华法林的使用剂量2007年9月Nanosphere基因芯片FDA要求在药品说明书中注释的基因多态性基因药物(进行剂量调整)CYP2C19氯吡格雷、伏立康唑、奥美拉唑、泮托拉唑、艾美拉唑、雷贝拉唑、地西泮、那非那韦CYP2C9塞来考昔、华法林CYP2D6阿托西汀、文拉法辛、利哌利酮、赛托修按吸入、他莫昔芬、噻吗洛尔、氟西汀、奥氮平、西维美林、托特罗定、特比萘芬、曲马多。
感染性疾病相关个体化医学分子检测技术指南

感染性疾病相关个体化医学分子检测技术指南前言感染性疾病是当今世界严重威胁人类健康的重大疾病,快速、准确的诊断是有效治疗、病情监测和控制疾病蔓延的重要前提。
随着分子检测技术的不断发展和完善,分子检测在病原微生物感染诊断及治疗监测上的临床应用日益广泛,已成为一些重要的感染性疾病的诊断和疗效评价中不可缺少的重要工具。
为使我国的感染性疾病分子检测临床应用健康有序发展,更好的为医患提供高质量的服务,有必要制订感染性疾病相关的分子检测技术指南,规范临床实验室相关分子检测操作程序,指导从事感染性疾病分子诊断的医务人员正确开展工作。
本指南以大量、丰富的临床实践为基础,同时消化吸取了大量国内外文献的精华,广泛征求相关学科专家的意见,遵循科学性、实用性、可行性的原则,反复修改而成。
我们衷心希望《感染性疾病相关个体化医学分子检测技术指南》能够对广大检验人员起到很好的帮助和指导作用,从而为提高感染性疾病临床诊治水平发挥积极的作用本指南起草单位:中国医科大学附属第一医院、国家卫生计生委临床检验中心本指南起草人:尚红、李金明、郭晓临、代娣、程仕彤目录1. 本指南适用范围 (3)2. 标准术语 (3)3. 感染性疾病相关的个体化医学分子检测概述 (9)4. 感染性疾病相关的个体化医学分子检测分析前质量控制 (12)4.1 标本采集 (13)4.2 标本的转运 (16)4.3 标本的接收 (17)4.4 标本的保存 (18)4.5 检验项目的选择 (19)5. 感染性疾病相关的个体化医学分子检测分析中质量控制 (20)5.1 实验室的设计要求 (20)5.2常用的分子检测方法 (21)5.3 试剂和方法的选择 (29)5.4 设备维护和校准 (36)5.5 人员培训 (36)5.6 试剂性能验证 (37)6. 感染性疾病相关的个体化医学分子检测分析后质量控制 (40)6.1 结果报告 (40)6.2 结果的解释及医患的沟通 (41)6.3 检测后标本的保存及处理 (42)7. 质量保证 (42)7.1 标准操作程序 (42)7.2 质控品 (42)7.3 室内质量控制 (43)7.4 室间质量评价 (47)8. 感染性疾病相关的个体化医学分子检测应用 (48)8.1 乙型肝炎病毒感染诊疗的个体化分子检测 (48)8.2 丙型肝炎病毒感染诊疗的个体化分子检测 (52)8.3 结核分枝杆菌感染诊疗的个体化分子检测 (56)8.4 人获得性免疫缺陷病毒感染诊疗的个体化分子检测 (57)附录 (65)参考文献 (66)1.本指南适用范围本指南由国家卫生计生委个体化医学检测技术专家委员会编订,是国家卫生计生委个体化医学检测技术系列指南之一,旨为临床实验室进行感染性疾病相关的个体化医学分子检测提供参考和指导。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
感染性疾病相关个体化医学分子检测技术指南前言感染性疾病是当今世界严重威胁人类健康的重大疾病,快速、准确的诊断是有效治疗、病情监测和控制疾病蔓延的重要前提。
随着分子检测技术的不断发展和完善,分子检测在病原微生物感染诊断及治疗监测上的临床应用日益广泛,已成为一些重要的感染性疾病的诊断和疗效评价中不可缺少的重要工具。
为使我国的感染性疾病分子检测临床应用健康有序发展,更好的为医患提供高质量的服务,有必要制订感染性疾病相关的分子检测技术指南,规范临床实验室相关分子检测操作程序,指导从事感染性疾病分子诊断的医务人员正确开展工作。
本指南以大量、丰富的临床实践为基础,同时消化吸取了大量国内外文献的精华,广泛征求相关学科专家的意见,遵循科学性、实用性、可行性的原则,反复修改而成。
我们衷心希望《感染性疾病相关个体化医学分子检测技术指南》能够对广大检验人员起到很好的帮助和指导作用,从而为提高感染性疾病临床诊治水平发挥积极的作用本指南起草单位:中国医科大学附属第一医院、国家卫生计生委临床检验中心本指南起草人:尚红、李金明、郭晓临、代娣、程仕彤目录1. 本指南适用范围 (3)2. 标准术语 (3)3. 感染性疾病相关的个体化医学分子检测概述 (9)4. 感染性疾病相关的个体化医学分子检测分析前质量控制 (12)4.1 标本采集 (13)4.2 标本的转运 (16)4.3 标本的接收 (17)4.4 标本的保存 (18)4.5 检验项目的选择 (19)5. 感染性疾病相关的个体化医学分子检测分析中质量控制 (20)5.1 实验室的设计要求 (20)5.2常用的分子检测方法 (21)5.3 试剂和方法的选择 (29)5.4 设备维护和校准 (36)5.5 人员培训 (36)5.6 试剂性能验证 (37)6. 感染性疾病相关的个体化医学分子检测分析后质量控制 (40)6.1 结果报告 (40)6.2 结果的解释及医患的沟通 (41)6.3 检测后标本的保存及处理 (42)7. 质量保证 (42)7.1 标准操作程序 (42)7.2 质控品 (42)7.3 室内质量控制 (43)7.4 室间质量评价 (47)8. 感染性疾病相关的个体化医学分子检测应用 (48)8.1 乙型肝炎病毒感染诊疗的个体化分子检测 (48)8.2 丙型肝炎病毒感染诊疗的个体化分子检测 (52)8.3 结核分枝杆菌感染诊疗的个体化分子检测 (56)8.4 人获得性免疫缺陷病毒感染诊疗的个体化分子检测 (57)附录 (65)参考文献 (66)1.本指南适用范围本指南由国家卫生计生委个体化医学检测技术专家委员会编订,是国家卫生计生委个体化医学检测技术系列指南之一,旨为临床实验室进行感染性疾病相关的个体化医学分子检测提供参考和指导。
本指南介绍了感染性疾病相关的个体化医学分子检测应注意的相关问题、技术方法、结果报告与解释、质量保证及临床应用等内容。
本指南主要适用于开展个体化医学分子检测的医疗机构临床检验实验室,同时供从事感染性疾病诊治的临床医师参考。
2. 标准术语2.1 感染性疾病(infectious disease)即由病原微生物引起的疾病的统称。
2.2 病原微生物(pathogen)指侵犯人体,引起感染的微生物,或称病原体。
病原微生物包括病毒、细菌、真菌、支原体、衣原体、立克次体、螺旋体、寄生虫和朊毒体。
2.3 宿主(host)为病原体提供生存环境的生物,本指南中的“宿主”仅指人体。
2.4 窗口期(window period)宿主感染病原体,需要一段时间之后才能产生抗体。
从感染病原体到能检测到抗体的时间就叫做窗口期。
2.5 扩增子/扩增产物(amplicon/amplification product)由目标扩增反应产生的相对低分子量的产物。
2.6 质控品(control)为质量控制目的而制备的标本称为质控品。
质控品不能用于校准。
质控品的性能指标有:稳定性、瓶间差、定值和非定值、分析物水平、预处理的要求等。
2.7 标准品(standard)用于定标,即标准曲线的绘制。
2.8 校准品(calibrator)指定用来校准某检测系统(仪器+试剂+方法程序)的,是在考虑到基质效应的情况下,人为赋予校准品的校准值。
因此,校准品必须专用于某一检测系统。
2.9 抑制作用(inhibition)临床标本中的某些成分或者标本采集和处理过程中引入的某些外源性物质可能对扩增反应或者识别过程产生的削弱作用。
2.10 内部质控(internal control)在同一个反应管中存在的一段非目标序列,将与目标序列一同被扩增,用于识别由温控故障、不合格的试剂或聚合酶活性等造成的抑制作用,以及识别相同的基质内是否存在抑制性物质。
2.11 核酸酶(nuclease)能够水解核酸的多种酶中的任何一种,比如内切酶和外切酶。
2.12 核酸提取(nucleic acid extraction)将核酸(RNA,DNA)从生物物质中分离出来的过程,以备进行核酸的扩增和分析。
2.13 检验(examination)以确定一个特性的值或特征为目的的一组操作。
实验室检验也常称为检测或试验。
确定一个特性的值的实验室检验称为定量检验,确定一个特性的特征的实验室检验称定性检验。
2.14 原始样品(primary sample)/标本(specimen)为检验、研究或分析一种或多种量或特性而取出的认为可代表整体的一独立部分的体液、呼出气、毛发或组织等。
2.15 样品(sample)取自原始样品的一部分或多部分。
2.16 寡核苷酸(Oligonucleotide)一种短分子单链DNA,通常为6-100个核苷酸,由化学方式合成。
2.17 引物(Primer)一个寡核苷酸,可以与目标DNA的互补链杂交。
在DNA聚合酶和核苷酸的参与下,启动DNA的合成过程(从3’-OH 端开始)。
2.18 探针(Probe)已定义的单链核酸片段,用于识别特定的包含其互补序列的DNA或者RNA 分子。
探针通常都附带一个标记(放射性标记或者化学性标记),使探针在杂交后能被检测到。
2.19 淬灭剂(Quencher)能够从荧光基团接收能量并且通过近端淬灭或者FRET淬灭来消耗该能量的分子。
2.20 野生型(wild type)基因或生物体在自然界中常见的或非突变型的形式。
2.21 突变(mutation)基因的结构发生改变而导致细胞、病毒或微生物的基因型发生稳定的、可遗传的变化过程。
2.22 点突变(point mutation)基因内单个核苷酸置换所造成的结构改变。
2.23 缺失突变(deletion mutation)由于相邻的多个核苷酸或片段丢失所造成的突变。
2.24 杂合子(heterozygote)又称“杂合体”。
在二倍体生物中,一对同源染色体上特定的基因座上有两个不同的等位基因的个体或细胞。
2.25 纯合子(homozygote)又称“纯合体”。
在二倍体生物中,一对同源染色体上特定的基因座上有两个相同的等位基因的个体或细胞。
2.26 表型(phenotype)一个生物体(或细胞)可以观察到的性状或特征,是特定的基因型和环境相互作用的结果。
2.27 基因型(genetype)一个生物体或细胞的特定基因组成。
2.28 单核苷酸多态性(Single nucleotide polymorphisms, SNPs)是指由单个核苷酸—A、T、C或G的改变而引起的DNA序列的改变,造成包括人类在内的物种之间染色体基因组的多样性。
2.29 随机误差(random error)在重复测量中按不可预见方式变化的测量误差的分量。
通常随机误差的参考量值是对同一被测量多次重复测量得到的均值。
2.30 系统误差(systematic error)在重复测量中保持不变或按可预见方式变化的测量误差的分量。
系统误差的参考量值是真值,或者是测量不确定度可忽略不计的测量标准测得的值,还可以约定量值。
2.31 验证(verification)通过提供客观证据证实对规定要求已得到满足的认定。
验证过程证实的检验程序的性能指标,应与检验结果的预期用途相关。
2.32 确认(validation)通过提供客观证据对特定的预期用途或应用要求已得到满足的认定。
性能确认应尽可能全面,并通过客观的证据(以性能特征形式) 证实满足检验预期用途的特定要求。
2.33 精密度(precision)在规定条件下,对同一或类似被测对象重复测量所得示值或测得值间的一致程度。
规定条件可以是重复性测量条件、期间精密度测量条件或复现性测量条件。
精密度通常无法衡量,而以不精密度表达,常用标准差、方差或变异系数表示,是对随机误差的衡量。
2.34 正确度(trueness)多次重复检测所得量值的平均值与一个参考量值间的一致程度。
通常用“偏倚”表达,是对系统误差的衡量。
选择一个合适的参考对正确度评价很重要,最好采用参考方法。
2.35 可报告范围(reportable range)指测量仪器的误差在预期规定范围内的被测量值的集合。
2.36 测量范围(measurement range)检测方法可直接对未经稀释、浓缩或其他非常规检测流程预处理的标本进行检测,得到的分析物浓度范围。
2.37 临床可报告范围(clinically reportable range)通过采用标本的稀释、浓缩或其他预期处理,用于延长直接的分析测量范围下的分析物值的范围,其范围一般较测量范围宽,是考虑方法检测限和预处理流程后的测量范围的延伸。
2.38 参考区间(reference interval)又称为参考范围、正常范围等,通常采用参考值分布的中间95%区间。
2.39 检测限(limit of detection, LoD)指某一分析方法在给定的可靠程度内可以从样品中检测待测物质的最小浓度或最小量。
2.40 干扰(interference)指被测物质浓度因样品特性或其他成分的影响而出现的临床显著性偏差,评价的是由样品引起的特异性偏差。
2.41 敏感性(sensitivity)指金标准诊断有病的全部病例中,被评价方法结果为阳性的病例占全部有病病例的比例,即敏感性=[真阳性/(真阳性+假阴性) ]× 100%。
2.42 特异性(specificity)指金标准诊断全部无病病例中,被评价检验方法结果为阴性的病例所占全部无病病例的比例,即特异性=[真阴性/(假阳性+真阴性) ]× 100%。
2.43 生物学变异(biological variation)指在机体稳定状态下,排除已知可能影响因素(例如,疾病、用药、禁食、运动等),除外已知节律性变化(例如,对于某些检验项目,昼夜或季节性变化等),依然存在的随机变异。
