无机化学工艺流程学习资料
无机工艺流程专题讲解学习
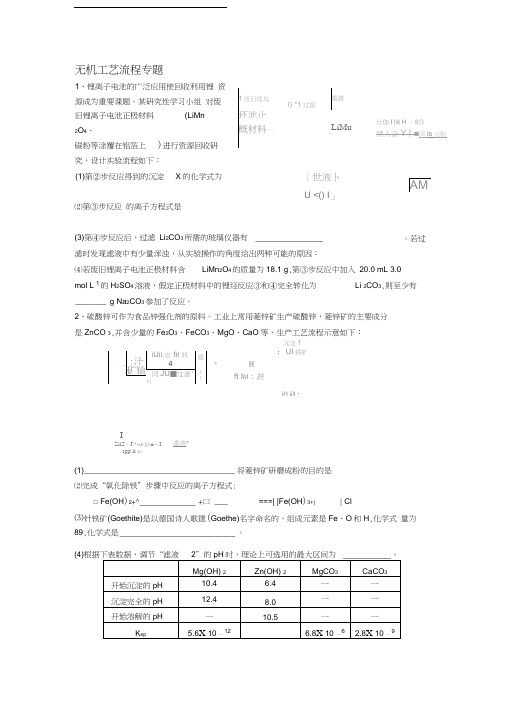
无机工艺流程专题1、锂离子电池的广泛应用使回收利用锂 资源成为重要课题。
某研究性学习小组 对废旧锂离子电池正极材料(LiMn2O 4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:⑵第③步反应 的离子方程式是(3)第④步反应后,过滤 Li 2CO 3所需的玻璃仪器有 _________________ 滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因: ⑷若废旧锂离子电池正极材料含LiMn 2O 4的质量为18.1 g ,第③步反应中加入 20.0 mL 3.0mol L 1的H 2SO 4溶液,假定正极材料中的锂经反应③和④完全转化为 Li 2CO 3,则至少有_______ g Na 2CO 3参加了反应。
2、硫酸锌可作为食品锌强化剂的原料。
工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分 是ZnCO 3,并含少量的Fe 2O3、FeCO 3、MgO 、CaO 等,生产工艺流程示意如下:iH iill ・(1) __________________________________ 将菱锌矿研磨成粉的目的是 ⑵完成“氧化除铁”步骤中反应的离子方程式:□ Fe(OH )2+^______________ +口 ___⑶针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe 、O 和H ,化学式 量为89,化学式是 _____________________________ 。
(4)根据下表数据,调节“滤液2”的pH 时,理论上可选用的最大区间为 ____________ 。
(1)第②步反应得到的沉淀 X 的化学式为[世液卜U <() I 」1废旧悝鳥I) *1过竄滤液环池止概材料—*LiMu址伽I 摘H :削》總人备Y | ■両is 点粉。
若过沉淀1;UI 铁矿IZiiS< J * H JI [()•■— I rpp k 闔》滤液*===| |Fe(OH )3+|| Cl⑸工业上从“滤液3”制取MgO过程中,合适的反应物是____________ (选填序号)。
无机化学工艺流程必备知识

无机化学工艺流程必备知识常见名词浸出:固体加水(酸)溶解得到离子浸出率:固体溶解后,离子在溶液中的含量的多少酸浸:在酸溶液中反应使可溶性金属离子进入溶液,不溶物通过过滤除去的溶解过程水洗:通常为除去水溶性杂质水浸:与水接触反应或溶解原料的预处理溶解:通常用酸溶。
如用硫酸、盐酸、浓硫酸等灼烧:如从海带中提取碘煅烧:改变结构,使一些物质能溶解。
并使一些杂质高温下氧化、分解。
如煅烧高岭土研磨:适用于有机物的提取1.基本操作:(1)酸浸的目的:提高浸取率、抑制某些离子的水解。
(2)粉碎、搅拌的作用:增大反应物的接触面积,加快反应速率,使反应充分进行。
(3)洗涤沉淀的方法:沿玻璃棒向过滤装置中加蒸馏水至刚好淹没沉淀,静置,待水流完,重复两到三次。
(过滤后取沉淀的实验都要洗涤)(4)洗涤的作用:洗去晶体表面的可溶性杂质。
①非水洗涤剂(或一定温度的水等)的使用:洗去晶体表面的可溶性杂质;减少晶体因溶解而引起的损耗;②挥发性溶剂(如乙醇),洗去晶体表面的可溶性杂质;减少晶体因溶解而引起的损耗;易于挥发除去,还可以带走晶体表面的水分,便于快速干燥。
③溶液中加入有机溶剂析出晶体,有机溶剂的作用:降低溶质的溶解度,便于其析出,提高产率。
(5)检验沉淀已经洗净的方法:先分析要洗涤的离子,再选择合适的试剂,如洗Cl-,可用AgNO3。
取最后一次洗涤液少许于试管中,加入……溶液,若无沉淀产生,则已经洗净。
(6)检验沉淀是否完全的方法:向上层清液中继续滴加原沉淀剂,若无沉淀产生,则说明沉淀完全。
(7)结晶操作方法:①溶解度随温度变化较大的晶体、受热易分解的晶体(包括结晶水合物):蒸发浓缩、冷却结晶、过滤、洗涤、干燥;②溶解度随温度变化较小的晶体:蒸发结晶,趁热过滤。
2.条件控制:(1)控制pH在一定范围的目的:使某些离子转化为沉淀而除去,而其他离子不沉淀。
(2)趁热过滤目的:①若取滤液,则防止因温度降低析出晶体,使产物的产率降低;②若取滤渣,则防止因温度降低,滤液中晶体析出混入产品,降低产品的纯度。
高考高三化学专题复习:《无机化学工艺流程》

无机化学工艺流程专题复习【考纲要求】1.了解科学、技术、社会的相互关系(如化学与生活、材料、能源、环境生命过程、信息技术的相互关系等)。
2.了解在化工生产中遵循“绿色化学”思想的重要性。
【考纲解读】无机化工生产流程图题是一道综合题,综合考查元素化合物、基本概念和理论、实验与探究等相关知识,综合考查学生化学实验与探究能力、分析和解决(解答)化学问题的能力和获取化学信息的能力,突出了对学生分析与综合、类比与比较、判断和推理等思维能力的要求,凸显了对“三维”目标和“STSE”的考查,充分体现了新课程的思想和理念。
【考查内容】1. 元素及其化合物①纯碱工业、氨工业、硅单质的制备、氯碱工业、海水中提取镁、海水中提取溴等;②围绕铁、铜、铝、氯、硫、磷等元素的单质或化合物的工业制备及这些元素及其化合物间的相互转化。
2. 基本实验操作化工生产过程中分离提纯、除杂主要包括过滤、洗涤、蒸发、结晶、蒸馏、萃取、分液等基本实验操作。
3. 化学反应原理从化学反应原理的角度选择原料、控制条件和选择设备等,是化工生产的基本思路。
化学反应原理的相关知识包括化学平衡理论、电离平衡理论、水解平衡理论、溶解平衡理论、电化学原理、化学反应与能量等,同时做到能综合运用这些知识分析化工生产中化学反应的情况。
【试题设问的角度】1. 从实验的角度设计问题,如:基本实验操作、分离提纯、除杂等。
2. 从化学反应原理的角度设计问题,如:原料的选择、条件的选择、利用信息对所加物质的用途进行分析、化学反应的分析等。
3. 从环境保护的角度设计问题,如:废物处理、绿色化学等。
【课时安排】 6课时第一课时:海水资源的开发利用第二课时:工艺流程题解题思路第三课时:工艺流程题的复习第四课时:工艺流程题强化训练第五课时:工艺流程题强化提升训练第六课时:过关检测第一课时:海水资源的开发利用【学生能力发展目标】1.学生阅读必修二课本92页,准确复述出海水综合开发利用的形式有哪些?2.小组讨论交流分析从海水中提取镁、溴和碘的工艺流程,并能写出核心的反应方程式。
化学无机工艺流程知识点

化学无机工艺流程知识点下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!1. 原料预处理:粉碎:将大块原料粉碎成较小的颗粒,增加反应表面积,提高反应速率。
高中化学考点复习-无机化学工艺流程

无机化学工艺流程无机化学工艺流程题是近年高考化学热点题型,这类试题将化工生产中的流程用框图形式表示出来,主要考查物质的制备、检验、分离等基本实验原理在化工生产中的实际应用,侧重考查学生运用化学知识来解决化工生产中实际问题的能力,体现能力立意的命题思想。
一、题型结构与解题策略1.化工生产流程主线的特点2.解题步骤与策略(1)分段剖析,明析细节,贯通整个流程。
化学工艺流程可分三个阶段:原料预处理、发生核心化学反应和产品的提纯分离。
以核心原料为准,结合箭头的指向,依据主线主产品,分支副产品,回头为循环的工艺流程,分析每一环节中物质流入和流出的意义,控制反应条件的作用,实现对整个流程的全盘分析。
(2)浏览全题,首尾呼应,找出流程主线。
运用首(原料)尾(产品)呼应法,分析从原料到产品,需要发生什么核心反应和除去哪些杂质,明确流程的主要任务:整个流程在控制反应条件下。
(3)由易到难,变换角度,逐一破解答案。
①先易后难:先回答与工艺流程相关的简单问题,确保易拿的分数先拿到,增强答题信心。
②变换角度:从基本理论(氧化还原、化学平衡、盐类水解、电化学等)、反应条件的控制(温度、压强、催化剂、原料配比、pH 调节、溶剂选择、除杂、产品分离等)、绿色化学观点(原子经济性、循环操作、环保)、经济角度(提高产量与产率、原料廉价易得、降低能耗、设备简单)、安全生产(防爆、防污染、防中毒等)多角度答题。
③对于棘手的问题:尝试从题给信息中寻找问题的答案。
二、无机化学工艺流程的知识点总结1.原料预处理阶段(1)研磨、粉碎、喷洒:①目的是增大反应物的接触面,加快反应速率和提高原料转化率、利用率、浸出率。
②增大接触面积的具体措施有:固体用粉碎、研磨的方法,液体用喷洒的方法,气体可用多孔分散器等。
(2)水浸、酸浸、碱浸:是指固体加水、酸、碱溶解得到离子,或向固体中加入适量溶剂,使其中可溶性的物质溶解或通过反应进入溶液。
水浸是与水接触反应或溶解;酸浸是溶解金属及金属氧化物,使可溶性金属离子进入溶液,不溶物通过过滤除去。
无机化学工艺流程复习讲解

无机化学工艺流程
一.工业流程的题型特点 工业流程题目在流程上一般分为 3 个过程:
(1)原料处理阶段的常见考点与常见名词 ①加快反应速率 ②溶解:通常用酸溶,水浸,浸出,浸出率,酸浸 ③灼烧、焙烧、煅烧:溶解,并使一些杂质高温下氧化、分解
(2)分离提纯阶段(除去杂质元素) ①调 pH 值除杂 a.控制溶液的酸碱性使其某些金属离子形成氢氧化物沉淀例 如:已知下列物质开始沉淀和沉淀完全时的 pH 如下表所示
(4)其他常见考点 ①化学方程式 ②实验仪器 ③计算 ④信息
二.常见考点设置 (1)反应速率与平衡理论的运用; 反应物颗粒大小:反应速率、原料的利用率等;温度:反应速 率、物质的稳定性、物质的结晶等。 (2)氧化还原反应的判断、化学方程式或离子方程式的书写; (3)利用控制 pH 分离除杂; (4)化学反应的能量变化; (5)实验基本操作:除杂、分离、检验、洗涤、干燥等; (6)流程中的物质转化和循环,资源的回收和利用; (7)环境保护与绿色化学评价。
物质 开始沉淀 沉淀完全
Fe(OH)3
2.7
3.7
Fe(OH)2
7.6
9.6
Mn(OH)2
8.3
9.8
若要除去 Mn2+溶液中含有的 Fe2+,应该怎样做?
提示:先用氧化剂把 Fe2+氧化为 Fe3+,再调溶液的 pH 到 3.7。 b.调节 pH 所需的物质一般应满足两点: 能与 H+反应,使溶液 pH 值增大;不引入新杂质。例如:若要 除去 Cu2+溶液中混有的 Fe3+,可加入 CuO、Cu(OH)2、Cu2(OH)2CO3 等物质来调节溶液的 pH 值。 ②试剂除杂 ③加热:加快反应速率或促进平衡向某个方向移动 如果在制备过程中出现一些受热易分解的物质或产物,则要注 意对温度的控制。如:侯德榜制碱中的 NaHCO3;还有如 H2O2、 Ca(HCO3)2、KMnO4、AgNO3、HNO3(浓)等物质。
2024届高三化学二轮复习+++无机化学工艺流程专题课件

(6)该流程中可以循环使用的物质是
(写化学式)。
NH3 (或NH3 ·H2O)
【2018全国】(14分)我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS ,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
其他
CaO、MgO、NaF等
3、操作线
原料的 预处理
粉碎 研磨 雾化
溶浸
煅烧 焙烧 灼烧
将块状固体粉碎或磨成粉末或将液体雾化,增大固液 (或固气或固固)接触面积,加快反应速率或使反应更 充分,增大原料的转化率(或浸取率)
水浸 酸浸 碱浸
除去不溶于水的杂质 使可溶性金属阳离子进入溶液,除去不溶物
酸溶时所加酸的量不能太多,原因:过多 的会消耗后续调节pH所加的碱性试剂 除去油污,溶解酸性氧化物、铝及其氧化物
(2019全国卷3节选) 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由 天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下 图所示。回答下列问题:
金属离子
Mn2+
Fe2+
Fe3+
Al3+
Mg2+
Zn2+
Ni2+
开始沉淀的pH
8.1
6.3
1.5Βιβλιοθήκη 3.48.92024高三化学二轮复习备考
无机化学工艺流程专题
一、结构解读
(2023•全国甲卷,26)BaTiO3是一种压电材料。以BaSO4为原料,采用下列路线可制备 粉状BaTiO3。
无机矿物 工业废料
无机化工流程专题讲解

•大多数提问用所学知识便可直接回答,但个别地方往 往有悖所学知识,这时就要考虑产物、环保、产量、成 本等等。 •最后要看清楚问什么,不要答非所问
谢谢指导!
【第2课时】
【例 2】(2011·福建高考)四氯化钛(TiCl4)是制取航天航空 工业材料—钛合金的重要原料。由钛铁矿(主要成分是 FeTiO3) 制备 TiCl4 等产品的制备甲酸铜晶体[Cu(HCOO)2·4H2O]的流程如下:
70℃~80℃的热水
分离提纯
2mol小苏打
1mol胆矾
研 磨
CO2冷 却 、
搅拌Ⅰ
操作a
洗涤
Cu2(OH)2CO3固 体
Cu(HCOO)2·4H2O
冷却、过滤、无水 乙醇洗涤、晾干
趁热过滤
搅
约50℃
拌
的热水
Ⅱ 甲酸
“趁热过滤”的原因防是止降温甲酸铜结晶而损失
(1)滤渣主要成分有Mg(OH)2和 CaSO4 以及未溶杂卤石。 (2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤 石浸出K+的原因: (加3)入“Ca除(O杂H”)2溶环液节,中氢,氧先根加与入K镁2C离O子3 结溶合液成,M经g(O搅H拌)2等, 操C作a2后+与,S过O滤42-,结再合加成稀入CHaS2SOO4而4 析溶出液,调使滤平液衡p向H右至移中动性,。
(4)700 ℃“焙烧 1”的目的是_________________________ _____________________________________________________,
550 ℃“焙烧 2”的目的是__________________________ _____________________________________________________。
高三化学一轮复习课件:无机化学工艺流程专题(人教版)

水浸:与水接触反应或溶解 浸出:固体加水(酸)溶解得到离子 浸出率:固体溶解后,离子在溶液中的含量的多少(更多转化) 酸浸:在酸溶液中反应使可溶性金属离子进入溶液,不溶物通 过过滤除去的溶解过程 ③灼烧、焙烧、煅烧:改变结构,使一些物质能溶解,并使一 些杂质高温下氧化、分解 ④控制反应条件的方法
(2)分离提纯阶段的常见考点 ①调 pH 值除杂 a.控制溶液的酸碱性使其某些金属离子形成氢氧化物沉淀例 如:已知下列物质开始沉淀和沉淀完全时的 pH 如下表所示
(4)其他常见考点 ①化学方程式 ②实验仪器 ③计算 ④信息
5.注重答案的文字叙述规范 (1)洗涤沉淀:往漏斗中加入蒸馏水至浸没沉淀,待水自然流下 后,重复以上操作 2~3 次。 (2)从溶液中得到晶体:蒸发浓缩—冷却结晶—过滤—洗涤—干 燥。 (3)在写某一步骤是为了除杂时,应该注明“是为了除去 XX 杂 质”,只写“除杂”等一类万金油式的回答是不给分的。 (4)看清楚是写化学反应方程式还是离子方程式,注意配平。
专题一 无机化工流程题复习策略与解题方法指导 1.无机化工流程题的特点 无机工业流程题能够以真实的工业生产过程为背景,体现能力 立意的命题为指导思想,能够综合考查学生各方面的基础知识及将 已有知识灵活应用在生产实际中解决问题的能力。所以这类题成为 近年来高考的必考题型。这类题常呈现的形式:流程图、表格、图 像 这类题常围绕以下几个知识点进行设问: 等。
物质 开始沉淀 沉淀完全
(OH)3
2.7
3.7
Fe(OH)2
7.6
9.6
Mn(OH)2
8.3
9.8
若要除去 Mn2+溶液中含有的 Fe2+,应该怎样做?
提示:先用氧化剂把 Fe2+氧化为 Fe3+,再调溶液的 pH 到 3.7。 b.调节 pH 所需的物质一般应满足两点: 能与 H+反应,使溶液 pH 值增大;不引入新杂质。例如:若要 除去 Cu2+溶液中混有的 Fe3+,可加入 CuO、Cu(OH)2、Cu2(OH)2CO3 等物质来调节溶液的 pH 值。 ②试剂除杂 ③加热:加快反应速率或促进平衡向某个方向移动 如果在制备过程中出现一些受热易分解的物质或产物,则要注 意对温度的控制。如:侯德榜制碱中的 NaHCO3;还有如 H2O2、 Ca(HCO3)2、KMnO4、AgNO3、HNO3(浓)等物质。
无机化学工艺流程

无机化学工艺流程无机化学工艺流程是指无机化学品生产的具体步骤和工艺要点。
无机化学品广泛应用于工业、农业、医药等领域,其生产过程涉及到原料准备、反应合成、分离纯化、产品处理等环节。
以下是一个典型的无机化学工艺流程的详细介绍。
1.原料准备无机化学品的生产通常以无机原料为基础。
原料的选择和准备是保证产品质量和工艺效果的重要环节。
原料可以是自然产生的矿石、矿物,也可以是经过化学处理得到的化合物。
2.反应合成无机化学品的生产主要是通过化学反应合成。
反应合成的条件对产品质量和产量有着重要影响。
常见的反应合成包括氧化、还原、置换、加合等反应。
其中,反应温度、压力、气氛、反应时间等都需要根据反应性质进行优化调节。
3.分离纯化反应合成后的产物中通常伴随着其他组分或杂质。
分离纯化环节的目的是提高产物的纯度和提取目标物质。
分离纯化的方法包括结晶、溶剂萃取、沉淀等。
不同的无机化学品有着不同的纯化方法和要求。
4.产品处理分离纯化后的产品需要进行进一步的处理。
产品处理包括过滤、干燥、粉碎等。
其中,过滤是除去悬浮物或固体杂质的常用方法,干燥是去除水分和溶剂的重要步骤。
5.包装和储存产品经过处理后需要进行包装和储存。
包装常用的材料包括塑料袋、玻璃瓶、铁桶等,需要根据产品特性选择适当的包装材料,确保产品的安全和稳定。
以上是一个简单的无机化学工艺流程的基本步骤。
不同的无机化学品在生产过程中可能会有更细致和复杂的操作要求,具体情况需要根据不同的产品来确定。
同时,工艺流程的优化和调整需要结合市场需求和生产设备的条件进行,并且要遵守安全、环保和质量控制等方面的相关规定和标准。
高中化学复习-化工流程(一)

MnS矿 MnO2 粉
H2SO
4
溶浸 滤渣1
MnO2 氧化
氨水 调pH 滤渣2
Na2S MnF2
除杂1 除杂2
滤渣3
滤渣4
NH4HCO3
沉锰
MnCO3
H2SO MnS4O4
(1)“滤渣1”含S和 SiO2(或不溶性;硅酸盐) 写出“溶浸”中二氧化锰与硫化锰反应的化学方程式
MnO2 + MnS + 2H2SO4 = 2MnSO4 + S + 2H2O
箔等)可以再生利用,其工艺流程如图:
NaOH 溶液
H2SO4
NaOH H2O2 NH3▪H2O
Na2CO3
正极片 放电 拆解
碱浸 滤液
酸浸 炭黑
氧化
调节 pH
沉锂
Fe(OH)3
Li2CO3
(1)“碱浸”中所得滤液的主要成分为
• 例4.(2013·全国新课标Ⅰ,27)锂离子电池的应用很
广,其正极材料可再生利用。某锂离子电池正极材料有
• 原料预处理 酸浸——金属元素 碱浸——Al、Al2O3、Al(OH)3、Si、SiO2 Na2CO3焙烧——Al2O3、Al(OH)3、SiO2
• 【2019Ⅲ】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工 业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、 Ni、Si等元素)制备,工艺如图:
• • (1)第①步反应的化学方程式是___________________,
• (2)第②步反应的离子方程式是____________________。
2、碱浸
• 一般选用氢氧化钠
Al、Al2O3、Al(OH)3——NaAlO2 Si、SiO2——Na2SiO3 其它金属单质及氧化物——滤渣
高中化学无机流程专题讲义

高中化学无机流程专题讲义已知CaO2·8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是________;(2)检验“水洗”是否合格的方法是________;(3)沉淀时常用冰水控制温度在0 ℃左右,其估计原因是(写出两种):①____________;②____________。
(4)测定产品中CaO2的含量的实验步骤:第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的bgKI晶体,再滴入少量2 mol·L—1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为cmol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O错误!===2I-+S4O错误!】①CaO2的质量分数为____________(用字母表示);②某同学第一步和第二步的操作都特别规范,第三步滴速太慢,如此测得的CaO2的质量分数估计________(填“不受影响”、“偏低"或“偏高”),原因是_________。
巩固练习【2019新课标3卷】(15分)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。
制备流程如图所示:回答下列问题:(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3Na2CrO4+Fe2O3+CO2+ NaNO2上述反应配平后FeO·Cr2O3与NaNO3的系数比为_______。
该步骤不能使用陶瓷容器,原因是_____。
(2)滤渣1中含量最多的金属元素是_______,滤渣2的主要成分是__________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大"或“小"),原因是_____________(用离子方程式表示)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
D.反应Ⅴ中的副产物氯化铵可用作氮肥
⑶反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是。
⑷(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫
酸铵反应的化学方程式。
【无ቤተ መጻሕፍቲ ባይዱ化学工艺流程作业一】
例4、以硫酸工艺的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
⑴生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是
。
⑵下列有关说法正确的是。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C CaS +4CO↑
1、工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物
Al(OH)3
Fe(OH)3
Fe(OH)2
Cu(OH)2
Zn(OH)2
开始沉淀的pH
3.3
1.5
6.5
⑷①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如右下图所示)。为使除汞效果最佳,应控制的条件是、。
②某毛纺厂废水中含0.001mol·L-1的硫化钠,与纸张漂白后废水(含0.002mol·L-1NaClO)按1:2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有。
4.2
5.4
沉淀完全的pH
5.2
3.7
9.7
6.7
8.0
⑴在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是
。
⑵上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有
。
⑶在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为
。
为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为。检验Fe3+是否沉淀完全的实验操作是
⑴上述流程中“碱浸”后,物质A必须经过(填写操作名称)处理后,方可“煅烧”;若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生的总的化学反应方程式为。
⑵上述流程中采用稀碱液比用热水更好,理由是。
⑶取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌。若反应后测得溶液的pH=4,则此时溶液中c(S2-)=。(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
⑴酸浸时,采用100~140℃和2~3h,其目的是。
⑵氧化时,需将溶液冷却到40℃以下,其目的是。
⑶除Al3+时,先调节pH值到(参见右表),得Fe(OH)3沉淀,
过滤除去滤液,再用硫酸溶解Fe(OH)3得硫酸铁溶液。
开始沉淀pH
沉淀完全pH
Al3+
3.5
4.7
Fe3+
1.9
3.2
⑷Na2SiO3溶液可由SiO2渣除杂后与35%的NaOH溶液反应制备,该反应的离子方程式为。
⑵反应I需控制反应温度低35℃,其目的是。
⑶工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是:
。
⑷反应Ⅳ常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极
发生的电极反应可表示为:。
例3、硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。生产硫化钠大多采用无水芒硝(Na2SO4)-炭粉还原法,其流程示意图如下:
。
⑷加入Zn粉的作用是。
“操作A”的名称是。
2、酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
⑴SnCl2用盐酸而不用水直接溶解的原因是,加入Sn粉的作用是。
⑵反应I生成的沉淀为SnO,写出该反应的化学方程式:
。
⑶检验沉淀已经“漂洗”干净的方法:。
③灼烧、煅烧:使物质高温下分解,或高温氧化等。
⑵控制反应条件的方法
①pH的控制:调节溶液的酸碱性使其中某些金属离子形成氢氧化物沉淀。
②加热的目的:加快反应速率或促进化学平衡的移动。
③降温的目的:防止某物质在高温下会分解,或为使平衡向需要的方向移动。
④趁热过滤:防止某物质降温时会析出。
⑤冰水洗涤:洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗。
⑸水解聚合时,强力搅拌的目的是;检验透明橙红色液体中,其分散质直径在l~l00nm的简单方法是
。
例2、以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
⑴反应I前需在FeSO4溶液中加入(填字母),以除去溶液中的Fe3+。
A、锌粉B、铁屑C、KI溶液D、H2
3、无机化学工艺流程题中涉及的问题:
⑴原料的预处理
①溶解:对金属及其氧化物通常采用酸溶,如用硫酸、盐酸、硝酸等,有时也常用碱溶(如铝及氧化铝等物质)。(用酸或碱溶解盐主要是为了抑制盐水解)
浸出:固体加水(或酸)溶解得到离子;
浸出率:固体溶解后,离子在溶液中的含量的多少;
②研磨:增大反应物接触面积,以加快反应速率或使反应更充分。
⑷反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0mol·L—1,则应控制溶液pH。已知:Ksp[Sn(OH)2]=1.0×10—26。
⑥利用有机溶剂(乙醇、乙醚等)洗涤:洗去晶体表面的杂质,降低晶体的溶解度,使晶体快速干燥。
⑦结晶过程的一般操作:蒸发浓缩→冷却结晶→过滤→洗涤→干燥。
例1、聚硅硫酸铁(PFSS)是新型无机高分子混凝剂,广泛应用于水的净化处理。PFSS化学组成可表示为:[Fe2(OH)n(SO4)3-n/2(SiO2)x]m,由钢渣合成PFSS主要工艺流程如下:
无机化学工艺流程
主备人:审核人:
1、无机化学工艺流程题的设计思路:
2、无机化学工艺流程题的一般解题步骤:
第一步:浏览全题,确定该流程的目的——由何原料获得何产物,对比原料和产物;
第二步:精读局部,明确反应原理——确定各步反应物、产物(正、逆向推断法结合),尽量弄懂流程图,但不必将每一种物质都推出。
第三步:针对问题再读图,明确要求——结合基础理论和实际问题,科学表述,规范书写。
