有机化学人名反应
100种有机化学人名反应

100种有机化学人名反应1. Arndt-Eistert反应醛、酮与重氮甲烷反应,失去氮并重排成多一个CH2基的相应羰基化合物,这个反应对于环酮的扩环反应很重要。
O+CH2N22. Baeyer-Villiger氧化由樟脑生成内酯:-OO+-N2CH2NN重排应用过氧酸使酮氧化成酯。
反应中在酮的羰基和相邻的碳原子之间引人一个氧原子。
如OCH3CH3CH3 OOCH3CH3H2SO5有时反应能生成二或多过氧化物,但环状酮转变为内酯能得到单一的预期产物。
合适的酸为过硫酸(Caro’s 酸)、过氧苯甲酸、三氟过氧乙酸。
除环酮外,无环的脂肪、芳香酮也可发生此反应。
二酮生成酸酐类、α、β-不饱和酮得到烯醇酯类。
3.Bechamp还原(可用于工业制备)在铁、亚铁盐和稀酸的作用下,芳香族硝基化合物能还原成相应的芳香胺。
C6H5-NO2 + 2Fe + 6HClC6H5-NH2 + 2FeCl3 + 2H2O。
当某些盐(FeCl2、FeCl3、FeSO4、CaCl2等)存在时,所用酸无论是过量还是少量,甚至在中性溶液中都能够进行这种还原。
此方法适用于绝大部分各种不同结构的芳香族化合物,有时也用来还原脂肪族硝基化合物。
4.Beckmann重排醛肟、酮肟用酸或路易斯酸处理后,最终产物得酰胺类。
单酮肟重排仅得一种酰胺,混酮肟重排得两种混合酰胺。
但一般质子化羟基的裂解和基团R的转移是从相反的位置同OR OH ORR'NRN时进行的。
R'NHR' R' OH NHR无论酯酮肟和芳酮肟都会发生此反应。
环酮肟重排得内酰胺,这在工业生产上很重要,利用此反应可帮助决定异构酮肟的结构。
5.Beyer喹啉类合成法芳香伯胺与一分子醛及一分子甲基酮在浓盐酸或ZnCl2存在下,反应生成喹啉类化合物。
HHNN R'HClNH2R'-H2+ R'CHO+RCOCH3RR这是对Doebner-Miller喹啉合成法的改进。
有机化学人名反应

有机化学人名反应
1. Friedel-Crafts反应:由Charles Friedel和James Crafts于1877年首次报道的一种重要的有机化学反应。
2. Grignard反应:法国化学家Victor Grignard于1900年发现的一种有机合成反应。
3. Wolff-Kishner还原反应:德国化学家Kurt Heinrich Wolff和美国化学家Morris Kishner于1913年和1919年分别发现的一种有机还原反应。
4. Birch还原反应:澳大利亚化学家Arthur John Birch于1944年发现的一种有机化学反应。
5. Cannizzaro反应:意大利化学家Stanislao Cannizzaro于1853年发现的一种有机化学反应。
6. Gabriel重氮化反应:德国化学家Siegmund Gabriel于1887年发现的一种有机化学反应。
7. Wurtz反应:法国化学家Charles Adolphe Wurtz于1855年发现的一种有机化学反应。
8. Fries重排反应:德国化学家Karl Fries于1887年发现的一种有机化学反应。
9. Hofmann消去反应:德国化学家August Wilhelm von
Hofmann于1865年发现的一种有机化学反应。
10. Robinson环加成反应:英国化学家Robert Robinson于1925年发现的一种有机化学反应。
有机合成常用人名反应

有机合成常用人名反应有机合成是化学领域中的一个重要分支,它研究有机化合物的合成方法和反应过程。
在有机合成中,常常会使用一些常用的人名反应,这些反应以人名命名,代表了该反应的发现者或者重要贡献者。
本文将介绍一些常用的人名反应,并对其原理和应用进行阐述。
一、格氏反应(Gattermann Reaction)格氏反应是一种用于合成醛的重要反应。
它是由德国化学家格氏(Gattermann)于1898年发现的。
格氏反应通过在芳香化合物上引入氰基,然后将其加氢还原,得到相应的醛。
格氏反应是一种重要的合成醛的方法,广泛应用于有机合成领域。
二、斯特雷克反应(Strecker Reaction)斯特雷克反应是一种合成α-氨基酸的方法,由德国化学家斯特雷克(Strecker)于1850年发现。
该反应通过使用醛、氰化物和胺,经过缩合和水解反应,合成出具有氨基酸结构的化合物。
斯特雷克反应是合成氨基酸的重要方法之一,广泛应用于生物化学和药物化学领域。
三、沃尔夫-克尼希反应(Wolf-Kishner Reduction)沃尔夫-克尼希反应是一种将醛或酮转化为对应的烷烃的方法。
该反应由德国化学家沃尔夫(Wolf)和克尼希(Kishner)于1912年发现。
沃尔夫-克尼希反应通过使用氨水和氢醇钠,将醛或酮转化为相应的烷烃。
这种还原反应在有机合成中具有重要的应用价值。
四、格里格纳德试剂(Grignard Reagent)格里格纳德试剂是一类由法国化学家格里格纳德(Grignard)于1900年发现的有机金属试剂。
格里格纳德试剂可以与卤代烃反应,生成烷基镁试剂。
这些烷基镁试剂可以与酮、醛、酸等化合物发生加成反应,合成出复杂的有机分子。
格里格纳德试剂是一种重要的有机合成试剂,在有机合成中具有广泛的应用。
五、费舍尔试剂(Fisher Reagent)费舍尔试剂是一种用于合成酮的试剂,由德国化学家费舍尔(Fisher)于1895年发现。
有机化学人名反应

取代反应:1,加特曼反应:加特曼(Gattermann L)发现:用催化量的金属铜代替氯化亚铜或溴化亚铜作催化剂,也可使重氮盐与盐酸或氢溴酸反应制得芳香氯化物或溴化物。
这样进行的反应叫做加特曼反应。
2,加特曼-科赫反应:苯、一氧化碳和氯化氢反应生成苯甲醛,此反应称为加特曼-科赫反应。
3,傅-克反应:芳香化合物芳环上的氢被烷基取代的反应称为傅-克烷基化反应;芳香化合物芳环上的氢被酰基取代的反应称为傅-克酰基化反应;统称傅-克反应。
4,布赫尔反应:萘酚在亚硫酸氢钠存在下与氨作用,转变成相应萘胺的反应称为布赫尔反应。
5,齐齐巴宾反应:吡啶与氨基钠反应,生成α-氨基吡啶,如果α位已被占据,则得γ-氨基吡啶,但产率很低。
这个反应称为齐齐巴宾(Chichibabin)反应。
6,刚穆伯—巴赫曼反应:芳香重氮盐中的芳基在碱性条件下与其它芳香族化合物偶联成联苯或联苯衍生物的反应称为刚穆伯(Gomberg)—巴赫曼(Bachmann)反应。
7,柯尔伯—施密特反应:干燥的酚钠或酚钾与二氧化碳在加温加压下生成羟基苯甲酸的反应称为柯尔伯—施密特(Kolbe-Schmitt)反应。
8,威廉森合成法:在无水条件下,醇钠和卤代烷作用生成醚的反应称为威廉森(Williamson A W)合成法。
9,席曼反应:芳香重氮盐和氟硼酸反应,生成溶解度较小的氟硼酸盐,后者加热分解产生氟苯,这称为席曼(Schiemann)反应。
10,桑德迈耳反应:1884年,桑德迈耳(Sandmeyer T)发现:在氯化亚铜或溴化亚铜的催化下,重氮盐在氢卤酸溶液中加热,重氮基可分别被氯或溴原子取代,生成芳香氯化物或溴化物。
这一反应称为桑德迈耳反应。
11,普塑尔反应:一些重氮盐在碱性条件下或稀酸的条件下可以发生分子内的偶联反应。
这个反应是普塑尔(Pschorr R)在寻找合成菲环的新方法中首先发现的,故称为普塑尔反应。
12,瑞穆尔—悌曼反应:酚与氯仿在碱性溶液中加热生成邻位及对位羟基醛的反应称为瑞穆尔—悌曼(Reimer —Tiemann)反应。
有机化学人名反应大全

一、Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯与一个新得卤代烷:卤代烷反应时,其活性次序为:R′I >R′Br 〉R′Cl.除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a—或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总就是先脱除含碳原子数最少得基团。
本反应就是由醇制备卤代烷得很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用得卤代烷R’X得烷基与亚磷酸三烷基酯(RO)3P得烷基相同(即R'=R),则Arbuzov反应如下:这就是制备烷基膦酸酯得常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯RP(OR')2与次亚膦酸酯R2POR'也能发生该类反应,例如:反应机理一般认为就是按SN2 进行得分子内重排反应:反应实例二、Arndt—Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例三、Baeyer——--Villiger反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上得一个烃基带着一对电子迁移到—O-O-基团中与羰基碳原子直接相连得氧原子上,同时发生O-O键异裂.因此,这就是一个重排反应具有光学活性得3-—-苯基丁酮与过酸反应,重排产物手性碳原子得枸型保持不变,说明反应属于分子内重排:不对称得酮氧化时,在重排步骤中,两个基团均可迁移,但就是还就是有一定得选择性,按迁移能力其顺序为:醛氧化得机理与此相似,但迁移得就是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应得酯,其中三氟过氧乙酸就是最好得氧化剂。
这类氧化剂得特点就是反应速率快,反应温度一般在10~40℃之间,产率高。
有机化学人名反应大全

一、Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R′I 〉R′Br 〉R′Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a—或b—卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷R’X 的烷基和亚磷酸三烷基酯(RO)3P 的烷基相同(即R' = R),则Arbuzov 反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯RP(OR')2和次亚膦酸酯R2POR' 也能发生该类反应,例如:反应机理一般认为是按S N2 进行的分子内重排反应:反应实例二、Arndt—Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸.反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺.反应实例三、Baeyer—--—Villiger反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到—O—O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂.因此,这是一个重排反应具有光学活性的3—-—苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂.这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
有机化学人名反应总结

有机化学人名反应总结是研究碳及其化合物的科学,其中许多反应被命名以纪念其首位发现者或发展者。
这些人名反应不仅对于的发展起到了巨大的推动作用,也源自于对科学家们的敬意和对他们贡献的赞扬。
在本文中,将总结几个人名反应,了解它们的原理和应用。
一、丁基锂合成反应(BuLi 生成反应)丁基锂是一种有机锂化合物,它的生成反应是通过将溶于正丁脱氢剂(n-BuLi)加入至正丁锂反应(floats-buLi)中得到的。
正丁锂反应是以但钾为催化剂,会使其在高压下进行。
该反应的关键是高温和高压条件下n-BuLi和粉末锂(floats-Li)之间的快速反应。
这个反应的应用十分广泛,可以用来合成各种有机锂试剂,如烃基锂、脂基锂,进而合成复杂的有机化合物。
二、格氏试剂合成反应 (Grignard 试剂生成反应)格氏试剂是有机锂试剂的后继者,由法国化学家弗朗索瓦·格里尼亚(francois auguste)发明并得名。
该反应以季碳基物质镁为催化剂,与卤化烃或卤化芳烃发生取代反应得到格氏试剂。
格氏试剂常用于合成范围广泛的有机化合物,主要反应机制类似于亲核取代反应,并使其非常重要的有机合成试剂之一。
三、斯托茨勒合成(Storz reaction)斯托茨勒合成反应是醛、酮与硫酸钠或硫酸食盐反应,生成酯的方法。
该反应是由俄罗斯化学家弗拉基米尔·利奥诺维奇·斯托茨(Vladimir Leontievich Stotsky)发现并命名的。
通过控制反应条件和底物的选择,可以合成具有多种不同结构的酯。
四、诺贝尔-加斯基诺反应 (Nobel-Gassman 试剂生成反应)诺贝尔-加斯基诺反应是一种用于合成β-哌啶酮的方法,是由德国化学家赫尔曼·斯图尔特·诺贝尔(Herman Staudinger)和法国化学家约瑟夫·加斯奥诺(Joseph Köck)合作发现的。
这个反应的关键是氰甲酸酯的转化,通过底物的选择,可以合成出不同结构的β-哌啶酮,具有广泛的应用前景。
有机化学人名反应大全

一、Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R′I 〉R′Br〉R′Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a—卤代醚、a- 或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应.当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷R’X的烷基和亚磷酸三烷基酯(RO)3P 的烷基相同(即R' = R),则Arbuzov 反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯RP(OR')2和次亚膦酸酯R2POR' 也能发生该类反应,例如:反应机理一般认为是按S N2 进行的分子内重排反应:反应实例二、Arndt-Eister反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸.反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例三、Baeyer--—-Villiger反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O—O键异裂.因此,这是一个重排反应具有光学活性的3-—-苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸.反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
有机化学人名反应大全

一、Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R′I >R′Br >R′Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则Arbuzov 反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理2 进行的分子内重排反应:一般认为是按 SN反应实例二、Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例三、Baeyer----Villiger反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
有机化学人名反应
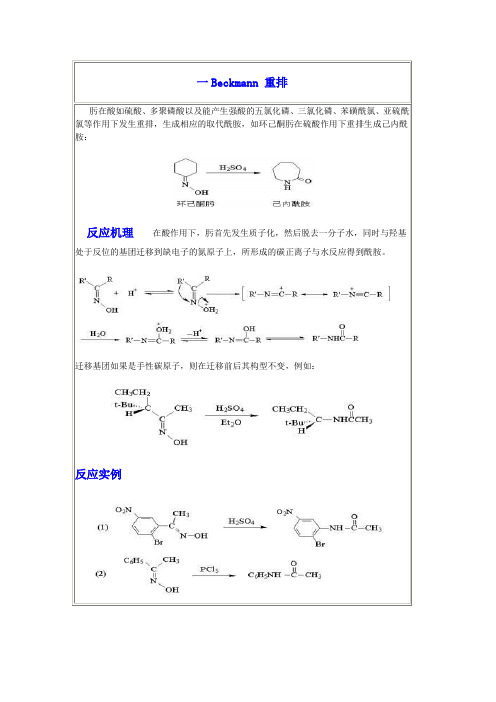
肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例反应机理反应实例反应机理反应实例反应机理反应实例吡啶类化合物不易进行硝化,用硝基还原法制备氨基吡啶甚为困难。
本反应是在杂环上引入氨基的简便有效的方法,广泛适用于各种氮杂芳环,如苯并咪唑、异喹啉、吖啶和菲啶类化合物均能发生本反应。
二元羧酸酯的分子内酯缩合见Dieckmann 缩合反应。
反应机理反应实例烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 -碳 14C 标记的烯丙基醚进行重排,重排后 -碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是 碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3] 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3] 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3] 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
有机化学人名反应

引言概述:有机化学人名反应是有机化学领域中的重要反应,以发现或命名人物命名,旨在纪念对有机化学做出重大贡献的科学家。
本文将介绍五个涉及有机化学人名反应的重要反应,包括Sn2反应、Friedel-Crafts反应、Hofmann降解反应、Diels-Alder反应和Hofmann重排反应。
正文内容:1. Sn2反应1.1 概述:Sn2反应是一种亲核取代反应,其中一个亲核试剂攻击官能团上的消极部分,然后将其替换为新的官能团。
1.2 人名来源:Sn2反应是以科学家在有机化学领域做出开创性贡献的Edwin S. Gould命名。
1.3 反应特点:Sn2反应的反应速率与亲核试剂浓度成正比,但与底物浓度无关。
1.4 影响因素:影响Sn2反应速率的因素包括底物结构、溶剂选择和温度等。
1.5 应用领域:Sn2反应在合成有机化学中广泛应用于底物的碳-氮键或碳-氧键的形成。
2. Friedel-Crafts反应2.1 概述:Friedel-Crafts反应是一种芳香族碳-碳键形成的反应,在芳香族化合物上引入新的取代基团。
2.2 人名来源:Friedel和Crafts是两位法国化学家,他们共同发现并开发了这一重要反应。
2.3 反应类型:Friedel-Crafts反应可以分为两种类型,即芳香烃的烷基化和芳香烃的酰基化。
2.4 反应机理:Friedel-Crafts反应的机理通常涉及亲电取代和负离子取代两种机制。
2.5 应用领域:Friedel-Crafts反应在药物合成和农药合成等领域具有重要的应用价值。
3. Hofmann降解反应3.1 概述:Hofmann降解反应是一种将主要氨基酸转化为次级氨基酸的反应。
3.2 人名来源:Hofmann是德国化学家Hermann Emil Fischer 的学生,他发现并研究了这个反应。
3.3 反应过程:Hofmann降解反应涉及以次氨基酸为中间体进行进一步反应,最终生成次级氨基酸。
有机化学人名反应

有机人名反应Organic Name Reactions目录....................................... 错误!未定义书签。
Bouveault-Blanc还原 .. (1)Cannizzaro 反应 (3)Chichibabin 反应 (4)Claisen重排 (5)Claisen 酯缩合反应 (7)Claisen-Schmidt 反应 (9)Clemmensen 还原 (10)Combes 合成法 .............. 错误!未定义书签。
Cope 重排. (11)Cope 消除反应 (13)Dieckmann 缩合反应 (14)Diels-Alder 反应 (15)Friedel-Crafts烷基化反应 (18)Friedel-Crafts酰基化反应 (19)Gabriel 合成法 (20)Gattermann 反应 (22)Gattermann-Koch 反应...............................23 Gomberg-Bachmann 反应 (24)Hell-Volhard-Zelinski 反应 (25)Hinsberg 反应 (26)Hofmann 烷基化 (27)Hofmann 消除反应 (28)Hofmann 重排(降解) (29)Koble 反应 ......................错误!未定义书签。
Koble-Schmitt 反应 .. (31)Mannich 反应 (32)Michael 加成反应 (33)Oppenauer 氧化 (35)Reformatsky 反应 (36)Rosenmund 还原 (37)Sandmeyer 反应 (38)Schmidt反应 (39)Skraup 合成法 (40)Williamson 合成法 (41)Wolff-Kishner-黄鸣龙反应 (43)反应机理反应实例反应机理反应实例反应机理反应实例吡啶类化合物不易进行硝化,用硝基还原法制备氨基吡啶甚为困难。
有机化学人名命名的反应

1.Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则Arbuzov 反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理一般认为是按 S N2 进行的分子内重排反应:反应实例2.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例3.Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
100种有机化学人名反应(有机化学)

1. ArndtEistert反应醛、酮与重氮甲烷反应失去氮并重排成多一个CH2基的相应羰基化合物这个反应对于环酮的扩环反应很重要。
OCH2N2O-CH2NNN2重排O2. BaeyerVilliger氧化应用过氧酸使酮氧化成酯。
反应中在酮的羰基和相邻的碳原子之间引人一个氧原子。
如由樟脑生成内酯OCH3CH3CH3OOCH3CH3H2SO5有时反应能生成二或多过氧化物但环状酮转变为内酯能得到单一的预期产物。
合适的酸为过硫酸Caro’s 酸、过氧苯甲酸、三氟过氧乙酸。
除环酮外无环的脂肪、芳香酮也可发生此反应。
二酮生成酸酐类、α、β不饱和酮得到烯醇酯类。
3. Bechamp还原可用于工业制备在铁、亚铁盐和稀酸的作用下芳香族硝基化合物能还原成相应的芳香胺。
C6H5-NO2 2Fe 6HCl C6H5-NH2 2FeCl3 2H2O。
当某些盐FeCl2、FeCl3、FeSO4、CaCl2等存在时所用酸无论是过量还是少量甚至在中性溶液中都能够进行这种还原。
此方法适用于绝大部分各种不同结构的芳香族化合物有时也用来还原脂肪族硝基化合物。
4. Beckmann重排醛肟、酮肟用酸或路易斯酸处理后最终产物得酰胺类。
单酮肟重排仅得一种酰胺混酮肟重排得两种混合酰胺。
但一般质子化羟基的裂解和基团R的转移是从相反的位置同时进行的。
NOHRRRNHRONRROHRNHRO 无论酯酮肟和芳酮肟都会发生此反应。
环酮肟重排得内酰胺这在工业生产上很重要利用此反应可帮助决定异构酮肟的结构。
5. Beyer喹啉类合成法芳香伯胺与一分子醛及一分子甲基酮在浓盐酸或ZnCl2存在下反应生成喹啉类化合物。
NH2NHRRHNRRRCHORCOCH3HCl H2这是对Doebner-Miller喹啉合成法的改进。
Doebner-Miller合成法由芳胺和不饱和醛或酮反应得到喹啉衍生物。
NH2NHCH3HNCH3 H2CH3O2CH3CHO 6. Blanc氯甲基化反应芳香族化合物苯、萘、蒽、菲、联苯及衍生物在ZnCl2或NH4Cl、AlCl3、SnCl4、H2SO4、H3PO4 存在下用甲醛和极浓盐酸处理发生芳香化合物的氯甲基化反应。
有机化学人名反应

有机化学人名反应取代反应:1,加特曼反应:加特曼(GattermannL)发现:用催化量的金属铜代替氯化亚铜或溴化亚铜作催化剂,也可使重氮盐与盐酸或氢溴酸反应制得芳香氯化物或溴化物。
这样进行的反应叫做加特曼反应。
2,加特曼-科赫反应:苯、一氧化碳和氯化氢反应生成苯甲醛,此反应称为加特曼-科赫反应。
3,傅-克反应:芳香化合物芳环上的氢被烷基取代的反应称为傅-克烷基化反应;芳香化合物芳环上的氢被酰基取代的反应称为傅-克酰基化反应;统称傅-克反应。
4,布赫尔反应:萘酚在亚硫酸氢钠存在下与氨作用,转变成相应萘胺的反应称为布赫尔反应。
5,齐齐巴宾反应:吡啶与氨基钠反应,生成-氨基吡啶,如果位已被占据,则得-氨基吡啶,但产率很低。
这个反应称为齐齐巴宾(Chichibabin)反应。
6,刚穆伯—巴赫曼反应:芳香重氮盐中的芳基在碱性条件下与其它芳香族化合物偶联成联苯或联苯衍生物的反应称为刚穆伯(Gomberg)—巴赫曼(Bachmann)反应。
7,柯尔伯—施密特反应:干燥的酚钠或酚钾与二氧化碳在加温加压下生成羟基苯甲酸的反应称为柯尔伯—施密特(Kolbe-Schmitt)反应。
8,威廉森合成法:在无水条件下,醇钠和卤代烷作用生成醚的反应称为威廉森(WilliamonAW)合成法。
9,席曼反应:芳香重氮盐和氟硼酸反应,生成溶解度较小的氟硼酸盐,后者加热分解产生氟苯,这称为席曼(Schiemann)反应。
10,桑德迈耳反应:1884年,桑德迈耳(SandmeyerT)发现:在氯化亚铜或溴化亚铜的催化下,重氮盐在氢卤酸溶液中加热,重氮基可分别被氯或溴原子取代,生成芳香氯化物或溴化物。
这一反应称为桑德迈耳反应。
11,普塑尔反应:一些重氮盐在碱性条件下或稀酸的条件下可以发生分子内的偶联反应。
这个反应是普塑尔(PchorrR)在寻找合成菲环的新方法中首先发现的,故称为普塑尔反应。
12,瑞穆尔—悌曼反应:酚与氯仿在碱性溶液中加热生成邻位及对位羟基醛的反应称为瑞穆尔—悌曼(Reimer—Tiemann)反应。
有机化学中的人名反应

有机化学中的人名反应
有机化学中的人名反应是指由某位科学家发现的有机反应,以其名字命名。
这些反应可以帮助我们更好地理解有机化学,并且可以用来制备有机化合物。
首先,我们来看看有机化学中最著名的人名反应——马尔科夫反应。
它是由俄国化学家马尔科夫发现的,它可以将烯烃和烷烃反应,生成烯烃和烷烃的混合物。
这种反应可以用来制备含有双烯烃的有机化合物,这些化合物在药物、农药和香料中都有广泛的应用。
其次,我们来看看有机化学中另一个著名的人名反应——马勒反应。
它是由德国化学家马勒发现的,它可以将烯烃和烷烃反应,生成烯烃和烷烃的混合物。
这种反应可以用来制备含有双烯烃的有机化合物,这些化合物在药物、农药和香料中都有广泛的应用。
最后,我们来看看有机化学中另一个著名的人名反应——马克斯-穆勒反应。
它是由德国化学家马克斯-穆勒发现的,它可以将烯烃和烷烃反应,生成烯烃和烷烃的混合物。
这种反应可以用来制备含有双烯烃的有机化合物,这些化合物在药物、农药和香料中都有广泛的应用。
总之,有机化学中的人名反应是由不同的科学家发现的,它们可以帮助我们更好地理解有机化学,并且可以用来制备有机化合物。
这些反应的发现为有机化学的发展做出了重要贡献,也为我们提供了更多的可能性。
有机化学人名反应大全

一、Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R′I >R′Br >R′Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则Arbuzov 反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理2 进行的分子内重排反应:一般认为是按 SN反应实例二、Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例三、Baeyer----Villiger反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Acetoacetic Ester CondensationAcetoacetic Ester SynthesisAcyloin CondensationAlder-Ene ReactionAldol AdditionAldol CondensationAppel ReactionArbuzov ReactionArndt-Eistert SynthesisAzide-Alkyne 1,3-Dipolar CycloadditionAzo CouplingbBaeyer-Villiger OxidationBaker-Venkataraman RearrangementBalz-Schiemann ReactionBamford-Stevens ReactionBarton DecarboxylationBarton-McCombie Reaction (Barton Desoxygenation) Baylis-Hillman ReactionBeckmann RearrangementBenzilic Acid RearrangementBenzoin CondensationBergman CyclizationBestmann-Ohira ReagentBiginelli ReactionBirch ReductionBischler-Napieralski ReactionBlaise ReactionBlanc ReactionBohlmann-Rahtz Pyridine SynthesisBoronic Acid Mannich ReactionBouveault-Blanc ReductionBrook RearrangementBrown HydroborationBucherer-Bergs ReactionBuchwald-Hartwig Cross Coupling Reaction cCadiot-Chodkiewicz CouplingCannizzaro Oxidation ReductionCBS ReductionChan-Lam CouplingClaisen CondensationClaisen RearrangementClemmensen ReductionClick ChemistryCollins ReagentCope EliminationCope RearrangementConia-Ene ReactionCorey-Bakshi-Shibata Reduction Corey-Chaykovsky Reaction Corey-Fuchs ReactionCorey-Kim OxidationCorey-Seebach ReactionCorey-Suggs ReagentCorey-Winter Olefin Synthesis Coumarin SynthesisCriegee Mechanism for Ozonolysis Cross MetathesisCurtius Rearrangement (Reaction) dDakin ReactionDarzens CondensationDarzens ReactionDelépine ReactionDess-Martin Oxidation DiazotisationDieckmann CondensationDiels-Alder Reaction1,3-Dipolar Cycloaddition Directed ortho Metalation Doebner ModificationeEglinton ReactionEne ReactionEnyne MetathesisEpoxidationEschweiler-Clarke ReactionEster PyrolysisEsterificationfFavorskii ReactionFinkelstein ReactionFischer EsterificationFischer Indole SynthesisFleming-Tamao OxidationFriedel-Crafts AcylationFriedel-Crafts AlkylationFriedlaender SynthesisFries RearrangementFukuyama CouplingFukuyama ReductiongGabriel SynthesisGewald ReactionGlaser CouplingGriesbaum CoozonolysisGrignard ReactionGrubbs ReactionhHaloform ReactionHantzsch Dihydropyridine Synthesis (Pyridine Synthesis) Hay CouplingHeck ReactionHell-Volhard-Zelinsky ReactionHenry ReactionHiyama CouplingHiyama-Denmark CouplingHofmann EliminationHofmann's RuleHorner-Wadsworth-Emmons ReactionHosomi-Sakurai ReactionHuisgen CycloadditionHunsdiecker ReactionHydroborationiIreland-Claisen RearrangementItsuno-Corey ReductionIwanow Reaction (Reagent)jJacobsen EpoxidationJacobsen-Katsuki EpoxidationJocic ReactionJohnson-Corey-Chaykovsky ReactionJones OxidationJulia-Lythgoe OlefinationJulia-Kocienski OlefinationkKabachnik-Fields ReactionKindler ReactionKnoevenagel CondensationKochi ReactionKolbe ElectrolysisKolbe Nitrile SynthesisKolbe-Schmitt ReactionKulinkovich ReactionKulinkovich-de Meijere ReactionKulinkovich-Szymoniak ReactionKumada CouplinglLawesson's ReagentLeuckart Thiophenol ReactionLuche ReductionmMalonic Ester SynthesisMannich ReactionMarkovnikov's RuleMcMurry ReactionMeerwein-Ponndorf-Verley ReductionMyers' Modification of the Ramberg-Bäcklund Reaction Myers-Saito CyclizationMichael AdditionMichaelis-Arbuzov ReactionMitsunobu ReactionMiyaura Borylation ReactionModified Julia OlefinationMukaiyama Aldol AdditionnNazarov CyclizationNef ReactionNegishi CouplingNewman-Kwart RearrangementNitroaldol ReactionNozaki-Hiyama CouplingNucleophilic Substitution (S N1 / S N2)oOhira-Bestmann ReagentOlefin MetathesisOppenauer OxidationOverman RearrangementOxy-Cope RearrangementOzonolysispPaal-Knorr Furan SynthesisPaal-Knorr Pyrrole SynthesisPaal-Knorr Thiophene SynthesisPaterno-Büchi ReactionPauson-Khand ReactionPechmann CondensationPetasis ReactionPeterson OlefinationPinacol Coupling ReactionPinacol RearrangementPinner ReactionPrévost ReactionPrilezhaev ReactionPrins ReactionPschorr ReactionqrRamberg-Bäcklund Reaction Reformatsky ReactionRing Closing MetathesisRing Opening Metathesis (Polymerization) Ritter ReactionRobinson AnnulationRosenmund ReductionRosenmund-von Braun Reaction Rubottom OxidationsSakurai ReactionSandmeyer ReactionSaytzeff's RuleSchiemann ReactionSchlosser ModificationSchmidt ReactionSchotten-Baumann ReactionSeebach UmpolungSeyferth-Gilbert HomologationSarett ReagentShapiro ReactionSharpless AminohydroxylationSharpless DihydroxylationSharpless EpoxidationShi EpoxidationSimmons-Smith ReactionSonogashira CouplingStaudinger CycloadditionStaudinger ReactionStaudinger SynthesisSteglich EsterificationStetter ReactionStille CouplingStrecker SynthesisSuzuki CouplingSwern OxidationtTamao-Kumada OxidationTebbe OlefinationTishchenko ReactionTsuji-Trost ReactionTrost AllylationuUgi ReactionUllmann ReactionUpjohn DihydroxylationvVan Leusen Imidazole Synthesis Van Leusen Oxazole Synthesis Van Leusen ReactionVicarious Nucleophilic Substitution Vilsmeier ReactionwWacker-Tsuji OxidationWeinreb Ketone Synthesis Wenker SynthesisWillgerodt-Kindler Reaction Williamson SynthesisWittig-Horner ReactionWittig Reaction[1,2]-Wittig Rearrangement[2,3]-Wittig RearrangementWohl-Ziegler ReactionWolff-Kishner ReductionWolff RearrangementWoodward cis-Hydroxylation Woodward ReactionWurtz ReactionWurtz-Fittig ReactionxyYamaguchi Esterification。
