二元液系气液平衡相图
实验D-7二元液系相图-基础化学实验中心

实验D-5 溶液的二元液系T-X图实验目的1.采用回流冷凝法测定不同浓度的二元液系的沸点和气液两相组成,绘制其沸点∽组成(t∽X)图(包括液体折射率工作曲线的绘制),并描述其相图特征,找出其恒沸点温度与组成。
2.用阿贝折光仪测量液体和蒸汽的组成。
了解液体折光率的测量原理和方法。
实验原理一个完全互溶双液体系的沸点∽组成图,表明在气液两相平衡时,沸点与气液两相组成的关系;它对于了解这一体系的性质及精馏过程都有很大的实用价值.在恒压下完全互溶的双液体系T∽X有下列三种情况:1.所有组成溶液沸点介于二纯组分沸点之间,如苯与甲苯(图D5-1A)。
2.有最高恒沸点,如卤化氢和水(图D5-1B)。
3.有最低恒沸点,如苯和乙醇(图D5-1C)。
A B C图D5-1 二元液系相图在图D5-1A中,A'LB'代表液相线,A'VB'代表气相线,等温水平线与气相线和液相线的交点分别代表在该温度时相互成平衡的气相和液相的组成.在图D5-1c中,绘制沸点∽组成图的原理说明如下:当总组成为X的溶液加热时,体系的温度沿着虚线上升,当温度达到T时(即和液相线相交时)溶液开始沸腾,此时平衡的气相组成为yV ,液相组成为X.温度升至Ti,气相组成为yi,液相组成为xi,在此相区f=C - P + 2式中:f为自由度;P为相数;C为组分数。
在本实验中C=2,在二相区(气、液二相),P = 2,∴f=2,由于压力指定(实验在恒压下进行)所以在二相区内f=l,因此,若指定温度则气液相浓度就不可改变,此时气、液两相的相对量亦不可变(服从杠杆原理);反之,若指定了气液相的相对量从而气液相组成一定,则沸点也确定了。
本实验采用后者使用Ellis平衡蒸馏仪利用回流方法保持气液两相相对量一定,测定平衡时的沸点,并分别收集气相冷凝液和液相的样品,用化学方法或物理方法分析其组成,这样在T—X图上可找到此沸点T1时互成平衡的液相组成Xl和气相组成yl。
实验二 双液系的气—液平衡相图

实验二双液系的气—液平衡相图1. 目的要求(1) 绘制在p0下环己烷-乙醇双液系的气-液平衡相图,了解相图和相律的基本概念。
(2) 掌握测定双组分液体沸点的方法。
(3) 掌握用折光率确定二元液体组成的方法。
2. 基本原理任意两个在常温时为液态的物质混合起来组成的体系称为双液系。
两种溶液若能按任意比例进行溶解,称为完全互溶双液系;若只能在一定比例范围内溶解,称为部分互溶双液系。
环己烷-乙醇二元体系就是完全互溶双液系。
双液系蒸馏时的气相组成和液相组成并不相同。
通常用几何作图的方法将双液系的沸点对其气相和液相的组成作图,所得图形叫双液系的沸点(T)组成(x)图,即T—x图。
它表明了在沸点时的液相组成和与之平衡的气相组成之间的关系。
图2.2.1 双液系的T-x图双液系的T—x图有三种情况:(1)理想溶液的T—x图(图2.2.1a),它表示混合液的沸点介于A、B二纯组分沸点之间。
这类双液系可用分馏法从溶液中分离出两个纯组分。
(2)有最低恒沸点体系的T—x图(图2.2.1b)和有最高恒沸点体系的T—x图(图2.2.1c)。
这类体系的T—x图上有一个最低和一个最高点,在此点相互平衡的液相和气相具有相同的组成,分别叫做最低恒沸点和最高恒沸点。
对于这类的双液系,用分馏法不能从溶液中分离出两个纯组分。
本实验选择一个具有最低恒沸点的环己烷—乙醇体系。
在101.325kPa下测定一系列不同组成的混合溶液的沸点及在沸点时呈平衡的气液两相的组成,绘制T—x图,并从相图中确定恒沸点的温度和组成。
测定沸点的装置叫沸点测定仪(图2.2.2)。
这是一个带回流冷凝管的长颈圆底烧瓶。
冷凝管底部有一半球形小室,用以收集冷凝下来的气相样品。
电流通过浸入溶液中的电阻丝。
这样可以减少溶液沸腾时的过热现象,防止暴沸。
测定时,温度计水银球要一半在液面下,一半在气相中,以便准确测出平衡温度。
溶液组成分析:由于环己烷和乙醇的折光率相差较大,而折光率的测定又只需少量样品,4. 实验步骤(1) 纯液体折光率的测定 :分别测定乙醇和环己烷的折光率,重复2次~3次。
Origin与实验数据作图

一、实验数据点作图及线性回归
用721型分光光度计测得某试样在不同的入 射光波长λ下的吸收值A如下 :
λ/nm 430 440 450 460 470 480
A
0.410 0.375 0.325 0.280 0.240 0.205
用Origin作图,并用直线方程A= a + bλ回归
一、实验数据点作图及线性回归
0.003
logP
2.80
2.78
2.76 2.85 2.86 2.87 2.88 2.89 2.90 2.91 2.92 2.93 2.94
1000/T(K)
三、 用Origin处理二元液系气液平衡相图实验数据并作图
选中D列(Y),以D列对A列(X)作图,
对所得散点进行拟合,方法是左键点击“Analysis”选择“Fit linear”,即得拟合的直线, 并在右下端窗口给出了拟合后的线性方程,其斜率B、截距A以及相关性R等信息,
log(col(D)) log(col(D))
y = a + b*x No Weighting
3.39566E-7
log(col(D)) Linear Fit of log(
-0.99998
0.99997
Value
Standard Error
Intercept
7.51888
0.00869
Slope
-1.62011
2.8
2.4
Normalized Heat Flow End
2.0
1.6
1.2
0.840
80
120
160
200
Temperature(℃)
五、多个XRD、DSC图
双液系气液平衡相图-物理化学实验
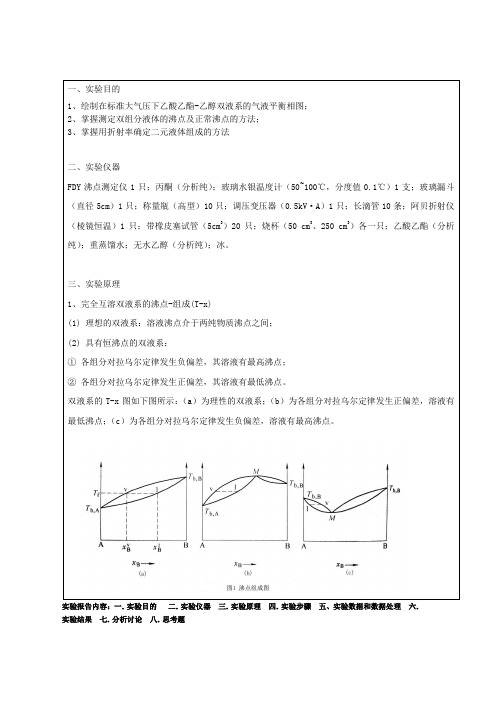
一、实验目的1、绘制在标准大气压下乙酸乙酯-乙醇双液系的气液平衡相图;2、掌握测定双组分液体的沸点及正常沸点的方法;3、掌握用折射率确定二元液体组成的方法二、实验仪器FDY沸点测定仪1只;丙酮(分析纯);玻璃水银温度计(50~100℃,分度值0.1℃)1支;玻璃漏斗(直径5cm)1只;称量瓶(高型)10只;调压变压器(0.5kV·A)1只;长滴管10条;阿贝折射仪(棱镜恒温)1只;带橡皮塞试管(5cm3)20只;烧杯(50 cm3、250 cm3)各一只;乙酸乙酯(分析纯);重蒸馏水;无水乙醇(分析纯);冰。
三、实验原理1、完全互溶双液系的沸点-组成(T-x)(1) 理想的双液系:溶液沸点介于两纯物质沸点之间;(2) 具有恒沸点的双液系:①各组分对拉乌尔定律发生负偏差,其溶液有最高沸点;②各组分对拉乌尔定律发生正偏差,其溶液有最低沸点。
双液系的T-x图如下图所示:(a)为理性的双液系;(b)为各组分对拉乌尔定律发生正偏差,溶液有最低沸点;(c)为各组分对拉乌尔定律发生负偏差,溶液有最高沸点。
实验报告内容:一实验目的二实验仪器三实验原理四实验步骤五、实验数据和数据处理六实验结果七.分析讨论八.思考题2、沸点测定仪本实验所用沸点仪是一只带回流冷凝管的长颈圆底烧。
冷凝管底部有一半球形小室,用以收集冷凝下来的气相样品。
电热丝直接加热液体以减少溶液沸腾时的过热现象及防止瓶暴沸。
小玻璃管有利于降低周围环境对温度计读数可能造成的波动。
3.组成分析本实验选用的乙酸乙酯和乙醇两者折射率相差颇大,而折射率测定又只需要少量样品,所以可用折射率-组成工作曲线来测得平衡体系的两相组成。
4、相图的绘制为了绘制二元双液系的T-x图,需在气液相达平衡后,同时测定气相组成、液相组成和溶液沸点。
实验装置图如图所示:四、实验步骤(1) 安装沸点仪并接通冷凝水;(2) 将乙醇加入沸点仪内,加热至缓慢沸腾(3) 记录乙醇的沸点(4) 测定乙醇的折射率(5) 加入不同摩尔分数的乙酸乙酯-乙醇溶液(6) 记录沸点(7) 吸取气相冷凝液、液相冷凝液测定折射率(8) 将溶液倒入回收瓶(9) 绘制曲线五、实验数据和数据处理室温:25℃大气压:100kPa M无水乙醇=46.07g/mol、M乙酸乙酯=88.11g/mol ρ无水乙醇=0.79g·mol-1ρ乙酸乙酯=0.902g·mol-1无水乙醇体积(ml) 乙酸乙酯体积(ml) 乙酸乙酯浓度(mol%)折射率n90 10 0.063 1.36380 20 0.131 1.36470 30 0.206 1.36560 40 0.287 1.36650 50 0.377 1.36740 60 0.476 1.36830 70 0.585 1.36920 80 0.707 1.37010 90 0.845 1.371 根据乙酸乙酯浓度与折射率,作图如下:添加直线拟合线及拟合方程,由拟合方程式可知:x=(y-1.3626)/0.0104室温:25℃大气压:100kPa混合体系沸点气相冷凝液折射率n 液相冷凝液折射率n 气相组成液相组成78 -- --0 076.8 1.3635 1.3626 0.0865 0.000076.2 1.3642 1.3629 0.1538 0.028875.5 1.3648 1.3632 0.2115 0.057774.7 1.3655 1.3635 0.2788 0.086574 1.3663 1.3642 0.3558 0.153873.3 1.3668 1.3651 0.4038 0.240472.6 1.3673 1.3659 0.4519 0.317372 1.368 1.3672 0.5192 0.442372.7 1.3695 1.3701 0.6635 0.721273.4 1.3697 1.3703 0.6827 0.740474.8 1.3703 1.3709 0.7404 0.798175.5 1.3708 1.3712 0.7885 0.826976.2 1.3713 1.3715 0.8365 0.855876.7 1.3716 1.3717 0.8654 0.875077 -- -- 1 1 查询数据可知:无水乙醇沸点:78℃乙酸乙酯沸点:77℃;由图可知在液相组成时,混合体系沸点76.8℃对应的值为0.0000;此数值属于误差,应当剔除。
10-2二元液系相图

二元液系相图一、实验目的1、测定环己烷-乙醇系统的沸点组成图(T-X图)2、掌握阿贝折光仪的使用方法二、实验原理1、一个完全互溶的二元系统的沸点-组成图,表明在气液二相平衡时,沸点和两相组成间的关系.2、在常温下,两种液态物质以任意比例相互溶解所组成的体系称之为完全互溶双液系。
完全互溶双液系在恒定压力下的沸点—组成图可分为三类:3、(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图1(a)所示。
4、(2)最大负偏差:混合物存在着最高沸点,如盐酸-水体系,如图1 (b)所示。
5、(3)最大正偏差:混合物存在着最低沸点,如正丙醇—水体系,如图1(c)所示。
BB B(a)(b)(c)本实验绘制环己烷-乙醇二元液系的T-X图。
其方法为将不同组成的溶液于蒸馏仪中进行蒸馏看,沸腾平衡后记下温度,一次吸取少量的蒸馏液和蒸出液。
分别用阿贝折光计测定其折射率,然后由环己烷-乙醇的折射率组成标准曲线或其数据表确定相应组成,从而绘制环已烷-乙醇二元液系相图。
三、实验仪器与试剂1、沸点测定仪1个;取样管12支;阿贝折光计1台;环己烷(分析纯);无水乙醇(分析纯);直流稳压电源1台四、实验步骤1、纯液体折光率的测定。
分别测定乙醇和环己烷的折光率。
2、工作曲线的绘制。
这有实验书所给定的数据进行绘制。
3、测定沸点-组成数据(1)安装沸点测定仪。
将干燥的沸点测定仪按图2-1安装图2-1好,检查带有温度计的橡皮塞是否塞紧。
加热用的电阻丝要靠近底部中心,温度计的水银球不能接触电阻丝,而且每次更换溶液后,要保证测定条件尽量平行(包括水银温度计和电阻丝的相对位置)。
(2)用老师粗略的配制好的20%,40% ,60% ,80%组成的环己烷-乙醇溶液约50ml。
(3)测定沸点及平衡的气液相组成。
取下塞子,加入所要测定的溶液(40ml),其液面以在水银球中部为宜。
接好加热线路,打开冷凝水,再接通电源。
调节直流稳压电源电压调节旋钮,使加热电压为10-15v,缓慢加热。
二元相图

实验二异丙醇——环己烷体系的气——液平衡相图一、目的1. 在常压下测定一完全互溶双液系在不同组成时的沸点和气液两相平衡时的组成并作出沸点——组成相图。
2. 了解沸点的测定方法。
3. 用阿贝折光仪测量液相和气相的组成,了解液体折光率的测定原理和方法。
二、原理两种在常温时为液体的物质混合起来而成的二组分体系称为双液系,两液体若能按任意比例互相溶解,称完全互溶双液系;若只能在一定比例范围内互溶,则称为部分互溶双液系。
例如异丙醇、环己烷双液系;丙酮、氯仿双液系;乙醇、水双液系都是完全互溶双液系,苯、水双液系是部分互溶双液系。
液体的沸点是指液体的蒸气压和外压相等时的温度。
在一定的外压下,纯液体的沸点有确定的值。
但对双液系,沸点不仅是与外压有关,而且还和双液系的组成有关,即和双液系中两种液体的相对含量有关。
由两种挥发性液体所构成的溶液与气相呈平衡时,气相组成与液相组成经常不同,亦即在恒压下将该溶液蒸馏,馏出液和母液组成不同。
对理想溶液,每一组分在气相中所占的分压P B等于该纯组分的饱和蒸发压P B与液相中该组分之摩尔分数的乘积,此即拉乌尔定律的数学表达式:P B=P B X B。
对大多数实际溶液由于两种液体分子的相互影响,与拉乌尔定律发生很大的偏差,原因是在两种组分之间存在着化学反应的趋势或者发生缔合,致使溶液的挥发性变小,另外有些物质组成溶液后使缔合度变小,溶液的挥发度增大,在这些实际溶液沸点组成曲线上便出现了最高或最低点,其液相曲线与气相曲线相交于一点,即两相组分相同,再继续蒸馏,只是使气相的总量增加而溶液的组成及沸点均不改变,这溶液称为恒沸混合物。
本实验研究由异丙醇——环己烷按不同比例组成的溶液,在蒸馏过程中,当达到一定沸点时,分别取出馏出液和母液试样,用物理方法,测其折光率分析其组成,尔后t-x相图。
折光率是一个物质的特征数值,溶液的折光率与组成有关,因此在一定温度下测定一系列已知浓度溶液的折光率,作出该溶液折光率——组成工作曲线,就可按内插法得到这种未知溶液的组成。
双液系气液平衡相图-学生用

冷凝液蒸汽RP 物理化学实验环己烷—乙醇恒压气液平衡相图绘制一、实验目的 1、 测定常压下环己烷-乙醇二元系统的气液平衡数据,绘制101325Pa 下的沸点-组成的相图。
2、 掌握阿贝折射仪的原理和使用方法。
3、 掌握水银温度计与大气压力计的校正与使用方法。
二、实验原理液体混合物中各组分在同一温度下具有不同的挥发能力。
因而,经过气液间相变达到平衡后,各组分在气、液两相中的浓度是不相同的。
根据这个特点,使二元混合物在精馏塔中进行反复蒸馏,就可分离得到各纯组分。
为了得到预期的分离效果,设计精馏装置必须掌握精确的气液平衡数据,也就是平衡时的气、液两相的组成与温度、压力间的依赖关系。
大量工业上重要的系统的平衡数据,很难由理论计算,必须由实验直接测定,即在恒压(或恒温)下测定平衡的蒸汽与液体的各组分。
其中,恒压数据应用更广,测定方法也较简便。
恒压测定方法有多种,以循环法最普遍。
循环法原理的示意图见图1。
在沸腾器P 中盛有一定组成的二元溶液,在恒压下加热。
液体沸腾后,逸出的蒸汽经完全冷凝后流入收集器R 。
达一定数量后逸流,经回流管流回到P 。
由于气相中的组成与液相中不同,所以随着沸腾过程的进行,P 、R 两容器中的组成不断改变,直至达到平衡时,气、液两相的组成也保持恒定。
分别从R 、P 中取样进行分析,即得出平衡温度下气相和液相的组成。
图 1 循环法原理示意图 图 2 在最低恒沸点的二元气液平衡相图本实验测定的恒压下环己烷-乙醇二元气液平衡相图,如图2所示。
图中横坐标表示二元系的组成(以B 的摩尔分数表示),纵坐标为温度。
显然曲线的两个端点*A t 、*B t 即指在恒压下纯A 与纯B 的沸点。
若溶液原始的组成为0x ,当它沸腾达到汽液平衡的温度为1t 时,其平衡汽液相组成分别为1y 与1x 。
用不同组成的溶液进行测定,可得一系列t −x −y 数据,据此画出一张由液相线与气相线组成的完整相图。
图2的特点是当系统组成为e x 时,沸腾温度为e t ,平衡的气相组成与液相组成相同。
二元系统气液平衡数据测定1
一、实验目的1. 了解和掌握用双循环汽液平衡器测定二元系统气液平衡数据的方法。
2. 了解缔合系统汽—液平衡数据的关联方法,从实验测得的T-p-x-y 数据计算各组分的活度系数。
3. 通过实验了解平衡釜的构造,掌握气液平衡数据的测定方法和技能。
4. 掌握二元系统气液平衡相图的绘制。
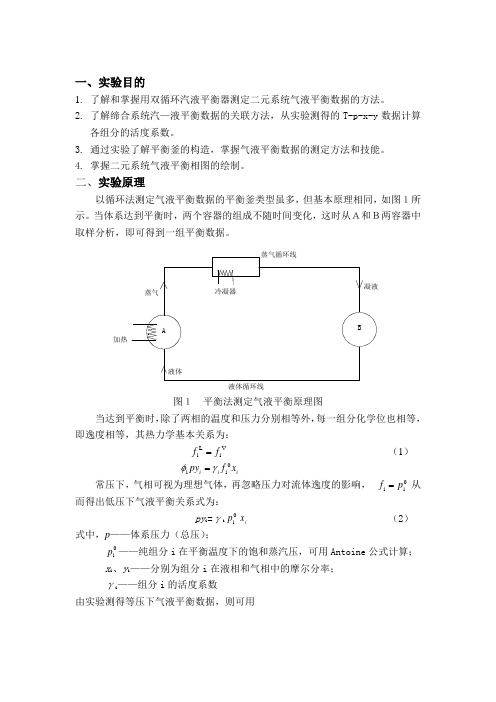
二、实验原理以循环法测定气液平衡数据的平衡釜类型虽多,但基本原理相同,如图1所示。
当体系达到平衡时,两个容器的组成不随时间变化,这时从A和B两容器中取样分析,即可得到一组平衡数据。
冷凝器凝液蒸气循环线蒸气加热液体液体循环线图1 平衡法测定气液平衡原理图BA图1 平衡法测定气液平衡原理图当达到平衡时,除了两相的温度和压力分别相等外,每一组分化学位也相等,即逸度相等,其热力学基本关系为:V i L i f f = (1) i i i x f py 0i i γφ=常压下,气相可视为理想气体,再忽略压力对流体逸度的影响,0i i p f = 从而得出低压下气液平衡关系式为:py i =γi0i p i x (2)式中,p ——体系压力(总压);0i p ——纯组分i 在平衡温度下的饱和蒸汽压,可用Antoine 公式计算; x i 、y i ——分别为组分i 在液相和气相中的摩尔分率; γi ——组分i 的活度系数由实验测得等压下气液平衡数据,则可用i p x py i ii =γ (3) 计算出不同组成下的活度系数。
本实验中活度系数和组成关系采用Wilson 方程关联。
Wilson 方程为: ln γ1=-ln(x 1+Λ12x 2)+x 2(212112x x Λ+Λ -121221x x Λ+Λ) (4)ln γ2=-ln(x 2+Λ21x 1)+x 1(121221x x Λ+Λ -212112x x Λ+Λ) (5)Wilson 方程二元配偶函数Λ12和Λ21采用非线性最小二乘法,由二元气液平衡数据回归得到。
目标函数选为气相组成误差的平方和,即F =2221211((j mj j y y y y ))计实计实-+-∑=三、主要仪器设备与实验装置流程图:1.平衡釜一台 2.阿贝折射仪一台 3.超级恒温槽一台4.50-100十分之一的标准温度计一支5.所用试剂(无水甲醇、异丙醇)为分析纯试剂。
13 实验五 二元液体溶液的气—液平衡相图
实验五 二元液态混合物的气-液平衡相图【目的要求】1.实验测定并绘制环己烷-乙醇体系的沸点组成(T -x )图,确定其恒沸点及恒沸混合物的组成。
2.了解测量折光率的原理,掌握阿贝折光仪的使用方法。
【实验原理】两种液体能在任意浓度范围内完全相溶的体系称完全互溶的双液体系。
根据相律:f =K Φ+2式中:f 为体系的自由度;K 为体系中的组分数;Φ为体系中的相数;2是指压力和温度两个变量。
对于定压下的二组分液态混合物,相律可表示为:f =3-Φ。
在大气压力下,液体的蒸气压和外压相等时,平衡温度即为沸点。
对于完全互溶的双液体系,当气液两相平衡时Φ=2,f =1。
完全互溶的双液体系在定压下并没有固定的沸点,为一沸程,并且是和溶液的组成有关的,即T 是x 的函数。
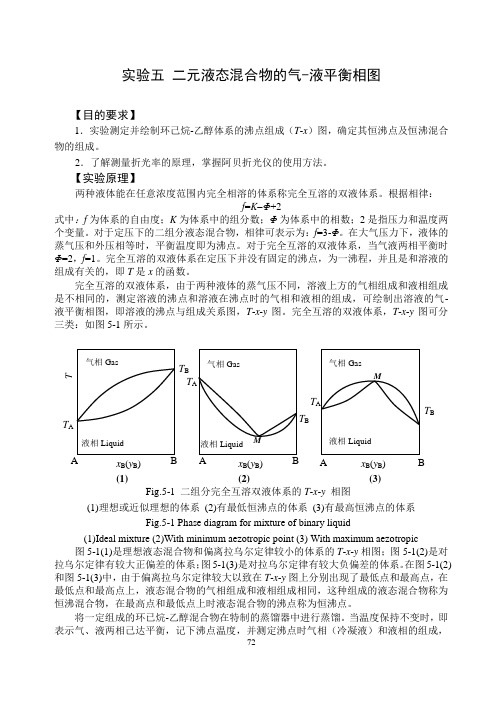
完全互溶的双液体系,由于两种液体的蒸气压不同,溶液上方的气相组成和液相组成是不相同的,测定溶液的沸点和溶液在沸点时的气相和液相的组成,可绘制出溶液的气-液平衡相图,即溶液的沸点与组成关系图,T -x -y 图。
完全互溶的双液体系,T -x -y 图可分三类:如图5-1所示。
图5-1(1)是理想液态混合物和偏离拉乌尔定律较小的体系的T -x -y 相图;图5-1(2)是对拉乌尔定律有较大正偏差的体系;图5-1(3)是对拉乌尔定律有较大负偏差的体系。
在图5-1(2)和图5-1(3)中,由于偏离拉乌尔定律较大以致在T -x -y 图上分别出现了最低点和最高点,在最低点和最高点上,液态混合物的气相组成和液相组成相同,这种组成的液态混合物称为恒沸混合物,在最高点和最低点上时液态混合物的沸点称为恒沸点。
将一定组成的环已烷-乙醇混合物在特制的蒸馏器中进行蒸馏。
当温度保持不变时,即表示气、液两相己达平衡,记下沸点温度,并测定沸点时气相(冷凝液)和液相的组成,Fig.5-1 二组分完全互溶双液体系的T -x -y 相图 (1)理想或近似理想的体系 (2)有最低恒沸点的体系 (3)有最高恒沸点的体系 Fig.5-1 Phase diagram for mixture of binary liquid(1)Ideal mixture (2)With minimum aezotropic point (3) With maximum aezotropic 液相Liquid 气相Gas T B x B (y B ) (3) M A B液相Liquid气相Gas T A T B x B (y B ) T (1) AB 液相Liquid 气相Gas T A T Bx B (y B ) (2) M A B T A图5-2 沸点仪示意图 1.温度计;2.接加热器;3.加液口;4.电热丝连接点;5.电热丝;6.分馏液;7.分馏液取样口 Fig.5-2 The sketch of ebulliometer 1.thermometer;2. connection pole;3. inlet orifice; 4. connection point of heater with wire;5.heater; 6. fractional liquid;7. sampling orifice 即可得到一组T -x -y 数据。
双液系的气-液平衡相图ppt课件

三.仪器与试剂 [注意按实际使用的记录]
四.试验步骤
1.工作曲线绘制
(1)调节超级恒温水浴温度在室温5℃以上,以适应季 节的变化,但所选温度应易于获得试样的密度数据。 环己烷和乙醇分别恒温10min,根据配制混合物所需 的体积,用移液管精确量取,配制环己烷摩尔分数为 0.10,0.20,0.30,0.40,0.50,0.60,0.70, 0.80,0.90 的环己烷-乙醇溶液各10ml。为避免样 品的挥发带来的误差,配制应尽可能迅速。 (2)用尽可能短的软管将阿贝折光仪连接在前述调好 的恒温水浴上,以保持折光仪棱镜处于恒定温度。测 量上述9个溶液以及无水乙醇和纯环己烷的折光率。
按上述相同的步骤,用第二套沸点仪测定环己 烷摩尔分数为0.90 的环己烷-乙醇溶液的沸 点以及气相和液相的折射率测定。
6.系列环己烷-乙醇溶液以及环己烷的测定 按上述第5步所述步骤,分别用第一套沸点仪从
低组成向高组成逐一测定各溶液的沸点、大气压 及两相样品的折光率,而用第二套沸点仪从高组成 向低组成逐一测定各溶液的沸点、大气压及两相 样品的折光率。直至完成所有溶液的测定。 系列溶液可回收供其它同学使用;每个试样测定 后,将沸点仪尽量倒干净即可,不必干燥。记录温度 数据时千万不要忘记注明所用温度计的编号或代 码!
2.精密数字温度温差仪温度的校正
将两套精密数字温度温差仪的探头同时放入 恒温水浴中,测定温度的差值,以其中一套的 读数为基准,对另一套精密数字温度温差仪读 数进行校正。并作燥的沸点仪安装好。检查 带有温度计的软木塞是否塞紧,电热丝要靠 近烧瓶底部的中心。温度计探头的位置应 处在支管之下,但至少要高于电热丝1 cm。 温度计套管中应加入适量的硅油或液体石 蜡,以完全浸没测温探头敏感部分(约2.5~ 3cm),便于传热。
双液系的气—液平衡相图

双液系的气—液平衡相图一、实验目的1.绘制在Pθ环已烷—乙醇的气液平衡相图,了解相图和相律基本概念;2.掌握测定双组分液体的沸点及正常沸点的方法;3.掌握用折光率确定二元液体的组成方法。
二、实验原理液体的沸点是指液体的蒸气压和外压相等时的温度,在一定的外压下,纯液体的沸点有确定值。
但双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。
根据相律:自由度=组分数-相数+2因此,一个气—液共存的二组分体系,其自由度为2。
只要任意再确定一个变量,整个体系的存在状态就可以用二维图形来描述。
两种挥发性液体混合,假设该二组分的蒸气压不同,则溶液的组成与其平衡气相的组成不同。
在压力保持一定,二组分系统气液到达平衡时,表示液态混合物的沸点与平衡时组成关系的相图,称为沸点和组成〔T-x〕图。
沸点和组成〔T-x〕的关系有以下三种:〔1〕理想液体混合物或接近理想液体混合物的双液系,其液体混合物的沸点介于两纯物质沸点之间见图1(a);〔2〕各组分蒸气压对拉乌尔定律产生很大的负偏差,其溶液有最高恒沸点见图1(b);〔3〕各组分蒸气压对拉乌尔定律产生很大的正偏差,其溶液有最低恒沸点见图1(c)。
第〔2〕、〔3〕两类溶液在最高或最低恒沸点时的气液两相组成相同,加热蒸发的结果只使气相总量增加,气液相组成及溶液沸点保持不变,这时的温度称恒沸点,相应的组成称恒沸组成。
图1. 沸点和组成〔T-x〕图本实验是测定具有最低恒沸点的环己烷—乙醇双液系的T-x图。
方法是用沸点仪〔如图2所示〕直接测定一系列不同组成之溶液的气液平衡温度〔即沸点),并收集少量馏出液〔即气相冷凝液〕及吸取少量溶液〔即液相〕,分别用阿贝折光仪测定其折光率。
根据已知组成的溶液折光率,作出一定温度下〔25℃〕该溶液的折光率—组成工作曲线,然后根据测得的样品溶液的气液两相的折光率,在此曲线上即可按内描法得到待测未知样品溶液的组成。
图2. 沸点测定仪示意图三、仪器与药品沸点测定仪1只丙酮〔分析纯〕水银温度计〔50~100℃,分度值0.1℃〕1支超级恒温水浴1台玻璃温度计〔0~100℃,分度值1℃〕1支称量瓶〔高型〕10只调压变压器〔0.5kVA〕1只25mL移液管数字式Abbbe折光仪〔棱镜恒温〕1台长滴管10支带玻璃磨口塞试管〔5mL〕4支无水乙醇〔分析纯〕烧杯〔50ml,250ml〕各1支环己烷〔分析纯〕玻璃漏斗〔直径5cm〕1只重蒸馏水,冰四、实验步骤1.调节超级恒温水浴温度,使阿贝折光仪上的温度计读数保持在25℃。
双液系的气液平衡相图
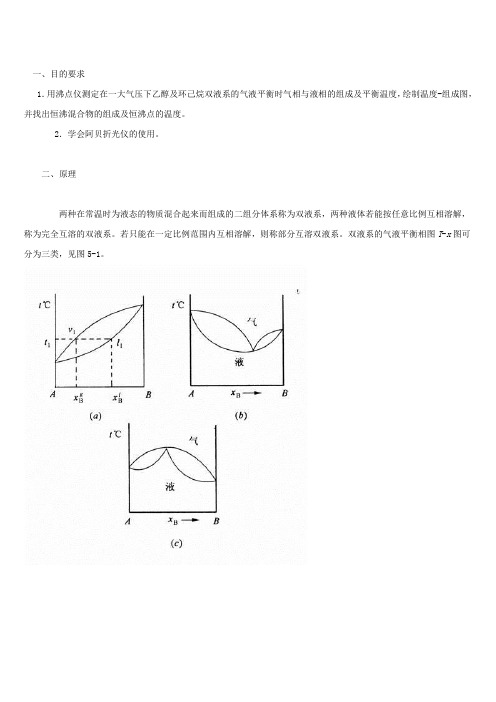
一、目的要求1.用沸点仪测定在一大气压下乙醇及环己烷双液系的气液平衡时气相与液相的组成及平衡温度,绘制温度-组成图,并找出恒沸混合物的组成及恒沸点的温度。
2.学会阿贝折光仪的使用。
二、原理两种在常温时为液态的物质混合起来而组成的二组分体系称为双液系,两种液体若能按任意比例互相溶解,称为完全互溶的双液系。
若只能在一定比例范围内互相溶解,则称部分互溶双液系。
双液系的气液平衡相图T-x 图可分为三类,见图5-1。
相线,表示在不同溶液的沸点时与溶液成平衡时的气相组成,下面的曲线表示液相线,代表平衡时液相的组成。
例如图x,液相组成点x。
无水乙醇(ml)1234环己烷(ml)43213.用阿贝折光仪测标准溶液以及纯乙醇、纯环己烷的折射率。
4.测定体系的沸点及气液两相的折射率。
测定方法如下:将一配制好的样品注入沸点仪中,液体量应盖过加热丝,处在温度计水银球的中部,旋开冷凝水,接通电源,电压不能超过规定电压,否则会烧断加热丝。
当液体沸腾、温度稳定后,记下沸腾温度及环境温度,并停止加热。
分别用滴管吸取气相及液相的液体用阿贝折光仪测其折射率,每份样品读数二次取平均值。
测定完之后,将沸点仪中的溶液倒回原试剂瓶中,换另一种样品按上述操作进行测定。
五、注意事项1.沸点仪中没有装人溶液之前绝对不能通电加热,如果没有溶液,通电加热丝后沸点仪会炸裂。
2.一定要在停止通电加热之后,方可取样进行分析。
3.使用阿贝折光仪时,棱镜上不能触及硬物(滴管),用擦镜纸擦镜面。
六、数据处理1.将标准溶液的体积百分数按式(5-1)换算成重量百分数,然后以重量百分数对折射作图。
W%=×100% (5-1)式中V1、D1分别代表乙醇的体积及比重,乙醇的比重在20℃为0.7893;V2、D2分别代表环己烷的体积及比重,环己烷的比重在20℃时为0.7791。
2.沸点校正,由于温度计的水银柱未全部浸人待测温度的区域内而须进行露茎校正。
校正公式 D t露=K·n·(t测一t环) (5-2)式中K=0.00016,n为露出于被测体系之外的水银柱长度,t测为测量温度计上的读数,t环为环境温度。
二元液系气液平衡相图

实验二二元液系气液平衡相图一、实验目得1、了解环己烷—乙醇系得沸点—组成图2、由图上得出其最低恒沸温度及最低恒沸组成(含乙醇%)3、学会使用数字阿贝折射仪4、学会使用WTS-05数字交流调压器二、原理一个完全互溶双液体系得沸点—组成图,表明在气液二相平衡时沸点与二相成分间得关系,它对了解这一体系对行为及分馏过程都有很大得实用价值。
在恒压下完全互溶双液系得沸点与组分关系有下列三种情况:1、溶液沸点介于二纯组分之间;2、溶液有最高恒沸点;3、溶液有最低恒沸点、图1表示有最低恒沸点,本次实验图形也像如此得样子,A′LB′代表液相线得交点表示在该温度时互成平衡得二相得成份。
绘制沸点—成份图得简单原理如下:当总成份为X得溶液开始蒸馏时,体系得温度沿虚线上升,开始沸腾时成份为Y得气相生成、若气相量很少,x、y二点即代表互成平衡时液气二相成份。
继续蒸馏,气相量逐渐增多,沸点沿虚线继续上升,气液二相成份分别在气相与液相线上沿箭头指示方向变化。
当二相成份达到某一对数值x′与y′,维持二相得量不变,则体系气液二相又在此成份达到平衡,而二相得物质数量按杠杆原理分配。
本实验利用回流得方法保持气液二相相对量一定,则体系温度恒定。
待二相平衡后,取出二相得样品,用阿贝折光仪测定其折射率。
得出该温度下气液二相平衡成份得坐标点,改变体系得总成份,再用上法找出一对坐标点,这样测得若干坐标点后,分别按气相点与液相点连成气相线与液相线,即得T—X平衡图。
三、步骤1、安装接通仪器,打开冷凝水;2、加入环己烷20ml,蒸馏至沸腾,待小兜有液体后回流三次,温度平衡2—3分钟基本不变,记下温度,关闭调压器;3、A组加入乙醇0。
5ml,用上法测定温度,然后关闭调压器,取出气相,液相得样品,测其折射率,以后分别加入1。
0,2.0,4、0,8.0,12、0ml乙醇;4、B组加入20ml无水乙醇,蒸馏至沸腾,待小兜有液体后回流三次,温度平衡2-3分钟基本不变,记下温度,关闭调压器;5、加环己烷0。
二元液系相图的绘制

大学化学实验II实验报告——物理化学实验学院:化工学院专业:班级:姓名实验日期实验时间学号指导教师同组人实验项目名称二元液系相图的绘制实验目的1.掌握阿贝折射仪的使用方法。
1、学习常压下完全互溶双液系气-液平衡相图的绘制。
实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组分间溶解度的不同,可分为完全互溶、部分互溶和完全不互溶三种情况。
两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,则混合物的组成与平衡时气相的组成不同。
当压力保持一定,混合物沸点与两组分的相对含量有关。
恒定压力下,真实的完全互溶双液系的气-液平衡相图(T-x),根据体系对拉乌尔定律的偏差情况,可分为3类:(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图(a)所示。
(2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图(b)所示。
(3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体的蒸汽压都大,混合物存在着最低沸点如图(c))所示。
二组分真实液态混合物气—液平衡相图(T-x图)后两种情况为具有恒沸点的双液系相图。
它们在最低或最高恒沸点时的气相和液相组成相同,因而不能象第一类那样通过反复蒸馏的方法而使双液系的两个组分相互分离,而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。
为了测定双液系的T-x相图,需在气-液平衡后,同时测定双液系的沸点和液相、气相的平衡组成。
本实验以环己烷-乙醇为体系,该体系属于上述第三种类型,在沸点仪中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T-x相图。
tAtAtAtB tBtBt/oCt/oCt/oCxBxBxBA B A AB B(a)(b)(c)x'x'本实验中两相的成分分析均采用折光率法测定:折光率是物质的一个特征数值,它与物质的浓度及温度有关,因此在测量物质的折光率时要求温度恒定。
二元液系相图 实验报告

二元液系相图一、实验目的1、用沸点仪测定在常压下环己烷-乙醇的气液平衡相图。
2、了解沸点的测定方法。
3、掌握阿贝折射仪的测量原理及使用方法。
二、实验原理1、液体的沸点是指液体的饱和蒸汽压和外压相等时的温度。
在一定外压下,纯液体的沸点有确定的值。
但对于完全互溶的双液系,沸点不仅与外压有关,而且还与双液系的组成有关。
2、用阿贝折射仪测定气液组成的折光率,来获得气液组成。
三、实验装置四、仪器及试剂仪器:EF-03沸点测量仪、阿贝折射仪、沸点仪、取样管试剂:无水乙醇、环己烷五、实验步骤1、安装好干燥的沸点仪。
2、加入纯乙醇30ml左右,盖好瓶塞,使电热丝浸入液体中,温度传感器与液面接触。
3、开冷凝水,将稳流电源调至(1.8-2.0A),接通电热丝,加热至沸腾,待数字温度计上读数恒定后,读下该温度值。
4、关闭电源,停止加热,将干燥的取样管自冷凝管上端插入冷凝液收集小槽中,取气相冷凝液样,迅速用阿贝折射仪测其折光率。
5、用干燥的小滴管取液相液样,用阿贝折射仪测其折光率。
6、分别在沸点仪中加入混合液,1、2、3、4、5、6重复上述操作。
7、根据环己烷-乙醇标准溶液的折射率,将上述数据转换成环己烷的摩尔分数,绘制相图。
8、实验完毕后,关闭冷凝水,关闭电源,整理实验台。
六、阿贝折光仪的使用1、用擦镜纸将镜面擦干,取样管垂直向下将样品滴加在镜面上,注意不要有气泡,然后将上棱镜合上,关上旋钮。
2、打开遮光板,合上反射镜。
3、轻轻旋转目镜,使视野最清晰。
4、旋转刻度调节手轮(下手轮),使目镜中出现明暗面(中间有色散面),图a。
5、旋转色散调节手轮(上手轮),使目镜中色散面消失,出现半明半暗面,图b,c。
6、再旋转刻度调节手轮(下手轮),使分界线处在十字相交点,图d。
7. 在下标尺上读取样品的折光率。
阿贝折光仪的校正(1)仪器校正。
在开始测定前,用纯水校正阿贝折光仪。
将超级恒温槽的温度调至25℃,将阿贝折光仪的数据调至1.3325,然后观察明暗分界线是否在十字线中间,若有偏差,则用螺丝刀微量旋转小孔内的螺钉,使分界线位移至十字线中间。
物化实验报告_双液系的气液平衡相图辩析

双液系的气液平衡相图1.1实验目的1.用沸点仪测定在常压下环已烷—乙醇的气液平衡相图。
2.掌握阿贝折射仪的使用方法。
1.2 实验原理将两种挥发性液体混合,若该二组分的蒸气压不同,则溶液的组成与其平衡气相的组成不同。
在压力保持一定,二组分系统气液达到平衡时,表示液态混合物的沸点与平衡时组成关系的相图,称为沸点和组成(T-x)图。
沸点和组成(T-x)的关系有下列三种:(1)理想液体混合物或接近理想液体混合物的双液系,其液体混合物的沸点介于两纯物质沸点之间见图1(a);(2)各组分蒸气压对拉乌尔定律产生很大的负偏差,其溶液有最高恒沸点见图1(b);(3)各组分蒸气压对拉乌尔定律产生很大的正偏差,其溶液有最低恒沸点见图1(c)。
第(2)、(3)两类溶液在最高或最低恒沸点时的气液两相组成相同,加热蒸发的结果只使气相总量增加,气液相组成及溶液沸点保持不变,这时的温度称恒沸点,相应的组成称恒沸组成。
第一类混合物可用一般精馏法分离出这两种纯物质,第(2)、(3)类混合物用一般精馏方法只能分离出一种纯物质和另一种恒沸混合物。
图1 沸点组成图为了测定二元液系的T-x图,需在气液达到平衡后,同时测定溶液的沸点、气相和液相组成。
本实验是测定具有最低恒沸点的环己烷—乙醇双液系的T-x图。
方法是用沸点仪(图2)直接测定一系列不同组成之溶液的气液平衡温度(即沸点),并收集少量馏出液(即气相冷凝液)及吸取少量溶液(即液相),分别用阿贝折射仅测定其折射率。
为了求出相应的组成,必须先测定已知组成的溶液的折射率,作出折射率对组成的工作曲线,在此曲线上即可查得对应于样品折射率的组成。
沸点仪的种类很多,图2所示是一种带有电阻丝加热的沸点仪。
沸腾的溶液由喷嘴喷向温度计,因此可以测得蒸气与液相平衡的温度。
气相经冷凝后贮存在小泡内。
图2 沸点仪1 水冷却入口,2 气相冷凝液贮存小泡,3 温度计,4 喷嘴,5 电炉丝,6 调压器2 实验操作2.1 实验药品、仪器型号及测试装置示意图1.仪器沸点仪、调压器、阿贝折射仪(编号00011887)SL-1超级恒温槽、1/10℃温度计、酒精温度计、滴管、放大镜。
二元液相系图

物理化学实验报告实验名称:完全互溶双液系统气液平衡相图的绘制专业班级:生物工程112班学生姓名:钟坤学号:1108110391实验时间:2103年5月14日8:00~10:00指导老师:刘定富老师一.实验目的1.测定常压下环己烷-乙醇二元系统的气液平衡数据,绘制沸点- 组成相图。
2.掌握双组分沸点的测定方法,通过实验进一步理解分馏原理。
3.掌握阿贝折射仪的使用方法。
二.实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组分间溶解度的不同,可分为完全互溶、部分互溶和完全不互溶三种情况。
两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,则混合物的组成与平衡时气相的组成不同。
当压力保持一定,混合物沸点与两组分的相对含量有关。
恒定压力下,真实的完全互溶双液系的气-液平衡相图(T -x ),根据体系对拉乌尔定律的偏差情况,可分为3类:(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图2.7(a)所示。
(2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图2.7(b)所示。
(3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体的蒸汽压t A t A tAtB t B t Bt / o C t / o C t / o C x B x Bx B A B A A B B(a)(b)(c)x 'x '都大,混合物存在着最低沸点如图2.7(c))所示。
图2.7 二组分真实液态混合物气—液平衡相图(T-x图)后两种情况为具有恒沸点的双液系相图。
它们在最低或最高恒沸点时的气相和液相组成相同,因而不能象第一类那样通过反复蒸馏的方法而使双液系的两个组分相互分离,而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。
为了测定双液系的T-x相图,需在气-液平衡后,同时测定双液系的沸点和液相、气相的平衡组成。
本实验以环己烷-乙醇为体系,该体系属于上述第三种类型,在沸点仪(如图2.8)中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T-x相图。
二元气液平衡简易操作说明

二元气液平衡简易操作说明配制不同浓度的二元体系,待气液达到平衡后,测定溶液的沸点,测定气、液相的温度和组成,绘制二元液系的T-x-y图,求出恒沸点及相应的恒沸混合物的组成。
气相组成测定方法:收集少量气相冷凝液,用阿贝折射仪测定其折射率;利用气相色谱测定。
不同浓度二元体系配制方法:可以通过向加热釜内添加原料的方法,改变釜内料液组成。
注意:设计数据表格,数据以表格形式填写。
背景知识:(一)温度-组成(T-x-y)相图苯-甲苯混合液的t-x-y相图(1)曲线两端点分别代表纯组份的沸点,左端点代表纯轻组份沸点,右端点代表纯重组份沸点。
(2)上方曲线代表饱和蒸汽线,也称为露点线,该线上方的区域代表过热蒸汽区;下方曲线代表饱和液体线,也称为泡点线,该线下方的区域代表过冷液体区。
(3)两条曲线之间的区域为气液共存区,平衡关系用两曲线间的水平线段表示,显然,只有在气液共存区,才能起到一定的分离作用。
(4)混合液的沸点不是一个定值,而是随组成不断变化。
在同样组成下,泡点(开始产生第一个气泡时对应的温度)与露点(即开始产生第一滴液滴时对应的温度)并不相等。
(二)x-y相图可由t-x-y相图中读出若干个平衡数据点而作出。
苯—甲苯混合液的x-y相图(1)图中曲线上任意点D 表示组成为x 1的液相与组成为y 1的气相互成平衡,且表示点D 有一确定的状态,该曲线称为平衡曲线。
(2)图中对角线为x=y 的直线,作查图时参考用。
(3)当y>x 时,平衡线位于对角线上方,平衡线离对角线越远,表示该溶液越容易分离。
(4)在总压变化不大时,外压对平衡线的影响可忽略,但t-x-y 图随压力变化较大。
(三)非理想溶液常压下乙醇-水系统相图溶液的非理想性来源于异分子间的作用力与同分子间的作用力不等,即BB AA AB f f f ≠≠。
表现在其平衡蒸汽压偏离拉乌尔定律,偏差可正可负,其中尤以正偏差居多。
(1)正偏差系统若 AB f <BB f 、AA f ,排斥力占主要地位,分子较易离开液面而进入气相,所以泡点较理想溶液低,混合时,体积变化ΔV>0,容易出现恒沸点、部分互溶、完全不溶等现象。
第4章 汽液相平衡

(6)
假设:忽略液体比容,并把气相当作理想气 体,并把 hlv当作常数,在这种条件下得到:
hlv hlv 1 B ln p s C C A RT R T T
(7)
这个方程称为克拉贝龙方程。
中南大学能源科学与工程学院
如果知道物质温度为 T1时的饱和蒸气压 p1s 、蒸 发潜热 hlv ,要计算相应 T2 时的饱和蒸气压 p 2 s ,则 可以用下式近似计算: p2 s hlv 1 1 ln (8) p1s R T2 T1 对于实际气体,在压力比较高时,可采用基于对比 态原理得出的通用蒸气压方程。李 -凯斯勒运用匹察提 出的三参数对比态关系,使蒸气压方程用下列关系表示:
i i i i i
y 若iv 不变化,再判断是否等于 1。若 ,则说 p yi 1 的初值不对,重新调整 明假定的 ,在返回到第 p 二步;若 ,则将结果打印出来。这样求出的 yi 1 p yi 和 即为泡点压力和气相成分。
i
中南大学能源科学与工程学院
开始
结束
x i 及各组 输入 T 、 分的物性参数, 给 p 及yi 赋初值
T s v s l h v hl hlv
则得
dp hlv dT T v v v l
(5a)
中南大学能源科学与工程学院
二 气液相变的蒸气压方程
将实际气体状态方程 v ZRT / p代入式(5a),得
dps hlv dT RT 2 v Z Zl ps
d ln p s hlv 或 dT RT 2 Z v Z l
1 2 n p p p 力平衡条件:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验二二元液系气液平衡相图
一、实验目的
1、了解环己烷—乙醇系的沸点—组成图
2、由图上得出其最低恒沸温度及最低恒沸组成(含乙醇%)
3、学会使用数字阿贝折射仪
4、学会使用WTS—05数字交流调压器
二、原理
一个完全互溶双液体系的沸点—组成图,表明在气液二相平衡时沸点和二相成分间的关系,它对了解这一体系对行为及分馏过程都有很大的实用价值。
在恒压下完全互溶双液系的沸点与组分关系有下列三种情况:1、溶液沸点介于二纯组分之间;2、溶液有最高恒沸点;3、溶液有最低恒沸点。
图1表示有最低恒沸点,本次实验图形也像如此的样子,A′LB′代表液相线的交点表示在该温度时互成平衡的二相的成份。
绘制沸点—成份图的简单原理如下:当总成份为X的溶液开始蒸馏时,体系的温度沿虚线上升,开始沸腾时成份为Y的气相生成。
若气相量很少,x、y二点即代表互成平衡时液气二相成份。
继续蒸馏,气相量逐渐增多,沸点沿虚线继续上升,气液二相成份分别在气相和液相线上沿箭头指示方向变化。
当二相成份达到某一对数值x′和y′,维持二相的量不变,则体系气液二相又在此成份达到平衡,而二相的物质数量按杠杆原理分配。
本实验利用回流的方法保持气液二相相对量一定,则体系温度恒定。
待二相平衡后,取出二相的样品,用阿贝折光仪测定其折射率。
得出该温度下气液二相平衡成份的坐标点,改变体系的总成份,再用上法找出一对坐标点,这样测得若干坐标点后,分别按气相点和液相点连成气相线和液相线,即得T—X平衡图。
三、步骤
1、安装接通仪器,打开冷凝水;
2、加入环己烷20ml,蒸馏至沸腾,待小兜有液体后回流三次,温度平衡2—3分钟基本不变,记下温度,关闭调压器;
3、A组加入乙醇0.5ml,用上法测定温度,然后关闭调压器,取出气相,液相的样品,测其折射率,以后分别加入1.0,2.0,4.0,8.0,12.0ml乙醇;
4、B组加入20ml无水乙醇,蒸馏至沸腾,待小兜有液体后回流三次,温度平衡2—3分钟基本不变,记下温度,关闭调压器;
5、加环己烷0.2ml用上法测定温度,然后关闭调压器,取出气相,液相样品,测其折射率,以后分别加入0.2,0.3,0.5,1.0,2.0ml环己烷;
6、将所得的折射率在相应的工作曲线上找到组成;
7、关闭电源,冷凝水,整理好仪器,倒掉废液;
8、签字,还工作曲线表。
四、数据处理
1、将测得的数据列成表格;
2、在标准计算纸上作沸点—组成图;
3、由图上标出最低恒沸温度和最低恒沸组成。
五、注意事项
1、平衡温度一定是稳定2—3分钟后的数字温度计上的读数;
2、来回振荡3次,并且充分均匀;
3、传感器不可靠在电热丝上;
4、传感器保持一段在液面下面,以免影响平衡温度;
5、调压器上的电源打在10V左右;
6、折光率要看正确,即一半白一半黑,黑白交叉正好在十字中心;
7、测定折光率时不可将取样管碰撞棱镜;
8、被测液放入后应立即关闭棱镜,以免挥发;
9、液体须充满整个棱镜,不可有气泡产生;
10、沸腾不能太过分厉害,以免冷凝不及;
11、塞子要塞紧,沸腾时不可打开侧盖上的管子,更不可一边沸腾,一边进行取样;
12、取样管用过一次以后希望不再用第二次;
13、测过折射率后应将棱镜打开晾干,以便下次再用,如不干则用吸球吹吹;
14、严禁用手擦棱镜及光学零件;
15、折光仪上严禁测定有腐蚀性的液体;
16、 折光仪不能曝晒强日光中;
17、 液体没有淹没电热丝时,切勿通电,否则电热丝要烧断;
18、 查工作曲线是时候要注意20D n ,就是说D n 表示折射率,上面的20或25,30表示
的是温度,因此做的是哪个温度,切勿乱用或混用,以免造成误差;
19、 作图时希望同学们注意使用的小方格坐标纸至少取10×10cm ;
20、 确定恒沸温度和恒沸组成应由图上找得,并纪录在数据处理栏中。
六、 思考题
1、 本实验气液二相是怎样达成平衡的?
2、 在室温下测折射率存在什么问题?
3、 小槽体积小对测量有何影响?
4、 本实验加入量多用量筒量取,那么这体积是否要求加入量很准确?
5、 要求沸腾时不能打开塞子或打开侧管取样,这是为了什么?如果这样做又将会怎
样?
6、 为什么要来回振荡几次?
7、 温度计为什么要不靠电热丝?
8、 要求沸腾不宜过快这是为了什么?
9、 如何判断气液二相是否处于平衡?
10、 如何保证测定折射率时液体保持平衡时的组成?
11、 本实验主要误差来自何处?
七、 指导教师要注意的易发生的问题
1、 此实验据我们实验结果看共是十二点,加上二点唇溶液的点,共十四个,实验时间如果不重做,3.5个小时可以完成,如果中途遇到曲折可能来不及;
2、 从现象看比以前的要易做些,但学生的数据仍有可能会发生倒个现象,特别是环己烷中加乙醇的前2个点。
如发生倒个现象可以请学生再蒸馏一下,特别是到达平衡点附近时要注意学生数据;
3、 实验中要常查学生数据,发现问题及早解决;
4、 现使用蒸馏仪比较好,漏气现象并不严重,因此一般不会发生一会儿温度就上升的现象,如发现有要及早帮助学生查找原因。
八、 结论
1、经过实验总结,认为方案比乙酸乙脂—乙醇体系要好些,主要是气液拉开,特别是上下点相反的图几乎是很少发生了,作图较以前好看些,偏离的点也少些了;
2、同以前一样,恒温的温度越低越好,挥发的慢,因此建议能避免避开30,35℃;
3、本实验蒸馏气到达冷凝前,常会有一些沸点较高的组分已经冷凝,因而所测气相成份可能并不代表真正的气相成份,为减少由此引入的误差,支管位置不宜太高,沸腾液体之液面与分支管上袋装部分间距离不应太远;
4、本实验系环己烷—乙醇系的沸点—组成图,数据基本上为南大书上查得:
最低恒沸物组成:68.5%(环己烷)
最低恒沸温度:64.8℃。
