pH标准缓冲溶液及常用pH缓冲溶液的配制
常用缓冲溶液的配制及PH计校正溶液配置方法

常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液24Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L )6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1mol/L 溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L )Na 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液242Na 2HPO 4·12H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L )242KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )9.巴比妥钠-盐酸缓冲液(18℃)10.Tris–盐酸缓冲液(0.05M ,25℃)50毫升0.1M 三羟甲基氨基甲烷(Tris )溶液与X 毫升0.1N 盐酸混匀后,加水稀释至100三羟甲基氨基甲烷(Tris )HOCH2 CH2OH CHOCH2 NH2分子量=121.14;0. 1M 溶液为12.114克/升。
PH计校准及缓冲液配置

标准缓冲溶液(均用pH标准缓冲物质配制)1.1 苯二甲酸氢钾标准缓冲溶液:c(KHC8H4O4)=0.05 mol/L(25℃时,pH=4.003)。
苯二甲酸氢钾的pH标准缓冲物质,有小塑料袋和瓶装两种,配制方法如下:a)袋装配制法:在250 mL(或500 mL)量瓶中(根据袋中标准缓冲物质量,选择量瓶大小),按袋上的说明配制成所需的浓度。
保存于聚乙烯瓶中。
b)瓶装配制法:称取5.10 g苯二甲酸氢钾(KHC8H4O4预先在115℃±5℃,烘2~3 h,于干燥器中冷却),溶于水并稀释至500 mL,混匀。
保存于聚乙烯瓶中。
1.2 0.025 mol/L磷酸二氢钾(KH2PO4)和0.025 mol/L磷酸氢二钠(Na2HPO4)混合标准缓冲溶液(25℃时,pH=6.864):磷酸二氢钾和磷酸氢二钠的pH标准缓冲物质,有小塑料袋装(混合磷酸盐)和瓶装(两种pH 标准缓冲物质分别包装)两种。
配制方法如下:a)袋装配制法:在量瓶(根据袋上说明确定量瓶大小)中按袋上说明配制成所需浓度后,保存于聚乙烯瓶中。
b)瓶装配制法:迅速称取3.40 g磷酸二氢钾(KH2PO4)和3.55 g磷酸氢二钠(Na2HPO4)(均预先在115±5℃烘2~3 h,于干燥器中冷却)溶于蒸馏水,转入1 000 mL量瓶中,加水至标线,混匀。
1.3 0.008 695 mol/L磷酸二氢钾(KH2PO4)和0.030 43 mol/L磷酸氢二钠(Na2HPO4)标准混合缓冲溶液(25℃时,pH=7.413):磷酸二氢钾和磷酸氢二钠两种pH标准缓冲物质分别用瓶包装,配制方法如下:迅速称取1.18 g磷酸二氢钾和4.31 g磷酸氢二钠(均预先在115℃±5℃烘2~3 h,于干燥器中冷却),溶于水,全量移入1 000 mL量瓶中,加水至标线,混匀。
保存于聚乙烯瓶中。
1.4 硼砂标准缓中溶液:c(Na2B4O7·10H2O)=0.010 mol/L(25℃时,pHs=9.182)。
常用的45种缓冲溶液的配制

1.乙醇-醋酸铵缓冲液(pH3.7)取5mol/L醋酸溶液15.0ml,加乙醇60ml和水20ml,用10mol/L氢氧化铵溶液调节pH值至3.7,用水稀释至1000ml,即得。
2.三羟甲基氨基甲烷缓冲液(pH8.0)取三羟甲基氨基甲烷12.14g,加水800ml,搅拌溶解,并稀释至1000ml,用6mol/L盐酸溶液调节pH值至8.0,即得。
3.三羟甲基氨基甲烷缓冲液(pH8.1)取氯化钙0.294g,加0.2mol/L三羟甲基氨基甲烷溶液40ml使溶解,用1mol/L盐酸溶液调节pH值至8.1,加水稀释至100ml,即得。
4.三羟甲基氨基甲烷缓冲液(pH9.0)取三羟甲基氨基甲烷6.06g,加盐酸赖氨酸3.65g、氯化钠5.8g、乙二胺四醋酸二钠0.37g,再加水溶解使成1000ml,调节pH值至9.0,即得。
5.乌洛托品缓冲液取乌洛托品75g,加水溶解后,加浓氨溶液4.2ml,再用水稀释至250ml,即得。
6.巴比妥缓冲液(pH7.4)取巴比妥钠4.42g,加水使溶解并稀释至400ml,用2mol/L盐酸溶液调节pH值至7.4,滤过,即得。
7.巴比妥缓冲液(pH8.6)取巴比妥5.52g与巴比妥钠30.9g,加水使溶解成2000ml,即得。
8.巴比妥-氯化钠缓冲液(pH7.8)取巴比妥钠5.05g,加氯化钠3.7g及水适量使溶解,另取明胶0.5g加水适量,加热溶解后并入上述溶液中。
然后用0.2mol/L盐酸溶液调节pH值至7.8,再用水稀释至500ml,即得。
9.甲酸钠缓冲液(pH3.3)取2mol/L甲酸溶液25ml,加酚酞指示液1滴,用2mol/L氢氧化钠溶液中和,再加入2mol/L甲酸溶液75ml,用水稀释至200ml,调节pH值至3.25~3.30,即得。
10.邻苯二甲酸盐缓冲液(pH5.6)取邻苯二甲酸氢钾10g,加水900ml,搅拌使溶解,用氢氧化钠试液(必要时用稀盐酸)调节pH值至5.6,加水稀释至1000ml,混匀,即得。
PH标准缓冲液配置

标准缓冲溶液(均用pH标准缓冲物质配制)1.1 苯二甲酸氢钾标准缓冲溶液:c(KHC8H4O4)=0.05 mol/L(25℃时,pHs=4.003)。
苯二甲酸氢钾的pH标准缓冲物质,有小塑料袋和瓶装两种,配制方法如下:a)袋装配制法:在250 mL(或500 mL)量瓶中(根据袋中标准缓冲物质量,选择量瓶大小),按袋上的说明配制成所需的浓度。
保存于聚乙烯瓶中。
b)瓶装配制法:称取5.10 g苯二甲酸氢钾(KHC8H4O4预先在115℃±5℃,烘2~3 h,于干燥器中冷却),溶于水并稀释至500 mL,混匀。
保存于聚乙烯瓶中。
1.2 0.025 mol/L磷酸二氢钾(KH2PO4)和0.025 mol/L磷酸氢二钠(Na2HPO4)混合标准缓冲溶液(25℃时,pHs=6.864):磷酸二氢钾和磷酸氢二钠的pH标准缓冲物质,有小塑料袋装(混合磷酸盐)和瓶装(两种pH标准缓冲物质分别包装)两种。
配制方法如下:a)袋装配制法:在量瓶(根据袋上说明确定量瓶大小)中按袋上说明配制成所需浓度后,保存于聚乙烯瓶中。
b)瓶装配制法:迅速称取3.40 g磷酸二氢钾(KH2PO4)和3.55 g磷酸氢二钠(Na2HPO4)(均预先在115±5℃烘2~3 h,于干燥器中冷却)溶于蒸馏水,转入1 000 mL量瓶中,加水至标线,混匀。
1.3 0.008 695 mol/L磷酸二氢钾(KH2PO4)和0.030 43 mol/L磷酸氢二钠(Na2HPO4)标准混合缓冲溶液(25℃时,pH=7.413):磷酸二氢钾和磷酸氢二钠两种pH标准缓冲物质分别用瓶包装,配制方法如下:迅速称取1.18 g磷酸二氢钾和4.31 g磷酸氢二钠(均预先在115℃±5℃烘2~3 h,于干燥器中冷却),溶于水,全量移入1 000 mL量瓶中,加水至标线,混匀。
保存于聚乙烯瓶中。
1.4 硼砂标准缓中溶液:c(Na2B4O7·10H2O)=0.010 mol/L(25℃时,pHs=9.182)。
ph缓冲溶液的配制方法

ph缓冲溶液的配制方法PH缓冲溶液是指在一定范围内,具有缓冲pH值的溶液,适用于化学、生物、医药等各个领域的实验和应用。
在实验中,通常需要制备一定浓度和pH值的缓冲溶液,以保证实验结果的准确性和可重复性。
本文将介绍几种常见的缓冲溶液配制方法。
一、磷酸缓冲液(PBS)磷酸缓冲液是一种常用的生物化学实验缓冲液,可以用于细胞培养、酶活性测定、免疫学实验等等。
其配制方法如下:1. 准备250ml坐标瓶,称取1.37g Na2HPO4·12H2O和0.26g KH2PO4。
3. 将两个溶液混合,加入NaCl使溶液最终重量达到250g,调节pH值至7.4-7.6,如果pH值过低,可加入1M NaOH调节,反之加入1M HCl。
二、三氯醋酸缓冲液(TCA)三氯醋酸缓冲液是一种酸性缓冲液,适用于蛋白质的沉淀和提取等实验。
其配制方法如下:1. 准备250ml坐标瓶,在其中加入11.9g三氯乙酸,加入去离子水至250ml。
2. 调节溶液pH值至2.0-2.5,可使用无水HCl或NaOH来调节pH值。
3. 再加入去离子水,使溶液最终体积达到500ml,并根据需要添加NaCl和KCl等。
五、TRIS缓冲液TRIS缓冲液是一种常用的生化和细胞学实验用缓冲液,其缓冲范围在7.0~9.2之间。
其配制方法如下:1. 准备500ml坐标瓶,称取12.11g Tris-Base。
3. 在室温下缓慢加入0.1M HCl溶液,同时使用pH计监测溶液pH值,当pH值达到所需值时停止加入。
4. 将溶液体积补至500ml,并调节pH值。
可根据实验需要调节缓冲液中的NaCl或其他化学物质的浓度。
以上就是几种常见缓冲溶液的配制方法,需要注意的是在配制过程中,一定要严格按照实验要求和操作规程进行,以获得准确的实验结果。
同时,制备的缓冲液要遵循使用前检测pH值、滤过消毒等规定操作,以保证实验的可重复性和安全性。
常用pH缓冲液缓冲液缓冲范围
资料常用pH缓冲溶液的配制和pH值•常用pH缓冲溶液的配制和pH值一、常用溶液的配制一溶液配制注意事项1.药品要有较好的质量试剂分为优级纯保证试剂,Guaranteed reagent,G.R.、分析试剂Antalytical reagent,A.R.化学纯Chemical pure,C.P.和实验试剂Laboratory reagent,L.R.等等;工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等;2.药品称量要精确;3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH 在~之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水;4.配好后的溶液,应立即除菌处理如高压灭菌、抽滤或加抑菌物质,以防杂菌生长;二1/15Mol/L磷酸缓冲液1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾KH2PO4,A.R.,用蒸馏水溶解后,倾入1 000ml容量瓶内,再稀释至刻度1 000ml;2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠Na2HPO4,.或者Na2HPO4·2H2O 用蒸馏水溶解后,放入1 000ml容量瓶内,再加蒸馏水稀释至刻度1 000ml;3.按附表的比例,配制成不同pH值的缓冲溶液;•三L PB液Na2HPO4·2H2O分子量= L溶液含L; Na2HPO4·12H2O分子量= L溶液含L; NaH2PO4·H2O分子量= L溶液含L; NaH2PO4·2H2O分子量= L溶液含L;四L PB缓冲液L Na2HPO4·2 H2O溶液LNa2HPO4·12 H2O溶液含LLNaH2PO4·H2O溶液含LNaH2PO4·2 H2O溶液含L欲配L PB缓冲液则在L PB缓冲液的基础上加H2O稀释1倍即可;欲配制PBS液时,则在溶液中加%的NaCl溶液即可;五无钙镁离子磷酸缓冲盐水PBSL PHNaClKClNa2HPO4如为Na2HPO4·12H2O,则为KH2PO4将上述试剂依次溶于1 000ml去离子水中,完全溶解后,115℃高压灭菌10min~15min,存在4℃冰箱中备用;此液可用于配制和稀释细胞分散剂以及洗涤细胞培养物;六硼酸盐缓冲液Borate saline buffer1.硼酸H3BO3L硼酸:硼酸加水至1 000ml;2.硼砂Na2B4O7L硼砂:硼砂加水至1 000ml;七巴比妥缓冲液1.离子强度L巴比妥缓冲液巴比妥钠蒸馏水 3 000mlHClN HCl=193ml浓HCl加1 807ml蒸馏水⑴ 将巴比妥钠溶于3 000ml蒸馏水;⑵ 加 N HCl 55ml;⑶ 用HCl调节pH到,并加蒸馏水至4 265ml;2. L巴比妥缓冲液巴比妥巴比妥钠加蒸馏水至 13. L巴比妥缓冲液巴比妥巴比妥钠加蒸馏水 1八L醋酸盐缓冲液见表附表5九三羟甲基甲烷—盐酸缓冲液Tris—HCl缓冲液不同pH,LL三羟甲基氨基甲烷加х,加水稀释至100ml见下表三羟甲基氨基甲烷Tris分子量=L三羟甲基氨基甲烷:,加水至1 000ml;:取,加水至1 000ml;•十L 碳酸盐缓冲液NaHCO3Na2CO3溶于蒸馏水中即得;不用时塞紧瓶塞,以免吸收空气中二氧化碳使PH下降;最好小量配制;十一甘油磷酸缓冲液1.配制磷酸缓冲液L Na2HPO4NaH2PO4混合即可2.9份甘油与1份磷酸缓冲液混合,即为甘油磷酸缓冲液;用途:用于免疫荧光试验;十二Hank’s液1.贮存液NaClKClNa2HPO4·12 H2OKH2PO4葡萄糖%酚红液双馏水加至115℃高压灭菌15min,冰冻保存;2.工作液贮存液 1份双馏水 9份115℃高压灭菌15min;临用时用灭菌的%NaHCO3液调pH值至左右溶液呈橙红色;十三萘钠氏试剂Nessler’s reagent配方1:氯化汞碘化钾20%NaOH 30ml加蒸馏水至 100ml配方2:碘化汞碘化钾 8g蒸馏水 50ml完全溶解后过滤,加20%NaOH 50ml;用途:检测溶液中氨离子;十四阿氏Alsever’s液葡萄糖柠檬酸钠氯化钠蒸馏水 100ml溶解后,以10%柠檬酸调节pH至,过滤,分装,10磅10min灭菌,4℃保存;十五青、链霉素混合液简称S.P.液或双抗液青霉素40万U 5支链霉素200万μg 1支分别溶于100ml灭菌无离子水中或共同溶于200ml灭菌无离子水中,混合后分装小瓶,置-10℃~-20℃冰箱保存备用1万单位μg/ml;临用时,按1%的量加入营养液或其他溶液中,最后浓度是青霉素100U/ml,链霉素100ug/ml;十六洗液清洁液配方1:重铬酸钾 150g蒸馏水 300ml浓硫酸 3 000ml将重铬酸钾加入蒸馏水中,使之自然溶解或水浴溶解,亦可在大坩埚中加热溶解,然后慢慢加入浓硫酸,边加边搅拌,见发热过剧则稍停,冷却后再继续加;此为强洗液;盛清洁液的容器要坚固,上加厚玻璃盖,操作时要穿橡皮围裙、长统胶靴、戴上眼镜和厚胶皮手套,以保安全;洗液一旦变绿,表示铬酸已经还原,失去了氧化能力,不宜再用;如将这样洗液加热,再加适量重铬酸钾,又可重新使用;配方2:浓硫酸 50%蒸馏水 50%重铬酸钾 5%此为中等强度洗液;配方3:重铬酸钾 100g蒸馏水 1 000ml加热溶解,冷却后缓慢加入工业硫酸 100ml此液为弱洗液,为棕红色;使用此液时,必须预先用热肥皂水将玻璃器皿洗净,经自来水冲洗,沥干然后才能浸入,否则该洗液很快失效;缓冲液名称及常用浓度缓冲pH范围主要物质分子量MES 2吗啉代乙磺酸Bis-TrisHEPESPIPESMOPSTricineTEA 三乙醇胺甘氨酸-盐酸缓冲液L 甘氨酸Mr=邻苯二甲酸-盐酸缓冲液L 邻苯二甲酸氢钾Mr=磷酸氢二钠-柠檬酸缓冲液磷酸氢二钠Mr=柠檬酸-氢氧化钠-盐酸缓冲液柠檬酸Mr=柠檬酸-柠檬酸钠缓冲液L 柠檬酸Mr= 柠檬酸钠Mr= 乙酸-乙酸钠缓冲液L 乙酸钠Mr= 乙酸Mr=邻苯二甲酸氢钾-氢氧化钠缓冲液邻苯二甲酸氢钾Mr= 磷酸氢二钠-磷酸二氢钠缓冲液L磷酸氢二钠-磷酸二氢钾缓冲液1/15 molL磷酸二氢钾-氢氧化钠缓冲液L巴比妥钠-盐酸缓冲液18℃巴比妥钠Mr=Tris-盐酸缓冲液L 25℃三羟甲基氨基甲烷TrisMr=甘氨酸-氢氧化钠缓冲液L 甘氨酸Mr=硼砂-氢氧化钠缓冲液L 硼砂Na2B4O710H2O Mr=碳酸钠-碳酸氢钠缓冲液L 碳酸钠Mr= 碳酸氢钠Mr= 碳酸钠-氢氧化钠缓冲液L磷酸氢二钠-氢氧化钠缓冲液氯化钾-盐酸缓冲液L 氯化钾Mr=氯化钾-氢氧化钠缓冲液L 氯化钾Mr=。
常用缓冲溶液的配制和PH计校正溶液配置方法
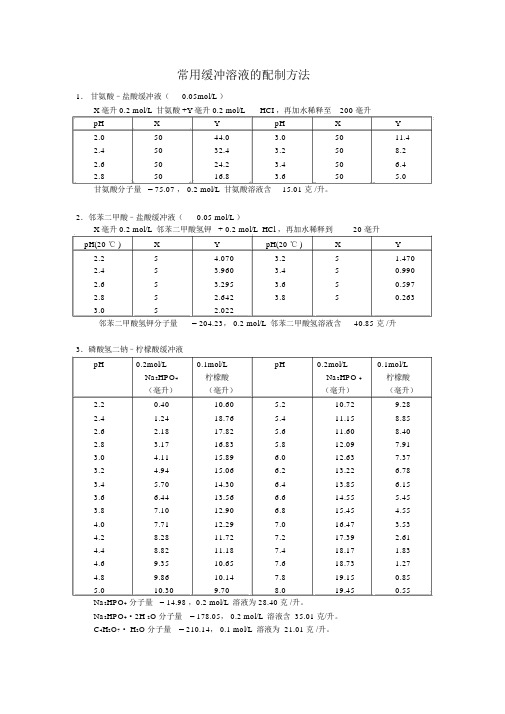
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L )X 毫升 0.2 mol/L 甘氨酸 +Y 毫升 0.2 mol/L HCI ,再加水稀释至200 毫升pH X Y pH X Y2.05044.03.05011.42.45032.43.2508.22.65024.23.450 6.42.85016.83.650 5.0甘氨酸分子量 = 75.07 , 0.2 mol/L 甘氨酸溶液含15.01 克 /升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L )X 毫升 0.2 mol/L 邻苯二甲酸氢钾 + 0.2 mol/L HCl ,再加水稀释到20 毫升pH(20 ℃ )X Y pH(20 ℃ )X Y2.25 4.0703.25 1.4702.453.960 3.450.9902.653.295 3.650.5972.85 2.6423.850.2633.05 2.022邻苯二甲酸氢钾分子量= 204.23, 0.2 mol/L 邻苯二甲酸氢溶液含40.85 克 /升3.磷酸氢二钠–柠檬酸缓冲液pH0.2mol/L0.1mol/L pH0.2mol/L0.1mol/L Na2HPO4柠檬酸Na2HPO 4柠檬酸(毫升)(毫升)(毫升)(毫升)2.20.4010.60 5.210.729.282.4 1.2418.76 5.411.158.852.6 2.1817.82 5.611.608.402.83.1716.83 5.812.097.913.04.1115.896.012.637.373.24.9415.066.213.22 6.783.4 5.7014.30 6.413.85 6.153.6 6.4413.56 6.614.555.453.87.1012.90 6.815.454.554.07.7112.297.016.47 3.534.28.2811.727.217.39 2.614.48.8211.187.418.17 1.834.69.3510.657.618.73 1.274.89.8610.147.819.150.855.010.309.708.019.450.55Na2HPO4分子量= 14.98 ,0.2 mol/L 溶液为 28.40 克 /升。
经常使用pH缓冲溶液的配制和pH值
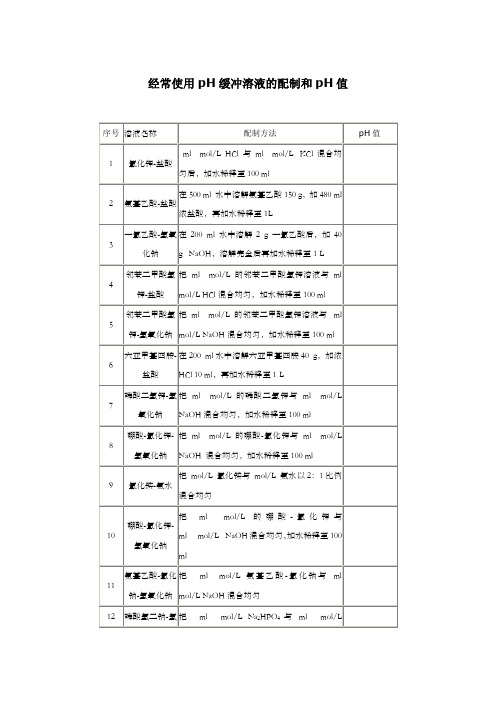
经常使用pH缓冲溶液的配制和pH值一、经常使用溶液的配制(一)溶液配制注意事项1.药品要有较好的质量 试剂分为优级纯(保证试剂,Guaranteed reagent ,G .R .)、分析试剂(Antalytical reagent ,A .R .)化学纯(Chemical pure ,C .P .)和实验试剂(Laboratory reagent ,L .R .)等等。
工业用的化学试剂,杂质较多,只在个别情形下应用,如配洗液用的硫酸、配干燥剂的氯化钙等。
2.药品称量要精准。
3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH 在~之间才可应用,在组织培育等特殊用途时应注意此项要求,配制一样化验用溶液只要求用双蒸馏水或去离子水。
4.配好后的溶液,应当即除菌处置(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。
(二)(1/15)Mol/L 磷酸缓冲液1.1/15Mol/L 磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH 2PO 4,A .R .),用蒸馏水溶解后,倾入1 000ml 容量瓶内,再稀释至刻度(1 000ml )。
2.1/15Mol/L 磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na 2HPO 4,.)(或Na 2HPO 4·2H 2O )用蒸馏水溶解后,放入1 000ml 容量瓶内,再加蒸馏水稀释至刻度(1 000ml )。
3.按附表的比例,配制成不同pH 值的缓冲溶液。
附表1 磷酸盐缓冲液配制法(单位:毫升)(三)L PB 液附表2 LPB 液配制法Na 2HPO 4·2H 2O 分子量= L 溶液含L 。
Na 2HPO 4·12H 2O 分子量= L 溶液含L 。
NaH 2PO 4·H 2O 分子量= L 溶液含L 。
NaH 2PO 4·2H 2O 分子量= L 溶液含L 。
(四)L PB 缓冲液附表3 L PB 缓冲液配制法L Na 2HPO 4·2 H 2O 溶液L Na 2HPO 4·12 H 2O 溶液含L LNaH 2PO 4·H 2O 溶液含L NaH 2PO 4·2 H 2O 溶液含L欲配L PB 缓冲液那么在L PB 缓冲液的基础上加H 2O 稀释1倍即可。
标准缓冲液的配制方法

13.硼砂-氢氧化钠缓冲液(0.05M 硼酸根)
o X 毫升 0.05M 硼砂+Y 毫升 0.2NNaOH 加水稀释至 200 毫升
-专 io pH
X
9.3
50
9.4
50
b 9.6
50
Y
pH
X
6.0
9.8
50
11.0
10.0
0.2V 盐酸 pH
pH(20℃) 7.0 7.2 7.4 7.6 7.8 8.0
X (毫升) 5 5 5 5 5 5
Y(毫升) 2.963 3.500 3.950 4.280 4.520 4.680
0.04M 巴比妥钠溶液(毫升)
0.2N 盐酸(毫升)
o 6.8
100
18.4
8.4 100
5.21
0.3 mol/L HAc(毫升)
9.25 8.80 8.20 7.35 6.30 5.10
0.2 mol/L
pH(18℃) NaAc(毫升)
4.8
5.90
5.0
7.00
5.2
7.90
5.4
8.60
5.6
9.10
5.8
9.40
Na2Ac·3H2O 分子量 = 136.09,0.2 mol/L 溶液为 27.22 克/升。
Na2HPO4 分子量 = 14.98,0.2 mol/L 溶液为 28.40 克/升。 Na2HPO4-2H2O 分子量 = 178.05,0.2 mol/L 溶液含 35.01 克/升。
Y 11.4 8.2 6.4 5.0
Y 1.470 0.990 0.597 0.263
0.1mol/L 柠檬酸 (毫升) 9.28 8.85 8.40 7.91 7.37 6.78 6.15 5.45 4.55 3.53 2.61 1.83 1.27 0.85 0.55
常用缓冲溶液的配制方法

常用缓冲溶液的配制方法缓冲溶液是一种能够稳定溶液酸碱度的溶液,是化学和生物学实验中必不可少的试剂。
它们能够在一定范围内抵抗外界酸碱变化,保持溶液的PH值稳定,从而确保实验结果的准确性和可重复性。
本文将介绍一些常用的缓冲溶液的配制方法。
一、醋酸酸钠缓冲溶液醋酸酸钠缓冲溶液适用于酸性条件下的实验。
它的PH值稳定在4.0左右,适用于生物学实验和某些化学分析。
配制方法:1.称取3.9克醋酸酸钠三水合物(CH3COONa·3H2O)并溶解在80毫升蒸馏水中。
2.加入相同质量的冰乙酸,溶解均匀。
3.用蒸馏水稀释至100毫升。
将溶液过滤或使用磁力搅拌器搅拌,使溶液变得均匀。
二、磷酸二氢钠/磷酸氢二钠缓冲溶液磷酸二氢钠/磷酸氢二钠缓冲溶液适用于酸性至中性条件下的实验。
它的PH值稳定在6.8-7.4范围内,适用于细胞培养和某些生物化学实验。
配制方法:1.称取磷酸二氢钠(NaH2PO4)7.5克并溶解在200毫升蒸馏水中。
2.用氢氧化钠(NaOH)溶液调节至PH值7.4。
3.将溶液稀释至250毫升。
使用磁力搅拌器搅拌溶液使其均匀。
三、碳酸氢钠/碳酸钠缓冲溶液碳酸氢钠/碳酸钠缓冲溶液适用于中性至碱性条件下的实验。
它的PH值稳定在9.6-11.0范围内,适用于某些酶反应和某些化学分析。
配制方法:1.称取2.54克碳酸氢钠(NaHCO3)和2.93克碳酸钠(Na2CO3)并溶解在200毫升蒸馏水中。
2.使用酚红指示剂滴定硫酸(H2SO4)溶液,直至PH值为10.0。
3.将溶液稀释至250毫升。
使用磁力搅拌器搅拌溶液使其均匀。
四、Tris缓冲溶液Tris缓冲溶液适用于酸性至中性条件下的实验。
它是一种常用的生物化学缓冲溶液,适用于DNA/RNA电泳和蛋白质电泳等实验。
配制方法:1.称取12.11克Tris氨基甲烷(Tris base)并溶解在800毫升蒸馏水中。
2.使用盐酸(HCl)溶液调节至PH值 7.4。
3.加入1克EDTA四钠盐并溶解。
常用缓冲溶液的配制和PH计校正溶液配置方法

常用缓冲溶液的配制和P H计校正溶液配置方法精选文档TTMS system office room 【TTMS16H-TTMS2A-TTMS8Q8-常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(L)X毫升 mol/L甘氨酸+Y毫升 mol/L HCI,再加水稀释至200毫升甘氨酸分子量 = , mol/L甘氨酸溶液含克/升。
2.邻苯二甲酸–盐酸缓冲液( mol/L)X毫升 mol/L邻苯二甲酸氢钾 + mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量 = , mol/L邻苯二甲酸氢溶液含克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量 = , mol/L溶液为克/升。
Na2HPO4·2H2O分子量 = , mol/L溶液含克/升。
C 4H2O7·H2O分子量 = , mol/L溶液为克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液( mol/L)柠檬酸C 6H 8O 7·H 2O :分子量, mol/L 溶液为克/升。
柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量, mol/L 溶液为克/毫升。
6.乙酸–乙酸钠缓冲液( mol/L )Na 2Ac·3H 2O 分子量 = , mol/L 溶液为克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液()Na2HPO4·2H2O分子量 = , mol/L溶液为克/升。
Na2HPO4·12H2O分子量 = , mol/L溶液为克/升。
Na2HPO4·2H2O分子量 = , mol/L溶液为克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L)1M溶液为克/升。
Tris溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
pH标准缓冲溶液及常用pH缓冲溶液的配制
1.67
1.67
1.67
1.68
1.68
1.69
1.69
1.69
不同温度时的pH值(pH in different temperatures)
45C
50C
55C
60C
70C
80C
90C
95C
-
1.70
1.71
1.72
1.72
1.74
1.77
1.79
1.81
-
酒石酸 盐标准 缓冲溶 液
在25C时,用无二 氧化碳的水溶解外 消旋的酒石酸氢钾
把50.0 ml0.05 mol/L NaHPO与26.9 ml0.1
mol/L NaOH混合均匀,加水稀释至100ml
12.0
13
氯化钾-氢氧化钠
把25.0 ml 0.2 mol/L KCl与66.0 ml 0.2 mol/L NaOH
混合均匀,加水稀释至100ml
13.0
酸,再加水稀释至1L
2.3
3
一氯乙酸-氢氧化钠
在200ml水中溶解2g一氯乙酸后,加40gNaOH
溶解完全后再加水稀释至1L
2.8
4
邻苯二甲酸氢钾-盐酸
把25.0 ml 0.2 mol/L的邻苯二甲酸氢钾溶液与6.0 ml
0.1 mol/L HCl混合均匀,加水稀释至100ml
3.6
5
邻苯二甲酸氢钾-氢氧
不同温度时的pH值(pH in different temperatures)
0 °C
5C
10C
15C
20C
25C
30C
35C
40C
9.46
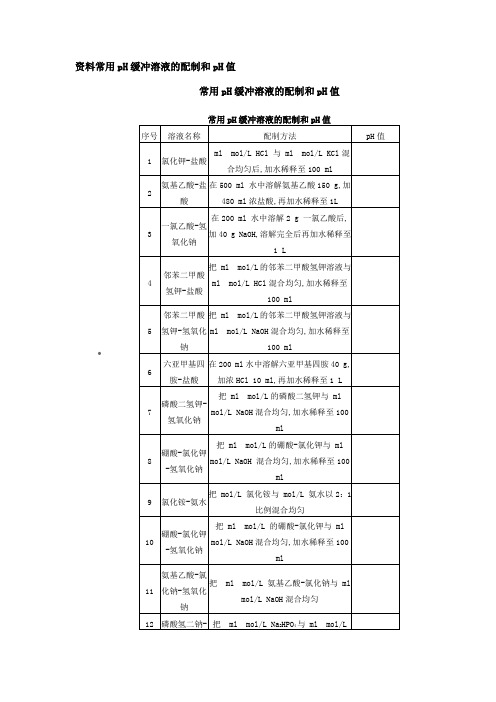
常用pH缓冲液配置方法及注意事项

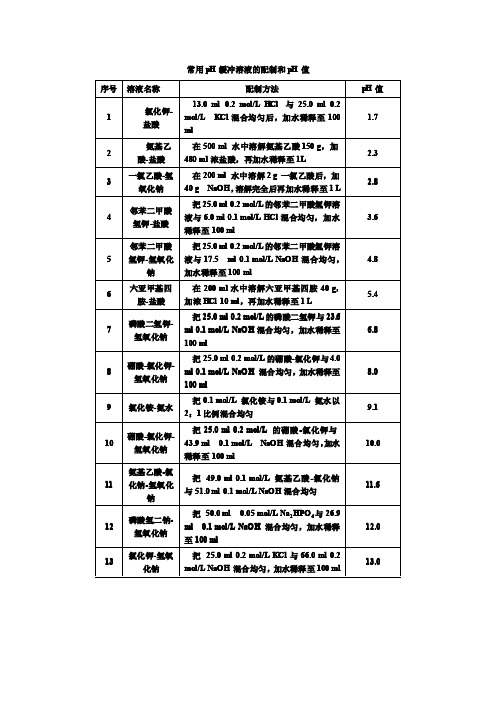
常用pH缓冲液配置方法及注意事项常用pH缓冲溶液的配制和pH值序号溶液名称配制方法pH值1氯化钾-盐酸13.0 ml 0.2 mol/L HCl 与25.0 ml 0.2 mol/L KCl混合均匀后,加水稀释至100 ml1.72氨基乙酸-盐酸在500 ml 水中溶解氨基乙酸150 g,加480 ml浓盐酸,再加水稀释至1L2.33一氯乙酸-氢氧化钠在200 ml 水中溶解2 g 一氯乙酸后,加40 g NaOH,溶解完全后再加水稀释至1 L2.84邻苯二甲酸氢钾-盐酸把25.0 ml 0.2 mol/L的邻苯二甲酸氢钾溶液与6.0 ml0.1 mol/L HCl混合均匀,加水稀释至100 ml3.65邻苯二甲酸氢钾-氢氧化钠把25.0 ml 0.2 mol/L的邻苯二甲酸氢钾溶液与17.5ml 0.1 mol/L NaOH混合均匀,加水稀释至100 ml4.86六亚甲基四胺-盐酸在200 ml水中溶解六亚甲基四胺40 g,加浓HCl 10 ml,再加水稀释至1 L5.47磷酸二氢钾-氢氧化钠把25.0 ml 0.2 mol/L的磷酸二氢钾与23.6 ml 0.1mol/L NaOH混合均匀,加水稀释至100 ml6.88硼酸-氯化钾-氢氧化钠把25.0 ml 0.2 mol/L的硼酸-氯化钾与4.0 ml 0.1mol/L NaOH 混合均匀,加水稀释至100 ml8.09氯化铵-氨水把0.1 mol/L 氯化铵与0.1 mol/L 氨水以2:1比例混合均匀9.110硼酸-氯化钾-氢氧化钠把25.0 ml 0.2 mol/L 的硼酸-氯化钾与43.9 ml 0.1mol/L NaOH混合均匀,加水稀释至100 ml10.011氨基乙酸-氯化钠-氢氧化钠把 49.0 ml 0.1 mol/L 氨基乙酸-氯化钠与51.0 ml0.1 mol/L NaOH混合均匀11.612磷酸氢二钠-氢氧化钠把 50.0 ml 0.05 mol/L Na2HPO4与26.9 ml 0.1 mol/L NaOH 混合均匀,加水稀释至100 ml12.013氯化钾-氢氧化钠把 25.0 ml 0.2 mol/L KCl与66.0 ml 0.2 mol/L NaOH混合均匀,加水稀释至100 ml13.0一、常用溶液的配制(一)溶液配制注意事项1.药品要有较好的质量试剂分为优级纯(保证试剂,Guaranteed reagent,G.R.)、分析试剂(Antalytical reagent,A.R.)化学纯(Chemical pure,C.P.)和实验试剂(Laboratory reagent,L.R.)等等。
常用缓冲溶液配制和PH计校正溶液配置方法

常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)甘氨酸分子量 = 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量 = 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量 = 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液液或浓盐酸调节,冰箱保存。
柠檬酸C 6H 8O 7·H 2O :分子量210.14,0.1 mol/L 溶液为21.01克/升。
柠檬酸钠Na 3 C 6H 5O7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升。
227.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液为85.61克/升。
Na 2HPO 4·12H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
Na 2HPO 4·2H 2O 分子量 = 178.05,1/15M 溶液为11.876克/升。
KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )巴比妥钠盐分子量=206.18;0.04M 溶液为8.25克/升10.Tris –盐酸缓冲液(0.05M ,25℃)50毫升0.1M 三羟甲基氨基甲烷(Tris )溶液与X 毫升0.1N 盐酸混匀后,加水稀释至100毫升。
常用标准缓冲溶液的配制

常用标准缓冲溶液在化学分析、仪器分析、生物化学等领域有广泛的应用。
它们通常用于标定传感器、校准仪器、测定物质特性等。
下面将详细介绍如何配制常用标准缓冲溶液。
一、磷酸盐标准缓冲溶液磷酸盐标准缓冲溶液通常用于pH测量。
具体配制方法如下:1. 称取约2克磷酸二氢钾,用纯水溶解。
2. 加入约700ml纯水。
3. 用氢氧化钠溶液调整溶液pH至7.0。
可以使用0.1N氢氧化钠溶液进行调pH。
4. 稀释至总容量为1000ml,这样就得到了磷酸盐标准缓冲溶液。
二、乙酸-乙酸钠缓冲液乙酸-乙酸钠缓冲液常用于PH计的校准。
其配制方法如下:1. 称取无水乙酸钠(28.85g)及乙酸(3mL,约27ml)溶于约500mL纯水中。
2. 用盐酸(1+1)溶液调整溶液pH至3.6~3.8。
3. 稀释至总容量约700mL。
三、纳氏试剂缓冲溶液纳氏试剂是一种常用的显色剂,常用于水质分析等工作中。
缓冲溶液的配制如下:1. 称取三乙醇胺9~15g,加少量纯水溶解,再加入氢氧化钠溶液至pH值约10,即得基本缓冲液。
2. 称取酒石酸钾钠20g及碘化钾2g溶于纯水,稀释至基本缓冲液总容量约50ml,然后慢慢加入碘化汞钾溶液(4%w/v)4~5滴,即得纳氏试剂缓冲溶液。
四、磺基水杨酸标准缓冲溶液磺基水杨酸标准缓冲溶液常用于电位滴定分析,其配制方法如下:1. 称取24克磺基水杨酸,加入约600毫升蒸馏水,完全溶解。
2. 用氢氧化钠溶液调整溶液pH至5.4,使其符合滴定分析要求。
可以使用0.1N氢氧化钠溶液进行调pH。
3. 稀释至总容量约1000ml,这样就得到了磺基水杨酸标准缓冲溶液。
需要注意的是,在配制标准缓冲溶液时,必须严格遵守实验室安全规范,包括正确处理化学药品、避免交叉污染、避免蒸发皿破裂等。
同时,也应注意保护实验环境的卫生和安全,如保持实验台整洁、避免有毒废料的排放等。
此外,对于不同类型和浓度的标准缓冲溶液,可能需要不同的配制步骤和注意事项。
常用缓冲溶液的配制和PH计校正溶液配置方法

常用缓冲溶液的配制和PH计校正溶液配置方法随着科学技术的不断发展和应用的不断推进,缓冲溶液的配制和pH 计校正溶液的配置方法已经成为实验室中常见的操作。
本文将介绍一些常用的缓冲溶液的配制方法和pH计校正溶液的配置方法。
缓冲溶液是指具有稳定pH值的溶液。
在化学实验和生物实验中,常需要进行pH的调节和保持。
常用的缓冲溶液有磷酸盐缓冲溶液、醋酸盐缓冲溶液、碳酸氢根缓冲溶液等。
下面将介绍一些常用缓冲溶液的配制方法:1.磷酸盐缓冲溶液的配制方法:a. 配制PH=7.0的磷酸盐缓冲溶液,可以依次将1mol/L的磷酸二氢钾和1mol/L的磷酸二氢钠分别稀释至10mmol/L,然后按照比例混合得到所需的pH=7.0的磷酸盐缓冲溶液。
b. 配制PH=6.8的磷酸盐缓冲溶液,可以依次将1mol/L的磷酸二氢钾和1mol/L的磷酸二氢钠分别稀释至10mmol/L,然后按照比例混合得到所需的pH=6.8的磷酸盐缓冲溶液。
c.配制其他pH值的磷酸盐缓冲溶液,可以根据需要调整磷酸二氢钾和磷酸二氢钠的浓度比例,以达到所需的pH值。
2.醋酸盐缓冲溶液的配制方法:a. 配制PH=4.0的醋酸盐缓冲溶液,可以将0.1mol/L的醋酸钠溶液和0.1mol/L的醋酸溶液按照比例混合得到所需的pH=4.0的醋酸盐缓冲溶液。
b. 配制PH=5.0的醋酸盐缓冲溶液,可以将0.01mol/L的醋酸钠溶液和0.1mol/L的醋酸溶液按照比例混合得到所需的pH=5.0的醋酸盐缓冲溶液。
c.配制其他pH值的醋酸盐缓冲溶液,可以根据需要调整醋酸钠和醋酸的浓度比例,以达到所需的pH值。
3.碳酸氢根缓冲溶液的配制方法:a. 配制PH=9.0的碳酸氢根缓冲溶液,可以将0.1mol/L的碳酸氢钠溶液和0.1mol/L的盐酸溶液按照比例混合得到所需的pH=9.0的碳酸氢根缓冲溶液。
b. 配制PH=10.0的碳酸氢根缓冲溶液,可以将0.01mol/L的碳酸氢钠溶液和0.1mol/L的盐酸溶液按照比例混合得到所需的pH=10.0的碳酸氢根缓冲溶液。
pH标准缓冲液的配制

pH标准缓冲液的配制
在使用PH酸度计时,我们需要定期对其进行计量检定,并符合国家有关规定。
测定前,应采用下列标准缓冲液校正仪器,也可用国家标准物质管理部门发放的标示pH 值准确至0.01pH 单位的各种标准缓冲液校正仪器。
下面简单介绍几种仪器校正用的标准缓冲液的配制方法:
1、草酸盐标准缓冲液:精密称取在54℃±3℃干燥4~5 小时的草酸三氢钾12.71g,加水使溶解并稀释至1000ml。
2、苯二甲酸盐标准缓冲液:精密称取在115℃±5℃干燥2~3 小时的邻苯二甲酸氢钾10.21g,加水使溶解并稀释至1000ml。
3、磷酸盐标准缓冲液:精密称取在115℃±5℃干燥2~3 小时的无水磷酸氢二钠3.55g 与磷酸二氢钾3.40g,加水使溶解并稀释至1000ml。
4、硼砂标准缓冲液:精密称取硼砂3.81g(注意避免风化),加水使溶解并稀释至1000ml,置聚乙烯塑料瓶中,密塞,避免空气中二氧化碳进入。
5、氢氧化钙:标准缓冲液于25℃,用无二氧化碳的水和过量氢氧化钙经充分振摇制成饱和溶液,取上清液使用。
因本缓冲液是25℃时的氢氧化钙饱和溶液,所以临用前需核对溶液的温度是否在25℃,否则需调温至25℃后再经溶解平衡后,方可取上清液使用。
存放时应防止空气中二氧化碳进入。
一旦出现浑浊,应弃去重配。
常用缓冲溶液的配制及PH计校正溶液配置方法

常用缓冲溶液的配制及PH计校正溶液配置方法缓冲溶液是在化学实验和生物实验中常用的一种溶液,它可以维持溶液的pH值在一定范围内稳定不变。
下面我将介绍几种常用的缓冲溶液的配制方法以及pH计校正溶液的配置方法。
一、Phosphate Buffered Saline (PBS) 缓冲溶液PBS是一种用于细胞培养、免疫沉淀等实验中常用的缓冲溶液。
配制方法:1.加入8g氯化钠(NaCl)、0.2g磷酸二氢钠(NaH2PO4)和2.16g 磷酸氢二钠二水合物(Na2HPO4·2H2O)到适量的去离子水中。
2.搅拌溶解,直至溶液变清澈,如有需要可以调整pH值。
3.用去离子水稀释至1L,装入干净的烧瓶中。
二、Tris Buffered Saline (TBS) 缓冲溶液TBS是一种用于免疫学实验中常用的缓冲溶液。
配制方法:1. 加入3g氯化钠(NaCl)、2.42g三羟甲基氨基甲烷(Tris)到适量的去离子水中。
2.搅拌溶解,直至溶液变清澈,如有需要可以调整pH值。
3.用去离子水稀释至1L,装入干净的烧瓶中。
三、Glycine Buffered Saline (GBS) 缓冲溶液GBS可以用于免疫沉淀、酶抗体共轭实验等实验中。
配制方法:1. 加入6.05g氯化钠(NaCl)、0.72g糖苷酸(Glycine)到适量的去离子水中。
2.搅拌溶解,直至溶液变清澈,如有需要可以调整pH值。
3.用去离子水稀释至1L,装入干净的烧瓶中。
pH计校正溶液用于校正pH计,在实验中保证pH计的准确性。
配制方法:1.首先准备三种校正溶液:pH4.00、pH7.00和pH10.00。
2.分别加入适量的草酸二钾二水合物(K2C2O4·2H2O)、磷酸柠檬二钠五水合物(Na2HPO4·5H2O)、盐酸(HCl)到三个烧杯中。
3.搅拌溶解,直至草酸二钾二水合物、磷酸柠檬二钠五水合物、盐酸完全溶解。
4.分别用去离子水稀释至1L,装入干净的烧瓶中。
常用缓冲溶液配制方法

常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾 + 0.2 mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液24Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量 = 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L)柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
7.磷酸盐缓冲液Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液为85.61克/升。
Na 2HPO 4·12H 2O 分子量 = 358.14,0.2 mol/L 溶液为71.628克/升。
NaH 2PO 4·2H 2O 分子量 = 156.01,0.2 mol/L 溶液为31.202克/升。
磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,所以用它们配制的缓冲液,pH 范围最宽:NaH 2PO 4: pKa1=2.12,pKa2=7.21; Na 2HPO 4:pKa1=7.21,pKa2=12.32配酸性缓冲液:用NaH 2PO 4,pH =1~4,配中性缓冲液:用混合的两种磷酸盐,pH =6~8, 配碱性缓冲液:用Na 2HPO 4,pH =10~12。
常用pH缓冲溶液的配制和pH值.
把 25.0 ml 0.2 mol/L 的硼酸 -氯化钾与
10
氢氧化钠 43.9 ml 0.1 mol/L NaOH 混合 均匀 ,加水
稀释至 1.0 ml 0.1 mol/L 氨基乙酸 -氯化钠
11 化钠-氢氧化 与 51.0 ml 0.1 mol/L NaOH 混合均匀
一氯乙酸-氢 在 200 ml 水中溶解 2 g 一氯乙酸后,加 3
氧化钠 40 g NaOH,溶解完全后再加水稀释至 1 L
邻苯 二甲 酸
把 25.0 ml 0.2 mol/L 的邻苯二甲酸氢钾溶
4
氢钾-盐酸 液与 6.0 ml 0.1 mol/L HCl 混合均匀,加水
稀释至 100 ml
邻苯二甲酸 把 25.0 ml 0.2 mol/L 的邻苯二甲酸氢钾溶
常用 pH 缓冲溶液的配制和 pH 值
序号 溶液名称
配制 方法
13.0 ml 0.2 mol/L HCl 与 25.0 ml 0.2
1
氯化钾- mol/L KCl 混合均匀后,加水稀释至 100
盐酸
ml
氨基 乙
在 500 ml 水中溶解氨基乙酸 150 g,加
2
酸-盐酸 480 ml 浓盐酸,再加水稀释至 1L
钠
磷酸 氢二 钠-
把 50.0 ml 0.05 mol/L Na2HPO4 与 26.9
12
氢氧化钠 ml 0.1 mol/L NaOH 混合均匀,加水稀释
至 100 ml
氯化钾-氢氧 把 25.0 ml 0.2 mol/L KCl 与 66.0 ml 0.2
13
化钠
mol/L NaOH 混合均匀,加水稀释至 100 ml
pH 值 1.7 2.3 2.8 3.6 4.8 5.4 6.8 8.0 9.1 10.0 11.6 12.0 13.0
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
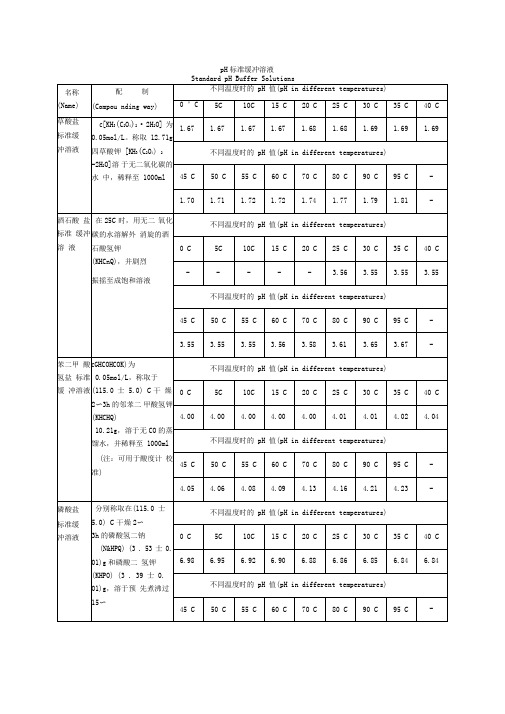
Standard pH Buffer Solutions
名称(Name)
配 制
(Compounding way)
不同温度时的pH值(pH in different temperatures)
0℃
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
草酸盐标准缓冲溶液
c[KH3(C2O4)2·2H2O]为0.05mol/L。称取12.71g四草酸钾[KH3(C2O4)2·2H2O]溶于无二氧化碳的水中,稀释至1000ml
0℃
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
6.98
6.95
6.92
6.90
6.88
6.86
6.85
6.84
6.84
不同温度时的pH值(pH in different temperatures)
45℃
50℃
55℃
60℃
70℃
80℃
90℃
95℃
-
6.83
6.83
6.83
6.84
6.85
6.86
6.88
0℃
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
4.00
4.00
4.00
4.00
4.00
4.01
4.01
4.02
4.04
不同温度时的pH值(pH in different temperatures)
45℃
50℃
55℃
60℃
70℃
80℃
90℃
95℃
-
4.05
4.06
4.08
4.09
4.134.164.21 Nhomakorabea3.55
3.55
3.56
3.58
3.61
3.65
3.67
-
苯二甲酸氢盐标准缓冲溶液
c(C6H4CO2HCO2K)为0.05mol/L,称取于(115.0±5.0)℃干燥 2~3h的邻苯二甲酸氢钾(KHC8H4O4)10.21g,溶于无CO2的蒸馏水,并稀释至1000ml
(注:可用于酸度计校准)
不同温度时的pH值(pH in different temperatures)
70℃
80℃
90℃
95℃
-
9.04
9.01
8.99
8.96
8.92
8.89
8.85
8.83
-
氢氧化钙标准缓冲溶液
在25℃,用无二氧化碳的蒸馏水制备氢氧化钙的饱和溶液。氢氧化钙溶液的浓度c[1/2Ca(OH)2]应在(0.0400~0.0412)mol/L。氢氧化钙溶液的浓度可以酚红为指示剂,用盐酸标准溶液[c(HCl)=0.1mol/L]滴定测出。存放时要防止空气中的二氧化碳的进入。出现混浊应弃去重新配制
不同温度时的pH值(pH in different temperatures)
0℃
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
9.46
9.40
9.33
9.27
9.22
9.18
9.14
9.10
9.06
不同温度时的pH值(pH in different temperatures)
45℃
50℃
55℃
60℃
50℃
55℃
60℃
70℃
80℃
90℃
95℃
-
11.84
11.71
11.57
11.45
-
-
-
-
-
注:为保证pH值的准确度,上述标准缓冲溶液必须使用pH基准试剂配制。
常用pH缓冲溶液的配制和pH值
Preparation and pH Values of Common pH Buffer Solutions
把25.0 ml 0.2 mol/L的邻苯二甲酸氢钾溶液与17.5 ml 0.1 mol/L NaOH混合均匀,加水稀释至100 ml
4.8
6
六亚甲基四胺-盐酸
在200 ml水中溶解六亚甲基四胺40 g,加浓HCl 10 ml,再加水稀释至1 L
5.4
7
磷酸二氢钾-氢氧化钠
1.67
1.67
1.67
1.67
1.68
1.68
1.69
1.69
1.69
不同温度时的pH值(pH in different temperatures)
45℃
50℃
55℃
60℃
70℃
80℃
90℃
95℃
-
1.70
1.71
1.72
1.72
1.74
1.77
1.79
1.81
-
酒石酸盐标准缓冲溶液
在25℃时,用无二氧化碳的水溶解外消旋的酒石酸氢钾(KHC4H4O6),并剧烈振摇至成饱和溶液
序号(No.)
溶液名称
(Solution name)
配制方法
(Preparation)
pH值
(pH value)
1
氯化钾-盐酸
13.0 ml 0.2 mol/L HCl 与25.0 ml 0.2 mol/L KCl混合均匀后,加水稀释至100 ml
1.7
2
氨基乙酸-盐酸
在500 ml 水中溶解氨基乙酸150 g,加480 ml浓盐酸,再加水稀释至1L
不同温度时的pH值(pH in different temperatures)
0℃
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
-
-
-
-
-
3.56
3.55
3.55
3.55
不同温度时的pH值(pH in different temperatures)
45℃
50℃
55℃
60℃
70℃
80℃
90℃
95℃
-
3.55
6.89
-
硼酸盐标准缓冲溶液
c(Na2B4O7·10H2O)称取硼砂(Na2B4O7·10H2O)(3.80± 0.01)g(注意:不能烘!),溶于预先煮沸过 15~30min并迅速冷却的蒸馏水中,并稀释至1000ml。置聚乙烯塑料瓶中密闭保存。存放时要防止空气中的CO2的进入(注:可用于酸度计校准)
不同温度时的pH值(pH in different temperatures)
0℃
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
13.42
13.21
13.00
12.81
12.63
12.45
12.30
12.14
11.98
不同温度时的pH值(pH in different temperatures)
45℃
4.23
-
磷酸盐标准缓冲溶液
分别称取在(115.0±5.0)℃干燥2~3h的磷酸氢二钠(Na2HPO4)(3.53±0.01)g和磷酸二氢钾(KH2PO4) (3.39±0.01)g,溶于预先煮沸过15~30min并迅速冷却的蒸馏水中,并稀释至1000ml(注:可用于酸度计校准)
不同温度时的pH值(pH in different temperatures)
2.3
3
一氯乙酸-氢氧化钠
在200 ml 水中溶解2 g 一氯乙酸后,加40 g NaOH,溶解完全后再加水稀释至1 L
2.8
4
邻苯二甲酸氢钾-盐酸
把25.0 ml 0.2 mol/L的邻苯二甲酸氢钾溶液与6.0 ml 0.1 mol/L HCl混合均匀,加水稀释至100 ml
3.6
5
邻苯二甲酸氢钾-氢氧化钠
