医疗器械产品查询流程
国内医疗器械产品备案登记流程

国内医疗器械产品备案登记流程概述国内医疗器械产品备案登记是指将医疗器械产品纳入监管范围,确保其质量、安全和有效性,并取得合法销售准入许可。
本文档将介绍国内医疗器械产品备案登记的流程。
申请资格在申请医疗器械产品备案登记前,申请人必须符合以下资格要求:1. 在中华人民共和国境内注册并具有独立法人资格的企业;2. 拥有相应的医疗器械生产、经营或使用资质。
流程步骤国内医疗器械产品备案登记的流程通常包括以下几个步骤:1. 准备备案材料申请人需准备以下备案材料:- 产品备案申请表;- 产品技术资料,包括产品说明书、性能试验报告等;- 产品标签、包装等相关资料;- 注册证明和法人资料等相关文件。
2. 提交备案申请申请人将准备好的备案材料提交给国家药品监督管理局(NMPA)或其授权的省级药品监督管理部门。
3. 材料审核相关部门将对备案申请材料进行审核,确保其完整、合规和真实。
4. 技术审评对备案申请材料中的产品技术资料进行审评,评估其质量、安全和有效性。
5. 现场核查根据需要,相关部门可能会进行现场核查,检查申请人的生产、经营设施及质量管理体系。
6. 许可决定在完成内容审核和现场核查后,相关部门将根据评估结果做出许可决定,决定核发备案凭证或拒绝备案。
7. 领取备案凭证如备案申请获批准,申请人可到相关部门领取备案凭证。
结论国内医疗器械产品备案登记是一项确保医疗器械产品质量和安全的重要步骤。
通过理解备案登记流程,申请人可以更好地准备备案申请,提高备案成功的机会。
> 注意:本文档所提供的内容仅为概述性说明,具体备案流程可能因相关法规和政策的变化而有所调整,请以最新的法规和政策为准。
医疗器械仓库出库流程

目录
• 出库前准备工作 • 拣货与复核 • 包装与标识 • 发货与交接 • 出库记录与报告
01
出库前准备工作
确认出库计划
根据销售订单或调拨单,确认出库医疗器械的名称、规格型号、数量、批次号等信 息。
核对医疗器械的有效期,确保出库产品在使用期限内。
确认收货单位、收货地址和联系方式等收货信息。
预计到达时间。
05
出库记录与报告
详细记录出库过程中的关键信息
01
02
03
出库申请
记录申请部门、申请人、 申请时间、申请理由等信 息。
出库审批
记录审批人、审批时间、 审批意见等信息。
货物出库
记录出库时间、出库数量 、货物状态、领用人签字 等信息。
生成出库报告,包括产品名称、数量、接收方等
01
出库报告内容应包括:产品名称 、规格型号、数量、接收方名称 及联系方式、出库日期等。
02
出库报告格式应规范统一,方便 后续的数据统计和分析。
定期汇总和分析出库数据,优化流程
01
定期对出库数据进行汇总,包括出库数量、货物种类、接收方 等。
02
分析出库数据,发现潜在的问题和趋势,如某些货物的出库频
率较高,可能需要增加库存或调整采购策略。
根据分析结果,优化出库流程,提高效率和准确性。例如,改
。
贴上相应的标签和标识
在医疗器械的包装上贴上清晰、准确的标签和标识,包括产品名称、规格型号、生产批号、 生产日期、有效期、生产厂家等信息。
对于有特殊要求的医疗器械,还应在标签和标识上注明特殊注意事项,如“易碎”、“勿倒 置”、“防潮”等。
标签和标识应牢固粘贴在包装上,不易脱落或模糊不清,以确保在运输和存储过程中能够清 晰识别。
如何检索查询医疗器械不良事件报告操作指南(FDA、NMPA)

医疗器械检索不良事件报告检索查询操作指南(FDA、NMPA)
1.美国食品药品管理局(FDA )关于不良事件报告检索查询操作指南
1)通过国内浏览器检索流程:
2)具体指引步骤如下图所示:
(1)通过国内浏览器搜索搜索MAUDE数据库
(2)点击“MAUDE - Manufacturer and User Facility Device Experience”打开MAUDE 数据库
(3)点击“Go to Simple Search”简单搜索,然后输入查找的产品名称,需要查找的年份
(4)点击“Search”后,可看到查找产品的不良事件报告例数,然后点击“Export To Excel ”导出数据
(5)打开导出的数据表,找到对应的“Event Type”发生事件类型,分为设备故障、损伤(伤害)、死亡几种事件类型
(6)最后统计不良事件报告情况
2.国内不良事件检索查询操作指南
1)通过国内浏览器检索流程:
2)具体指引步骤如下图所示:
(1)通过国内浏览器搜索国家药品监督管理局,点击官网查看
(2)打开国家药品监督管理局官网后,点击查看医疗器械专栏
(3)直接在医疗器械专栏的搜索框中输入需要检索的产品名称
(4)统计不良事件的召回和通报数
注:因为国内的不良事件有个专门的不良事件监测网站和国家不良事件监测系统,所以在国家药品监督管理局中很难搜索到不良事件报告例数,只有部分产品会有召回信息,而没有发生严重不良事件,国内一般很少会有不良事件通报情况。
国内注册涉及的国内不良事件调查,一般可通过对应产品的指导原则去查看是否有不良事件的发生或召回。
医疗器械产品注册证号码内容及如何查询相关产品信息

医疗器械产品注册证号码内容及如何查询相关产品信息国家对医疗器械实行分类注册管理。
境内第一类医疗器械由设区的市级(食品)药品监督管理机构审查,批准后发给医疗器械注册证书。
境内第二类医疗器械由省、自治区、直辖市(食品)药品监督管理部门审查,批准后发给医疗器械注册证书。
境内第三类医疗器械由国家食品药品监督管理局审查,批准后发给医疗器械注册证书。
境外医疗器械由国家食品药品监督管理局审查,批准后发给医疗器械注册证书。
台湾、香港、澳门地区医疗器械的注册,参照境外医疗器械办理。
医疗器械注册证书有效期4年。
医疗器械注册证书由国家食品药品监督管理局统一印制,相应内容由审批注册的(食品)药品监督管理部门填写。
注册号的编排方式为:×(×)1(食)药监械(×2)字××××3第×4××5××××6号。
如:苏食药监械(准)字2010(2)第2 66 1173号。
其中:×1 为注册审批部门所在地的简称:境内第三类医疗器械、境外医疗器械以及台湾、香港、澳门地区的医疗器械为“国”字;境内第二类医疗器械为注册审批部门所在的省、自治区、直辖市简称;境内第一类医疗器械为注册审批部门所在的省、自治区、直辖市简称加所在设区的市级行政区域的简称,为××1(无相应设区的市级行政区域时,仅为省、自治区、直辖市的简称);×2为注册形式(准、进、许):“准”字适用于境内医疗器械;“进”字适用于境外医疗器械;“许”字适用于台湾、香港、澳门地区的医疗器械;××××3为批准注册年份;×4为产品管理类别;××5为产品品种编码;××××6为注册流水号。
因此,查询医疗器械产品注册信息可根据实际产品的注册证号或者产品名称等相关信息,登陆国家局网站查询一、二、三类医疗器械产品注册信息或者登陆相应发证部门网站直接查询产品的注册情况。
药店医疗器械验收流程

药店医疗器械验收流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classicarticles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!药店医疗器械验收流程如下:1. 收货前检查:在收到医疗器械前,工作人员首先要检查订单信息是否与实际收到的货物相符,包括货物数量、型号规格等是否与订单一致。
医疗器械法规对产品追溯的要求

04
医疗器械产品追溯实 施现状与问题
实施现状
法规框架初步建立
我国已初步建立起医疗器械法规体系,对产品追溯有明确要求, 但具体实施细则和监管措施尚待完善。
提升信息化管理水平
推进信息化建设
鼓励企业采用先进的信息化技术 ,如物联网、大数据等,提升医 疗器械产品追溯的信息化管理水
平。
建立统一追溯平台
建立国家统一的医疗器械产品追 溯平台,实现不同系统间的数据 交换和信息共享,提高追溯效率
。
强化数据安全保护
加强医疗器械产品追溯数据的安 全保护,确保数据的真实性、完
各环节之间通过信息化手段实现信息的互联互通,确保追溯信息的完整 性和准确性。
追溯体系建立与实施
建立医疗器械追溯体系需要制定相关 法规和标准,明确追溯要求和实施方 法。
监管部门需要对企业的追溯体系进行 监督和检查,确保追溯信息的真实性 和可靠性。
企业需要建立相应的管理制度和操作 流程,配备必要的设备和人员,确保 追溯体系的正常运行。
企业应对策略建议
企业应积极关注法规政策动态,加强内部追溯体 系建设,提升数据管理能力,以应对日益严格的 监管要求和市场挑战。
THANKS
感谢观看
和可操作性,导致法规执行力度不足。
02
企业重视程度不够
部分医疗器械生产企业对产品追溯的重要性认识不足,缺乏主动加入追
溯平台的意愿和动力。
03
技术支持不足
医疗器械产品追溯涉及多个环节和领域,需要专业的技术支持和保障。
医疗器械产品检验与成品放行指南生产记录

医疗器械产品检验与成品放行指南生产记录一、引言医疗器械产品的检验与成品放行是确保产品质量和安全性的重要环节。
本文将详细介绍医疗器械产品检验与成品放行的相关流程和指南。
二、检验流程1.接收产品:在收到医疗器械产品时,需要进行验收,包括检查外包装是否完好、标签是否齐全等。
2.校验规格:校验产品的规格是否符合订单要求,包括尺寸、重量、材料等。
3.进行功能性检验:根据产品的功能要求,进行相应的功能性检验,以确保产品的性能符合要求。
4.进行外观检验:对产品的外观进行检查,包括产品是否有损伤、颜色是否正常等。
5.进行性能检验:根据产品的性能要求,进行相应的性能检验,确保产品的性能指标符合标准要求。
6.进行安全性检验:对产品的安全性进行检验,包括材料的安全性、辐射的安全性等。
7.进行环境适应性检验:根据产品的使用环境,进行相应的环境适应性检验,以确保产品在各种环境下正常工作。
8.进行耐久性检验:对产品的耐久性进行检验,包括使用寿命、质量损耗等。
9.进行标准符合性检验:对产品的各项指标进行检验,以确保产品符合相应的标准要求。
10.制定检验报告:根据检验结果,制定相应的检验报告,记录检验过程和结果。
三、成品放行流程1.检验合格:经过检验后,如果产品符合规定的标准要求,即为合格产品。
2.评估和审查:对合格产品进行评估和审查,包括产品的整体质量、可靠性等。
3.进行认证:对合格产品进行认证,确保产品质量和安全性达到标准要求。
4.发放合格证书:对通过认证的产品发放合格证书,证明产品质量和安全性达到标准要求。
5.进行包装:对合格产品进行包装,确保产品在运输过程中不受损。
6.进行核查:对包装后的产品进行核查,确保产品和包装是否正常。
7.进行质量检验:对包装后的产品进行质量检验,确保产品在包装后质量不受损失。
8.进行出货准备:对产品进行出货准备,包括生成出货清单、准备运输工具等。
9.进行出货检查:对出货前的产品进行检查,确保产品符合要求。
国内医疗器械经营范围查询

国内医疗器械经营范围查询在国内,医疗器械的经营范围是受到严格管控的。
经营医疗器械需要符合相关法规和规定,只有获得了相应的资质和许可证才能合法开展业务。
本文将介绍国内医疗器械经营范围的查询方法和相关规定。
什么是医疗器械经营范围?医疗器械经营范围是指经营者根据所获得的许可证,可以经营的医疗器械种类和范围。
不同的医疗器械经营企业根据所获得的许可证种类不同,其经营范围也会有所区别。
如何查询医疗器械经营范围?想要查询医疗器械经营范围,可以通过以下途径进行查询:1.国家药监局网站:国家药监局网站上会公布已经获得医疗器械经营许可证的企业名单,可以通过查询企业名单了解企业经营的范围。
2.医疗器械经营企业官方网站:许多医疗器械经营企业会在其官方网站上公布自己的经营范围,可以直接在其网站上查询相关信息。
3.咨询药监部门:如果有疑问或不确定某家医疗器械经营企业的经营范围,可以直接向当地药监部门进行咨询,他们会提供相关信息和帮助。
4.第三方信息平台:一些第三方的医疗器械信息平台也提供医疗器械经营企业的查询服务,可以通过这些平台进行查询。
医疗器械经营范围的法规要求根据《医疗器械监督管理条例》,医疗器械经营企业应当在经营范围内开展业务,并严格按照国家规定的管理要求进行操作。
同时,医疗器械经营企业还需要按照相关法规和标准定期进行检查和验收,确保产品的质量和安全。
结语通过查询医疗器械经营范围,可以更清晰地了解不同企业的经营情况,选择合适的合作伙伴或产品供应商。
在查询时,务必注意选择正规的渠道,避免被虚假信息所误导。
希望以上信息对您有所帮助,祝您在医疗器械经营领域取得成功!。
医疗器械产品分类界定工作流程

医疗器械产品分类界定工作流程
一、申请方式
申请企业通过中国食品药品检定研究院网站进入“医疗器械标准管理研究所医疗器械分类界定信息系统”页面(网址:/biaogzx),点击进入“医疗器械分类界定信息系统”,注册后填写《分类界定申请表》,并上传其他申请材料。
在线打印《分类界定申请表》,连同其他申请材料(应与网上上传的资料完全相同)加盖申请企业骑缝章,邮寄送至相关单位。
境内产品的相关材料寄至申请企业所在地的省级食品药品监督管理部门,境外及港、澳、台产品的相关材料寄至国家食品药品监督管理局医疗器械标准管理中心(地址:北京天坛西里2号,邮编:100050)。
二、申请材料要求
(一)分类界定申请表;
(二)产品照片和/或产品结构图;
(三)产品标准和编制说明(如有);
(四)境外上市证明材料(如是进口产品);
(五)其他与产品分类界定有关的材料。
所有申请材料应为中文本。
三、申请状态和结果查询
申请企业登陆“医疗器械分类界定信息系统”,点击“查询”界面下的“当前状态”,即可查询申请状态和结果。
上海市医疗器械经营企业产品信息追溯申报系统操作说明

上海市医疗器械经营企业产品信息追溯申报系统操作说明为了规范和管理上海市医疗器械经营企业产品信息的追溯工作,上海市对医疗器械经营企业开发了一套产品信息追溯申报系统。
本操作说明将详细介绍该系统的操作步骤和注意事项,以便用户正确使用该系统。
一、系统登录1.打开浏览器,输入系统网址并访问。
2.在登录页面输入用户名和密码,点击“登录”按钮进行登录。
二、产品信息追溯申报1.登录系统后,点击系统主界面上的“产品信息追溯申报”按钮。
2.在产品信息追溯申报页面,点击“新建申报”按钮开始填写申报信息。
3.在新建申报页面,根据要求填写申报信息,包括产品名称、产品类别、生产企业等。
4.填写完申报信息后,点击“保存”按钮保存申报信息。
三、上传产品信息1.在产品信息追溯申报页面,点击“上传产品信息”按钮。
2.在弹出的文件选择对话框中,选择要上传的产品信息文件,点击“确定”按钮开始上传。
3.等待上传完成后,系统将自动解析产品信息文件,并在页面显示上传结果。
四、查看申报进度1.在产品信息追溯申报页面,点击“查看申报进度”按钮。
2.在申报进度页面,可以查看申报进度的详细信息,包括申报状态、审核进度等。
五、申报管理1.在产品信息追溯申报页面,点击“申报管理”按钮。
2.在申报管理页面,可以对已经提交的申报进行管理,包括查看申报详情、修改申报信息、撤销申报等。
六、消息通知1.在系统主界面上方的导航栏中,点击“消息通知”按钮。
2.在消息通知页面,可以查看系统发送的通知消息。
七、操作注意事项1.系统支持的产品信息文件格式为XML格式,上传时请确保文件格式正确。
2.在填写申报信息时,必填项不能为空,否则无法保存或提交申报。
3.申报完成后,可以在申报进度页面查看申报状态和审核进度。
4.如果需要修改已提交的申报信息,可以在申报管理页面进行修改。
5.撤销申报操作不可逆,请谨慎操作。
6.及时查看系统发送的通知消息,以便了解申报结果和审核进度。
关于如何查询医疗器械分类
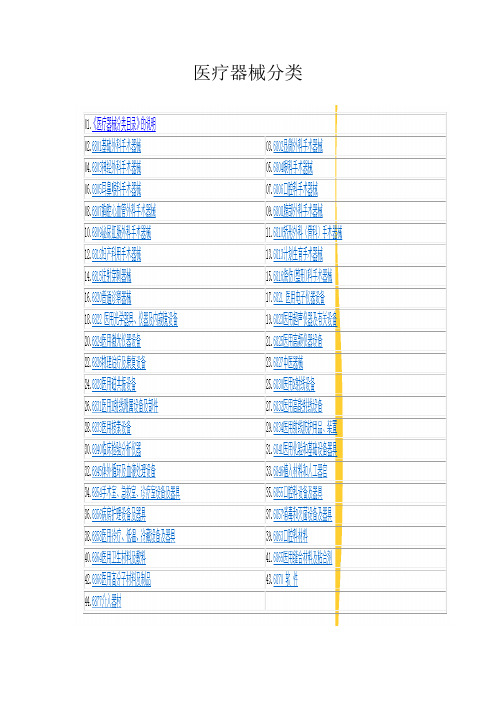
产品1
产品2
产品3
产家
深圳迈瑞生物医疗电子有限公司
北京京精医疗设备有限公司
微创医疗器械(上海)有限公司
产ห้องสมุดไป่ตู้大类
(医疗器械分类)
6830—4
6845
6877
产品型号
生命信息与支持、临床检验及试剂、数字超声、放射影像
血液回收
心血管介入产品、骨科医疗器械、糖尿病及内分泌医疗器械、电生理医疗器械、大动脉及外周血管介入产品、神经介入产品、外科手术等
查需要查询医疗器械公司的官网,查询所需信息。
3.配合医疗器械分类目录查询完所需的相关信息。
医疗机构器械采购网上操作手册

医疗机构器械采购网上操作手册一.医疗机构医用器械、耗材采购操作1)用户登陆首先打开四川药械采购与监管(),点击“医用耗材采购相关平台”中的“医用耗材采购、配送、监督平台”。
在采购类别下拉菜单中选择医疗器械、耗材采购;在用户类别中选择医疗机构;输入用户名和密码,并输入校验码。
2)采购订单的制定及审核进入平台后,点击“制订计划”中“制订采购计划”,我们可以根据各医疗机构的要求生成不同类型的采购计划。
选择“确定”后,进入到“增加采购计划品种”,在此选择“在线加入采购品种”。
进入页面后,我们首先要选择品种范围,在“本院品种”和“全部品种”的选项中,我们选择“全部品种”。
在对耗材的查询中,可通过按耗材的“产品名称”、“分类编号”、“生产企业”、“产品注册号”、“配送企业”等查询集中采购耗材相关信息。
例如:在这里我们输入产品名称“起搏器”,单击“查看待选品种”我们就可以看到所有与“起博器”的相关信息,从中我们可以选择需要购买的耗材,输入相关的信息就可以进行确认了。
然后输入该耗材的“配送企业”。
接下来输入:“实际采购价(注:不能高于挂网限价)”、“采购数量”,然后点击“选中确定”,然后我们就可以“查看选中品种”,看到刚才我们所选择的“起搏器”的相关采购信息,如果我们还要添加其它器械,可以点击“在线加入计划品种”,其余操作重复以上步骤。
在确认输入无误后,就点击“审核通过”,这样就生成了一张采购订单。
(一旦审核通过后则不能再修改订单)注意:1)医疗机构对当月所要采购的耗材在当月生成订单,并在当月完成配送确认的操作,这样才能确保上报数据的准确性。
如果存在跨月操作,可能会造成订单金额和实际采购金额不一致,因此,最好避免。
2)程序中还设计了本院品种的管理功能,在程序中“挂网目录”下的“挂网品种查询”中,我们可以看到在每个耗材前有个“选择”框,对本院常用的耗材打上“√”并“确定选择”后,可以将该耗材添加为“本院品种”。
这样,医疗机构制订计划将很方便。
医疗器械进货查验记录

医疗器械进货查验记录一、引言医疗器械作为医院和临床工作中必不可少的重要设备,对于患者的诊疗质量和安全性有着关键影响。
为了确保医疗器械的质量和合规性,每一批进货的医疗器械都需要进行严格的查验。
本文将介绍医疗器械进货查验记录的相关内容,旨在提高医疗器械的质量安全管理水平。
二、查验标准医疗器械的查验标准是保障医疗器械质量和安全性的重要依据。
查验标准通常包括国家标准、行业标准、企业标准以及法规要求等。
在进货查验过程中,必须严格按照这些标准进行。
三、进货查验记录表格医疗器械进货查验通常通过一张查验记录表格进行。
表格中包含了医疗器械的名称、规格、数量、生产日期、生产厂家、批号等信息。
在查验的过程中,对于每一项查验内容都需要填写相应结果。
常见的查验内容包括外观检查、功能检测、标识确认、附属设备检验等。
四、查验过程1.外观检查外观检查是医疗器械进货查验的第一步。
在外观检查中,需要检查医疗器械是否有破损、变形、脏污、划痕等情况。
同时还需要核实医疗器械的产品标识是否清晰可辨,并且是否符合规定的标识要求。
2.功能检测功能检测是医疗器械进货查验的关键环节,它直接关系到医疗器械的安全性和有效性。
功能检测通常需要根据医疗器械的使用说明书,进行相应的操作和测试。
对于高级别的医疗器械,可能还需要验收人员具备相应的专业知识和操作技能。
3.标识确认在标识确认环节,需要核对医疗器械的标示内容是否与实际情况相符。
例如,产品名称、型号规格、注册证号码等是否准确、一致。
对于已经过期或者损坏的产品,在进货查验过程中必须予以拒收。
4.附属设备检验某些医疗器械会配备附属设备,如电源适配器、数据线等。
在附属设备检验环节,需要检查这些设备是否完整、齐全,并且与医疗器械相匹配。
五、查验记录保存进货查验记录的保存是非常重要的一环,直接关系到医疗器械质量管理的可追溯性。
查验记录应该被有效地保存,并按照规定的时间进行归档。
在查验记录中,应该包含查验时间、查验人员、查验结果等信息。
医疗器械质量查询记录

医疗器械质量查询记录医疗器械是指用于诊断、治疗、监测、缓解或预防疾病的器械、设备、器具、材料或其他物品。
在医疗领域中,医疗器械的质量是非常重要的,因为低质量的医疗器械可能会给患者的健康和生命安全带来潜在的风险。
为了确保医疗器械的质量,各国都建立了严格的质量控制和监管制度。
医疗器械质量查询记录是一种记录医疗器械质量信息的系统。
该系统主要包括医疗器械的生产信息、质量评审信息、质量检验信息、质量投诉信息等。
通过这个系统,可以实时了解到医疗器械的质量情况,及时发现和解决质量问题,提高医疗器械的质量,保障患者的安全。
1.确定记录的内容和范围:首先需要确定记录哪些医疗器械的质量信息,这些信息应该包括哪些内容,如生产批号、生产日期、质量评审结果、质量检验结果等。
同时,还需要确定记录的范围,即要记录哪些阶段的质量信息。
2.设计数据库结构:根据记录的内容和范围,确定数据库中各个表的结构和关系。
例如,可以设计一个医疗器械表,包括器械名称、生产批号、生产日期等字段,另外还可以设计一个质量评审表,包括器械名称、评审日期、评审结果等字段。
4.建立质量查询平台:为了方便用户查询医疗器械质量信息,需要建立一个质量查询平台。
该平台可以是一个网页或应用程序,用户可以通过输入医疗器械的名称或生产批号等信息进行查询。
查询结果应该包括医疗器械的生产信息、质量评审信息、质量检验信息等。
5.建立质量问题反馈机制:为了及时发现和解决质量问题,需要建立一个质量问题反馈机制。
用户可以通过质量查询平台或其他渠道向厂家或监管部门反馈质量问题,并及时得到处理和回复。
医疗器械质量查询记录的建立可以提高医疗器械的质量,并保障患者的安全。
同时,这也是一种对医疗器械企业的监督和约束,促使其提高产品质量和服务水平。
通过建立这样一个质量查询记录系统,可以加强医疗器械的质量监管,提高整个医疗行业的质量水平。
医疗器械唯一标识udi查询
医疗器械唯一标识UDI从2021年正式实施至今,所有第三类医疗器械已全部纳入,并于2023年逐步向第二类医疗器械覆盖,医疗器械赋码已成为必然。
那什么是医疗器械唯一标识码UDI?有什么编码规则呢?医疗器械唯一标识数据库有什么作用?在哪里可以实现UDI码在线查询?很多人对此不甚了解,今天借此机会盘点一下医疗器械唯一标识码UDI 的相关知识。
一、医疗器械唯一标识码(UDI码)是什么意思?有什么含义?医疗器械唯一标识、医疗器械唯一标识数据载体和医疗器械唯一标识数据库共同组成医疗器械唯一标识系统。
官方定义来说,医疗器械唯一标识(unique device identification,UDI)是指在医疗器械产品或者包装上附载的,由数字、字母或符号组成的代码,具有唯一标志性。
简单来说,医疗器械产品包装上除了常见的商品条码以外的另外一个标志UDI的编码符号(一维码、二维码或射频识别RFID标签),就是医疗器械唯一标识码,也称UDI码,用于编号与产品的配对识别。
医疗器械唯一标识数据载体,是指医疗器械唯一标识码的媒介表现形式,目前以一维码、二维码、射频标签三种形式为主。
1.医疗器械唯一标识数据库则是由NMPA建设直管的,用于储存医疗器械唯一标识及相关信息的数据库,所有的UDI码都需上传至数据库内进行动态备案维护。
数据信息面向公众开放,支持查询下载。
二、如何查询医疗器械唯一标识码(UDI码)?有哪些网站?2.NMPA查询方式:---<NMPA>---<医疗器械>---<医疗器械唯一标识集成服务>---<医疗器械唯一标识数据库>---<输入产品标识/名称或企业>查询说明:医疗器械唯一标识码(UDI码)官方数据库,支持产品标识、产品名称或企业名称进行检索,检索结果提供最小销售单元产品标识、编码体系名称、最小销售单元中使用单元数量、注册备案人名称、产品名称、规格六大产品信息。
医疗器械产品标准查询

医疗器械产品标准查询医疗器械产品标准是指对医疗器械产品性能、安全、有效性等方面的要求和规定,是保障医疗器械产品质量和安全的重要依据。
医疗器械产品标准的制定和执行,对于保障患者的生命安全和健康具有重要意义。
因此,了解医疗器械产品标准是每一个从事医疗器械相关工作的人员都应该重视和关注的问题。
要查询医疗器械产品标准,首先需要了解医疗器械产品标准的种类和来源。
医疗器械产品标准主要包括国家标准、行业标准和企业标准。
国家标准是由国家相关部门或机构制定的,具有强制性和法律效力;行业标准是由行业协会或组织制定的,对某一类医疗器械产品的性能、安全、有效性等方面进行规定;企业标准是由医疗器械生产企业根据自身产品特点和生产技术制定的,对企业自身生产的医疗器械产品进行规范。
在查询医疗器械产品标准时,可以通过以下途径进行:1. 国家标准查询,可以通过国家标准化管理委员会官方网站或者国家标准检索系统进行查询,输入相关的医疗器械产品标准编号、名称或关键词,即可查找到相关的国家标准信息。
2. 行业标准查询,可以通过各行业协会或组织的官方网站进行查询,或者通过行业标准检索系统进行查询,输入相关的医疗器械产品标准编号、名称或关键词,即可查找到相关的行业标准信息。
3. 企业标准查询,可以通过医疗器械生产企业的官方网站或者企业内部的标准管理系统进行查询,获取相关的企业标准信息。
在查询医疗器械产品标准时,需要注意以下几点:1. 确认标准适用范围,在查询标准信息时,需要确认标准的适用范围,以确保所查询的标准与自身工作或研究的医疗器械产品相关。
2. 注意标准更新和变更,医疗器械产品标准是动态更新的,需要关注标准的最新版本和变更情况,以确保使用的标准符合最新要求。
3. 参考多种来源,在查询医疗器械产品标准时,可以参考多种来源的标准信息,以获取更全面和准确的标准内容。
总之,查询医疗器械产品标准是每一个从事医疗器械相关工作的人员都应该重视和关注的问题。
医疗器械产品检定

医疗器械产品检定在医疗保健领域,医疗器械的安全和有效性是至关重要的。
为了确保患者的生命和健康得到保障,医疗器械产品的检定显得尤为重要。
本文将介绍医疗器械产品检定的意义、流程和重要性。
一、医疗器械产品检定的意义医疗器械产品检定是指通过一系列标准化的测试和评估,对医疗器械产品的性能和质量进行验证和确认。
通过检定,可以确保医疗器械产品符合国家和行业标准的要求,以确保产品的安全性、有效性和可靠性。
医疗器械产品的检定旨在保证医疗器械在正常使用条件下能够安全有效地工作。
这对于患者的生命和健康具有重要意义。
只有通过严格的检定程序,才能发现和消除可能存在的缺陷和隐患,提高产品的性能和质量,从而确保全社会的公共卫生安全。
二、医疗器械产品检定的流程医疗器械产品检定是一个系统性和复杂的过程,包括以下几个主要步骤:1. 制定检定标准:根据国家和行业的相关法规和标准,制定医疗器械产品检定的技术要求和评价准则。
这些标准包括医疗器械产品的材料、结构、性能、安全性等方面的要求。
2. 准备检定样品:从生产商或市场上采集一定数量的医疗器械产品作为检定样品。
这些样品应该能够代表整个产品的特征和性能。
3. 实施检定测试:根据检定标准,对检定样品进行各项测试和评估。
这些测试包括物理性能测试、化学成分测试、生物兼容性测试等。
测试的目的是验证产品的性能和质量是否符合要求。
4. 分析和评估数据:对测试结果进行分析和评估,确认医疗器械产品是否符合检定标准的要求。
如果产品存在缺陷或不合格的情况,需要制定相应的改进措施。
5. 发布检定报告:根据检定结果,编制检定报告并正式发布。
这个报告对于医疗器械产品的新注册、生产和销售具有指导和规范作用。
三、医疗器械产品检定的重要性医疗器械产品检定的重要性体现在以下几个方面:1. 保障患者生命和健康:医疗器械产品的不合格可能导致患者的生命和健康受到威胁。
通过检定,可以尽早发现和修复潜在的缺陷和风险,提高产品的质量和安全性,从而保障患者的生命和健康。
医疗器械说明书检索

医疗器械说明书检索随着医疗技术的不断发展,越来越多的医疗器械被广泛应用于临床实践中。
医疗器械的使用要求严格,为了确保其安全有效性,医疗器械说明书成为医护人员使用医疗器械的重要参考依据。
然而,随着医疗器械种类的增多,如何高效地检索到所需的医疗器械说明书成为一个迫切需要解决的问题。
在进行医疗器械说明书检索前,我们首先需要了解医疗器械说明书的特点和结构。
一份合格的医疗器械说明书通常包括以下内容:产品概述、产品特点、适应症、禁忌症、使用方法、注意事项、不良反应、储存条件、包装规格等。
根据这些特点,我们可以有针对性地进行检索。
使用关键词检索是一种常见的方法。
我们可以根据医疗器械的名称、型号、用途等关键词进行检索。
例如,如果我们需要查找一种心脏起搏器的说明书,可以在检索引擎中输入“心脏起搏器说明书”等关键词,以获得相关的搜索结果。
此外,还可以根据医疗器械的厂家、生产日期等信息进行检索。
利用专业的医疗器械数据库是一种高效的检索方式。
目前,国内外建立了许多医疗器械数据库,其中包括了大量的医疗器械说明书。
通过这些数据库,我们可以根据医疗器械的属性、分类等进行检索。
例如,在国家药品监督管理局的医疗器械注册证书查询系统中,我们可以根据医疗器械的注册证书编码或产品名称进行检索,以获得相应的注册证书和说明书。
一些医疗器械企业也会在其官方网站上提供医疗器械说明书的下载服务。
通过访问这些官方网站,我们可以直接下载到所需的医疗器械说明书。
在下载前,我们可以使用浏览器的搜索功能,输入医疗器械名称或关键词,以快速定位所需的说明书。
在进行医疗器械说明书检索时,我们还需要注意以下几点。
首先,要确保所检索到的说明书是最新版本,因为医疗器械的使用规范和说明经常会有更新。
其次,要仔细阅读说明书中的使用方法、注意事项和禁忌症等内容,以确保正确使用医疗器械并避免不良事件的发生。
最后,应将检索到的医疗器械说明书进行整理和归档,以便随时查阅和使用。
